PENGARUH PENGGUNAAN KINCIR SEBAGAI SUMBER ARUS TERHADAP PERFORMANSI
UDANG VANAME (Litopenaeus vannamei) PADA BUDIDAYA SISTEM SUPER INTENSIF
Bunga Rante Tampangallo, Hidayat Suryanto Suwoyo, dan Early Septiningsih
Balai Penelitian dan Pengembangan Budidaya Air Payau Jl. Makmur Dg. Sitakka No. 129, Maros 90512, Sulawesi Selatan
E-mail: bungatampangallo@yahoo.com
ABSTRAK
Budidaya udang vaname (Litopenaeus vannamei) secara intensif memerlukan kincir air sebagai sumber oksigen. Padat penebaran yang tinggi memerlukan jumlah kincir yang cukup banyak agar kebutuhan cultivan akan oksigen terpenuhi. Efek dari penggunaan kincir yang banyak menimbulkan adanya arus dalam kolam budidaya. Oleh karena penelitian ini bertujuan untuk mengukur pengaruh kecepatan arus terhadap kadar glukosa hemolim, total sel hemosit, aktifitas prophenoloksidase, dan osmolalitas hemolim sebagai indikator tingkat stress udang vaname akibat adanya arus yang ditimbulkan oleh kincir dalam tambak. Peubah yang diamati adalah kecepatan arus dengan menggunakan current meter, kadar glukosa hemolim menggunakan alat tes glukosa darah, total sel hemosit, aktifitas prophenoloksidase dengan melihat aktifitas L-DOPA, dan osmolalitas hemolim dengan menggunakan microosmometer Fiske Model 210. Hasil penelitian menunjukkan bahwa udang vaname yang ditempatkan pada semua stasiun pengamatan mengalami stres. Kondisi stres mulai dialami oleh udang setelah tiga jam pengamatan yang ditandai dengan menurunnya jumlah sel hemosit, glukosa hemolim, dan osmoregulasi akibat adaptasi yang dilakukan untuk melawan arus dan mempertahankan diri, namun aktifitas prophenoloksidase masih tetap tinggi hingga akhir pengamatan.
KATA KUNCI: kincir, arus, hemolim, Litopenaeus vannamei, super intensif PENDAHULUAN
Udang vaname (Litopenaeus vannamei) merupakan udang yang hidup di perairan pasifik yang dikenal dengan nama white legs shrimp. Udang ini telah diintroduksi ke Indonesia sejak tahun 2000 dan mengalami perkembangan yang sangat pesat. Udang ini telah dibudidayakan pada setiap tingkat sistem budidaya, mulai dari pola tradisional plus, semiintensif (Gunarto & Hendrajat, 2008; Subyakto, et al., 2009) hingga super intensif (Atjo, 2013). Hal ini dimungkinkankarena adanya tingkat toleransi yang sangat luas dari udang ini.
Sifat udang vaname yang dapat memanfaatkan semua ruang budidaya, memungkinkan penebaran udang dilakukan dalam jumlah yang cukup tinggi. Perkembangan budidaya udang vaname super intensif dalam tambak ukuran kecil menjadi inovasi teknologi budidaya yang telah dikenal teknologinya. Sistem ini dapat membudidayakan udang vaname dengan kepadatan hingga 1000 ekor/m2, dengan menerapkan manajemen panen yang baik, yakni panen parsial hingga 3 kali (Atjo, 2013). Panen parsial dimaksudkan untuk mengurangi biomassa dalam petakan tambak, sehingga tidak melebihi daya dukung tambak.
Kepadatan yang tinggi harus pula diimbangi dengan ketersediaan oksigen yang memadai untuk kehidupan cultivan. Sumber oksigen biasanya diharapkan dari pergantian air, penggunaan kincir air, blower, dan sejenisnya. Penggunaan kincir akan menyebabkan pergerakan air dalam tambak dan menimbulkan arus dalam petakan tambak. Penambahan kincir pada masa pemeliharaan 60 hari hingga panen dapat mencapai 3-4 buah per petak (Budiardi et al., 2005). Hal ini untuk menunjang kebutuhan oksigen terlarut optimal untuk udang vaname adalah 4 ppm dengan batas toleransi >0,8 ppm. Jumlah kincir yang banyak dapat mengakibatkan arus/goncangan air yang cukup kuat dalam petakan tambak akibat pergerakan kincir dan dapat menimbulkan stres pada udang yang dipelihara. Penelitian ini bertujuan untuk mengukur pengaruh kecepatan arus terhadap kadar glukosa hemolim, total sel hemosit, aktivitas prophenoloksidase, dan osmolalitas hemolim sebagai indikator tingkat stres udang vaname akibat adanya arus yang ditimbulkan oleh kincir dalam tambak.
BAHAN DAN METODE
Penelitian telah dilakukan di Instalasi Tambak Punaga, Balai Penelitian dan Pengembangan Budidaya Air Payau, Kabupaten Takalar. Penelitian dimulai dengan mengukur arus dalam petak tambak yang disebabkan oleh kincir air. Arus diukur dengan menggunakan current meter. Penentuan stasiun pengukuran kecepatan arus ditentukan berdasarkan jumlah kincir yang digunakan dalam tambak, jarak dari kincir, dan kedalaman air. Untuk mengetahui pengaruh arus yang disebabkan oleh kincir terhadap beberapa parameter hemolim, maka dipersiapkan 3 buah pipa paralon sepanjang ± 30cm yang telah dilubangi. Setiap pipa paralon diisi 15 ekor udang vaname berukuran 17-23 g/ekor yang diambil dari tambak udang super intensif. Pipa tersebut kemudian ditempatkan pada stasiun yang dapat mewakili kecepatan arus dalam tambak, yakni satsiun 1 (arus lambat), 2 (arus sedang), dan stasiun 3 (arus cepat).
Pengambilan sampel hemolim dilakukan pada 0, 3, 6, dan 9 jam setelah perlakuan. Hemolim diambil pada bagian abdomen segmen ke dua dengan menggunakan syringe volume 1mL dan jarum berukuran 26 gauge yang telah dibasahi antikoagulan Na-sitrat 3,8% (Braak, 2002). Sampel hemolim masing-masing diambil sebanyak ±0,4 mL per ekor lalu dibagi-bagi ke dalam Effendorf yang telah disediakan. Sample tersebut kemudian dianalisis meliputi:
Glukosa Hemolim
Pengamatan glukosa hemolim menggunakan alat test glukosa darah. Pengukuran kadar glukosa hemolim dilakukan dengan langsung menempelkan ujung syringe ke strip alat tes glukosa sampai strip jenuh. Nilai yang tertera pada alat deteksi kadar glukosa darah kemudian dicatat sebagai kadar glukosa hemolim. Pengamatan glukosa darah hanya dilakukan pada pengamatan 0, 6 dan 9 jam karena keterbatasan strip glukosa.
Total Sel Hemosit
Pengamatan total hemosit atau total haemosit count (THC) dilakukan dengan mengambil hemolim sebanyak 0,1mL lalu dimasukkan ke dalam effendorf yang sudah berisi 0,3mL antikoagulan. Campuran dihomogenkan dengan cara menggoyangkan tangan membentuk angka delapan. Setelah homogen, diambil sekitar 20µL lalu diteteskan ke hemositometer (improved neubauer type). Jumlah sel hemosit diamati dan dihitung di bawah mikroskop cahaya dengan pembesaran 40 x 100 kali (Blaxhall & Daishley, 1973). Total sel hemosit dihitung menggunakan rumus :
di mana :
N = Jumlah sel hemosit (sel/mL)
n1, n2, n3, n4, n5 = jumlah sel hemosit dalam kotak kecil hemositometer (sel)
Prophenoloksidase
Prophenoloksidase diamati dengan mengacu pada prosedur Liu & Chen (2004). Aktifitas phenoloksidase (PO) diukur berdasarkan formasi dopachrome yang dihasilkan oleh L-dihydroxyphenil alanine (L-Dopa) dengan menggunakan spektrofotometer merk Genesys. Hemolim yang telah dikoleksi dalam effendorf ditambahkan antikoagulan sebanyak 0,6mL lalu dihomogenkan. Campuran ini kemudian disentrifuge dengan kecepatan 1000 rpm pada 4oC selama 20 menit. Cairan supernatan dibuang dan pellet dibilas dengan 1mL cocodilate-citrate buffer (0,01M sodium cacodylate; 0,45M sodium chloride; 0,10M trisodium citrate; pH 7) dan disentrifuge kembali dengan kecepatan dan kondisi yang sama. Supernatan dibuang dan pellet dilarutkan dengan 200µL cacodylate buffer (0,01M sodium cacodylate; 0,45M sodium chloride; 0,01M kalsium klorid; 0,26M magnesium klorid; pH7). Larutan kemudian dibagi dua masing-masing sebanyak 100µL. Larutan pertama diinkubasi dengan 50µL trypsin (1mg.mL-1 cacodylate buffer) sebagai aktivator sedangkan larutan kedua ditambahkan 50µL
4 10 x 15 x 5 n5 n4 n3 n2 n1 N
cacodylate buffer (pengganti tripsin). Kedua-duanya diinkubasi selama 10 menit pada temperatur 25-26oC. Selanjutnya masing-masing ditambah 50µL L-DOPA (3 mg/mL cacodylate buffer) dan 5 menit kemudian ditambahkan 800µL cacodilate buffer. Aktifitas PO kemudian diukur menggunakan spektrofotometer dengan kerapatan optik absorban 490nm. Densitas optikal (OD) dari aktifitas PO pada semua kondisi uji dinyatakan sebagai formasi dopachrome dalam 50 µL hemolim.
Osmolaritas
Osmolaritas diukur dengan mengambil 0,1mL hemolim ditambahkan dengan 0,9mL antikoagulan. Pemisahan plasma darah menggunakan metode Partidge dan Jenkins (2002). Darah disentrifuge dengan kecepatan 5000rpm selama 3 menit. Plasma darah diambil sebanyak 20µL untuk pengukuran osmolaritas. Nilai osmotik plasma diukur dengan menggunakan microosmometer merk Fiske Model 210. Tingkat kerja osmotik (TKO) dihitung dengan melihat osmolalitas plasma dibagi osmolalitas media. Apabila nilai TKO>1 dikategorikan hyperosmotik, TKO=1 isoosmotik dan TKO<1 dikategorikan sebagai hyposmotik.
HASIL DAN BAHASAN Kondisi Arus
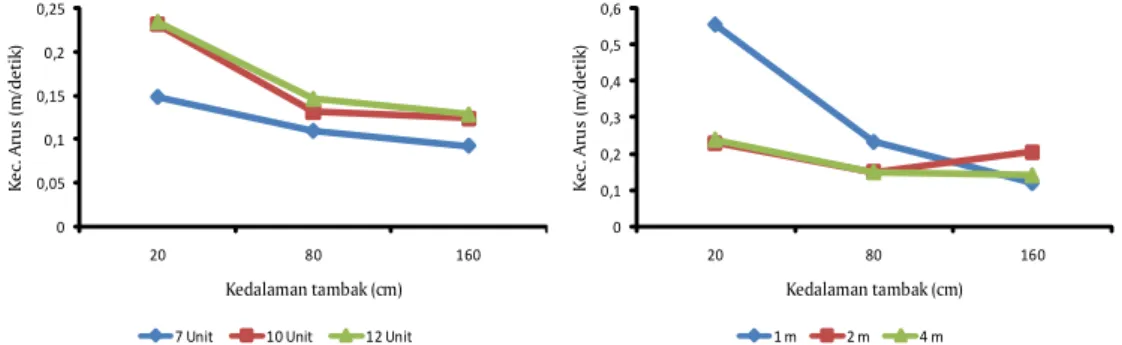
Hasil pengukuran arus dalam petak tambak dapat dilihat pada Gambar 1. Arus tersebut terbentuk dari adanya kincir air yang digunakan dalam penelitian ini. Kincir air/padle whell merupakan alat yang sangat dibutuhkan dalam budidaya udang sistem intensif. Alat ini diharapkan dapat mensuplai oksigen yang sangat dibutuhkan udang yang dipelihara. Air tambak yang teraduk oleh kincir air dapat mengikat oksigen di udara sehingga dapat meningkatkan oksigen dalam tambak. Kemampuan setiap jenis aerator yang biasa digunakan untuk mensuplai oksigen berbeda-beda. Menurut Boyd & Ahmad, 1987, kincir air mampu mentransfer oksigen sebanyak 2,13 kg.O2/Kw.hr dan tertinggi dibanding tipe aerator lainnya seperti propeller-aspitarotors-pumps (1,58 kg.O2/Kw.hr), vertical pumps (1,28kg.O2/Kw.hr), pump sprayers (1,28kg.O2/Kw.hr), dan terendah diffused air systems (0,97kg.O2/ Kw.hr). Penempatan kincir air dalam tambak pemeliharaan perlu diperhatikan dan diperhitungkan dengan baik. Seiring dengan bertambahnya padat penebaran dan bobot udang yang dipelihara maka idealnya kincir air juga harus ditambah. Efek dari penambahan jumlah kincir air adalah kemungkinan pergerakan air/arus dalam tambak juga akan meningkat. Berdasarkan hasil penelitian ini, terlihat bahwa penggunaan 7 unit kincir dapat menimbulkan arus dalam petakan tambak 0,148m/detik pada kedalaman 20cm, 0,109m/detik pada kedalaman 80cm dan 0,092m/detik pada kedalaman 160cm. Pada posisi yang sama dengan jumlah kincir 10 buah kecepatan arus masing-masing 0,2345, 0,132, dan 0,124m/detik sedangkan jika jumlah kincir dinaikkan menjadi 12 kincir maka kecepatan arus menjadi 0,235, 0,147, dan 0,129m/detik. Demikian halnya arus pada jarak 1 meter dari kincir di kedalaman 20cm kecepatannya 0,554m/detik, di 80cm 0,232m/detik sedang di 160cm 0,119 m/
Gambar 1. Arus dalam tambak penelitian budidaya udang vaname (Litopenaeus vannamei) super intensif. (Sebelah kiri adalah kecepatan arus dengan jumlah kincir berbeda dan kanan adalah kecepatan arus pada kedalaman tambak)
0 0,05 0,1 0,15 0,2 0,25 20 80 160 K ec . A ru s (m /d et ik ) Kedalaman tambak (cm)
7 Unit 10 Unit 12 Unit
0 0,1 0,2 0,3 0,4 0,5 0,6 20 80 160 K ec . A ru s (m /d et ik ) Kedalaman tambak (cm) 1 m 2 m 4 m
detik. Pada jarak 2 meter dari kincir masing-masing 0,23, 0,15, dan 0,21m/detik sedang pada jarak 4 meter kecepatannya 0,24, 0,15, dan 0,14m/detik.
Terlihat bahwa penambahan kincir dapat meningkatkan arus secara signifikan, demikian halnya bila jarak antar kincir yang semakin rapat. Berdasarkan hal tersebut, maka penambahan kincir air harus diperhitungkan jumlah maksimal yang dapat digunakan dan pengaturan jarak antar kincir tidak terlalu rapat. Kebutuhan oksigen dapat dipenuhi dengan mencari alternatif aerator yang sesuai.
Glukosa Hemolim
Hasil pengamatan glukosa hemolim selama penelitian dapat dilihat pada Gambar 2. Glukosa hemolim udang setelah 6 jam pengamatan pada daerah arus lambat (stasiun 1) dan cepat (Stasiun 3) cenderung meningkat, berbeda dengan udang yang ditempatkan di daerah arus sedang (stasiun 2) yang menurun. Pada pengamatan selanjutnya, glukosa hemolim udang di stasiun 1 dan 3 menurun sedang di stasiun 2 glukosanya meningkat. Peningkatan glukosa darah dapat menjadi indikator tingkat stres.
Berdasarkan hasil yang diperoleh terlihat bahwa penyebab stres pada hewan uji bukan hanya karena arus tapi juga dipicu oleh kurungan. Hal ini terlihat dari Gambar 2, stasiun 2 merupakan daerah yang memiliki arus sedang dibanding stasiun 1, arus lambat dan 3, arus cepat. Kurungan dapat menjadi pemicu stress pada ikan yang mengakibatkan tingginya glukosa darah dan kortisol ikan (Small, 2004). Udang yang dikurung kemungkinan telah mengalami kelelahan dan tidak mendapatkan asupan pakan yang cukup sehingga glukosa dalam darah digunakan sebagai sumber energi (Pascual, et al., 2003). Hal inilah yang terlihat pada pengamatan setelah 9 jam, glukosa hemolim udang yang ditempatkan di stasiun 1 menurun drastis.
Total Sel Hemosit
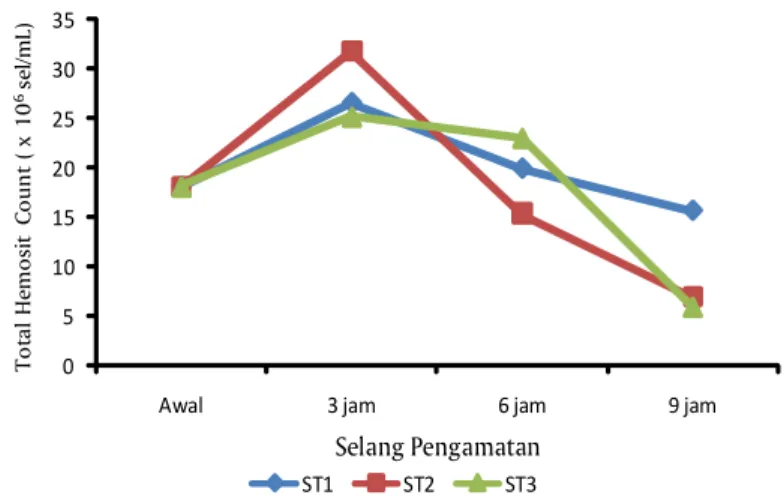
Hasil pengamatan total sel hemosit pada setiap stasiun pengamatan dapat dilihat pada Gambar 3. Total hemosit tertinggi ditemukan di stasiun 2 setelah 3 jam udang vaname ditempatkan pada arus sedang. Hal ini dapat menjadi pertanda adanya usaha dari udang vaname untuk beradaptasi dengan arus air. Adanya arus yang cukup cepat dibandingkan sebelumnya membuat hewan uji bergerak melawan arus air dan mengalami tekanan/stress sehingga memicu hati untuk memompa hemolim lebih cepat yang diindikasikan dengan tingginya total sel hemolim.
Pada pengamatan selanjutnya terlihat total sel hemosit pada semua stasiun mengalami penurunan. Hal ini dapat menggambarkan bahwa udang sudah mulai kelelahan melawan arus. Pada stasiun
Gambar 2. Glukosa hemolim udang vaname yang ditempatkan pada jarak kincir yang berbeda
0 5 10 15 20 25 30 35 40 45 50
Awal 6 jam 9 jam
G lu k o sa h e m o li m (m g /d L) Pengamatan ST1 ST2 ST3
yang terdekat dari kincir dengan arus yang lebih cepat, sel hemolimnya lebih rendah dibanding stasiun 1 yang lebih lambat arusnya. Hal ini mengindikasikan bahwa penggunaan kincir yang terlalu rapat, dengan arus yang cepat/tinggi dapat menyebabkan cultivan mengalami stress dan menyebabkan sebagian besar energi akan terserap untuk mengimbangi arus.
Aktivitas Prophenoloksidase
Kontras dengan hasil pengamatan pada pengamatan total sel hemosit, aktifitas prophenoloksidasi walaupun pada umumnya menurun, namun pada hewan uji di stasiun 3 cenderung meningkat kembali pada pengamatan 6-9 jam setelah perlakuan (Gambar 4). Hal ini kemungkinan disebabkan adanya sistem pertahanan tubuh cultivan yang cukup baik karena adanya asupan pakan yang cukup baik pada pemeliharaan. Hasil penelitian yang dilakukan oleh Otoshi et al. (2001) dan Gusman et al. (2001) dalam Pascual et al. (2003) bahwa udang yang dipelihara dalam kolam yang berisi bakteri, mikroalga, dan mikrobial-dentrital karena dapat menyuplai makanan dan meningkatkan aktifitas enzim pencernaan untuk mencerna pakan. Penambahan nukleotida dalam pakan udang vanamei
Gambar 3. Total sel hemosit udang vaname yang ditempatkan pada jarak kincir yang berbeda
0 5 10 15 20 25 30 35
Awal 3 jam 6 jam 9 jam
T o ta l H em o si t C o u n t ( x 1 0 6se l/ m L ) Selang Pengamatan ST1 ST2 ST3
Gambar 4. Aktivitas prophenoloksidase udang vaname yang ditempatkan pada jarak kincir yang berbeda
0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 0,04
Awal 3 jam 6 jam 9 jam
P ro PO (A bs ) Selang Pengamatan ST1 ST2 ST3
dapat meningkatkan aktifitas phenoloksidase hewan uji sehingga lebih resisten terhadap bakteri patogen (Manopo, 2010).
Osmolaritas
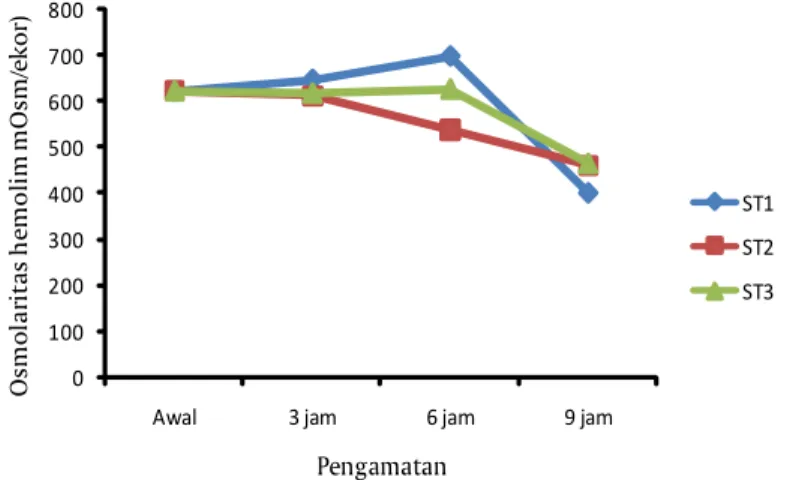
Osmolaritas hemolim udang uji yang ditempatkan pada semua stasiun penelitian dapat dilihat pada Gambar 5. Pada stasiun 1 dan 3, osmolaritas udang uji meningkat hingga pengamatan 6 jam namun setelah 9 jam osmolaritas hemolim semua udang uji menurun.
Tingkat kerja osmotik juvenil udang vaname yang ditempatkan pada arus lambat dan arus cepat hingga pengamatan 6 masih sama atau meningkat sedangkan yang ditempatkan di arus sedang sudah mulai menurun pada pengamatan 6 jam namun setelah 9 jam semua udang vaname mengalami penurunan tingkat kerja osmotik. Osmolaritas merupakan suatu upaya yang dilakukan untuk menyesuaikan ion-ion dalam tubuh organisme dengan media hidupnya. Organ yang bertanggungjawab dalam proses osmolaritas pada udang adalah kelenjar antenal. Osmolaritas hemolim dan medium sangat dipengaruhi oleh suhu, salinitas, oksigen, siklus molting, dan amoniak. Perubahan parameter ini dapat menyebabkan udang mengalami kondisi stres. Osmolaritas yang menurun pada pengamatan 9 jam kemungkinan disebabkan karena semakin berkurangnya kemampuan udang uji mempertahankan cairan dalam tubuh. Kemampuan mempertahankan cairan dalam tubuh memerlukan energi. Energi dapat diperoleh dari glukosa darah, sementara pada jam pengamatan tersebut kadar glukosa dalam darah telah terbagi terpakai untuk melawan arus serta proses adaptasi lainnya.
KESIMPULAN
Udang vaname (Litopenaeus vannamei) yang ditempatkan pada semua stasiun pengamatan mengalami stres. Kondisi stres mulai dialami oleh udang setelah 3 jam yang ditandai dengan menurunnya jumlah sel hemosit, glukosa hemolim, dan osmoregulasi akibat adaptasi yang dilakukan untuk melawan arus dan mempertahankan diri. Prophenoloksidase yang masih tetap tinggi di akhir pengamatan menandakan daya tahan tubuh udang yang baik karena asupan pakan yang baik.
DAFTAR ACUAN
Atjo, H. 2013. Budidaya udang supra intensif. Majalah Trobos edisi Juli 2013. http://www.trobos.com/ show_article.
Blaxhall, P. and Daishley, K. 1973. Some Blood Parameters of the Rainbow Trout I. The Kamloops variety. J. Fish. Biol. 5: 1-8.
Gambar 5. Osmolaritas hemolim udang vaname yang ditempatkan pada stasiun dengan kecepatan arus yang berbeda
0 100 200 300 400 500 600 700 800
Awal 3 jam 6 jam 9 jam
O sm o la ri tas h em o li m m O sm /e k o r) Pengamatan ST1 ST2 ST3
Boyd, C. and T. Ahmad. 1987. Evaluation od Aerator for Channel Catfish Farming. Alabama Agr. Exp. Sta., Bull. 584, Auburn University, 52 pp.
Braak, K. Van den. 2002. Haemocytic Defence in Black Tiger Shrimp (Panaeus monodon). PhD thesis, Wageningen University – with ref. – with summary in Dutch. Nedherlands. 159 pages.
Budiardi, T., Batara, T., dan Wahjuningrum, D. 2005. Tingkat Konsumsi Oksigen Udang Vaname (Litopenaeus vannamei) Dan Model Pengelolaan Oksigen Pada Tambak Intensif. J. Akuakultur Indonesia 4(1):89-96.
Gunarto dan Hendrajat, E.A. 2008. Budidaya udang vanamei, Litopenaeus vannamei pola semiintensif dengan aplikasi beberapa jenis probiotik komersial. J. Ris. Akuakultur 3(3):339-349.
Hastuti, S., Supriyono, E., Mokoginta, I., and Subandiyono. 2003. Respon glukosa darah ikan (Osphronemus gouramy, LAC.) terhadap stres perubahan suhu lingkungan. Jurn. Akuakultur Indonesia 2(2):73-77.
Liu C.H. and J.C. Chen. 2004. Effect of ammonia on the immune respons of white shrimp Litopenaeus vannamei and susceptibility to Vibrio alginolyticus. Fish and Shelfish Imunology. 16:321 – 334. Otoshi CA, Montgomery AD, Look AM, Moss SM (2001) Effects of diet and water source on the nursery
production of Pacific white shrimp Litopenaeus vannamei. J World Aquacult Soc 32:243–249 Pascual, G., Gaxiola, G., Rosas, C. 2003. Blood metabolites and hemocyanin of the white shrimp, Litopenaeus
vannamei: the effect of culture conditions and comparison with other crustacean spesies. Marine Biology 142:735-745.
Manopo, H. 2011. Peran Nukleotida sebagai Imunostimulan terhadap Respon Imun Nonspesifik dan Resistensi Udang Vaname (Litopenaeus vannamei). Tesis. Sekolah Pascasarjana Institut Pertanian Bogor. 121 pages.
Smal, B.C. 2004. Effect of isoeugenol sedation on plasma cortisol, glucose, and lactate dynamics in channel catfish Ictalurus punctatus exposed to three stressors. Aquaculture 238:469-481.
Surbakti, H. 2012. Karakteristik Pasang Surut dan Pola Arus di Muara Sungai Musi, Sumatera Selatan. Jurn. Penelitian Sains 15(1):35-39
Subyakto, S.S., Sutende, D., Afandi, M., dan Sofiati. 2009. Budidaya Udang Vannamei (Litopenaeus Vannamei) Semiintensif Dengan Metode Sirkulasi Tertutup Untuk Menghindari Serangan Virus. Jurn. Ilmiah Perikanan dan Kelautan 1(2):121-127.
DISKUSI
Nama Penanya:
Indra Jaya
Pertanyaan:
Dari hasil penelitian menunjukkan udang yang dipeliara dalam sistem super intensif semakin stress, lalu bagaimana supaya tidak stress?
Tanggapan:
Pada budidaya super intensif jadi density sangat tinggi sehingga pasokan O2 dalam air juga harus tinggi sehingga kincir juga harus lebih banyak. Dalam penelitian ini tujuan akhir adalah mencari aerator alternatif untuk penggantian kincir sebagai sumber O2 yang lebih aman dan jarak kincir tidak boleh dekat supaya stress diminimalisir.
Nama Penanya:
Yohana
Pertanyaan:
Jika memang dalam pemeliharaan super intensif udang justru semakin stress maka apakah masih diperbolehkan udang dipelihara dalam kondisi tersebut?
Tanggapan:
Masih bisa dipelihara dengan pengunaan alternatif aerator seperti blower dimana O2 bisa berdifusi langsung ke dalam air, kemudian dapat juga dengan meningkatkan penggantian air menjadi lebih banyak.