BAB II
TINJAUAN PUSTAKA
2.1. Eceng Gondok dalam Produksi Bioetanol
Konversi biomassa lignoselulosa ke bahan bakar bio berpotensi mengamankan sekuritas energi dan mengurangi emisi gas rumah kaca demi keberlangsungan lingkungan (Wyman, 1999 dalam Kumar et al. 2009; Joshi et al. 2011). Eceng gondok, tersedia dalam jumlah banyak dan tidak diinginkan, cocok digunakan sebagai tanaman penghasil bioenergi karena bereproduksi dengan cepat, memiliki kandungan lignin rendah, resistan terhadap zat kimia, tidak kompetitif dengan tanaman pangan, dan memiliki kecenderungan polusi genetik yang rendah melalui penyerbukan silang antar tanaman pangan terkultivasi (Patel, 2012; Bhattacharya dan Kumar, 2010; Mukhopadhyay dan Chatterjee, 2010). Kapabilitasnya menghasilkan etanol menyamai limbah pertanian, sesuai untuk produksi bahan bakar bio dan juga sebagai kandidat bahan baku industri penghasil lapangan kerja (Mashima et al. 2008). Hronich et al. (2008) menyatakan bahwa penggunaan eceng gondok menjadi ekonomis pada biaya produksi sekitar $40 per ton massa kering.
Produksi etanol sendiri diperkirakan meningkat tajam di masa depan, karena kemungkinan naiknya harga minyak, meningkatnya permintaan bahan bakar cair, peraturan pemerintahan yang menyarankan penggunaan bahan bakar bio (Mandat
E-10), dan produksi bahan bioplastik dari etanol (Nag, 2008; Neves et al. 2007). Di samping alasan-alasan di atas, mencampurkan etanol ke dalam bensin juga meningkatkan bilangan oktan bensin, dan memungkinkan pembakaran yang lebih sempurna (Wyman 1994).
2.2. Karakteristik dan Pola Perkembangbiakan Eceng Gondok
Eceng gondok adalah tanaman akuatis terapung perenial yang berasal dari Brazil, basin Amazon, daerah ekuator, daerah tropis dan sub-tropis Amerika Selatan. Dengan daun yang lebar dan mengkilap, eceng gondok dapat mencapai tinggi 1 meter di atas permukaan air. Batangnya panjang, menggelembung dan berongga. Akarnya yang berbulu dan bebas bergantung berwarna ungu kehitaman. Satu tangkai tegak menyokong segerombol 8 – 15 bunga yang atraktif, kebanyakan berwarna lavender sampai merah jambu dengan enam kelopak seperti dalam Gambar 2.1 (Patel, 2012; Flacker, 2004).
Sebagai salah satu tanaman dengan laju pertumbuhan tercepat, eceng gondok berproduksi terutama melalui stolon yang membentuk anak tanaman. Eceng gondok juga dapat menghasilkan tanaman baru melalui fragmentasi (pecah menjadi bagian kecil), membentuk tunas daun di pucuk dasar batang, dan memproduksi sejumlah besar bibit yang tahan hingga tiga puluh tahun. Eceng gondok umum (Eichhornia crassipes) tumbuh secara agresif, dan diketahui dapat melipat-gandakan populasinya dalam dua minggu (Flacker, 2004). Dalam suatu studi, dua tanaman menghasilkan 1.200 anak tanaman dalam empat bulan. Satu tanaman dapat memproduksi 5.000 bibit dan unggas air memakan dan memindahkan bibit ke lokasi baru (Anonim, 2012). Tanaman tropis ini menyebar ke berbagai bagian bumi di akhir abad ke-19 dan awal abad-20 (Wilson et al. 2005). Semua usaha ilmuwan dan teknokrat di seluruh dunia untuk memberantas tanaman ini secara kimiawi dan biologis hanya membuahkan sedikit hasil (Jafari, 2010).
Adapun mudahnya adaptasi eceng gondok di habitat barunya dapat dilacak ke beberapa sifat (Flacker, 2004; Soltan dan Rashed, 2003):
1. Eceng gondok berkembang-biak secara efektif melalui dua metode vegetatif. 2. Batangnya yang berongga dan terisi udara memudahkannya tetap terapung. 3. Daunnya yang menyerupai kipas mempermudah penyebarannya ke badan air
ketika angin bertiup.
5. Eceng gondok dapat bertahan hidup di campuran logam berat dengan konsentrasi sampai 3 mg/l.
2.3. Dampak Ekologi, Kimia – Fisik dan Utilisasi Eceng Gondok
Keberadaan eceng gondok pada ekosistem yang dimasukinya bersifat merusak. Eceng gondok dapat merubah struktur dan fungsi ekosistem dengan mengganggu rantai makanan dan siklus nutrisi. Eceng gondok juga menutupi permukaan air dan menghalangi cahaya matahari. Ketika eceng gondok ataupun tumbuhan yang diganggunya membusuk, pembusukannya menghabiskan oksigen terlarut dalam air (Patel, 2012; Flacker, 2004).
Pertumbuhan eceng gondok yang masif dan invasif juga berpengaruh pada kehidupan manusia. Terganggunya aktivitas pelayaran dan nelayan, sistem drainasi yang tersumbat, serta menurunnya estetika dan nilai rekreasional lingkungan merupakan contoh gangguan yang disebabkan gulma ini (Patel, 2012; Flacker, 2004).
Ketika tumbuh di luar kendali, eceng gondok merupakan gangguan, tetapi beberapa peneliti menyarankan penggunaan tanaman eksotis ini sebagai sumber daya dapat dipanen, misalnya sebagai makanan hewan, sumber antioksidan, sumber antibiotik, biosorben, agen fitoremediasi, bahan pulp, pupuk organik, bahan kerajinan tangan dan perabotan, bahan biofuel, dan untuk memproduksi enzim selulase (Bhattacharya dan Kumar, 2010; Calvert, 2001; Patel, 2012; Chen et al. 2010; Cheng et al. 2010; Dada, 2002; Delgado et al. 1993; Flacker, 2004; Goswami
dan Saikia, 1994; Hasan et al. 2007; Ibrahim et al. 2012; Jianbao et al. 2008; Ma et al. 2010; Mahamadi, 2011; Mishima et al. 2008; Orth dan Sapkota, 1988; Yerima et al. 2009; Yi et al. 2009). Akan tetapi, bahkan dengan banyaknya pemanfaatannya, sejauh ini dampak negatif tanaman ini ke habitat adopsinya masih jauh melampaui kontribusinya ke lingkungan barunya (Flacker, 2004).
Dari segi komposisi kimianya, tanaman ini memiliki flavanoid, asam amino, protein kasar, sianida, fosfat, zat organik dan karbon organik tinggi (Nyananyo et al. 2007). Tanaman segar mengandung 95,5% kelembapan, 0,04% N, 1,0% abu, 0,06% P2O5, 0,20% K2O, 3,5% bahan organik. Pada basis kelembapan nol, terdapat 75,8% bahan organik, 1,5% N, dan 24,2% abu. Abu mengandung 28,7% K2O, 1,8% Na2O, 12,8% CaO, 21,0% Cl, dan 7,0% P2O5. Protein mentah mengandung, per 100 g, 0,72 g metionin, 4,72 g fenilalanin, 4,32 g treonin, 5,34 g lisin, 4,32 g isoleusin, 0,27 g valin, dan 7,2 g leusin (Matai dan Bagchi, 1980 dalam Jafari, 2010). Kuantitas hemiselulosa, selulosa dan lignin dari berbagai sumber ditunjukkan dalam Tabel 2.1.
Tabel 2.1. Kandungan Hemiselulosa, Selulosa dan Lignin Eceng Gondok (Basis Kering) Komponen (% berat) Ahn et al. (2012) Sornvoraweat dan Kongkiattikajorn (2010) Gunnarson dan Peterson (2007) Chanakya et al. (1993) Patel et al. (1993) Abdelhamid dan Gabr (1991) Hemiselulosa 34,19 32,69 0,024 22-43,4 33,39 43,4 33,4 Selulosa 17,66 19,02 0,017 17,8-31 18 17,8 19,5 Lignin 12,22 4,37 0,027 7-26,36 26,36 7,8 9,27
(Sornvoraweat dan Kongkiattikajorn, 2010; Hasan dan Chakrabati, 2009)
Hasan dan Chakrabarti (2009) juga menyampaikan bahwa hanya ada sedikit variasi dalam komposisi proksimat dalam hubungannya dengan lokasi geografis.
Akan tetapi, eceng gondok yang hidup di kondisi yang berbeda mungkin memiliki variasi komposisi karena akar mereka menyerap polutan secara alami (Jafari, 2010). Lebih jauh lagi, sebuah studi oleh Mahmood et al. (2005) menunjukkan bahwa di bawah pengaruh limbah tekstil, eceng gondok mengalami penurunan ukuran secara anatomis. Kondisi yang sama kemungkinan besar juga dialami eceng gondok di perairan Danau Toba yang tercemar. Namun, besar pengaruh hal tersebut dalam produksi bioetanol masih belum dapat dipastikan.
2.4. Danau Toba dan Masalah Eceng Gondok
Danau Toba merupakan danau terbesar Indonesia dan terletak di provinsi Sumatera Utara, 176 km ke barat ibukota provinsi, Medan. Danau Toba memiliki panjang 87 km dari barat laut ke Tenggara dan lebar 27 km, dan berada 904 meter di atas permukaan laut dengan kedalaman 505 meter. Danau tersebut merupakan salah satu tujuan wisata penting. Daerah resapannya seluas 3.704 km2, meliputi sebagian area dari lima kabupaten. Kualitas air di danau ini telah terpengaruh secara negatif oleh buangan air domestik, peternakan ikan, polusi minyak dan polusi biologis (Moedjodo et al. 2006; Worldlake, 2012).
Sejak 1990, eceng gondok telah tampak mengambang di daerah Parapat, menandakan dimulainya eutrofikasi danau tersebut (Moedjodo et al. 2006). Setelah itu, berbagai masalah mulai bermunculan, mulai dari terganggunya penangkapan ikan sampai meluasnya tempat perkembangbiakan vektor penyakit (Opande et al.
2004). Walaupun sejumlah konsep sudah diberikan untuk mengatasi masalah lingkungan tersebut, merealisasikan konsep ini terbukti susah karena perbedaan persepsi dan konflik kepentingan antara pemegang saham (Moedjodo et al. 2006).
Ledakan pertumbuhan eceng gondok dalam danau ini telah dihubungkan dengan polusi fosfor dan nitrogen. Idealnya, jalan terbaiknya adalah menekan masukan limbah. Akan tetapi, terbatasnya limbah yang bisa dikurangi dan lamanya waktu operasi telah menyebabkan cara ini tidak efektif. Jelas kiranya bahwa populasi eceng gondok harus dikendalikan. Mukhopadhyay dan Chatterjee (2010) mengusulkan cara pengendalian yang ramah lingkungan dengan menggunakannya sebagai bahan baku murah dalam proses inovatif biokonversi ke etanol.
2.5. Ulasan Teknologi Produksi Bioetanol
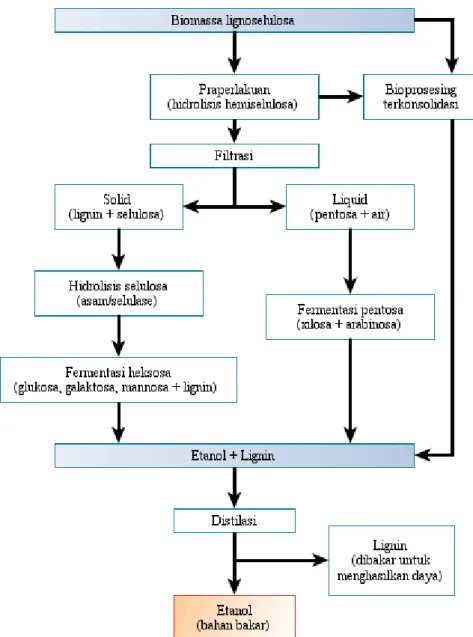
Teknologi produksi bioetanol saat ini (proses generasi pertama) menggunakan gula tebu dan/atau biji-bijian dan umbi – umbian berbasis tepung (terutama jagung dan kentang) sebagai substrat utama. Akan tetapi oleh karena dampak negatifnya pada harga makanan dan sekuritas makanan, trend saat ini sedang bergeser ke biomassa lignoselulosa. Ada dua proses lignoselulosa yang tersedia, proses enzimatis dan proses termokimia. Proses enzimatis umumnya melibatkan hidrolisis biomassa lignoselulosa ke gula diikuti fermentasi gula ke etanol (lihat Gambar 2.2). Proses termokimia menggunakan jalur gasifikasi dan jalur pirolisis (Joshi et al. 2011; Foust et al. 2009; Piccolo dan Bezzo, 2007).
Gambar 2.2. Tahapan dalam Produksi Bioetanol Secara Umum (Joshi et al. 2011)
Untuk biomassa lignoselulosa herbal, proses enzimatis lebih cocok (Foust et al. 2009). Penjelasan lengkap tentang praperlakuan, hidrolisis/sakarifikasi, fermentasi dan skema terintegrasi proses ini akan diuraikan dalam tiap sub bagian.
Untuk saat ini, etanol selulosa masih kurang diminati karena keuntungannya yang marginal. Beberapa alasan yang menyebabkannya antara lain:
a. Teknologi praperlakuan yang ada kurang efisien atau terlalu mahal dan banyak kelemahan yang menyertainya.
b. Harga enzim terlalu tinggi.
c. Konversi oleh mikroba masih terbatas. Sebagai contoh, Zymmomonas mobilus yang lebih toleran dari ragi hanya mampu mentolerir konsentrasi etanol sampai 16% saja.
Teknologi ini diperumit lagi oleh masalah-masalah umum bioreaktor seperti kontaminasi mikroba, tidak stabilnya proses, problematika daur ulang dan washout mikroba, serta pemrosesan akhir yang sukar. Khusus untuk proses fermentasi lignoselulosa, tingginya kekentalan pada loading padatan tinggi menyebabkan masalah pengadukan (Huang et al. 2011). Walau begitu, teknik-teknik untuk mengatasi masalah – masalah ini telah banyak dikembangkan.
2.5.1. Metode Praperlakuan
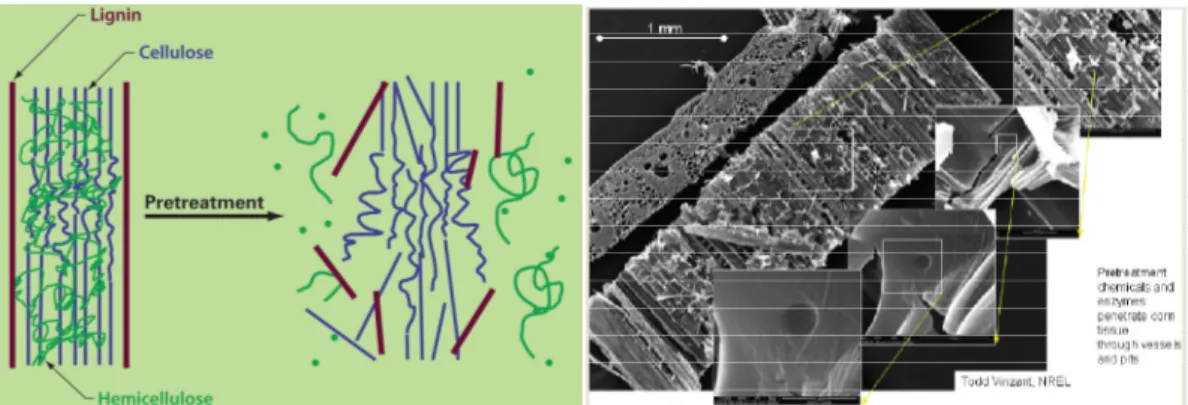
Salah satu rintangan utama dalam hidrolisis selulosa adalah karakteristik substrat yang tidak mendukung hidrolisis selulosa. Karakteristik ini kemudian dimodifikasi agar hidrolisis berlangsung lebih efisien (Huang et al. 2011). Sebab itulah, praperlakuan memiliki dampak besar pada seluruh operasi dan biasanya merupakan bagian paling mahal (Joshi et al. 2011). Praperlakuan umumnya berguna
untuk membuka struktur lignoselulosa agar dapat diakses enzim seperti dalam Gambar 2.3 (Huang et al. 2011; Sanderson, 2006 dalam Neves et al. 2007). Beberapa masalah umum dalam praperlakuan adalah terbentuknya produk penghambat, pembukaan struktur lignin – hemiselulosa – selulosa kurang efektif, terlalu banyak selulosa terdegradasi, perlunya biaya kapital (peralatan) atau operasi yang mahal, daur ulang senyawa kimianya mahal, terbentuknya limbah, ataupun kondisi operasi yang tidak aman (Geddes et al. 2011; Huang et al. 2011; Menon dan Rao, 2012; Neves et al. 2007). Sejumlah cara praperlakuan dijabarkan dalam Tabel 2.2. Praperlakuan yang telah dilakukan biasanya bertujuan untuk meningkatkan akses enzim, menghilangkan lignin, dan mengganggu kristalinitas selulosa. Dalam banyak studi, meningkatkan akses enzim dianggap lebih penting daripada menghilangkan lignin (Zhu, 2011; Huang et al. 2011). Ahn et al. (2012) juga menunjukkan bahwa praperlakuan yang menghasilkan konten selulosa tinggi lebih penting dibanding dengan yang menghasilkan konten lignin rendah. Selain hal-hal di atas, hal yang perlu diperhatikan adalah terbentuknya pseudo-lignin dalam metode pretreatment tertentu (Hu et al. 2003).
Praperlakuan yang ada dikembangkan untuk mengurangi limbah, kerusakan, inhibitor, gula nonfermentable, meningkatkan hasil gula, dan mengurangi biaya praperlakuan (Kumar et al. 2009; Houghton et al. 2006). Secara garis besar, praperlakuan fisik biasanya memerlukan energi besar, sedangkan praperlakuan biologis memerlukan waktu lama. Praperlakuan kimiawi menggunakan bahan kimia,
dan peralatan yang mahal (Taherzadeh dan Karimi, 2008). Dalam penelitian ini, beberapa jenis praperlakuan dipilih dan dibandingkan untuk mengetahui metode yang paling sesuai dengan prioritas kesederhanaan, keamanan, dan ramah lingkungan.
Gambar 2.3. Perubahan Struktur Mikro Akibat Praperlakuan (Houghton et al. 2006)
2.5.2. Metode Hidrolisis
Tahap hidrolisis mentransformasi selulosa ke gula terfermentasi. Dua metode umum hidrolisis adalah hidrolisis asam dan hidrolisis enzimatis. Metode hidrolisis lain adalah hidrolisis termal yang sangat jarang digunakan. Hidrolisis enzimatis lebih dipilih karena bekerja pada suhu wajar, menghasilkan yield tinggi dengan jumlah yang sedikit, merupakan senyawa alami yang dapat terbiodegradasi dan ramah lingkungan (Wyman, 1994).
Tabel 2.2. Berbagai Metode Praperlakuan
Metode Praperlakuan Keterangan Literatur
Praperlakuan asam: asam encer, dan asam pekat
Menghidrolisa hemiselulosa dan merusak struktur kristal selulosa, tapi menghasilkan produk samping inhibitor, dan memerlukan peralatan tahan korosi. Biasanya menggunakan H2SO4, tetapi asam fosfat
dikatakan menghasilkan lebih sedikit produk samping beracun dan dapat digunakan pada reaktor baja antikarat. Jenis asam encer memberi yield rendah sedangkan jenis asam pekat menghasilkan produk samping, mendegradasi selulosa dan memerlukan biaya daur ulang mahal.
Eshtiaghi et al. 2012 Merina dan Trihadinigrum, 2011 Satyanagalakshmi et al. 2011 Sornvoraweat dan Kongkiattikajorn, 2010 Sassner et al. 2008 Praperlakuan alkali/basa Memisahkan lignin dan sebagian hemiselulosa, dan meningkatkan
reaktivitas selulosa. Biasanya menggunakan NaOH, Ca(OH)2, urea
atau Ammonia (SAA, ARP). NaOH juga meningkatkan derajat polimerisasi dan kristalinitas selulosa. Ammonia juga mengembangkan substrat yang tersisa.
Eshtiaghi et al. 2012 Aswathy et al. 2010 Taherzadeh dan Karimi 2008
Hamelinck et al. 2005 Teymouri et al. 2005 Praperlakuan dengan agen
pengoksidasi: hidrogen per-oksida, asam per asetat
Yield setinggi 98% berhasil dicapai. Saha dan Cotta, 2007 Teixeira et al. 1999 Gould, 1984 Praperlakuan dengan
pelarut organik
Melarutkan lignin dan sebagian hemiselulosa tapi memerlukan peralatan dengan tekanan tinggi. Pelarut organik yang sudah digunakan misalnya metanol, etanol, aseton, etilen glikol, trietilen glikol, dan alkohol tetrahidrofurfuril.
Yamashita et al. 2010 Pan et al. 2005
Steam explosion, ammonia fiber expansion/explosion, acid catalyzed steam explosion
Bahan dipanaskan pada suhu dan tekanan tinggi kemudian didekompresi ke tekanan atmosfir secara tiba-tiba. Masih belum praktis karena butuh energi besar dan peralatan mahal.
Huang et al. 2011 Hamelinck et al. 2003
Tabel 2.2. Berbagai Metode Praperlakuan (lanjutan)
Metode Praperlakuan Keterangan Literatur
Liquid Hot Water (LHW)
Menghidrolisa hemiselulosa menggunakan air bersuhu tinggi (160 – 190oC) dan tekanan tinggi (30 bar).
Eshtiaghi et al. 2012 Kim et al. 2009 Perez et al. 2007 Hamelinck dan Faaij, 2006
Praperlakuan cairan ionik
Berbagai cairan ionik yang ada dapat diatur untuk melarutkan selulosa, ataupun lignin. Substrat dilarutkan dalam cairan ionik dan dipanaskan kemudian dipresipitasi dengan antisolven. Proses ini merupakan teknologi baru dan lebih cocok untuk biomassa berkayu. Muhammad et al. 2012 Sathitsuksanoh et al. 2012 Guragain et al. 2011 Lee et al. 2009 Granstorm et al. 2008 Kosan et al. 2008 Praperlakuan mikrobial Jamur akar putih, coklat, dan lunak (Basidiomycetes) telah
banyak digunakan untuk mendepolimerisasi substrat lignoselulosa tanpa banyak produk samping inhibitor
Chandel et al. 2011b Zhong et al. 2011 Cardona et al. 2007 Penggilingan
Ekstrusi
Tanpa mempengaruhi lignin dan hemiselulosa, meningkatkan aksesibilitas dan merubah kristalinitas selulosa. Merupakan salah satu metode paling efektif tetapi kurang cocok diterapkan di industri. Penggilingan dilakukan dalam hampir semua proses di laboratorium. Harun et al. 2011 Merina dan trihadinigrum, 2011 Satyanagalakshmi et al. 2011
(Eshtiaghi et al. 2012; Muhammad et al. 2012; Sathitsuksanoh et al. 2012; Chandel et al. 2011b; Geddes et al. 2011; Guragain et al. 2011; Harun et al. 2011; Huang et al. 2011; Joshi et al. 2011; Merina dan Trihadinigrum, 2011; Satyanagalakshmi et al. 2011; Aswathy et al. 2010; Sornvoraweat dan Kongkiattikajorn, 2010; Kim et al. 2009; Lee et al. 2009; Granstorm et al. 2008; Kosan et al. 2008; Neves et al. 2007; Hamelinck dan Faaij, 2006; Wyman, 1994)
Hidrolisis asam menggunakan berbagai asam mineral pada suhu tinggi, walaupun proses sering mendegradasi glukosa ke hidroksimetil furfural (HMF) dan produk samping beracun lain, atau mencapai yield rendah. Harga asam, daur ulang, dan pengolahan limbahnya masih menjadi masalah dalam hidrolisis asam.
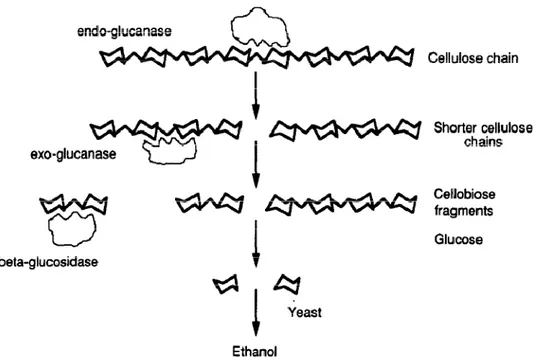
Gambar 2.4. Aktivitas Enzim dalam Hidrolisis Selulosa (Wyman, 1994)
Hidrolisis enzimatis memanfaatkan 3 kelompok enzim untuk berfungsi dengan baik (Lihat Gambar 2.4). Pertama, 1,4--D-glukan glukanohidrolase (EC 3.2.1.3) dan 1,4--D-glukan 4-glukanohidrolase (EC 3.2.1.4), dikenal sebagai endo-1,4--glukanase, memotong rantai selulosa secara acak. Kemudian, 1,4--D-glukan glukohidroliase (EC 3.2.1.74) dan 1,4--D-glukan selobiohidroliase (EC 3.2.1.91), dikenal sebagai ekso-1,4--glukanase berturut-turut membebaskan glukosa dan D-selobiosa pada ujung selulosa. Akhirnya, -D-glukosidase (EC 3.2.1.21), dikenal
juga sebagai selobiase, mengubah selobiosa menjadi D-glukosa (Joshi et al. 2011; Geddes et al. 2011; Neves et al. 2007; Wyman, 1994).
Selulase komersial dan produksi on-site selulase dapat digunakan. Kebanyakan glukanase diproduksi Trichoderma ressei (jamur akar halus) sedangkan selobiase dari Aspergillus niger (Barta et al. 2010 dalam Geddes et al. 2011; Kaur et al. 2007 dalam Joshi et al. 2011).
Gambar 2.5. Berbagai Senyawa Turunan Hidrolisis Asam (Chandel et al. 2011b)
Salah satu perbedaan terbesar hidrolisis asam dan enzim adalah produk samping hidrolisis asam yang sangat beragam dan bersifat menginhibisi
Lignin Cellulose Hemicellulose Others Phenolics (Vanillin, Syringaldehyde, 4-hydroxybenzoic acid, ferulic acid, etc) 5-hydroxymethyl furfural (HMF) Furfurals 5-hydroxymethyl furfural (HMF) Weak acids (Acetic acid, Formic acid, Levulinic acid) Tannins Terpenes Resins Heavy metals Hibbert ketones
pertumbuhan. Selain itu, jenis hidrolisis asam menghasilkan limbah dan memerlukan penanganan khusus. Oleh sebab itulah, proses hidrolisis yang digunakan dalam penelitian ini menggunakan jenis hidrolisis enzim. Berbagai jenis produk samping hasil hidrolisis asam dapat dilihat pada Gambar 2.5.
2.5.3. Fermentasi dan Skema Proses Terpadu
Ragi Saccharomyces cerevisiae merupakan mikroorganisme yang paling disukai dalam fermentasi heksosa. Selain ragi, Pichia stipitis dan Candida shehatae juga mampu memfermentasi heksosa dan pentosa ke etanol (Parekh et al. 1986 dalam Joshi et al. 2011). Gorsek dan Zajsek (2010) menemukan bahwa dalam jangkauan suhu 16oC sampai 30oC, produksi etanol oleh ragi meningkat.
Di samping intensifikasi proses, penggembangan juga dilakukan dalam sistem bioreaktor misalnya external loop liquid-lift bioreactor, circulating loop bioreactor, bioreaktor membran, ultrasonic airlift reactors, fluidized bed reactor (Stang et al. 2001; Roble et al. 2003; Huang et al. 2011). Sistem bioreaktor yang dikembangkan biasanya mengangkat isu-isu mengenai masalah viskositas campuran yang tinggi sehingga mengurangi transfer massa ataupun merujuk pada upaya integrasi proses ekstraksi etanol secara simultan dalam proses kontiniu sehingga mengurangi inhibisi produk. Beberapa skema proses yang sering digunakan dalam produksi bioetanol dirangkum dalam Tabel 2.3.
Tabel 2.3. Skema Proses Terpadu dalam Produksi Bioetanol Skema Proses Terpadu Keterangan Separated hydrolysis and fermentation (SHF)
Tahap hidrolisis selulosa dan fermentasi dipisah sehingga mengurangi interaksi antar tahap.
Kelemahan: sering kali produk akhir hidrolisis menghambat kerja enzimnya dan membatasi kinerjanya.
Simultaneous saccharification and fermentation (SSF) atau Hybird Hydrolysis and Fermentation (HHF)
Tahap hidrolisis selulosa dan fermentasi digabung. Secara umum meningkatkan kinetika fermentasi dan ekonomi karena mengurangi akumulasi gula yang menginhibisi enzim dan adanya etanol mengurangi kontaminasi mikroba.
Kelemahan: kondisi optimal enzim dan mikroba mungkin berbeda dan banyak gula dipakai untuk pertumbuhan ragi.
Simultaneous saccharification and cofermentation (SSCF)
Sama seperti SSF tetapi fermentasi pentose juga diintegrasikan ke dalam proses. Kelemahan: sama seperti SSF tapi
lebih rumit lagi.
Consolidated
BioProcessing (CBP) atau Direct Microbial Conversion (DMC)
Produksi selulase, hidrolisis substrat, dan fermentasi dilakukan dalam satu tahapan. Kelemahan CBP/DMC: tidak ada mikroba alami yang mampu memproduksi selulase sekaligus memfermentasi hidrolisat (harus menggunakan mikroba hasil rekayasa genetik) dan proses terbentur oleh wujud alami suspensi yang berserat (rheologi aliran).
(Joshi et al. 2011; Geddes et al. 2011; Neves et al. 2007)
2.5.4. Strategi-strategi yang Diterapkan untuk Meningkatkan Tiap Proses
Selain pengembangan teknologi dan mikroorganisme dalam proses itu sendiri, beberapa strategi juga telah dikembangkan untuk meningkatkan efisiensi tiap proses. Beberapa di antara strategi-strategi tersebut adalah detoksifikasi hidrolisat, penambahan additif, immobilisasi sel dan enzim, penambahan antibiotik/agen antibakteri, penambahan enzim xilanase dan pektinase, penggunaan bakteri/jamur
anaerob penghasil selulosom dan/atau strain flokulen (Chandel et al. 2011b; Huang et al. 2011; Najafpour et al. 2004; Rakin et al. 2009; Maye, 2011).
Berbagai cara detoksifikasi telah tersedia misalnya evaporasi vacuum, separasi membran, netralisasi, overliming, activated charcoal pretreatment, resin penukar ion, ekstraksi dengan etil asetat, aklimatisasi mikrobial, detoksifikasi mikrobial in-situ, dan detoksifikasi enzimatis. Dari cara-cara yang ada, detoksifikasi biologislah yang paling menguntungkan (Chandel et al. 2011b). Detoksifikasi biologis dapat dilakukan dengan simultaneous detoxification and enzymatic production, simultaneous detoxification and fermentation, dan cara lainnya.
Penggunaan aditif seperti Tween 20, Tween 80, polietilen glikol (PEG), bovine serum albumin (BSA), dapat mengurangi adsorpsi selulase ke lignin dan menjaga kestabilan enzim. Sebuah kelas protein non katalitik seperti ekspansin, protein mirip ekspansin, dan swollenins, diketahui dapat mengubah struktur selulosa walau penjelasan mengenai cara kerja protein ini masih sebatas spekulasi (Huang et al. 2011). Aditif lain seperti ion Mg2+dapat meningkatkan toleransi ragi S. cerevisiae terhadap etanol melalui penurunan permeabilitas membran plasma (Hu et al. 2003).
2.6. Produksi Bioetanol dari Eceng Gondok dan Perkembangannya
Penelitian mengenai pembuatan bioetanol dari eceng gondok dapat dilihat di Tabel 2.4. Dari tabel tersebut dapat dilihat bahwa hampir semua penelitian berkutat pada optimisasi bagian proses ataupun pengembangan mikroba yang ada. Sementara
berbagai studi telah dilakukan, hasil-hasil tersebut belum diterapkan di industri karena sebab-sebab seperti: yield etanol yang rendah; teknik pemrosesan yang kompleks dan lama; penggunaan bahan kimia, peralatan, ataupun alur proses yang mahal; dan teknik yang tidak ramah lingkungan. Dalam penelitian ini akan dicoba teknik pemrosesan yang berbeda yaitu fermentasi non-steril yang dilangsungkan bersamaan dengan hidrolisis hemiselulosa-selulosa, isomerisasi xilosa dan ekstraksi etanol serta sistem daur-ulang larutan fermentasi.
2.7. Komponen – Komponen dalam Produksi Bioetanol
2.7.1. Selulosa
Selulosa merupakan glukan paling penting yang tersusun oleh sakarida homopolimer selobiosa yang terdiri dari dua molekul -D-glukosa yang terikat dalam ikatan -(1–4)- glikosidik dan dapat berputar untuk membentuk ikatan intramolekul dan intermolekul (Bobleter, 2005). Dalam banyak penelitian, eceng gondok dikeringkan untuk mempermudah penanganannya, tetapi selulosa mengalami modifikasi fisik berupa penciutan (disebut juga hornifikasi) yang dapat menghambat sakarifikasi saat didehidrasi (Arantes dan Saddler, 2011; Zhu, 2011; Houghton et al. 2006).
Tabel 2.4. Berbagai Penelitian mengenai Bioetanol dari Eceng Gondok
Judul Penelitian Metodologi Hasil
Abdel-Fattah dan Abdel-Naby, 2012.** Pretreatment and enzymic saccharification of water hyacinth cellulose
- Praperlakuan: NaOH, alkalin H2O2, asam perasetat, NaClO2, kombinasi NaClO2 dengan NaOH, alkalin H2O2, atau asam perasetat.
- Hidrolisis: enzimatis dengan selulase
- Variasi: metode praperlakuan, penambahan gula dan etanol, penambahan selobiase, dan waktu sakarifikasi (hidrolisis)
Hasil terbaik dicapai dengan
kombinasi praperlakuan
NaClO2 selama 1 jam dan asam perasetat selama 15
menit pada 100 oC. Penambahan 8% glukosa ataupun 8% etanol menginhibisi enzim. Sedangkan penambahan selobiase meningkatkan konversi selulosa. Ahn et al. 2012. Optimization of pretreatment and saccharification for the production of bioethanol from water hyacinth by Saccharomyces cerevisiae
- Praperlakuan: dicuci, akar dibuang, dikeringkan, ditepungkan, kemudian diolah dalam larutan NaOH 1, 3, 5, 7, 10% w/v pada suhu 60 oC (24 jam) atau 100 oC (2 jam). Lalu didinginkan dan diolah dengan H2O2 0,1; 0,5; 1; 2; 3; dan 6% v/v selama 24 jam. - Hidrolisis: enzimatis dengan Cellulast 1.5 L and Viscozyme L dengan konsentrasi 1, 5, 10, 15, 20–25% v/v dan rasio 1:9, 3:7, 5:5, 7:3, dan 9:1 selama 112 jam.
- Mikroba fermentasi: Saccharomyces cerevisiae KCTC 7928 - Mode: SHF
- Variasi: konsentrasi NaOH, suhu dan waktu praperlakuan dengan NaOH, konsentrasi H2O2, konsentrasi enzim, rasio enzim, konsentrasi eceng gondok (mula-mula 2,5% dikonsentrasikan dengan faktor 2, 5, 7, 10 dan 15).
Konversi glukosa 71,42% dicapai untuk NaOH 7% pada 100 oC dan H2O2 2%. Rasio enzim terbaik 5:5 dan konsentrasi 1%. Konversi glukosa tertinggi untuk 25 g/l eceng gondok adalah 74%. Yield etanol tertinggi 0,35 g/g biomassa.
Tabel 2.4. Berbagai Penelitian mengenai Bioetanol dari Eceng Gondok (lanjutan)
Judul Penelitian Metodologi Hasil
Eshtiaghi et al. 2012. Preliminary study for
bioconversion of
water hyacinth
(Eichhornia
crassipes) to
bioethanol
- Praperlakuan: dibersihkan, dipotong-potong dan dikeringkan. Selanjutnya:
i. 10 g tepung dicampur ke 1, 3, 5, 7 dan 9% w/w larutan asam sulfat sampai 100 ml dan diautoklaf pada 121 oC selama 15 menit
ii. 10 g tepung dicampur ke 1, 2, 3, 4, dan 5% w/w larutan NaOH sampai 100 ml dan dipanaskan pada 85 oC selama 1 jam
iii. 2 g tepung dicampur ke 20 ml air dan dipanaskan pada 160 oC dan 200 oC selama 10 menit
- Hidrolisis: enzimatis dengan Crystalzyme 200 XL, Cellulast 1.5 L FG, Alcalase 2.5 L DX, Validase ANC-L dan Xylanase (rasio 1:1:1:1:1) dengan konsentrasi 0,8% w/w pada 55 oC selama 12 jam
- Mikroba fermentasi: Saccharomyces cerevisiae 0,2 g/ 50 ml sampel - Mode: SHF
- Variasi: metode praperlakuan, konsentrasi asam, konsentrasi alkali, suhu pemanasan air, konsentrasi enzim (0,8% w/w dan 4% w/w) dan lama fermentasi
Konversi gula optimum
mencapai 50,5% dengan
praperlakuan asam dan enzim dengan konsentrasi 4%. Yield etanol 1,5 % v/w mampu dicapai dalam 3 hari, lebih dari 3 hari hanya ada sedikit efek. Takagi et al. 2012. Efficient bioethanol production from water hyacinth Eichhornia crassipes by both preparation of the saccharified solution and selection of fermenting yeasts
- Praperlakuan: dicuci, dikeringkan, ditepungkan, kemudian 3, 6 atau 9 g tepung dicampur ke 100 ml asam sulfat 3% v/v dan diautoklaf pada 121 oC selama 1 jam. Hidrolisat kemudian dinetralkan dengan Ba(OH)2 sampai pH 4,5.
- Hidrolisis: enzimatis dengan selulase GC220 0 – 1000 IU pada 50 oC selama 24 jam, diikuti evaporasi vakum pada 70 oC untuk pengentalan.
- Mikroba fermentasi: (masing – masing) 0,1 g per 100 ml Saccharomyces cerevisiae NBRC10217
Saccharomyces cerevisiae sake yeast No.7
Saccharomyces cerevisiae brewers’ yeast BSRIYB23-3 Saccharomyces cerevisiae TY2
Pichia stipitis NBRC1689 - Mode: SHF
- Variasi: loading eceng gondok, konsentrasi selulase, dan jenis mikroba fermentasi
Kadar etanol setinggi 9,6 1,1 g/l berhasil dicapai untuk larutan terkonsentrasi.
Konsentrasi selulase
optimum 400 IU. Loading eceng gondok di atas 3 g
tidak memberi dampak
positif. Jenis mikroba yang memberikan hasil maksimum adalah S. cerevisiae TY2
Tabel 2.4. Berbagai Penelitian mengenai Bioetanol dari Eceng Gondok (lanjutan)
Judul Penelitian Metodologi Hasil
Guragain et al.
2011.*
Comparison of some
new pretreatment
methods for second generation bioethanol
production from
wheat straw and
water hyacinth
- Praperlakuan: crude glycerol (CG), ionic liquid (IL), dan dilute acid pretreatment (DAP)
- Hidrolisis: enzimatis dengan selulase dari T. reesei - Mikroba fermentasi: Saccharomyces cerevisiae - Mode: -
- Variasi: metode praperlakuan dan jenis substrat (eceng gondok dan wheat straw/jerami)
CG dan DAP lebih baik dari IL. Harun et al. 2011** Effect of physical pretreatment on dilute acid hydrolysis of water hyacinth (EICHHORNIA CRASSIPES)
- Praperlakuan: steaming (121 3 oC, 30 menit), boiling (100 3 oC, 30 menit), dan ultrasonication
- Hidrolisis: asam sulfat 5% pada suhu 121 3 oC, 60 menit
- Variasi: metode praperlakuan, besar daya ultrasonication, dan lama ultrasonication
Produksi gula tertinggi (155,13 mg gula/g massa kering) diperoleh dari sampel yang dilumatkan.
Kurniati et al.
2011.**
Modification of
surface structure and crystallinity of water hyacinth (Eichhornia crassipes) following recombinant α-L-arabinofuranosidase (abfa) treatment
- Praperlakuan: dipotong, dibersihkan, dikeringkan, dan ditepungkan.
- Hidrolisis: enzimatis dengan α-L-arabinofuranosidase dengan rasio enzim intraselular dan ekstraselular 1:10, 1:8, 1:4, 1:2, 1:1 pada 70 oC selama 1, 2, 4, 8, 12, dan 24 jam. - Variasi: perbandingan enzim intraselular (P) dan enzim ekstraselular (S) (analisa aktivitas), perbandingan enzim intraselular (P) dan enzim ekstraselular (S) (konsentrasi gula pereduksi), lama hidrolisis
Aktivitas enzim terbaik pada rasio P:S = 1:10 sampai 1:0.
Rasio P:S = 1:2
menghasilkan konsentrasi gula pereduksi terbesar. Waktu hidrolisis terbaik 8 jam.
Tabel 2.4. Berbagai Penelitian mengenai Bioetanol dari Eceng Gondok (lanjutan)
Judul Penelitian Metodologi Hasil
Merina dan
Trihadinigrum, 2011. Produksi bioetanol dari eceng gondok (Eichhornia
crassipes) dengan Zymomonas mobilis dan Saccharomyces cerevisiae
- Praperlakuan: dibersihkan, dikeringkan, dan ditepungkan. Selanjutnya:
i. 25 g tepung dicampur ke 420 ml asam sulfat 2% v/v disetir 7 jam diikuti netralisasi dan penambahan buffer
ii. pemanasan (121 oC, 30 menit) diikuti penambahan air dan buffer
- Hidrolisis: likuifikasi (A. niger) dan pemanasan diikuti (atau tanpa) sakarifikasi (S. cerevisiae) dan pemanasan
- Mikroba fermentasi: (masing-masing) Saccharomyces cerevisiae
Zymomonas mobilis - Mode: SSF
- Variasi: metode praperlakuan, seeding ratio likuifikasi (4/40 v/v dan 8/40 v/v), ada tidaknya sakarifikasi, dan jenis mikroba fermentasi.
Kadar etanol tertinggi 0,27% dicapai dengan pemanasan, likuifikasi dengan seeding ratio 8/40 v/v dan sakarifikasi diikuti fermentasi 3 hari oleh S. cerevisiae. Sari et al. 2011.** The Kinetic of Biodegradation Lignin in Water Hyacinth (Eichhornia Crassipes) by Phanerochaete Chrysosporium using Solid State Fermentation (SSF) Method for Bioethanol Production, Indonesia.
- Praperlakuan: dipotong, dikeringkan, ditepungkan, lalu 15 g tepung dicampur air dengan perbandingan 1:3 dan diautoklaf selama 20 menit pada 121 oC.
- Delignifikasi:
i. Dengan jamur akar putih (Phanerochaete chrysosporium) selama 8 minggu
ii. Dengan gabungan Pleurotus osterotus dan Phanerochaete chrysosporium selama 8 minggu
- Variasi: metode delignifikasi
Delignifikasi sampai 67,23% berhasil dicapai pada minggu
ke 8. Selulosa dan
hemiselulosa terurai 11,01% dan 36,57%.
Tabel 2.4. Berbagai Penelitian mengenai Bioetanol dari Eceng Gondok (lanjutan)
Judul Penelitian Metodologi Hasil
Satyanagalakshmi et al. 2011.
Bioethanol
production from acid
pretreated water
hyacinth by separate
hydrolysis and
fermentation.
- Praperlakuan: dibersihkan, dikeringkan, digiling dengan knife mill, kemudian 10 g biomassa dicampur ke: (i) HCl 2% v/v; (ii) H2SO4 2% v/v; (iii) asam asetat 30% v/v; (iv) asam formiat 30% v/v dan diautoklaf (121 oC, 1 jam) diikuti netralisasi dengan NaOH, pencucian dan pengeringan.
- Hidrolisis: enzimatis dengan selulase komersial Zytex - Mikroba fermentasi: Saccharomyces cerevisiae - Mode: SHF
- Variasi: konsentrasi asam (1-7% w/v), loading biomassa (5; 7,5; 10; 12,5; 15 dan 17,5% w/w), jenis surfaktan (Tween 80, Triton X-100, dan PEG), konsentrasi surfaktan (0,01; 0,02; 0,05; 0,1 dan 0,2), konsentrasi selulase (10, 30, 50, 70 FPU/g biomassa), suhu (80 o, 100 o & 121 oC), dan waktu inkubasi (15 – 90 menit)
Hasil terbaik (0,292% w/v etanol) untuk waktu inkubasi 24 jam, loading biomassa 12,5% w/w, surfaktan Triton X-100 0,1%, dan konsentrasi selulase 70 FPU. Kondisi
praperlakuan optimum
dicapai dengan 4% asam sulfat pada loading padatan 10% w/w pada suhu 121 oC selama 75 menit. Tanti et al. 2011. Fermentasi Hidrolisat Eceng Gondok Menjadi Bioetanol Menggunakan Pichia stipitis.
- Praperlakuan: pencucian, pengecilan ukuran, dan pengeringan pada 80 oC selama 24 jam, diikuti sterilisasi dengan autoklaf pada 121 oC selama 15 menit.
- Hidrolisis: termal pada 175 oC dan tekanan 8 – 10 bar (10 g eceng gondok per 200 ml aquades)
- Mikroba fermentasi: Pichia stipitis NRRL Y-7124 - Mode: SHF
- Variasi: suhu (25 dan 30 oC), dan laju pengadukan (75 dan 150 rpm)
Yield etanol tertinggi (58,356 ge/gs) diperoleh pada variasi suhu 25 oC dan pengadukan 75 rpm. Ma et al. 2010.* Combination of biological pretreatment with mild acid pretreatment for enzymatic hydrolysis and ethanol production from water hyacinth. - Praperlakuan:
i. Dengan asam sulfat 0,25% saja
ii. Dengan asam sulfat 0,25% dan jamur akar putih Echinodontium taxodii iii. Dengan asam sulfat 0,25% dan jamus akar coklat Antrodia sp. 5898 - Hidrolisis: enzimatis
- Mikroba fermentasi: Saccharomyces cerevisiae - Mode: SHF
- Variasi: metode praperlakuan, suhu praperlakuan dan lama praperlakuan
Yield etanol tertinggi 0,192 g/g massa kering dicapai untuk copraperlakuan asam sulfat dan E. taxodii selama 10 hari.
Tabel 2.4. Berbagai Penelitian mengenai Bioetanol dari Eceng Gondok (lanjutan)
Judul Penelitian Metodologi Hasil
Mukhopadhyah dan Chatterjee, 2010. Bioconversion of water hyacinths hydrolysate into ethanol
- Praperlakuan: 0,1 N H2SO4 dan 1% (w/v) NaOH kemudian dicuci, dikeringkan dan digiling
- Hidrolisis: enzimatis dengan selulase dari Trichoderma reesei ATCC 26921 dan -glukosidase dari Aspergillus phoenicis ATCC 52007
- Mikroba fermentasi: Saccharomyces cerevisiae MTCC 171 (tahap 1) diikuti Pachysolen tannophilus MTCC 1077 (tahap 2)
- Mode: SHF, SSF, SBB, PH-SSF - Variasi: mode proses
Yield etanol tertinggi 0,21 0,011 g/g substrat dicapai dengan mode PH-SSF. Sornvoraweat dan Kongkiattikajorn, 2010. Separated Hydrolysis and Fermentation of Water Hyacinth
Leaves for Ethanol Production
- Praperlakuan: dibersihkan, dikeringkan, digiling, kemudian 1,5 g bubuk diautoklaf dalam 100 ml asam sulfat 0,1 M selama 10 – 90 menit, suhu 120 – 135 oC.
- Hidrolisis: enzimatis dengan selulase, -amilase, xilanase, amiloglukosidasie, dan pektinase dalam 0,1 M Na3PO4, 48 jam, 50 oC.
- Mikroba fermentasi: (monokultur dan co-kultur) Saccharomyces cerevisiae TISTR 5048
Saccharomyces cerevisiae KM 1195 Saccharomyces cerevisiae KM 7253 Candida tropicalis TISTR 5045 - Mode: SHF
- Variasi: waktu praperlakuan, suhu praperlakuaan, dan jenis mikroba fermentasi
Yield 0,27 g/g biomassa dan utilisasi gula 0,51 dicapai pada suhu 30 0,2 oC dan pH 5,0 0,2 dengan ko-kultur S. cerevisiae TISTR 5048 dan C. tropicalis TISTR
5045. Kondisi optimum
praperlakuan dicapai pada 135 oC dan 30 menit, dan sakarifikasi 24 jam pada 50 o
C. Masami et al. 2008.
Ethanol production
from the water
hyacinth Eichhornia crassipes by yeast isolated from various hydrospheres
- Praperlakuan: dibersihkan, dikeringkan, lalu digiling
- Hidrolisis: 3 g bubuk ditambah ke 50 ml asam sulfat encer 0,5 – 4% v/v suhu 121 oC, waktu 0,5 – 1,5 jam kemudian dinetralkan dan disaring.
- Mikroba fermentasi:
Saccharomyces cerevisiae 484 dari Sungai Katsuragawa Saccharomyces cerevisiae K7 dan 11 strain lain
- Mode: SHF
- Variasi: konsentrasi asam sulfat, waktu hidrolisis
Hasil terbaik (1,77 0,4 g/l etanol) diperoleh untuk hidrolisis dengan asam sulfat encer 1% v/v suhu 121 oC dan waktu 1 jam.
Tabel 2.4. Berbagai Penelitian mengenai Bioetanol dari Eceng Gondok (lanjutan)
Judul Penelitian Metodologi Hasil
Mishima et al. 2008.* Ethanol production
from candidate
energy crops: Water hyacinth (Eichhornia crassipes) and water
lettuce (Pistia
stratiotes L.)
- Praperlakuan: - - Hidrolisis: -
- Mikroba fermentasi: (masing-masing) Saccharomyces cerevisiae NBRC 2346 Escherichia coli KO11 (strain rekombinan) - Mode: SHF, SSF
- Variasi: Jenis biomassa (eceng gondok dan water lettuce), jenis mikroba fermentasi, dan mode proses.
Hasil terbaik (16,9 g/l etanol) dicapai untuk substrat eceng gondok dengan proses SSF menggunakan E. coli KO11.
Isarankura-Na-Ayudhya et al. 2007. Appropriate
Technology for the
Bioconversion of Water Hyacinth (Eichhornia crassipes) to Liquid Ethanol: Future Prospects for Community Strengthening and Sustainable Development
- Praperlakuan: dibersihkan, dipotong-potong, dihancurkan, lalu dikeringkan
- Hidrolisis: 100 g tepung eceng gondok dicampur dengan 1% atau 10% H2SO4 sampai 1000 ml, lalu diautoklaf pada 121oC selama 15 menit. Kemudian didinginkan, disaring, dipanaskan ke 60 oC, ditambah NaOH dan Ca(OH)2 sampai pH 10, ditambah 10 g neopepton, pH disesuaikan ke 5,6, lalu ditambah air sampai 1000 ml.
- Mikroba fermentasi: Candida shehatae TISTR 5843 - Mode: SHF
- Variasi: jenis substart (sabouraud dextrose broth, sabouraud xylose broth, hidrolisat eceng gondok), dan konsentrasi asam sulfat
Yield etanol tertinggi 0,19 g/g atau 1,01 g/l pada konsentrasi asam sulfat 10%.
Walaupun kebanyakan polisakarida larut dalam air, selulosa tidak larut dalam air karena ikatan hidrogen intra dan intermolekuler (Kajiwara dan Miyamoto, 2005). Alomorf selulosa ada 4: selulosa I, selulosa II, selulosa III, dan selulosa IV. Dari alomorf ini, selulosa I lah yang paling banyak ditemukan di alam. Selulosa I sendiri tersusun oleh kombinasi fasa triklinik Idan fasa monoklinik I(Perez dan Mazeau, 2005). Polimerasi dan kristalinitas selulosa bervariasi dan mempengaruhi sifat hidrolitiknya (Lihat Gambar 2.6 dan 2.7).
Gambar 2.6. Kiri: Unit Penyusun Selulosa, Selobiosa; Kanan: Fasa Selulosa Monoklinik Idan Triklinik I(Perez dan Mazeau, 2005)
Supermolecular Architecture
Gambar 2.7. Ringkasan Informasi Struktural Selulosa (Kondo, 2005)
2.7.2. Hemiselulosa
Hemiselulosa merupakan heteropolisakarida yang tersusun dari molekul yang berbeda-beda seperti pentosa (xylosa & arabinosa), heksosa (Dmannosa,
D-I. OH: C-6-OH, C-2- and C-3-OH (Secondary)
II. Polarity (or Reactivity) in water: C-2-OH > C-6-OH > C-3-OH III. Inter- and intramolecular hydrogen bonds
↓
1. Crystal structure: I (Iα and Iβ), II, IIII, IIIII, IVI, IVII
Na-cellulose (alkali-cellulose)
2. Biosynthesis in plants and animals: cell wall cellulose formation 3. Solution properties: rigidity (or flexibility) and dimension of chains 4. Gel formation: sol ↔ gel transition (thermotropic hydrogels) 5. Liquid crystallinity: lyotropic and thermotropic liquid crystals 6. Degradability: enzymatic
7. Adsorption: water and vapor 8. Physical properties
9. Biomass: energy conversion into alcohol
10. Derivatization: etherification, esterification, dehydration, etc.
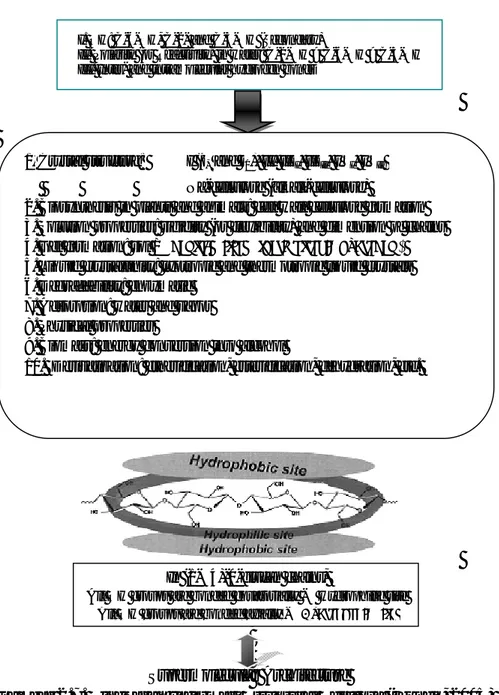
In (1→4)-β-glucan chains,
All OH groups are bonded equatorially → Hydrophilic site All OH groups are bonded axially → Hydrophobic site
glukosa, & D-galaktosa), fukosa, asam glukuronat, dan asam mannuronat dengan komponen utama xiloglukan atau xilan (Lihat Gambar 2.8). Polisakarida ini kurang stabil dibanding selulosa karena kurangnya kristalinitas dan derajat polimerisasi yang rendah. Dua gugus fungsional yang reseptif terhadap hidrolisis dalam hemiselulosa tumbuhan adalah ikatan ester dan asetal. Asam asetat dari ester yang terhidrolisis dalam hidrolisis asam mengakibatkan reaksi autohidrolisis. (Bobleter, 2005; Spiridon dan Popa, 2005). Meski kandungan hemiselulosa dalam eceng gondok sangat tinggi, penelitian yang memanfaatkan biopolimer ini masih sedikit.
Gambar 2.8. Representasi Struktur Hemiselulosa (Knill dan Kennedy, 2005)
2.7.3. Lignin
Berbeda dengan selulosa dan hemiselulosa yang merupakan polimer karbohi-drat, lignin merupakan polimer fenol (Gambar 2.9). Lignin bersifat hidrofobik dan keberadaannya dalam lignoselulosa merintangi hancurnya sel tanaman oleh jamur dan bakteri. Ada 3 monomer lignin (lignol) yang ini tergabung ke lignin dalam bentuk alkohol fenil propionat: p-hidroksifenil propanol / alkohol koumaril (H), guaiasil propanol / alkohol koniferil (G) dan alkohol siringil/sinapil (S). Saat ini,
α-D-Me-GlcpA Ac 1 Ac ↓ ↓ ↓ 3 3 2 →4)-β-D-Xylp-(1→4)-β-D-Xylp-(1→4)-β-D-Xylp-(1→4)-β-D-Xylp-(1→ hardwood xylan α-D-GalpA Ac 1 Ac ↓ ↓ ↓ 2 6 3 →4)-β-D-Glcp-(1→4)-β-D-Manp-(1→4)-β-D-Manp-(1→4)-β-D-Glcp-(1→ softwood glucomannan
organisme yang dianggap paling efektif dalam degradasi lignin adalah jamur akar putih (Kumar et al. 2009).
Beberapa literatur pernah melaporkan bahwa kandungan lignin suatu sampel sesudah praperlakuan lebih tinggi daripada kandungan lignin original sampel itu sendiri. Penyelidikan lebih lanjut menyarankan bahwa sejenis senyawa mirip lignin yang disebut pseudo-lignin telah terbentuk akibat praperlakuan tersebut (Hu et al. 2013).
Gambar 2.9. Representasi Struktur Lignin dan Lignols (Knill dan Kennedy, 2005; Chapple et al. 1998 dalam Houghton et al. 2006)
2.7.4. Struktur Mikrofibril Lignoselulosa
Secara alami, ketiga komponen utama dalam produksi bioetanol ini tidak berdiri sendiri, melainkan tergabung dalam satu matriks. Kristalin selulosa dan struktur morfus hemiselulosa saling mengisi dengan lignin yang terikat secara kovalen ke hemiselulosa. Akibat dari struktur ini, selulosa terisolasi oleh hemiselulosa dan lignin (Gambar 2.10).
Gambar 2.10. Matriks Selulosa – Hemiselulosa – Lignin (Somerville et al. 2004 dalam Houghton et al. 2006; Chandel et al. 2011a)
2.8. Mikroorganisme dalam Produksi Bioetanol
2.8.1. Trichoderma reesei
Trichoderma reesei merupakan jamur yang paling umum digunakan dalam produksi selulase. Jamur ini memproduksi berjenis-jenis enzim selulase dan hemiselulase. Jenis terbesar enzim selulase yang diproduksi adalah selobiohidrolase I. Produksi enzim-enzim sangat dipengaruhi media tumbuh jamur walaupun mekanisme induksi oleh selulosa masih menjadi misteri. Selulase biasanya diproduksi on-site dengan 3 – 5% bagian dari substrat yang sudah diolah (Olsson et al. 2005). Selain T. reesei, Trichoderma viride juga dapat menghasilkan selulase (Shuler dan Kargi, 1992).
2.8.2. Aspergillus niger
Aspergillus niger juga digunakan untuk memproduksi selulase namun berbeda dengan selulase dari T. reesei yang dapat mendegradasi kristalin selulosa, selulase dari A. niger tidak dapat mendegradasi kristalin selulosa. Akan tetapi, selulase dari A. Niger melengkapi jenis selulase yang diproduksi T. reesei. A. niger juga memproduksi pektinase dan hemiselulase (Shuler dan Kargi, 1992).
2.8.3. Saccharomyces cerevisiae
Saccharomyces cerevisiae merupakan organisme yang paling luas digunakan dalam fermentasi gula menjadi etanol. Ragi ini mampu memfermentasi semua gula heksosa dalam biomassa lignoselulosa dan menghasilkan yield etanol yang sangat dekat dengan yield teoritis (0,51 g etanol/ g glukosa), tetapi tidak mampu menggunakan gula pentosa (Olsson et al. 2005). S. cerevisiae menghasilkan etanol dalam keadaan anaerob pada suhu 30 – 35 oC dan pH 3 – 7 (Chandel et al. 2011a).
2.8.4. Candida utilis
Candida utilis merupakan ragi yang sudah diterima FDA sebagai additif makanan. Saat ini, ragi ini banyak digunakan untuk memproduksi senyawa industri penting seperti protein sel tunggal dan RNA. Walaupun mampu menghasilkan etanol, ragi ini lebih sering digunakan untuk produksi biomassa karena tidak menghasilkan etanol dalam jumlah banyak dan memiliki sistem represi etanol yang cukup kompleks (Tomita et al. 2012; Rosma dan Cheong, 2007). Dalam penelitian
ini, peran Candida utilis lebih menonjol untuk menghilangkan xilosa daripada menghasilkan etanol.
2.8.5. Jamur Akar Putih (White Rot Fungus)
Jamur akar putih telah banyak diteliti dan digunakan untuk menguraikan lignin. Penggunaan jamur ini meliputi dalam proses pulping, dan pretreatment biomassa lignoselulosa. Tergantung jenisnya, jamur akar putih dapat bersifat selective decay maupun nonselective decay. Jamur ini memproduksi ligninase, hemiselulase, dan selulase (Kubicek, 2013). Dalam penelitian ini, jamur akar putih yang digunakan adalah Ganoderma boninense.
2.9. Modifikasi Proses dalam Produksi Bioetanol
2.9.1. Ekstraksi dalam Produksi Bioetanol
Dalam sistem produksi bioetanol yang ada, etanol biasanya dipisahkan melalui destilasi, kemudian etanol dicampur ke gasolin. Teknik pemisahan yang lain adalah melalui ekstraksi. Melalui pemilihan solven yang tepat, etanol yang terekstrak tidak memerlukan teknik pemisahan tambahan.
Kriteria dalam pemilihan solven meliputi kestabilan kimiawi, solubilitas dalam umpan cair (koefisien partisi), pembentukan busa dan emulsi, ketidaklarutan fasa / selektivitas (faktor separasi) & kapasitas (koefisien distribusi), pemisahan solven dan produk yang mudah dan ekonomis, biokompatibilitas dengan organisme fermentasi, keamanan terhadap pekerja, resiko lingkungan karena emisi (volatilitas),
kemudahan menyingkirkan residual dan generasi limbah dalam mengekstrak etanol dari larutan fermentasi (Offeman et al. 2006; Kim et al. 1999; Muson dan King, 1984). Baird (1981) dan Victor (1985) menjabarkan penggunaan alkohol alifatik, propilen, allen, metil asetilen, dan atau metil allen dalam proses ekstraksi etanol, dan Turpin et al. (1992) menerapkan teknik ekstraksi etanol dari larutan glukosa dan ragi menggunakan alkilat dengan sistem daur-ulang dan ekstraksi eksternal.
Gambar 2.11. Ekstraksi Etanol dengan Minyak dan Turunannya. Senyawa C18:1: () minyak olive, metil oleat, alkohol oleil, () etil oleat dan butil oleat; Senyawa C18:1 – OH: ( ) minyak jarak, metil risinoleat, alkohol risinoleil, ( ) oil safflower, metil linoleat; senyawa C12:0: ( ) minyak kelapa, metil laurat, alkohol lauril (Offeman et al. 2006).
Dari pengujian berbagai jenis ektraktan yang ada diketahui bahwa asam karboksilat, alkohol, dan ester memiliki koefisien distribusi terbaik. Mencampur
solven dan penggunaan solven yang bercabang juga dapat meningkatkan faktor separasi (Muson dan King, 1984). Offeman et al. (2006, 2008, 2010) menguji berbagai jenis alkohol, alkohol turunan tumbuhan, ester dan asam karboksilat, dan menemukan bahwa alkohol, ester maupun asam karboksilat dengan jumlah karbon sama dengan atau kurang dari 12 bersifat racun/inhibisi, sedangkan jumlah karbon sama dengan atau lebih tinggi dari 14 (16 untuk asam karboksilat) tidak bersifat racun maupun inhibisi walaupun verifikasi lebih lanjut diperlukan. Percabangan-juga meningkatkan faktor separasi (). Dari berbagai minyak dan turunannya, metil ricinoleat memiliki KDE yang berlipat lebih tinggi dengan konsekuensi penurunan faktor separasi (Gambar 2.11).
Percobaan ekstraksi simultan etanol dengan asam oleat telah dilakukan sejalan dengan penerapan external-loop liquid-lift bioreactor. Peningkatan produksi bioetanol dilaporkan terjadi akibat modifikasi tersebut (Stang et al. 2001). Efisiensi ekstraksi berbagai alkohol dari air juga dapat ditingkatkan dengan penambahan garam. Berbagai literatur menunjukkan efek salting out berupa peningkatan zona separasi, koefisien distribusi dan selektivitas solven (Ghalami-Choobar et al. 2011; Palei, 2010). Efek penambahan garam terhadap fermentasi sendiri bervariasi tergantung jenis garam. S. cerevisiae dapat tumbuh dalam media berbasis glukosa dengan kadar sodium klorida 1,5 M. Maiorella et al. (1984) menemukan bahwa efek inhibisi berbagai garam menurun dengan urutan berikut: CaCl2, (NH4)2SO4 > NaCl, NH4Cl > KH2PO4 > MgCl2 > MgSO4 > KCl (Jonsson et al. 2013).
2.9.2. Co-Fermentasi Hemiselulosa
Co-fermentasi hemiselulosa diawali dengan menghidrolisis hemiselulosa menjadi komponen gulanya. Jenis gula yang dihasilkan dari hemiselulosa umumnya adalah pentosa dengan komponen utama xilosa. Kemudian, gula dikonversi ke alkohol. Ada beberapa strategi untuk fermentasi xilosa, di antaranya adalah penggunaan mikroorganisme pengguna gula pentosa seperti Pichia stipitis, Chandida shehatea, Fusarium oxysporum, dan lain-lain (Mukhopadhyay dan Chatterjee, 2010; Isarankura-Na-Ayudhya et al. 2007; Nigam, 2002), isomerisasi xilosa menjadi xilulosa dengan xilosa isomerase (Miller et al. 2012; Chandrakant dan Bisaria, 2000; Gong et al. 1981), maupun penggunaan mikroorganisme mutan atau rekombinan melalui rekayasa genetik (Lee et al. 2012; Brat et al. 2009; Madhavan et al. 2009; van Maris et al. 2007).
Dalam penelitian ini, co-fermentasi hemiselulosa dilakukan dengan menggunakan mikroorganisme Candida utilis, dimana hidrolisis hemiselulosa menggunakan hemiselulase yang dihasilkan dari Aspergillus niger dan Trichoderma reesei.
2.9.3. Sistem Fermentasi Non-Steril
Fermentasi non-steril dalam produksi bioetanol dipatenkan oleh Jan Larsen di tahun 2012. Dalam patennya, Larsen memanfaatkan inhibitor hasil pretreatment untuk mencegah perkembangan bakteri asam laktat. Kadar inhibitor dalam larutan
fermentasinya diatur dengan mengubah rasio substrat terhadap air, dan melalui pencucian substrat.
Dalam penelitian ini, inhibitor berasal dari praperlakuan dan hasil fermentasi karena penerapan proses daur ulang.
2.9.4. Daur Ulang dalam Produksi Bioetanol
Sistem daur ulang sudah banyak diteliti dalam produksi bioetanol berupa daur ulang sel, daur ulang solid, daur ulang distilat, dan daur ulang enzim. Daur ulang enzim dapat dilakukan dengan mendaur ulang padatan tak larut (Weiss et al. 2013), atau mendaur ulang sebagian larutan fermentasi (Xue et al. 2012). Pada proses yang menggunakan destilasi sebagai operasi pemisahan, daur ulang distilat dapat dilakukan (Gumienna et al. 2011).
Dalam penelitian ini, daur ulang yang dimaksud melibatkan seluruh larutan fermentasi. Hal ini dimungkinkan karena pemisahan akhir etanol menggunakan teknik ekstraksi dan impuritis sisa berupa etanol mendukung cara kerja fermentasi non-steril. Selain itu, co-fermentasi yang diterapkan dapat mencegah akumulasi gula pentosa dalam larutan fermentasi.