GONAD DAN OVULASI PADA IKAN SUMATRA Puntius tetrazona
RACHMAN SALEH
SKRIPSI
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN AKUAKULTUR DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
EFEKTIVITAS KOMBINASI AROMATASE INHIBITOR, ANTI-DOPAMIN DAN OVAPRIM DALAM MEMPERCEPAT PEMATANGAN GONAD DAN OVULASI PADA IKAN SUMATRA Puntius tetrazona
Adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal dari atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2009
RACHMAN SALEH C14104052
RACHMAN SALEH. Efektivitas Kombinasi Aromatase Inhibitor, Anti-Dopamin Dan Ovaprim Dalam Mempercepat Pematangan Gonad Dan Ovulasi Pada Ikan Sumatra Puntius tetrazona; dibimbing oleh AGUS OMAN SUDRAJAT dan HARTON ARFAH.
Jumlah penduduk yang terus meningkat membutuhkan bahan pangan yang semakin besar terutama kebutuhan pangan berupa sumber protein. Hal ini mendorong peningkatan produktifitas budidaya ikan sehingga dibutuhkan benih ikan dalam jumlah yang besar dan terus-menerus. Teknologi pemijahan buatan telah dikembangkan untuk memenuhi kebutuhan benih tersebut. Ovaprim merupakan premiks yang mengandung hormon Luteinizing Hormone Releasing Hormon Analogs (LHRH-a) dan anti dopamin serta telah digunakan secara luas dalam pemijahan buatan. Harga ovaprim yang mahal dan terus meningkat (barang impor) dan ketersediaan serta distribusinya yang belum merata menjadi kendala dalam penyediaan benih ikan sehingga dicari bahan lain yang mudah di dapat dan relatif lebih murah yang dapat meningkatkan efisiensi penggunaan ovaprim. Dengan demikian ketergantungan akan ovaprim dapat dikurangi. Aromatase inhibitor (AI) telah diketahui dapat mempercepat pematangan gonad. Penggunaan AI diharapkan dapat mengurangi ketergantungan pada ovaprim. Anti dopamin adalah bahan kimia yang yang mampu memblok kerja dopamin pada gonad sehingga dapat mempercepat pematangan gonad.
Penelitian ini bertujuan untuk melihat efektivitas kombinasi aromatase inhibitor, anti-dopamin dan ovaprim dalam mempercepat pematangan gonad dan ovulasi pada ikan sumatra Puntius tetrazona. Penelitian ini terdiri dari tiga perlakuan : Spawnprime B.I (50% Ovaprim; 25% AI; 25% AD), Spawnprime B.II (25% Ovaprim; 50% AI; 25% AD), dan Spawnprime B.III (25% Ovaprim; 25% AI; 50% AD) serta tiga kontrol (tanpa kombinasi) (Ovaprim, Aromatase Inhibitor (AI) 100 ppm dan Anti-dopamin 10 mg/ml).
Ikan yang digunakan adalah ikan sumatra dengan panjang 2 -5 cm dan sudah matang gonad. Induk betina disuntik secara intra muscular dengan dosis 0,5
(stripping) selang waktu 3 jam untuk pengecekan ovulasi. Parameter yang diamati adalah tingkat keberhasilan pemijahan, lama waktu ovulasi, tingkat ovulasi dan diameter telur.
Hasil penelitian menunjukkan bahwa tingkat keberhasilan memijah pada spawnprime B.I, B.II, B.III serta kontrol ovaprim dan AI yaitu sebesar 100 % sedangkan pada kontrol AD tidak ada yang memijah. Lama waktu ovulasi perlakuan Spawnprime B rata-rata lebih lama 4 - 6 jam lebih lama dari kontrol ovaprim (p<0,05). Sedangkan tingkat ovulasi berkisar antara 17,28 % - 26,82 % serta tidak berbeda nyata antar pelakuan dan kontrol (p<0,05). Diameter telur tidak berbeda nyata antar perlakuan dan kontrol yaitu berkisar antara 1,03 ± 0,08 mm – 1,15 ± 0,03 mm (p<0,05). Telur yang diovulasikan oleh induk yaitu berkisar antara 510 - 791 butir, hal ini disebabkan adanya perbedaan bobot induk sumatra betina. Dari persamaan y = 131,14x + 184,07 dengan R2 = 0,2407 menunjukan bahwa semakin besar bobot tubuh ikan sumatra maka telur yang diovulasikan akan semakin besar pula.
Kombinasi Aromatase Inhibitor dan anti-dopamin berperan dalam mempercepat pemetangan gonad ikan. Kombinasi tersebut dapat mensubtitusi ovaprim sehingga penggunaan ovaprim menjadi lebih sedikit atau efisien. Aromatase Inhibitor dapat mempercepat pematangan gonad dan ovulasi pada ikan sumatra Puntius tetrazona. Spawnprime B dapat dijadikan sebagai salah satu premiks domestik selain ovaprim untuk pemijahan buatan.
GONAD DAN OVULASI PADA IKAN SUMATRA Puntius tetrazona
RACHMAN SALEH
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan Pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN AKUAKULTUR DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
dan Ovaprim dalam Mempercepat Pematangan Gonad Dan Ovulasi Pada Ikan Sumatra Puntius tetrazona
Nama Mahasiswa : Rachman Saleh Nomor Pokok : C14104052
Disetujui, Komisi Pembimbing
Pembimbing I Pembimbing II
Dr. Ir. Agus Oman Sudrajat, M. Sc Ir. Harton Arfah, M.Si NIP: 19640813 199203 1001 NIP: 19661111 199103 1003
Diketahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP: 19610410 198601 1002
KATA PENGANTAR
Segala puji syukur bagi Allah SWT yang telah memberikan rahmat-Nya sehingga penyusunan skripsi yang berjudul ” Efektivitas Kombinasi Aromatase Inhibitor, Anti-dopamin dan Ovaprim dalam Mempercepat Pematangan Gonad Dan Ovulasi Pada Ikan Sumatra Puntius tetrazona” dapat diselesaikan. Skripsi ini adalah hasil penelitian yang dilaksanakan pada bulan Oktober 2008 sampai bulan Mei 2009 di Kolam Percobaan Babakan, laboratorium Pengembangbiakan Dan Genetika Biota Akuatik dan Laboratorium MST (Marine and Science Technology), Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada kedua orang tua yang dengan sabar dan ikhlas membimbing hingga penelitian ini selesai, juga kepada Dr. Agus Oman Sudrajat dan Harton Arfah, M. Si sebagai dosen pembimbing skripsi serta Prof. Dr. Enang Harris sebagai dosen penguji tamu. Ucapan terima kasih juga penulis sampaikan kepada Prof. Dr. Komar Sumantadinata selaku penanggung jawab Kolam Percobaan Babakan yang telah memberikan izin pamakaian tempat dan fasilitas pada penelitian ini, Pak Wawan sebagai teknisi kolam babakan yang telah banyak membantu pada penelitian ini serta rekan-rekan BDP 41 atas dukungannya.
Penulis Berharap semoga skripsi ini bermanfaat.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bogor 8 April 1986, adalah anak ke-4 dari empat bersaudara dari ayah Rumekso dan ibu Yayan Sutriani.
Pendidikan formal yang dilalui penulis adalah lulus SMU Negeri 1 Bogor pada tahun 2004.
Selama perkuliahan, penulis aktif sebagai asisten dosen pada mata kuliah Dasar-dasar Akuakultur (S1), Fisiologi Reproduksi Ikan (D3), Dasar-dasar Genetika Ikan (S1) dan Pengembangbiakan Ikan (D3). Penulis juga masuk pada kepanitiaan kegiatan ”Temu Angkatan Mahasiswa Baru Akuakultur” tahun 2005.
Penulis Pernah melakukan praktek lapang Pembenihan Ikan Patin Siam Pangasius hypophthalmus di Loka Riset Pemuliaan dan Teknologi Budidaya Perrikanan Air Tawar Sukamandi dan Pembesaran Ikan Mas Cyprinus carpio di Keramba Jaring Apung Jangari Perdana Cirata, Jawa Barat.
Untuk Menyelesaikan studi di Fakultas Perikanan dan Ilmu Kelautan, penulis melakukan penelitian dengan judul ” Efektivitas Kombinasi Aromatase Inhibitor, Anti-dopamin dan Ovaprim dalam Mempercepat Pematangan Gonad Dan Ovulasi Pada Ikan Sumatra Puntius tetrazona”.
DAFTAR ISI
Halaman
KATA PENGANTAR ...i
RIWAYAT HIDUP ...ii
DAFTAR ISI ...iii
DAFTAR GAMBAR ...v
DAFTAR TABEL ...vi
DAFTAR LAMPIRAN ...vii
I. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
II. TINJAUAN PUSTAKA 2.1Ikan Sumatra Puntius tetrazona ... 3
2.2Proses Perkembangan Gonad ... 4
2.3Penggunaan Hormon dalam Pemijahan Ikan ... 5
2.4Ovaprim ... 6
2.5Aromatase Inhibitor ... 7
III. METODOLOGI 3.1Waktu dan Tempat ... 8
3.2Alat dan Bahan ... 8
3.3Prosedur penelitian ... 8
3.3.1 Instalasi dan persiapan wadah ... 8
3.3.2 Pengadaptasian dan pemeliharaan induk ... 9
3.3.3 Pembuatan spawnprime B ... 9
3.3.4 Seleksi induk ikan Sumatra ... 10
3.3.5 Persiapan perlakuan ... 10
3.3.6 Perlakuan kombinasi campuran tiga bahan (Aromatase inibitor, anti-dopamin, dan ovaprim) ... 11
3.4 Parameter yang diamati ... 12
IV. HASIL DAN PEMBAHASAN
4.1 Hasil ... 15
4.2 Pembahasan ... 19
V. KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 24
5.2 Saran ... 24
DAFTAR PUSTAKA ... 25
DAFTAR GAMBAR
Halaman
1. Ikan sumatra Puntius tetrazona ... 3
2. Skema proses perkembangan oosit ... 5
3. Grafik keberhasilan pemijahan ikan sumatra Puntiustetrazona ... 15
4. Grafik lama waktu ovulasi ikan sumatra Puntius tetrazona ... 16
5. Grafik telur diovulasikan pada ikan sumatra Puntius tetrazona ... 16
6. Grafik tingkat ovulasi (Ovulation Rate [OR]) ... 17
7. Grafik diameter telur ikan sumatra Puntius tetrazona ... 17
8. Grafik lama menetas telur ikan sumatra Puntius tetrazona ... 18
DAFTAR TABEL
Halaman 1. Tingkat keberhasilan ovulasi dan lama waktu ovulasi Ikan sumatra Puntius
tetrazona pada temperatur 27 °C ... 15 2. Parameter tambahan (FR, HR, dan SR) pada pemijahan buatan ikan sumatra
DAFTAR LAMPIRAN
Halaman
1. Formulasi bahan dan analisis biaya Spawnprime B ... 27
2. Data perlakuan ... 28
3. Parameter uji pada ikan sumatra Puntius tetrazona ... 29
4. Lama waktu ovulasi ikan sumatra Puntius tetrazona ... 30
5. Kualitas air ... 30
6. Parameter tambahan pada ikan sumatra Puntius tetrazona ... 30
7. Prosedur penelitian ... 32
I. PENDAHULUAN 1.1 Latar Belakang
Jumlah penduduk yang terus meningkat dan terjadi sangat cepat membutuhkan bahan pangan yang semakin besar baik di negara maju maupun di negara berkembang terutama kebutuhan pangan berupa sumber protein yang berasal dari ikan. Kecenderungan adanya perubahan dan perilaku dan gaya hidup serta pola konsumsi pangan dari daging merah (red meat) ke produk perikanan (DKP, 2005) mendorong peningkatan produktifitas kegiatan budidaya yang diikuti dengan penyediaan benih dalam jumlah yang besar dan terus-menerus. Hal ini dapat dilihat dari target produksi lele dan patin tahun 2009 masing-masing sebesar 250.000 ton dan 75.000 ton dengan kenaikan produksi perikanan sebesar 20 % / th (DJPB, 2009) serta sasaran kebutuhan benih lele dan patin tahun 2009 masing-masing sebesar 1.948.240.000 ekor dan 121.670.000 ekor (DKP, 2005). Demikian pula pada ikan hias, ekspor ikan hias indonesia pada tahun 2007 mencapai 1.589 ton (DJPB, 2009). Oleh karena itu diperlukan teknologi untuk mempercepat pematangan gonad dan ovulasi agar induk dapat cepat memijah yaitu teknologi pemijahan buatan dengan pemberian rangsangan hormon pada fase kematangan gonad tertentu. Menurut Nurman (1998) dalam Prasetya (2002), untuk meningkatkan jumlah dan mutu benih, selain pemijahan alami dapat pula dilakukan pemijahan buatan dan didahului dengan rangsanagan hormonal sehingga kebutuhan dan ketersediaan benih ikan dalam meningkatkan produksi budidaya dapat terpenuhi.
Pemijahan buatan (induced breeding) menggunakan ovaprim dalam mempercepat proses pemijahan ikan. Ovaprim adalah produk hormon campuran yang diproduksi oleh Syndell Laboratories, Kanada yang mengandung hormon analog yang terdiri atas LHRH (Luteinizing Hormone Releasing Hormon) yang mampu merangsang hipofisa untuk mensekresikan GTH II (Gonadotropin Hormone) yang merangsang pematangan akhir (Final maturation) gonad dan mengandung anti-dopamin untuk melancarkan produksi GnRH dari penghambatan senyawa dopamin. Penyuntikan ovaprim dosis tertentu mampu merangsang pemijahan pemijahan induk ikan. Namun di sisi lain terjadi ketergantungan penggunaan ovaprim pada proses pemijahan dalam upaya penyediaan benih ikan.
Kondisi ini dikhawatirkan karena bila ketersediaan ovaprim berkurang atau bahkan berhenti maka kegiatan pembenihan pun akan terhambat. Harga ovaprim yang semakin mahal (mencapai Rp. 220.000,00/10 ml) membuat biaya produksi benih semakin tinggi sehingga tidak semua pembudidaya mampu membelinya. Ketersediannya yang masih impor menyebabkan distribusinya tidak merata sehingga tidak semua pembudidaya dapat memperolehnya. Dari hal tersebut perlu dicari bahan lain yang mudah di dapat dan relatif lebih murah yang dapat meningkatkan efisiensi penggunaan ovaprim sehingga ketergantungan akan ovaprim dapat dikurangi.
Dewasa ini untuk memacu proses pematangan akhir gonad dan ovulasi dapat dilakukan dengan rekayasa hormonal melalui pemberian aromatase inhibitor yang mampu menghambat kerja enzim aromatase dalam mensintesis estradiol-17β sehingga menghentikan proses vitelogenesis (proses penumpukan kuning telur). Terhentinya proses vitelogenesis akibat pemberian aromatase inhibitor merupakan sinyal balik untuk dimulainya proses pematangan telur. Proses pematangan akhir dan ovulasi pada ikan salmon dengan pemberian aromatase inhibitor telah berhasil dilakukan oleh Afonso (1999 a, b).
Pada penelitian ini digunakan ikan sumatra sebagai ikan model karena ikan sumatra merupakan salah satu ikan hias ekspor dan cukup representatif untuk ikan-ikan konsumsi.
Penggunaan ovaprim dengan proporsi yang lebih kecil dengan substitusi aromatase inhibitor dan anti-dopamin diharapkan dapat memacu proses pematangan akhir dan ovulasi pada induk ikan sehingga penggunaan ovaprim dapat lebih efektif, efisien dan ekonomis.
1.2 Tujuan
Penelitian ini bertujuan untuk melihat efektivitas kombinasi ovaprim, aromatase inhibitor, dan anti-dopamin dalam mempercepat pematangan gonad dan ovulasi pada ikan sumatra Puntius tetrazona.
II. TINJAUAN PUSTAKA 2.1 Ikan Sumatra Puntius tetrazona
Gambar 1. Ikan Sumatra Puntius tetrazona
Ikan Sumatra Puntius tetrazona adalah spesies ikan air tawar tropis yang penyebarannya secara geografis meliputi Malaysia, Sumatra dan Kalimantan. Ikan Sumata dapat tumbuh mencapai panjang 7 cm dengan lebar badan 3 cm namun ukurannya lebih kecil bila dipelihara di suatu wadah pemeliharaan. Ikan Sumatra sering dijumpai pada air yang bening atau agak keruh dengan arus air yang sedang. Ikan ini hidup pada iklim tropis dan menyukai air dengan pH berkisar antara 6,0 – 8,0, kesadahan air berkisar antara 5 – 19 dGH dengan kisaran suhu 20 – 25 o
C. Ikan ini sering terlihat berenang di danau dengan perubahan tinggi air yang besar sehingga memiliki kisaran toleransi yang lebar terhadap fluktuasi kualitas air (Wikipedia, 2008).
Ikan Sumatra aktif berenang secara bergerombol dan biasanya berkelompok dalam 5 ekor atau lebih dan berenang di kolom air (middle level). Ikan ini bersifat omnivora. Ikan Sumatra biasanya mengalami kematangan seksual ketika mencapai panjang tubuh 2 – 3 cm atau setelah berumur 6 – 7 minggu. Induk betina berukuran lebih besar dengan perut membulat sedangkan jantan berwarna lebih cerah, hidung merah dengan garis merah di atas warna hitam pada sirip dorsalnya (Wikipedia, 2008). Ikan Sumatra dapat memijah dengan jumlah telur yang dihasilkan sebanyak 500 butir/ekor betina (Scheurmann 1990; Axelrod 1992), jumlah telur yang dihasilkan akan meningkat berdasarkan tingkat kematangan dan ukuran ikan. Telur yang dipijahkan bersifat adhesive (menempel) dengan rata-rata diameter telur 1.18 ± 0.05 mm. Menurut Novianto (2004), derajat pembuahan, derajat penetasan dan tingkat kelangsungan hidup larva ikan sumatra
berturut-turut dapat mencapai 97,82 %, 94,65 %, dan 97,5 %. Tingginya derajat pembuahan selalu diikuti oleh daya tetas telur yang baik, kecuali kalau ada faktor lingkungan yang mempengaruhinya (Oyen et al., 1991; Poxton, 1991; Sayer et al., 1991; Suseno , 1983; dan Wardani, 1996). Menurut Novianto (2004), telur ikan sumatra yang telah dibuahi dan diinkubasi pada suhu 29 oC akan menetas setelah 18 – 24 jam sejak pencampuran antara telur dengan sperma. Bila pemeliharaannya baik maka induk betina dapat memijah selang dua minggu kemudian (Munro et al. 1990).
2.2 Proses Perkembangan Gonad
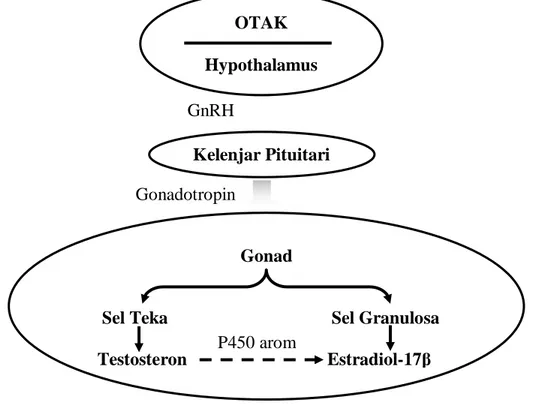
Menurut Swanson (2008) reproduksi pada ikan, seperti pada vertebrata tingkat tinggi diatur oleh sistem endokrin reproduksi yang terdiri dari otak (hypothalamus), kelenjar pituitari dan gonad. Kelenjar pituitari berperan dalam menginisiasi pematangan reproduksi (puberty), pemeliharaan reproduksi sperma dan telur pada gonad,merangsang pematangan akhir dan pengeluaran gamet (spawning).
Hormon memegang peran yang sangat kritis dalam proses reproduksi. Hormon adalah penyampai bahan kimia yang disekresikan ke dalam darah oleh organ tertentu seperti kelenjar pituitari (Mittelmark, 2008). Pada ikan, gonadothropin adalah hormon pituitari utama yang bertanggung jawab mengatur pematangan seksual dan perkembangan gamet (Swanson, 2008). Secara morfologi tingkat kematangan gonad (TKG) diartikan perubahan bentuk, ukuran panjang dan berat, warna, diameter telur dan perkembangan isi gonad yang merupakan suatu tahap tertentu dari perkembangan gonad sebelum dan sesudah ikan memijah.
Gonadothropin yang disekresikan ke dalam darah akan masuk ke sel teka menstimulir terbentuknya testosteron kemudian testosteron masuk ke dalam sel granulosa dan diubah oleh enzim aromatase menjadi estradiol-17β. Hormon estradiol-17 β kemudian masuk ke hati melalui peredaran darah dan merangsang hati untuk mensintesis vitelogenin lalu dialirkan lewat peredaran darah menuju gonad untuk diserap oleh oosit diikuti dengan perkembangan diameter telur. Menurut Effendi (1979) kematangan seksual pada ikan dicirikan oleh
perkembangan diameter rata-rata telur dan distribusi penyebaran ukuran telur. Setelah mencapai ukuran maksimum, perkembangan akan terhenti dan oosit akan memasuki fase dorman (Woynarovich dan Hovarth, 1980).
Gambar 2. Skema proses perkembangan oosit (Nagahama et al.,1995)
2.3 Penggunaan Hormon dalam Pemijahan Ikan
Menurut Rottmann et al., (1991), reproduksi pada ikan diatur oleh mekanisme internal yaitu ikan dan eksternal yaitu faktor-faktor lingkungan. Faktor-faktor lingkungan memicu mekanisme internal untuk bekerja. Mekanisme internal yang mengontrol proses reproduksi pada ikan adalah rantai otak, hypothalamus, pituitari dan gonad. Hormon dalam teknologi pemijahan buatan mempengaruhi rangakaian mekanisme pada beberapa tingkatan dengan mempercepat dan menghambat suatu proses. Bahan utama yang digunakan dalam pemijahan buatan antara lain :
1. Ekstrak pituitari dan Gonadotropin murni untuk merangsang ovarium dan testes
2. LHRH Analogs (LHRHa) tunggal atau dikombinasikan dengan Anti-dopamin yang meningkatkan potensi LHRH untuk merangsang pituitari.
GnRH Gonadotropin OTAK Hypothalamus Kelenjar Pituitari Gonad
Sel Teka Sel Granulosa
Testosteron Estradiol-17β
3. Steroid untuk merangsang sel gamet secara langsung.
Menurut Chakroff (1976) pemijahan buatan diartikan sebagai upaya untuk membuat ikan menghasilkan telur dan sperma ketika mereka tidak dapat melakukannya sacara alami. Pemijahan buatan dilakukan ketika kondisi kolam tidak dapat membuat mendukung terjadinya pemijahan alami atau ketika ikan tidak siap memijah ketika pembudidaya menginginkannya untuk memijah.
2.4 Ovaprim
Ovaprim adalah merk dagang dari hormon yang mengandung 20 μg analog salmon gonadotropin hormon (sGnRH-a) (D arg, Trp, Leu, Pro Net), LHRH dan 10 mg domperidon sejenis anti-dopamin, per mililiter (Nandesha et al, 1990).
Anti-dopamin adalah bahan kimia yang dapat menghentikan kerja dopamin sedangkan dopamin adalah bahan kimia yang menghambat pelepasan hormon dari pituitari dan juga menghambat pituitari dalam merespon penyuntikan LHRHa. Anti dopamin yang terkandung dalam ovaprim berfungsi untuk memblok dopamin sehingga menstomilasi sekresi gonadotropin (Harker, 1992 dalam Prasetya,2002).
Ovaprim terdiri dari sGnRH. sGnRH umum terdapat pada sebagian besar ikan bertulang keras sehingga bisa digunakan untuk ikan salmon, catfish, dll.
Ovaprim memiliki fungsi antara lain (Anonimous, 2009) : 1. Menekan musim pemijahan
2. Mengatur kematangan gonad selama musim pemijahan normal
3. Merangsang produksi sperma pada jantan untuk periode waktu yang lama dan volume yang lebih banyak
4. Lebih aman dengan hasil yang dapat diprediksi
5. Merangsang pematangan gonad sebelum musim pemijahan normal 6. Memaksimalkan potensi reproduksi
7. Mempertahankan materi genetik pada beberapa ikan yang terancam punah 8. Mempersingkat periode pemijahan
2.5 Aromatase Inhibitor
Enzim aromatase yang ada pada otak ikan maupun gonad berfungsi mengkonversi hormon androgen menjadi esterogen. Adapun aromatase inhibitor adalah bahan kimia yang mampu menghambat atau menghentikan kerja enzim aromatase sehingga menghambat produksi hormon esterogen yang ada di otak maupun gonad (Sumantri, 2006).
Penyuntikan aromatase inhibitor diharapkan mampu menghambat kerja enzim aromatase dalam mengubah testosteron menjadi estradiol-17β pada lapisan sel granulosa. Hal ini menyebabkan konsentrasi hormon estradiol-17β dalam darah menurun sehingga menghambat hati untuk mensintesis vitelogenin maka proses viteligenesis terhenti. Hal ini merupakan sinyal balik bagi hipofisa untuk memproduksi GTH II yang berperan dalam proses pematangan akhir (final maturation).
Afonso et al. (1999) mengatakan bahwa pemberian AI sebesar 10 mg/kg pada induk coho salmon siap pijah menghasilkan waktu ovulasi pada hari ke-10 yaitu sebesar 67% dengan fertilitas 85%.
Kestemont (1988) dalam Novianto (2004) menyatakan bahwa kombinasi antara LHRH-a dan pimodize dapat menyebabkan tingginya GtH yang disekresikan dan keberadaannya dalam plasma darah lebih lama.
III. METODOLOGI 3.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Oktober 2008 sampai bulan Mei 2009 bertempat di Kolam Percobaan Babakan, Laboratorium Pengembangbiakan Dan Genetika Biota Akuatik dan Laboratorium MST (Marine and Science Technology), Fakultas Perikanan Dan Ilmu Kelautan, Departemen Budidaya Perairan, Program Studi Teknologi Dan Manajeman Akuakultur, Institut Pertanian Bogor.
3.2 Alat dan Bahan
Alat yang digunakan pada pemeliharaan induk dan perlakuan terdiri dari 3 buah bak beton berdimensi (1 x 1 x 0,6) m, 4 buah akuarium berdimensi (0,5 x 0,5 x 0,4) m, 30 akuarium berdimensi (0,2 x 0,15 x 0,15) m, instalasi aerasi, selang sifon, pompa air,ember, baskom, serokan ikan, shelter batu bata dan tanaman air), freezer, filter sederhana, timbangan digital, kalkulator, alat tulis, 6 buah syringe 0,5 ml, 30 buah botol film, lempeng plastik, mikroskop, gelas objek, dan pipet. Pada pembuatan larutan Spawnprime B digunakan alat-alat seperti timbangan digital, homogenizer, vortex, gelas ukur, gelas piala, micropipet, tip, centrifuse, eppendorf, stirer, 6 buah botol gelap, senter, dan refrigerator.
Bahan yang digunakan dalam penelitian ini adalah induk ikan sumatra dengan panjang 2-5 cm, pakan ikan (pelet apung dan bloodworm beku), NaCl, Aromatase inhibitor (AI), Anti-dopamin (domperidon), akuades, dan MS-222.
3.3 Prosedur Penelitian
3.3.1 Instalasi dan persiapan wadah
Tahap pertama adalah penyusunan tata letak akuarium serta sistem aerasi untuk penampungan air, pemeliharaan induk dan wadah perlakuan.
Wadah penampungan air dan pemeliharaan induk berupa akuarium sebanyak 4 buah berukuran (0,6 x 0,4 x 0,5) m dan bak beton sebanyak 3 buah berukuran (1 x 1 x 0,8) m dicuci hingga lumut dan kotoran yang menempel bersih kemudian dikeringkan selama satu hari lalu diisi air hingga tinggi 0,8 m. Setelah itu diberi aerasi kuat dan filter untuk menyaring endapan lumpur, karat dan debu
yang berasal dari udara. Pada wadah pemeliharaan induk diberikan Shelter berupa bata berlubang dan tanaman air Ki Ambang (Pistia sp).
Wadah perlakuan terdiri dari akuarium sebangak 30 buah berukuran (0,2 x 0,2 x 0,15) m dicuci hingga bersih, dikeringkan lalu ditutup dengan menggunakan plastik mulsa. Pengisian air, pemasangan aerasi dan pemberian shelter berupa tanaman air Ki Ambang (Pistia sp) dilakukan sesaat sebelum perlakuan. Letak wadah perlakuan dikondisikan gelap untuk mencegah stess dan ikan loncat ke luar akuarium saat perlakuan dan inkubasi induk.
3.3.2 Pengadaptasian dan pemeliharaan induk
Induk ikan Sumatra Puntius tetrazona berasal dari pembudidaya ikan sumatra di desa Cibuntu, Ciampea – Bogor. Jumlah induk sebanyak 300 ekor yang terdiri dari 200 ekor betina dan 100 ekor jantan berukuran 2-2,5 cm dipelihara secara terpisah pada wadah yang berbeda antara jantan dan betina. Pemisahan induk jantan dan betina berdasarkan ciri kelamin sekunder yaitu dari bentuk (dimorfisme) dan warna tubuh (dikromatisme) ikan.
Pemberian pakan awal berupa pelet apung berdiameter 2 mm. Selanjutnya dikombinasikan dengan bloodworm beku lalu bloodworm beku total untuk mempercepat pematangan gonad. Frekuensi pemberian pakan dilakukan sebanyak 3 kali sehari secara ad satiation (sekenyangnya).
Penyiponan dan penggantian air dilakukan 1–2 kali sehari tergantung dari jumlah feces yang diekskresikan. Volume air yang diganti sebanyak 30 – 50 % dari volume total. Pengamatan terhadap kesehatan dan perkembangan induk dilakukan setiap kali pemberian pakan.
3.3.3 Pembuatan larutan Spawnprime B
Larutan Spawnprime B terdiri dari ovaprim yang telah dilakukan pengenceran sebanyak 20 kali dengan dosis 0,01ml/g bobot tubuh, Aromatase Inhibitor (AI) 100 ppm yang telah dilarutkan dalam NaCl 0,9% dan Anti-dopamin 10 mg/ml yang telah dilarutkan dalam NaCl 0,9%. Larutan Anti-dopamin berasal dari tablet yang mengandung 10 mg domperidon/tablet kemudian dilarutkan dalam NaCl lalu dihomogenkan dengan menggunakan homegenizer dan di-stirer
over night (semalaman). Setelah itu larutan tersebut disentrifuse dengan kecepatan 5000 rpm untuk memisahkan carier dengan bahan aktif Anti-dopamin yang terlarut. Setelah disentrifuse maka akan terbentuk pellet dan supernatan, supernatan diambil menggunakan micropipet 20-1000 µl dengan tip. Pembuatan Spawnprime B sebanyak 3 buah dan 3 buah kontrol sesuai dengan rancangan perlakuan. Perlakuan terdiri dari perlakuan : Spawnprime B.I (50% Ovaprim; 25% AI; 25% AD), Spawnprime B.II (25% Ovaprim; 50% AI; 25% AD), dan Spawnprime B.III (25% Ovaprim; 25% AI; 50% AD). Kontrol (tidak dilakukan kombinasi) terdiri dari Ovaprim, Aromatase Inhibitor (AI) 100 ppm dan Anti-dopamin 10 mg/ml. Larutan Spawnprime B dan kontrol disimpan dalam botol gelap dan kedap kemudian ditaruh dalam refrigerator.
3.3.4 Seleksi induk ikan Sumatra
Setelah induk terlihat siap untuk dipijahkan yakni terlihat dari warna tubuh yang relatif lebih pucat dan bentuk perut induk betina yang menggembung mulai dari pangkal sirip pektoral hingga urogenital maka dilakukan seleksi induk matang gonad. Pengamatan induk matang gonad meliputi warna dan bentuk perut yang menggembung berisi telur kemudian di daerah urogenital terdapat zona transparan sehingga terlihat beberapa butir telur berwarna putih kekuningan yang mengindikasikan bahwa induk siap dipijahkan serta dilakukan stripping untuk mengecek kemungkinan telur sudah mengalami ovulasi. Induk yang siap dipijahkan relatif tidak agresif bela dibandingkan dengan induk yang belum siap dipijahkan. Induk yang telah diseleksi dipisahkan pada akuarium lain yang telah disiapkan dan dipelihara seperti biasa sedangkan sisanya dikembalikan ke akuarium pemeliharaan induk. Induk dipuasakan (diberok) sehari sebelum perlakuan untuk mengecek kemungkinan menggembungnya perut bukan disebabkan berisi telur melainkan feces serta untuk membuang feces yang masih berada dalam saluran pencernaan.
3.3.5 Persiapan perlakuan
Persiapan perlakuan meliputi pengisian air pada akuarium perlakuan dan inkubasi induk, pemasangan sistem aerasi, pemberian shelter berupa tanaman air
Ki Ambang (Pistia sp) secukupnya serta pengecekan seluruh peralatan yang dibutuhkan pada saat perlakuan.
3.3.6 Perlakuan kombinasi campuran tiga bahan (Aromatase inibitor, anti-dopamin, dan ovaprim)
Perlakuan ini dilakukan pada malam hari yaitu pada pukul. 22.00 WIB hingga induk ovulasi. Perlakuan ini terdiri dari beberapa tahap yaitu :
1. Pengecekan ovulasi telur
Pengecekan telur bertujuan untuk memastikan belum terjadi ovulasi pada induk sumatra betina yang akan diberikan perlakuan dengan cara mengurut perut dari arah depan (anterior) ke arah belakang (posterior) menggunakan jari.
2. Pengukuran panjang dan bobot ikan
Pengukuran panjang dan bubut bertujuan untuk menentukan fekunditas, Tingkat Ovolasi (ovulation Rate) serta menghitung volume bahan (larutan) yang akan disuntikan.
3. Penghitungan vulume suntik
Volume suntik dihitung berdasarkan bobot induk sumatra yang akan diberikan perlakuan.
4. Peminsanan induk betina ikan sumatra
Pemingsanan ikan menggunakan bahan pembius dengan merk MS-222 dengan konsentrasi 100 ppm. Setelah ikan ditimbang dan larutan siap untuk disuntikan maka dilakukan pemingsanan dengan cara merendam ikan dalam MS-222 dengan konsentrasi 100 ppm hingga ikan pingsan.
5. Penyuntikan
Penyuntikan dilakukan secara hati-hati secara intra-muscular sambil diurut secara perlahan hingga seluruh larutan masuk ke dalam tubuh ikan.
6.Inkubasi induk
Induk betina Sumatra yang telah disuntik ditempatkan pada akuarium inkubasi secara hati-hati.
7.Pengecekan Ovulasi telur
Ikan yang telah mendapat perlakuan dilakukan pengecekan ovulasi dengan cara stripping. Stripping dilakukan 8 jam setelah penyuntikan. Bila belum
terjadi ovulasi maka stripping dilakukan selang waktu 3 jam. Pengecekan ovulasi dengan cara stripping dilakukan selama 24 jam setelah penyuntikan.
8.Pengamatan dan penghitungan telur ikan sumatra
Pengamatan telur meliputi pengukuran diameter telur dan pengamatan pergeseran posisi inti telur serta penghitungan jumlah telur yang telah mengalami ovulasi.
3.4 Parameter yang Diamati Parameter utama :
1. Tingkat keberhasilan pemijahan
Dengan penyuntikan ovaprim, aromatase inhibitor (AI), anti-dopamin (AD), dan kombinasi ketiganya dapat diketahui pengaruhnya terhadap keberhasilan memijah (S) dengan rumus :
S =
2. Lama waktu ovulasi / Ovulatalion Time (OT)
Setelah 8 jam pasca penyuntikan dilakukan dilakukan pengecekan terhadap induk yang mengalami ovulasi. Setiap selang waktu 3 jam dilakukan pengecekan telur terhadap induk-induk betina yang mengalami ovulasi. Pengecekan ovulasi telur dilakukan dengan cara mengambil ikan menggunakan serokan ikan kemudian diurut (stripping) menggunakan jari jempol secara perlahan.
3. Tingkat Ovulasi / Ovulation Rate (OR)
Tingkat ovulasi diperoleh dari jumlah telur yang diovulasikan dari total telur yang dihasilkan (fekunditas) dalam satu ekor induk sumatra betina dengan bobot tertentu. Tingkat ovulasi dapat dihitung dengan rumus :
4. Diameter telur
Diameter telur diukur di bawah mikroskop menggunakan mikrometer dengan perbesaran 40 kali. Diameter telur yang diamati adalah diameter telur sebelum dan sesudah diberikan perlakuan. Diameter telur dapat dihitung menggunakan rumus (Cindelaras 2005) :
A = B / 0,2 x 0,01 mm
Keterangan : A = Ukuran sebenarnya dalam mm
B = Nilai yang didapat dari pengamatan mikrometer 0,2 = Apabila perbesaran lensa objektif 20x
5. Telur yang diovulasikan
Telur yang diovulasikan adalah jumlah telur yang diovulasikan per ekor induk betina.
6. Derajat Pembuahan (Fertilization Rate / FR)
Derajat pembuahan adalah persentase jumlah telur yang dibuahi dari telur yang diovulasikan. Pengamatan derajat pembuahan dilakukan delapan jam setelah proses pembuahan.
Derajat pembuahan dihitung dengan menggunakan rumus :
FR =
7. Derajat Penetasan (Hatcing Rate / HR)
Derajat penetasan adalah persentase jumlah telur yang menetas dari telur yang dibuahi. Pengamatan dilakukan sampai tidak ada lagi telur yang menetas.
Derajat penetasan dapat dihitung dengan menggunakan rumus :
HR =
8. Tingkat Kelangsungan Hidup (Survival Rate / SR)
Tingkat kelangsungan hidup larva adalah persentase jumlah larva yang hidup setelah berumur 2 hari.
Tingkat kelangsungan hidup larva dapat dihitung dengan menggunakan rumus :
SR =
Parameter pendukung : 1. Kualitas air
Sampel air yang diukur berasal dari bak penampungan air, akuarium inkubasi, dan akuarium pemeliharaan induk. Parameter kualitas air yang diamati terdiri dari disolve oxygen (DO), pH, suhu, dan amonia (NH3). Data kualitas air
disajikan dalam bentuk tabel.
3.5 Analisis Data
Data tingkat keberhasilan pemijahan, lama waktu ovulasi, telur yang diovulasikan, tingkat ovulasi, dan diameter telur dianalisis secara deskriptif menggunakan program SPSS 15 dan microsoft exel 2003 serta dilakukan uji – F dan uji lanjut Duncan. Data disajikan dalam bentuk tabel, grafik, dan diagram.
IV. HASIL DAN PEMBAHASAN 4.1 Hasil
Keberhasilan pemijahan dan lama waktu ovulasi dari perlakuan dapat dilihat pada Tabel 1.
Tabel 1. Tingkat keberhasilan pemijahan dan lama waktu ovulasi ikan sumatra Puntius tetrazona pada temperatur 27 °C
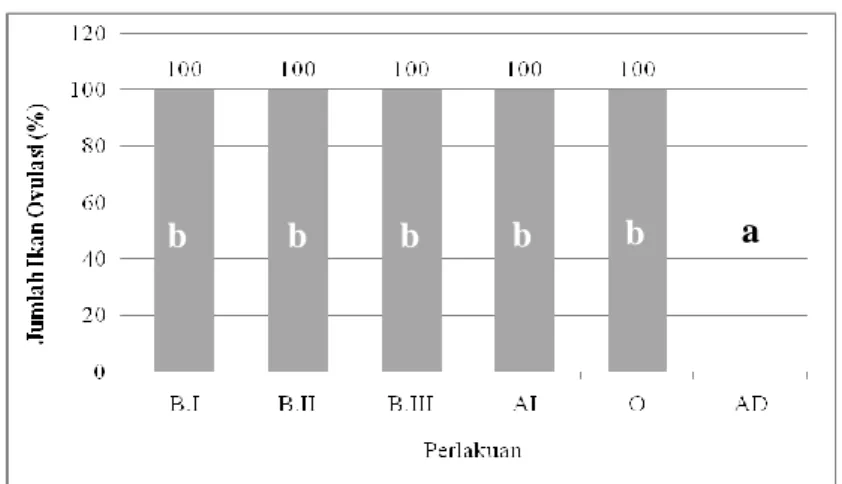
Perlakuan (%O:%AI:%AD) Keberhasilan Persentase keberhasilan Lama waktu ovulasi dalam 24 jam (jam) Rata-rata lama waktu ovulasi (jam) Spawnprime B.I (50:25:25) 1 = Berhasil 100% 14 11,7 ± 2,08c 2 = Berhasil 10 3 = Berhasil 11 Spawnprime B.II (25:50:25) 1 = Berhasil 100% 11 14 ± 3,00c 2 = Berhasil 14 3 = Berhasil 17 Spawnprime B.III (25:25:50) 1 = Berhasil 100 % 14 13 ± 1,73c 2 = Berhasil 11 3 = Berhasil 14 Kontrol AI (0:100:0) 1 = Berhasil 100 % 14 14,3 ± 0,58c 2 = Berhasil 15 3 = Berhasil 14 Kontrol Ovaprim (100:0:0) 1 = Berhasil 100% 8 8 ± 0,00b 2 = Berhasil 8 3 = Berhasil 8 Kontrol AD (0:0:100) 1 = Tidak Berhasil 0 % - - a 2 = Tidak Berhasil - 3 = Tidak Berhasil - Keterangan : - : Tidak ovulasi dalam selang waktu 24 jam
Huruf yang sama menunjukkan tidak berbeda nyata (p<0,05)
Keterangan : Huruf yang sama menunjukkan tidak berbeda nyata (p<0,05) Gambar 3. Grafik keberhasilan pemijahan ikan sumatra Puntius tetrazona
Dari Tabel 1 dan Gambar 3, dapat dilihat bahwa tingkat keberhasilan pemijahan ikan sumatra pada Spawnprime B.I, B.II, B.III, perlakuan AI dan
Ovaprim tidak memberikan perbedaan yang nyata yaitu sebesar 100 % namun tingkat kekerhasilan pemijahan ikan sumatra pada perlakuan AD sebesar 0 % (tidak memijah)
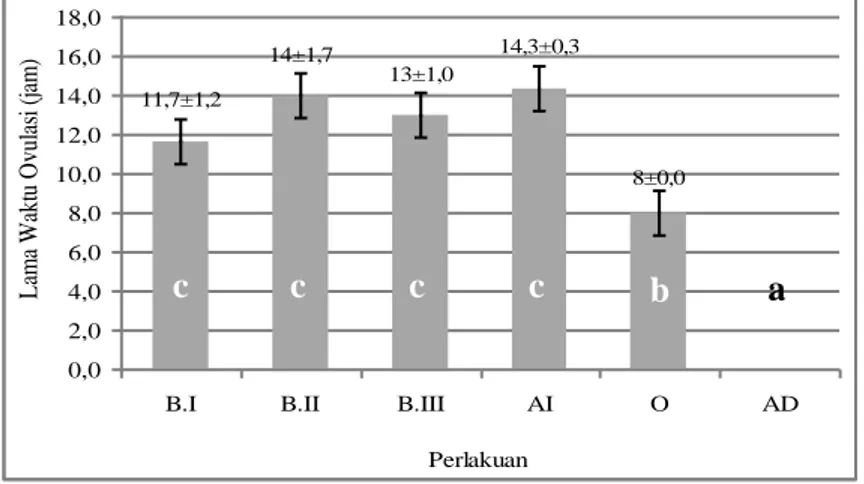
Keterangan : Huruf yang sama menunjukkan tidak berbeda nyata (p<0,05) Gambar 4. Grafik lama waktu ovulasi ikan sumatra Puntius tetrazona
Dari Gambar 4 di atas terlihat bahwa lama waktu ovulasi ikan sumatra berbeda pada tiap-tiap perlakuan. Perlakuan ovaprim memiliki memiliki waktu ovulasi tercepat dibandingkan dengan perlakuan lainnya yaitu 8 jam (p<0,05). Pada Spawnprime B.I, B.II, B.III dan AI memiliki lama waktu ovulasi yang sama (p<0,05). Sedangkan perlakuan AD tidak mengalami ovulasi dalam 24 jam.
Keterangan : Huruf yang sama menunjukkan tidak berbeda nyata (p<0,05) Gambar 5. Grafik telur diovulasikan pada ikan sumatra Puntius tetrazona
Gambar 5 menunjukkan rata-rata telur yang diovulasikan per ekor induk sumatra betina pada tiap-tiap perlakuan. Jumlah telur yag diovulasikan pada
8±0,0 14,3±0,3 13±1,0 14±1,7 11,7±1,2 0,0 2,0 4,0 6,0 8,0 10,0 12,0 14,0 16,0 18,0
B.I B.II B.III AI O AD
Perlakuan L am a W akt u O vul as i ( ja m ) 733±343,86 791±305,63 570±103,03 652±406,69 510±201,33 0 100 200 300 400 500 600 700 800 900
B.I B.II B.III AI O AD
Perlakuan Jum la h T el ur O vul as i ( but ir ) b c c c c a b a b b b b
Spawnprime B.I – B.II, ovaprim dan AI tidak berbeda (p<0,05). Sedangkan pada perlakuan AD tidak terjadi ovulasi dalam 24 jam.
Keterangan : Huruf yang sama menunjukkan tidak berbeda nyata (p<0,05) Gambar 6. Grafik tingkat ovulasi (Ovulation Rate [OR])
Dari Gambar 6, terlihat bahwa Ovulation rate (tingkat ovulasi) telur pada pemijahan ikan sumatra pada setiap perlakuan berkisar antara 17,28 % - 24,84 %. Hasil analisa statistik menunjukkan tidak ada perbedaan antar perlakuan B.I, B.II, B.III, AI dan ovaprim. Namun semua perlakuan tersebut berbeda nyata denan AD (p<0,05).
Keterangan : Huruf yang sama menunjukkan tidak berbeda nyata (p<0,05) Gambar 7. Grafik diameter telur ikan sumatra Puntius tetrazona
0.00 17,28±6,83 22,10±13,79 19,32±3,49 26,82±10,36 24,84±11,7 0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00
B.I B.II B.III AI O AD
Perlakuan T ingk at O vul as i ( % ) 1,10±0,06 1,05±0,01 1,07±0,04 1,10±0,09 1,08±0,05 0,96 0,00 0,20 0,40 0,60 0,80 1,00 1,20
B.I B.II B.III O AI AD Awal
Perlakuan R at a-ra ta D ia m et er T el ur ( m m ) b a b b b b b a b b b b
Berdasarkan Gambar 7 terlihat bahwa diameter telur ikan sumatra sama antar perlakuan B.I, B.II, B.III, ovaprim dan AI. Namun semua perlakuan tersebut berbeda terhadap perlakuan AD (p<0,05). Spawnprime B.I, B.II, B.III dan perlakuan AI memiliki diameter telur terbesar yaitu sebesar 1,10 mm. Diameter telur ovaprim, B.III, dan B.II berturut-turut yaitu 1,08 mm, 1,07 mm, dan 1,05 mm.
Gambar 8. Lama menetas telur ikan sumatra Puntius tetrazona
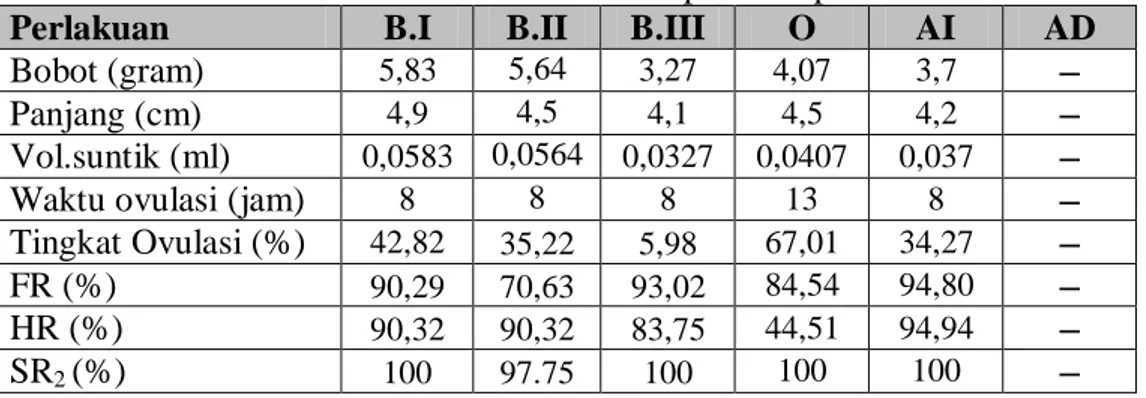
Tabel 2. Parameter tambahan (FR, HR, dan SR) pada pemijahan buatan ikan sumatra Puntius tetrazona pada temperatur 27 °C
Perlakuan B.I B.II B.III O AI AD
Bobot (gram) 5,83 5,64 3,27 4,07 3,7 Panjang (cm) 4,9 4,5 4,1 4,5 4,2 Vol.suntik (ml) 0,0583 0,0564 0,0327 0,0407 0,037 Waktu ovulasi (jam) 8 8 8 13 8 Tingkat Ovulasi (%) 42,82 35,22 5,98 67,01 34,27 FR (%) 90,29 70,63 93,02 84,54 94,80 HR (%) 90,32 90,32 83,75 44,51 94,94 SR2 (%) 100 97.75 100 100 100
Dari Gambar 8 dan Tabel 2 menunjukan bahwa terjadi perbadaan lama waktu menetas telur ikan sumatra antar perlakuan B.I, B.II, B.III dengan perlakuan Ovaprim, AI dan AD. Lama waktu menetas paling cepat terdapat pada Spawnprime B.I yaitu sebesar 22,22 jam dibandingkan bengan Spawnprime B.III, B.II, ovaprim, dan perlakuan AI semakin menurun dengan lama waktu menetas berturut-turut yaitu 22,77, 22,87, 23,32, dan 25,60 jam.
0.00 5.00 10.00 15.00 20.00 25.00 30.00 1 S el 2 S el 4 S el 8 S el 16 Se l 32 Se l Mor ulla Bla stul a Gas trul la Not ochor d Bint ik M ata Mene tas Stadia telur Wak tu (j am ) Ova AI AD I II III
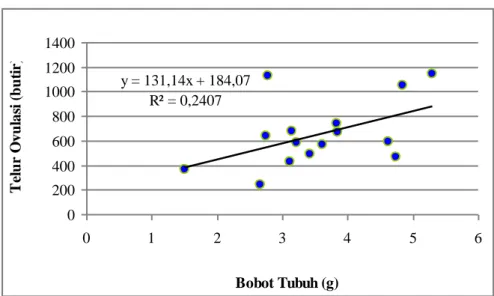
Gambar 9. Hubungan bobot tubuh - telur ovulasi ikan sumatra Puntius tetrazona
Gambar 9 menunjukkan hubungan antara bobot tubuh ikan sumatra dengan fekunditas. Persamaan y = 131,14x + 184,07 dengan R2 = 0,2407 menunjukan bahwa semakin besar bobot tubuh ikan sumatra maka telur yang diovulasikan akan semakin besar pula.
4.2 Pembahasan
Penyuntikan AI (100 ppm) pada perlakuan AI dengan dosis 0,5 ml/kg mampu mempercepat pematangan gonad dan proses ovulasi pada ikan sumatra Puntius tetrazona pada selang waktu 12 – 14 jam setelah penyuntikan. Hal ini sejalan dengan penelitian yang dilakukan oleh Afonso et al. (1999), pemberian AI sebesar 10 mg/kg pada induk coho salmon siap pijah menghasilkan waktu ovulasi pada hari ke-10 yaitu sebesar 67% dengan fertilitas 85%. Aromatase inhibitor adalah bahan kimia yang mampu menghambat atau menghentikan kerja enzim aromatase sehingga menghambat produksi hormon esterogen yang ada di otak maupun gonad (Sumantri, 2006). Hal yang sama terjadi pada ovaprim yaitu 100 % ikan mengalami ovulasi sestelah penyuntikan. Namun, penyuntikan anti dopamin (10 mg/ml) secara tunggal tidak mampu mempercepat pematangan gonad dan proses ovulasi pada ikan sumatra Puntius tetrazona dalam 24 jam, hal ini diduga penyuntikan anti dopamin secara tunggal tidak bisa memaksa otak untuk mengeluarkan LHRH pada disebabkan masih berjalan proses vitelogenesis.
y = 131,14x + 184,07 R² = 0,2407 0 200 400 600 800 1000 1200 1400 0 1 2 3 4 5 6 Bobot Tubuh (g) T el u r O vu las i ( b u ti r)
Anti-dopamin yang terkandung dalam ovaprim berfungsi untuk memblok dopamin sehingga menstimulasi sekresi gonadotropin. Menurut Harker (1992) dalam Prasetya (2002), anti-dopamin adalah bahan kimia yang dapat menghentikan kerja dopamin sedangkan dopamin adalah bahan kimia yang menghambat pelepasan hormon dari pituitari dan juga menghambat pituitari dalam merespon penyuntikan LHRHa.
Kombinasi aromatase inhibitor (AI), anti dopamian (AD) dan ovaprim dengan proporsi yang berbeda pada pemijahan ikan sumatra mampu mempercepat pematangan gonad dan ovulasi telur pada induk betina. Hal ini terjadi karena AI dan AD memiliki fungsi dalam proses fisiologi reproduksi ikan yaitu pada tahap pematangan telur (final maturation) dan ovulasi pada induk ikan betina.
Dari Tabel 1 dan Gambar 3 dapat dilihat bahwa pengurangan proporsi ovaprim mulai dari 50 – 25 % volume suntik dengan penambahan larutan AI 100 ppm dan AD 100 ppt mampu merangsang proses pematangan telur dan ovulasi pada induk sumatra betina. Hal ini dapat dilihat dari persentase jumlah ikan yang mengalami ovulasi setelah disuntik ovaprim sesuai dengan perlakuan dimana seluruh induk betina pada perlakuan B.I, B.II, B.III, ovaprim, AI, dan AD mengalami ovulasi kecuali pada perlakuan AD. Pada Spawnprime B.I, B.II, B.III, dan ovaprim, induk betina sumatra yang berhasil ovulasi disebabkan karena adanya stimulasi hormon dari ovaprim yang mengandung LHRH dan anti dopamin yang merangsang kelenjar hipofisa untuk mensekresikan GtH II dan menghambat sekresi dopamin yang dapat menghambat pelepasan hormon oleh kelenjar hipofisa. GtH II akan sampai ke gonad melalui peredaran darah kemudian merangsang lapisan teka untuk mensekrsikan hormon 17 -hidroksi progesteron yang kemudian akan diubah menjadi maturating inducing steroid (MIS) oleh enzim 20 -dihidroksi steroid dehidrogenase yang akan merangsang proses peleburan inti telur dan pecahnya lapisan folikel sehingga telur keluar menuju rongga ovari. Pada perlakuan AI, induk sumatra betina yang ovulasi disebabkan adanya stimulasi dari aromatase inhibitor sehingga kerja enzim aromatase yang ada di otak maupun gonad menjadi terhambat. Terhambatnya kerja enzim aromatase dalam mengubah testosteron menjadi estradiol-17β pada lapisan sel granulosa menyebabkan konsentrasi hormon estradiol-17β dalam darah menurun
sehingga menghambat hati untuk mensintesis vitelogenin yang mengakibatkan terhentinya proses viteligenesis. Hal ini merupakan sinyal balik bagi hipofisa untuk memproduksi GTH II yang berperan dalam proses pematangan akhir (final maturation) dan ovulasi. Namun pada perlakuan AD tidak satupun induk betina sumatra yang mengalami ovulasi, hal ini diduga karena tidak adanya sinkronisasi kerja anti dopamin dengan sistem hormon pada tubuh induk betina dimana kondisi induk masih pada tahap vitelogenesis. Keberadaan anti dopamin dalam menghambat kerja dopamin pada otak tidak mampu memaksa otak untuk meranmengeluarkan LHRH dalam jumlah yang cukup untuk merangsang kelenjar pituitari untuk mengeluarkan LH segingga tidak terjadi pematangan gonad.
Dari Gambar 4 terlihat adanya perbedaan lama waktu ovulasi pada tiap-tiap perlakuan. Hal ini disebabkan oleh penurunan konsentrasi LHRH yang disuntikan akibat dari pengurangan proporsi ovaprim yang digunakan sesuai dengan rancangan perlakuan. Waktu ovulasi tercepat yaitu pada ovaprim selama 8 jam kemudian semakin lama seiring dengan penurunan proporsi ovaprim yaitu pada Spawnprime B.I, B.III, B.II, dan perlakuan AI yaitu berturut-turut selama 12 jam, 13 jam, 14 jam, dan 14 jam. Spawnprime B.I memiliki rata-rata waktu ovulasi lebih cepat bila dibandingkan dengan waktu ovulasi Spawnprime B.III dan B.II ,hal ini disebabkan konsentrasi ovaprim pada Spawnprime B.I dua kali lebih besar dari Spawnprime B.III dan B.II. Hal ini mengakibatkan konsentrasi LHRH dan anti dopamin yang disuntikkan ke dalam tubuh ikan menjadi lebih besar dan menstimulasi kelenjar hipofiasa untuk lebih banyak mensekresikan GtH II. Jumlah GtH II yang semakin banyak menyebabkan keberadaannya dalam plasma darah semakin lama sehingga dapat memaksimalkan proses pematangan gonad dan mempercepat proses ovulasi. Spawnprime B.III memiliki rata-rata waktu ovulasi lebih cepat dibandingkan dengan Spawnprime B.II walaupun jumlah proporsi ovarpim sama besar, hal ini diduga disebabkan konsentrasi anti dopamin pada Spawnprime B.III lebih besar sehingga pelepasan GtH II oleh kelenjar hipofisa dapat berjalan dengan baik. Hal ini juga dikemukakan oleh Kestemont (1988) dalam Novianto (2004) yang menyatakan bahwa kombinasi antara LHRH-a dLHRH-an pimodize dLHRH-apLHRH-at menyebLHRH-abkLHRH-an tingginyLHRH-a GtH yLHRH-ang disekresikLHRH-an dLHRH-an keberadaannya dalam plasma darah lebih lama.
Menurut Mittelmark (2008) hormon memegang peran yang sangat kritis dalam proses reproduksi. Semakin menurunnya konsentrasi LHRH dalam darah mengakibatkan proses pematangan gonad dan ovulasi menjadi lebih lambat.
Dari Gambar 5 dapat dilihat bahwa telur yang diovulasikan pada Spawnprime B yaitu berkisar antara 570 -791 butir, lebih besar dari ovapim yaitu 510 butir.
Gambar 6 menunjukkan tingkat ovulasi dari tiap-tiap perlakuan telihat adanya perbedaan tingkat ovulasi baik antar perlakuan B.I, B.II, B.III maupun ovaprim, AI, dan AD. Hal ini menunjukkan adanya pengaruh dari tiga jenis bahan dengan fungsi dan mekanisme kerja yang berbeda pada sistem reproduksi ikan terhadap proses pematangan telur dan ovulasi. Tingkat ovulasi tertinggi terdapat pada Spawnprime B.II yaitu sebesar 26,82 %. Spawnprime B.I, perlakuan AI, Spawnprime B.III, dan ovaprim berturut-turut yaitu 24,84 %, 22,10 %, 19,32 % dan 17,28 %. Pada Spawnprime B.I, perlakuan AI, dan Spawnprime B.III memiliki tingkat ovulasi lebih besar dibandingkan ovaprim, hal ini menunjukkan bahwa pengurangan proporsi ovaprim dengan substitusi AI dan AD mampu merangsang pematangan telur dan ovulasi. Penambahan AI dan AD dapat menggantikan fungsi LHRH-a akibat pengurangan proporsi ovapim pada penyuntikan induk sumatra betina. Dengan penambahan AI maka kerja enzim aromatase dalam mengubah testosteron menjadi estradiol-17β pada lapisan sel granulosa menjadi terhambat. Hal ini menyebabkan konsentrasi hormon estradiol-17β dalam darah menurun sehingga menghambat hati untuk mensintesis vitelogenin akibatnya proses viteligenesis terhenti. Hal ini merupakan sinyal balik bagi hipofisa untuk memproduksi GTH II yang berperan dalam proses pematangan akhir (final maturation). Oleh karena itu kekurangan hormon LHRH-a dLHRH-apLHRH-at diimbLHRH-angi dengLHRH-an proses pemLHRH-atLHRH-angLHRH-an telur yLHRH-ang lebih LHRH-awLHRH-al LHRH-akibLHRH-at dLHRH-ari kerja AI dalam sistem hormon reproduksi ikan dan diduga ikan juga menghasilkan LHRH secara endogenous karena proses vitelogenesis terhenti akibat dari kerja AI. Demikian pula pada perlakuan AI, tingginya tingkat ovulasi disebabkan besarnya jumlah AI yang masuk ke dalam tubuh sehingga proses vitelogenesis terhenti dengan sempurna diikuti pelepasan GtH II oleh kelenjar hipofisa akibar dari feedback negatif.
Ukuran diameter telur dapat menggambarkan tingkat kematangan gonad pada ikan. Menurut Effendi (1979) kematangan seksual pada ikan dicirikan oleh perkembangan rata-rata diameter telur dan distribusi penyebaran ukuran telur.
Berdasarkan Gambar 7 terlihat bahwa diameter telur ikan sumatra yang diberi perlakuan memiliki perbedaan pada tiap-tiap perlakuan. Spawnprime B.I dan perlakuan AI memiliki diameter telur terbesar yaitu sebesar 1,10 mm. Diameter telur ovaprim, Spawnprime B.III, dan Spawnprime B.II berturut-turut yaitu 1,08 mm, 1,07 mm, dan 1,05 mm. Besarnya ukuran diameter telur pada Spawnprime B.I dan perlakuan AI diduga disebabkan adanya LHRH endogenous dari tubuh ikan yang jumlahnya semakin meningkat dengan semakin besarnya proporsi AI yang diberikan.
Gambar 8 dan Tabel 2 menunjukan bahwa perkembangan embrio (embriogenesis) dan perkembangan larva pada spawnprim B tidak memiliki perbedaan yang signifikan bila dibandingkan dengan ovaprim. Hal ini dapat dilihat dari lama waktu menetas yang relatif sama serta tingkat kelangsungan hidup larva yaitu berkisar antara 97,75 – 100 %.
Dari persamaan y = 131,14x + 184,07 dengan R2 = 0,2407 (Gambar 9) menunjukan bahwa semakin besar bobot tubuh ikan sumatra maka jumlah telur yang diovulasikan akan semakin besar pula.
Luteinizing Hormone Releasing Hormon (LHRH) dan aromatase inhibitor (AI) berperan dalam mempercepat pematangan gonad. Penurunan LHRH dengan penambahan AI dan AD mampu mempercepat pematangan gonad dan ovulasi telur pada induk betina dalam pemijahan buatan (induced bredding). Dilihat dari segi ekonomi, AI memiliki harga yang sangat murah yaitu Rp. 10,00/mg. Spawnprime B.I dengan harga sebesar Rp. 135.020,00 lebih murah 63,6 % dari harga ovaprim yaitu sebesar Rp. 220.000,00 namun tetap memberikan hasil terbaik dengan tingkat ovulasi pada Spawnprime B.I sebesar 27,44 % sedangkan ovaprim sebesar 19,65 %. Jika dibandingkan antara premiks Spawnprime B dan ovaprim maka premiks Spawnprime B.II dapat dijadikan sebagai salah satu alternatif premiks hormon untuk pemijahan buatan (induced spawning). Spawnprime B dapat dijadikan sebagai salah satu premiks domestik selain ovaprim untuk pemijahan buatan.
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Aromatase inhibitor (AI) mampu mempercepat pematangan gonad dan ovulasi pada ikan sumatra Puntius tetrazona.
Pengurangan proporsi ovaprim dengan penambahan aromatase inhibitor dan anti-dopamin pada pemijahan buatan mampu mempercepat proses pematangan gonad dan ovulasi telur ikan sumatra Puntius tetrazona.
Substitusi ovaprim dengan AI dan AD memiliki rata-rata waktu ovulasi lebih lama 6 jam dibandingkan dengan ovaprim.
Premiks terbaik (Spawnprime B.II) memiliki harga Rp. 80.040,00/10 ml lebih murah 63,6 % dari harga ovaprim yaitu Rp. 220.000,00/10 ml.
5.2 Saran
Spawnprime B dapat dijadikan sebagai salah satu premiks domestik selain ovaprim untuk pemijahan buatan.
Kombinasi ovaprim dengan AI dan AD dapat digunakan untuk mempercepat pematangan gonad dan ovulasi ikan sumatra Puntius tetrazona.
Disarankan untuk penelitian lebih lanjut menggunakan spesies ikan yang dapat memijah secara alami.
Jika menggunakan Spawnprime B.II pada pemijahan buatan (Induce breeding) maka penyuntikan dilakukan 6 jam lebih awal dibandingkan menggunakan ovaprim untuk mendapatkan waktu ovulasi yang sama, pagi hari.
DAFTAR PUSTAKA
Anonimous. 2009. Induced Spawning Of Cultured Fish Using Ovaprim. Http :// www.Syndell.com. [tanggal kunjung 7 Januari 2009].
Afonso LOB, Iwama GK, Smith J, dan Donaldson EM. 1999. Effect of Aromatase Inhibitor Fadrozol on Plasma Sex Steroid and Ovulation Rate in Female Coho Salmon, Onchorhynchus kisuth, Close to Final Maturation. Gen. Comp. Endocrinol 113 : 221-229
Axelrod, H.R.; M.E. Sweeney (1992). The Fascination of Breeding Aquarium Fish. Neptune City, N.J.: T.F.H. Publications, Inc. Ltd..
Chakroff, M. 1976. Freshwater Fish Pond Culture and management. VITA Publication. Uniited State.
Cindelaras S. 2005. Perkembangan Embrio Ikan Zebra Danio (Brachydanio rerio). Skripsi. Program Studi Teknologi dan Manajemen Akuakultur. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Departemen Kelautan Dan Kelautan. 2005. Revitalisasi Perikanan Budidaya 2006-2009. Jakarta.
Direktur Jendral Perikanan Budidaya. Direktur Produksi. 2009. Kinerja 2008 dan Rencana 2009 Perikanan Budidaya. Bahan Diskusi Satgas Perikanan Budidaya. Bogor.
Mittelmark, J. 2008. Induced Reproduction in Fish. http: // www . Seagrant . umn. edu / aquaculture induced_fish_reproduction [tanggal kunjung 5 Desember 2008].
Munro, A.D.; C. Li-Lian, and K. Nqankee (1990). "Preliminary observations on environmental control of ovulation and spawning in a small tropical Cyprinid (Barbus tetrazona)". Proc. of the Second Asian Fish. Forum, Tokyo, Japan.: 17–22.
Nagahama Y, et al. 1995. Regulation of oocite growth and maturation in fish. Dev Biol. 30 : 103 -104
Nandeesha MC, Rao KG, Jayanna RN, Parker NC, Varghese TJ, Keshavanath P, dan Shetty HPC. 1990. Induced Spawning of Indian Major Carps Through
Single Application of Ovaprim-C. The Second Asian Fisheries Forum. Asian Fisheries Society, Manila, Philippines.
Novianto, E. 2004. Evaluasi Penyuntikan Ovaprim-C dengan Dosis yang Berbeda kepada Ikan Sumatra Puntius tetrazona. Skripsi. Program Studi Teknologi dan Manajemen Akuakultur. Departemen Budadaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Prasetya, T. 2002. Pengaruh Pemberian Hormon LHRH-A Terhadap Perkembanga Diameter Telur Ikan Botia Botia Macracabthus Bleeker. Skripsi. Program Studi Teknologi dan Manajemen Akuakultur. Departemen Budadaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Scheurmann, L. 1990. Aquarium Fish Breeding. Baron's Educational Series Inc. Hauppauge, N.Y.
Sumantri D. 2006. Efektifitas Ovaprim dan Aromatase Inhibitor dalam Mempercepat Pemijahan pada Ikan Lele Dumbo Clarias sp. Skripsi. Program Studi Teknologi dan Manajemen Akuakultur. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Swanson, P. 2008. Endocrine Regulation of Reproduction. http: // www . north west fishery sciense center . noaa . gov / research / divisions / reutd / phys_ endo / endocrine . cfm [tanggal kunjung 5 Desember 2008].
Wardani, S L. 1996. Pengaruh Lama waktu Penyimpanan Telur Ikan Mas Cyprinus Carpio L. Terhadap Derajat Pembuahan, Perkembangan Embrio Dan Daya Tetas Telur. Skripsi. Program Studi Teknologi dan Manajemen Akuakultur. Departemen Budadaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Wikipedia. 2009. Tiger Barb. http : //en.wikipedia.org/wiki/Tiger_barb [tanggal kunjung 27 Desember 2008]
Woynarovich, E. and L. Hovarth. 1980. The Artificial Propagation of Warm Water Fin Fishes: a manual for extension. FAO Fish. Pap. 201.183p.
Lampiran 1. Formulasi Bahan
dan Analisis Biaya
Spawnprime
B
Keterangan Keb. Bahan (ml)* Total Keb. Bahan/ekor (ml) Total Stok. Bahan (ml) Total Keb. Bahan
O** AI AD O AI AD O AI AD O AI AD
Kontrol Ovaprim (O) 0.2 0 0 0.2 0.04 0 0 0.04 5 0 0 5 0.25 0 0 Kontrol Aromatase inhibitor (AI) 0 0.2 0 0.2 0 0.04 0 0.04 0 5 0 5 0 0.5 0 Kontrol Anti-dopamin (AD) 0 0 0.2 0.2 0 0 0.04 0.04 0 0 5 5 0 0 50
Spawnprime B.I 0.1 0.05 0.05 0.2 0.02 0.01 0.01 0.04 2.5 1.25 1.25 5 0.125 0.125 12.5
Spawnprime B.II 0.05 0.1 0.05 0.2 0.01 0.02 0.01 0.04 1.25 2.5 1.25 5 0.0625 0.25 12.5
Spawnprime B.III 0.05 0.05 0.1 0.2 0.01 0.01 0.02 0.04 1.25 1.25 2.5 5 0.0625 0.125 25
Total 0.4 0.4 0.4 0.08 0.08 0.08 10 10 10 0.5 1 100 Dosis = 0.02 ml/2g Dosis = 0.02 ml/2g Dosis = 0.02 ml/2g Dosis = 0.02 ml/2g Keterangan
Persentase bahan (%) Keb. Bahan (ml)*
Total Keb. Bahan / ekor (ml) Total
O AI AD O AI AD O AI AD
Kontrol Ovaprim (O) 100 0 0 0.01 0 0 0.01 0.002 0 0 0.002 Kontrol Aromatase inhibitor (AI) 0 100 0 0 0.01 0 0.01 0 0.002 0 0.002 Kontrol Anti-dopamin (AD) 0 0 100 0 0 0.01 0.01 0 0 0.002 0.002
Spawnprime B.I 50 25 25 0.005 0.0025 0.0025 0.01 0.001 5E-04 0.0005 0.002
Spawnprime B.II 25 50 25 0.0025 0.005 0.0025 0.01 5E-04 0.001 0.0005 0.002
Spawnprime B.III 25 25 50 0.0025 0.0025 0.005 0.01 5E-04 5E-04 0.001 0.002
Total 0.02 0.02 0.02 0.004 0.004 0.004 Dosis = 0.0005 ml/g Dosis = 0.0005 ml/kg
Keterangan Harga Total Untuk 20 kg bobot tubuh O AI AD
Kontrol Ovaprim (O) 5500 0 0 5500 220000 Kontrol Aromatase inhibitor (AI) 0 2 0 2 80 Kontrol Anti-dopamin (AD) 0 0 2500 2500 100000
Spawnprime B.I 2750 0.5 625 3375.5 135020 Spawnprime B.II 1375 1 625 2001 80040 Spawnprime B.III 1375 0.5 1250 2625.5 105020 Total 11000 4 5000 Dosis = 0.02 ml/2g Keteranagn :
* : 5 ekor ikan dangan berat 4 g / ekor **: Setelah diencerkan 20x
Jenis Bahan Harga
Ovaprim Rp. 22.000,-/ml Aromatase inhibitor (AI) Rp. 4,-/mg Anti-dopamin Rp. 50,-/mg
Lampiran 2. Data Perlakuan
Ket erangan :
O : Kontrol Ovaprim
AI : Kontrol Aromatase inhibitor AD : Kontrol anti dopamin B.I : Perlakuan Spawnprime B.I B.II : Perlakuan Spawnprime B.II B.III : Perlakuan Spawnprime B.III
O1, O2, …, B.III.1, B.III.2, B.III.3 : ulangan pada masing-masing perlakuan 1, 2, 3 No. Perlakuan Bobot (g) Panjang (cm) Pingsan (menit) Penyuntikan Ovulasi Keterangan
Lama Waktu Ovulasi Vol. Suntik
(ml) TGL Jam suntik TGL Ovulasi
Jumlah
Telur Total jam menit pembulatan 1 B.I.1 3,22 4,4 2,03 0,0322 04-Apr-09 22:42 05-Apr-09 12:43 583 Memijah 13 61 14 2 B.I.2 2,78 4,5 1,55 0,0278 25-Apr-09 22.53 26-Apr-09 08.29 1126 Memijah 9 36 10 3 B.I.3 3,42 5 1,48 0,0342 25-Apr-09 23.00 26-Apr-09 10.00 489 Memijah 11 0 11 4 B.II.1 4,62 4,5 2,25 0,0462 04-Apr-09 22:53 05-Apr-09 9:40 593 Memijah 10 47 11 5 B.II.2 2,75 3,7 2,08 0,0225 04-Apr-09 23:00 05-Apr-09 13:00 637 Memijah 14 0 14 6 B.II.3 5,3 5,5 1,31 0,053 25-Apr-09 23.07 26-Apr-09 15.53 1143 Memijah 16 46 17 7 B.III.1 3,62 4,2 2,31 0,0362 04-Apr-09 23:21 05-Apr-09 13:21 567 Memijah 13 60 14 8 B.III .2 3,14 4,5 3,19 0,0314 04-Apr-09 23:28 05-Apr-09 10:00 674 Memijah 10 32 11 9 B.III .3 4,74 5 2 0,0474 25-Apr-09 23.33 26-Apr-09 13.33 468 Memijah 14 0 14 10 AI.1 4,85 4 1,43 0,0485 04-Apr-09 23:36 05-Apr-09 13:36 1051 Memijah 14 0 14 11 AI.2 3,85 4,5 2,17 0,0385 04-Apr-09 23:05 05-Apr-09 13:50 666 Memijah 13 105 15 12 AI.3 2,66 4 1,49 0,0266 25-Apr-09 23.59 26-Apr-09 13.59 238 Memijah 14 0 14 13 O.1 1,5 3,5 2,51 0,015 05-Apr-09 00.05 05-Apr-09 8:05 362 Memijah 8 0 8 14 O.2 3,11 4 2,13 0,0311 05-Apr-09 00.11 05-Apr-09 8:11 428 Memijah 8 0 8 15 O.3 3,84 4,5 2,43 0,0384 25-Apr-09 23.49 26-Apr-09 07.49 739 Memijah 8 0 8 16 AD.1 2,14 3,5 1,51 0,0214 05-Apr-09 00.34 06-Apr-09 – – Tidak Memijah – – – 17 AD.2 2,71 4,5 1,35 0,0271 26-Apr-09 00.16 26-Apr-09 – – Tidak Memijah – – – 18 AD.3 3,98 4,5 2,01 0,0398 26-Apr-09 00.25 26-Apr-09 – – Tidak Memijah – – –
Lampiran 3. Parameter uji pada ikan sumatra Puntius tetrazona Perlakuan % induk ovulasi Telur Ovulasi (butir) Diameter telur (mm) Tingkat ovulasi (%) Lama waktu ovulasi (jam) B.I.1 100 583 1.04 19,76941 14 B.I.2 1126 1.13 38,18243 10 B.I.3 489 1.15 16,58189 11 Rata-rata 100 733 ± 343,86b 1.10 ± 0,06b 24,85± 11,66b 11,7 ± 1,2c B.II.1 100 593 1.06 20,10851 11 B.II.2 637 1.06 21,60054 14 B.II.3 1143 1.04 38,7589 17 Rata-rata 100 791 ± 305,63b 1.05 ± 0,01b 26,82± 10,36b 14 ± 1,7c B.III.1 100 567 1.04 19,22686 14 B.III.2 674 1.05 22,85521 11 B.III.3 468 1.12 15,86979 14 Rata-rata 100 570 ± 103,03b 1.07 ± 0,04b 19,32± 3,49b 13 ± 0,3c AI.1 100 1051 1.07 35,6392 14 AI.2 666 1.07 22,58393 15 AI.3 238 1.15 8,070532 14 Rata-rata 100 652 ± 406,69b 1.10 ± 0,05b 22,10 ± 13,79b 14,3 ± 1,0c O.1 100 362 1.03 12,27535 8 O.2 428 1.03 14,51339 8 O.3 739 1.18 25,05934 8 Rata-rata 100 510 ± 201,33b 1.08 ± 0,09b 17,28 ± 6,83b 8 ± 0,00b AD.1 – – – – – AD.2 – – – – AD.3 – – – – Rata-rata – - a - a - a - a Ket erangan : O : Kontrol Ovaprim
AI : Kontrol Aromatase inhibitor AD : Kontrol anti dopamin B.I : Perlakuan Spawnprime B.I B.II : Perlakuan Spawnprime B.II B.III : Perlakuan Spawnprime B.III
Lampiran 4. Lama waktu ovulasi ikan sumatra Puntius tetrazona Perlakuan Ulangan Over
Rate
Kisaran Lama Waktu Ovulasi (jam) Tidak ovulasi Lama Waktu Ovulasi (jam) 0 – 8 9 – 11 12 – 14 15 – 17 B.I 1 14 2 10 3 11 B.II 1 11 2 14 3 17 B.III 1 14 2 11 3 14 AI 1 14 2 15 3 14 O 1 8 2 8 3 8 AD 1 – 2 – 3 –
Keterangan : - : Tidak ovulasi dalam selang waktu 24 jam
Lampiran 5. Kualitas air No. Asal sampel
Parameter Suhu (°C) DO (ppm) TAN (ppm) pH 1 Tandon 27 5.23 0.11 8 2 Akuarium pemeliharaan 27.4 4.55 0.82 5 3 Akuarium perlakuan 27 4.45 0.43 7
Lampiran 6. Parameter tambahan pada ikan sumatra Puntius tetrazona
Perlakuan Tahapan embriogenesis (jam)*
1 sel 2 sel 4 sel 8 sel 16 sel 32 sel O 0.53 0.72 0.92 1.08 1.28 1.40 AI 0.42 0.60 0.77 0.92 1.08 1.30 AD – – – – – – B.I 0.45 0.65 0.70 0.93 1.13 1.30 B.II 0.60 0.85 0.97 1.10 1.37 1.52 B.III 0.45 0.55 0.77 0.93 1.08 1.17
Perlakuan Tahapan embriogenesis (jam)*
Morulla blastula gastrula Notochord Bintik mata menetas O 1.93 3.27 4.65 11.18 11.43 23.32 AI 1.48 2.80 3.97 7.77 8.63 25.60 AD – – – – – – B.I 2.12 3.40 5.10 9.48 9.58 22.22 B.II 2.08 2.97 3.95 8.70 8.90 22.87 B.III 2.10 2.90 3.72 7.15 9.65 22.77 Ket :
FR : Fertilization Rate (Derajat Pembuahan) HR : Hatching Rate (Derajat Penetasan)
SR2 : Survival Rate 2 (Tingkat Kelangsungan Hidup setelah 2 hari)
Lampiran 7.
Prosedur Penelitian
Persiapan wadah
Pemeliharaan Ikan
Pembuatan Larutan
Premiks
Seleksi Ikan Uji
Perlakuan
Penyuntikan Larutan
Spawnprime
B
Pemijahan
Pengumpulan Data
Pelarutan Bahan
Pencampuran Bahan sesuai
Proporsi
Cek Matang Gonad
Pemuasaan 1 Hari
Penimbangan Bobot
Penentuan Dosis
Pemingsanan
Lampiran 8. Data analisis statistika
ONEWAY
Bobot Fekunditas Lama_waktu_ovulasi Tingkat_ovulasi Diameter_telur BY
Perlakuan
/STATISTICS HOMOGENEITY /MISSING ANALYSIS .
Oneway
Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig. Bobot .964 5 12 .477 Fekunditas 2.638 5 12 .078 Lama_waktu_ovulasi 3.649 5 12 .031 Tingkat_ovulasi 3.516 5 12 .034 Diameter_telur 5.971 5 12 .005 ANOVA Sum of
Squares df Mean Square F Sig.
Bobot Between Groups 4.836 5 .967 .960 .479
Within Groups 12.095 12 1.008
Total 16.931 17
Fekunditas Between Groups 1217865.7
78 5 243573.156 3.413 .038 Within Groups 856398.66 7 12 71366.556 Total 2074264.4 44 17 Lama_waktu_ ovulasi Between Groups 1590895.1 67 5 318179.033 29.050 .000 Within Groups 131435.33 3 12 10952.944 Total 1722330.5 00 17
Tingkat_ovulasi Between Groups 1366.237 5 273.247 4.054 .022
Within Groups 808.882 12 67.407
Total 2175.119 17
Diameter_telur Between Groups 2.924 5 .585 226.26
0 .000
Within Groups .031 12 .003
BOBOT ANOVA
Source of
Variation SS df MS F P-value F crit
Between Groups 4.8358 5 0.9672 0.9595 0.4793 3.1059
Within Groups 12.095 12 1.0079
FEKUNDITAS ANOVA
Source of
Variation SS df MS F P-value F crit
Between Groups 1E+06 5 243573.1556 3.4130 0.0378 3.1059
Within Groups 856399 12 71366.5556
Total 2E+06 17
LAMA_WAKTU_OVULASI ANOVA
Source of
Variation SS df MS F P-value F crit
Between Groups 2E+06 5 318179.0333 29.0496 0.0000 3.1059
Within Groups 131435 12 10952.9444
Total 2E+06 17
TINGKAT_OVULASI ANOVA
Source of
Variation SS df MS F P-value F crit
Between Groups 1366.4 5 273.2805578 4.0543 0.0218 3.1059 Within Groups 808.85 12 67.40456204 Total 2175.3 17 DIAMETER_TELUR ANOVA Source of
Variation SS df MS F P-value F crit
Between Groups 2.9245 5 0.5849 226.2598 0.0000 3.1059
Within Groups 0.031 12 0.0026

![Gambar 6. Grafik tingkat ovulasi (Ovulation Rate [OR])](https://thumb-ap.123doks.com/thumbv2/123dok/2368618.2744240/30.893.264.674.191.417/gambar-grafik-tingkat-ovulasi-ovulation-rate-or.webp)