Fakta dan Faktor-faktor Destruktif bagi Karang
Tingkat tumpang tindih dampak yang terjadi pada ekosistem terumbu karang semakin meningkat dengan adanya fenomena alam yang menyebabkan pemutihan karang. Istilah pemutihan karang itu sendiri didefinisikan oleh Brown (1997) sebagai pemutihan karang yang diikuti dengan lepasnya symbiotik alga (zooxanthellae) dan atau peluluhan pigmennya. Selanjutnya secara sistemik
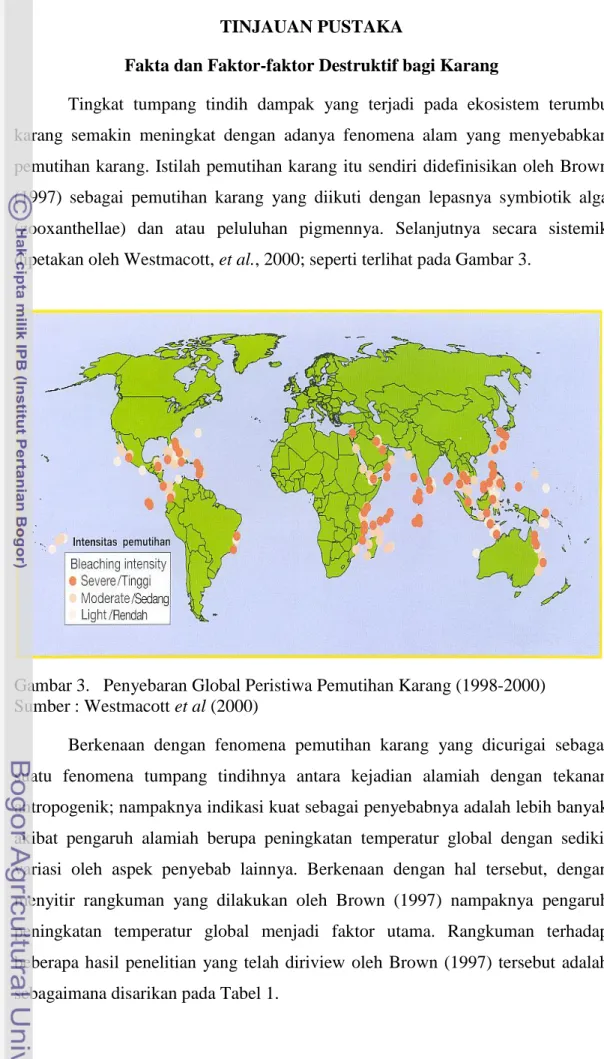
dipetakan oleh Westmacott, et al., 2000; seperti terlihat pada Gambar 3.
Gambar 3. Penyebaran Global Peristiwa Pemutihan Karang (1998-2000)
Sumber : Westmacott et al (2000)
Berkenaan dengan fenomena pemutihan karang yang dicurigai sebagai suatu fenomena tumpang tindihnya antara kejadian alamiah dengan tekanan antropogenik; nampaknya indikasi kuat sebagai penyebabnya adalah lebih banyak akibat pengaruh alamiah berupa peningkatan temperatur global dengan sedikit variasi oleh aspek penyebab lainnya. Berkenaan dengan hal tersebut, dengan menyitir rangkuman yang dilakukan oleh Brown (1997) nampaknya pengaruh peningkatan temperatur global menjadi faktor utama. Rangkuman terhadap beberapa hasil penelitian yang telah diriview oleh Brown (1997) tersebut adalah sebagaimana disarikan pada Tabel 1.
Tabel 1. Rangkuman Tentang Identifikasi Pemutihan Karang akibat beberapa Stressor
No Stressor Observasi Penelitian
Lapangan
Observasi Laboratorium
1 Peningkatan temperatur air laut
Glynn, 1993 Hoegh-Guldberg dan Smith, 1989; Glynn dan DCroz, 1990, Lesser et at., 1990; Igleas Prieto et al., 1992 2 Penurunan temperatur air
laut
Coles dan Fadlalah, 1991; Kobluk dan Kysonko, 1994
Muscatine et al., 1991; Gates et al., 1992
3 Peningkatan Irradiance Fisk dan Done, 1985; Glesson dan Wellington, 1993; Brown et al., 1994; Glesson dan Wellington, 1995
Hoegh-Guldberg dan Smith, 1989; Lesser, 1989, Lesser et at., 1990; Lesser dan Shik, 1989
4 Kombinasi pengaruh peningkatan temperatur dan Irradiance
Harriot, 1985; Brown dan Suharsono, 1990; Williams dan Bunkley-Williams, 1990; Brown et al, 1995
Lesser et al., 1990; Glynn et al., 1992
5 Penurunan salinitas Goreau, 1964; Van Woesik et al., 1995; De Vantier et al., in press
Fang et al., 1995 6 Bakterial dan infeksi
lainnya
Upon dan Peters, 1986; Kushmoro et al., 1996
Kushmoro et al., 1996 Sumber : Brown, 1997
Berdasarkan keterangan di atas, nampak bahwa penyebab pemutihan karang dapat bermacam-macam. Namun demikian indikasi terjadinya perubahan pemutihan karang secara global lebih banyak disebabkan oleh pengaruh peningkatan temperatur; meskipun dalam skala lokal indikasi pengaruh irradian yang dalam hal ini terutama pengaruh sinar ultraviolet diuraikan beberapa peneliti juga memberikan andil. Pengaruh pencahayaan terutama direspon oleh fitobiotik yang dalam hal ini zooxanthella dengan cara memacu proses eksitasi elektronik. Mekanisme eksitasi elektronik ini secara rinci dikemukakan oleh Page (1990) bahwa apabila cahaya ini kuat mengenai fitobiotik maka dapat menyebabkan proses luluhnya pigmen, sehingga selanjutnya pigmen tidak mampu melakukan reduksi dalam proses fotosintesis. Ini berarti bahwa secara luas pengaruh temperatur lebih dominan dengan dampak penyebaran yang luas. Meskipun demikian, secara teoritis memang dampak peningkatan irradiance dapat mempengaruhi photosistem I dan II terhadap zooxanthellae. Namun apabila mengacu kepada proses pelepasan zooxanthellae sebagaimana diinformasikan
oleh Fang et al., (1998), maka pemutihan karang lebih ditentukan oleh karang
dalam merespon stress lingkungan. Dalam hal ini dipicunya katalisis temperatur
dengan meningkatnya produk calmodulin yang selanjutnya memacu
dapat terjadi pemecahan sel yang diikuti oleh keluarnya zooxanthellae dari jaringan endoderm karang. Dengan demikian secara substansial efek temperatur lebih dominan dibandingkan efek radiasi matahari. Meskipun hal terakhir dapat
menyebabkan peluluhan pigmentasi (chlorophyll c) (Rivers et al., 2002; Bynagle
et al., 2003). Ini dipertegas oleh hasil penelitian Brown et al., (1994) bahwa retraksi jaringan secara nyata dipengaruhi oleh adanya pengaruh temperatur. Akibat antropogenik tidak diinformasikan memberikan pengaruh yang berarti terhadap pemutihan karang sebagaimana dilakukan pengakajian di beberapa
wilayah Indonesia (Edinger et al., 1998).
Pada masa yang akan datang dengan semakin meningkatnya berbagai aktivitas hulu terhadap ekosistem karang, diperkirakan akan lebih meningkatkan tekanan terhadap ekosistem ini. Indikasi ini semakin menguat dengan telaah representatif terhadap pola pemanfaatan sumberdaya pesisir yang selama ini berlangsung khususnya di Indonesia dan di Asia Tenggara umumnya (Westmacott
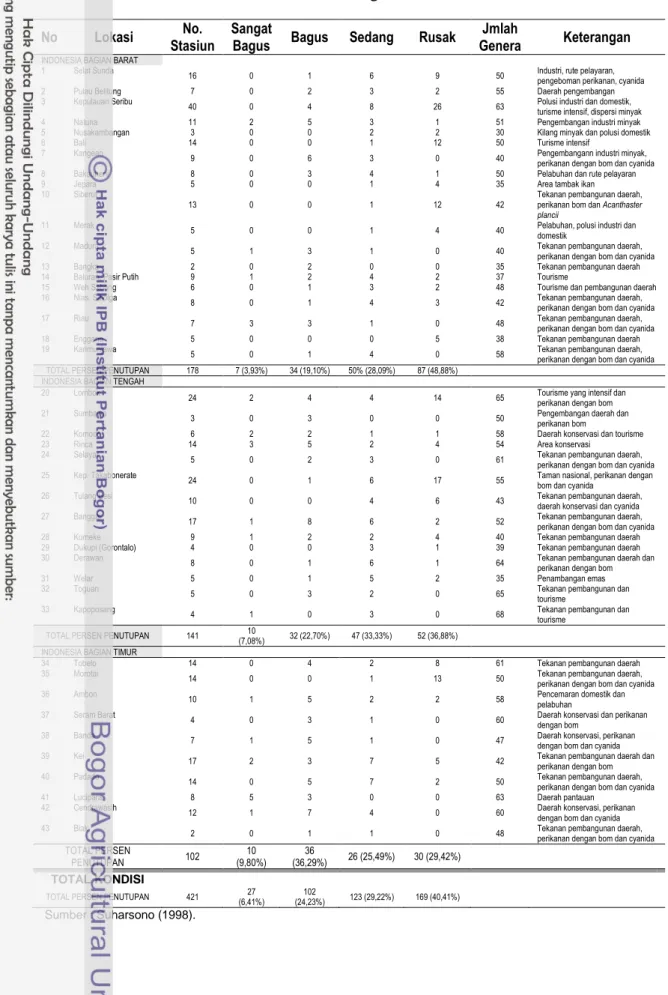
et al., 2000). Kondisi kualitas terumbu karang saat ini di perairan Indonesia juga menambah ke arah indikasi tersebut (Tabel 2; Suharsono, 1998). Kepunahan ekosistem ini sangat merugikan dipandang dari berbagai sudut. Secara ekologis kehilangan ekosistem ini dapat menyumbangkan kerugian yang tidak sedikit mengingat bahwa ekosistem ini adalah salah satu penyumbang terbesar terhadap produksi ikan bersih di kawasan pantai; di samping keindahannya yang juga tidak ditemukan lagi dan yang jauh lebih penting potensi genetik serta berbagai potensi obat-obat penting akan ikut musnah.
Bioekologi Zooxanthellae dan Karang
Kekuatan kalsifikasi karang oleh hubungan fungsionalnya dengan zooxanthellae melalui aktivitas fotosintesis di dalam jaringan tubuhnya seperti
halnya setua konsep stromatolites dari precambrian. Hal ini tercermin dari
terlaksananya karang membangun strukturnya juga dalam membangun suatu varietas yang besar dari binatang yang berkelakuan sebagaimana tanaman karena adanya simbiosis. Simbiosis karang dengan zooxanthellae berlangsung efektif karena alga ini tidak hanya memasok nutrien yang diperlukan inangnya (karang) akan tetapi juga memasok dalam bentuk produksi primer bersih. Jadi terumbu
Tabel 2. Kondisi Kesehatan Terumbu Karang di Indonesia
No Lokasi Stasiun No. Sangat Bagus Bagus Sedang Rusak Genera Jmlah Keterangan
INDONESIA BAGIAN BARAT
1 Selat Sunda 16 0 1 6 9 50 Industri, rute pelayaran,
pengeboman perikanan, cyanida
2 Pulau Belitung 7 0 2 3 2 55 Daerah pengembangan
3 Kepulauan Seribu 40 0 4 8 26 63 Polusi industri dan domestik,
turisme intensif, dispersi minyak
4 Natuna 11 2 5 3 1 51 Pengembangan industri minyak
5 Nusakambangan 3 0 0 2 2 30 Kilang minyak dan polusi domestik
6 Bali 14 0 0 1 12 50 Turisme intensif
7 Kangean 9 0 6 3 0 40 Pengembangann industri minyak,
perikanan dengan bom dan cyanida
8 Bakauheni 8 0 3 4 1 50 Pelabuhan dan rute pelayaran
9 Jepara 5 0 0 1 4 35 Area tambak ikan
10 Siberut
13 0 0 1 12 42 Tekanan pembangunan daerah, perikanan bom dan Acanthaster plancii
11 Merak 5 0 0 1 4 40 Pelabuhan, polusi industri dan
domestik
12 Madura 5 1 3 1 0 40 Tekanan pembangunan daerah,
perikanan dengan bom dan cyanida
13 Bangka 2 0 2 0 0 35 Tekanan pembangunan daerah
14 Baluran, Pasir Putih 9 1 2 4 2 37 Tourisme
15 Weh Sabang 6 0 1 3 2 48 Tourisme dan pembangunan daerah
16 Nias. Sibolga
8 0 1 4 3 42 Tekanan pembangunan daerah, perikanan dengan bom dan cyanida
17 Riau 7 3 3 1 0 48 Tekanan pembangunan daerah,
perikanan dengan bom dan cyanida
18 Enggano 5 0 0 0 5 38 Tekanan pembangunan daerah
19 Karimunjawa 5 0 1 4 0 58 Tekanan pembangunan daerah,
perikanan dengan bom dan cyanida TOTAL PERSEN PENUTUPAN 178 7 (3,93%) 34 (19,10%) 50% (28,09%) 87 (48,88%)
INDONESIA BAGIAN TENGAH
20 Lombok 24 2 4 4 14 65 Tourisme yang intensif dan
perikanan dengan bom
21 Sumbawa 3 0 3 0 0 50 Pengembangan daerah dan
perikanan bom
22 Komodo 6 2 2 1 1 58 Daerah konservasi dan tourisme
23 Rinca 14 3 5 2 4 54 Area konservasi
24 Selayar 5 0 2 3 0 61 Tekanan pembangunan daerah,
perikanan dengan bom dan cyanida
25 Kep. Takabonerate 24 0 1 6 17 55 Taman nasional, perikanan dengan
bom dan cyanida
26 Tulang Besi 10 0 0 4 6 43 Tekanan pembangunan daerah,
daerah konservasi dan cyanida 27 Banggai
17 1 8 6 2 52 Tekanan pembangunan daerah, perikanan dengan bom dan cyanida
28 Kumeke 9 1 2 2 4 40 Tekanan pembangunan daerah
29 Dukupi (Gorontalo) 4 0 0 3 1 39 Tekanan pembangunan daerah
30 Derawan 8 0 1 6 1 64 Tekanan pembangunan daerah dan
perikanan dengan bom
31 Welar 5 0 1 5 2 35 Penambangan emas
32 Toguan 5 0 3 2 0 65 Tekanan pembangunan dan
tourisme
33 Kapoposang 4 1 0 3 0 68 Tekanan pembangunan dan
tourisme TOTAL PERSEN PENUTUPAN 141 (7,08%) 10 32 (22,70%) 47 (33,33%) 52 (36,88%)
INDONESIA BAGIAN TIMUR
34 Tobelo 14 0 4 2 8 61 Tekanan pembangunan daerah
35 Morotai 14 0 0 1 13 50 Tekanan pembangunan daerah,
perikanan dengan bom dan cyanida 36 Ambon
10 1 5 2 2 58 Pencemaran domestik dan pelabuhan
37 Seram Barat 4 0 3 1 0 60 Daerah konservasi dan perikanan
dengan bom
38 Banda 7 1 5 1 0 47 Daerah konservasi, perikanan
dengan bom dan cyanida
39 Kei 17 2 3 7 5 42 Tekanan pembangunan daerah dan
perikanan dengan bom
40 Padado 14 0 5 7 2 50 Tekanan pembangunan daerah,
perikanan dengan bom dan cyanida
41 Lucipara 8 5 3 0 0 63 Daerah pantauan
42 Cendrawasih 12 1 7 4 0 60 Daerah konservasi, perikanan
dengan bom dan cyanida
43 Biak 2 0 1 1 0 48 Tekanan pembangunan daerah,
perikanan dengan bom dan cyanida
TOTAL PERSEN
PENUTUPAN 102 (9,80%) 10 (36,29%) 36 26 (25,49%) 30 (29,42%)
TOTAL KONDISI
TOTAL PERSEN PENUTUPAN 421 (6,41%) 27 (24,23%) 102 123 (29,22%) 169 (40,41%) Sumber : Suharsono (1998).
Karang yang ada sekarang mempunyai produktivitas kotor yang sebanding dengan produksi ekosistem terestrial.
Kata simbiosis didefinisikan sebagai hidup bersama dengan organisme
yang berbeda. Endosimbiont (organisme yang hidup dalam binatang) secara
umum diistilahkan dengan nama zooxanthellae, zoochlorellae dan cyanobacteria, yakni sebagai nama origin dalam dasar taksonomi, tetapi sekarang dideskripsikan sebagai suatu kompleks taksa yang secara luas saling melengkapi dalam taksonomi tanaman atau binatang. Zooxanthellae sendiri merupakan dinoflagellata laut yang ditemukan dalam beberapa invertebrata tropis termasuk karang (Trench, 1979). Dalam perkembangannya, penamaan zooxanthellae berkembang sebagai kumpulan dari beberapa familia dan mungkin klas dari dinoflagellata laut (Blank dan Trench, 1985; Roman dan Power, 1991). Secara formal maupun informal penamaan dari kelompok tersebut sesuai dengan taksonomi alga yang tetap
diaplikasikan dalam identifikasinya pada endosimbiont dalam jaringan polip
karang. Zooxanthellae secara efektif sekarang diartikan dengan endosymbiotik dari produser primer.
Berdasarkan klasifikasinya maka zooxanthellae dikelompokkan sebagai mikroalga dengan klas dinoflagellata (Borneman, 1998). Dikemukakan lebih lanjut bahwa eksistensi biota ini mulai diketahui sebagai sel yang berada di dalam jaringan karang pada 1881. Awal mula nomenklaturnya dinamakan
Zooxanthellae nutricula. Kemudian dengan berkembangnya teknik identifikasi, jenis ini ditemukan sebagai jenis yang masuk dalam klas dinoflagellata pada tahun 1922. Dalam perkembangannya maka penamaan zooxanthellae berubah yaitu
dengan nama Symbiodinium sp; Gymnodinium sp; Symbiodinium microadriaticum
dan Zooxanthellae microadriaticum.
Sejak tahun 1970-1980 sebagaimana diinformasikan oleh Borneman (1998) pengetahuan tentang keberadaan zooxanthellae dalam karang terdiri dari hanya satu jenis. Namun setelah diketahui tentang pengaruh beberapa aspek faali dan lingkungan serta tampilan fenotipnya maka mulai ditemukan adanya bermacam jenis zooxanthellae. Zamani (1995) merangkum beberapa pendapat
aspek tersebut, yaitu : morfologi, struktur tubuhnya, infectivitas, photoadaptif, isoenzym, steropol dan bentuk isoelektrik dari protein peridinium dalam
chlorophyll c-nya. Selanjutnya, dengan ditemukannya Symbiodinium pilosum dan
Symbiodinium kawaguti yang ditemukan pada Montipora verrucosa, maka sejak itu ditemukan banyak jenis dari zooxanthellae. Berkenaan dengan hal tersebut,
Trench (1979) menginventaris beberapa clade zooxanthellae yang bervariasi,
yaitu sebagaimana diinfomasikan pada Tabel 3.
Tabel 3. Beberapa Zooxanthellae yang berasosiasi dengan Cnidaria
No Jenis Zooxanthellae Karang Inang
1 Symbiodinium Sp Oculina divisa
2 Symbiodinium Sp. Millepora dichotoma 3 S. microadriaticum Cassiopeia xamachana
4 S. goreauii Ragactis lucida
5 S. kawaguti Montipora verrucosa
6 S. pilosum Zoanthus sociatus
7 S. meandrinae Meandrina meandrites
8 S. pulchorum Aiptasia pulchellae
9 S. cariborum Condylactus gigantean
10 S. bermudense Aiptasia pallida
11 S. californicum Anthopleua elegantissima 12 Symbiodinium Sp Acropora cervicornis (high ligh) 13 Symbiodinium Sp Acropora cervicornis (low ligh) 14 Gledinium visucum Millepora dichotoma (low ligh)
Sumber : Trench (1979)
Sorokin (1993) mengemukakan bahwa beberapa clade zooxanthellae yang
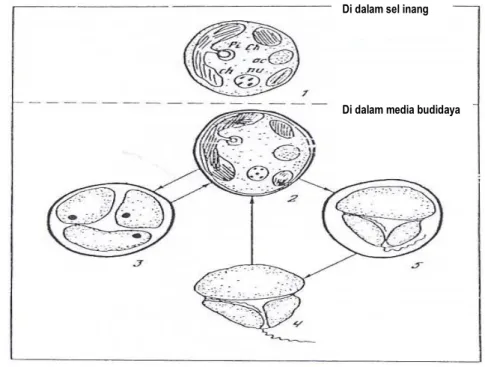
hidup pada beberapa inang mempunyai ciri yang mirip seperti ukuran selnya, morfologi, komposisi pigmen dan siklus hidupnya. Siklus hidup zooxanthellae tersebut didasarkan kepada tahap perubahan pergerakan tubuhnya. Dalam hal ini nampak adanya perbedaan bentuk tubuh antara dalam jaringan inang dengan dalam hidup bebasnya di perairan. Merangkum beberapa temuan selama masa budidayanya, Sorokin (1993) menyajikan siklus hidup zooxanthellae dalam 4 bentuk (Gambar 4) : (1) Bentuk yang bersifat tetap (immotil) berupa cyst dengan
kulit sel yang keras; (2) Bentuk gymnodinium flagella; (3) Zoosporangia yang
mengandung zoozpora motil yang besar; (4) Zoozporangia yang mengandung 2
atau 3 zoospora nonmotil. Dari bentuk tersebut zoospora yang motile dapat
berenang secara aktif dan dapat terpenetrasi pada polip karang muda dan dalam jaringan coelenterata simbiotik lainnya.
Gambar 4. Skema Siklus Hidup Zooxanthellae
Sumber : Sorokin (1993)
Keterangan :
A. Zooxanthellae dalam jaringan inang 1. Cyst zooxanthellae dalam jaringan inang Pi = Pyrenoid
Ch = Chloroplast Ac = Accumulatif body Nu = Nucleus
B. Zooxanthellae dalam media budidaya 2. Cyst dengan dinding yang keras 3. Zoosporangia
4. Zoospora motil 5. Zoospora immotil
Sejak 1970, semua dinoflagellata simbiotik dianggap sebagai species
endemik tunggal Symbiodinium microadriaticum Freudenthal (Taylor, 1974).
Dengan berkembangnya ragam penelitian lanjutan yang meliputi perilaku (behavior), fisiologi dan ultrastruktural sebagaimana diinformasikan oleh Baker
(2003); La Jeunesse (2001); Santos et al. (2001), secara genetik dijumpai
bermacam jenis Symbiodinium. Perkembangan mengenai ragam clade
zooxanthellae dikemukakan beberapa peneliti sebagai berikut : 1. Clade A, B dan C diperoleh oleh Rowan dan Powers (1991). 2. Clade D diperoleh oleh Carlos et al. (1999).
Di dalam sel inang
G
3. Clade E (Symbiodinium californium ditemukan oleh La Jeunesse dan Trench, 2000).
4. Clade F ditemukan oleh La Jeunesse, 2001.
5. Clade G ditemukan oleh Pochon et al. (2001) dan yang terbaru adalah 6. Clade H ditemukan oleh Pochon et al. (2004).
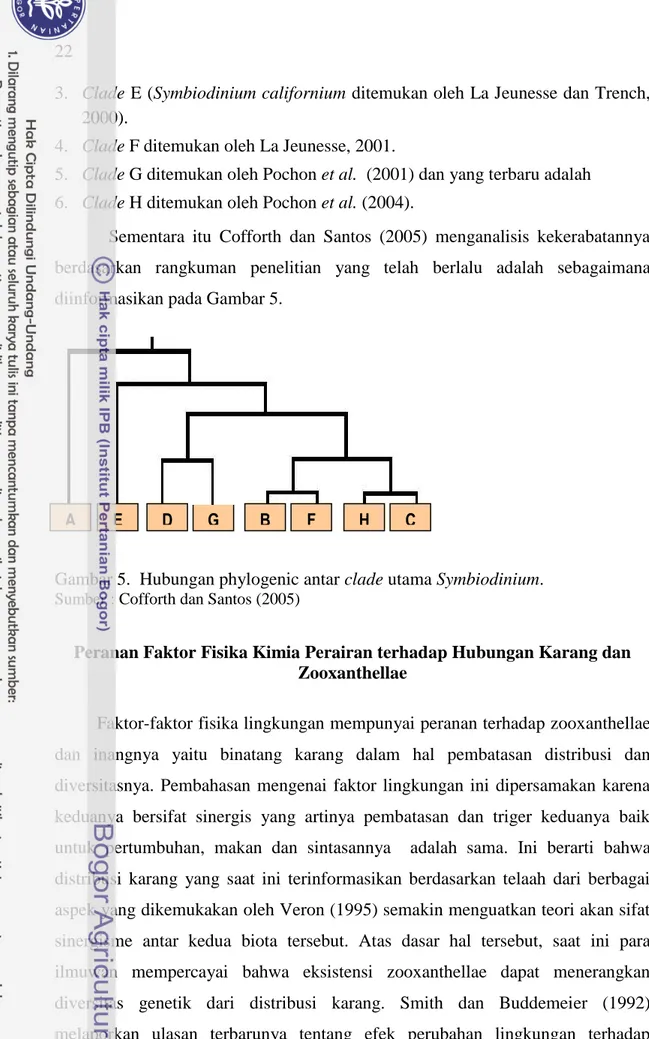
Sementara itu Cofforth dan Santos (2005) menganalisis kekerabatannya berdasarkan rangkuman penelitian yang telah berlalu adalah sebagaimana diinformasikan pada Gambar 5.
Gambar 5. Hubungan phylogenic antar clade utama Symbiodinium.
Sumber : Cofforth dan Santos (2005)
Peranan Faktor Fisika Kimia Perairan terhadap Hubungan Karang dan Zooxanthellae
Faktor-faktor fisika lingkungan mempunyai peranan terhadap zooxanthellae dan inangnya yaitu binatang karang dalam hal pembatasan distribusi dan diversitasnya. Pembahasan mengenai faktor lingkungan ini dipersamakan karena keduanya bersifat sinergis yang artinya pembatasan dan triger keduanya baik untuk pertumbuhan, makan dan sintasannya adalah sama. Ini berarti bahwa distribusi karang yang saat ini terinformasikan berdasarkan telaah dari berbagai aspek yang dikemukakan oleh Veron (1995) semakin menguatkan teori akan sifat sinergisme antar kedua biota tersebut. Atas dasar hal tersebut, saat ini para ilmuwan mempercayai bahwa eksistensi zooxanthellae dapat menerangkan diversitas genetik dari distribusi karang. Smith dan Buddemeier (1992) melaporkan ulasan terbarunya tentang efek perubahan lingkungan terhadap ekosistem terumbu karang. Berikut adalah beberapa telaah variable fisik kimia
perairan yang mempunyai peranan penting dalam memperngaruhi distribusi karang beserta endosimbionnya.
Temperatur
Temperatur adalah peubah yang berperan dalam mengendalikan distribusi horizontal dari terumbu karang. Hanya yang memenuhi syarat ini oleh beberapa rujukan yang mungkin adalah efek dari arus dalam pendistribusian dari planula karang (Veron, 1995). Meskipun pernyataan ini pada akhir-akhir ini ditentang, namun hal tersebut tetap menjadi satu dari beberapa pernyataan yang berlangsung terus dalam literatur biologi karang.
Pandangan yang telah bertahan lama dimana saat ini tidak banyak didukung adalah bahwa distribusi terumbu karang dibatasi oleh distribusi karang; dan bahwa hal ini secara umum menyangkut proses fisiologi khususnya dalam hal penangkapan pakan dan reproduksi. Logika alternatifnya adalah bahwa temperatur membatasi keduanya baik terumbu karang dan karang melalui proses interaksi ekologi, dimana kebutuhan energi (cahaya dan hubungan simbiosis) dari terumbu karang secara progresif menjadi kurang kompetitif melawan dominasi makroalga dalam ekosistem. Selang waktu efektif dari temperatur minimum bagi karang dan terumbu karang adalah berbeda. Bagi biota karang, temperatur minimum efektif adalah temperatur yang menyebabkan kematiannya di lingkungan alami. Dalam hal ini terjadi pada habitat karang yang terus menerus atau berulang-ulang selama periode tertentu (dalam jam sampai dengan mingguan) mendapat aliran massa air dengan suhu rendah. Adapun temperatur minimum efektif untuk ekosistem terumbu karang adalah pada suatu kondisi mana konstruksi terumbu tidak dapat dipertahankan. Ini juga berkaitan dengan siklus lingkungan alam, tetapi terjadi dalam rangka waktu yang sangat lama, yakni puluhan bahkan ratusan tahun.
Sejak diawali penelitian oleh Dana (1843); Vaughan (1918 dan 1919); Davis (1928); Yonge (1940) kemudian berturut-turut Vaughan dan Wells (1943); Wells (1954a dan 1957); Stoddart (1969) yang kesemuanya itu dirangkum dalam
Veron (1995); Rosen (1984) mengemukakan bahwa temperatur 18oC yang terus
menerus dalam periode waktu tertentu diidentifikasi sebagai temperatur minimum air laut yang secara fungsional terumbu masih dapat bertahan hidup normal.
Korelasi ini baru-baru ini diuji ulang dalam rentang temperatur dan dicatat di Jepang oleh Veron dan Minchin (1992) dan ditemukan benar. Temperatur rendah sering tercatat di lingkungan terumbu karang, tapi dalam sebagian kasus hanya ditemukan adanya kematian parsial (dimana bagian koloni karang mati) atau meliputi terumbu karang yang secara geologis merupakan hasil peninggalan lampau atau secara primer terdiri dari runtuhan yang tidak terkonsulidasi. Fluktuasi temperatur dalam jangka pendek di terumbu karang Teluk Teluk (Arab dan Parsia) (Coles dan Fadlallah, 1991) diketahui sebagai temperatur minimum.
Semua karang akan mati jika terbuka sampai dengan tidak normal oleh pengaruh temperatur rendah yang abnormal, juga organisme lainnya. Sangat
sedikit zooxanthellae karang diketahui dapat mentolerir temperatur di bawah 11oC
pada kondisi alamiah. Oulastrea crispata di Semenanjung Noto Laut Jepang dapat
mentolerir temperatur pada kira-kira 0oC (Tidak diketahui dalam periode
waktunya) dan nampaknya zooxanthellae tetap tinggal (Veron dan Minchin,
1992). Siderastrea radians diketahui tercatat hidup dan toleran pada temperatur
4,5 oC (Veron, 1995).
Sebagian besar informasi dari studi tentang toleransi pada temperatur rendah dilakukan di Selat Tanabe dan dekat Kushimoto Jepang Selatan; dimana
species Acropora, Porites, Echinophyllia, Hydnophora dan Leptastrea mengalami
tekanan secara fisiologis pada temperatur 9,4oC (Fukuda, 1974 dalam Veron dan
Minchin, 1992). Studi ini ketika dikombinasikan dengan peneliti lain (Veron, 1992) tentang distribusi regional, memperlihatkan bahwa terdapat kawasan-kawasan tertentu yang mempunyai perbedaan toleransi species karang terhadap temperatur minimum dan bahwa kesuburan atau kekayaan species di kawasan marginal setidak-tidaknya mendapat setengah tekanan toleransi fungsionalnya dari temperatur yang menerpanya.
Catatan lain dari kelangsungan hidup akibat temperatur rendah ditemukan hampir sama, yang dapat dirangkum sebagaimana uraian berikut :
a. Solenastrea hyades di utara Carolina (Macintyre dan Pilkey, 1969 dalam
b. Acropora Sp, Porites Spp dan Platygyra daedalea di Teluk Persia dan Teluk
Arab pada temperatur 11oC oleh Coles dan Fadlallah (1991).
c. Montipora Spp di P. Yaeyama pada temperatur kurang dari 13oC (Nomura,
dalam Veron dan Minchin, 1992).
Pada kisaran temperatur serupa juga ditemukan di Florida dan selatan Victoria
Australia bahwa karang dengan jenis Plesiastrea versipora dan dua jenis
Coscinarea dapat hidup dengan baik (Davis, 1982; dan Burn, 1985).
Catatan tentang toleransi pada temperatur rendah, pada akhirnya bahwa karang dapat menyebar lebar baik dari segi taksonomi maupun secara geografis. Karang selalu mengalami kematian partial dan secara sekuensial akan mengalami pemulihan. Observasi yang relevan diperoleh bahwa sebagian besar penulis mengemukakan bahwa kematian terbesar terjadi di perairan dangkal, dimana udara dingin terjadi. Hubungan yang sama tepat antara rata-rata temperatur minimum air laut permukaan dan mortalitas dapat dilihat di Kushimoto, dimana
temperatur minimum rata-rata bulanan sekitar 15,3oC. Acropora hyacinthus
sebagai species karang dominan di kawasan tersebut menderita meskipun tidak
mengalami kematian saat temperatur menurun mencapai 13,7oC pada tahun 1980.
Beberapa diantaranya mengalami pemutihan dan sebagian mati pada temperatur
13,4oC kemudian kematian secara luas terjadi pada tahun 1984 saat temperatur
mencapai 13,2oC (Misaki, 1980 dalam Veron dan Minchin, 1992). Dalam studi
tersebut, temperatur kritis untuk bertahan hidup adalah 2oC di bawah rataan
temperatur minimum bulanan. Kematian serupa akan dijumpai oleh species lain, dan studi juga memperlihatkan bahwa variasi kematian yang luas akan terjadi saat lamanya perubahan itu berlangsung.
Kematian juga tidak hanya berkaitan dengan temperatur sebagai faktor pembatas distribusi karang. Kompetisi dengan makroalga (Crossland, 1984), variasi aktivitas metabolik (khususnya kalsifikasi)(Crossland, 1984), reproduksi; adalah juga akibat temperatur yang secara potensial berperan sebagai pembatas. Dari hal tersebut, kompetisi dengan makroalga nampaknya menyebabkan karang mengalami invasi terutama di lokasi lintang tinggi di Indo Pasifik dan mungkin
juga terjadi pada lokasi lainnya. Kesimpulan yang dapat diutarakan dari catatan data di Jepang bahwa :
a. 22,5% dari total diversitas species karang dapat mentolerir temperatur
minimum 10,4oC.
b. 27% dari total diversitas species karang dapat mentolerir temperatur minimum
13,2oC.
c. 40% dari total diversitas species karang dapat mentolerir temperatur minimum
14,1oC.
Data statistik ini mengabaikan penjelasan tentang frequensi dan lama waktu ditemuinya karang pada variasi temperatur, sehingga mereka secara konservative
menunjukkan bahwa setengah dari semua karang mentolerir temperatur 14oC,
juga bahwa setengah dari species sisanya mentolerir temperatur 4oC kurang dari
temperatur minimum yang tercatat di lingkungan terumbu karang di Jepang. Ini adalah fakta yang kuat yang menunjukkan bahwa pembangunan terumbu tidak dibatasi oleh toleransi karang pada temperatur rendah.
Pada saat hampir mati, sebagian besar pengaruh temperatur rendah pada
karang adalah terhadap morfologinya. Beberapa species Acropora pada lintang
ekstrim di Jepang berbentuk deretan bertingkat yang melebur tidak teratur dengan plates-nya (tempat lekatan yang mati). Pembatasan pertumbuhan ini nampaknya merupakan bagian dari kematian partial dan pemulihannya. Veron dan Minchin (1992) mencatat bahwa pemulihan jenis tersebut dapat cepat melebihi pemulihan
akibat bahaya Acanthaster. Di Tateyama (lokasi karang paling utara dunia)
karang juga ditemukan; semua jenis kecuali Alveopora japonica yang tumbuh luar
biasa, pertumbuhannya merata dalam bentuk encrusting dan beberapa (seperti
Blastomosa wellsi) mempunyai perbedaan struktur corralite. Hal yang mirip terjadi pada karang yang hidup pada lintang tinggi di Australia juga mempunyai perbedaan morfologi serta struktur corralitenya, tetapi secara fisiologis tidak mengalami halangan atau tekanan dari faktor lingkungannya. Jika riset dilakukan tanpa rujukan bentuk koloni di kawasan lintang rendah, maka morfologi yang dijumpai menunjukkan keberadaan species karang di lintang tinggi dan jika mirip morfologinya di amphitropikal diyakini sebagai perpindahan tempat dari distribusi karang tropis. Bagaimanapun, morfologi ini memperlihatkan eksistensi dari
subspecies secara geografik, walau satu jenis adalah secara primer ditentukan oleh lingkungan dari pada perbedaan genetik.
Sedikit data yang tersedia tentang laju pertumbuhan karang pada
temperatur rendah yang ekstrim. Rata-rata pertumbuhan dari jenis Acropora,
diukur di Kushimoto dan subtropis Kuroshima masing-masing adalah 19 dan 99 mm/th (Veron dan Minchin, 1992). Crossland (1984) menyimpulkan bahwa temperatur rendah merupakan determinan (penentu) primer, sedangkan cahaya merupakan determinan sekunder dari pertumbuhan dan kelangsungan hidup
Acropora formosa di Pulau-pulau Houtman Abrolhos barat. Secara nyata karang-karang di pulau-pulau ini nampaknya tumbuh dengan melimpah dan merupakan tingkat produksi karbonat yang relatif tinggi seperti di terumbu karang tropis (Smith, 1981).
Tekanan temperatur panas tidak seperti tekanan yang dialami oleh karang pada temperatur dingin, yakni bukan merupakan fenomena pembatasan dispersi karang dan juga tidak merupakan pengaruh batas-batas lintang. Secara prinsipil,
pengaruh temperatur panas menyebabkan breakdown (kerusakan) simbiosis
karang dengan zooxanthellae yang diekspresikan dalam bentuk keluarnya
zooxanthellae dari jaringan sel karang atau yang lebih dikenal dengan istilah coral
bleaching (pemutihan karang). Meskipun tekanan temperatur tinggi dapat terjadi di daerah terumbu karang lintang tinggi (seperti di Hawaii; Jokiel dan Coles,
1990; di Bermuda, Cook et al., 1990), namun hal itu cenderung terjadi dalam areal
yang sempit di kawasan ekuator dan secara umum ini berkaitan dengan saat surut atau surut yang tidak normal. Pada skala biogeografi, tekanan temperatur panas
selalu berkorelasi dengan fluktuasi cuaca harian yang mana El Nino Southern
Oscillation (ENSO) telah diketahui pengaruhnya yang sangat penting (Guzman dan Cortes, 1992).
Di barat Pasifik, ENSO dapat meningkatkan pemanasan sampai 2-3oC dari
temperatur normal untuk beberapa bulan dan kemungkinkan pada gilirannya menyebabkan bleaching yang luas dan bahwa menyebabkan kematian seperti observasi yang telah dilakukan di Indonesia pada tahun 1983 oleh Brown dan Suharsono (1990); dan di tempat lain pada periode tahun 1986-1987 dan
1989-1990 (Williams dan Bunkley Williams, 1989-1990). Bagaimanapun ENSO berhubungan dengan elevasi temperatur yang mungkin mempunyai dampak nyata terhadap biogeografi hanya di sepanjang timur Pasifik, dimana mereka menerima pengaruh tersebut. Secara langsung ataupun tidak langsung dapat mengakibatkan
bleaching karena massa airnya melewati kawasan ini (Lessios et al., 1983; Glynn,
1984) dan mungkin juga menyebabkan kepunahan/kematian massal dari Acropora
di sini. Karena efek dari fluktuasi ENSO sinergis dengan surut yang ekstrim pergerakan massa air menuju sepanjang timur Pasifik, menyebabkan fluktuasinya mungkin berpengaruh terhadap kawasan yang dilaluinya karena adanya halangan oleh Tanah Genting Amerika Tengah, pada akhirnya mereka ini menjadi penting seperti Barrier Pasifik timur dalam memelihara keterisolasian kawasan.
Nilai pembatas temperatur tinggi yang secara ekologis berpengaruh
terhadap karang maksimum adalah 30oC - 34oC (Jokiel dan Coles, 1990; Glynn,
1984; Hoegh-Guldberg dan Smith, 1989). Nilai maksimum ini secara geografis dan dengan waktu yang terbuka keterpengaruhannya, dengan toleransi lebih tinggi
dari 2 oC dari lokasi tropis atau daerah sedang (temperate)(Coles et al, 1976).
Temperatur yang optimum untuk pertumbuhan mempunyai variasi yang lebar dengan ketersediaan nutrien dan mempunyai sifat sinergis dengan pengaruh
salinitas dan cahaya (Coles dan Jokiel, 1978) dan optimum pada temperatur 26 oC
seperti yang laporkan di karang yang ada di Hawaii (Jokiel dan Coles, 1990).
Musim
Valentines (1984) mengemukakan hipotesis bahwa secara progressive
musim mempunyai peranan penting dalam meningkatkan pembangunan strategi untuk ketahanan populasi karang yang menurun sebagai suatu implikasi adanya gradien lintang dimana species menetap pada suatu lintang bukan sebagai penipisan species, sebagaimana halnya dengan karang. Namun demikian, musim menjadi suatu isu terhadap adaptasi keberadaan karang di lintang tinggi (Crossland, 1984; Dodge dan Lang, 1983); meskipun pendapat tersebut ditentang oleh Smith (1981). Dalam hal ini Smith (1981) lebih condong pengaruhnya terutama dalam hal efek terhadap laju kalsifikasi dan pertumbuhan. Hal yang lebih nyata, musim secara besar berpengaruh terhadap kompetisi khususnya dengan makroalga. Kalsifikasi dan produktivitas primer, keduanya kurang terpengaruh
secara musim di daerah tropis (Chalker et al., 1984). Tetapi kompetisi dengan makroalga merupakan faktor pembatas pertumbuhan pada terumbu karang dekat pantai. Hal ini disebabkan oleh kawasan khususnya pada saat musim hujan akan mengalami masukan massa air dengan beragam polutan pembatas kehidupan karang.
Cahaya
Kemampuan karang untuk membangun terumbu adalah dengan cara memanfaatkan energi dari cahaya matahari. Hal ini menjadi kunci bagi eksistensi pandangan teori terumbu karang yang modern dan juga bisa jadi untuk semua terumbu karang dalam skala geologi. Cahaya, bukan temperatur jelas sekali secara ekologis merupakan pembatas dari pada semua parameter fisika lingkungan, oleh sebab itu nampaknya menunjukkan bahwa cahaya dapat menyebabkan pembatasan secara fisik terhadap biogeografi secara horizon. Kepentingan cahaya, dari kajian biogeografi dan evolusi adalah terkait dengan evolusi dari proses simbiosis karang dengan alga simbionnya yang berperan dalam pembangunan terumbu karang yang melampaui waktu evolusi itu sendiri. Terkait dengan hal tersebut dan dalam peran cahaya, hal ini sinergis dengan adanya sedimentasi lingkungan, dimana pengaruhnya akan dapat menyebabkan hilang/tenggelamnya diversitas secara ekologis.
Kebutuhan cahaya bagi zooxanthellae terkait dengan sifatnya sebagai klorofil tanaman yang diperlengkapi dengan pigmen. Menurut Meeks (1974) dinyatakan bahwa distribusi pigmen chlorophyll bervariasi diantara familia alga. Chlorophyl-a merupakan pigmen fotolitik primer dari semua familia, sementara chlorophyl lain seperti b, c (c1,c2 dan c3) serta d mempunyai distribusi terbatas dan hanya pelengkap atau sebagai pigmen fotolitik sekunder. Chlorophyl-b adalah ciri dari tanaman hijau dan ditemukan dalam alga chlorophyceae, Euglenophyceae dan beberapa tanaman tingkat tinggi. Chlorophyl ini mempunyai suatu fungsi sebagai pigmen pemanen cahaya, mentransfer energi cahaya yang diserap kepada chlorophyll-a untuk photosystem primer (Meek, 1974). Rasio Chlorophyl-a : chlorophyll-b berkisar dari 2:1 sampai dengan 3:1 dalam fitoplankton. Chlorophyl-c ditemukan pada sekelompok tanaman coklat seperti cryptophyceae,
dinophyceae, rhaphidophyceae, chrysophyceae, bacillariophyceae, xanthophyceae dan phaeophyceae (Meek, 1974). Komponen chlorophyl-c mengandung 3 komponen yang secara spectruk berbeda nyata, yaitu chlorophyl-c1, c2 dan c3. Dalam hal ini chlorophyl-c2 selalu berada dalam dinophyceae (zooxanthellae termasuk dalam kelompok ini; baik yang hidup bebas maupun alga simbiotik). Apabila ditelusur lebih lanjut bahwa variabilitas cahaya yang ada sebagaimana dikemukakan oleh Glynn (1993); Gleason (1993) dicirikan oleh kepekatan, dimana kesesuaian lokasi dengan kesesuaian adaptasinya dicirikan oleh semakin pekat, tidak diinformasikan tentang perbedaan warna. Tingkat kepekatan itu dimungkinkan oleh sifat fotoadaptif dari zooxanthellae. Peridinin dan pigmen caretenoid lain dalam sel zooxanthellae merupakan komposisi spesifik dari kelompok dinoflagellata sebagai kompleks protein pigmen. Komposisi ini secara kuat merespon cahaya hijau pada kisaran panjang gelombang 490 - 540 nm.
Secara faktual dapat dinyatakan bahwa cahaya dapat berubah dengan lintang dari variasi musiman terhadap panjang hari dan kisaran efek dari sudut jatuhnya cahaya terhadap karang dan simbionnya (Campbell dan Aarup, 1989) sebagaimana ketergantungannya dengan kedalaman. Kemungkinan pengaruh keberadaan cahaya terhadap distribusi karang pada berbagai kedalaman dan lintang mempunyai perbedaan kecil pada kecerahan perairan, temperatur, pertumbuhan musiman makroalga, kebutuhan cahaya yang specifik dari zooxanthellae dan mekanisme fotoadaptasi (adaptasi terhadap cahaya). Di Izu
Jepang (35o LU) dan Pulau Lord Howe (31,5o LS) serta Pulau-pulau Houtman
Abrolhos (28,5o LS) karang secara reguler ditemukan pada perairan jernih
kedalaman 30 m dan kadang juga ditemukan di kedalaman 40 m dimana suatu substrat horizontal yang sesuai tersedia. Ketersediaan cahaya nampaknya tidak membatasi karang pada kedalaman tersebut. Pada kenyataannya efek dari keberadaan dari zooxanthellae oleh Veron (1995) diinformasikan bahwa
zooxanthellae berubah dengan kedalaman secara signifikan pada Montastrea
annularis. Oleh sebab itu dinyatakan bahwa kedalaman dan lintang membatasi distribusi zooxanthellae.
Nutrien dan Faktor Biotik
Nutrien dan faktor-faktor biotik mempunyai variasi regional yang luas sehingga dampak yang terjadi dari berbagai aktivitas secara luas juga akan mengikutinya dalam skala waktu yang tidak diketahui. Konsekuensi dari antropogenik akibat masukan nutrien dalam skala biogeografi (di Great Barrier Reef, Yellowless, 1991) sedikit diketahui tetapi secara signifikan terutama terkait dengan perubahan iklim global (Wilkinson dan Buddemeier, 1984). Perubahan
biotik terhadap komunitas karang oleh Acanthaster plancii telah diketahui secara
luas (Guzman dan Curtez, 1989; Done, 1992), dimana hal ini memberikan suatu konsekuensi terhadap pola distribusi karang maupun komposisi species yang ada di terumbu karang tersebut.
Berdasarkan hal tersebut di atas, nampak bahwa pembatasan antara zooxanthellae dengan karang mempunyai hubungan yang erat. Proses pembatasan ini pernah pula dilakukan eksperimen terhadap pengaruh temperatur sebagaimana
dilakukan oleh Bynagle et al. (2003). Dikemukakan bahwa proses pelepasan
zooxanthellae dari inang karang pada terjadi temperatur 31oC. Selanjutnya
diinformasikan bahwa proses tersebut dapat dipacu dengan pengaruh perlakuan penyinaran ultraviolet.
Secara biologis proses keluarnya zooxanthellae dari inang terdiri dari
beberapa mekanisme. Menurut Gates et al. (1992) mekanisme tersebut adalah :
(a) exocytosis yaitu suatu proses keluarnya sel (dalam hal ini zooxanthellae) dari
jaringan polyp karang (baik dari endoderm, mesoglea atau ectoderm) menuju keluar baik dari tiap lapisan menuju lapisan luarnya atau keluar dari polyp; (b)
apoptosis yaitu proses keluarnya sel mati dari jaringan polyp karang; (c) necrosis
yaitu suatu proses keluarnya zooxanthellae dari polyp karang yang disertai
dengan degradasi coenosarcnya (calsium) dan bahkan disertai dengan seluruh
polyp karang; (d) pinching off yaitu proses keluarnya zooxanthellae disertai
dengan vacuolanya serta (e) host cell detachment yaitu suatu proses keluarnya
zooxanthellae beserta jaringannya. Tiga mekanisme terakhir merupakan mekanisme akibat tekanan lingkungan, seperti akibat tekanan suhu atau tekanan akibat kuatnya pencahayaan. Sementara mekanisme keluarnya zooxanthellae secara alamiah yaitu pengeluaran zooxanthellae mati dan zooxanthellae hidup
akibat pengaturan densitas internal cenderung melalui mekanisme exocytosis dan apoptosis.
Mekanisme pelepasan zooxanthellae dari inang diperlihatkan oleh Zamani (1995) dari studi efek Cu dan peningkatan temperatur pada sea anemon. Dijelaskan bahwa dengan meningkatnya temperatur maka akan terjadi penurunan densitas zooxanthellae, peningkatan area vacuola dengan waktu. Demikian pula dengan peningkatan kadar Cu. Secara selular diterangkan bahwa ada dua mekanisme pelepasan zooxanthellae, yaitu : (1) Adanya degradasi insitu dari zooxanthellae dan (2) Pelepasan zooxanthellae ke coelenteron (Gambar 6).
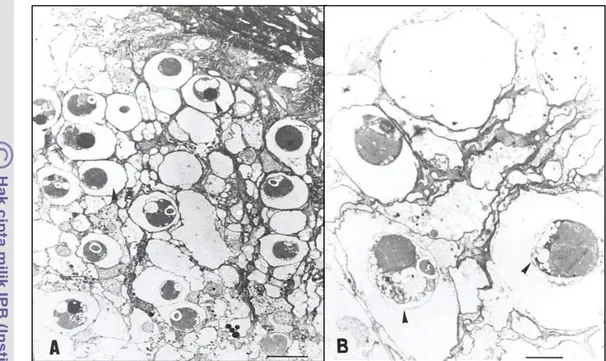
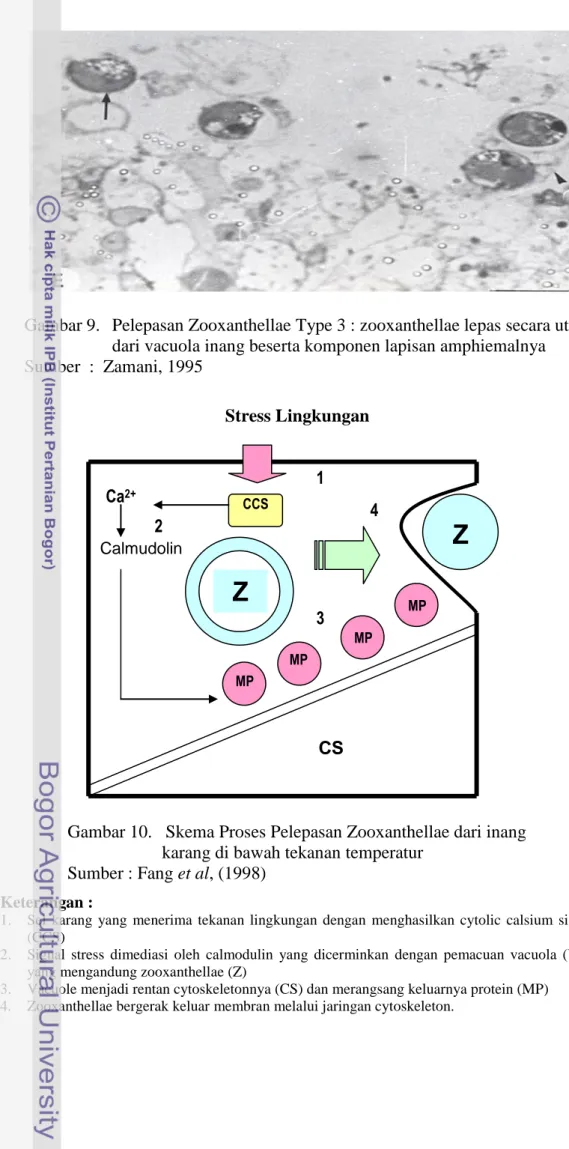
Dari kedua mekanisme tersebut dalam prosesnya terdapat tiga tipe pelepasan zooxanthellae dari jaringan inangnya, yaitu : (a) Type I : zooxanthellae menyelimuti cytoplasma inang (Gambar 7); (b) Type II : zooxanthellae secara parsial atau menyeluruh dikelilingi oleh sisa-sisa jaringan (Gambar 8) dan (c) Type III : zooxanthellae lepas secara utuh dari vacuola inang beserta komponen lapisan amphiemalnya (Gambar 9). Hal terakhir diperlihatkan oleh penelitian
Fang et al, (1998) adalah sebagaimana disajikan pada Gambar 10.
Gambar 6. Pelepasan zooxanthellae ke coelenteron Sumber : Zamani, 1995
Gambar 7. Pelepasan Zooxanthellae Type 1 : zooxanthellae menyelimuti cytoplasma inang
Sumber : Zamani, 1995
Gambar 8. Pelepasan Zooxanthellae Type 2 : zooxanthellae secara parsial atau menyeluruh dikelilingi oleh sisa-sisa jaringan
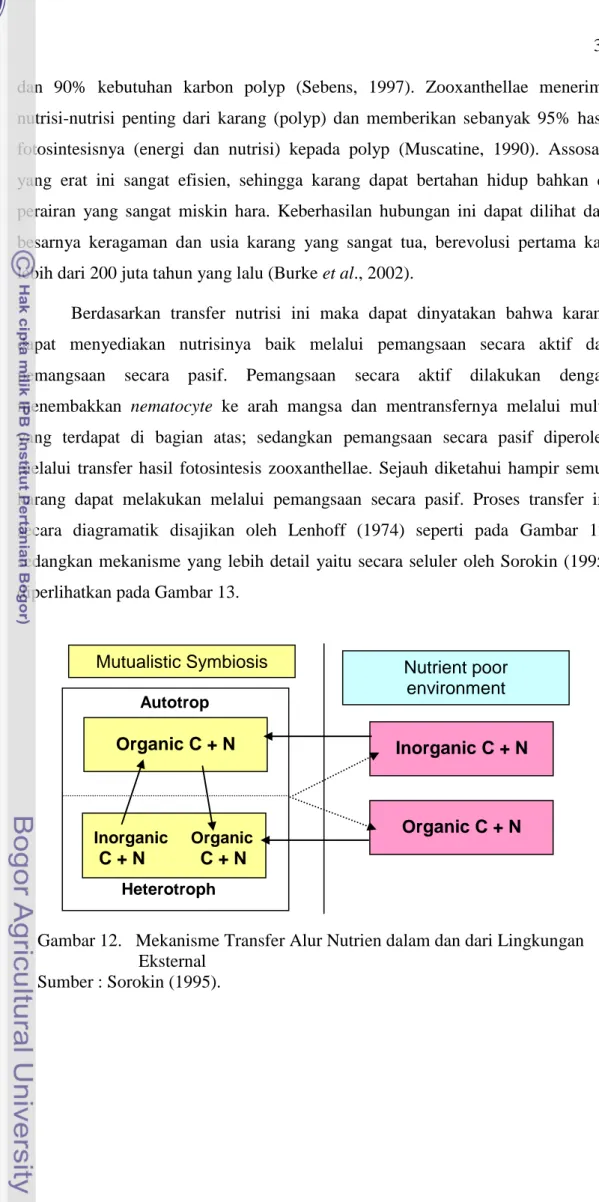
Stress Lingkungan
Calmudolin
Gambar 10. Skema Proses Pelepasan Zooxanthellae dari inang karang di bawah tekanan temperatur
Sumber : Fang et al, (1998)
Keterangan :
1. Sel karang yang menerima tekanan lingkungan dengan menghasilkan cytolic calsium signal (CCS)
2. Signal stress dimediasi oleh calmodulin yang dicerminkan dengan pemacuan vacuola (VO) yang mengandung zooxanthellae (Z)
3. Vacuole menjadi rentan cytoskeletonnya (CS) dan merangsang keluarnya protein (MP) 4. Zooxanthellae bergerak keluar membran melalui jaringan cytoskeleton.
Gambar 9. Pelepasan Zooxanthellae Type 3 : zooxanthellae lepas secara utuh dari vacuola inang beserta komponen lapisan amphiemalnya Sumber : Zamani, 1995
Z
Z
MP MP MP MP CCS Ca2+ CS 1 2 3 4Proses Simbiosis Zooxanthellae dan Peran Fungsionalnya
Sejak berabad-abad lalu dan bahkan hingga saat ini, karang (Scleractinia)
dianggap sebagai batu atau tumbuhan walaupun sesungguhnya mereka merupakan hewan. Karang itu sendiri merupakan salah satu kelompok Coelenterata berbentuk polyp yaitu semacam bentuk tabung dengan mulut di bagian atas yang dikelilingi oleh tentakel. Secara morfologis, binatang ini berbentuk mirip satu dengan lainnya; pembedanya adalah keragaman rangka yang dibentuknya. Oleh sebab itu, taksonomi karang didasarkan kepada rangka bentukannya. Karena kemampunnya
ini maka karang bersifat menetap (sessile). Dengan tipe hidup ini membawa
konsekuensi terhadap sifat konservatif dalam kehidupannya.
Salah satu sifat konservatif dari biota karang adalah adanya proses simbiosis dengan zooxanthellae. Proses terbentuknya simbiosis atau yang dikenal dengan endosimbiosis ini mengundang perdebatan sejak awalnya, yakni apakah
terbentuknya endosimbiosis sejak anakan karang (planula) mulai dilepaskan oleh
induknya atau melalui transduksi dari lepasan planula yang keluar tanpa pembekalan (Veron, 1995). Apabila teori pertama yang terjadi maka awal evolusinya akan mengalami proses pembekalan zooxanthellae yang kemudian secara turun temurun mengalami proses pertumbuhan di dalam jaringan polip karang. Di sini tidak memperdebatkan keduanya, namun lebih ditekankan bahwa pada kenyataannya terdapat endosimbiosis dengan perannya yang besar dalam mekanisme kehidupan fungsional binatang karang. Profil relokasinya oleh Muscatine (1974) diperlihatkan sebagaimana disajikan pada Gambar 11.
Pada kondisi awal evolusi dipahami bahwa simbiosis antara zooxanthellae dengan karang dalam ekosistem laut pada dasarnya merupakan suatu kejadian yang diawali oleh adanya bertemunya zooxanthellae dengan karang dengan peluang yang tinggi oleh sebab karang hidup menetap dan zooxanthellae bersifat planktonik. Bertemunya keduanya merupakan suatu fenomena dengan peluang yang besar oleh adanya kondisi dinamik air laut. Perez (1982) mengemukakan bahwa proses pengenalan dan pada akhirnya relokasi zooxanthellae pada karang merupakan fenomena respon biotik sebagai turunan dari aktivitas fisik dinamik air
laut dan proses interkoneksitas kimiawi. Dengan demikian peluang bertemunya keduanya sangat dimungkinkan terjadi di laut dengan dua pertimbangan tersebut.
Gambar 11. Penampang Lintang Jaringan karang dan Konsentrasi zooxanthellae di dalamnya
Keterangan :
Epi = epiderm lapisan permukaan jaringan polip karang M = mesoglea
En = endodermis lapisan dalam jaringan polip karang Zx = zooxanthellae
Sumber : Muscatine (1974)
Terapan fungsional simbiosis pertama-tama dapat ditinjau dari kaitannya dengan transfer nutrisi diantara keduanya. Dalam memenuhi nutrisinya semua karang dapat menggunakan tentakelnya untuk menangkap mangsa (plankton). Proses penangkapannya mempergunakan bantuan nematocyte suatu bentuk protein spesifik yang mampunyai kemampuan proteksi dan melumpuhkan
biomassa tertentu seperti zooplankton. Meskipun mempunyai kemampuan feeding
active (memangsa secara aktif), akan tetapi kebanyakan proporsi terbesar makanan karang berasal dari simbiosis yang unik, yaitu zooxanthellae. Zooxanthellae ini merupakan alga uniselluler yang bersifat mikroskopik hidup dalam berbagai jaringan tubuh karang yang transparan dan menghasilkan energi langsung dari cahaya matahari melalui fotosintesis.
Biasanya mereka ditemukan dalam jumlah yang besar dalam setiap polyp hidup bersimbiosis dan memberikan warna pada polyp, energi dari fotosintesis
dan 90% kebutuhan karbon polyp (Sebens, 1997). Zooxanthellae menerima nutrisi-nutrisi penting dari karang (polyp) dan memberikan sebanyak 95% hasil fotosintesisnya (energi dan nutrisi) kepada polyp (Muscatine, 1990). Assosasi yang erat ini sangat efisien, sehingga karang dapat bertahan hidup bahkan di perairan yang sangat miskin hara. Keberhasilan hubungan ini dapat dilihat dari besarnya keragaman dan usia karang yang sangat tua, berevolusi pertama kali
lebih dari 200 juta tahun yang lalu (Burke et al., 2002).
Berdasarkan transfer nutrisi ini maka dapat dinyatakan bahwa karang dapat menyediakan nutrisinya baik melalui pemangsaan secara aktif dan
pemangsaan secara pasif. Pemangsaan secara aktif dilakukan dengan
menembakkan nematocyte ke arah mangsa dan mentransfernya melalui mulut
yang terdapat di bagian atas; sedangkan pemangsaan secara pasif diperoleh
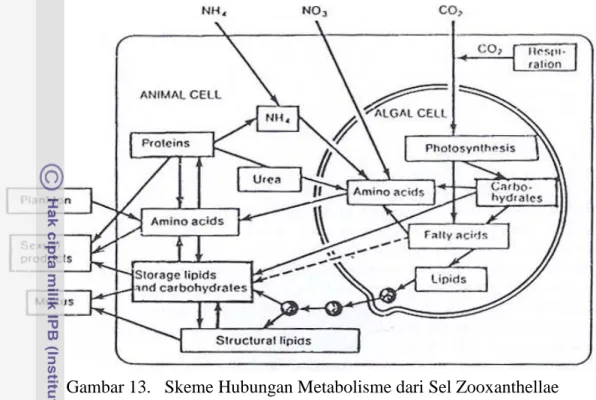
melalui transfer hasil fotosintesis zooxanthellae. Sejauh diketahui hampir semua karang dapat melakukan melalui pemangsaan secara pasif. Proses transfer ini secara diagramatik disajikan oleh Lenhoff (1974) seperti pada Gambar 12, sedangkan mekanisme yang lebih detail yaitu secara seluler oleh Sorokin (1995) diperlihatkan pada Gambar 13.
Autotrop
Heterotroph
Gambar 12. Mekanisme Transfer Alur Nutrien dalam dan dari Lingkungan Eksternal Sumber : Sorokin (1995). Organic C + N Inorganic Organic C + N C + N Organic C + N Inorganic C + N
Mutualistic Symbiosis Nutrient poor
Karang mempunyai bentuk rangka untuk menyokong badannya yang sederhana. Karang pembentuk terumbu mempunyai kerangka dari kalsium karbonat yang proses pembentukannya memerlukan waktu lama sebagai hasil dari simbiosisnya dengan zooxanthellae (Lenhoff, 1974). Karang ini kebanyakan dari
kelompok scleractinia yang dikenal sebagai hermatipik atau pembentuk terumbu.
Berdasarkan hal tersebut, maka dapat dinyatakan bahwa simbiosis mempunyai peran penting dalam proses kehidupan karang. Adanya simbiosis, maka secara phototropikal dapat memperpanjang kehidupan karang dalam suatu periode tertentu.
Secara nyata keadaan yang merugikan dari ketergantungan terhadap cahaya timbul karena kebutuhan dari simbiosis alamiah. Sejauh diketahui, hanya sedikit sekali species karang dapat bertahan secara fakultatif (karang yang dapat hidup untuk jangka waktu tak terbatas dengan atau tanpa adanya zooxanthellae
atau yang biasa disebut aposymbiosis), yakni hanya Astrangia danae (Jasques,
1983) dan Madracis Sp termasuk dalam kelompok ini.
Gambar 13. Skeme Hubungan Metabolisme dari Sel Zooxanthellae dalam Inang Polip
Dengan demikian menjadi jelas bahwa konsep simbiosis menjadi demikian penting dalam kehidupan karang dan kelestarian ekosistem bentukannya. Hubungan intra maupun ekstraspesifik yang terus berlangsung dalam proses pembentukan kestabilan ekosistem terumbu karang secara filosofis termasuk dalam konsep microevolusi yang ditampilkan oleh hubungan simbiosis antara zooxanthellae dan binatang karang.