1 BAB I PENDAHULUAN
A.Latar Belakang Masalah
Titanium dioksida (TiO2) merupakan bahan semikonduktor yang banyak
digunakan untuk aplikasi dalam bidang fotokatalis (Lu et al., 2007), sel surya
(Chiba et al., 2006), antiburam (Farahmandjou & Khaili, 2013), antibakteri
(Gupta et al., 2013), antijamur (Wolfrum et al., 2002), lapisan pelindung cat
(Salthammer et al., 2007), dan pembersih air limbah (Li et al., 2003). Aplikasi
TiO2 dalam kehidupan sehari-hari di atas dapat digunakan karena TiO2 bersifat
tidak toksik, memiliki kestabilan kimia tinggi, dan reaktivitas fotokatalitik yang
tinggi serta bersifat inert (Wade, 2005).
Penelitian tentang TiO2 berkembang pesat dalam bidang fotovoltaik,
fotokatalis, dan superfotohidrofil. Fotoaktivitas TiO2 terjadi karena proses kimia
akibat transisi elektron dari pita valensi ke pita konduksi. Energi celah pita
memiliki peran penting dalam transisi elektron. Energi celah pita berkaitan dengan
tipe struktur TiO2. TiO2 memiliki 11 tipe struktur. Tiga diantaranya terdapat di
alam dalam bentuk mineral yang stabil yaitu anatas, rutil, dan brookit (Banfield &
Veblen, 1992). Tipe struktur anatas memiliki energi celah pita 3,2 eV; Rutil 3,0
eV; dan brookit 3,4 eV (Wunderlich et al., 2004). Energi celah pita anatas lebih
tinggi daripada rutil sehingga fotoaktivitas anatas lebih baik daripada rutil
(Hoffman et al., 1995). Energi celah pita TiO2 menyebabkan fotoaktivitas TiO2
hanya dapat mengabsorbsi energi foton pada daerah ultraviolet (200-400) nm
2
matahari memiliki 5% emisi sinar ultraviolet yang sampai ke permukaan bumi
(Garcia, 2003). Oleh karena itu, perlu dilakukan usaha untuk meningkatkan
fotoaktifitas TiO2 antara lain dengan pengontrolan ukuran, morfologi, dan tipe
struktur. Pengontrolan tipe struktur meliputi pH, temperatur, tekanan, metode,
teknik sintesis serta penggunaan prekusor titanium dioksida.
TiO2 dapat disintesis dengan berbagai metode, antara lain: metode sol-gel
(Seo et al., 2001), solvotermal (Jolivet et al.,2000), plasma (Irie et al., 2003),
deposition-precipitation (Idakiev et al., 2005), reduksi sederhana (Nino-Martinez
et al., 2008), hidrotermal (Hong et al., 2009), pengendapan (Zhao et al., 1998) dan
refluks (Aini & Sutrisno, 2013). Khan et al. (2006) telah berhasil mensintesis
TiO2 nanotube dengan kristalinitas tinggi melalui perlakuan post-treatment
dengan merefluks TiO2 dengan asam peroksida (H2O2). Hasil yang diperoleh yaitu
kristalinitas TiO2 meningkat setelah direfluks sehingga mengindikasikan material
tersebut dapat diaplikasikan dengan baik sebagai fotokatalisis. Kondisi pH refluks
dapat mempengaruhi hasil sintesis titanium dioksida. Ichzan, dkk (2015) telah
mensintesis TiO2 dengan metode kopresipitasi pada variasi pH larutan prekusor
dalam kondisi basa yaitu 9,11, dan 12. Hasil penelitian menunjukkan bahwa
ketiga jenis pH memiliki fasa anatas dan menghasilkan ukuran butir serbuk TiO2
yang berbeda. Ukuran butir serbuk TiO2 terkecil pada sampel pH 9. Penelitian lain
oleh Diamandescu et al. (2008) juga mensintesis TiO2 pada pH basa dan
menghasilkan TiO2 berstruktur anatas. Senyawa basa yang sering digunakan
3
(Idakiev et al., 2005), LiOH dan KOH (Braun et al., 1992; Sikhwivhilu et al.,
2009).
Prekusor merupakan bahan dasar yang digunakan untuk sintesis. Prekusor
yang dapat digunakan dalam sintesis antara lain: TiCl4 (Kamegawa et al., 2009),
Ti(O)2.O.2H2O (Sutrisno, 2012), TiO2 (Richmond et al., 2011). Fatimah (2009)
meneliti tentang dispersi TiO2 ke dalam SiO2-montmorillonit untuk mendapatkan
TiO2 yang homogen di dalam padatan SiO2-montmorillonit dengan pengaruh
prekusor. Prekusor titanium isopropoksida (TTIP) menunjukkan karakter
fisikokimiawi lebih baik dibandingkan dengan titanium tetraklorida (TiCl4), dan
titanium oksida klorida (TiOCl2).
Beberapa penelitian yang pernah dilakukan untuk meningkatkan efisiensi
aktivitas fotokatalis TiO2 antara lain dengan sintesis nanokristalin TiO2 (Yu et al.,
2004), penyisipan dopan (Wang et al., 2008), dan penambahan zat pensensitif
(sensitizer) (Yu et al., 2003). Material dopan dan zat pensensitif (sensitizer) yang
biasa digunakan diantaranya adalah kobalt (Diantoro dkk., 2010), timbal (Tahta
dkk., 2012), nitrogen (Lynch et al., 2015), kadmium sulfida (Yu et al., 2003),
emas (Ramasamy et al., 2009), kadmium dan seng (Li et al., 2007), perak (Wang
et al., 2008).
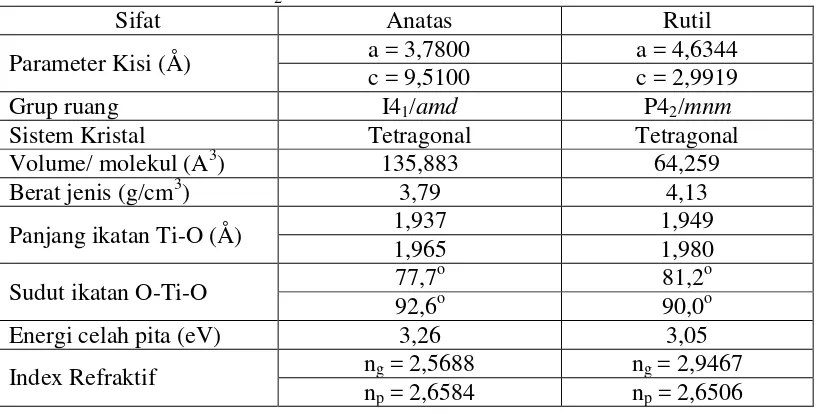
Zat pensensitif perak memiliki konduktivitas yang baik dan stabil secara
kimiawi (Yeo et al., 2003). Golongan perak halida terkenal sebagai material yang
peka cahaya dan secara luas digunakan sebagai bahan sumber dalam fotografis
film menyerap foton dan melepaskan sebuah elektron dan lorong positif. Salah
4
meneliti tentang modifikasi kimia TiO2 secara in-situ dengan penambahan
Ag/AgCl dan porous magnesian (PM) atau imporous magnesian (IM)
menunjukkan bahwa aktifitas fotokatalitik terhadap dekomposisi gas benzena dari
Ag/AgCl/TiO2/PM 3.28 × 10−4% Ag dengan kecepatan reaksi (k = 2,36 × 10−2
min-1) adalah 5,21 lebih tinggi dari TiO2/PM (porous magnesian) dan 30,57 kali
lebih tinggi dari TiO2/IM (imporous magnesian). Hasil ini mengusulkan perak
klorida bisa bertindak sebagai zat pensensitif yang dapat digunakan sebagai
fotokatalis.
Temperatur dan waktu sintesis juga sangat berpengaruh terhadap
morfologi dan sifat-sifat TiO2 termodifikasi. Banyak peneliti yang melakukan
sintesis modifikasi TiO2 sebagai fotokatalisator pada temperatur ruang (Kiyonaga
et al., 2008) dengan menggunakan TiO2 sintesis maupun komersial, seperti TiO2
fasa anatas, TiO2 fasa rutil, dan TiO2 (degusa-P25). Sangcay et al. (2012) telah
mensintesis TiO2-AgCl dengan metode sol-gel dan dikalsinasi pada temperatur
400-600 oC. Hasil penelitian menunjukkan bahwa sampel TiO2-AgCl pada 400 oC
selama 2 jam memiliki konsentrasi anatas paling tinggi dan diameter paling kecil
sedangkan penelitian Nursiah (1999) menunjukkan kalsinasi paling baik adalah
550 oC selama 30 menit. Waktu sintesis harus optimal dan selektif mungkin
supaya zat pensensitif dapat menempel pada permukaan TiO2 secara sempurna.
B.Identifikasi Masalah
Berdasarkan latar belakang yang telah dipaparkan diatas, maka hal-hal yang
5
1. TiO2 dapat diaplikasikan untuk berbagai macam fungsi, diantaranya:
fotokatalis, antiburam, sel surya, antibakteri, antijamur, dan lain-lain.
2. Sintesis TiO2 dapat dilakukan dengan berbagai metode.
3. Terdapat beragam jenis basa yang sering digunakan antara lain: NH4OH,
NaOH, KOH, LiOH.
4. Prekusor merupakan bahan dasar untuk menghasilkan produk.
5. Zat pensensitif (sensititizer) digunakan untuk meningkatkan kemampuan
fotokatalitik dalam sintesis modifikasi TiO2.
6. Temperatur sintesis modifikasi TiO2.
7. Waktu sintesis modifikasi TiO2.
C.Pembatasan Masalah
Berdasarkan identifikasi masalah diatas, maka dalam penelitian ini masalah
dibatasi sebagai berikut:
1. Titanium dioksida (TiO2) diaplikasikan sebagai material antiburam.
2. Metode sintesis yang digunakan adalah metode refluks.
3. Basa yang digunakan dalam sintesis adalah NH4OH pekat dengan pH ~10.
4. Prekusor yang digunakan yaitu TiO2 rutil.
5. Zat pensensitif yang digunakan untuk meningkatkan kemampuan fotokatalitik
dalam sintesis modifikasi TiO2 adalah perak klorida, dengan berbagai variasi
perak yaitu 0%; 0,5%; 1,5%; 3%; dan 5%.
6. Sintesis modifikasi TiO2 dilakukan pada temperatur 150 oC.
6 D.Rumusan Masalah
Perumusan masalah dalam penelitian ini adalah sebagai berikut:
1. Bagaimanakah pengaruh variasi perak 0%; 0,5%; 1,5%; 3%; dan 5% pada
material TiO2-tersensitifkan AgCl (TiO2@AgCl) terhadap karakter fisik yang
dihasilkan?
2. Bagaimanakah aktivitas antiburam material TiO2-tersensitifkan AgCl
(TiO2@AgCl) pada berbagai variasi perak 0%; 0,5%; 1,5%; 3%; dan 5%?
E.Tujuan Penelitian
Berdasarkan rumusan masalah di atas, tujuan penelitian ini adalah:
1. Mengetahui karakter fisik material TiO2-tersensitifkan AgCl (TiO2@AgCl)
pada berbagai variasi perak.
2. Mengetahui kemampuan aktivitas antiburam material TiO2-tersensitifkan AgCl
(TiO2@AgCl) pada berbagai variasi perak.
F. Manfaat Penelitian
Manfaat penelitian ini adalah:
1. Meningkatkan pengetahuan terhadap sintesis material TiO2-tersensitifkan AgCl
(TiO2@AgCl).
2. Meningkatkan pengetahuan tentang karakter fisik material TiO2-tersensitifkan
AgCl (TiO2@AgCl).
3. Meningkatkan pengetahuan tentang kemampuan material TiO2-tersensitifkan
7 BAB II
KAJIAN PUSTAKA
A. Deskripsi Teori
1. Nanopartikel Titanium Dioksida
Titanium dioksida berwujud padatan, berwarna putih dengan titik lebur
1855oC, berat molekul 79,90, densitas 4,26 g/cm3. Titanium dioksida tidak larut
dalam air, HCl, HNO3, dan akuaregia tetapi larut dalam asam sulfat pekat
membentuk titanium sulfat (TiSO4) (Cotton et al., 1999). Titanium dioksida
memiliki 3 fase kristal utama yaitu anatas (tetragonal), rutil (tetragonal), dan
brookit (ortorombik). Struktur rutil dan anatas cukup stabil keberadaanya
dibandingkan dengan struktur brookit (Gates, 1991). Anatas merupakan fase
kristal TiO2 yang memiliki aktivitas fotokatalitik paling besar. Kemampuan
fotokatalitik semikonduktor TiO2 dipengaruhi morfologi, luas permukaan,
kristalinitas, dan ukuran partikelnya. Secara termodinamik, anatas kurang stabil
bila dibandingkan dengan rutil, akan tetapi secara kinetik pembentukannya lebih
disukai pada suhu rendah (<600oC).
TiO2 tipe anatas memiliki energi celah pita lebih besar (3,2 eV) daripada
rutil (3,2 eV). Besarnya energi celah pita menggambarkan kemampuan suatu
semikonduktor sebagai fotokatalis. Energi celah pita yang semakin besar
menyebabkan aktivitas fotokatalitiknya meningkat dan ukuran partikelnya
menurun sehingga fotoaktivitas anatas lebih baik daripada rutil (Hoffman et al.,
1995). Energi celah pita terjadi karena transisi elektron dari pita valensi ke pita
8
sedangkan pita valensi berasal dari hasil hibridisasi kulit 2p oksigen. Bentuk
struktur anatas dan rutil dapat dilihat pada Gambar 1 berikut (Kunie & Hrvjoe,
2012).
(a) (b)
Gambar 1. Struktur TiO2 (a) Anatas (b) Rutil
Perbedaan struktur anatas dan rutil adalah pada distorsi dan pola
penyusunan rantai oktahedron. Masing-masing Ti4+ dikelilingi oleh enam ion O2-.
Oktahedral pada struktur rutil mengalami sedikit distorsi ortorombik, sedangkan
anatas distorsi ortorombiknya cukup besar sehingga tidak simetri. Setiap
oktahedron struktur rutil dikelilingi sepuluh oktahedron tetangga, sedangkan pada
struktur anatas hanya dikelilingi delapan oktahedron tetangga. Perbedaan struktur
kisi pada anatas dan rutil menyebabkan perbedaan densitas massa, luas
permukaan, sisi aktif, dan struktur pita elektronik (Linsebigler et al., 1995). Rutil
dan anatas mempunyai struktur kristal yang berbeda (Sugiyama & Takeuchi,
1991; Khitrova et al., 1977; Carp et al., 2004; Cromer & Herrington, 1955; Baur,
9
Tabel 1. Struktur Kristal TiO2 Fasa Rutil dan Anatas.
Sifat Anatas Rutil
Parameter Kisi (Å) a = 3,7800 a = 4,6344
c = 9,5100 c = 2,9919
Grup ruang I41/amd P42/mnm
Sistem Kristal Tetragonal Tetragonal
Volume/ molekul (A3) 135,883 64,259
Modifikasi TiO2 telah banyak dilakukan untuk peningkatan
fotoaktivitasnya. Hal ini karena TiO2 hanya aktif pada sinar ultraviolet (UV),
dimana ketersediannya hanya sekitar 5% dari cahaya matahari yang sampai ke
bumi (Garcia, 2003). TiO2 hanya mampu mengabsorbsi pada daerah (<400 nm)
(Linsebiger et al., 1995 ). TiO2 mempunyai sifat fotokatalitik yang baik pada
daerah panjang gelombang UV tetapi kurang baik pada daerah tampak sehingga
semikonduktor TiO2 tidak cukup efektif bila digunakan di bawah sinar matahari.
Oleh karena itu, perlu usaha untuk menggeser panjang gelombang dan aktivitas
TiO2 dari sinar UV ke panjang gelombang sinar tampak.
Sifat yang mempengaruhi aktivitas fotokatalitik partikel TiO2 meliputi luas
permukaan, kristalinitas, ukuran kristal, dan struktur kristal. Anatas telah
diketahui memiliki aktivitas fotokatalitik yang tinggi karena strukturnya lebih
terbuka dibandingkan dengan rutil. Beberapa modifikasi titania yang umum
10
1. Sensitifikasi permukaan dengan cara eksitasi energi celah pita semikonduktor
dapat menggunakan zat pensensitif seperti AgCl, AgI, AgBr, atau sensor
cahaya.
2. Penurunan ukuran butiran titania yang lebih kecil dikatakan memiliki area
permuakaan yang luas dan hal tersebut menguntungkan karena ada banyak sisi
aktif untuk degradasi dan adsorpsi polutan.
3. Penambahan akseptor elektron ke dalam semikonduktor yang memiliki energi
celah pita yang lebih besar dengan semikonduktor lain yang memiliki energi
celah pita yang lebih kecil yang mengalami fotoeksitasi. Contoh : Sensitifikasi
TiO2 dengan CdS.
4. Penambahan zat doping. Penambahan doping dapat digunakan pada ion logam
dan non logam sebagai zat yang dapat menangkap elektron keluar dari pita
valensi untuk mencegah terjadinya rekombiansi pembawa elektron. Oleh
karena itu, hal ini akan meningkatkan efisiensi fotokatalis (Wen et al., 2009)
Adanya zat pendadah dan zat pensensitif dapat berupa logam maupun
nonlogam mampu menggeser serapan panjang gelombang yang lebih besar
(daerah sinar tampak). Hal ini disebabkan karena terjadi penurunan energi celah
pita oleh elektron pada logam yang mengefisiesikan pemisahan serapan ke daerah
sinar tampak. Choi et al. (1994) telah memperlihatkan pembelajaran sistematis
pada nanopartikel TiO2 terdadah ion logam dengan metode sol-gel berpengaruh
11 3. Perak Klorida
Perak merupakan logam putih dapat dilihat dan ditempa. Rapatannya
tinggi (10,5 g ml-1), tidak larut dalam asam klorida, asam sulfat encer, tetapi dapat
larut dalam asam nitrat pekat. Perak murni memiliki konduktivitas kalor dan
listrik yang sangat tinggi diantara semua logam dan memiliki resistansi
kontak yang sangat kecil. Perak meleleh pada temperatur 960oC dalam suasana
karbon monoksida, menguap pada temperatur sekitar 850oC dan mendidih pada
temperatur 1955oC.
Perak halida terkenal sebagai material yang fotosensitif atau peka cahaya
dan secara luas digunakan sebagai sumber fotografis film. Perak halida menyerap
foton dan membebaskan sebuah elektron dan lorong positif pada proses fotografis
(Hu et al., 2006). Perak klorida merupakan kristal anorganik yang berwarna putih.
Perak klorida memiliki energi celah pita 2,93 eV yang dikenal sebagai sumber
dekomposisi polutan organik (Cao et al., 2011).
Penempelan logam pada permukaan semikonduktor merupakan salah satu
metode modifikasi permukaan semikonduktor. Logam dapat meningkatkan
produk fotokatalitik atau meningkatkan kecepatan reaksi fotokatalitik. Modifikasi
elektronik permukaan semikonduktor melalui deposisi logam dapat dilakukan
dengan menggunakan beberapa logam mulia yang tidak mudah teroksidasi atau
logam transisi seperti platina (Pt), paladium (Pd), emas (Au), perak (Ag), nikel
(Ni), cobal (Co), timah (Sn) dan tembaga (Cu). Pemilihan logam sebagai
penjebak elektron didasarkan pada sifatnya yang tidak mudah teroksidasi atau
12
bertindak sebagai akseptor elektron. Logam Ag yang memiliki potensial
reduksi 0,799 volt. Perubahan potensial negatif dan arus anoda dapat
merespon penyinaran cahaya tampak, sehingga dapat diaplikasikan untuk
fotokatalis.
Mekanisme migrasi elektron pada permukaan semikonduktor yang
termodifikasi logam melalui tahap eksitasi elektron dari pita valensi ke pita
konduksi. Setelah mengalami eksitasi, elektron bermigrasi menuju logam dan
terperangkap dalam logam, sehingga rekombinasi elektron-hole dapat terjadi, dan
hole dapat berdifusi ke permukaan semikonduktor di mana pada permukaan
tersebut akan terjadi oksidasi senyawa-senyawa yang didegradasi. Logam AgCl
mempunyai aktifitas katalitik dan memodifikasi sifat fotokatalitik semikonduktor
melalui perubahan distribusi elektronnya yang terlihat pada Gambar 2 (Cao et al.,
2011).
Gambar 2. Skema Diagram Elektron-hole Proses AgI/AgCl/TiO2
dibawah Sinar Tampak
Penelitian Cao et al. (2011) yang terlihat pada Gambar 2 menunjukkan terjadi
proses transfer elektron dari pita konduksi (CB) AgI ke AgCl kemudian bereaksi
13
dapat mendekomposisis kontaminan organik, sementara itu h+ bergerak dalam
arah yang berlawanan dari pita valensi (VB) AgCl ke AgI atau ke TiO2. Namun,
dalam penelitian ini TiO2, tidak bisa menghasilkan pasangan elektron-hole pada
cahaya tampak dengan energi celah pita (energi celah pita) (Eg = 3.12 eV).
Sementara, h+ bisa mentransfer dari VB AgCl ke TiO2 dengan energi celah pita
sebesar (Eg VB = 2,8 eV) sehingga secara efektif dapat mencegah rekombinasi
pasangan elektron-hole.
Penelitian lain oleh Yan et al. (2013) tentang TiO2 terdoping C, F
ditambahkan AgCl dihasilkan bahwa pemisahan pasangan elektron-hole lebih
efektif dengan adanya AgCl. Pasangan elektron hole pertama kali mengalami
eksitasi oleh cahaya tampak menyebabkan hole berpindah ke permukaan AgCl
dan mengalami oksidasi ion Cl menjadi atom Cl0. Atom Cl0 bertindak sebagai
spesies reaktif terhadap degradasi zat warna. Pada waktu yang sama elektron
dalam TiO2 terdoping C,F mengalami reduksi O2 menjadi O2 radikal.
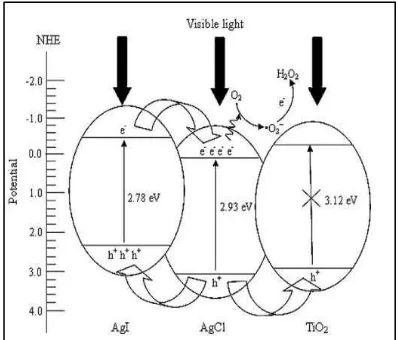
4. Fotokatalisis Titanium Dioksida (TiO2)
Secara umum proses fotokatalisis adalah proses kombinasi antara proses
fotokimia dan katalis. Fotokatalisis didefinisikan sebagai proses sintesis secara
kimiawi dengan melibatkan cahaya sebagai pemicu dan katalis sebagai
pemercepat proses transformasi (Slamet dkk., 2007). Proses fotokatalis
14
Gambar 3. Mekanisme Fotokatalis TiO2
Reaksi fotokatalis dimulai ketika TiO2 diiradiasi oleh sinar UV dan TiO2
menyerap foton (hv) dengan energi yang sebanding atau lebih besar dari energi
celah pitanya.
Tahapan reaksi fotokatalis dapat diuraikan sebagai berikut:
a. Foton (hv) yang diserap oleh TiO2 menyebabkan elektron (e-) pada pita valensi
(VB) tereksitasi ke pita konduksi (CB), dengan meninggalkan hole (h+) pada
pita valensi.
TiO2 + hv TiO2 (h+VB + e-CB)
b. Elektron dan hole dapat mengalami reaksi redoks dengan spesies seperti : OH-,
senyawa organik, atau O2 yang diadsorpsi pada permukaan titania. Elektron
dari pita konduksi akan mengalami reduksi sedangkan hole dari pita valensi
akan mengalami oksidasi.
TiO2 (h+VB) + H2Oads TiO2+ •OHads + H+
15
c. Pembawa muatan h+ mengoksidasi H
2O atau ion OH- menjadi radikal hidroksil
(•OH) yang sangat kuat. •OH mampu memecah polutan yang teradsorpsi di
permuakan titania atau di dalam larutan encer serta mendegradasi polutan
menjadi air dan CO2.
•OH + Dads D+ads + H2O
d. Pita konduksi elektron mereduksi spesies O2 yang teradsorpsi menjadi
superoksida (•O2) kemudian mengalami serangkaian reaksi berikut untuk
menghasilkan •OH.
TiO2 (eCB-) + O2ads + H+ TiO2 + HO2• O2•- + H+
TiO2 (eCB-) + HO2• + H+ H2O2
H2O2 + hv 2HO•
H2O2 + O2•- HO• + O2 + HO-
H2O2 + TiO2 (ecb-) HO• + HO- + TiO2
Oksidasi dan reduksi langsung atau tidak langsung dari polutan yang
teradsorpsi dan spesies lain di dalam larutan encer oleh pembawa mautan yang
terfotogenerasi (h+/e-) menyebabkan polutan mengalami mineralisasi. Jika reaksi
redoks tidak terjadi, energi dan hasil rekombinasi pembawa muatan dilepaskan
dalam bentuk kalor yang menyebabkan reduksi yang sangat besar dalam efisiensi
fotokatalis TiO2.
5. Antiburam
TiO2 secara luas digunakan sebagai fotokatalis untuk konversi energi
matahari dan sebagai material antiburam. Secara teoritik material antiburam
16
bersifat polar atau hidrofilik (suka air). Keadaan permukaan bahan sama sekali
tidak menolak air yang disebut keadaan superhidrofilik (sangat suka dengan air).
Proses fotohidrofilitas memerlukan suatu fotokatalis, pada umumnya pita valensi
TiO2 terisi penuh dan pita konduksi kosong. Prinsip fotohidrofilitas adalah karena
timbulnya hole-elektron jika suatu elektron berpindah dari pita valensi ke pita
konduksi. Timbulnya hole ini akan berinteraksi dengan air sehingga air akan
terurai membentuk radikal OH dan ion hidrogen.
Penurunan sudut kontak air di permukaan TiO2 dapat terjadi oleh
mekanisme yang dapat dijelaskan sebagai berikut (Liciulli, 2002).
a. Pembentukan elektron pada CB dan hole pada VB akibat adanya sinar UV.
TiO2 + hv 2h+ + 2e
-b. Elektron pada CB mereduksi Ti(IV) menjadi Ti(III) menurut reaksi:
Ti4+ + e Ti3+
Selama penyinaran UV, Ti3+ bereaksi dengan oksigen yang terserap di
permukaan dan kembali menjadi Ti4+ menurut reaksi sebagai berikut :
Ti3+ + O2 Ti4+ + O2
2-c. Hole (h+) akan mengoksidasi (O22-) yang berasal dari bridging site oksigen pada
kristal TiO2. Hasil oksidasi yaitu oksigen akan dilepas dan menghasilkan
oksigen vacancies.
4h+ + 2O22- O2 (oxygen vacancies)
d. Adanya oxygen vacancies, permukaan menjadi hidrofilik karena air dapat
dengan mudah mengisi tempat kosong dan menghasilkan grup OH teradsorpsi
17
H2O + h+ •OH + H+
H+ + e- •H
2 •H + O2 2 OH atau •H + OH- H2O
Mekanisme superhidrofilisitas secara ringkas TiO2 terdapat pada Gambar 4
(Sutrisno, 2011).
Gambar 4. Mekanisme Superhidrofilisitas pada Permukaan TiO2
Efek superhidrofilik akan berkurang bila cahaya UV dihentikan (Guan,
2005). Secara sederhana sifat superhidrofilisitas disajikan dalam Gambar 5
(Takeuchi et al., 2005b)
18 6. Karakterisasi TiO2
a. Difraksi Sinar-X (XRD)
Spektroskopi X-ray diffraction atau XRD merupakan salah satu metode
karakterisasi material kristalin untuk menentukan parameter kisi dan struktur
kristal (Handayani & Haryadi, 1998). Cara kerja XRD yaitu serbuk cahaya
monokromatik sinar-X ditembakkan pada kristal, satu pantulan atau difraksi dari
variasi sudut sinar-X akan menunjukkan sinar mula-mula, jika seberkas sinar-X
menumbuk partikel berukuran atom maka sinar tersebut akan dipantulkan oleh
partikel atomik yang ditumbuknya.
Bragg menunjukkan bahwa lebih mudah untuk memperhatikan sinar-X yang
direfleksi dari setumpuk bidang dalam kristal karena hanya bergantung pada sudut
tertentu, yang ditentukan oleh panjang gelombang sinar-X dan ruang antar bidang
dalam kristal itu. Variabel ini dapat dihubungkan melalui persamaan Bragg
(Smallmann,1991) pada Persamaan 1.
2d sinθ = nλ ...(1)
Dimana, n= orde
λ= panjang gelombang sinar monokromatis
d= jarak antar bidang kristal
θ = sudut pola difraksi
19 b. Spektroskopi UV-Vis
Spektrum yang diperoleh untuk senyawa padatan disebut sebagai diffuse
reflectance spectrum (spektrum refleksi). Spektrum ini lebih dikenal sebagai
spektrum elektronik karena spektrum pada daerah tampak ini muncul sebagai
akibat terjadinya transisi elektronik pada orbital dx yang mengalami pembelahan
sehingga memungkinkan elektron mengalami transisi dari tingkat energi rendah
ke tingkat energi tinggi jika elektron itu memperoleh energi yang sesuai (10 Dq).
Energi transisi elektronik ini muncul sebagai puncak pita medan ligan pada
spektrum senyawa yang bersangkutan dapat diketahui posisi panjang gelombang
maksimum dan dihitung energinya.
Bahan yang telah disintesis dapat diketahui besarnya energi celah pita
yang dihasilkan dengan menggunakan metode spektrofotometri UV-Vis Diffuse
Reflektansi. Metode ini didasarkan pada pengukuran intensitas UV-Vis yang
direfleksikan oleh sampel. Reflektansi yang terukur merupakan reflektansi yang
dinyatakan dalam Persamaan 2 :
R’ =
...(2) Nilai ini akan digunakan untuk mengetahui persamaan Kubelka-Munk
(Persamaan 3):
F(R’ )=
...(3)
Persamaan 2 memiliki hubungan dengan parameter k (koefisien absorbansi) dan s
(koefisien hamburan reflektansi difusi), F(R’ )= k/s, sehingga persamaan (4)
20
=
...(4)
Spektrum UV-Vis diffuse reflectance menghasilkan kurva hubungan
antara k/s dengan panjang gelombang (λ) atau absorbansi (A) dengan panjang
gelombang (λ) (Morales et al., 2007). Hubungan absorbansi (A) dengan
reflektansi dinyatakan dalam Persamaan (5) dibawah ini :
A= log
...(5) Perhitungan dilakukan pada setiap sampel dengan menggunakan metode
Kubelka Munk dimana energi celah pita diperoleh dari grafik hubungan antara hv
(eV) dengan (F(R’ )hv)2. Energi celah pita semikonduktor adalah besarnya hv
pada saat (F(R’ )hv)2 = 0 yang diperoleh dari persamaan linier kurva tersebut .
B.Penelitian yang Relevan
Yang et al. (2016) telah meneliti tentang modifikasi kimia TiO2 secara
in-situ dengan penambahan Ag/AgCl dan porous magnesian (PM) atau imporous
magnesian (IM) menunjukkan bahwa aktifitas fotokatalitik terhadap dekomposisi
gas benzena dari Ag/AgCl/TiO2/PM 3.28 × 10−4 % Ag dengan kecepatan reaksi
(k=2,36 × 10−2 min-1) adalah 5,21 lebih tinggi dari TiO2/PM (porous magnesian)
dan 30,57 kali lebih tinggi dari TiO2/IM (imporous magnesian). Hasil ini
mengusulkan perak klorida bisa bertindak sebagai zat pensensitif yang dapat
digunakan sebagai fotokatalis.
Sintesis AgI/AgCl/TiO2 dengan metode pertukaran ion yang dilakukan
oleh Cao et al. (2011) menunjukkan bahwa TiO2 memiliki energi (Eg=3,12 eV),
21
AgCl ke TiO2. Di sisi lain Hu et al. (2006) mensintesis Ag/AgBr/TiO2 dengan
metode deposition-precipitation. Hasil menunjukkan bahwa pada permukaan
katalisator sebagian besar perak berada dalam spesies Ag0 di dalam struktur baik
sebelum maupun setelah reaksi. Spesies Ag0 akan mencari hvb+ kemudian
menangkap ecb- dalam proses reaksi fotokatalitik. Formasi H2O2 mengungkapkan
bahwa •OH dan O2• terbentuk pada saat cahaya tampak menyinari larutan
Ag/AgBr/TiO2 sedangkan spesies oksigen reaktif tidak terbentuk saat cahaya
tampak menyinari sistem Ag0/TiO2. Hasil ini menunjukkan bahwa AgBr
merupakan jenis fotoaktif yang baik untuk mendegradasikan zat warna dan bakteri
di bawah cahaya tampak. Metode deposition-precipitation juga digunakan Hu et
al. (2006) saat mensintesis TiO2@AgI menggunakan basa NaOH pada temperatur
kamar. Katalisator yang dihasilkan menunjukkan efisiensi yang tinggi dalam
mendegradasikan zat warna nonbiodegradable reactive red K-2G di bawah radiasi
cahaya tampak dengan konsentrasi perak 10% selama 150 menit, dan 16% total
belerang pada K-2G dapat diubah menjadi SO42- pada waktu yang sama.
Pengembangan TiO2 dapat digunakan sebagai material antiburam dan
swabersih oleh Bennani et al (2009). Material antiburam memiliki sifat hidrofilik.
Sifat hidrofilik TiO2 yang berada di permukaan suatu material tertentu akan
menyebabkan tetesan air tersebar merata dan tidak membentuk butiran (droplet)
berdasarkan penelitian Wanatabe et al. (2000). Penelitian Fujishima et al. (1999)
menunjukkan bahwa Fenomena hidrofilitas yang terjadi pada permukaan film
TiO2 dan terpapar oleh sinar UV akan mengalami penurunan sudut kontak yang
22 C.Kerangka Berpikir
TiO2 merupakan bahan semikonduktor yang dimanfaatkan sebagai
fotokatalis. Pemanfaatan TiO2 sebagai fotokatalis dapat diaplikasikan pada
antiburam. Material antiburam terbentuk dari suatu elektron dan hole. Hole akan
bereaksi dengan air membentuk radikal hidroksil dan ion hidrogen. Ion
hidrogen ini akan direduksi oleh elektron sehingga membentuk gas hidrogen.
Adanya elektron dan hole berpengaruh terhadap energi celah pita. TiO2 tipe anatas
dan rutil mempunyai energi celah pita yang lebar sebesar 3,2 dan 3,0 eV. Energi
celah pita TiO2 hanya mengabsorbsi di daerah sinar ultraviolet sehingga
diperlukan penambahan zat pensensitif untuk memperkecil energi celah pita
TiO2 agar dapat mengabsorbsi ke daerah tampak. Salah satu zat pensensitif yang
digunakan pada TiO2 adalah AgCl. AgCl memiliki energi celah pita dibawah
energi celah pita TiO2 yaitu 2,93 eV. TiO2 yang ditambahkan pada senyawa yang
memiliki energi celah pita lebih rendah akan meningkatkan aktivitas fotokatalitik
23 BAB III
METODE PENELITIAN
A. Subjek dan Objek Penelitian 1. Subjek Penelitian
Subjek penelitian ini adalah TiO2 terdispersikan zat pensensitif AgCl.
2. Objek Penelitian
Objek yang akan diteliti dalam penelitian ini adalah karakteristik fisik
TiO2@AgCl dan kemampuan aktivitas antiburam pada kaca preparat.
B. Variabel Penelitian 1. Sintesis TiO2@AgCl
a. Variabel Bebas
Variasi perak senyawa TiO2@AgCl yang digunakan yaitu: 0%; 0,5%; 1,5%;
3%; dan 5%.
b. Variabel Terikat
Variabel terikat pada penelitian ini adalah karakteristik fisik dan energi celah
pita TiO2@AgCl pada berbagai variasi perak.
2. Uji Antiburam TiO2@AgCl
a. Variabel Bebas
Variasi uji antiburam pada sinar ultraviolet dan sinar matahari tidak langsung
24 b. Variabel Terikat.
Variabel terikat pada penelitian ini adalah gradien penurunan sudut kontak
dalam waktu (0-40) menit.
C. Instrumen Penelitian 1. Alat yang Digunakan
a. Peralatan gelas
b. Seperangkat alat refluks
c. Pompa vakum
d. Penyaring Buchner
e. Neraca analitik
f. Magnetic Stirrer
g. pH meter
h. Gelas ukur
i. Kaca preparat
j. Kamera
k. Pemanas
l. Kacamasir
m. Termometer
n. Spektrofotometer Diffuse Reflectance-UV (DR-UV)
25 2. Bahan yang Digunakan
a. TiCl4 p.a Merck
b. AgNO3 p.a Merck
c. H2O2 p.a Merck
d. NH4OH pekat
e. Akuades
f. Aseton
g. Etanol
h. Minyak Parafin
D. Prosedur Penelitian 1. Preparasi Prekursor
a. Titanium tetraklorida (TiCl4) sebanyak 100 mL dimasukkan ke dalam gelas
beker.
b. Campuran H2O2 dipersiapkan di dalam buret yang berada di lemari asam.
c. Kemudian campuran H2O2 ditambahkan tetes demi tetes ke dalam gelas beker
hingga terbentuk endapan kekuningan.
d. Proses penyaringan dilakukan setelah endapan terbentuk dan mengeringkan
dengan temperatur 80oC.
2. Sintesis Nanopartikel TiO2-tersensitifikan AgCl (TiO2@AgCl)
a. Sebanyak 5 gram prekusor (mengandung ion Cl-) dimasukkan dalam
26
gelas erlenmeyer, dan diaduk selama 1 jam dengan pengaduk magnet sebagai
campuran (a).
b. Sejumlah gram perak (mengandung ion Ag+) dengan variasi 0%; 0,5%; 1,5%;
3% dan 5% (Lampiran 1) dicampurkan dengan akuades di dalam gelas beker
sebagai campuran (b).
c. Campuran (a) dan campuran (b) dicampurkan sebagai campuran TiO2
tersensitifkan AgCl atau campuran (c).
d. Campuran (c) ditambahkan NH4OH tetes demi tetes hingga pH ~10,
kemudian ditambahkan dengan tetrametil amonium hidroksida.
e. Campuran (c) diaduk dengan pengaduk magnet serta dipanaskan hingga
temperatur 150oC di dalam peralatan refluks selama 6 jam.
f. Campuran hasil refluks didinginkan selama ±24 jam.
g. Campuran hasil refluks disaring dengan kacamasir, kemudian dikeringkan
menggunakan oven pada temperatur 110oC.
p. Endapan dikarakterisasi dengan XRD dan Spektrofotometer Diffuse
Reflectance-UV (DR-UV ).
q. Hasil sampel ditandai sebagai V1-V5 untuk variasi perak 0%; 0,5%; 1,5%;
3%; dan 5%.
3. Uji Aktivitas Antiburam TiO2-tersentifikan AgCl (TiO2@AgCl)
a. Sampel V1 ditimbang sebanyak 0.025 gram kemudian dimasukkan ke dalam
27
b. Akuades sebanyak 25 mL dimasukkan ke dalam gelas beker sambil diaduk
dengan pengaduk magnet selama 15 menit sehingga terbentuk suspensi V1.
c. Dua buah kaca preparat disiapkan dan dicuci dengan etanol dan aseton.
d. Salah satu kaca preparat dicelupkan ke dalam suspensi V1 sedangkan kaca
preparat yang lain tanpa dilakukan pencelupan.
e. Kedua kaca preparat dikeringkan pada temperatur kamar dan ditetesi satu
tetes air pada masing-masing kaca preparat.
f. Kedua kaca preparat disinari dengan sinar UV dan sinar matahari tidak
langsung.
g. Mengamati pengurangan sudut kontak air terhadap permukaan kaca preparat
dengan foto sampel setiap 4 menit dihitung t=0 menit sampai 40 menit.
h. Langkah a-g adalah kontrol yaitu pada sampel V1 (TiO2@AgCl 0%).
i. Langkah diatas diulangi untuk sampel V2-V5 sebagai pembanding kontrol.
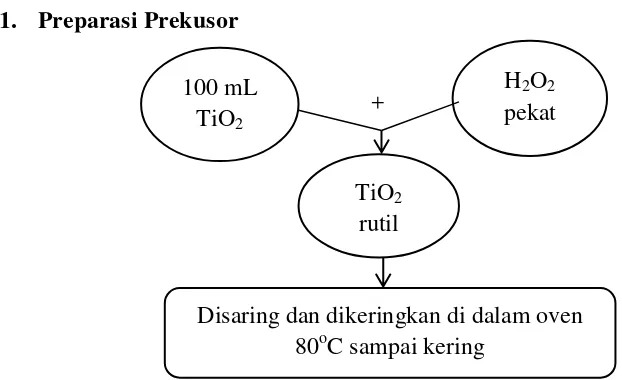
E. Diagram Alir 1. Preparasi Prekusor
+
Gambar 7. Diagram Alir Preparasi Prekusor Disaring dan dikeringkan di dalam oven
80oC sampai kering 100 mL
TiO2
H2O2
pekat
TiO2
28
+
2. Sintesis Nanopartikel TiO2-tersentifikan AgCl (TiO2@AgCl)
Gambar 8. Diagram Alir Sintesis Nanopartikel TiO2@AgCl
XRD, UV-Vis Diffuse Reflectance 5 gram prekusor
+ 50 mL akuades NH4OH + % AgCl
(0; 0,5; 1,5; 3, 5) sampai pH ~10 + tetrametil amonium
hidroksida Diaduk selama 1 jam
Refluks 150oC 6 jam
Dinginkan ± 24 jam dan disaring
Dikeringkan dengan oven pada 110oC
29
3. Uji Aktivitas Antiburam TiO2-tersentifikan AgCl (TiO2@AgCl)
+
Gambar 9. Diagram Alir Uji Aktivitas Antiburam TiO2@AgCl
0,025 gram sampel V1-V5
25 mL H2O
Dua kaca preparat (sampel dan pembanding)
Dicelupkan dalam suspensi V1-V5
Dikeringkan
Dicuci dengan etanol dan aseton suspensi
Ditetesi satu tetes H2O
+
Disinari dengan
sinar ultraviolet sinar matahari tidak Disinari dengan langsung
30 F. Teknik Analisa Data
1. Penentuan Struktur TiO2@AgCl Hasil Sintesis dengan X-Ray Diffraction
(XRD)
Penentuan difraktogram TiO2@AgCl, XRD direkam dengan difraktometer
sinar-X Rigaku Multiflex dengan radiasi Cu Kα (λ= 1,5406) pada tegangan 32 kV,
arus 20 mA, dan rentang 2θ = 20o-80o serta nikel sebagai filter. Berdasarkan hasil
difraktogram XRD, akan ditunjukkan tipe kristal TiO2@AgCl. Metode ini dapat
digunakan untuk menentukan ukuran kristal dengan menggunakan persamaan
scherrer pada Persamaan 6 berikut ini.
D =
...(6)
dimana :
λ = panjang gelombang sinar-X yang digunakan (0,15406 nm)
k = konstanta Scherrer (0,9)
β = puncak pada setengah tinggi intensitas (FWHM= Full Width a Half
Maximum), β= FWHM x (π/180o) rad
θ = sudut difraksi
Hasil XRD dianalisa lebih lanjut dengan U-FIT untuk menentukan
parameter kisi (a,b,c) dan volume masing-masing sampel sesuai dengan bentuk
strukturnya.
2. Penentuan Energi Celah Pita dan Absorbansi TiO2@AgCl Hasil Sintesis
dengan Diffuse Reflectance UV (DR-UV).
TiO2@AgCl yang telah disintesis dapat diketahui besarnya energi celah
31
reflektance UV-Vis. Data Spektrum diffuse reflektance UV-Vis berupa kurva
hubungan antara reflektansi (R) dengan panjang gelombang (λ) atau absorbansi
(A) dengan panjang gelombang (λ). Energi celah pita dapat ditentukan dengan
menggunakan grafik hubungan antara energi foton (hv) dengan (F(R’ )hv)2 yang
terdapat pada Persamaan 3. Grafik yang diperoleh disinggungkan dengan garis
linear untuk mengetahui besar energi celah pitanya.
Penentuan absorbansi dan panjang gelombang pada masing-masing
sampel V1-V5 dapat dilakukan dengan melihat hasil spektrum absorbansi yang
terdapat di Lampiran 6.
3. Uji Aktivitas Antiburam TiO2@AgCl Hasil Sintesis
Teknik analisa data uji antiburam adalah dengan melakukan pengukuran
sudut kontak. Pengukuran sudut kontak dilakukan dengan cara mengambil gambar
(foto) kaca preparat yang terlapisi sampel V1-V5 dan tertetesi satu tetes air
diatasnya. Hasil pengambilan gambar (foto) kemudian diolah dalam aplikasi
Corel Draw pada komputer dengan memilih toolbar freehand tools dimention,
kemudian menarik garis lurus antara kaca preparat dengan garis lengkung pada air
sehingga akan muncul besarnya sudut kontak. Selanjutnya, untuk pengukuran
penurunan sudut kontak sampel V1-V5 dilakukan dengan membuat grafik
hubungan antara besarnya nilai sudut kontak terhadap waktu. Semakin cepat
penurunan sudut kontak maka material tersebut semakin suka terhadap air
32 BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Preparasi dan Karakterisasi Prekusor 1. Preparasi Prekusor
Pembuatan prekusor merupakan langkah awal dalam sintesis titanium
dioksida (TiO2). Prekusor dipreparasi dengan melarutan hidrogen peroksida
(H2O2) pekat tetes demi tetes ke dalam larutan titanium tetraklorida (TiCl4).
Berdasarkan penelitian Gao et al. (2007) TiCl4 dapat teroksidasi oleh H2O2
membentuk prekusor Ti(O)2.O.2H2O. Namun, hasil penelitian ini membentuk
prekusor TiO2 rutil setelah TiCl4 ditetesi H2O2. Larutan TiCl4 yang semula tidak
berwarna berubah menjadi endapan berwarna kuning.
Endapan yang terbentuk disaring dan dikeringkan di dalam oven pada
temperatur 80oC selama 2 jam. Endapan yang semula berwarna kuning berubah
menjadi putih seperti pada Gambar 10.
(a) (b)
33 2. Karakterisasi Prekusor TiO2
Prekusor TiO2 yang diperoleh dari reaksi TiO2 dengan H2O2
dikarakterisasi menggunakan XRD (X-Ray Diffraction) merk Rigaku Multiflex
dengan radiasi Cu Kα (λ=1,5405981) yang terdapat di Laboratorium Terpadu
FMIPA UNY dan hasil difraksinya dapat dilihat pada Gambar 11.
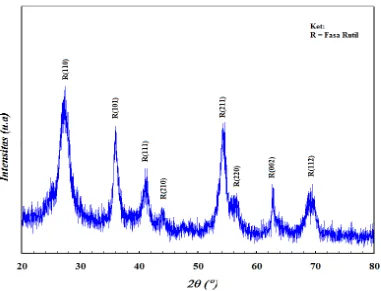
Gambar 11. Difraktogram Difraksi Sinar-X Prekusor TiO2
Gambar 11 menunjukkan bahwa prekusor memiliki fasa rutil (Lampiran
3), selanjutnya dianalisa menggunakan program U-FIT Version 1.2 tahun 1992
dengan parameter kisi standard yang terdapat pada Lampiran 2. Berdasarkan hasil
U-FIT diperoleh parameter kisi prekusor TiO2 dengan nilai a = 4,6307 Å, c =
34
lengkap dapat dilihat pada Lampiran 4. Parameter kisi dan grup ruang prekusor
TiO2 fasa rutil tersebut hampir sama dengan yang dipaparkan oleh Sugiyama &
Takeuchi (1991) yang memiliki sistem kristal tetragonal dengan grup ruang
P42/mnm dan parameter kisi a = 4,6344 Å, c = 2,9919 Å.
Data XRD dari Gambar 11 dapat dianalisa lebih lanjut dengan metode RIR
untuk memperoleh data kuantitatif berupa persentase fasa rutil yang ditunjukkan
pada Gambar 12 (Lampiran 3).
Gambar 12. Persentase Fasa Rutil dalam Prekusor TiO2
B. Sintesis dan Karakterisasi TiO2-tersensitifkan AgCl (TiO2@AgCl)
1. Sintesis Nanopartikel TiO2-tersensitifkan AgCl (TiO2@AgCl)
Metode pengendapan basa teknik refluks dapat digunakan untuk
mensintesis berbagai macam fasa nanokristalin titanium dioksida (TiO2). Langkah
awal sintesis ini adalah mencampurkan prekusor TiO2 rutil dengan 50 mL akuades
lalu mengaduknya dengan magnetic stirrer selama 1 jam. Perak nitrat sebagai
35
0%; 0,5%; 1,5%; 3%; dan 5% atau di simbolkan dengan V1-V5. Campuran
tersebut selanjutnya ditambahkan amonium hidroksida (NH4OH) pekat 8M
sampai pH~10 untuk membuat suasana basa di dalam larutan, kemudian
campuran tersebut direfluks pada temperatur 150oC selama 6 jam seperti pada
Gambar 13.
Gambar 13. Proses Refluks Titanium Dioksida
Langkah kedua yaitu mendinginkan campuran hasil refluks selama ±24
jam, kemudian dilakukan pengukuran pH dan menyaring campuran dengan
kacamasir untuk memperoleh endapan. pH campuran sebelum refluks adalah ~10
sedangkan pH campuran setelah refluks adalah ~8. Keadaan ini menunjukkan
bahwa pH refluks sebelum dan setelah refluks berada pada kondisi basa.
Langkah terakhir yaitu mengeringkan endapan di dalam oven pada
temperatur 110oC sampai kering. Warna endapan sampel V1 sebelum dan sesudah
direfluks adalah putih sedangkan warna endapan sampel V2-V5 sebelum direfluks
36
keabu-abuan meningkat seiring dengan peningkatan perak seperti yang terlihat
pada Gambar 14 berikut ini.
(a) (b) (c)
(d) (e)
Gambar 14. Serbuk Hasil Analisis TiO2@AgCl dengan variasi (a) V1 (b) V2 (c)
V3 (d) V4 (e) V5
Endapan TiO2@AgCl yang berbentuk serbuk kemudian dikarakterisasi
dengan XRD untuk mengetahui parameter kisi dan ukuran kristal, UV-Vis untuk
mengetahui absorbansi dan nilai energi celah pitanya serta uji antiburam untuk
mengetahui kemampuan aktivitas antiburam sampel pada kaca preparat. Aktivitas
antiburam yang baik ditunjukkan dengan kaca preparat yang tidak buram jika
37
2. Karakterisasi Nanopartikel TiO2-tersensitifkan AgCl (TiO2@AgCl)
a. XRD
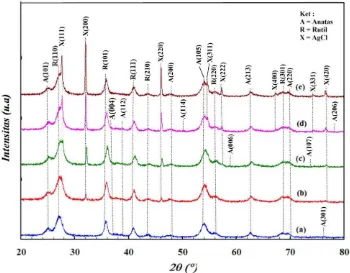
Hasil Spektra XRD nanopartikel TiO2-tersensitifkan AgCl ditunjukkan
pada Gambar 15 berikut ini.
Gambar 15. Difraksi Sinar-X TiO2@AgCl dengan variasi (a) V1 (b) V2 (c) V3
(d) V4 (e) V5
Gambar 15 menunjukkan bahwa sampel V1 memiliki fasa anatas dan rutil,
sedangkan pada V2-V5 memiliki fasa anatas, rutil, AgCl. Hasil data XRD dari
Gambar 15 dianalisa lebih lanjut dengan metode RIR dan diperoleh kenaikan
jumlah fasa AgCl seiring dengan penambahan perak awal sintesis yang dapat
38
Tabel 2. Persentase (%) AgCl, Anatas, Rutil dalam TiO2@AgCl
Berdasarkan Tabel 2 diatas dapat dialirkan grafik hubungan %AgCl
terhadap variasi perakseperti pada Gambar 16.
Gambar 16. Grafik Hubungan %AgCl dalam TiO2@AgCl dengan variasi (a) V1
(b) V2 (c) V3 (d) V4 (e) V5
Gambar 16 menunjukkan bahwa semakin besar %Ag yang digunakan
untuk analisa maka semakin besar ion AgCl yang tersensitifkan di permukaan
TiO2. Ion AgCl dapat terbentuk dari ion Cl- dari prekusor TiO2 dan ion Ag+ dari
penambahan perak saat sintesis. Adanya AgCl dapat menggeser absorsi sinar UV
ke daerah tampak. Berdasarkan Gambar 16 menunjukkan bahwa AgCl yang TiO2@AgCl pada
Variasi perak % AgCl % Anatas % Rutil
0% 0 15 85
0,50% 0,79 18 81
1,50% 3,5 17 80
3% 4,38 16,1 79
39
terbentuk belum optimum sehingga dimungkinkan masih ada ion Cl- yang tersebar
di permukaan jika dilakukan penambahan perak diatas konsentrasi 5%.
Hasil data XRD dari Gambar 15 dapat dianalisis lebih lanjut dengan
program U-FIT dan diperoleh data 2θ, Intensitas, dan (hkl) Spektra XRD
TiO2@AgCl yang ditunjukkan pada Tabel 3, dimana untuk keterangan A= fasa
41
Data parameter kisi dan grup ruang TiO2@AgCl hasil sintesis ditunjukkan
dalam Tabel 4 di bawah ini.
Tabel 4. Parameter Kisi dan Grup Ruang TiO2@AgCl
TiO2
Parameter kisi yang diperoleh dari Tabel 4 memiliki parameter kisi yang
identik dengan parameter kisi anatas yang dipaparkan oleh Khitrova et al. (1977)
dengan nomor PDF 01-083-2243 dengan a = 3,7800 Å, c = 9,5100 Å yang
memiliki sistem kristal tetragonal dan grup ruang I41/amd. Parameter kisi rutil
identik dengan parameter kisi yang dipaparkan oleh Sugiyama et al. (1991)
dengan nomor PDF 01-076-0322 dengan a = 4,6344 Å, c = 2,9919 Å yang
memiliki sistem kristal tetragonal dan grup ruang P42/mnm dan parameter kisi
AgCl identik dengan parametr kisi yang di paparkan oleh Swanson et al. (1955)
dengan nomor PDF 01-085-1355 dimana a = 5,549 Å yang memiliki sistem
kristal kubik dan grup ruang Fm-3m. Informasi lebih lanjut dapat dilihat pada
42
Tabel 4 juga menunjukkan bahwa volume anatas, rutil, dan AgCl secara
umum mengalami kenaikan. Hal ini dimungkinkan karena adanya ion Ag+ dari
AgCl yang menyisip ke dalam struktur TiO2 sehingga mengakibatkan volumenya
meningkat atau kemungkinan lain adalah salah satu ion penyusun struktur TiO2
digantikan oleh salah satu ion AgCl sehingga volumenya meningkat karena kristal
AgCl memiliki massa atom yang lebih besar dari TiO2.
Berdasarkan Tabel 4, pengaruh kadar perak dalam senyawa TiO2@AgCl
terhadap volume anatas, rutil, dan AgCl dapat diperjelas dengan grafik pada
Gambar 17 berikut ini.
(a) (b)
(c)
Gambar 17. Grafik Volume TiO2@AgCl pada Fase (a) Anatas (b) Rutil (c) AgCl
43
Fasa anatas, rutil dan AgCl dari penelitian ini telah diteliti sebelumnya oleh
Sangchay et al (2012) yang mensintesis TiO2-AgCl dengan metode sol gel
menggunakan TTIP, AgNO3, C2HCl3O2 kemudian di kalsinasi pada temperatur
400oC, 500oC, 600oC. Serbuk TiO2-AgCl hasil sintesis dibandingkan dengan TiO2
Degusa P25 melalui karakterisasi XRD. Hasil XRD menunjukkan bahwa TiO2
Degusa P25 memiliki fasa anatas dan rutil sedangkan TiO2-AgCl memiliki fasa
anatas dan fasa AgCl pada temperatur 400oC. Kalsinasi pada temperatur yang
lebih tinggi menunjukkan perubahan komposisi anatas dan AgCl. Hal itu terjadi
karena pada temperatur yang lebih tinggi fasa anatas bertransformasi menjadi rutil
sedangkan fasa AgCl berkurang. Oleh karena itu pada kalsinasi temperatur 400oC
memiliki kristalinitas anatas yang cukup baik.
Ukuran kristal TiO2@AgCl pada berbagai variasi perak dapat ditentukan
dari puncak tunggal yang tidak berhimpit dengan puncak fasa lain dan dapat
dihitung menggunakan persamaan Scherrer (Persamaan 6) yang terdapat pada
Lampiran 5 dan ditunjukkan pada Tabel 5.
Tabel 5. Perubahan Ukuran Kristal Berdasarkan Kenaikan %AgCl.
Sampel Ukuran kristal (nm)
Anatas Rutil AgCl
TiO2@0%AgCl 6,7427 9,5717 -
TiO2@0,5%AgCl 7,7101 8,7836 60,7459
TiO2@1,5%AgCl 7,0111 11,6039 52,9633
TiO2@3%AgCl 6,7026 12,1240 56,7245
TiO2@5%AgCl 6,0306 12,1327 57,5402
Berdasarkan Tabel 5 perubahan ukuran kristal TiO2@AgCl ditunjukkan pada
44
(a) (b)
(c)
Gambar 18. Grafik Hubungan Ukuran Kristal TiO2@AgCl pada Fase (a) Anatas
(b) Rutil (c) AgCl.
Gambar 18 menunjukkan bahwa semakin besar variasi perak yang
ditambahkan saat awal sintesis menyebabkan menurunnya ukuran kristal fasa
anatas dan fasa AgCl namun ukuran kristal fasa rutil meningkat
b. Spektrofotometer Diffuce Reflectance UV-Vis (DR-UV)
Karakterisasi dengan diffuce reflectance UV-Vis dilakukan untuk
mengetahui absorbansi atau kemampuan material untuk menyerap cahaya dan
energi celah pita. Serbuk hasil sintesis sebelum dianalisa perlu dilakukan preparasi
sampel dengan cara mencampurkan serbuk TiO2@AgCl dengan sedikit etanol
kemudian campuran tersebut dilapiskan pada kaca preparat. Kaca yang terlapisi
sampel TiO2@AgCl dikeringkan pada temperatur kamar.
45
Sampel V1-V5 akan mengabsorpsi panjang gelombang tertentu. Pengukuran
dilakukan pada panjang gelombang 200-800 nm kisaran radiasi UV adalah
100-400 nm sedangkan untuk visibel adalah 100-400-750 nm. Hasil karakterisasi UV-Vis
berupa absorbansi TiO2@AgCl terhadap panjang gelombang yang terlihat pada
Gambar 19.
Gambar 19. Spektra UV-Vis TiO2@AgCl pada Variasi Perak (a) V1 (b) V2 (c) V3
(d) V4 (e) V5
Gambar 19 menunjukkan bahwa material TiO2@AgCl 0% (V1) mengalami
penyerapan energi yang terjadi pada gelombang maksimal 234 nm yang
merupakan daerah UV. Hal tersebut dapat terjadi karena adanya material TiO2
memiliki bentuk oktahedral tidak sempurna yaitu transisi D2d pada anatas dan
transisi D2h pada rutil. Fase Anatas memiliki empat transisi di D2d yaitu transisi
B2-A1, B2-B1, E-A1, E-B1dimana B1 (x2-y2), E(xy,yz), A1 (x2+y2+z2), dan B2 (x,y).
Fasa rutil memiliki tiga transisi di D2h yaitu transisi B1g-Ag, B2g-Ag, B3g-Ag dimana
200 300 400 500 600 700 800
46
B1g(dxy), B2g (dxz), B3g (dyz). Transisi d-d pada TiO2 hanya terjadi pada oktahedral
sempurna. Orbital d pada oktahedral sempurna dapat mengalami pembelahan
(splitting) menjadi dua orbital yaitu eg dan t2g. Oleh karena itu TiO2 hanya
menyerap pada panjang gelombang tertentu yang dapat ditunjukkan pada Tabel 6.
Tabel 6. Panjang Gelombang Sinar UV-Vis
Sampel λ(nm)
Visibel UV
TiO2@AgCl 0% (V1) - 234
TiO2@AgCl 0,5% (V2) 454 358
TiO2@AgCl 1,5% (V3) 453 357
TiO2@AgCl 3% (V4) - 353
TiO2@AgCl 5% (V5) 463 363
Berdasarkan Tabel 6 menunjukkan bahwa sampel V1 dan V3 terjadi
penyerapan daerah ultraviolet sedangkan sampel V2,V4,V5 terjadi penyerapan di
daerah ultaviolet dan sinar tampak. Adanya perbedaan daerah serapan pada
masing-masing sampel juga terjadi karena adanya tumpang tindih antar 3 tipe
struktur pada TiO2@AgCl yaitu anatas, rutil, dan AgCl.
Berdasarkan data spektra Reflektansi UV-Vis Diffuce Reflectance pada
Lampiran 6 dapat dihitung energi celah pita masing-masing sampel menggunakan
persamaan Kubelka-Munk (Persamaan 3). Hasil perhitungan tersebut kemuadian
dialirkan grafik hubungan antara eV dengan (F(R’ x hv)1/2 yang terdapat pada
47
(a) (b)
(c)
(d) (e)
Gambar 20. Perhitungan Energi celah pita TiO2@AgCl pada Variasi Perak (a) V1
48
Berdasarkan grafik pada Gambar 20, dapat dilihat perbedaan yang signifikan
energi celah pita material TiO2@AgCl pada berbagai variasi perak dalam Tabel 7.
Tabel 7. Energi Celah Pita TiO2@AgCl pada berbagai Variasi Perak
Sampel Energi celah pita (eV)
TiO2@AgCl 0% (V1) 3,14 -
TiO2@AgCl 0,5% (V2) 3,04 -
TiO2@AgCl 1,5% (V3) 3,03 1,94
TiO2@AgCl 3% (V4) 2,97 2,24
TiO2@AgCl 5% (V5) 3,02 1,99
Berdasarkan Tabel 7 dapat terlihat bahwa sampel tanpa penambahan AgCl
(V1) memiliki energi celah pita 3,14 eV, sedangkan sampel TiO2 dengan
penambahan AgCl mengalami penurunan energi celah pita. Penurunan energi
celah pita menunjukkan aktivitas fotokatalitik yang baik pada sampel. Aktivitas
fotokatalitik sampel yang baik terjadi pada daerah tampak. Sampel yang
mengalami pergeseran ke daerah tampak terjadi pada sampel yang memiliki dua
energi celah pita yaitu pada sampel V3-V5.
3. Uji Aktivitas Antiburam TiO2-tersensitifkan AgCl (TiO2@AgCl)
Pengujian antiburam dilakukan dengan mengukur sudut kontak antara
cairan (akuades) dengan substrat (kaca preparat) yang telah dilapisi oleh
nanopartikel TiO2@AgCl pada berbagai variasi perak untuk menentukan sifat
hidrofilitasnya (suka terhadap air). Langkah awal untuk melakukan uji ini adalah
membuat sampel TiO2@AgCl. Berat tiap sampel yang ditimbang yaitu 0,025
gram, kemudian dicampurkan dengan akuades sampai volumenya 25 mL.
49
stirrer. Konsentrasi campuran sampel yang diperoleh adalah 1000 ppm. Satu kaca
preparat steril (tanpa pencelupan) dan satu kaca preparat yang dilapisi suspensi
sampel V1-V5 disiapkan dengan teknik dipcoating yaitu pencelupan cepat. Kaca
preparat yang telah kering ditetesi akuades dan dilakukan pengambilan gambar
(foto) setiap 4 menit sekali dalam rentang waktu 0-40 menit. Sampel V1-V5
dilakukan pengukuran sudut kontak menggunakan paparan sinar matahari tidak
langsung (di dalam ruangan) dan paparan sinar ultraviolet. Pengukuran sudut
kontak dilakukan dengan cara mengambil gambar (foto) kaca preparat yang
terlapisi sampel V1-V5 dan tertetesi satu tetes air diatasnya. Hasil gambar tersebut
(foto) selanjutnya diukur sudut kontaknya menggunakan aplikasi Corel Draw
pada komputer dengan memilih toolbar freehand tools dimention, kemudian
menarik garis lurus antara kaca preparat dengan garis lengkung pada air sehingga
akan muncul besarnya sudut kontak.
Penurunan sudut kontak sampel V1-V5 dilakukan dengan membuat grafik
hubungan antara besarnya nilai sudut kontak terhadap waktu. Sampel yang
mengalami penurunan sudut kontak tajam (memiliki selisih penurunan sudut
kontak awal dan akhir tinggi) menunjukkan aktivitas antiburam yang baik pada
material itu. Aktivitas Antiburam dapat terjadi karena material tersebut mudah
menyerap air di permukaan sehingga permukaan air yang semula cembung
menjadi melebar. Adanya aktivitas Antiburam tinggi pada kaca preparat
memperlihatkan bahwa material tersebut tidak mudah buram, memiliki daya serap
tinggi, memiliki sifat hidrofilik tinggi (suka terhadap air). Proses penurunan sudut
50
(a) (b)
Gambar 21. Penurunan Sudut Kontak Akuades pada Kaca Preparat tanpa Lapisan TiO2@AgCl saat (a) t=0 menit (b) t= 40 menit.
Informasi gambar penurunan sudut kontak masing-masing sampel dengan
paparan sinar ultraviolet dan sinar matahari tidak langsung dapat dilihat pada
Lampiran 7. Berdasarkan data penurunan sudut kontak (Lampiran 8) dialirkan
grafik hubungan antara waktu dan sudut kontak dengan paparan sinar ultraviolet
(Gambar 22) dan paparan sinar matahari tidak langsung (Gambar 23).
51
Gambar 23. Grafik Penurunan Sudut Kontak Air pada Kaca Preparat tanpa Lapisan TiO2@AgCl (a) dan dilapisi sampel V1-V5 untuk (b)-(f)
pada Paparan Matahari Tidak Langsung.
Penurunan sudut kontak air pada kaca preparat terlihat jelas pada Gambar
22 dan Gambar 23. Pada waktu 0 menit, tetesan akuades berbentuk lebih cembung
dengan ukuran sudut yang besar dan mengalami penurunan sudut kontak hingga
pada waktu 40 menit. Hal ini dapat dilihat dari selisih sudut kontak pada menit ke
0 dan ke 40 pada masing sampel yang ditunjukkan dengan Gambar 24 berikut ini.
(a) (b)
52
Penurunan sudut kontak menunjukkan sifat hidrofilitas suatu material, semakin
besar penurunan sudut maka semakin bersifat hidrofilik. Gambar 24 menunjukkan
material yang memiliki selisih sudut kontak terbesar di daerah ultraviolet adalah
sampel V2 sebesar 27,8o sedangkan pada sinar matahari tidak langsung selisih
sudut kontak terbesar adalah sampel V3 sebesar 25,36o.
Sudut kemiringan garis singgung (slope) penurunan sudut kontak juga
menunjukkan sifat hidrofilitas. Slope yang semakin besar semakin bersifat
hidrofilik. Slope dapat diperoleh dengan mengalirkan grafik hubungan antara
sudut kontak dan waktu pada masing-masing sampel. Grafik yang diperoleh
disinggungkan dengan garis lurus (linear), kemudian diukur besarnya sudut
kemiringan penurunan sudut kontak dengan aplikasi Corel Draw. Slope dilakukan
pada sampel tanpa pencelupan dan sampel dengan pencelupan V1-V5.
Berdasarkan Lampiran 9 dapat diketahui sudut kemiringan garis singgung
penurunan sudut kontak air pada paparan sinar ultraviolet dan sinar matahari tidak
langsung yang dialirkan Gambar 25.
(a) (b)
Gambar 25. Sudut Kemiringan Garis Singgung Penurunan Sudut Kontak pada Paparan (a) Sinar Ultraviolet (b) Sinar Matahari Tidak Langsung.
53
Gambar 25 diatas menunjukkan bahwa sudut kemiringan garis singgung
penurunan sudut kontak terbesar pada sinar ultraviolet sebesar 45o pada sampel
V2 sedangkan pada sinar matahari tidak langsung sebesar 45,95o pada sampel V3.
Slope terbesar menunjukkan kemampuan aktivitas antiburam paling baik. Oleh
karena itu, sampel V2 dan V3 memiliki aktivitas antiburam yang baik. Slope besar
menunjukkan bahwa sampel tersebut memiliki luas permukaan air yang lebar
terhadap kaca preparat sehingga sudut kontak antara kaca preparat kecil.
Permukaan air yang luas menyebabkan air tersebar merata di permukaan kaca dan
mengabsorbsi kontaminan yang ada di permukaan sehingga kaca menjadi bersih
54 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dan pembahasan yang
telah diuaraikan maka dapat disimpulkan bahwa :
1. Penambahan perak pada TiO2-tersensitifkan AgCl memunculkan fasa baru
(fasa AgCl) sedangkan sampel kontrol hanya berisi fasa anatas dan rutil.
Penambahan perak yang semakin tinggi menyebabkan semakin banyaknya
fasa AgCl yang terbentuk dan ukuran kristal fasa rutil meningkat namun
ukuran kristal fasa anatas menurun. Hasil analisa DR-UV menunjukkan
bahwa sampel 0% dan 0,5% memilki satu energi celah pita secara
berturut-turut 3,14 eV dan 3,04 eV sedangkan sampel 1,5%; 3%; dan 5% memiliki dua
energi celah pita pada rentang (1,94-3,02) eV.
2. Aktivitas antiburam terbaik pada paparan sinar ultraviolet adalah TiO2
-tersensitifkan 0,5% perak dan aktivitas antiburam terbaik pada paparan sinar
55 B. Saran
Berdasarkan hasil penelitian ini, maka saran yang perlu ditambahkan
adalah sebagai berikut :
1. Perlu dilakukan penelitian lanjutan untuk memvariasikan persentase perak
diatas 5% dan perlu menggunakan metode lain.
2. Perlu dilakukan karakterisasi lebih lanjut menggunakan EDX, SEM, IR agar
56
DAFTAR PUSTAKA
Aini, N. & Sutrisno, H. (2013). Rekayasa Mikrostruktur Larutan Padat Ti (1-x)CrxO2 Melalui Metode Pengendapan Basa Dengan teknik Refluks Dan
Karakterisasinya. E-Jurnal Universitas Negeri Yogyakarta. 2(4). 1-8.
Banfield, J.F. & Veblen, D.R. (1992). Conversion of Perovskite to anatase and TiO2 (B): a TEM Study and The Use of Fundamental Building Blocks for
Understanding Relationship Among the TiO2 Minerals. American
Mineralogist. 77: 545-557.
Bennani, J., Dillert, R., Thosten, M., Gesing & Bahnemann, D. (2009). Physical properties, Stability, and Photocatalytic Activity of TiO2/ SiO2 Films.
Separation and Purification Technology. 67: 173-179.
Braun, J.H., Baidins, A. & Margainski, R.E. (1992). TiO2 Pigment Technology. a
Review. Progress in Organic Coatings. 20: 105-138.
Cacciafesta P., Hallam K.R., Oyedepo C.A., Humphris A.D.L., Miles M.J., & Jandt K.D. (2002). Characterization of Ultrafat Titanium Oxide Surface. Chemical Material. 14: 777-789.
Cao, J., Benyan, X., Bangde, L., Haili, L. & Shifu, C. (2011). Preparation, Characterization and Visible-light Photocatalytic activity of AgI/AgCl/TiO2.
Applied Surface Science. 257: 7083-7089.
Carp, O., Huisman, C.L. & Reller, A. (2004). Photoinduced reactivity of titanium dioxide. Prog. Solid State Chem. 32 (1-2): 33-177.
Chiba, Y., Islam, A., Watanabe, Y., Komiya, R., Koide, N. & Han, L. (2006). Dye-Sensitized Solar Cells with Conversion Efficiency of 11.1%. Japanese Journal of Applied Physics. 45(25): L638-L640.
Choi, W., Termin A. & Hoffmann M.R. (1994). Dehydration of Synthesized Coprecipitated Titania Powders. Journal of Materials Science. 8: 485-489.
Cotton, F.A., Wilkinson, G., Murillo, C.A., & Manfred, B. (1999). Advance Inorganic Chemical, 6th Edition. John Willey & Sons Inc: Van Couver.
Diamandescu L., Vasiliu, F., Tarabasanu-Mihaila D., Feder, M., Vlaicu A.M., Teororescu C.M., Macovei D., Enculescu, I., Parvulescu, V. & Vasile E. (2008). Structural and Photocatalytic Properties of Iron and Europium Doped TiO2 Nanoparticles Obtained Under Hydrotermal Conditions.
57
Diantoro, M., Santana, J. & Fuad, A. (2010). Kajian Evolusi Struktur Kristal Dan Magnetodielektrisitas Senyawa Spintronik Ti1-xCoxO2+δ. Jurnal Sains. 39:
21-26.
Farahmandjou, M. & Khalili, P. (2013). Study of Nano SiO2/TiO2
Superhydrophobic Self-Cleaning Surface Produced by Sol-Gel. Australian Journal of Basic and Applied Sciences. 7(6): 462-465.
Fatimah, I. (2009). Dispersi TiO2 dalam SiO2 Montmorillonit: Efek jenis
Prekusor. Jurnal Penelitian Saintek. 14(1): 41-58.
Fujishima, A., Hashimoto, K. & Watanabe, T. (1999). TiO2. Photocatalysis
Fundamental and Application. Bkc. Inc, Tokyo, Japan.
Garcia, C.G., Polo, A.S. & Murakami Iha, N.Y. (2003). Photoelectrochemical Solar Cell Using Extract of Eugenia Jambolana Lam a A Natural Sensitizer. Annals of the Brazilian Academy of sciences. 75(2): 163-165.
Gates, B. C. 1991. Catalytic Chemistry. Kanada: John Willey & Sons. Inc.
Gerfin, T., Gratzel, M. & Walder, L. (1997). Molecular Level Artificial Photosynthetic Materials. Progress Inorganic Chemical. 44: 345-393.
Guan, K. (2005) Relationship Between Photocatalytic Activity, Hydrophilicity and self Cleaning Efect of TiO2/SiO2 Films. Survey and Coatings
Technology. 191: 155-160.
Gupta, K., Singh, R.P., Pandey, A. & Pandey A. (2013). Photocatalytic antibacterial performance of TiO2 and Ag-doped TiO2 against S. Aureus. P.
aeruginosa and E. coli. Beilstein journal of nanotechnology. 4: 345-351.
Handayani, S. & Haryadi, W. (1998). “Modifikasi Sintesis Zeolit A sebagai Bahan Pengisi Deterjen (Builder)”. Cakrawala Pendidikan. No.1. tahun XVIII, Yogyakarta: LPM IKIP Yogyakarta.
Hoffmann, M.R., Martin, S.T., Choi, W. & Bahnemann, D.W. (1995). Environmental Application of Semiconductor Photocatalysis. Chemical Review. 95: 69-96.