INTISARI
Binahong (Anredera cordifolia (Tenore) Steen) merupakan tanaman familia Basellaceae. Secara empiris, daun binahong dapat digunakan untuk mengobati beberapa penyakit seperti infeksi. Salah satu contohnya adalah infeksi kulit yang biasa disebabkan oleh bakteri Bacillus subtilis dan Pseudomonas aeruginosa. Maka dilakukan penelitian mengenai uji potensi antibakteri ekstrak polar daun binahong terhadap Bacillus subtilis dan Pseudomonas aeruginosa untuk mengetahui potensi daun binahong sebagai antibakteri. Senyawa kimia yang terkandung dalam daun binahong belum diketahui secara pasti maka dalam penelitian ini dilakukan uji tabung dan KLT untuk mengidentifikasi senyawa kimia yang mungkin terkandung dalam daun binahong.
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan acak lengkap pola satu arah. Uji potensi antibakteri ekstrak polar daun binahong terhadap Bacillus subtilis dan Pseudomonas aeruginosa dilakukan dengan metode difusi paper disk. Uji kandungan kimia terhadap serbuk daun binahong dilakukan dengan uji tabung dan uji kandungan kimia ekstrak polar daun binahong dilakukan dengan metode Kromatografi Lapis Tipis (KLT). Analisis hasil KLT dilakukan secara deskriptif komparatif.
Hasil uji potensi antibakteri dengan metode difusi paper disk menunjukkan bahwa ekstrak polar daun binahong tidak memiliki potensi antibakteri. Berdasarkan uji tabung, serbuk daun binahong diketahui mengandung flavonoid, alkaloid, polifenol, dan tanin. Untuk uji KLT, diketahui bahwa ekstrak polar daun binahong mengandung flavonoid, alkaloid, dan tanin.
Kata kunci : potensi antibakteri, daun binahong, Bacillus subtilis, Pseudomonas aeruginosa, metode difusi, uji tabung, KLT
ABSTRACT
Binahong (Anredera cordifolia (Tenore) Steen) is a plant of Basellaceae. Binahong is often traditionally used to treat some illness as infection. One example is skin infection disease which is caused by Bacillus subtilis and Pseudomonas aeruginosa. Based on that phenomena, the writer would like to conduct a research about antibacterial potential test from polar extract of binahong leaf to Bacillus subtilis and Pseudomonas aeruginosa to know the potential of binahong leaf as an antibacterial. The chemical compounds of binahong leaf have not been known. So, the writer conducted tube test and TLC.
This research was a pure experimental research with the one way pattern of complete-random research design. Antibacterial potency test from polar extract of binahong leaf against Bacillus subtilis and Pseudomonas aeruginosa conducted by paper disk diffusion method and the result was analyzed by one way ANOVA. The test to chemical material compounds performed with tube test and thin layer chromatography (TLC). The TLC result was analysed using comparative-descriptive analysis method.
The result of this research showed that polar extract of binahong leaf have not antibacterial activity against Bacillus subtilis and Pseudomonas aeruginosa. Based on tube test, the powder of binahong leaf related to flavonoid, alkaloid, polyphenol, and tannin. The TLC result showed that polar extract of binahong leaf contain of flavonoid, alkaloid, and tannin.
Keywords : antibacterial potency, binahong leaf, Bacillus subtilis, Pseudomonas aeruginosa, diffusion method, tube test, TLC
UJI POTENSI ANTIBAKTERI EKSTRAK POLAR DAUN BINAHONG (Anredera cordifolia (Tenore) Steen)
TERHADAP Bacillus subtilis ATCC 6633 DAN Pseudomonas aeruginosa ATCC 27853
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Oleh:
Christina Dewi Nelawati
NIM : 038114023
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
Diantara letih masih ada bahagia
Diantara sedih masih ada tawa
Diantara semua… ada banyak cahaya
yang akan menerangi perjalanan panjang yang telah terlewati
hingga aku tertawa dalam bahagia
Aku yakin…….
Langkah adalah kenyataan
Tangis adalah luapan
Bahagia adalah bentuk….
Dan bentuk luapan kenyataan adalah sebuah keberhasilan
By. Me
Kupersembahkan karya kecil ini untuk
Tuhan dan Bunda Maria
Bapak dan Ibu tercinta
Mas Aru
My dearest one Yulius
Almamaterku
KATA PENGANTAR
Puji dan syukur kepada Bapa di surga atas segala rahmat, kekuatan, dan kasih yang berlimpah sehingga penulis dapat menyelesaikan skripsi yang berjudul UJI POTENSI ANTIBAKTERI EKSTRAK POLAR DAUN BINAHONG (Anredera cordifolia (Tenore) Steen) TERHADAP Bacillus subtilis ATCC 6633 DAN Pseudomonas aeruginosa ATCC 27853. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S. Farm.) Program Studi Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa dalam penyusunan skripsi ini tidak terlepas dari bantuan bebagai pihak dalam bentuk doa, tenaga, waktu, semangat, kritik, saran, serta bimbingan dan pengarahan. Untuk itu penulis mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah bersedia membantu penulis dalam menyelesaikan skripsi ini, terutama kepada:
1. Ibu Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Ibu Erna Tri Wulandari, M.Si., Apt. selaku dosen pembimbing utama yang telah bersedia meluangkan waktu untuk membimbing dengan sabar, menguji, dan memberikan banyak masukan kepada penulis.
3. Bapak Ign. Y. Kristio Budiasmoro, M.Si. selaku dosen penguji yang bersedia meluangkan waktu untuk menguji dan memberikan masukan, kritik dan saran kepada penulis.
4. Bapak Yohanes Dwiatmaka, M.Si. selaku dosen penguji yang bersedia meluangkan waktu untuk menguji dan memberikan masukan, kritik dan saran kepada penulis.
5. Adek, sahabat, dan teman seperjuanganku Tina, terima kasih atas kebersamaan, pengalaman, kerjasama, dukungan, doa, dan semangat yang kita bangun sampai selesainya skripsi ini.
6. Sahabat-sahabatku di Farmasi, Wati, Ratih, Totok, Bambang, Bangun, terima kasih atas segala bantuan, kebersamaan, kerjasama, dan dukunganya.
7. Sahabat-sahabatku Curut, Rosa pi, Linda, dan Emitha, terimakasih kita pernah saling berbagi rasa, canda, semangat, dan pengalaman bersama.
8. Teman-teman seperjuanganku di lantai 3, Rosa, Vian, Yohana, dan Dita, terima kasih untuk masukan dan sarannya.
9. Semua teman-teman farmasi ’03 kelas A especially kelompok B, terima kasih atas pengalaman, kebersamaan, kekeluargaan dan canda tawa yang selalu menyertai kebersamaan kita.
10.Untuk teman-teman seperjuangan di Januari 2007, Priska, Rindu, Eliz, Lusi, Tatik, Agung, Adi, Toto, terimakasih untuk kebersamaan dan pengalaman yang tak kan pernah aku lupakan.
11.Seluruh laboran dari lantai 1 sampai 4 terutama Mas Sarwanto, Mas Wagiran, Mas Sigit, Mas Otok, Pak Mukmin yang telah banyak membantu sampai terselesaikannya skripsi ini.
12.Semua pihak yang telah membantu dan mendukung penulis dari awal sampai akhir skripsi ini.
Penulis menyadari bahwa skripsi ini jauh dari sempurna. Untuk itu penulis mengharapkan kritik dan saran yang berguna demi kesempurnaan skripsi ini. Semoga Tuhan selalu memberkati semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini.
Yogyakarta, Penulis
INTISARI
Binahong (Anredera cordifolia (Tenore) Steen) merupakan tanaman familia Basellaceae. Secara empiris, daun binahong dapat digunakan untuk mengobati beberapa penyakit seperti infeksi. Salah satu contohnya adalah infeksi kulit yang biasa disebabkan oleh bakteri Bacillus subtilis dan Pseudomonas aeruginosa. Maka dilakukan penelitian mengenai uji potensi antibakteri ekstrak polar daun binahong terhadap Bacillus subtilis dan Pseudomonas aeruginosa untuk mengetahui potensi daun binahong sebagai antibakteri. Senyawa kimia yang terkandung dalam daun binahong belum diketahui secara pasti maka dalam penelitian ini dilakukan uji tabung dan KLT untuk mengidentifikasi senyawa kimia yang mungkin terkandung dalam daun binahong.
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan acak lengkap pola satu arah. Uji potensi antibakteri ekstrak polar daun binahong terhadap Bacillus subtilis dan Pseudomonas aeruginosa dilakukan dengan metode difusi paper disk. Uji kandungan kimia terhadap serbuk daun binahong dilakukan dengan uji tabung dan uji kandungan kimia ekstrak polar daun binahong dilakukan dengan metode Kromatografi Lapis Tipis (KLT). Analisis hasil KLT dilakukan secara deskriptif komparatif.
Hasil uji potensi antibakteri dengan metode difusi paper disk menunjukkan bahwa ekstrak polar daun binahong tidak memiliki potensi antibakteri. Berdasarkan uji tabung, serbuk daun binahong diketahui mengandung flavonoid, alkaloid, polifenol, dan tanin. Untuk uji KLT, diketahui bahwa ekstrak polar daun binahong mengandung flavonoid, alkaloid, dan tanin.
Kata kunci : potensi antibakteri, daun binahong, Bacillus subtilis, Pseudomonas aeruginosa, metode difusi, uji tabung, KLT
ABSTRACT
Binahong (Anredera cordifolia (Tenore) Steen) is a plant of Basellaceae. Binahong is often traditionally used to treat some illness as infection. One example is skin infection disease which is caused by Bacillus subtilis and Pseudomonas aeruginosa. Based on that phenomena, the writer would like to conduct a research about antibacterial potential test from polar extract of binahong leaf to Bacillus subtilis and Pseudomonas aeruginosa to know the potential of binahong leaf as an antibacterial. The chemical compounds of binahong leaf have not been known. So, the writer conducted tube test and TLC.
This research was a pure experimental research with the one way pattern of complete-random research design. Antibacterial potency test from polar extract of binahong leaf against Bacillus subtilis and Pseudomonas aeruginosa conducted by paper disk diffusion method and the result was analyzed by one way ANOVA. The test to chemical material compounds performed with tube test and thin layer chromatography (TLC). The TLC result was analysed using comparative-descriptive analysis method.
The result of this research showed that polar extract of binahong leaf have not antibacterial activity against Bacillus subtilis and Pseudomonas aeruginosa. Based on tube test, the powder of binahong leaf related to flavonoid, alkaloid, polyphenol, and tannin. The TLC result showed that polar extract of binahong leaf contain of flavonoid, alkaloid, and tannin.
Keywords : antibacterial potency, binahong leaf, Bacillus subtilis, Pseudomonas aeruginosa, diffusion method, tube test, TLC
DAFTAR ISI
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN ... iv
KATA PENGANTAR ... v
PERNYATAAN KEASLIAN KARYA ... viii
INTISARI... ix
ABSTRACT...x
DAFTAR ISI... xi
DAFTAR TABEL... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN... xvii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian Penelitian... 3
3. Manfaat Penelitian ... 4
B. Tujuan Penelitian ... 4
BAB II. PENELAAHAN PUSTAKA... 5
A. Binahong ... 5
1. Deskripsi ... 5
2. Kandungan Kimia ... 6
3. Khasiat dan Kegunaan ... 6
B. Penyarian... 6
C. Ekstrak Etanol ... 9
D. Kromatografi Lapis Tipis (KLT) ... 9
E. Uraian Kandungan Kimia Tumbuhan ... 11
1. Alkaloid... 11
H. Metode Pengujian Potensi Antibakteri... 18
I. Bakteri Uji... 20
J. Antibakteri ... 21
K. Keterangan Empiris... 22
BAB III. METODOLOGI PENELITIAN ... 23
A. Jenis Penelitian... 23
B. Variabel Penelitian dan Definisi Operasional ... 23
1. Variabel Penelitian ... 23
2. Definisi Operasional ... 23
C. Bahan dan Alat Penelitian... 25
1. Bahan ... 25
2. Alat ... 25
D. Tata Cara Penelitian ... 26
1. Identifikasi Tanaman... 26
2. Pengumpulan Bahan dan Pengeringan... 26
3. Pembuatan Serbuk... 26
4. Uji Tabung ... 26
5. Pembuatan Ekstrak Polar Daun Binahong ... 28
6. Pembuatan Sampel untuk KLT ... 29
7. Identifikasi Kualitatif Senyawa Ekstrak Polar Daun Binahong dengan metode KLT... 29
8. Uji potensi ekstrak polar daun binahong terhadap B. subtilis dan P. aeruginosa dengan metode difusi paper disk... 30
E. Analisis Hasil ... 32
BAB IV. HASIL DAN PEMBAHASAN ... 33
A. Identifikasi Tanaman... 33
B. Pengumpulan Bahan, Pengeringan, dan Pembuatan Serbuk... 33
C. Identifikasi Kandungan Senyawa Aktif Ekstrak Polar Daun Binahong dengan Uji Tabung ... 35
D. Pembuatan Ekstrak Polar ... 40
E. Identifikasi Kualitatif Senyawa Ekstrak Polar Daun Binahong dengan Metode Kromatografi Lapis Tipis (KLT)... 42 F. Uji Potensi Antibakteri Ekstrak Polar Daun Binahong
Terhadap Bacillus subtilis dan Pseudomonas aeruginosa
dengan Metode Difusi paper disk... 49
BAB V. KESIMPULAN DAN SARAN... 53
A. Kesimpulan ... 53
B. Saran... 53
DAFTAR PUSTAKA ... 54
LAMPIRAN... 57
BIOGRAFI PENULIS ... 72
DAFTAR TABEL
Tabel I. Pembuatan variasi konsentrasi ekstrak polar daun binahong ... 30 Tabel II. Hasil pengamatan uji tabung terhadap serbuk daun binahong... 35 Tabel III. Hasil identifikasi kualitatif ekstrak polar daun binahong
untuk pemeriksaan alkaloid secara KLT dengan fase diam silika gel GF 254 dan fase gerak etil asetat: metanol: air
(70:20:10)... 44 Tabel IV. Hasil identifikasi kualitatif ekstrak polar daun binahong
untuk pemeriksaan fenolik secara KLT dengan fase diam silika gel GF 254 dan fase gerak toluen: etil asetat: metanol
(70:20:10)………... 45
Tabel V. Hasil identifikasi kualitatif ekstrak polar daun binahong untuk pemeriksaan flavonoid secara KLT dengan fase diam selulosa dan fase gerak butanol: asam asetat: air (4:1:5) ... 47 Tabel VI. Hasil identifikasi kualitatif ekstrak polar daun binahong untuk
pemeriksaan tanin secara KLT dengan fase diam silika gel
GF 254 dan fase gerak etil asetat: metanol: air (100:13,5:10) ... 48 Tabel VII. Rata-rata diameter zona hambat amoksisilin terhadap Bacillus subtilis dengan metode difusi paper disk ...50 Tabel VIII. Rata-rata diameter zona hambat ekstrak polar daun binahong
terhadap Pseudomonas aeruginosa dengan metode difusi
paper disk ...51
DAFTAR GAMBAR
Gambar 1. Reaksi antara senyawa fenolik dengan FeCl3……… 39
Gambar 2. Reaksi antara NaCl dengan senyawa fenolik……… 39 Gambar 3. Reaksi antara flavonoid dengan NH3……… 46
DAFTAR LAMPIRAN
Lampiran 1. Surat pengesahan determinasi ... 57 Lampiran 2. Foto tanaman binahong (Anredera cordifolia (Tenore)
Steen) ... 58 Lampiran 3. Foto serbuk daun binahong………... .... 59 Lampiran 4. Foto Hasil Identifikasi Kualitatif Uji Tabung Serbuk Daun
Binahong untuk Pemeriksaan Pendahuluan………. .... 60 Lampiran 5. Foto Hasil Identifikasi Kualitatif Uji Tabung Serbuk Daun
Binahong untuk Pemeriksaan Antrakinon……… 60 Lampiran 6. Foto Hasil Identifikasi Kualitatif Uji Tabung Serbuk Daun
Binahong untuk Pemeriksaan Alkaloid ………... 61 Lampiran 7. Foto Hasil Identifikasi Kualitatif Uji Tabung Serbuk Daun
Binahong untuk Pemeriksaan Senyawa
Fenolik……… ... 62 Lampiran 8. Foto Hasil Identifikasi Kualitatif Uji Tabung Serbuk Daun
Binahong untuk Pemeriksaan Tanin……… .... 63 Lampiran 9. Foto Hasil Identifikasi Kualitatif Uji Tabung Serbuk Daun
Binahong untuk Pemeriksaan Saponin……… .... 63 Lampiran 10. Foto Hasil Identifikasi Kualitatif KLT Ekstrak Polar
Daun Binahong untuk Pemeriksaan Alkaloid dengan Deteksi UV 254 nm, 365 nm, dan pereaksi semprot
Dragendorff………… ... 64
Lampiran 11. Foto Hasil Identifikasi Kualitatif KLT Ekstrak Polar Daun Binahong untuk Pemeriksaan Senyawa Fenolik dengan Deteksi UV 254 nm, 365 nm, dan pereaksi
semprot FeCl3 ...65
Lampiran 12. Foto Hasil Identifikasi Kualitatif KLT Ekstrak Polar DaunBinahong untuk Pemeriksaan Flavonoid dengan
Deteksi UV 254 nm, 365 nm, dan Uap Amonia ... 66 Lampiran 13. Foto Hasil Identifikasi Kualitatif KLT Ekstrak Polar
Daun Binahong untuk Pemeriksaan Tanin dengan deteksi UV 254 nm, 365 nm, dan pereaksi semprot FeCl3... 67
Lampiran 14. Kontrol konatminasi media dan kontrol pertumbuhan
bakteri Bacillus subtilis ... 68 Lampiran 15. Foto Uji Potensi Antibakteri Ekstrak Polar Daun Binahong terhadap Bacillus subtilis dengan Metode Difusi
paper disk………… ... 69 Lampiran 16. Kontrol kontaminasi media dan kontrol pertumbuhan
Bakteri Pseudomonas aeruginosa...70 Lampiran 17. Foto Uji Potensi Antibakteri Ekstrak Polar Daun Binahong
terhadap Pseudomonas aeruginosa dengan Metode Difusi paper disk... 71
BAB I PENGANTAR
A. Latar Belakang
Daun tanaman binahong (Anredera cordifolia (Tenore) Steen) secara tradisional telah dikenal oleh masyarakat sebagai obat alami, diantaranya berkhasiat sebagai obat gatal-gatal pada kulit, obat infeksi pada luka, mengobati luka setelah operasi, mengobati luka bakar, dan disentri. Selain itu, daun, umbi, dan herba tanaman binahong juga dapat digunakan untuk memulihkan stamina yang loyo, typus, maag, radang usus dan ambeien. Dapat pula mengatasi pembengkakan dan pembekuan darah, memulihkan kondisi lemah setelah sakit, rematik, luka memar terpukul, asam urat, dan mencegah stroke (Anonim, 2006).
Meskipun dalam masyarakat binahong telah digunakan sebagai obat, penelitian pendukung mengenai kandungan kimia yang terdapat pada tanaman belum diketahui dengan pasti. Penelitian mengenai kegunaan binahong juga masih terbatas. Dari penelitian yang pernah dilakukan mengemukakan bahwa ekstrak kloroform herba (Anredera cordifolia (Tenore) Steen) dapat menghambat pertumbuhan beberapa bakteri (Meyer, 2004).
maag, typus, disentri, mencegah stroke, asam urat, dan sakit pinggang. Untuk pemakaian luar, daun dan batang ditumbuk halus kemudian dioleskan pada bagian yang sakit. Misalnya untuk menyembuhkan memar karena terpukul, terkena api, rheumatik, pegal linu, nyeri urat, gatal-gatal dan menghaluskan kulit (Anonim, 2006).
Penyari yang digunakan pada seduhan maupun rebusan adalah air. Air digunakan sebagai penyari karena mudah didapat, murah, stabil, tidak mudah menguap, tidak mudah terbakar, tidak beracun, dan alamiah. Namun, sebagai penyari air juga mempunyai beberapa kerugian yaitu tidak selektif, sari dapat ditumbuhi kapang dan kuman, serta cepat rusak dan untuk pengeringan dibutuhkan waktu lama. Oleh karena itu, sediaan dalam penelitian ini dibuat dalam bentuk ekstrak polar dengan penyari etanol. Etanol dipilih sebagai penyari karena lebih selektif, kapang dan kuman sulit tumbuh dalam etanol 20% ke atas, tidak beracun, netral, serta dapat bercampur dengan air pada segala perbandingan (Anonim, 1986). Sebelum dimaserasi dengan etanol, dilakukan penyarian dengan kloroform untuk menghilangkan senyawa kurang polar seperti lemak dan klorofil yang dapat mengganggu penyarian (Mursyidi, 1990).
3
Berdasarkan manfaat daun binahong dalam bidang pengobatan, khususnya sebagai antibakteri, maka perlu adanya penelitian mengenai potensi antibakteri ekstrak polar daun binahong terhadap P. aeruginosa dan B. subtilis yang ditunjukkan dengan diameter zona hambat, Kadar Hambat Minimum (KHM), dan Kadar Bunuh Minimum (KBM). Penelitian juga bertujuan untuk mengetahui kandungan kimia yang mungkin terdapat dalam daun binahong yang memiliki potensi antibakteri terhadap P. aeruginosa dan B. subtilis.
1. Rumusan masalah
Berdasarkan latar belakang yang telah dipaparkan, maka dapat dirumuskan permasalahan sebagai berikut:
a. Apakah ekstrak polar daun binahong memiliki potensi antibakteri terhadap P. aeruginosa dan B. subtilis ?
b. Berapa KHM dan KBM ekstrak polar daun binahong yang mampu membunuh atau menghambat pertumbuhan P. aeruginosa dan B. subtilis? c. Apa senyawa kimia yang terdapat dalam serbuk dan ekstrak polar daun
binahong yang diduga memiliki potensi antibakteri terhadap P. aeruginosa dan B. subtilis?
2. Keaslian penelitian
(Meyer, 2004). Sedangkan penelitian tentang potensi antibakteri ekstrak polar daun binahong (Anredera cordifolia (Tenore) Steen) terhadap P. aeruginosa dan B. subtilis belum pernah dilakukan.
3. Manfaat penelitian
Penelitian mengenai potensi antibakteri ekstrak polar daun binahong diharapkan memiliki beberapa manfaat antara lain:
a. Manfaat teoritis
Hasil penelitian diharapkan dapat memberi informasi tentang potensi antibakteri ekstrak polar daun binahong sebagai antibakteri pada pengobatan tradisional.
b. Manfaat praktis
Hasil penelitian diharapkan dapat memberi alternatif penggunaan daun binahong sebagai obat yang berkhasiat antibakteri.
B. Tujuan Penelitian
1. Mengetahui ada atau tidak potensi antibakteri ekstrak polar daun binahong terhadap P. aeruginosa dan B. subtilis.
2. Mengetahui KHM dan KBM ekstrak polar daun binahong yang mampu membunuh atau menghambat pertumbuhan P. aeruginosa dan B. subtilis. 3. Mengetahui senyawa kimia yang terdapat dalam serbuk dan ekstrak polar
BAB II
PENELAAHAN PUSTAKA
A. Binahong (Anredera cordifolia (Tenore) Steen)
1. Deskripsi
Binahong merupakan tumbuhan yang termasuk dalam familia Basellaceae dengan genus Anredera dan spesies Anredera cordifolia (Tenore) Steen.
pada bagian basal berlekatan, panjang 2-4 mm, putik satu dengan panjang 1-2 mm. Akar merupakan akar tunggang (Webb et al., 1988).
2. Kandungan Kimia
Anredera cordifolia (Tenore) Steen mengandung asam askorbat dan fenol dalam jumlah kecil (Sato, Nagata, dan Engle, 2005). Basellaceae lainnya yaitu Anredera diffusa mengandung asam oleanolik yang berperan dalam proses wound healing (Moura-Letts dan Marcalo, 2006).
3. Khasiat dan Kegunaan
Bagian dari tanaman ini yang berkhasiat sebagai obat yaitu umbi, daun, dan akarnya (Anonim, 1994). Tanaman ini memiliki khasiat sebagai antiinflamasi, anti ulcer, dan perlindungan terhadap hati (hepatic) (Anonim, 2005). Selain itu, tanaman binahong secara empiris digunakan untuk mengobati gatal-gatal pada kulit, mengobati infeksi pada luka, mengobati luka setelah operasi, mengobati luka bakar, memulihkan stamina yang loyo, typus, maag, radang usus, disentri, dan ambeien. Dapat pula mengatasi pembengkakan dan pembekuan darah, memulihkan kondisi lemah setelah sakit, rematik, luka memar terpukul, asam urat dan mencegah stroke (Anonim, 2006).
B. Penyarian
7
terdapat dalam berbagai simplisia dapat digolongkan ke dalam alkaloida, glikosida, flavonoid, dan lain-lain. Struktur kimia yang berbeda-beda akan mempengaruhi kelarutan serta stabilitas senyawa-senyawa tersebut terhadap pemanasan, logam berat, udara, cahaya, dan derajat keasaman. Dengan diketahuinya zat aktif yang dikandung simplisia akan mempermudah pemilihan cairan penyari dan cara penyarian yang tepat. Penyarian disamping memperhatikan sifat fisik simplisia dan zat aktifnya, harus juga memperhatikan zat-zat yang sering terdapat dalam simplisia seperti protein, karbohidrat, lemak dan gula. Dalam pemilihan cairan penyari harus mempertimbangkan banyak faktor. Cairan penyari yang baik harus memenuhi kriteria murah dan mudah diperoleh, stabil secara fisika dan kimia, bereaksi netral, tidak mudah menguap dan tidak mudah terbakar, selektif, tidak mempengaruhi zat berkhasiat, serta diperbolehkan oleh peraturan (Anonim, 1986).
Cara penyarian dapat dibedakan menjadi sebagai berikut: 1. Infundasi
2. Maserasi
Maserasi merupakan cara penyarian yang sederhana. Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Maserasi dilakukan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari, tidak mengandung zat yang mudah mengembang dalam cairan penyari, tidak mengandung benzoin, stirak dan lain- lain. Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol atau pelarut lain. Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan. Sedangkan kerugiannya yaitu pengerjaan lama dan penyariannya kurang sempurna. Maserasi umumnya dilakukan dengan cara 10 bagian simplisia dengan derajat halus yang cocok dimasukkan ke dalam bejana, kemudian dituangi dengan 75 bagian cairan penyari (Anonim, 1986). 3. Perkolasi
9
4. Penyarian Berkesinambungan
Prinsip kerjanya yaitu, cairan penyari diisikan pada labu, serbuk simplisia diisikan pada tabung dari kertas saring atau tabung yang berlubang- lubang dari gelas baja tahan karat atau bahan lain yang cocok. Cairan penyari dipanaskan hingga mendidih. Uap penyari akan naik ke atas melalui serbuk simplisia. Uap penyari mengembun karena didinginkan oleh pendingin balik. Embun turun melalui serbuk simplisia sambil melarutkan zat aktifnya dan kembali ke labu. Cairan akan menguap kembali berulang proses seperti di atas (Anonim, 1986).
C. Ekstrak Etanol
Ekstrak adalah sediaan kering, kental, atau cair yang dibuat dengan menyari simplisia nabati atau hewani menurut cara yang cocok, di luar pengaruh cahaya matahari langsung. Ekstrak kering harus mudah digerus menjadi serbuk (Anonim, 1993).
Etanol meskipun harganya mahal, tetap dipertimbangkan sebagai penyari karena lebih selektif; kapang, khamir dan kuman lebih sulit tumbuh dalam etanol 20% keatas; dapat bercampur dengan air pada segala perbandingan; pengeringan diperlukan waktu sebentar. Etanol dapat melarutkan alkaloid, glikosida, flavonoid, damar, klorofil, lemak, tanin dan saponin (Anonim, 1986).
D. Kromatografi Lapis Tipis (KLT)
pada penyangga berupa pelat gelas, logam, atau lapisan yang cocok. Campuran yang akan dipisah, berupa larutan, ditotolkan berupa bercak atau pita (awal). Setelah pelat atau lapisan ditaruh di dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak), pemisahan terjadi selama perambatan kapiler (pengembangan) (Stahl, 1985). Macam-macam fase diam antara lain: (Sastrohamidjojo, 1991)
1). Silika, untuk memisahkan asam-asam amino, alkaloid, gula, asam lemak, minyak atsiri, terpenoid, anion dan kation organik.
2). Alumina, untuk memisahkan alkaloid, zat warna, steroid, vitamin, asam amino.
3). Kieselguhr, untuk memisahkan gula, asam-asam dibasa, asam lemak, asam amino, steroid.
4). Selulosa, untuk memisahkan asam amino, alkaloid. 5). Sephadex, untuk memisahkan asam amino.
Fase diam yang umum digunakan adalah silika gel. Fase diam terikat dan melekat pada pelat kaca karena adanya pengikat, misalnya kalsium sulfat hidrat (CaSO. n H2O), pati atau silikat berbobot molekul rendah. Untuk membentuk
11
Fase gerak merupakan medium angkut yang terdiri dari satu atau beberapa pelarut. Fase gerak bergerak dalam fase diam, yaitu suatu lapisan berpori karena adanya gaya kapiler. Yang digunakan adalah pelarut yang bertingkat mutu analitik dan bila diperlukan sistem pelarut multi komponen maka harus berupa suatu campuran sesederhana mungkin yang terdiri atas maksimum tiga komponen (Stahl, 1985).
Deteksi senyawa yang dipisah dapat dilakukan dengan lampu UV untuk eksitasi fluoresensi, pereaksi semprot yang dilanjutkan dengan pemanasan agar memperoleh warna yang optimum, dan deteksi biologi (Stahl, 1985).
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan angka Rf atau hRf. Harga Rf dinyatakan sebagai perbandingan antara jarak titik pusat bercak dari titik awal dengan jarak garis depan dari titik awal. Angka Rf berjangka antara 0,00 dan 1,00 dan hanya dapat ditentukan dua desimal. hRf ialah angka Rf dikalikan faktor 100 (h), menghasilkan nilai berjangka 0 sampai 100 (Stahl, 1985).
E. Uraian tentang Kandungan Kimia Tumbuhan 1. Alkaloid
Kebanyakan alkaloid menunjukkan aktifitas fisiologis tertentu. Alkaloid seringkali beracun bagi manusia dan banyak yang mempunyai kegiatan fisiologi yang menonjol, jadi digunakan secara luas dalam bidang pengobatan (Harborne, 1987).
Alkaloid biasanya tanwarna, seringkali bersifat optis aktif, kebanyakan berbentuk kristal, tetapi hanya sedikit yang berupa cairan (misalnya nikotina) pada suhu kamar (Harborne, 1987).
Secara kimia, alkaloid merupakan suatu golongan heterogen. Ia berkisar dari senyawa sederhana seperti koniina, yaitu alkaloid utama Conium maculatum, sampai ke struktur pentasiklik seperti strikhnina, yaitu racun kulit stychnos (Harborne, 1987).
13
2. Flavonoid
Flavonoid adalah senyawa fenol alam yang terdapat dalam hampir semua tumbuhan dari bangsa Algae hingga Gymnospermae. Pada tumbuhan tinggi, flavonoid terdapat baik dalam bagian vegetatif maupun dalam bunga. Sebagai pigmen bunga, flavonoid berperan jelas dalam menarik burung dan serangga penyerbuk bunga (Robinson, 1991). Flavonoid menunjukkan aktivitas sebagai anti alergi, antiinflamasi, antimikroba, dan antikanker (Anonim, 2007).
KLT untuk analisis senyawa flavonoid dapat dilakuakan dengan fase diam selulosa (sangat cocok untuk isolasi flavonoid), silika, dan poliamid. Butanol: asam asetat: air (4:1:5) fase atas, merupakan fase gerak yang sering digunakan (Mursyidi, 1990).
Pada UV 254 nm, semua flavonoid menyebabkan pemadaman fluoresensi, dimana terlihat sebagai warna biru gelap pada lempeng KLT. Pada UV 365 nm, tergantung pada strukturnya, flavonoid berfluoresensi kuning, biru, atau hijau (Wagner, 1984).
3. Fenolik
Beberapa senyawa fenolik bersifat racun terhadap hewan pemangsa tumbuhan dan beberapa bersifat racun serangga. Senyawa fenolik lain mempunyai aktivitas antiinflamasi, karena dapat menghambat sintesis prostaglandin (Robinson, 1991).
fase gerak lain tergantung jenis polifenol yang terdapat dalam tanaman. Deteksi dapat dilakukan dengan Besi (III) klorida yang akan menghasilkan warna kuning tua sampai violet yang intensif. Bercak biru atau kehijauan juga dihasilkan (Stahl, 1969).
Hanya antosianin dan beberapa derivat quinon yang dapat dideteksi secara langsung dengan sinar tampak pada lempeng silika gel. Senyawa fenolik lainnya, merupakan senyawa yang tidak berwarna dan harus diwarnai (Stahl, 1969).
4. Tanin
Tanin terdapat luas dalam tumbuhan berpembuluh, dalam angiospermae terdapat khusus dalam jaringan kayu. Secara kimia terdapat dua jenis utama tanin, yaitu tanin terkondensasi dan terhidrolisis (Harborne, 1987).
Tanin terhidrolisis dapat dihidrolisis oleh asam atau enzim seperti tanase. Tanin jenis ini terbentuk dari beberapa molekul asam fenolik seperti asam galat dan asam heksahidroksidipenik yang disatukan oleh ikatan ester dengan molekul glukosa. Sedangkan tanin terkondensasi tidak terhidrolisis menjadi molekul yang lebih sederhana dan tidak mengandung gugus gula (Trease dan Evans, 2002).
Makin murni tanin, makin kurang kelarutannya dalam air, dan makin mudah diperoleh dalam bentuk kristal. Tanin larut pula, setidak-tidaknya sampai batas tetentu dalam pelarut organik yang polar, tetapi tidak larut dalam pelarut organik non polar seperti benzena atau kloroform. Larutan tanin dalam air dapat diendapkan dengan penambahan asam mineral atau garam (Robinson, 1991).
15
F. Media
Media adalah suatu bahan yang terdiri atas campuran nutrisi yang dipakai untuk menumbuhkan mikrobia. Selain untuk menumbuhkan mikrobia, medium dapat digunakan pula untuk isolasi, memperbanyak, pengujian sifat- sifat fisiologi dan perhitungan jumlah mikrobia (Jutono, 1980).
Lazimnya, media biakan mengandung air, sumber energi, zat hara sebagai sumber karbon, nitrogen, sulfur, phosphat, oksigen, hidrogen, serta trace elements. Media biakan yang digunakan untuk menumbuhkan bakteri terdapat dalam bentuk padat ( padat datar, padat miring, dan padat tegak) , semi padat, dan cair. Media padat diperoleh dengan menambahkan agar. Agar berasal dari ganggang merah. Agar digunakan sebagai bahan pemadat karena tidak diuraikan mikroorganisme. Kandungan agar sebagai bahan pemadat dalam media adalah 1,5-2% (Lay, 1994).
digunakan dalam laboratorium mikrobiologi karena mudah disiapkan dan harganya lebih murah dibandingkan media sintetik (Lay, 1994).
G. Sterilisasi
Sterilisasi ialah suatu usaha untuk membebaskan alat-alat atau bahan- bahan dari segala macam bentuk kehidupan terutama mikrobia. Cara sterilisasi yang dipakai tergantung pada macamnya bahan dan sifat bahan yang disterilkan (ketahanan terhadap panas, bentuk bahan yang disterilkan: padat, cair atau berbentuk gas) (Jutono, 1980).
Hampir semua tindakan yang dilakukan dalam diagnosa mikrobiologis, sterilitas sangat diutamakan baik alat-alat yang dipakai maupun medianya. Terdapat berbagai cara sterilisasi yang dikenal: (Anonim, 1993)
1. Pemanasan
Tujuan dari sterilisasi dengan pemanasan yaitu untuk merusak atau membunuh mikroba. Sterilisasi dengan pemanasan dapat dilakukan dengan panas kering dan panas basah.
a. Panas Kering
- Dengan membakar: cara ini digunakan untuk sterilisasi alat-alat yang berupa logam seperti ose, pinset dan alat gelas seperti ujung pipet, bibir tabung, bibir atau mulut erlenmeyer pada penuangan media. Alat yang digunakan yaitu lampu spiritus atau bunsen.
17
pipet, juga untuk bahan-bahan minyak dan powder, misalnya talk. Sterilisasi dikerjakan dengan panas 175˚C selama 1,5- 2 jam.
b. Panas Basah
- Dengan merebus: digunakan untuk mensterilkan alat-alat yang berupa gunting, pinset, scalpel, jarum, spuit injeksi dengan cara direbus dalam suasana mendidih selama 30-60 menit.
- Dengan uap air panas: digunakan terutama untuk mensterilkan media-media yang akan mengalami kerusakan bila dikerjakan sterilisasi uap panas dengan tekanan, ataupun untuk alat-alat tertentu. Cara ini dilakukan dengan pemanasan 100˚C selama 1 jam.
- Dengan uap air bertekanan (autoclave): cara ini dipakai untuk sterilisasi media yang tahan terhadap pemanasan tinggi. Sterilisasi dijalankan dengan menggunakan panas 121˚C selama 10-30 menit tergantung kebutuhan. Sterilisasi basah lebih cepat dibanding sterilisasi kering.
- Pasteurisasi: digunakan untuk mensterilkan susu dan minuman beralkohol. Panas yang digunakan 61,7˚C selama 30 menit.
2. Filtrasi
Cara sterilisasi ini digunakan untuk media yang tidak tahan terhadap pemanasan misalnya urea broth ataupun untuk sterilisasi vaksin, serum, enzim, dan vitamin. Kelemahannya golongan virus mampu menembus filter sterilisasi.
3. Penyinaran atau radiasi
elektromagnetik, misalnya sinar ultra violet, sinar gamma, sinar X, dan juga sinar katoda (elektron kecepatan tinggi).
4. Khemis
Sterilisasi dengan menggunakan bahan kimia yang disebut desinfektan. Biasanya digunakan untuk obyek yang tidak hidup, karena akan merusak jaringan. Prosesnya disebut disinfeksi.
H. Metode Pengujian Potensi Antibakteri
Metode pengukuran potensi antibakteri dapat dilakukan dengan : 1. Metode Difusi
Metode ini mengukur aktivitas mikroba berdasarkan pengamatan luas daerah hambat pertumbuhan mikroba karena obat berdifusi dari titik awal pemberian ke daerah difusi. Mikroba ditanam pada media yang sesuai dan di atasnya diletakkan kertas cakram yang mengandung bahan obat atau dibuat sumuran dengan diameter tertentu yang diisi larutan bahan obat dengan obat dengan kadar tertentu (Hugo dan Russel, 1987).
a. Cara Kirby Bauer
19
dibandingkan daerah di luar pengaruh antibiotik tersebut (Hugo dan Russel, 1987).
b. Cara sumuran
Penyiapan dilakukan seperti cara Kirby Bauer. Pada agar yang telah diolesi bakteri uji dibuat sumuran dengan garis tengah tertentu dan tegak lurus terhadap permukaan media. Kemudian ke dalam sumuran ini diberi larutan uji dan diinkubasi pada 37ºC selama 24-28 jam, hasilnya dibaca seperti cara Kirby Bauer (Hugo dan Russel, 1987).
c. Cara Pour Plate
Mula-mula satu mata ose suspensi bakteri dicampur dengan 4 ml agar 1,5% pada temperatur 50ºC. Setelah suspensi mikrobia homogen, tuangkan di atas Mueller Hinton Agar dan dibiarkan membeku, kemudian di atasnya diletakan disk dan diinkubasi pada suhu 37ºC selama 18-24 jam, hasilnya dibaca dengan mengukur diameter hambat (Hugo dan Russel, 1987).
Hasil metode difusi adalah: (Anonim, 1992)
a. Zona irradikal adalah suatu daerah di sekitar disk atau sumuran yang menunjukkan pertumbuhan bakteri yang kurang subur atau jarang karena bakteri hanya dihambat, tidak dimatikan.
b. Zona radikal adalah suatu daerah di sekitar disk atau sumuran yang sama sekali tidak ditemukan adanya pertumbuhan bakteri.
2. Metode Dilusi
dibuat tersebut ditambahkan suspensi bakteri uji ke dalam media, sedangkan pada dilusi padat masing-masing konsentrasi obat yang telah dibuat dicampurkan ke dalam media agar dan setelah menjadi padat baru ditanami bakteri uji dan diinkubasi (Hugo dan Russel, 1987). Keuntungan metode ini dibandingkan dengan metode difusi adalah dapat menentukan KHM dan KBM dari larutan uji tersebut (Anonim, 1992).
I. Bakteri Uji 1. Bacillus subtilis
Bacillus subtilis termasuk dalam familia Bacillaceae, merupakan bakteri Gram positif, berbentuk batang silinder, berdiameter 1µm dengan panjang 3-4 µm, lurus atau sedikit lengkung dengan ujung bulat, tunggal atau rantai. Organisme ini bergerak aktif dengan peritritik flagella. Spora berbentuk oval dan terletak di tengah (Salle, 1961).
Basil saprofit menggunakan sumber-sumber nitrogen dan karbon untuk energi dan pertumbuhan. Spora resisten terhadap panas, kering, dan desinfektan kimia tertentu selama waktu yang cukup lama dan tetap ada selama bertahun- tahun dalam tanah kering (Jawetz et al, 1996).
21
2. Pseudomonas aeruginosa
Pseudomonas aeruginosa termasuk dalam familia Pseudomonadaceae, merupakan bakteri berbentuk batang, Gram-negatif, bergerak, aerob, berukuran sekitar 0,6 x 2 µm dan terlihat sebagai bakteri tunggal, berpasangan, kadang-kadang membentuk rantai yang pendek, dan membentuk koloni halus bulat dengan warna fluoresensi kehijauan (Jawetz et al, 1996).
P. aeruginosa menimbulkan infeksi pada luka dan luka bakar, menimbulkan nanah hijau kebiruan; meningitis, bila masuk bersama punksi lumbal; dan infeksi saluran kemih, bila masuk bersama kateter dan instrumen lain atau dalam larutan untuk irigasi. Keterlibatan saluran napas, terutama dari respirator yang terkontaminasi, mengakibatkan pneumonia yang disertai nekrosis. Bakteri ini dapat menyebabkan otitis eksterna invasif (maligna) pada penderita diabetes ( Jawetz et al, 1996).
J. Antibakteri
Antibakteri adalah obat pembasmi bakteri, khususnya bakteri yang merugikan manusia. Obat yang digunakan untuk membasmi bakteri, ditentukan harus memiliki sifat toksisitas selektif setinggi mungkin. Artinya obat tersebut haruslah bersifat toksik untuk bakteri, tetapi relatif tidak toksik untuk hospes (Anonim, 1995).
Amoksisilin mempunyai aktivitas yang sama dengan ampisilin. Bedanya, di Gastro Intestinal amoksisilin diserap lebih efektif dibanding ampisilin (Harvey et all, 2003).
Penisilin dan ampisilin diketahui memiliki aktivitas yang tinggi terhadap B. subtilis ( Weber, Saviteer, Rutala, dan Thomann, 1988). Luas wilayah jernih merupakan petunjuk kepekaan mikroorganisme terhadap antibiotik. Wilayah penghambatan ampisilin terhadap P. aeruginosa dikatakan susceptible/peka jika lebih dari 14 mm, intermediet 12-13 mm, dan resisten pada wilayah kurang dari 11 mm (Lay, 1994).
K. Keterangan Empiris
P. aeruginosa merupakan bakteri patogen utama pada manusia. P. aeruginosa bersifat invasif dan toksigenik, menimbulkan infeksi pada penderita bila fungsi pertahanan inang abnormal. Sedangkan B. subtilis adalah bakteri Gram positif yang mempunyai spora. Bakteri ini dapat menyebabkan iridociclitis, penopthalmitis dan memproduksi septicima. Dalam jumlah banyak dapat memproduksi enterotoksin yang dapat meracuni makanan.
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni dengan rancangan acak lengkap pola satu arah. Penelitian dilakukan di Laboratorium Farmakognosi Fitokimia dan Laboratorium Mikrobiologi Fakultas Farmasi Universitas Sanata Dharma.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel Penelitian
a. Variabel bebas : ekstrak polar daun binahong dengan konsentrasi 100%, 75%, 50%, dan 25% b/v.
b. Variabel tergantung : diameter zona hambat
c. Variabel pengacau terkendali : media pertumbuhan mikroba uji, waktu inkubasi 24 jam, suhu inkubasi 37ºC, kepadatan suspensi bakteri uji setara dengan larutan standar Mc. Farland II (6x 108 CFU/ml), umur tanaman, tempat tumbuh, diameter paper disk (6 mm), jenis bakteri uji, volume suspensi bakteri uji yang diinokulasikan dalam media (0,2 ml), volume larutan uji yang diinokulasikan dalam paper disk (20µl)
d. Variabel tak terkendali : suhu pengeringan bahan dengan sinar matahari 2. Definisi Operasional
yang dapat dilihat dari zona jernih yang menggambarkan zona hambat pertumbuhan bakteri, dibandingkan dengan CMC 1% sebagai pelarut.
b. Ekstrak polar daun binahong adalah ekstrak yang diperoleh dengan cara mengekstraksi 150 g serbuk daun binahong secara maserasi dengan pelarut kloroform, ampas hasil penyarian diangin-anginkan, kemudian ampas dimaserasi lagi dengan etanol etanol 70% sebanyak 3500 ml dan menghasilkan ekstrak kental sebanyak 22,24 g.
c. Metode difusi paper disk merupakan metode difusi dengan menggunakan paper disk yang diletakkan pada media yang telah ditanami bakteri. Ke dalam paper disk diberi larutan uji dan diinkubasi pada suhu 37º C selama 24 jam. d. Zona hambat adalah zona jernih yang tidak dijumpai pertumbuhan bakteri uji
B. subtilis dan P. aeruginosa dan zona yang masih terdapat bakteri uji B. subtilis dan P. aeruginosa dalam jumlah yang sedikit.
e. Daun binahong diambil dari tanaman binahong yang diperoleh dari kebun obat Balai Penelitian Tanaman Obat (BPTO) Tawangmangu.
f. Kultur murni Bacillus subtilis ATCC 6633 merupakan bakteri Gram positif berbentuk batang silinder, berdiameter 1µm dengan panjang 3-4 µm, lurus atau sedikit lengkung dengan ujung bulat, tunggal atau rantai dan diperoleh dari Dinas Kesehatan Propinsi D.I Yogyakarta.
25
C. Bahan dan Alat Penelitian 1. Bahan
a. Daun tanaman binahong yang berupa simplisia kering diperoleh dari kebun obat Balai Penelitian Tanaman Obat (BPTO) Tawangmangu.
b. Kultur murni B. subtilis ATCC 6633 merupakan bakteri Gram positif berbentuk batang dan diperoleh dari Dinas Kesehatan Propinsi D.I Yogyakarta.
c. Kultur murni P. aeruginosa ATCC 27853 merupakan bakteri Gram negatif, berbentuk batang dan diperoleh dari Dinas Kesehatan Propinsi D.I Yogyakarta.
d. Medium Nutrient Agar (NA), larutan Mc. Farland II (6x 108 CFU/ml), paper disk, amoksisilin injeksi kering (Danoxilin® 1000 mg), CMC 1%, aquadest steril, Silika gel GF 254 (E. Merck), toluen, etil asetat, metanol, air, butanol, asam asetat glasial, pereaksi semprot Dragendorff, pereaksi semprot FeCl3,
uap amonia, skopolamin, eugenol, rutin, asam tanat. 2. Alat
D. Tata Cara Penelitian 1. Identifikasi tanaman
Identifikasi tanaman binahong dilakukan oleh Balai Penelitian Tanaman Obat (BPTO) Tawangmangu.
2. Pengumpulan bahan dan pengeringan
Daun binahong yang diperoleh dari kebun Balai Penelitian Tanaman Obat (BPTO) Tawangmangu berupa simplisia kering.
3. Pembuatan serbuk
Pembuatan serbuk dilakukan dengan menggunakan blender kering sampai diperoleh serbuk halus. Kemudian dilakukan pengayakan dengan menggunakan pengayak berukuran 12/50 sampai semua serbuk dapat melewati ayakan.
4. Uji tabung a. Uji pendahuluan
Dua gram serbuk daun binahong dipanaskan dengan 10 ml air selama 30 menit di atas air mendidih. Larutan yang diperoleh disaring melalui kapas. Jika larutan menjadi berwarna kuning sampai merah dan bila pada saat penambahan kalium hidroksida warna larutan menjadi lebih intensif berarti menunjukkan adanya senyawa yang mengandung kromofor dengan gugus hidrofilik.
b. Uji alkaloid
27
ditambah 3 tetes pereaksi Mayer. Bila terbentuk endapan dengan kedua pereaksi alkaloid berarti menunjukkan adanya alkaloid. Adanya alkaloid dari basa tertier dan kuartener ditunjukkan dengan penambahan serbuk natrium karbonat sampai pH 8-9, dicampur dengan 4 ml kloroform dan diaduk pelan. Setelah kloroform memisah, diambil dengan pipet Pasteur, ditambahkan asam cuka 5% hingga pH 5. diaduk lalu dipisahkan lapisan atasnya, tambah 5 tetes pereaksi Dragendroff pada lapisan atas, bila terbentuk endapan menunjukkan alkaloid dari basa kuartener. Lapisan bawah ditambah 10 tetes asam klorida 1% diaduk dan dipisahkan lapisan atas serta ditambah 2 tetes pereaksi Dragendroff. Bila didapatkan endapan berarti menunjukkan alkaloid dari basa tertier.
c. Uji antrakinon
Tiga ratus miligram serbuk daun binahong dididihkan 2 menit dengan 10 ml kalium hidroksida 0,5 N dan 1 ml larutan hidrogen peroksida, setelah dingin suspensi disaring melalui kapas. Lima ml filtrat ditambah 10 tetes asam asetat sampai pH 5, ditambahkan 10 ml toluen. Lima ml lapisan atas dipisahkan dengan dipipet dan dimasukkan dalam tabung reaksi. Ditambah kalium hidroksida 0,5 N, bila didapatkan warna merah pada lapisan air berarti menunjukkan adanya senyawa antrakinon.
d. Uji polifenol
menunjukkan adanya polifenol. Uji diulang dengan filtrat hasil pendidihan 2 g serbuk dengan 9-10 ml etanol 80% selama 10 menit dalam pengangas air.
e. Uji tanin
Dua gram serbuk daun binahong dipanaskan dengan 10 ml air selama 30 menit di atas penangas air. Disaring 5 ml filtrat ditambah 1 ml larutan NaCl 2%, bila terjadi suspensi atau endapan disaring melalui kertas saring. Filtrat ditambah 5 ml larutan gelatin 1%. Bila terbentuk endapan menunjukkan adanya tanin. f. Uji saponin
1) Tambahkan 10 ml air suling ke dalam tabung reaksi yang berisi 100 mg serbuk daun binahong, ditutup dan dikocok kuat-kuat selama 30 detik. Tabung dibiarkan dalam posisi tegak selama 30 menit. Apabila terbentuk buih setinggi kurang lebih 3 cm dari permukaan cairan, menunjukkan adanya saponin.
2) Uji lain dilakukan dengan pipa kapiler (diameter 1 mm, panjang 12,5 cm). Larutan hasil pemanasan 2 g serbuk daun binahong dengan 10 ml air dipanaskan selama 30 menit di atas penangas air. Setelah disaring, filtrat dimasukkan ke dalam pipa kapiler penuh-penuh. Kapiler diletakkan dalam posisi tegak, lalu cairan dibiarkan mengalir bebas. Tinggi air suling yang diperlakukan sama. Bila didapatkan tinggi cairan yang diuji setengah atau kurang dari tinggi air suling maka menunjukkan adanya saponin. 5. Pembuatan ekstrak polar daun binahong
29
dengan platform shaker. Hasil penyarian disaring dengan corong dan ampas dari hasil penyarian ini dikeringkan dengan diangin-anginkan agar sisa kloroform menguap. Ampas kemudian dimaserasi dengan 3500 ml etanol 70% selama 3 x 24 jam dalam Erlenmeyer ditutup aluminium foil. Setelah disaring, maserat diuapkan dengan rotaevaporator hingga pekat. Maserat pekat kemudian diuapkan lagi di oven hingga diperoleh ekstrak kental.
6. Pembuatan sampel untuk KLT
Pembuatan sampel untuk KLT dengan konsentrasi 10% dilakukan dengan melarutkan 0,5 g serbuk daun binahong dalam 5 ml etanol 70%.
7. Identifikasi kualitatif senyawa ekstrak polar daun binahong dengan metode Kromatografi Lapis Tipis (KLT)
a. Uji KLT alkaloid
Fase diam yang digunakan adalah silika gel GF 254 dan fase gerak etil asetat: metanol: air (70:20:10). Sebagai pembanding digunakan skopolamin. Sampel dan pembanding ditotolkan bersama-sama pada lempeng KLT, kemudian dielusi dengan jarak 10 cm. Setelah itu dideteksi di bawah sinar UV 254 dan 365 nm, kemudian dideteksi dengan pereaksi semprot Dragendorff.
b. Uji KLT senyawa fenolik
c. Uji KLT flavonoid
Fase diam yang digunakan yaitu selulosa dengan fase gerak butanol: asam asetat glasial: air (4:1:5). Pembanding yang digunakan yaitu rutin. Sampel dan pembanding ditotolkan pada lempeng KLT dengan jarak elusi 10 cm. Setelah itu dideteksi dengan sinar UV 254 nm, UV 365 nm dan uap amonia.
e. Uji KLT tanin
Fase diam yang digunakan yaitu silika gel GF 254 dengan fase gerak etil asetat: metanol: air (100: 13,5: 10). Pembanding yang digunakan yaitu asam tanat 1%. Sampel dan pembanding ditotolkan pada lempeng KLT dengan jarak elusi 10 cm. Setelah itu dideteksi dengan sinar UV 254 nm, 365 nm, dan pereaksi semprot besi (III) klorida.
8. Uji potensi ekstrak polar daun binahong terhadap B. subtilis dan P. aeruginosa dengan metode difusi paper disk
a. Pembuatan konsentrasi larutan uji
Ekstrak polar daun binahong dengan konsentrasi 75%, 50%, dan 25% dibuat dengan mengencerkan ekstrak konsentrasi 100%, sampai kadar yang diinginkan dalam volume 5 ml. Pembuatan konsentrasi 100% dilakukan dengan menimbang 10 g ekstrak kental kemudian dilarutkan dalam 10 ml CMC 1%. Tabel I. Pembuatan variasi konsentrasi ekstrak polar daun binahong
31
Sebagai kontrol negatif digunakan larutan CMC 1% dan kontrol positif amoksisilin (0,03 g/1ml).
b. Persiapan stok bakteri uji
Diambil 1 ose bakteri dari biakan murni B. subtilis dan P. aeruginosa, kemudian masing-masing ditanam pada media nutrien agar miring, lalu diinkubasi selama 24 jam pada suhu 37˚C.
c. Pembuatan suspensi bakteri uji B. subtilis dan P. aeruginosa
Beberapa ose bakteri uji dari stok bakteri, kemudian diinokulasikan pada 2 ml media nutrien broth steril yang telah diinkubasi selama 24 jam suhu 37˚C, homogenkan dengan vortex, kemudian disesuaikan kekeruhannya dengan standar Mc. Farland II (6x 108 CFU/ml). Suspensi bakteri yang diperoleh telah siap diinokulasikan ke dalam media nutrien agar yang steril.
d. Pembiakan suspensi B. subtilis dan P. aeruginosa secara spread plate
Diambil 0,2 ml bakteri dari suspensi bakteri uji yang telah setara dengan larutan standar Mc. Farland II (6 x 108 CFU/ml), kemudian diinokulasikan secara spread plate ke dalam cawan petri yang berisi 20 ml media nutrien agar steril yang telah memadat.
e. Pengujian potensi antibakteri
diinkubasi selama 24 jam pada suhu 37ºC. Diukur diameter zona hambatnya menggunakan penggaris.
f. Pengujian potensi antibakteri dengan metode dilusi padat
Pada Erlenmeyer yang berisi 20 ml media nutrien agar steril dimasukkan 0,2 ml suspensi bakteri uji, kemudian tambahkan pula 1 ml larutan uji, campur dengan vortex. Masukkan campuran tersebut dalam cawan petri steril secara pour plate. Inkubasi selama 24 jam pada suhu 37ºC. Diamati pertumbuhan bakteri yang terjadi dengan melihat kekeruhan yang dibandingkan dengan kontrol pertumbuhan bakteri. Pada hasil inkubasi yang jernih diambil satu ose dan ditanam secara streak plate pada media padat steril dan diinkubasi selama 24 jam pada suhu 37º C kemudian diamati pertumbuhan bakteri sampai didapatkan nilai KHM dan KBM.
E. Analisis Hasil
BAB IV
HASIL DAN PEMBAHASAN
A. Identifikasi Tanaman
Daun binahong yang digunakan dalam penelitian ini diambil dari kebun obat Balai Penelitian Tanaman Obat (BPTO) Tawangmangu, Karanganyar, Surakarta, Jawa Tengah. Diidentifikasi di BPTO menurut Backer (1968). Tujuan identifikasi tanaman ini untuk mencegah kesalahan tanaman yang akan digunakan dalam penelitian sehingga dapat dipastikan tanaman yang digunakan adalah binahong (Anredera cordifolia (Tenore) Steen). Dari hasil identifikasi yang dilakukan berdasarkan acuan tersebut, tanaman binahong yang digunakan dalam penelitian adalah Anredera cordifolia (Tenore) Steen (Lampiran 1).
35
C. Identifikasi Kandungan Senyawa Aktif Ekstrak polar Daun Binahong dengan Uji Tabung
Untuk mengetahui senyawa bioaktif dalam ekstrak polar daun binahong dapat dilakukan analisis kualitatif dengan uji tabung dan KLT. Uji tabung didahului dengan ekstraksi kemudian diidentifikasi dengan penambahan reagen yang akan memberikan warna dan endapan. Uji tabung dilakukan dalam tabung reaksi karena bahan yang diekstraksi dan diidentifikasi hanya sedikit sehingga cukup dilakukan dalam tabung reaksi. Karena pengerjaannya dilakukan di tabung reaksi maka disebut uji tabung. Tujuan dilakukan uji tabung yaitu untuk identifikasi kandungan utama daun binahong, kemudian dipertegas dengan uji KLT. Uji tabung yang dilakukan meliputi uji pendahuluan, alkaloid, antrakinon, polifenol, tanin, dan uji saponin. Uji tabung didasarkan oleh reaksi dan perubahan warna yang terjadi. Reaksi warna maupun pengendapan dapat terjadi karena dalam serbuk daun binahong mengandung senyawa metabolit dengan gugus fungsional atau kromofor yang bereaksi dengan reagensia yang ditambahkan. Tabel II. Hasil pengamatan uji tabung terhadap serbuk daun binahong
No Pengujian Pengamatan Hasil
1 Uji pendahuluan
Larutan hasil penyaringan Filtrat + larutan KOH
Kuning orange
Orange kemerahan ( lebih intensif) + + Uji alkaloid
Filtrat A1+ Dragendorff Terbentuk endapan ungu + 2
Lapisan atas + Dragendorff Terbentuk endapan merah + Lapisan bawah + Mayer Tidak terbentuk endapan - 3 Uji antrakinon
Filtrat + KOH 0,5 N Tidak terbentuk warna merah
-
Terbentuk sedikit endapan putih +
Uji saponin
Pembentukan buih
Terbentuk buih namun cepat hilang
- 6
Fltrat dimasukkan pipa kapiler
Tinggi cairan uji hampir sama dengan tinggi air
-
a. Uji pendahuluan
37
senyawa yang mengandung gugus kromofor seperti flavonoida, antrakinon, dan sebagainya, dengan gugus hidrofilik (gugus gula, asam fenolat, dan sebagainya). b. Uji alkaloid
Pemeriksaan terhadap alkaloida dilakukan dengan menambahkan asam klorida 1% pada serbuk daun binahong (simplisia). Hal ini bertujuan untuk menggaramkan alkaloida yang terdapat dalam bentuk basa. Adanya alkaloida dipertegas dengan reaksi pengendapan, yaitu dengan penambahan pereaksi Dragendorff dan pereaksi Mayer. Dari hasil uji, terbentuk endapan pada larutan dengan penambahan kedua pereaksi tersebut. Adanya akaloid dari basa tertier dan basa kuartener dapat ditunjukkan dengan penambahan serbuk natrium karbonat sampai pH 8-9, kemudian dicampur dengan kloroform untuk melarutkan basa kuartenernya. Setelah terjadi pemisahan, fase kloroform diambil dan ditambah asam cuka 5% sampai pH 5 agar basa kuartener tidak ikut larut dalam basa tertier. Lapisan atas dipisahkan dan ditambah pereaksi Dragendorff. Terbentuknya endapan menunjukkan adanya alkaloid dari basa kuartener. Lapisan bawah ditambah asam klorida 1%, lapisan atas dipisahkan dan ditambah pereaksi Dragendorff, terbentuknya endapan menunjukkan adanya alkaloida dari basa tertier. Dari uji yang dilakukan terbukti adanya alkaloid dari basa kuartener. Hal ini ditunjukkan dengan terbentuknya endapan pada penambahan pereaksi Dragendorff.
c. Uji antrakinon
dipanaskan dengan larutan kalium hidroksida 0,5 N dan hidrogen peroksida selama 2 menit. Pemanasan dengan kalium hidroksida bertujuan untuk menghidrolisis glikosida antrakinon menjadi aglikonnya, yaitu antrakinon. Sedangkan larutan hidrogen peroksida berfungsi untuk mengoksidasi bentuk tereduksi dari antrakinon yaitu antron, oksantron, dan diantron menjadi antrakinon. Penambahan asam asetat sampai pH 5 dan toluen bertujuan untuk memisahkan lapisan air (basa) dengan fase pelarut organik. Reaksi dinyatakan positif bila pada lapisan air (basa) berwarna merah setelah ditambahkan kalium hidroksida 0,5 N. Dari hasil uji yang dilakukan, diperoleh hasil negatif. Pada penambahan kalium hidroksida 0,5 N lapisan air (basa) berwarna jernih yang berarti di dalam serbuk daun binahong tidak terdapat antrakinon.
d. Uji polifenol
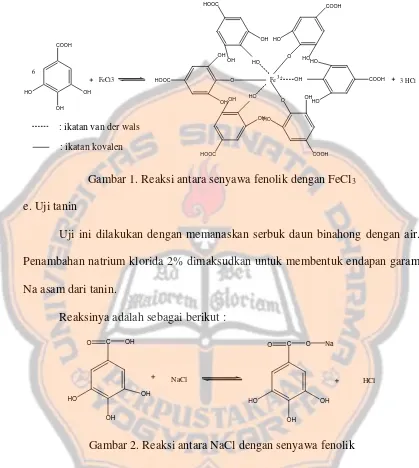
39
Reaksinya adalah sebagai berikut:
COOH
: ikatan van der wals
: ikatan kovalen
Gambar 1. Reaksi antara senyawa fenolik dengan FeCl3
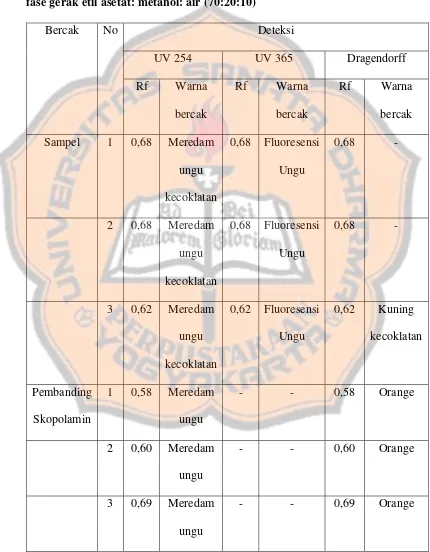
e. Uji tanin
Uji ini dilakukan dengan memanaskan serbuk daun binahong dengan air. Penambahan natrium klorida 2% dimaksudkan untuk membentuk endapan garam Na asam dari tanin.
Reaksinya adalah sebagai berikut :
C
Gambar 2. Reaksi antara NaCl dengan senyawa fenolik
f. Uji saponin
Pemeriksaan saponin dilakukan dengan mengocok serbuk yang telah diberi air. Hasil dinyatakan positif apabila terbentuk buih yang stabil pada permukaan cairan. Dari uji yang dilakukan terbentuk buih yang tidak stabil (hilang dalam beberapa saat). Uji lain dapat dilakukan dengan menggunakan pipa kapiler. Filtrat dimasukkan kedalam pipa kapiler kemudian ketinggiannya dibandingkan dengan tinggi air dalam pipa kapiler yang lain. Bila tinggi filtrat separuh atau kurang dari tinggi air suling, menunjukkan adanya saponin. Dari uji yang dilakukan, tinggi cairan yang diuji hampir sama dengan tinggi air suling, sehingga dapat disimpulkan bahwa serbuk daun binahong tidak mengandung saponin.
D. Pembuatan Ekstrak Polar Daun Binahong
41
Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan yang digunakan sederhana dan mudah diusahakan (Anonim, 1985). Selain itu, maserasi memiliki kelebihan yaitu tidak menggunakan pemanasan sehingga tidak merusak senyawa-senyawa yang tidak tahan pemanasan yang mungkin terdapat dalam serbuk daun binahong seperti flavonoid. Dalam penelitian ini, maserasi dilakukan secara kinetik dengan alat shaker sehingga terjadi proses penggojogan terus menerus yang dapat meratakan konsentrasi larutan di luar butir serbuk simplisia sehingga tetap terjaga adanya derajat perbedaan konsentrasi yang sebesar-besarnya antara larutan di dalam sel dengan larutan di luar sel (Anonim, 1985).
dengan memudarnya warna maserat yang diperoleh. Tujuan dari proses penyarian yang berulang ini untuk memperoleh hasil yang lebih baik daripada penyarian yang dilakukan sekali. Pada penelitian ini dilakukan sebanyak 3x24 jam karena setelah proses maserasi yang ketiga telah diperoleh maserat yang encer. Untuk menghindari terjadinya penjenuhan cairan penyari, pelarut etanol diganti setiap 24 jam sehingga cairan penyari selalu baru dan dapat menyari dengan efektif. Setelah itu hasil maserasi (maserat) dipekatkan menggunakan vacuum evaporator. Agar diperoleh ekstrak kental, maserat disimpan dalam oven dengan suhu tidak lebih dari 50˚C sampai cairan penyari menguap seluruhnya. Suhu berpengaruh pada kecepatan penguapan, makin tinggi suhu, makin cepat penguapan. Disamping mempengaruhi kecepatan penguapan, suhu juga berperanan terhadap kerusakan bahan yang diuapkan. Oleh karena itu pengaturan suhu sangat penting agar penguapan berjalan cepat dan kemungkinan terjadinya peruraian dapat ditekan sekecil mungkin. Karena kandungan kimia daun binahong belum diketahui dengan pasti maka dipilih suhu tidak lebih dari 50˚C agar kerusakan senyawa kimia daun binahong yang tidak tahan panas seperti flavonoid dapat dihindari. Dari hasil maserasi ini didapatkan ekstrak kental sebanyak 22,24 gram.
E. Identifikasi Kualitatif Senyawa Ekstrak Polar Daun Binahong dengan Metode Kromatografi Lapis Tipis (KLT)
a. Uji KLT alkaloid
43
bersifat non polar. Pembanding yang digunakan yaitu skopolamin dalam etanol 70%. Deteksi di bawah sinar UV 254 nm menunjukkan adanya pemadaman bercak pada sampel maupun pembanding. Pada sinar UV 365 nm terjadi fluoresensi hijau kekuningan pada sampel, namun tidak terjadi fluoresensi pada pembanding. Setelah disemprot dengan pereaksi Dragendorff diperoleh warna bercak orange pada pembanding, namun pada sampel tidak terdapat warna.
Alkaloida dapat dideteksi dengan sinar UV 254 nm, UV 365 nm, dan pereaksi Dragendorff. Sebagian besar alkaloida menunjukkan peredaman pada UV 254 nm dan beberapa alkaloida berfluoresensi biru atau kuning pada UV 365 nm. Alkaloida akan berwarna coklat atau orange setelah disemprot dengan Dragendorff, tetapi warna yang terjadi tidak stabil (Wagner, 1984).
Dari hasil uji KLT ekstrak polar daun binahong diperoleh 3 bercak sampel. Bercak pertama dan kedua (Rf 0,68) meredam ungu kecoklatan pada UV 254 nm dan berfluoresensi ungu pada UV 365 nm. Setelah disemprot dengan Dragendorff tidak terdapat bercak. Bercak ketiga (Rf 0,62) meredam ungu kecoklatan pada UV 254 nm dan berfluoresensi ungu pada UV 365 nm. Setelah disemprot dengan Dragendorff menghasilkan bercak kuning kecoklatan yang tidak stabil.
namun golongan alkaloid yang lain.
Tabel III. Hasil identifikasi kualitatif ekstrak polar daun binahong untuk pemeriksaan alkaloid secara KLT dengan fase diam silika gel GF 254 dan fase gerak etil asetat: metanol: air (70:20:10)
45
b. Uji KLT senyawa fenolik
Pemeriksaan fenolik ekstrak polar daun binahong secara KLT dilakukan dengan fase diam silika gel GF 254 dan fase gerak toluen: etil asetat: metanol (70:20:10). Deteksi dilakukan dengan UV 254 nm, 365 nm, dan pereaksi semprot besi (III) klorida. Dari hasil uji KLT diperoleh dua bercak sampel. Bercak pertama (Rf 0,15) meredam kecoklatan pada UV 254 nm, berfluoresensi ungu pada UV 365 nm, namun tidak terjadi bercak dengan pereaksi semprot besi (III) klorida. Bercak kedua (Rf 0,2) meredam kecoklatan pada UV 254 nm, berfluoresensi ungu pada UV 365 nm, dan tidak terjadi bercak pada penyemprotan besi (III) klorida.
Dari kedua bercak sampel tidak ada yang sama dengan pembanding, baik Rf (Rf 0,75) maupun warna bercaknya. Dari hasil ini, kemungkinan sampel tidak mengandung senyawa fenolik.
Tabel IV. Hasil identifikasi kualitatif ekstrak polar daun binahong untuk pemeriksaan fenolik secara KLT dengan fase diam silika gel GF 254 dan fase gerak toluen: etil asetat: metanol (70:20:10)
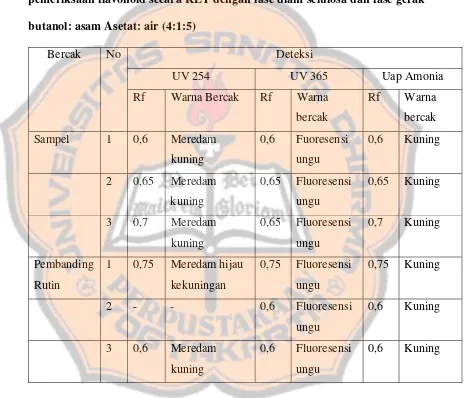
c. Uji KLT flavonoid
Pemeriksaan flavonoid ekstrak polar daun binahong secara KLT dilakukan dengan menggunakan fase diam selulosa dan fase gerak butanol: asam asetat glasial: air (4:1:5). Deteksi bercak dilakukan dengan sinar UV 254 nm, 365 nm, dan uap amonia.
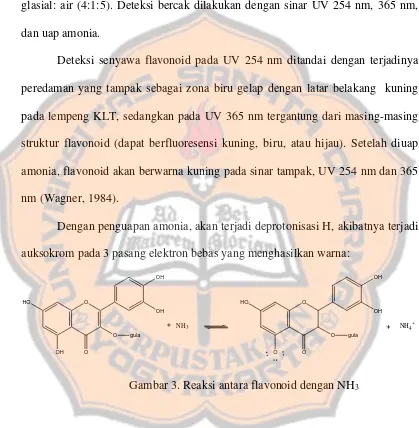
Deteksi senyawa flavonoid pada UV 254 nm ditandai dengan terjadinya peredaman yang tampak sebagai zona biru gelap dengan latar belakang kuning pada lempeng KLT, sedangkan pada UV 365 nm tergantung dari masing-masing struktur flavonoid (dapat berfluoresensi kuning, biru, atau hijau). Setelah diuap amonia, flavonoid akan berwarna kuning pada sinar tampak, UV 254 nm dan 365 nm (Wagner, 1984).
Dengan penguapan amonia, akan terjadi deprotonisasi H, akibatnya terjadi auksokrom pada 3 pasang elektron bebas yang menghasilkan warna:
O
Gambar 3. Reaksi antara flavonoid dengan NH3
47
ketiga diperoleh Rf 0,7 yang meredam kuning kehijauan pada UV 254 nm, berfluoresensi ungu pada UV 365 nm, dan berwarna kuning setelah diuapi amonia.
Tabel V. Hasil identifikasi kualitatif ekstrak polar daun binahong untuk pemeriksaan flavonoid secara KLT dengan fase diam selulosa dan fase gerak butanol: asam Asetat: air (4:1:5)
Deteksi
ketiga memiliki Rf berbeda dengan rutin namun memiliki warna yang sama. Dari hasil tersebut diduga ekstrak polar daun binahong mengandung rutin dan golongan flavonoid lain.
d. Uji tanin
Senyawa tanin dapat dideteksi dengan pereaksi besi (III) klorida (FeCl3).
Setelah disemprot, senyawa tanin akan memberikan warna biru tua yang menunjukkan adanya tanin galat (Anonim, 1987).
Pemeriksaan tanin dari ekstrak polar daun binahong dilakukan dengan fase diam silika gel GF 254 dengan fase gerak etil asetat: metanol: air (100:13,5:10). Pembanding yang digunakan yaitu larutan asam tanat 1% dalam etanol 70%.
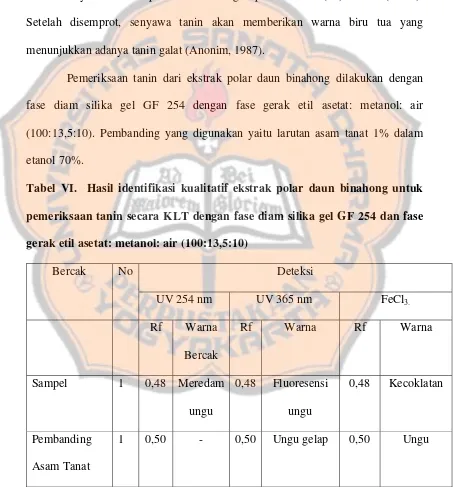
Tabel VI. Hasil identifikasi kualitatif ekstrak polar daun binahong untuk pemeriksaan tanin secara KLT dengan fase diam silika gel GF 254 dan fase gerak etil asetat: metanol: air (100:13,5:10)
49
Dari sampel tersebut diperoleh bercak dengan harga Rf 0,48 meredam ungu pada UV 254 nm dan berfluoresensi ungu gelap pada UV 365 nm. Setelah disemprot dengan FeCl3., warnanya menjadi kecoklatan. Pada pembanding
diperoleh bercak meredam ungu pada UV 254 nm dan berfluoresensi ungu pada UV 365 nm. Dari sampel tersebut ternyata Rf-nya mendekati Rf pembanding yaitu 0,50 dan menunjukkan warna bercak yang sama. Namun pada penyemprotan dengan FeCl3, warna yang dihasilkan berbeda. Sehingga dapat disimpulkan bahwa
sampel mengandung senyawa tanin namun berbeda jenis dengan pembanding asam tanat.
F. Uji Potensi Antibakteri Ekstrak Polar Daun Binahong terhadap Bacillus subtilis dan Pseudomonas aeruginosa
dengan Metode Difusi paper disk
Sebagai kontrol positif digunakan amoksisilin (0,03 g/ml). Amoksisilin digunakan sebagai kontrol positif karena merupakan suatu antibiotik golongan beta laktam derivat ampisilin dengan spektrum luas. Amoksisilin mempunyai aktivitas bekterisida terhadap bakteri Gram positif maupun Gram negatif dengan mekanisme menghambat pembentukan atau sintesis dinding sel mikroba (Surini, 2006). amoksisilin sebagai derivat ampisilin juga diketahui memiliki aktivitas yang tinggi terhadap B. subtilis. Volume bahan uji yang dijenuhkan dalam paper disk untuk tiap perlakuan sama yaitu 20 µl.
Metode difusi dipilih karena metode ini sederhana dan praktis dengan prinsip yaitu senyawa uji ditempatkan dalam media padat yang telah diinokulasi bakteri uji. Pada penelitian ini dipilih metode difusi paper disk dengan pertimbangan senyawa uji yang digunakan tidak mudah menguap sehingga saat diangin-anginkan setelah pemberian senyawa uji pada paper disk, senyawa tidak akan habis. Setelah diinkubasi selama 24 jam, diperoleh hasil sebagai berikut : Tabel VII. Rata-rata diameter zona hambat amoksisilin terhadap Bacillus subtilis dengan metode difusi paper disk
Diameter zona hambat (cm) Senyawa
Replikasi I Replikasi II Replikasi III
51
Pada kontrol negatif CMC 1% tidak menunjukkan zona hambat, kontrol positif amoksisilin menunjukkan adanya zona jernih di sekitar paper disk dengan rata-rata diameter 2,7 cm. B. subtilis susceptible (peka) terhadap amoksisilin karena amoksisilin memiliki aktivitas yang tinggi terhadap B. subtilis (Weber, Saviteer, Rutala, dan Thomann, 1988).
Pada semua variasi konsentrasi ekstrak tidak menunjukkan adanya zona hambat. Sehingga dapat disimpulkan bahwa ekstrak polar daun binahong tidak memiliki potensi antibakteri terhadap B.subtilis. Hal ini kemungkinan disebabkan karena golongan kandungan senyawa kimia flavonoid, alkaloid, dan tanin yang terdapat dalam daun binahong bukan golongan yang memiliki aktivitas antibakteri sehingga tidak memberikan daya hambat terhadap B.subtilis. Selain itu, ukuran partikel dari ekstrak terlalu kasar untuk dapat menembus dinding sel bakteri.
Pada pengujian potensi antibakteri ekstrak polar daun binahong terhadap bakteri P. aeruginosa diperoleh hasil sebagai berikut :
Tabel VIII. Rata-rata diameter zona hambat ekstrak polar daun binahong terhadap Pseudomonas aeruginosa dengan metode difusi paper disk
Diameter zona hambat (cm) Senyawa
Replikasi I Replikasi II Replikasi III
Berdasarkan hasil uji tersebut, hanya ditemukan adanya zona jernih pada kontrol positif amoksisilin dengan rata-rata 2,1 cm (21 mm). Berdasarkan data diameter zona hambat tersebut, dapat disimpulkan bahwa P. aeruginosa susceptible (peka) terhadap amoksisilin (Lay, 1994).
Pada kontrol negatif CMC 1% dan semua konsentrasi larutan uji tidak ditemukan adanya zona jernih. Dari hasil uji tersebut maka dapat disimpulkan bahwa ekstrak polar daun binahong tidak memiliki potensi antibakteri terhadap P. aeruginosa. Hal ini kemungkinan disebabkan golongan kandungan senyawa kimia flavonoid, alkaloid, dan tanin yang terdapat dalam daun binahong bukan golongan yang memiliki aktivitas antibakteri sehingga tidak memberikan potensi antibakteri terhadap P. aeruginosa. Selain itu, sama seperti pada uji potensi antibakteri terhadap B. subtilis, ukuran partikel ekstrak yang kasar menyebabkan ekstrak tidak dapat menembus dinding sel bakteri. Diduga karena hal inilah ekstrak polar daun binahong tidak memberikan daya hambat terhadap bakteri P. aeruginosa.