i
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAUN BINAHONG (Anredera cordifolia (Ten.) Steenis) TERHADAP BAKTERI Staphylococcus aureus ATCC 25923 dan
Escherichia coli ATCC 25922
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Juana Merianti Simanjuntak NIM: 108114110
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
The effective prayer of a righteous man can accomplish much. Elijah was a
man with a nature like ours, and he prayed earnestly that it would not rain,
and it did not rain on the earth for three years and six months. Then he
prayed again, and the sky poured rain and the earth produced its fruit. James
5:16b-18.
vii PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa atas perlindungan dan berkat-Nya yang melimpah, sehingga penulis dapat menyelesaikan skripsi yang berjudul “UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAUN BINAHONG (Anredera cordifolia (Ten.) Steenis) TERHADAP BAKTERI Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922” ini dengan baik dan lancar untuk memenuhi salah satu syarat memperoleh gelar Sarjana Farmasi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa perjuangan panjang dalam dalam penyelesaian skripsi ini tidak lepas dari bantuan dan kerja sama banyak pihak, baik secara langsung maupun tidak langsung. Oleh karena itu, penulis ingin mengucapkan terimakasih kepada:
1. Bapak Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma yang telah mengijinkan penulis menjalankan pembelajaran
selama masa studi.
2. Bapak Prof. Dr. C.J. Soegihardjo, Apt. selaku Dosen Pembimbing dan Dosen Penguji Skripsi yang telah mendampingi, memotivasi dan memberi masukan kepada penulis selama proses penyelesaian skripsi ini.
3. Ibu Dr. Erna Tri Wulandari, M.Si., Apt. selaku Dosen Penguji yang telah memberi masukan kepada penulis selama proses penyelesaian skripsi ini. 4. Ibu Damiana Sapta Candrasari, M.Sc. selaku Dosen Penguji yang telah
viii
5. Ibu Dr. Sri Hartati Yuliani, M.Si., Apt. selaku Kepala Penanggungjawab Laboratorium Fakultas Farmasi yang telah memberikan ijin dalam penggunaan semua fasilitas laboratorium untuk kepentingan penelitian skripsi ini.
6. Bapak Yohanes Dwiatmaka, M.Si., yang telah memberikan bantuan dalam determinasi tanaman Anredera cordifolia (Ten.) Steenis.
7. Seluruh laboran lantai satu sampai dengan lantai empat terutama Bapak Wagiran, Mas Sigit, Pak Parlan, Mas Andri, Pak Mus, yang telah banyak membantu selama penelitian sampai skripsi dapat diselesaikan.
8. Ibu Maria Dwi Jumpowati, S.Si yang telah bersedia meluangkan waktu untuk memberi semangat serta masukan kepada penulis.
9. Pak Havid dan seruh pegawai Balai Besar Teknik Kesehatan Lingkungan dan Pengendalian Penyakit Yogyakarta, yang telah banyak meluangkan waktu untuk membantu dalam menyelesaikan penelitian.
10. Saudara-saudariku terkasih Rosmauli Sherly Manurung, Ertim Bunawolo, Irna Manurung, Agustina Manurung, Sutrisno Simanjuntak, Bernat Pasaribu, Yenni Pasaribu, Dorta Pasaribu, untuk dukungan, doa, kebersamaan dan motivasinya.
ix
12. Sahabat terbaikku Alm. Bonifasius Prasetya Krissutantriarsa yang telah menjadi sumber semangat dan motivasi untuk penulis.
13. Seluruh dosen dan karyawan terima kasih atas kerjasamanya Selama penelitian sampai skripsi selesai.
14. Teman-teman angkatan 2010 Fakultas Farmasi Universitas Sanata Dharma khususnya Teman-teman FKK B 2010, terima kasih untuk semangatnya. 15. Semua pihak yang tidak dapat disebutkan penulis satu per satu yang telah ikut
berperan dan membantu selama penyusunan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, penulis sangat terbuka dengan segala kritik dan saran yang membangun dari semua pihak. Akhir kata, semoga skripsi ini bermanfaat bagi perkembangan ilmu pengetahuan terutama dalam bidang farmasi serta semua pihak yang membutuhkan.
x
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI... vi
xi
4. Aktivitas farmakologi………. 10
B. Escherichia coli ... 10
1. Ekstraksi dengan menggunakan pelarut ... 19
xii
M. Metode Pengujian Aktivitas Antimikroba ... 28
1. Metode dilusi ... 28
2. Metode difusi ... 29
N. Landasan Teori ... 30
O. Hipotesis ... 31
BAB III. METODE PENELITIAN... 32
A. Jenis dan Rancangan Penelitian ... 32
B. Variabel dan Definisi Operasional ... 32
1. Variabel bebas ... 32
4. Penetapan kadar air pada serbuk kering daun binahong ... 37
5. Pembuatan ekstrak etanol dengan metode maserasi ... 37
6. Skrining fitokimia ... 37
xiii
8. Uji potensi antibakteri ekstrak etanol daun binahong terhadap
S. aureus dan E. coli ... 41
F. Tata Cara Analisis Hasil ... 43
BAB IV. HASIL DAN PEMBAHASAN ... 45
A. Penyiapan Bahan ... 45
1. Hasil determinasi tanaman ... 45
2. Hasil pengumpulan dan pembuatan serbuk ... 45
3. Penetapan kadar air serbuk daun binahong ... 47
4. Pembuatan ekstrak etanol dengan metode maserasi ... 48
B. Skrining Fitokimia ... 51
1. Uji tabung... 52
2. Uji kromatografi lapis tipis ... 56
C. Uji Potensi Antibakteri Ekstrak Etanol Daun Binahong Terhadap S. aureus ATCC 25923 dan E. coli ATCC 25922 Dengan Metode Difusi sumuran ... 60
D. Penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) Ekstrak Etanol Daun Binahong Terhadap Staphylococcus aureus ATCC 25923 Dengan Metode Dilusi Cair .... 66
BAB V. KESIMPULAN DAN SARAN ... 71
A. Kesimpulan ... 71
B. Saran ... 71
xiv
xv
DAFTAR TABEL
Halaman Tabel I. Pembuatan Variasi Konsentrasi UJi ... 42 Tabel II. Hasil Pengujian Ekstrak Etanol Daun Binahong……… 51 Tabel III. Hasil Uji Tabung Ekstrak Etanol Daun Binahong ... 52 Tabel IV. Hasil Uji Alkaloid Ekstrak Etanol Daun Binahong
Dengan Metode KLT ... 57 Tabel V. Hasil Uji Tanin Ekstrak Etanol Daun Binahong Dengan Metode
KLT ... 59 Tabel VI. Hasil Uji Zona Hambat Ekstrak Etanol Daun Binahong Terhadap
Bakteri S. aureus dan E. coli ... 63 Tabel VII. Hasil Uji Dilusi Cair Ekstrak Etanol Daun Binahong Terhadap
Bakteri S. aureus ... 67 Tabel VIII. Hasil Uji Penegasan Ekstrak Etanol Daun Binahong Terhadap
xvi
DAFTAR GAMBAR
Halaman
Gambar 1. Daun Binahong ... 8
Gambar 2. Kerangka Flavonoid ... 25
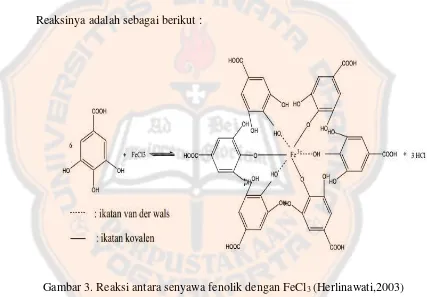
Gambar 3. Reaksi antara senyawa fenolik dengan besi (III) klorida ... 54
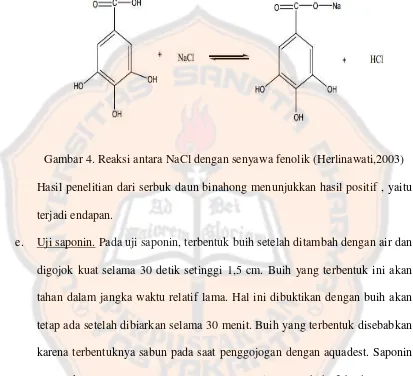
Gambar 4. Reaksi antara natrium klorida dengan senyawa Fenolik ... 55
Gambar 5. Reaksi hidrolisis saponin dalam air ... 56
Gambar 6. Reaksi antara alkaloid dengan pereaksi Dragendroff ... 58
xvii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat Pengesahan Determinasi Daun Binahong ... 78
Lampiran 2. Sertifikat Hasil Uji Bakteri S. aureus ATCC 25923 ... 79
Lampiran 3. Sertifikat Hasil Uji Bakteri E. coli ATCC 25922 ... 80
Lampiran 4. Foto Daun Binahong ... 81
Lampiran 5. Foto Serbuk Daun Binahong ... 81
Lampiran 6. Foto Hasil Uji Tabung Alkaloid Daun Binahong dan Pembanding (Daun Kecubung) ... 82
Lampiran 7. Foto Hasil Uji Tabung Flavonoid Daun Binahong dan Pembanding (Rutin) ... 83
Lampiran 8. Foto Hasil Uji Tabung Polifenol Daun Binahong dan Pembanding (Timol) ... 83
Lampiran 9. Foto Hasil Uji Tabung Tanin Daun Binahong dan Pembanding (Tanin) ... 84
Lampiran 10. Foto Hasil Uji Tabung Saponin Daun Binahong dan Pembanding (Buah Lerak) ... 84
Lampiran 11. Foto Hasil KLT Alkaloid UV 254 ... 85
Lampiran 12. Foto Hasil KLT Alkaloid UV 366 ... 86
Lampiran 13. Foto Hasil KLT Alkaloid Semprot Dragendroff ... 87
Lampiran 14. Foto Hasil KLT Tanin UV 254 ... 88
xviii
Lampiran 16. Foto Hasil KLT Tanin Semprot Besi (III) Klorida ... 90
Lampiran 17. Foto Stok Konsentrasi Ekstrak Daun Binahong ... 91
Lampiran 18. Foto DMSO 1% ... 91
Lampiran 19. Foto Timol ... 92
Lampiran 20. Foto Nephelometer ... 92
Lampiran 21. Foto Vortex ... 93
Lampiran 22. Foto Hasil Uji Potensi Antibakteri Ekstrak Etanol Daun Binahong Terhadap S. aureus ATCC 25923 Dengan Metode Difusi Sumuran ... 94
Lampiran 23. Foto Hasil Uji Potensi Antibakteri Ekstrak Etanol Daun Binahong Terhadap E. coli ATCC 25922 Dengan Metode Difusi Sumuran……….. .. 95
Lampiran 24. Foto Kontrol Pertumbuhan Staphylococcus aures ATCC 25923……… . 96
Lampiran 25. Foto Kontrol Pertumbuhan E. coli ATCC 25923... 96
Lampiran 26. Foto Kontrol Pelarut DMSO 1% ... 97
Lampiran 27. Foto Kontrol Ruangan ... 97
Lampiran 28. Foto Hasil Uji KHM dan KBM Ekstrak Etanol Daun Binahong Dengan Metode Dilusi Cair jam ke-0 Terhadap S. aureus ATCC 25923 ... 98
xix
Lampiran 30. Foto Hasil Uji KHM dan KBM Ekstrak Etanol Daun Binahong Dengan Metode Dilusi Cair jam ke-48 Terhadap
S. aureus ATCC 25923 ... 100 Lampiran 31. Foto Hasil Uji Penegasan Dengan Metode Streak Plate jam
ke-24 Terhadap S. aureus ATCC 25923 ... 101 Lampiran 32. Foto Hasil Uji Penegasan Dengan Metode Streak Plate jam
xx INTISARI
Tingkat kejadian resistensi antibiotik terhadap Staphylococcus aureus dan Escherichia coli semakin meningkat sehingga perlu dilakukan eksplorasi terhadap senyawa alam yang memiliki aktivitas antibakteri, salah satunya adalah daun binahong. Daun binahong memiliki kandungan senyawa tanin yang bersifat sebagai antibakteri.
Penelitian ini adalah penelitian eksperimental murni dengan rancangan penelitian acak lengkap pola satu arah. Ekstraksi dilakukan dengan menggunakan pelarut etanol dan mengunakan metode maserasi. Uji aktivitas antimikroba menggunakan metode difusi sumuran, dilanjutkan metode dilusi cair untuk mengetahui Kadar Hambat Minimal (KHM) dan Kadar Bunuh Minimum (KBM). Ekstrak etanol daun binahong kemudian diuji secara kualitatif dengan menggunakan metode uji tabung dan metode kromatografi lapis tipis untuk mengidentifikasi kandungan senyawanya. Data zona hambat yang diperoleh kemudian dianalisis secara deskriptif komparatif.
Hasil Penelitian dengan metode difusi sumuran menunjukkan bahwa ekstrak etanol daun binahong memiliki aktivitas antibakteri terhadap bakteri Staphylococcus aureus pada konsentrasi 15,624%, sedangkan untuk bakteri Escherechia coli ekstrak etanol daun binahong tidak memiliki aktivitas antibakteri.
Hasil penelitian menggunakan metode dilusi cair didapatkan nilai KBM ekstrak etanol daun binahong terhadap bakteri Staphylococcus aureus pada konsentrasi 9,624%.
Berdasarkan uji tabung, ekstrak etanol daun binahong diketahui mengandung alkaloid, polifenol, tanin, dan saponin. Untuk uji KLT, diketahui bahwa ekstrak etanol duan binahong mengandung alkaloid dan tanin.
xxi ABSTRACT
The incidence rate of antibiotic resistance to Staphylococcus aureus and Escherichia coli increased so that it is necessary to exploration of natural compounds that have antibacterial activity, one of which is a leaf binahong. Binahong leaves contain tannin which is as a antibacterial.
This study is a purely experimental, completely randomized and one way design. Extraction is done by using ethanol solvent and the method of maceration. Antimicrobial activity test takes diffusion method, followed by liquid dilution method to determine the Minimal Inhibitory Concentration (MIC) and Minimal Bactericidal Concentration (MBC). Ethanol extract of Binahong leaves is subsequently tested qualitatively to identify the content of the active compound. The result of inhibition zone was analysed using comparative-descriptive analyzing method.
The result of diffusion method showed that ethanol extract of Anredera Binahong leaves has antimicrobial activity for Staphylococcus aureus in concentration 15,624%, and ethanol extract of Binahong leaves for Escherechia coli has not antimicrobial activity.
The result of a dilution method, is obtained Minimum Bacteriocidal Concentration (MBC) of ethanol extract of Binahong leaves for Staphylococcus aureus in concentration 9,624%.
Based of tube test of ethanol extract of Binahong leaves is discovered that it contains alkaloids, polyphenols, tannins, and saponins. Thin Layer Chromatography (TLC) test is discovered that etanol extract of Binahong leaves contains alkaloids and tannis.
1 BAB I PENGANTAR
A.Latar Belakang
Penyakit infeksi merupakan penyebab utama kematian di dunia terutama di daerah tropis, seperti Indonesia. Salah satu penyebab penyakit infeksi adalah bakteri. Gibron (1991), menjelaskan bahwa infeksi karena bakteri masih mendominasi potensi terjadinya infeksi berat, sepsis, syok septic, dan disfungsi organ. Kematian di ruang perawatan intensif di Amerika sebanyak 40% disebabkan oleh bakteri gram positif dan 60% oleh bakteri gram negatif (Nasronuddin, 2007). Pada penelitian ini digunakan S. aureus yang merupakan salah satu bakteri gram positif dan E. coli yang merupakan salah satu bakteri gram negatif.
Terdapat 7.632 kasus penyakit infeksi yang disebabkan oleh bakteri E. coli dan untuk mengatasi kasus penyakit infeksi tersebut digunakan antibiotik secara luas sebagai terapi untuk menghambat maupun membunuh pertumbuhan bakteri E. coli. Hal tersebut seringkali memicu peristiwa resistensi. Setiap tahunnya resistensi E. coli mengalami peningkatan 0,59 % per tahun pada amoksisislin (Tadesse, Zhao, Tong, Ayers, Singh, dan Bartholommew, dkk., 2002).
Februari 2006 menunjukkan bahwa sebesar 74,1% isolat S. aureus mengalami resistensi multiobat, sehingga mempersulit pemilihan antibiotik yang sesuai untuk terapi (Lisa, 2007). Dalam hal ini, resistensi multiobat didefinisikan sebagai resistensi terhadap dua atau lebih jenis antibakteri yang berbeda.
Nasronudin (2007) menjelaskan, bahwa pengobatan penyakit infeksi akibat bakteri dapat diatasi dengan penggunaan antibiotik. Antibiotik diharapkan mampu menghambat maupun membunuh pertumbuhan bakteri penyebab infeksi tersebut. Namun, seiring dengan meningkatnya penggunasalahan antibiotik di masyarakat, maka kemampuan bakteri untuk bertahan hidup menjadi lebih kuat sehingga menyebabkan peristiwa resistensi. Tentu saja hal ini menjadi masalah kesehatan bagi dunia. Oleh karena itu penelitian-penelitian terkait eksplorasi senyawa-senyawa baru yang bersifat antibakteri terus dilakukan, terutama yang berasal dari bahan alam.
Widjayanti (1999) dalam Nur Iman (2009) menjelaskan salah satu tanaman yang secara empiris digunakan sebagai obat antibakteri adalah tanaman binahong. Secara khusus seluruh bagian-bagian tanaman binahong bisa digunakan sebagai obat untuk menyembuhkan berbagai penyakit, misalnya biji binahong dapat digunakan untuk menyembuhkan penyakit diabetes, pembengkakan liver, dan radang usus, sementara daun binahong dimanfaatkan untuk reumatik dan penyembuhan luka infeksi. Pada penelitian yang meneliti tentang kandungan daun binahong menjelaskan bahwa dalam daun binahong terdapat aktivitas antioksidan dan total fenol yang cukup tinggi. Daun binahong diketahui memiliki kandungan asam oleanolik. Asam oleanoik merupakan golongan triterpenoid, selain itu terdapat pula saponin, flavonoid, alkaloid, dan tanin (Wongso,2008). Selain itu menurut Yin et al., (2007) daun binahong diketahui memiliki kandungan minyak atsiri.
Menurut Tsikalange et al., (2005) ekstrak air akar binahong dengan konsentrasi 50 mg/ml memiliki daya hambat terhadap bakteri gram positif (Bacillus pumilus, Bacillus subtilis dan Staphylococcus aureus) serta bakteri gram negatif (Enterobacter cloacae, Escherichia coli, Klebsiella pneumonia, Serratia marcescens, dan Enterobacter aerogenes) pada konsentrasi 60 mg/ml, tetapi tidak pada bakteri Bacillus sereus.
(2007) ekstrak etanol umbi binahong diketahui mengandung flavonoid, polifenol, tanin, dan saponin.
Menurut Sanarto, Prijadi dan Tanjaya (2010) ekstrak metanol daun binahong mengandung flavonoid, saponin dan tanin sehingga memiliki aktivitas antibakteri terhadap E. coli dengan nilai Kadar Hambat Minimum pada konsentrasi 15%.
Pada penelitian Mokhtarpor, Naserian, Valizadeh, Mesgaran, Pourmollae (2014) menjelaskan bahwaekstraksi kandungan fenol dan tanin dari kacang pistachio menggunakan pelarut, air-metanol, air-etanol, dan air menghasilkan lebih banyak kandungan total fenol dan tanin pada pelarut air-etanol. Hal ini menunjukkan bahwa tanin larut lebih banyak pada pelarut tanin.
Sebuah bahan obat dikategorikan sebagai antibakteri jika memiliki fungsi sebagai bakteriostat dan bakteriosid. Bakteriostat adalah kemampuan suatu obat untuk menghambat pertumbuhan bakteri dalam kadar tertentu dan dapat dilihat dari nilai KHM, sedangkan bakteriosid adalah kemampuan obat untuk membunuh bakteri dalam kadar tertentu dan dapat dilihat dari nilai KBM.
Berdasarkan latar belakang diatas maka penelitian ini bertujuan untuk menguji aktivitas antibakteri ekstrak etanol daun binahong dengan berbagai konsentrasi menggunakan pelarut DMSO terhadap bakteri S. aureus yang mewakili gram positif dan E. coli yang mewakili gram negatif.
1. Perumusan masalah
a. Apakah ekstrak etanol daun binahong memiliki aktivitas antibakteri terhadap S. aureus ATCC 25923 dan E. coli ATCC 25922 ?
b. Berapa Konsentrasi Hambat Minimum (KHM) dan Konsentrasi Bunuh Minimum (KBM) dari ekstrak etanol daun binahong terhadap S. aureus ATCC 25923 dan E. coli ATCC 25922?
c. Kandungan kimia apa sajakah yang terdapat di dalam ekstrak etanol daun binahong yang bermanfaat sebagai antibakteri ?
2. Keaslian penelitian
Sejauh pengamatan penulis, penelitian dengan judul “Uji Aktivitas Antibakteri Ekstrak Etanol Daun Binahong (Anredera cordifolia (Ten) Steenis) Terhadap Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922” belum pernah dilakukan. Penelitian sebelumnya yang berkaitan dengan (Anredera cordifolia (Tenore) Steen), yaitu :
a. Nilai KHM ekstrak etil asetat daun binahong dengan konsentrasi 25% terhadap bakteri Staphlylococcus aureus dan konsentrasi 50% terhadap bakteri Pseudomonas aeruginosa (Mufid,2010).
b. Ekstrak kloroform daun binahong tidak memiliki aktivitas antijamur terhadap Candida albicans (Rochari,2009).
c. Ekstrak etanol umbi binahong tidak memiliki aktivitas antibakteri terhadap bakteri S. aureus dan P. aeruginosa (Herlinawati,2007).
e. Ekstrak etanol daun binahong pada dosis 200mg/kgBB dapat menurunkan kadar asam urat tikus putih yang terinduksi kafein (Lidinilla,2014).
f. Ekstrak petroleum eter tidak memiliki aktivitas antibakteri terhadap S. aureus dan E. coli, ekstrak etil asetat memiliki aktivitas antibakteri terhadap S. aureus dengan nilai KBM sebesar 2% dan terhadap E. coli dengan nilai KBM 4% (Setiaji,Yuliani dan Da’I., 2009).
g. Ekstrak metanol daun binahong memiliki aktivitas antibakteri terhadap E. coli dengan nilai KHM pada konsentrasi 15% (Sanarto, Prijadi dan Tanjaya,2010).
Perbedaan penelitian yang dilakukan oleh penulis dengan penelitian-penelitian sebelumnya adalah penggunaan pelarut yang berbeda. Pelarut yang digunakan penelitian-penelitian sebelumnya, adalah etil asetat, metanol, kloroform, dan petroleum eter, sedangkan pada penelitian ini digunakan pelarut etanol. Pada penelitian sebelumnya ada juga yang menggunakan pelarut etanol tapi bagian tanaman yang digunakan adalah umbi binahong, sedangkan pada penelitian ini bagian tanaman yang digunakan adalah daun binahong.
3. Manfaat penelitian
b. Manfaat praktis. Manfaat praktis hasil penelitian ini adalah untuk memperluas pengetahuan tentang pengobatan penyakit infeksi yang disebabkan oleh S. aureus dan E. coli dengan menggunakan daun bianhong yang memiliki potensi sebagai antibakteri.
B. Tujuan penelitian 1. Tujuan umum
Secara umum penelitian ini bertujuan untuk mengetahui aktivitas antibakteri ekstrak etanol daun binahong terhadap bakteri S. aureus ATCC 25923 dan E. coli ATCC 25922.
2. Tujuan khusus
8 BAB II
PENELAAHAN PUSTAKA
A. Tanaman Binahong 1. Klasifikasi
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Caryophyllales Suku : Basellaceae Marga : Anredera
Jenis : Anredera cordifolia (Ten.) Steenis
Nama umum : Binahong (Badan POM RI, 2008)
2. Uraian tanaman
Binahong merupakan tumbuhan menjalar, berumur panjang, bisa mencapai panjang lebih dari 6 m. batang lunak, silindris, saling membelit, berwarna merah, bagian dalam solid, permukaan halus, kadang membentuk semacam umbi yang melekat di ketiak daun dengan bentuk tak beraturan dan bertekstur kasar. Daun tunggal, bertangkai sangat pendek, tersusun berseling, berwarna hijau, berbentuk jantung, panjang 5-10 cm, lebar 3-7 cm, helaian daun tipis lemas, ujung runcing, pangkal berlekuk, tepi rata, permukaan licin, bisa dimakan. Bunga majemuk berbentuk tandan, bertangkai panjang, muncul di ketiak daun, mahkota berwarna krem keputih-putihan berjumlah lima helai tidak berlekatan, panjang helai mahkota 0,5-1 cm, berbau harum. Akar berbentuk rimpang dan berdaging lunak (BPOM, 2008 ).
3. Kandungan kimia
Daun binahong diketahui memiliki kandungan asam oleanolik. Asam oleanoik merupakan golongan triterpenoid, selain itu terdapat pula saponin, flavonoid, alkaloid, dan tanin (Wongso,2008). Menurut Yin et al., (2007), daun binahong memiliki kandungan minyak atsiri.
Ekstrak alkaloid dari beberapa jenis tanaman di laporkan memiliki fungsi medis, seperti siamine yang merupakan alkaloid pada Cassia siamea memiliki aktivitas antioksidan (Cagnotti, Kay, dan Gandolfo, 2007 ). Selain itu, tanaman binahong juga memiliki kandungan fenol, triterpenoid dan steroid. Senyawa fenolik seperti flavonoid termasuk dalam metabolit sekunder dari tanaman yang memiliki aktivitas antibakteri (Manoi, 2009).
4. Aktivitas farmakologi
Secara empiris binahong digunakan sebagai obat batuk atau muntah darah, darah rendah, memperlancar haid, menambah nafsu makan, mimisan, radang hati, luka operasi, luka akibat benda tajam, dan luka bakar (Rohmawati,2007). Selain itu binahong juga dapat digunakan untuk mengobati infeksi luka (Anonim, 2006). Ada pula penelitian yang menyatakan bahwa ekstrak kloroform dari herba binahong dapat menghambat pertumbuhan beberapa bakteri (Meyer,2004). Selain itu juga dijelaskan bahwa didalam daun binahong terdapat aktivitas antioksidan, asam askorbat dan total fenol yang cukup tinggi yang dapat digunakan sebagai antibakteri (Uchida, et al., 2003).
B. Escherichia coli 1. Morfologi dan fisiologi
Escherichia coli tumbuh dengan baik di hampir semua media pembenihan, dapat meragi laktosa dan bersifat mikroaerofilik (Radji, 2010 ).
2. Patogenesis dan gejala penyakit
Beberapa galur Escherichia coli menjadi penyebab infeksi pada manusia, seperti infeksi saluran kemih, infeksi meningitis pada neonates dan infeksi intestine (gastroenteritis). Ketiga penyakit infeksi tersebut sangat bergantung pada ekpresi faktor virulensi masing-masing serotipe Escherichia coli, termasuk adanya adhesin, invasin, dan jenis toksin yang diproduksi, serta kemampuan melawan pertahanan tubuh sel inang. Sebagian besar penyakit yang disebabkan oleh infeksi Escherichia coli ditularkan melalui makanan yang tidak dimasak dan daging yang terkontaminasi. Penularan penyakit dapat terjadi melalui kontak langsung dan biasanya terjadi di tempat yang memiliki sanitasi dan lingkungan yang kurang bersih (Radji, 2010).
Berdasarkan sifat virulensi, Escherichia coli dikelompokkan menjadi Escherichia coli yang menyebabkan infeksi intestine dan Escherichia coli yang menyebabkan infeksi ekstraintestin. Berikut adalah penyakit-penyakit yang disbebakan oleh Escherichia coli berdasarkan sifat virulensinya.
a. Escherichia coli yang menyebabkan infeksi intestin:
2. Escherichia coli enterotoksigenik (ETEC) merupakan penyebab diare pada anak dan wisatawan yang berpergian ke daerah yang bersanitasi buruk. Strain ETEC memproduksi endotoksin yang sifatnya labil terhadap panas (LT) dibawah kontrol plasmid. Sub unit B melekat pada Gm1 gangliosida pada sisi sel epitel dari usus kecil dan mmeberikan fasilitas sebuah pemasukan dari subunit A kedalam sel, dimana mengaktifasi adenylyl cyclase. Hal ini ditandai dengan adanya peningkatan konsentrasi lokal dari cyclic adenosine monophosfat (cAMP), yang menghasilkan hiperekskresi yang sering dan lama dari air dan klorid serta menghambat penyerapan natrium. Lumen ususu digelembungkan dengan cairan hipermotility dan diarepun terjadi.
3. Escherichia coli enterohemoragik (EHEC) memproduksi verotoksin. Nama verotoksin sesuai dengan efek sitotoksik, dimana toksin ini berada pada sel vero, yaitu sel ginjal yang diperoleh dari ginjal monyet afrika. EHEC berhubungan dengan colitis hemiragik, bentuk diare yang berat dan dengan sindroma uremia hemolitik, suatu penyakit akibat gagal ginjal akut, anemia hemolitik mikroangiopatik dan trombositopenia. 4. Escherichia coli enteroagregatif (EAEC) merupakan penyebab utama
EAEC juga memproduksi hemolisin yang diperkirakan mirip dengan hemolisin yang diproduksi oleh galur Escherichia coli yang dapat menyebabkan infeksi saluran kemih.
5. Escherichia coli enteroinvasif (EIEC) mekanisme patogenik EIEC mirip dengan patogenesis infeksi yang disebabkan oleh shigella. EIEC masuk dan berkembang dalam epitel sel-sel kolon sehingga menyebabkan kerusakan pada sel kolon. Gejala klinis yang ditimbulkan mirip dengan gejala diare yang disebabkan oleh Shigella. Gejala diare biasa disertai dengan demam.
b. Escherichia coli yang menyebabkan infeksi ekstraintestin :
1. Escherichia coli uropatogenik (UPEC) menyebabkan kira-kira 90% infeksi saluran kemih mulai dari sistisis sampai pielonefritis. Nefropatogenik Escherichia coli secara khas memproduksi hemolisin. Kebanyakan infeksi disebabkan oleh Escherichia coli dari sejumlah antigen O. Antigen K menjadi penting dalam patogenesis infeksi sistem saluran bagian atas.
2. Sepsis terjadi bila pertahanan inang normal tidak mencukupi. Escherichia coli dapat memasuki aliran darah dan menyebabkan sepsis. Bayi yang baru lahir dapat sangat rentan terhadap sepsis Escherichia coli karena tidak memiliki antibodi IgM. Sepsis dapat terjadi akibat infeksi saluran kemih.
N meningitides. Mekanisme virulensi berhubungan dengan antigen K1 belum dipahami (Jawetz, Melnick, dan Adelberg, 2005).
C. Staphylococus aureus 1. Morfologi dan fisiologi
Bakteri Staphylococus aureus termasuk dalam famili Micrococcaceae. Bakteri ini berbentuk bulat namun koloni mikroskopiknya cenderung berbentuk menyerupai buah anggur. Staphylococus aureus menghasilkan pigmen berwarna emas. Bakteri ini tumbuh dengan atau tanpa bantuan oksigen (anaerob fakultatif) dan menghasilkan enzim katalase. Staphylococus aureus adalah bakteri gram positif yang berdiameter 0,8 – 1 mikron, tidak bergerak, dan tidak berspora. Staphylococus aureus dapat tumbuh pada suhu 15-45OC dan dalam NaCl berkonsentrasi 15% (Radji, 2010).
2. Toksin dan enzim
S. aureus dapat menimbulkan penyakit melalui kemampuannya menyebar luas dalam jaringan dan melalui pembentukan berbagai zat ekstraseluler. Berbagai zat yang berperan sebagai faktor virulensi dapat berupa protein, termasuk enzim dan toksin, contohnya :
1. Katalase
2. Koagulase
Enzim ini dapat menggumpalkan plasma oksalat atau plasma sitrat, karena adanya faktor koagulase reaktif dalam serum yang berekasi dengan enzim tersebut. Esterase yang dihasilkan dapat meningkatkan aktivitas penggumpalan, sehingga terbentuk deposit fibrin pada permukaan sel bakteri yang dapat menghambat fagositosis
3. Hemolisin
Hemolisin merupakan toksin yang dapat membentuk suatu zona hemolisis di sekitar koloni bakteri. Hemolisin pada S. aureus terdiri dari alfa hemolisin, beta hemolisin dan delta hemolisin. Alfa hemolisin adalah toksin yang bertanggung jawab terhadap pembentukan zona hemolisis di sekitar koloni S. aureus pada medium agar darah. Toksin ini dapat menyebabkan nekrosis pada kulit hewan dan manusia. Beta hemolisin adalah toksin yang terutama dihasilkan Staphylococcus yang diisolasi dari hewan, yang menyebabkan lisis pada sel darah merah domba dan sapi, sedangkan delta hemolisin adalah toksin yang dapat melisiskan sel darah manusia dan kelinci, tetapi efek lisisnya kurang terhadap sel darah merah domba.
4. Leukosidin
5. Toksin eksfoliatif
Toksin ini mempunyai aktivitas proteolitik dan dapat melarutkan matriks mukopolisakarida epidermis, sehingga menyebabkan pemisahan intraepithelial pada ikatan sel di stratum granulosum. Toksin eksfoliatif merupakan penyebab Staphylococcal Scalded Skin Syndrome, yang ditandai dengan melepuhnya kulit.
6. Toksin Sindrom Syok Toksik (TSST)
Sebagian besar galur S. aureus yang diisolasi dari penserita sindrom syok toksik menghasilkan eksotoksin pirogenik. Pada manusia, toksin ini menyebabkan demam, syok, ruam kulit, dan gangguan multisistem organ dalam tubuh.
7. Enterotoksin
Enterotoksin adalah enzim yang tahan panas dan tahan terhadap suasana basa didalam usus. Enzim ini merupakan penyebab utama keracunan makanan, terutama pada makanan yang mengandung karbohidrat dan protein (Jawetz, Melnick, Adelberg, 2005).
3. Patogenesis dan patologi
Beberapa jenis penyakit yang ditimbulkan oleh infeksi Staphylococus aureus adalah sebagai berikut.
b. Folikulitis. Merupakan infeksi superfisial pada folikel-folikel rambut dengan mengeluarkan pastula berwarna putih. Tempat pastula-pastula itu tumbuh akan terasa gatal selama 1-2 hari sebelumnya.
c. Furunkel. Merupakan infeksi Staphylococus aureus yang menginvasi bagian dalam dari folikel rambut. Furunkel merupakan peradangan yang disertai pembengkakan dan menyakitkan. Walaupun dapat terjadi di seluruh bagian tubuh, infeksi ini lebih sering dijumpai di daerah wajah, leher, ketiak, dan anus. Furunkel dikenal dengan nama borok atau bisul.
d. Mastitis. Merupakan infeksi pada payudara. Infeksi ini terjadi pada payudara ibu yang sedang menyusui melalui luka atau melalui putting payudara yang terluka. Infeksi ini menyebabkan luka yang menyakitkan.
e. Piomiositis. Merupakan infeksi pada otot. Infeksi ini umumnya terjadi didaerah tropis.
f. Endokarditis. Merupakan infeksi pada katup jantung. Infeksi ini dapat terjadi apabila Staphylococus aureus menyerang endokardium yang merupakan bagian paling dalam dari jantung. Kondisi ini menyebabkan kerusakan permanen pada jantung. Hal ini terutama terjadi pada pecandu narkoba yang menggunakan narkoba melalui injeksi intravena.
h. Pneumonia. Merupakan infeksi Staphylococus aureus pada paru-paru. Pneumonia dapat timbul setelah seseorang menderita flu.
i. Sindrom renjat toksik. Sindrom ini dapat menyebabkan demam tinggi, tekanan darah rendah, kulit terkelupas, dan kerusakan organ-organ tertentu. Sindrom ini dapat menyebabkan kematian. Wanita yang menggunakan tampon berisiko terkena infeksi ini (Radji, 2010).
D. Simplisia
Simplisia adalah bahan yang digunakan untuk obat dan belum mengalami perubahan proses apapun, dan kecuali dinyatakan lain umumnya berupa bahan yang telah dikeringkan (Gunawan dan Mulyani, 2004).
Berdasarkan hal tersebut, maka simplisia di bagi menjadi tiga golongan, yaitu simplisia nabati, simplisia hewan dan simplisia mineral (Gunawan dan Mulyani, 2004).
E. Ekstraksi
Ekstraksi merupakan kegiatan penarikan kandungan kimia yang terdapat pada simplisia. Ragam ektraksi yang tepat sudah tentu tergantung pada tekstur dan kandungan air bahan tumbuhan yang diekstraksi dan pada jenis senyawa yang diisolasi. Umumnya kita perlu membunuh jaringan tumbuhan untuk mencegah terjadinya oksidasi enzim atau hidrolisis (Harbone, 1996).
Macam-macam metode ekstraksi dapat dilakukan, diantaranya : a. Ekstraksi dengan menggunakan pelarut
1. Cara Dingin
1) Maserasi adalah proses pengestrakan simplisia dengan menggunakan pelarut dan dilakukan beberapa kali pengocokan atau pengadukan pada temperatur ruang (kamar). Secara teknologi maserasi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada keseimbangan. Maserasi kinetik berarti dilakukan pengadukan yang kontinyu (terus-menerus). Remaserasi berarti pengulangan penambahan pelarut. Pengulangan penambahan pelarut dilakukan setelah penyaringan maserat pertama dan seterusnya.
dilakukan terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
2. Cara Panas
1) Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
2) Sokhlet adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinyu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
3) Digesti adalah maserasi kinetik (dengan pengadukan berkala) pada temperatur yang lebih tinggi dari temperatur ruang (kamar), yaitu secara umum dilakukan pada temperature 40-50 °C.
4) Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air mendidih, temperatur terukur 96-98 °C selama waktu tertentu (15-20 menit).
5) Dekok adalah infus yang waktunya lebih lama (lebih dari 30 menit) dan temperatur sampai titik didih air (100 °C).
fase uap air dari ketel secara kontinyu sampai sempurna dan diakhiri dengan kondensasi fase uap campuran (senyawa kandungan menguap ikut terdestilasi) menjadi destilat air bersama senyawa kandungan yang memisah sempurna atau memisah sebagian (Sampurno, 2000).
F. Ekstrak
Ekstrak adalah sediaan kering, kental, atau cair dibuat dengan penyari simplisia menurut cara yang cocok, di luar pengaruh cahaya matahari langsung. Ekstrak kering harus mudah digerus menjadi serbuk. Cairan penyari dapat menggunakan air, etanol, atau campuran air dan etanol (Badan POM RI, 2010).
G. Kromatografi Lapis Tipis
Kromatografi Lapis Tipis (KLT) ialah metode pemisahan fisikakimia. Pada KLT ini digunakan dua macam fase , yaitu fase diam dan fase gerak. Fase diam berupa lapisan yang seragam (uniform) pada permukaan bidang datar yang didukung oleh lempeng kaca, pelat aluminium, atau pelat plastik. Sedangkan fase gerak adalah pelarut pengembang yang akan bergerak sepanjang fase diam karena pengaruh kapiler pada pengembangan secara mekanik (ascending) atau karena pengaruh gravitasi pada pengambangan secara menurun (descending) (Rohman dan Gandjar, 2007).
Prinsip kerjan KLT adalah pemisahan berdasarkan perbedaan kepolaran
menggunakan fase diam plat silika dan fase geraknya disesuaikan dengan jenis sampel yang ingin dipisahkan. Larutan atau campuran larutan yang digunakan
dinamakan eluen. Semakin dekat kepolaran antara sampel dengan eluen maka sampel akan semakin terbawa oleh fase gerak tersebut. Plat KLT diletakkan di dalam bejana rapat yang berisi larutan pengembang atau fase gerak yang cocok, pemisahan terjadi selama masa perambatan kapiler atau pengembangan, selanjutnya senyawa tidak berwarna harus ditampakkan atau dideteksi dengan lampu ultraviolet atau dengan pereaksi semprot (Rohman dan Gandjar, 2007). Pada kromatografi lapis tipis dikenal istilah faktor retardasi (Rf) yang
Alkaloid merupakan golongan senyawa yang sangat heterogen apabila dipandang secara kimiawi. Semua alkaloid mengandung unsur nitrogen (N), sering dalam bentuk cincin heterosiklik, tetapi tidak semua demikian. Hal ini digunakan sebagai dasar penamaannya, seperti nama “alkaloid” bermakna alkali (basa) karena alkaloid mempunyai sifat alkalis atau basa. Senyawa alifatik sederhana (asam amino) walaupun mengandung nitrogen tapi tidak termasuk dalam golongan alkaloid (Soegihardjo, 2013).
mungkin sama. Banyak alkaloid berasal dari asam amino aromatik, misalnya fenilalanina atau tirosina (Soegihardjo, 2013).
Alkaloid tersebar luas dalam suku atau familia tanaman, antara lain Rubiaceae, Solanaceae, Papaveraceae, Apocynaceae, Asclepiadaceae, dan Asteraceae. Bahkan ada alkaloid yang terdapat pada fungi (alkaloid ergot pada secale cornutum , yakni kapang pada tanaman gandum) dan dalam cod liver oil (perasan hati ikan laut Gadus morrhua) yang belum murni (Soegihardjo, 2013).
Peran alkaloid dalam tumbuhan antara lain berperan dengan keberadaan asam organik tertentu, misalnya alkaloid opium berhubungan dengan adanya asam mekonat; alkaloid kinkona terkait dengan asam kuinat dan kinkotanat. Selain itu, alkaloid berperan dalam hubungannya dengan oksigen in statu nascendi (oksigen singlet) yang berbahaya bagi organisme hidup; hal ini dibuktikan dengan adanya sinar UV yang kuat pada tumbuhan akan meningkatkan biosintesis alkaloid (Soegihardjo, 2013).
Kebanyakan alkaloid berbentuk padat dan yang berbentuk kristalin merupakan garam dengan asam yang mengandung unsur N, C, H, dan O tetapi ada alkaloid yang tidak mengandung oksigen, misalnya nikotina dan koniina yang berbentuk cair. Di alam, alkaloid dapat berbentuk bebas atau terikat sebagai garam dengan asam organik atau N-oksida. Kebanyakan alkaloid tidak berwarna, tetapi ada alkaloid yang berwarna, misalnya berberina berwarna kuning dan garam sanguinarina berwarna merah tembaga (Soegihardjo, 2013).
isolasinya dari bahan tumbuhan. Alkaloid bebas umumnya sedikit larut dalam air, tetapi larut dalam pelarut organik, sedangkan garamnya berlaku kebalikannya kecuali garam sulfas kinina kelarutannya dalam air (1:1000), sedangkan kinina hidroklorida larut dalam air kurang dari satu bagian (Soegihardjo, 2013).
Identifikasi alkaloid selain analisis kualitatif alkaloid dapat dilakukan dengan pertolongan pereaksi. Misalnya, dengan pereaksi Meyer, Dragendroff, Wagner, dan Buchardat; reaksi warna, misalnya dengan pereaksi asam sulfat pekat, asam nitrat pekat, dan fluoresensi (Soegihardjo, 2013).
Pemisahan alkaloid secara KLT dapat menggunakan fase diam silika gel, alumina, selulosa atau kieselguhr. Pemisahan yan baik diperoleh jika silika gel sudah diaktifkan. Banyak alkaloid dapat dideteksi secara visible. Sebagian besar alkaloid juga memiliki bercak yang beflurosensi dibawah sinar UV365. Reagen yang biasa digunakan untuk mendeteksi alkaloid adalah Dragendroff. Pada penyemprotan dengan menggunakan reagen Dragendorff menunjukkan warna coklat atau orange (visible) yang tidak stabil (Wagner,1984). Contoh fase gerak yang sering digunakan adalah etil asetat-metanol-air (100:16,5:13,5) (Sthal,1969).
I. Flavonoid
Gambar 2. Kerangka Flavonoid
Flavonoid umumnya terdapat dalam tumbuhan, terikat pada gula sebagai glikosida dan flavonoid yang manapun mungkin saja terdapat dalam satu tumbuhan dalam beberapa bentuk kombinasi glikosida (Robinson, 1991).
Ada beberapa fase gerak yang biasa digunakan untuk menghasilkan pemisahan yang baik pada lempeng selulosa. Butanol - Asam asetat - Air (40:50:10). Aglikon dari flavonoid mempunyai nilai Rf yang tinggi dan waktu elusi yang lama (Stahl, 1969).
Pada UV 254 nm, semua flavonoid menyebabkan pemadaman flurosensi, dimana terlihat sebagai warna biru gelap pada lempeng KLT. Pada UV 365 nm, tergantung pada strukturnya, flavonoid berfluoresensi kuning, biru, atau hijau (Wagner, 1984).
J. Senyawa Polifenol
Aktivitas fisiologis senyawa fenolik tumbuhan banyak dan beragam. Beberapa senyawa fenolik bersifat racun terhadap hewan pemangsa tumbuhan (herbivor) dan beberapa bersifat racun serangga. Senyawa fenolik lain mempunyai aktivitas antiinflamasi, karena senyawa ini menghambat sintesis prostaglandin (Robinson, 1991).
Hanya antosianin dan beberapa derivat quinon yang dapat dideteksi secara langsung dengan sinar tampak pada lempeng silika gel. Senyawa fenolik lainnya, merupakan senyawa yang tidak berwarna dan harus diwarnai. Bila diwarnai dengan menggunakan besi (III) klorida bercak akan terlihat berwarna kuning tua sampai ungu tergantung jenis polifenolnya. Biasanya, bercak yang terjadi berwarna biru kehijauan (Stahl, 1969).
K. Saponin
Saponin tersebar luas di berbagai jenis tumbuhan. Keberadaan saponin sangat mudah ditandai yaitu dengan adanya pembentukan larutan koloidal antara saponin dan air sehingga apabila digojok menimbulkan buih yang stabil. Saponin merupakan senyawa berasa pahit menusuk dan menyebabkan bersin dan sering mengakibatkan iritasi pada selaput lender (Gunawan dan Mulyani 2004). Beberapa saponin bekerja sebagai senyawa antimikroba (Robinson, 1991).
cm bila larutan sampel ditambah air digojok dalam gelas ukur selama 15 detik dan selanjutnya dibiarkan selama 15 menit (Gunawan dan Mulyani 2004).
Pengujian KLT untuk saponin menggunakan fase gerak contohnya kloroform - metanol - air (65:35:10) untuk memisahkan campuran glikosida terpenoid yang netral. Fase diam yang sering digunakan adalah silika gel (Wagner, 1984).
L. Tanin
Tanin merupakan senyawa yang sangat kompleks, biasanya terdapat sebagai campuran polifenol yang sangat sulit dikristalkan. Tanin dengan air membentuk larutan koloidal, mempunyai reaksi asam dan rasanya sangat sepat. Semakin murni tanin, maka akan mengurangi kelarutannya di dalam air dan akan lebih mudah membentuk kristal. Tanin larut pula dalam pelarut organik yang polar, setidak-tidaknya sampai batas tertentu, tetapi tidak larut dalam pelarut organik yang nonpolar seperti benzene dan kloroform. Larutan tanin dalam air dapat diendapkan dengan penambahan asam mineral atau garam (Robinson, 1991).
terhidrolisis menjadi molekul yang lebih sederhana dan tidak mengandung gugus gula. Tanin terkondendasi akan berubah warna menjadi cairan tidak larut berwarna merah ketika bereaksi dengan asam atau enzim terkondensasi, sedangkan tanin terhidrolisis akan membentuk warna biru ketika bereaksi dengan garam besi (Trease dan Evans, 2002).
Tanin merupakan senyawa asam karboksilat fenol yang dapat dipisahkan menggunakan fase diam silika gel dan fase gerak toluen - etil format - asam format (50:40:10) (Stahl,1969).
Beberapa tanin terbukti mempunyai aktivitas antioksidan, menghambat pertumbuhan tumor dan meracuni hati (Robinson, 1991). Tanin juga berfungsi sebagai anthelmintik, anti HIV, antibakteri, antikanker, dan antikarsinogenik (Duke, 1992).
M. Metode Pengujian Aktivitas Antimikroba
Pengujian ini bertujuan untuk mengetahui kemampuan suatu larutan uji dalam menghambat atau membunuh mikroba. Metode pengujian aktivitas antimikroba dapat dibedakan menjadi dua, yaitu :
1. Metode dilusi
ada pertumbuhan mikroba) adalah Kadar Hambat Minimum (KHM). Selanjutnya biakan dari semua tabung yang jernih diinokulasikan pada biakan media agar padat, diinkubasi selama 24 jam lalu diamati ada tidaknya koloni yang tumbuh. Konsetrasi terendah obat pada biakan padat yang ditunjukkan dengan ketiadaan pertumbuhan koloni mikroba adalah Kadar Bunuh Minimum (KBM) (Dzen dkk, 2003).
Kemampuan antibakteri dikatakan kuat apabila memiliki nilai KHM antara 0,05 – 0,050 mg/mL, sedang apabila nilai KHM antara 0,6 – 1,50 mg/mL, dan lemah apabila diatas 1,50 mg/mL (Diaz, et al., 2010).
2. Metode difusi
Metode difusi merupakan metode yang digunakan untuk mengukur potensi antibakteri berdasarkan pengamatan luas zona jernih yang terbentuk di sekitar tempat penginokulasian obat atau larutan uji karena berdifusinya obat atau larutan uji (Jawetz, Melnick, dan Adelberg, 2005). Metode difusi dilakukan dengan cara menempatkan senyawa uji pada media padat yang ditanami dengan biakan bakteri. Metode difusi terdapat beberapa macam, yaitu :
a. Cara Kirby Bauer
adanya pertumbuhan yang kurang subur jika dibandingkan dengan daerah di luar pengaruh antibiotik tersebut (Dzen dkk, 2003).
b. Cara sumuran
Penyiapan dilakukan seperti cara Kirby Bauer. Pada agar yang telah diolesi bakteri uji dibuat sumuran dengan garis tengah tertentu dan tegak lurus terhadap permukaan media. Kemudian ke dalam sumuran ini diberi larutan uji dan diinkubasi pada suhu 37°C selama 24-28 jam. Hasil inkubasi dibaca seperti cara Kirby Bauer (Dzen dkk, 2003).
c. Cara Pour Plate
Mula-mula satu mata ose suspensi bakteri dicampur dengan 4 ml agar 1,5% pada temperatur 50°C. Setelah itu, suspensi mikroba yang sudah homogeny dituang di atas media agar dan dibiarkan membeku, kemudian diatasnya diletakkan disk dan diinkubasikan pada suhu 37°C selama 18-24 jam. Hasil ikubasi dibaca dengan mengukur diameter hambat (Dzen dkk, 2003).
N. Landasan Teori
Daun binahong memiliki banyak khasiat salah satunya adalah mengobati infeksi mikroba, yaitu penyakit infeksi pada luka yang disebabkan oleh E. coli dan S. aureus (Anonim, 2005).
Herlinawati (2007) etanol dapat melarutkan senyawa-senyawa yang bersifat nonpolar maupun yang bersifat polar seperti alkaloid, tanin, flavonoid, dan saponin.
Pada umumnya efek suatu obat sangat berhubungan erat dengan dosis atau konsentrasinya. Dosis atau konsentrasi yang berbeda akan menghasilkan efek yang berbeda juga (Bonang dan Koeswardono, 1982). Uji KHM dan KBM berfungsi untuk menentukan dosis yang akan menghasilkan efek antibakteri.
Berdasarkan penjelasan tersebut, maka perlu dilakukan penelitian untuk mengetahui aktivitas antibakteri ekstrak etanol daun binahong dengan konsentrasi yang berbeda sehingga diperoleh KHM dan KBM.
O. Hipotesis
32 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini adalah penelitian eksperimental murni dengan menguji konsentrasi ekstrak etanol daun Binahong, dengan variasi konsentrasi terhadap pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli . Untuk mengetahui daya antibakteri, semua kondisi perlakuan dibuat sama. Rancangan penelitian yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) pola searah. Penelitian ini dilakukan di Laboratorium Farmakognosi Fitokimia Universitas Sanata Dharma untuk membuat ekstrak etanol daun binahong, uji kandungan kimia (uji tabung) dan uji KLT. Uji mikrobiologi dilakukan di Balai Besar Teknik Kesehatan Lingkungan dan Pengendalian Penyakit Yogyakarta. Penelitian dilakukan selama 2 bulan dimulai dari tanggal 05 Februari 2014 sampai dengan 05 April 2014.
B. Variabel dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas. yaitu ekstrak etanol daun binahong dengan konsentrasi 39,06%, 15,624%, 6,249%, dan 2,499%.
b. Variabel tergantung. yaitu diameter zona hambat pertumbuhan S. aureus dan E. coli.
(37oC), jenis bakteri uji, volume suspensi bakteri uji yang diinokulasikan dalam media (1 ml), konsentrasi suspensi bakteri uji setara dengan larutan standar Mc. Farland II (6x108 CFU/ml), volume larutan uji yang diinokulasikan dalam sumuran , yaitu 20 µl, dan tempat tumbuh binahong di daerah Yogyakarta. Daun binahong yang diambil adalah daun binahong ketika tanaman menjelang berbunga.
d. Variabel tak terkendali. Antara lain suhu pengeringan daun binahong di bawah matahari dengan ditutup kain hitam dan umur tanaman binahong. 2. Definisi operasional
a. Potensi antibakteri. Kemampuan ekstrak etanol daun binahong yang dapat membunuh atau menghambat bakteri S. aureus ATCC 25923 dan E. coli ATCC 25922 yang dapat dilihat dari zona jernih yang menggambarkan zona hambat pertumbuhan bakteri, dibandingkan dengan DMSO 1% sebagai pelarut.
c. Jumlah koloni Staphylococcus aureus dan Escherichia coli. Jumlah dari sekumpulan bakteri Staphylococcus aureus dan Escherichia coli yang dibuat suspensi dengan kekeruhan setara 2 McFarland.
d. Media pengeraman. Media yang dipakai untuk menumbuhkan Staphylococcus aureus dan Escherichia coli. Media yang digunakan dalam penelitian ini adalah Mueller-Hinton (MH) agar.
e. Diameter zona bening 10-20 mm atau lebih. Berarti mempunyai daya hambat yang sangat kuat.
f. Diameter zona bening 5 mm-10 mm. Berarti mempunyai daya hambat sedang.
g. Diameter zona bening < 5 mm. Berarti mempunyai daya hambat lemah. h. Sterilisasi alat dan bahan. Suatu usaha untuk membebaskan alat-alat atau
bahan-bahan dari segala macam kehidupan, terutama kehidupan mikroorganisme.
C. Bahan Penelitian 1. Bahan
25923 dan E. coli ATCC 25922 diperoleh dari koleksi Balai Kesehatan Yogyakarta, Mueller-Hinton (MH) Broth yang digunakan adalah MH Broth kode CM 0405 (OXOID), Nutrient Broth nomor 2 dengan kode CM 0067 (OXOID), Agar (MERCK), fase diam atau lempeng KLT silika Gel GF 254 dan selulosa, fase gerak, yaitu toluene (MERCK) - etil asetat (MERCK) (93:7), etil asetat (MERCK) - etanol (MERCK) - air (70:20:10), toluene (MERCK) - etil asetat (MERCK) - metanol (MERCK) (70:20:10), n-butanol (MERCK) - asam asetat (MERCK) - air (4:1:5) , etil asetat (MERCK) – methanol (MERCK) - air (100:13,5:10), rutin, ekstrak Daun Kecubung, eugenol, asam tanat, Glycyrrhiza Radix, deteksi uap amoniak, Dragendroff LP, larutan besi (III) klorida, larutan meyer, hidroklorida 1%, natrium hidroksida.
2. Alat atau instrument penelitian
KLT/chamber, lampu UV dengan panjang gelombang 365 nm, dan 254 nm, mikropipet 5 µL (Gilson 0503356), alat semprot pereaksi, nephelometer (Phonix) untuk mengukur kekeruhan suspensi bakteri, class II biological safety cabinet (ESCO).
D. Tata Cara Penelitian 1. Determinasi tanaman binahong
Determinasi daun binahong dilakukan dengan menggunakan pustaka acuan C.A. Backer (1986). Determinasi dilakukan di Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma. Untuk mempermudah determinasi, digunakan bagian dari tanaman binahong seperti batang, bunga, daun dan umbi.
2. Pengumpulan daun binahong
Daun Binahong diperoleh dari rumah masyarakat Perumahan Candi Indah, Ngemplak, Sleman, Yogyakarta. Daun yang diambil adalah daun dari tanaman binahong yang menjelang berbunga. Daun diambil pada sore hari setelah proses fotosintesis berlangsung.
3. Pembuatan Serbuk
4. Penetapan kadar air pada serbuk kering daun binahong
Sebanyak ± 5 g serbuk kering daun binahong yang sudah diayak dimasukkan ke dalam alat moisture balance lalu diratakan. Bobot serbuk kering daun binahong ditimbang sebelum pemanasan (bobot A) dan sesudah pemanasan (bobot B). Serbuk kering daun binahong dipanaskan pada suhu 105oC selama 15 menit. Kemudian dilakukan perhitungan terhadap selisih bobot A dan bobot B yang merupakan kadar air serbuk daun binahong (Depkes RI,2000).
5. Pembuatan ekstrak etanol dengan metode maserasi
Sebanyak 300 g serbuk daun binahong dibagi ke dalam 3 erlemeyer terpisah, kemudian masing-masing erlemeyer direndam dengan 500 ml etanol selama 5 hari (serbuk : cairan penyari = 1:5) dan tiap 8 jam di gojok secara perlahan-lahan. Lima hari kemudian dilakukan remaserasi. Setelah itu hasil maserasi dan hasil remaserasi digabungkan kemudian diuapkan dengan menggunakan rotary evaporator. Untuk menghilangkan seluruh pelarut yang masih terdapat di dalam ekstrak, hasil penguapan dari rotary evaporator diuapkan kembali di atas waterbath. Hasil penyarian ditempatkan dalam cawan porselin yang telah ditara sebelumnya.
6. Skrining Fitokimia
Skrining fitokimia meliputi uji tabung dan uji KLT.
a. Pembuatan larutan uji tabung 0,1%. Sebanyak 0,1 g ekstrak daun binahong dilarutkan kedalam 10 ml aquadest kemudian dipanaskan diatas waterbath dengan suhu 60°C.
kedalam 3 tabung reaksi (A,B,C). tabung A digunakan sebagai blangko, tabung B direaksikan dengan 3 tetes Besi (III) Klorida 10%, warna biru tua atau hitam kehijauan menunjukkan adanya tanin dan polifenol, tabung C direaksikan dengan penambahan gelatin 1%. Apabila terbentuk endapan pada tabung C maka larutan ekstrak positif mengandung tanin (Robinson,1991). Pembanding pada uji tabung senyawa polifenol digunakan Timol dan pembanding pada uji tanin digunakan tanin dengan perlakuan yang sama dengan senyawa uji (ekstrak etanol daun binahong) (Mariana, 2005).
c. Uji saponin. Sebanyak 10 ml larutan uji binahong dimasukkan kedalam tabung reaksi kemudian ditutup dan dikocok vertikal kuat-kuat selama 10 detik. Tabung reaksi dibiarkan dalam kondisi tegak selama 30 menit. Setelah itu diteteskan HCl 2N, busa tidak hilang (Depkes RI, 1995). Pembanding yang digunakan pada uji tabung saponin adalah kulit buah lerak yang ditambah dengan air dan dimasukkan dalam tabung reaksi lalu digojog secara vertikal selama 10 detik (Depkes RI, 1995).
etanol daun kecubung 10 % (Farnsworth, 1996).
e. Uji flavonoid. Sebanyak 1 ml larutan uji binahong diuapkan hingga kering dan residu yang diperoleh dilarutkan dalam etanol panas 50%, setelah itu ditambahkan logam Mg dan HCl pekat sebanyak 4-5 tetes. Larutan ekstrak berubah warna menjadi merah atau jingga menunjukkan adanya flavonoid (Farnsworth,1996). Pembanding yang digunakan pada uji tabung senyawa flavonoid adalah rutin dengan perlakuakn yang sama dengan senyawa uji (ekstrak etanol daun binahong) (Farnsworth, 1996)
7. Uji kualitatif secara Kromatografi Lapis Tipis Ekstrak Etanol Daun Binahong.
a. Pembuatan Larutan Uji untuk KLT dari Ekstrak Etanol Daun Binahong. Ekstrak etanol daun binahong yang digunakan untuk uji KLT adalah ekstrak etanol dengan konsentrasi 10%. Pembuatannya dilakukan dengan cara ekstrak etanol daun binahong ditimbang sebanyak 0.5 g kemudian dilarutkan dengan 5 mL etanol p.a 70%.
b. Pembuatan larutan asam tanat 1% untuk pembanding tanin. Sebanyak 0,5g serbuk asam tanat dilarutkan dalam 0,5 ml etanol p.a, sehingga diperoleh asam tanat dengan konsentrasi 1%.
c. Pembuatan larutan ekstrak daun kecubung 10% untuk pembanding alkaloid. Sebanyak 0,5 g ekstrak etanol daun kecubung dilarutkan dalam 5 ml etanol p.a, sehingga diperoleh konsentrasi ekstrak etanol daun kecubung 10%. d. Pembuatan fase diam. Fase diam yang digunakan dalam uji KLT untuk
dengan cara menimbang 1.5 g silika gel GF untuk setiap pembuatan lempeng. Kemudian dilarutkan dengan 3 mL aquadest untuk setiap gramnya.
e. Penjenuhan fase gerak di dalam bejana. Bejana kromatografi yang akan digunakan, dilapisi dengan kertas saring yang telah dipotong dengan ukuran yang sesuai di bagian dalamnya. Fase gerak yang digunakan dimasukkan ke dalam bejana. Kemudian bejana ditutup rapat dan dibiarkan hingga seluruh isi bejana jenuh dengan uap fase gerak yang ditandai dengan seluruh permukaan kertas saring pada dinding bagian dalam bejana telah terbasahi oleh fase gerak.
f. Uji KLT senyawa fenolik. Fase diam yang digunakan adalah silika gel GF254 dan fase gerak yang digunakan adalah toluene - etil asetat - metanol dengan perbandingan 70:20:10 v/v. Sebagai standar pembanding digunakan eugenol sebanyak 1 ml dan dilarutkan dalam 1 ml etanol 70%. Eugenol yang digunakan sebagai senyawa pembanding adalah eugenol cair yang ada di Laboratorium Farmakognosi Fitokimia. Sampel dan pembanding ditotolkan bersama-sama pada lempeng KLT, kemudian dielusi pada batas tertentu sepanjang 10 cm dan diangin-anginkan agar kering. Setelah itu dideteksi dibawah sinar UV 254 nm dan pereaksi semprot besi (III) klorida.
dan diangin-anginkan agar kering. Setelah itu dideteksi dibawah sinar UV 254 nm, UV 365 nm, dan pereaksi semprot besi (III) klorida.
h. Uji KLT alkaloid. Fase diam yang digunakan adalah silika gel GF 254 dan fase gerak yang digunakan adalah etil asetat - methanol - air (70:20:10). Sebagai pembanding digunakan daun kecubung. Sampel dan pembanding ditotolkan bersama-sama pada lempeng KLT, kemudian dielusi pada batas tertentu (10) cm. setelah itu di deteksi dibawah sinar UV 254 nm dan UV 365 nm, kemudian dideteksi dengan pereaksi semprot Dragendroff.
8. Uji potensi antibakteri ekstrak etanol daun binahong terhadap S. aureus dan E. coli.
a. Penyiapan stok bakteri uji. dua ose diambil dari kultur bakteri stok menggunakan jarum ose steril dan dilakukan inokulasi pada 5 ml nutrian Agar miring dan diinkubasi selama 24 jam pada suhu 37ºC di inkubator. b. Pembuatan suspensi Bakteri uji. Pembuatan suspensi bakteri dilakukan
dengan mengambil 1-2 ose bakteri dari stok yang telah dibuat sebelumnya, diinokulasikan pada 3 ml media nutrient Broth. Suspensi tersebut diinkubasi selama 24 jam pada suhu 37ºC. Kemudian divortex, dan disetarakan kekeruhannya dengan larutan standard Mc. Farland II (6×108 CFU/ml) menggunakan Nutrien Broth.
dibuat dengan cara menimbang 19,07 g ekstrak kental (hasil penyarian) yang kemudian dilarutkan ke dalam 25 ml DMSO 1%. Larutan itu merupakan stok larutan uji. Dari stok larutan uji tersebut, dapat dibuat variasi konsentrasi larutan uji sebagai berikut:
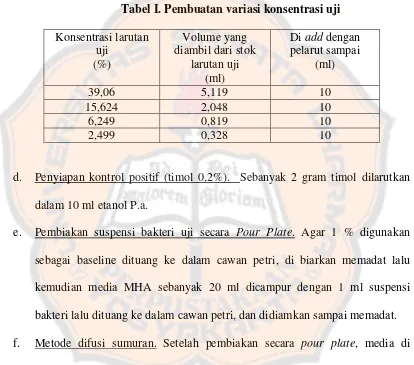
Tabel I. Pembuatan variasi konsentrasi uji Konsentrasi larutan bakteri lalu dituang ke dalam cawan petri, dan didiamkan sampai memadat. f. Metode difusi sumuran. Setelah pembiakan secara pour plate, media di
jangka sorong. Pada uji potensi antibakteri ini dilaukan replikasi sebanyak 3 kali.
g. Metode dilusi cair. Pada uji aktivitas antibakteri dengan menggunakan metode difusi, didapatkan konsentrasi terkecil dari ekstrak daun binahong yang memiliki aktivitas antibakteri. Dari konsentrasi terkecil tersebut, dibuat rentang konsentrasi yang lebih rendah sebanyak 9 variasi konsentrasi untuk mengetahui KHM dari masing-masing ekstrak. Pengujian dimulai dengan membuat suspensi bakteri yang disetarakan kekeruhannya dengan standard Mc. Farland II (6×108 CFU/ml). Dari suspensi tersebut, diambil 1 ml, ditambah dengan larutan uji sebanyak 1 ml dengan kadar tertentu dan dicampur rata dengan 4 ml MHB. Setelah itu dituang dalam tabung kecil dan diinkubasi selama 24 jam pada suhu 37ºC. diukur kekeruhannya dengan menggunakan alat nephlometer.
E. Tata Cara Analisis Hasil
bermakna (signifikan) dinyatakan dengan p < 0,05 dan perbedaan tidak bermakna (tidak signifikan) dinyatakan dengan p > 0,05.
45 BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini secara umum bertujuan untuk mengetahui dosis minimum ekstrak etanol daun binahong yang dapat menghambat dan membunuh bakteri Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922. Selain itu, penelitian ini juga bertujuan untuk mengetahui kandungan kimia yang terdapat dalam ekstrak etanol daun binahong.
A. Penyiapan Bahan 1. Hasil determinasi tanaman
Determinasi tanaman dilakukan di Laboratorium Kebun Tanaman Obat Fakultas Farmasi, Universitas Sanata Dharma. Determinasi dilakukan dengan menggunakan acuan C. A. Backer (1986). Determinasi tanaman bertujuan untuk memastikan bahwa tanaman yang digunakan adalah tanaman binahong. Hasil determinasi menunjukkan bahwa daun binahong yang digunakan dalam penelitian ini memiliki nama ilmiah Anredera cordifolia (Tenore) Steenis. (Lampiran1). 2. Hasil pengumpulan dan pembuatan serbuk
dilakukan pada sore hari, dengan asumsi bahwa pada sore hari setelah melakukan fotosintesis, tanaman menghasilkan metabolit sekunder dalam jumlah yang optimum, sehingga didapatkan hasil kandungan kimia yang maksimal. Setelah dipanen, dilakukan sortasi basah atau dengan kata lain dilakukan pemisahan dan pembuangan bahan-bahan asing atau tumbuhan atau bagian tumbuhan lain yang masih tercampur. Tujuan sortasi basah adalah agar bahan baku simplisia bersih dan tidak tercampur dengan tanah, kerikil, atau pengotor lainnya, misalnya serangga atau bagian tumbuhan lain.
Setelah dilakukan sortasi basah, daun binahong di cuci dengan sabun sunlight lalu dibilas dengan menggunakan air PAM yang mengalir dengan tujuan agar bahan baku simplisa yang diperolah bersih dari pengotor seperti debu atau tanah yang masih menempel di daun. Setelah itu dilakukan penirisan agar kelebihan air cucian keluar.
Perajangan daun binahong dilakukan agar pengeringan berlangsung lebih cepat. Perajangan dilakukan dengan pisau yang terbuat dari bahan stainless steel. Karena bila memakai pisau yang terbuat dari besi dan aluminium, senyawa flavonoid yang terkandung di daun binahong akan rusak.
enzimatik yang dapat mempengaruhi terurainya kandungan kimia pada daun binahong.
Tanda daun binahong sudah kering, yaitu mudah meremah apabila diremas dengan tangan. Menurut persyaratan obat tradisional pengeringan dilakukan sampai kadar air kurang dari 10% (Depkes RI, 1995).
Pengeringan dilakukan dibawah sinar matahari langsung dengan ditutup kain hitam untuk menghindari terurainya kandungan kimia karena terkena sinar matahari langsung, menghindari debu dan jika sudah kering tidak terbawa oleh angin.
Penyerbukan dilakukan dengan menggunkaan blender. Penyerbukan ini bertujuan untuk memperkecil ukuran partikel bahan dan meningkatkan luas permukaan bahan. Bila luas permukaan bahan meningkat, maka kontak antara cairan penyari dengan bahan semakin besar, sehingga serbuk akan semakin mudah terbasahi oleh penyari, dengan demikian diharapkan penyarian akan lebih efektif dan mempermudah penarikan senyawa dari serbuk oleh penyari.
Serbuk daun binahong yang diperoleh kemudian diayak menggunakan pengayak nomor 40 mesh agar serbuk memiliki derajat kehalusan yang sama sesuai. Menurut Depkes RI (1986) simplisia daun yang akan diserbuk baiknya dilakukan pengayakan dengan menggunakan pengayak nomor 40 mesh.
3. Penetapan kadar air serbuk daun binahong
Persyaratan yang ditetapkan adalah serbuk memiliki kadar air kurang dari 10% (Direktorat Jendral Pengawasan Obat dan Makanan RI, 1995). Penetapan kadar air serbuk dalam penelitian ini menggunakan metode susut pengeringan (Gravimetri). Serbuk daun binahong dipanaskan menggunakan alat moisture balance pada suhu 105oC selama 15 menit dengan asumsi bahwa air telah menguap semua. Tujuan digunakan suhu 105oC agar kandungan air menguap (diatas titik didih air). Setelah serbuk dipanaskan, dilakukan perhitungan terhadap kadar air yang diteliti. Pada penelitian ini dilakukan sebanyak tiga replikasi dan diperoleh rata-rata kadar air dalam serbuk daun binahong sebesar 7,4%. Hal ini menunjukkan bahwa serbuk daun binahong yang digunakan dalam penelitian ini telah memenuhi persyaratan yang ditetapkan. Pengujian kadar air dalam serbuk dilakukan untuk mencegah pertumbuhan mikroorganisme akibat tingginya kandungan air dalam serbuk.
4. Pembuatan ekstrak etanol dengan metode maserasi
berulang-ulang sehingga akan terjadi keseimbangan konsentrasi antara di luar sel dan didalam sel (Depkes RI,1986).
Menurut Depkes RI (1986), maserasi pada umumnya dilakukan dengan cara 10 bagian simplisia dengan derajat halus yang cocok dimasukkan ke dalam bejana, kemudian dituangi dengan 50 bagian cairan penyari, ditutup dan dibiarkan selama 5 hari, sambil diaduk tiap 8 jam sekali.
Dalam penelitian ini, serbuk yang digunakan sebanyak 300 g dibagi kedalam 3 erlenmeyer (tiap Erlenmeyer berisi 100 g serbuk), kemudian direndam dengan 500 ml etanol 70% pada tiap Erlenmeyer. Perbandingan serbuk dan cairan penyari 10:50. Pengadukan dilakukan dengan cara manual , yaitu menggunakan sendok tiap 8 jam sekali selama 5 hari. Setelah 5 hari, cairan penyari diganti yang baru dengan volume yang sama dan diperlakukan sama dengan yang sebelumnya, yaitu didiamkan selama 5 hari dan diaduk tiap 8 jam (remaserasi).