Karakteristik Semen Segar
Dari hasil penampungan semen yang berlangsung pada bulan Oktober 2003 sampai dengan Juli 2004 dan rusa dalam kondisi rangga keras memperlihatkan bahwa rataan nilai sifat-sifat semen segar rusa Timor yang diperoleh selama penelitian cukup baik (Tabel 3)
Tabel 3 Rataan nilai karakteristik semen segar rusa Timor
Karakteristik semen Nilai rataan
Volume (ml) Warna Konsistensi Gerakan massa
Konsentrasi (10
6sperma/ml) pH
Spermatozoa hidup (%) Motilitas (%)
MPU (%)
3.11 ± 1.47 krem - kuning sedang dan kental
++ dan +++
799.09 ± 285.11 6.96 ± 0.54 81.41 ± 3.46 71.82 ± 3.37 83.09
±3.20
Rataan volume semen yang diperoleh selama penelitian adalah 3.11± 1.47 ml (kisaran antara 1.4 sampai 5.3 ml). Hasil penelitian ini sedikit lebih
tinggi dari yang dilaporkan Drajad (2000) yakni 0.68 ml, Masyud dan Taurin (2000) yakni berkisar 1.2 – 1.7 ml dan Semiadi et al. (1998a) yakni berkisar antara 0.4 sampai 1.9 ml. Menurut Semiadi et al. (1998a) rendahnya volume semen yang terkumpul disebabkan oleh variasi umur, tingkat rangsangan elektroejakulator, ukuran probe dan lama pejantan berada dalam kondisi rangga keras.
Warna semen berkaitan erat dengan konsentrasi dan konsistensi, semakin
tinggi konsentrasi spermatozoa menyebabkan meningkatnya konsistensi dan
kepekatan warna semen. Semen rusa yang normal berwarna krem kekuningan
karena terdapat riboflavin hasil sekresi kelenjat vesikularis. Warna semen yang di
dapat pada penelitiaan umumnya krem – kuning dengan konsistensi berkisar
antara sedang dan kental (rata-rata sedang). Hal ini sama dengan yang dilaporkan Masyud dan Taurin (2000).
Konsistensi semen segar yang diperoleh selama penelitian termasuk baik dengan kisaran sedang dan kental, dengan gerakan massa berkisar antara ++ dan +++, persentase hidup rata-rata 81.41
± 3.46, persentase motilitas rata-rata71.82 ± 3.37 serta persentase MPU rata-rata 83.09 ± 3.20. Nilai motilitas ini lebih tinggi dibandingkan dengan hasil penelitian Semiadi et al. (1998a). yaitu 38%
pada rusa Sambar. Perbedaan hasil ini kemungkinan disebabkan oleh perbedaan bangsa ternak, individu ternak dan umur ternak yang digunakan. Menurut Everett dan Bean (1992); Shukla et al. (1992) persentase motilitas sangat nyata dipengaruhi oleh jumlah ejakulat, umur pejantan, perubahan temperatur, dan jenis pejantan.
Nilai fisiologis derajat keasaman (pH) semen segar yang diperoleh selama penelitian berkisar antara 6.5 sampai 7.7 (rata-rata 6.96 ± 0.54), dimana hasil ini relatif lebih rendah dibandingkan dengan yang dilaporkan Masyud dan Taurin (2000), yakni berkisar 7.67 sampai 7.79. Pada rusa, pH semen ini tidak berbeda jauh dengan hewan- hewan lain seperti kambing (7.71 – 7.07) dan domba (7.12).
Hal tersebut menjadi dasar untuk larutan pengencer karena pH larutan dapat mempengaruhi viabilitas spermatozoa. Perbedaan nilai fisiologis pH kemungkinan disebabkan oleh perbedaan ras, lingkungan dan perbedaan complex
buffer system (Evans & Maxwel 1987). Derajat keasaman ini akan memp engaruhidaya tahan spermatozoa. Semakin rendah atau semakin tinggi dari pH normal, akan membuat spermatozoa lebih cepat mati. Penurunan pH dapat terjadi karena semen dibiarkan pada suhu kamar tanpa diencerkan. Ini akibat dari penimbunan asam laktat ya ng merupakan hasil akhir proses metabolisme, yakni pemecahan fruktosa (fruktolisis). Asam laktat ini dalam jangka waktu lama dapat menurunkan pH semen. Penurunan pH ekstraseluler secara efektif dapat menurunkan pH intraseluler.
Penentuan konsentrasi spermatozoa sangat penting dalam penentuan
kualitas spermatozoa. Konsentrasi bersama dengan volume dan persentase
motilitas akan menggambarkan tingkat pengenceran dan banyaknya betina yang
dapat diinseminasi. Konsentrasi spermatozoa yang didapatkan pada penelitian ini
termasuk golongan konsentrasi sedang yaitu rata-rata 799.09
± 285.11 jutaspermatozoa/ml. Hasil penelitian ini relatif sama dengan hasil penelitian Masyud dan Taurin (2000) yakni berkisar antara 840 sampai 1140 juta sel/ml. Bila dibandingkan dengan rusa Sambar, konsentrasi rusa Timor ini lebih tinggi, yakni pada rusa Sambar konsentrasi rataannya adalah 547.75 sel spermatozoa/ml (Semiadi et al. 1998a). Variasi nilai konsentrasi spermatozoa ini kemungkinan disebabkan oleh perbedaan individu ternak yang digunakan dan kondisi ternak.
Menurut Everett dan Beans (1982) konsentrasi spermatozoa sangat nyata dipengaruhi oleh jumlah ejakulat, interval penampungan, kondisi pejantan, dan lingkungan. Perbedaan konsentrasi spermatozoa dapat juga dipengaruhi oleh kondisi individu, genetik, dan pakan. Apabila individu cukup sehat dan dalam kondisi yang optimal serta diberi pakan dengan kualitas baik, maka konsentrasi spermatozoa akan memiliki nilai yang lebih baik. Dibandingkan dengan hewan lain, konsentrasi spermatozoa rusa ini lebih mendekati sapi yaitu 700 – 1000 x 10
6spermatozoa/ml semen (Hafez 2000).
Pengaruh Jenis Pengencer terhadap Kualitas Semen Cair
Hasil pengenceran semen menggunakan pengencer tris maupun natrium sitrat dengan sumber karbohidrat glukosa dan fruktosa didapatkan adanya perbedaan, tetapi secara statistik menunjukkan tidak terjadi interaksi antara jenis pengencer dengan sumber karbohidrat yang berpengaruh terhadap kualitas semen cair rusa Timor selama disimpan dalam lemari es (P>0.05), namun jenis pengencer maupun karbohidrat masing- masing memberikan pengaruh nyata (P<0.05) terhadap beberapa parameter kualitas semen cair pada beberapa tahap evaluasi. Hal ini menunjukkan bahwa pengaruh jenis karbohidrat terhadap kualitas semen rusa Timor tidak tergantung atau dipengaruhi oleh jenis pengencer yang digunakan, baik pengencer tris maupun natrium sitrat.
Pengaruh Jenis Pengencer terhadap Persentase Motilitas
Hasil penelitian menunjukkan penyimpanan dalam pengencer tris maupun
natrium sitrat dengan sumber karbohidrat glukosa dan fruktosa setelah disimpan
dalam lemari es (suhu 3 – 5
oC) selama 48 jam relatif stabil (Tabel 4). Perbedaan
yang nyata (P<0.05) mulai terjadi setelah penyimpanan lebih dari 60 jam, dimana
terjadi penurunan persentase motilitas sebesar 2.14% pada pengencer tris glukosa, nilai penurunan ini nyata lebih rendah jika dibandingkan dengan pengencer natrium sitrat glukosa (4.29%), natrium sitrat fruktosa (2.29 %), dan tris-fruktosa (9.29%). Dari hasil penelitian motilitas spermatozoa menunjukkan bahwa spermatozoa dalam pengencer natrium sitrat glukosa, natrium sitrat fruktosa, dan tris glukosa secara teknis layak dipakai untuk IB pada rusa Timor dengan menggunakan semen cair sampai penyimpanan 60 jam, karena memiliki persentase motilitas progresif di atas 50%, sedangkan spermatozoa dalam pengencer tris fruktosa layak digunakan sampai dengan penyimpanan 36 jam.
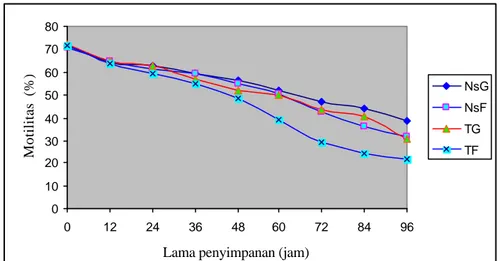
Tabel 4 Rataan persentase motilitas spermatozoa yang disimpan dalam lemari es (3 – 5
oC) pada berbagai jenis pengencer
Jenis pengencer Lama
penyimpanan
(Jam) NsG NsF TG TF
….………..%...……….
0 12 24 36 48 60 72 84 96
71.43 ± 3.8
a64.28 ± 5.3
a62.86 ± 5.7
a59.28 ± 7.3
a56.43 ± 7.5
a52.14 ± 3.9
a47.14 ± 5.7
a44.28 ± 9.3
a38.57 ±15.7
a70.71 ± 3.4
a65.00 ± 6.4
a61.43 ± 7.5
a59.28 ± 11.0
a55.00 ±13.2
a50.71 ± 14.8
a42.86 ± 18.7
a36.43 ± 20.1
a32.14 ± 23.1
ab72.14 ± 3.9
a65.00 ± 5.0
a62.86 ± 7.0
a57.86 ± 3.9
a52.14 ± 6.4
a50.00 ±7.6
a43.57 ± 7.5
a40.71 ± 7.3
a30.71 ± 9.3
ab71.43 ± 3.8
a63.57 ± 4.7
a59.28 ± 6.7
a55.00 ± 7.1
a48.57 ± 10.7
a39.28 ± 16.4
b29.28 ± 17.9
b24.28 ± 17.2
b21.43 ± 16.0
bKeterangan: Angka yang diikuti oleh huruf superskrip yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (P<0.05)
NsG : Natrium sitrat glukosa TG : Tris glukosa NsF : Natrium sitrat fruktosa TF : Tris fruktosa
Hasil evaluasi pengaruh jenis pengencer yang dikombinasikan dengan
sumber karbohidrat terhadap rataan persentase motilitas spermatozoa rusa Timor
yang disimpan selama 96 jam dalam lemari es (3 – 5
oC) menunjukkan bahwa
persentase motilitas spermatozoa cenderung lebih tinggi pada jenis pengencer
yang ditambahkan dengan glukosa (Tabel 4). Hal ini diduga karena spermatozoa
rusa Timor lebih memilih menggunakan glukosa sebagai sumber energinya
dibandingkan dengan menggunakan fruktosa. Menurut Toelihere (1981),
spermatozoa akan lebih mudah menggunakan glukosa dalam metabolismenya
dibandingkan dengan fruktosa. Hal ini sependapat dengan yang dikemukakan oleh Hawab (2001) yang menyatakan bahwa walaupun sel hidup dapat memetabolisme semua karbohidrat heksosa melalui glikolisis, namun glukosa merupakan molekul karbohidrat utama yang berfungsi sebagai penghasil energi utama untuk semua tipe sel.
Semen rusa yang telah diencerkan menggunakan pengencer tris maupun natrium sitrat dengan sumber karbohidrat glukosa dan fruktosa setelah disimpan dalam lemari es (suhu 3 – 5
oC) akan mengalami penurunan (Gambar 7).
Keterangan:
NsG : Natrium sitrat glukosa TG : Tris glukosa NsF : Natrium sitrat fruktosa TF : Tris fruktosa
Gambar 7 Grafik penurunan persentase motilitas spermatozoa yang disimpan dalam lemari es (3 – 5
oC) pada berbagai kombinasi jenis pengencer dan karbohidrat.
Penurunan motilitas spermatozoa mulai tampak setelah penyimpanan 12 jam dan terus turun secara gradual. Pada penyimpanan 84 jam pengencer natrium sitrat glukosa ternyata mampu mempertahankan motilitas (40%) lebih tinggi 44.28% dengan penurunan 27.15%, disusul dengan tris glukosa 40.71% dengan penurunan 31.43%, natrium sitrat fruktosa 36.43% dengen penurunan 34.28%, dan tris glukosa 24.28% dengan penurunan sebesar 47.15%. Terjadinya penurunan motilitas ini diduga akibat pengaruh metabolisme spermatozoa (Hafez 1987). Metabolisme spermatozoa akan menghasilkan asam laktat yang bila ada dalam jumlah yang banyak akan dapat merubah suasana semen menjadi asam
0 10 20 30 40 50 60 70 80
0 12 24 36 48 60 72 84 96
Lama penyimpanan (jam)
Motilitas (%)
NsG NsF TG TF
yang berakibat mempercepat proses kematian spermatozoa. Menurut Setiadi dan Julizar (2001), fenomena penurunan motilitas spermatozoa setela h penyimpanan yang lama lebih diakibatkan oleh menurunnya zat makanan spermatozoa dan pengaruh zat toksik hasil sampingan dari proses metabolisme spermatozoa. Rizal
et al. (2002) menambahkan bahwa motilitas spermatozoa sangat bergantung padasuplai energi berupa adenosin triphosphate (ATP) hasil dari proses metabolisme sel.
Pengaruh Jenis Pengencer terhadap Persentase Hidup Spermatozoa
Semen rusa yang telah diencerkan menggunakan pengencer tris maupun natrium sitrat dengan sumber karbohidrat glukosa dan fruktosa setelah disimpan dalam lemari es (suhu 3- 5
oC) akan mengalami penurunan kualitas. Hasil analisis statistik menunjukkan bahwa pengencer tris dan natrium sitrat memiliki pengaruh yang nyata (P<0.05) dalam mempertahankan persentase hidup spermatozoa selama penyimpanan dalam lemari es (suhu 3 – 5
oC). Rataan persentase hidup spermatozoa rusa Timor yang disimpan selama 96 jam dalam lemari es sekali lagi menunjukkan bahwa glukosa merupakan sumber karbohidrat terbaik untuk preservasi semen rusa diband ingkan dengan fruktosa (Tabel 5).
Tabel 5 Rataan persentase hidup spermatozoa yang disimpan dalam lemari es (3 – 5
oC) pada berbagai jenis pengencer
Jenis pengencer Lama
penyimpana n
(Jam) NsG NsF TG TF
.……….………...%...
0 12 24 36 48 60 72 84 96
80.22 ± 4.1
a78.43 ± 4.9
a77.87 ± 6.5
a75.24 ± 5.5
a73.42 ± 6.8
a67.83 ± 6.2
ab65.65 ± 7.0
a61.64 ± 11.0
ab55.71 ± 10.3
ab80.16 ± 3.1
a77.31 ± 4.1
a76.10 ± 4.8
a74.34 ± 8.3
a73.32 ± 7.4
a68.92 ± 9.8
a62.77 ± 7.5
ab59.24 ± 12.9
ab51.65 ± 24.3
ab81.01 ± 3,2
a78.34 ± 3.8
a76.42 ± 5.8
a73.89 ± 2.4
a71.68 ± 4.8
a69.96 ± 6.3
a68.26 ± 6.5
a66.54 ± 5.7
a64.27 ± 3.8
a80.44 ± 3.7
a78.57 ± 1.5
a76.01 ± 4.4
a71.88 ± 2.9
a69.95 ± 5.0
a61.31 ± 12.7
b58.94 ± 13.7
b51.53 ± 24.6
b42.60 ± 29.4
bKeterangan: Angka yang diikuti oleh huruf superskrip yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (P<0.05)
NsG : Natriu m sitrat glukosa TG : Tris glukosa NsF : Natriu m sitrat fruktosa TF : Tris fruktosa
Selama penyimpanan persentase spermatozoa hidup rusa Timor cenderung menurun secara gradual. Laju penurunan persentase hidup spermatozoa selama penyimpanan dalam lemari es sangat mencolok pada pengencer tris fruktosa (Gambar 8). Dari keempat jenis pengencer yang digunakan ternyata pengencer tris- glukosa dapat mempertahankan persentase spermatozoa hidup rata-rata lebih tinggi dibandingkan dengan pengencer natrium sitrat-glukosa, natrium sitrat- fruktosa dan tris- fruktosa. Secara umum rataan penurunan persentase hidup spermatozoa pada jenis pengencer yang ditambahkan glukosa cenderung lebih rendah dibandingkan dengan fruktosa, terutama yang dikombinasikan dengan tris.
Hal ini diduga karena tris memiliki kapasitas sebagai penyangga yang paling optimal dalam mempertahankan kesetabilan pH semen rusa Timor, sehingga menguntungkan untuk memelihara kelangsungan hidup spermatozoa. Lapwood et
al. (1966) menyatakan bahwa kemampuan karbohidrat dalam melindungi selspermatozoa tergantung pada berat molekul karbohidrat dan tipe penyangga yang ditambahkan dalam pengencer.
Keterangan:
NsG : Natrium sitrat glukosa TG : Tris glukosa NsF : Natrium sitrat fruktosa TF : Tris fruktosa
Gambar 8 Grafik penurunan persentase hidup spermatozoa yang disimpan di dalam lemari es (3 – 5
oC) pada berbagai kombinasi jenis pengencer dan karbohidrat.
Meskipun secara statistik tidak menunjukkan interaksi yang nyata antara jenis pengencer dan sumber karbohidrat, namun secara umum menunjukkan
0 10 20 30 40 50 60 70 80 90
0 12 24 36 48 60 72 84 96
Lama penyimpanan (jam)
Hidup (%)
NsG NsF TG TF
bahwa glukosa cenderung lebih tinggi dalam mempertahankan persentase hidup spermatozoa dibandingkan dengan fruktosa. Hal ini kemungkinan disebabkan glukosa yang ditambahkan dalam pengencer tris dan natrium sitrat mampu memelihara kestabilan pH, melindungi spermatozoa terhadap terjadinya cekaman dingin, dan mempertahankan tekanan osmotik. Menurut Lapwood et al. (1966), karbohidrat yang ditambahkan dalam pengencer dapat memelihara tekanan osmotik, memfasilitasi metabolisme fruktosa, mengurangi kerusakan akibat pengencer dan melindungi spermatozoa terhadap terjadinya cekaman dingin.
Woelder et al. (1997) menambahkan bahwa sumber karbohidrat yang ditambahkan dalam pengencer dapat mengurangi kerusakan sel spermatozoa selama dilakukan penurunan suhu secara cepat.
Hasil pengamatan semen cair menunjukkan bahwa tingkat penurunan persentase hidup spermatozoa selama penyimpanan lebih rendah jika dibandingkan dengan tingkat penurunan persentase motilitas spermatozoa pada keempat jenis pengencer. Tingkat penurunan persentase hidup dan persentase motilitas spermatozoa pada awal hingga 96 jam penyimpanan masing- masing adalah 16.74% dan 41.43% pada pengencer tris glukosa, 24.51% dan 32.86%
pada pengencer natrium sitrat glukosa, 28.51% dan 39.57% pada pengencer natrium sitrat fruktosa, serta 37.84% dan 50.00% pada pengencer tris fruktosa.
Hal ini menunjukkan bahwa penurunan persentase motilitas spermatozoa yang dratis tidak diikuti dengan penurunan persentase hidup yang dratis pula, karena persentase spermatozoa yang tergolong hidup dihitung tidak saja yang motil progresif tetapi juga yang bergerak di tempat atau melingkar.
Pengaruh Jenis Pengencer terhadap Persentase MPU
Membran plasma utuh mutlak harus dimiliki oleh spermatozoa supaya terjamin kelangsungan hidupnya dan tercapai keberhasilan saat proses fertilisasi.
Selain berfungsi untuk melindungi organel-organel yang berada di dalam sel, membran plasma berfungsi juga untuk mengatur keluar masuknya zat- zat makanan serta keseimbangan elektrolit intra maupun ekstraseluler.
Hasil penelitian menunjukkan bahwa penambahan glukosa dan fruktosa ke
dalam pengencer tris dan natrium sitrat yang disimpan selama 72 jam relatif stabil
(Tabel 6). Perbedaan yang nyata (P<0.01) mulai terjadi pada saat penyimpanan lebih dari 84 jam, dimana terjadi penurunan persentase MPU sebesar 0,39% pada pengencer tris glukosa, nilai ini nyata lebih tinggi jika dibandingkan dengan pengencer natrium sitrat glukosa (2.76%), natrium sitrat fruktosa (3.30%), dan tris fruktosa (12.16%). Kenyataan ini memberikan indikasi bahwa pengencer tris glukosa lebih mampu berinteraksi dengan membran plasma spermatozoa dengan jalan melenturkannya sehingga dapat melindungi membran plasma spermatozoa dari kerusakan.
Tabel 6 Rataan persentase MPU spermatozoa yang disimpan dalam lemari es (3 – 5
oC) pada berbagai jenis pengencer
Jenis pengencer Lama
penyimpanan
(Jam) NsG NsF TG TF
…………..……….%...
0 12 24 36 48 60 72 84 96
81.74 ± 4.1
a81.63 ± 4.8
a80.44 ± 6.6
a78.28 ± 5.6
a76.16 ± 5.7
a73.47 ± 4.3
a69.43 ± 6.4
a66.67 ± 11.2
ab59.24 ± 11.1
ab81.36 ± 3.7
a79.94 ± 4.5
a77.94 ± 3.6
a77.17 ± 6.9
a74.58 ± 6.0
a72.80 ± 10.3
a67.80 ± 9.8
a64.50 ± 12.4
ab56.17 ± 26.2
ab82.48 ± 2.8
a81.08 ± 3.2
a78.43 ± 4.5
a78.07 ± 2.2
a74.76 ± 4.2
a72.46 ± 6.5
a70.30 ± 5.8
a69.94 ± 4.4
a67.35 ± 3.1
a82.16 ± 3.7
a81.49 ± 1.5
a79.21 ± 4.4
a75.34 ± 2.9
a73.49 ± 5.0
a67.27 ± 12.7
a65.55 ± 13.7
a53.39 ± 24.6
b43.59 ± 29.4
bKeterangan: Angka yang diikuti oleh huruf superskrip yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (P<0.05)
NsG : Natriu m sitrat glukosa TG : Tris glukosa NsF : Natriu m sitrat fruktosa TF : Tris fruktosa
Glukosa dapat melindungi membran plasma spermatozoa selama proses penurunan suhu karena glukosa dapat bersifat sebagai krioprotektan ekstraseluler.
Sebagai krioprotektan ekstraseluler glukosa dapat melindungi membran plasma
dengan cara melenturkannya. Menurut Garcia dan Graham (1989) yang dikutip
dalam Yildiz et al. (2000) monosakarida (glukosa) yang ditambahkan dalampengencer dapat menurunkan persentase kerusakan akrosom, mempertahankan
motilitas selama proses preservasi semen. Paulenz et al. (2002) menambahkan
kerusakan membran plasma dapat terjadi pada saat penurunan penanganan semen
yaitu ketika penurunan temperatur terutama pada saat penurunan cepat dari suhu
20
oC menuju 5
oC yang menyebabkan kerusakan sel akibat cekaman dingin.
Cekaman dingin ini menyebabkan perubahan pada lipid membran plasma dan menyebabkan membran plasma kehilangan daya selektivitasnya.
Rusaknya membran plasma dapat juga disebabkan adanya peroksidasi lipid pada bagian membran sel. Membran plasma terdiri dari 60% protein dan 40%
lipid dimana lipid yang membentuk membran plasma terdiri atas 65% fosfolipid, 25% kolesterol dan 10% lipid lainnya. Lipid pada bagian membran plasma sangat rentan terhadap adanya reaksi peroksidasi.
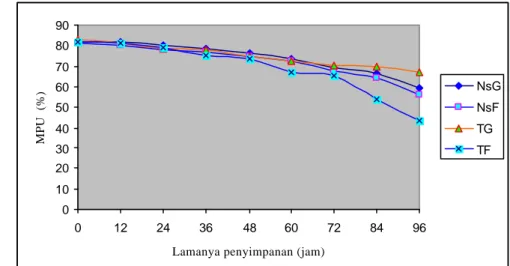
Gambar 9 memperlihatkan grafik MPU spermatozoa pada setiap 12 jam pengamatan dari masing- masing perlakuan. Grafik ini memperlihatkan dengan jelas terjadi penurunan MPU spermatozoa dengan semakin lamanya waktu penyimpanan. Penurunan persentase MPU yang sangat dratis terlihat setelah semen disimpan selama 84 jam.
Keterangan:
NsG : Natrium sitrat glukosa TG : Tris glukosa NsF : Natrium sitrat fruktosa TF : Tris fruktosa
Gambar 9 Grafik penurunan MPU spermatozoa yang disimpan di dalam lemari es (3 – 5
oC) pada berbagai kombinasi jenis pengencer dan karbohidrat.
Tingkat penurunan persentase MPU selama penyimpanan lebih rendah jika dibandingkan dengan tingkat penurunan persentase motilitas spermatozoa pada keempat jenis pengencer. Tingkat penurunan persentase MPU dan motilitas spermatozoa pada awal hingga 96 jam penyimpanan masing- masing adalah
0 10 20 30 40 50 60 70 80 90
0 12 24 36 48 60 72 84 96
Lamanya penyimpanan (jam)
MPU (%)
NsG NsF TG TF
15.13% dan 41.43% pada pengencer tris glukosa, 22.50% dan 32.86% pada pengencer natrium sitrat glukosa, 25.19 dan 39.57 pada pengencer natrium sitrat fruktosa, serta 38.57% dan 50.00% pada pengencer tris fruktosa. Hal ini menunjukkan bahwa penurunan persentase motilitas spermatozoa yang dratis tidak diikuti dengan penurunan persentase MPU yang dratis pula, dimana spermatozoa yang tidak motil dalam pengencer masih memiliki membran plasma yang baik.
Pengaruh Jenis Pengencer dan Dosis Gliserol terhadap Kualitas Semen Beku Hasil pengenceran semen menggunakan pengencer tris maupun natrium sitrat dengan sumber karbohidrat glukosa dan fruktosa dan level gliserol 10% dan 15% didapatkan adanya perbedaan, tetapi secara statistik menunjukkan tidak terjadi interaksi antara jenis pengencer dengan dosis gliserol yang berpengaruh terhadap kualitas semen rusa Timor pada berbagai tahap pembekuan (P>0.05), akan tetapi jenis pengencer maupun dosis gliserol masing- masing memberikan pengaruh nyata (P<0.05) terhadap beberapa parameter kualitas semen beku pada beberapa tahap evaluasi. Hal ini menunjukkan bahwa pengaruh dosis gliserol terhadap kualitas spermatozoa semen beku rusa Timor tidak tergantung atau dipengaruhi oleh jenis pengencer ya ng digunakan, baik pengencer tris ataupun natrium sitrat.
Pengaruh Gliserol terhadap Kualitas Semen
Persentase Motilitas
Motilitas merupakan salah satu kriteria yang penting untuk menilai kualitas spermatozoa yang akan digunakan untuk inseminasi buatan. Motilitas diperlukan bagi spermatozoa untuk mencapai tempat fertilisasi dan menembus dinding ovum.
Hasil penelitian menunjukkan bahwa penambahan gliserol ke dalam
pengencer tris maupun sitrat tidak mempengaruhi motilitas spermatozoa pasca
pengenceran, na mun pasca ekulibrasi dan pasca thawing pengaruh gliserol sudah
dapat terlihat. Hal ini didukung dari hasil analisis statistik yang menunjukkan
bahwa gliserol tidak berpengaruh nyata (P>0.05) terhadap persentase motilitas
spermatozoa pasca pengenceran (Tabel 7). Namun pada pasca ekulibrasi dan
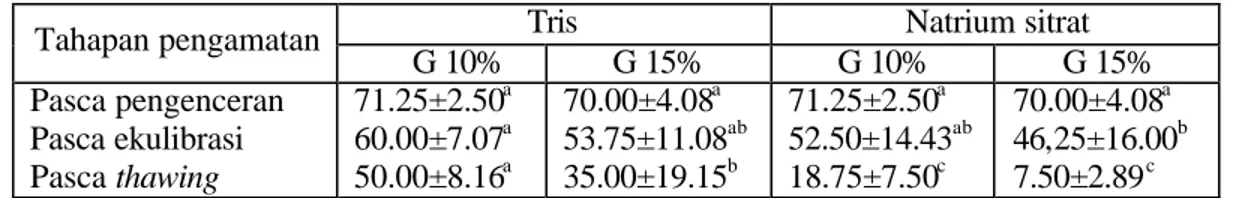
pasca thawing, penambahan gliserol sudah memperlihatkan pengaruh yang nyata (P<0.05), dimana penambahan gliserol 10% ke dalam pengencer tris menghasilkan persentase motilitas spermatozoa yang relatif lebih tinggi dibandingkan dengan kombinasi jenis pengencer dan level gliserol yang lain (tris gliserol 15%, natrium sitrat gliserol 10%, dan natrium sitrat gliserol 15%).
Tabel 7 Rataan persentase motilitas spermatozoa dalam berbagai kombinasi jenis pengencer dan dosis gliserol
Tris Natrium sitrat
Tahapan pengamatan
G 10% G 15% G 10% G 15%
Pasca pengenceran Pasca ekulibrasi Pasca thawing
71.25±2.50a 60.00±7.07a 50.00±8.16a
70.00±4.08a 53.75±11.08ab 35.00±19.15b
71.25±2.50a 52.50±14.43ab 18.75±7.50c
70.00±4.08a 46,25±16.00b 7.50±2.89c Keterangan: Angka yang diikuti oleh huruf superskrip yang berbeda pada baris yang sama
menunjukkan perbedaan yang nyata (P<0.05)
G : dosis gliserol (%)
Penambahan gliserol 10% ke dalam pengencer tris mampu memberikan perlindungan terhadap semen rusa Timor dari pengaruh yang merugikan.
Pengaruh perlindungannya yaitu memodifisier kristal-kristal es yang terbentuk selama proses pembekuan, sehingga kerusakan organel-organel sel spermatozoa dapat dihindarkan. Bila organel-organel sel spermatozoa rusak, seperti mitokondria maka rantai oksidasi akan terputus sehingga proses metabolisme tidak dapat berlangsung dan akhirnya sel mati.
Peranan lain dari gliserol adalah mencegah terjadinya dehidrasi, karena memiliki daya pengikat air yang kuat. Sifat demikian mempengaruhi tekanan uap sehingga titik beku medium menurun, akibatnya sel spermatozoa akan memperoleh kesempatan lebih lama untuk mengeluarkan air. Mazur (1980), mengatakan bahwa gliserol dapat mencegah pengumpulan molekul- molekul H
2O dan kristalisasi es pada daerah titik beku larutan.
Gliserol akan memberikan perlindungan yang efektif terhadap spermatozoa
selama propses pembekuan bila konsentrasinya di dalam pengencer optimal. Bila
konsentrasi gliserol tidak optimal di dalam pengencer semen maka akan
menimbulkan penurunan kualitas spermatozoa.
Dari hasil penelitian terlihat bahwa penambahan gliserol 15% pada pengencer tris maupun natrium sitrat dan penambahan gliserol 10% pada natrium sitrat menghasilkan rataan motilitas yang rendah pada pasca thawing. Hal ini diduga dosis gliserol yang ditambahkan ke dalam pengencer terlalu tinggi sehingga tidak mampu melindungi sprematozoa. Menurut Rizal et al. (2002) konsentrasi gliserol yang berlebihan akan menimbulkan efek toksik pada spermatozoa, sebaliknya apabila kurang, gliserol tidak akan memberikan efek yang optimal. Rendahnya persentase motilitas pasca thawing pada pengencer tris gliserol 15% dan natrium sitrat 15% kemungkinan disebabkan oleh efek toksik dari gliserol. Semakin tinggi dosis gliserol yang ditambahkan ke dalam pengencer kecendrungan efek toksik yang ditimbulkan juga semakin besar.
McLaughlin et al. (1992) mengatakan bahwa efek toksisitas dari gliserol adalah memodifikasi struktur membran plasma dan pada konsentrasi yang tinggi dapat menghambat metabolisme energi. Akibat dari terganggunya mekanisme ini spermatozoa akan mengalami kekurangan energi sehingga viabilitas dan motilitasnya menurun.
Faktor lain yang mungkin menjadi penyebab rendahnya motilitas spermatozoa pasca thawing adalah tingginya ion Ca
2+intraseluler dan intoksikasi ion Ca
2+menyebabkan spermatozoa lebih rentan terhadap cekaman dingin.
Cekaman dingin menyebabkan gangguan metabolisme spermatozoa. Penyebab adanya cekaman dingin adalah daya kontraksi selubung lipoprotein sel spermatozoa yang besar dari pada kontraksi isi sel spermatozoa
Persentase Hidup
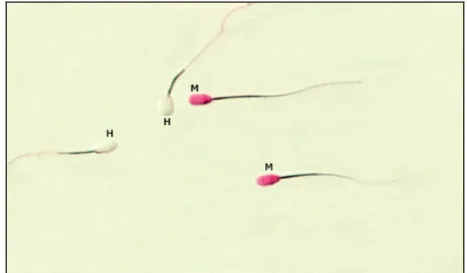
Spermatozoa rusa dapat dibedakan antara yang hidup dengan yang mati dengan cara penambahan zat warna eosin. Spermatozoa yang hidup ditandai dengan kepala sperma yang tidak berwarna (transparan), sedangkan yang mati ditandai dengan kepala spermatozoa yang berwarna merah. (Gambar 10).
Spermatozoa yang hidup akan tetap tidak berwarna saat diberi pewarna eosin,
karena zat warna eosin yang terikat pada natrium dengan mekanisme pompa
natrium akan terdorong keluar sel. Sedangkan pada spermatozoa yang telah mati
tidak terdapat potensial ion natrium dan kalium antara di dalam dan di luar sel,
sehingga eosin yang berikatan dengan natrium akan dengan mudah berdifusi dan menunjukkan warna merah pada kepala spermatozoa saat diberi pewarna eosin.
Gambar 10 Bentuk spermatozoa yang hidup (H = kepala sperma tidak berwarna) dan mati (M = kepala sperma berwarna merah)
Hasil penelitian menunjukkan bahwa penambahan gliserol ke dalam pengencer tris dan natrium sitrat belum mempengaruhi daya hidup spermatozoa pasca pengenceran. Hal ini terlihat dari hasil analisis statistik yang menunjukkan bahwa penambahan gliserol tidak berpengaruh nyata (P>0.05) terhadap persentase hidup spermatozoa pasca pengenceran (Tabel 8). Namun pada pasca ekulibrasi dan pasca thawing penambahan gliserol telah mampu memberikan pengaruh yang nyata (P<0.05) terhadap daya hidup spermatozoa.
Tabel 8 Rataan persentase hidup spermatozoa dalam berbagai kombinasi jenis pengencer dan dosis gliserol
Tris Natrium sitrat
Tahapan
pengamatan G 10% G 15% G 10% G 15%
Pasca pengenceran Pasca ekulibrasi Pasca thawing
80.27±4.02
a65.00±6.34
a57.50±9.56
a79.48±2.73
a58.99±10.24
ab45.25±15.90
b80.50±1.02
a59.07±11.78
ab36.46±15.17
b79.31±1.76
a51.91±14.02
b18.45±4.73
cKeterangan: Angka yang diikuti oleh huruf superskrip yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (P<0.05)
G : dosis gliserol (%)
Penambahan gliserol 10% pada tahapan pengamatan pasca ekulibrasi dapat mempertahankan daya hidup spermatozoa yang lebih baik daripada penambahan gliserol 15%, terutama yang dikombinasikan dengan pengencer tris. Pada tahapan pengamatan pasca thawing penambahan gliserol 10% yang dikombinasikan dengan pengencer tris mampu mempertahankan daya hidup yang lebih baik dibandingkan dengan kombinasi tris gliserol 15%, natrium sitrat gliserol 10%, dan natrium sitrat gliserol 15%. Hal ini berarti bahwa penambahan gliserol sebesar 10% ke dalam pengencer tris mampu melindungi spermatozoa dari pengeruh cekaman dingin selama proses pembekuan.
Rendahnya persentase hidup spermatozoa pada pengencer tris gliserol 15%
dan pada pengencer natrium sitrat, diduga karena pengaruh toksik gliserol. Efek toksik ini akan memodifikasi struktur membran plasma dan pada konsentrasi yang tinggi menghambat metabolisme energi (McLaughlin et al. 1992). Gliserol juga dapat merusak struktur membran spermatozoa selama proses pembekuan, menyebabkan cekaman osmotik dan menimbulkan efek negatif terhadap antibiotik di dalam pengencer (Toelihere, 1985). Menurut Fahy (1986), penggunaan krioprotektan dalam pengencer untuk pembekuan harus memperhatikan sifat toksisitasnya yang berkaitan dengan komposisi pengencer, metode pencampuran, ekulibrasi, pendinginan dan pembekuan.
Faktor lain yang menyebabkan rendahnya persentase hidup spermatozoa pasca thawing adalah akibat bayaknya asam laktat dari hasil metabolisme spermatozoa yang tidak dapat dioksidasi. Menumpuknya asam laktat ini mengakibatkan meningkatkan kadar keasaman larutan yang berakibat buruk bagi spermatozoa karena bersifat racun.
Persentase Membran Plasma Utuh
Spermatozoa yang memiliki membran plasma utuh (MPU), setelah dipapar
dengan larutan hipoosmotik mengunakan metode hypoosmotik swelling test
(HOS-Test) ditandai dengan ekor melingkar atau menggembung. Hal ini dapat
terjadi karena medium yang masuk ke dalam sel dipertahankan oleh membran
plasma yang utuh tersebut. Sebaliknya jika membran plasma sudah tidak utuh
akan ditandai dengan ekor spermatozoa tetap lurus bila dipaparkan dalam larutan
hipoosmotik. Hal ini terjadi karena membran plasma yang sudah tidak utuh lagi
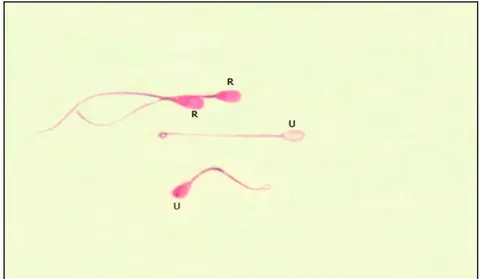
tidak dapat mempertahankan medium yang telah masuk ke dalam sel (Gambar 11).
Gambar 11 Bentuk membran plasma yang utuh (U=ekor sperma yang melingkar) dan rusak (R=ekor sperma lurus).
Hasil penelitian menunjukkan bahwa penambahan gliserol ke dalam pengencer tris maupun natrium belum mempengaruhi persentase MPU pasca pengenceran, tetapi pada tahap pasca ekulibrasi dan pasca thawing telah memberikan pengaruh yang berbeda. Hal ini terlihat dari hasil analisis statistik yang menunjukkan bahwa penambahan gliserol berpengaruh nyata (P<0.05) terhadap persentase MPU spermatozoa pasca ekulibrasi dan pasca thawing (Tabel 9). Keadaan ini dapat memberikan gambaran bahwa gliserol telah memperlihatkan daya kerjanya dalam melindungi membran plasma spermatozoa pasca ekulibrasi dan pasca thawing.
Tabel 9 Rataan persentase membran plasma utuh spermatozoa dalam berbagai kombinasi jenis pengencer dan dosis gliserol
Tris Natrium sitrat
Tahapan
pengamatan G 10% G 15% G 10% G 15%
Pasca pengenceran Pasca ekulibrasi Pasca thawing
81.58±1.87
a65.00±6.34
a59.04±9.37
a80.37±.73
a58.99±10.24
ab46.57±16.67
b80.50±1.02
a59.07±11.78
ab37.46±13.82
b79.31±1.76
a51.91±14.02
b20.20±6.49
cKeterangan: Angka yang diikuti oleh huruf superskrip yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (P<0.05)