SKRIPSI
RESPON PERTUMBUHAN KULTUR SEL LIMFOID UDANG VANAME (Litopenaeus vannamei) PADA MEDIA YANG BERBEDA
Oleh :
INDRA TRI PRAYUGI JOMBANG – JAWA TIMUR
FAKULTAS PERIKANAN DAN KELAUTAN UNIVERSITAS AIRLANGGA
SURABAYA 2014
SKRIPSI
RESPON PERTUMBUHAN KULTUR SEL LIMFOID UDANG VANAME (Litopenaeus vannamei) PADA MEDIA YANG BERBEDA
Oleh :
INDRA TRI PRAYUGI NIM : 141011105
Menyetujui, Komisi Pembimbing
Pembimbing Utama
Dr. Ir. Endang Dewi Masithah, M.P. HIDAYATUL UDCHIYAH
NIP. 19690912 199702 2 001
Pembimbing Serta
SKRIPSI
RESPON PERTUMBUHAN KULTUR SEL LIMFOID UDANG VANAME (Litopenaeus vannamei) PADA MEDIA YANG BERBEDA
Oleh :
INDRA TRI PRAYUGI NIM : 141011105
Telah diujikan pada
Tanggal : 24 Juni 2014
KOMISI PENGUJI SKRIPSI
Ketua : Moch. Amin Alamsjah, Ir., M.Si., Ph.D Anggota : Rr. Juni Triastuti, S.Pi., M.Si.
Dr. Gunanti Mahasri, Ir. M.Si. Dr. Endang Dewi Masithah, Ir. M.P.
Dr. Widjiati, M.Si., drh.
Surabaya, 7 Juli 2014 Fakultas Perikanan dan Kelautan
Universitas Airlangga Dekan,
Prof. Dr. Hj. Sri Subekti,drh.DEA NIP. 19520517 197803 2 001
RINGKASAN
INDRA TRI PRAYUGI. Respon Pertumbuhan Kultur Sel Limfoid Udang Vaname (Litopenaeus vannamei) pada Media yang Berbeda. Dosen Pembimbing I Dr. Ir. Endang Dewi Masithah, M.P. dan Dosen Pembimbing II Dr. Widjiati, M.Si., drh.
Masalah utama pada budidaya udang vaname hingga saat ini adalah munculnya penyakit yang disebabkan oleh virus, bakteri dan jamur. Informasi tentang karakteristik penyakit yang diperlukan untuk pencegahan dan pengendalian penyakit pada udang belum banyak diketahui. Salah satu cara yang bisa dipakai untuk mengetahui karakteristik penyakit adalah dengan menggunakan kultur sel. Kultur sel ini nantinya bisa membantu untuk menentukan dan memahami hubungan antara udang dan patogen pada tingkat seluler dan molekuler sehingga memberikan kemudahan dalam pencegahan dan pengendalian penyakit yang menyerang udang.
Pembuatan kultur sel udang memerlukan media yang tepat untuk pertumbuhan dan perkembangan sel yang dikultur. Media yang sering digunakan untuk kultur sel udang adalah media MEM, media L-15 dan media TCM. Namun, sampai saat ini belum ada referensi khusus perihal media mana yang dapat memberikan hasil terbaik terhadap pertumbuhan sel limfoid udang yang sedang dikultur. Berdasarkan hal tersebut, maka penelitian tentang jenis media pertumbuhan yang paling baik dalam kultur sel limfoid udang vaname sangat diperlukan.
Tujuan dari penelitian ini adalah untuk mengetahui perbedaan pertumbuhan dan media terbaik bagi pertumbuhan kultur sel limfoid udang vaname (L. vannamei) pada media yang berbeda. Penelitian dilakukan di Laboratorium In Vitro, Fakultas Kedokteran Hewan, Universitas Airlangga Surabaya pada bulan Februari 2014. Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan 3 perlakuan dan 3 kali ulangan. Data hasil penelitian dianalisis menggunakan ANAVA. Apabila menunjukkan adanya perbedaan maka dilanjutkan dengan uji Jarak Berganda Duncan.
Bahan yang digunakan dalam penelitian ini adalah udang vaname berumur 2 bulan dengan panjang tubuh ± 8 cm, media L-15, media MEM, media TCM, penicilin-streptomycin, amphoterycin B, Fetal Calf Serum (FCS), NaHCO3, aquabidest, tripsin, phenol red, trypanblue dan larutan fiksatif. Parameter utama yang diamati adalah jumlah dan viabilitas sel limfoid udang vaname sedangkan parameter pendukungnya adalah ada tidaknya kontaminasi.
v
SUMMARY
INDRA TRI PRAYUGI. Growth Response of White Shrimp (Litopenaeus vannamei) Lymphoid Cell Cultures in Different Media. Academic Advisor I Dr. Ir. Endang Dewi Masithah, M.P. and Academic Advisor II Dr. Widjiati, M.Si., drh.
The main problem in vaname culture is the emergence of diseases caused by viruses, bacteria and fungi. Information about disease characteristics is necessary for the prevention and control of disease in shrimp is not widely known. One way that can be used to determine the characteristics of the disease is by using cell culture. This cell culture will help determining and understanding the relation between shrimp and pathogens at cellular and molecular level so it can provide ease in the prevention and control of in shrimp.
Shrimp cell culture requiring an exact medium for proper growth and development of cultured cells. Medium that often used for shrimp cell culture are MEM, L-15 and TCM. However, until now there is no specific reference regarding which medium can provide the best results on the growth of shrimp lymphoid cells that was cultured. Based on this fact, the research of the best media for the growth of white shrimp lymphoid cell cultures is indispensable.
The purpose of this study was to determine the differences in growth and the best medium for the growth of white shrimp lymphoid cell cultures (L. vannamei) in different media. The study was conducted in the In Vitro Laboratory, Faculty of Veterinary Medicine, Airlangga University in February 2014. Research design used Completely Randomized Design with 3 treatments and 3 replications. The data was analyzed using ANOVA. If it shows a difference than Duncan 's Multiple Range Test is used.
Materials used in this study were 2 months old white shrimp with a body length of ± 8 cm, L-15 medium, MEM medium, TCM medium, penicillin- streptomycin, amphoterycin B, Fetal Calf Serum (FCS), NaHCO3, aquabidest, trypsin, phenol red, trypanblue and fixative solution. The main parameters measured were the amount and viability of white shrimp lymphoid cells while the supporting parameter is contamination .
Results of analysis of variance (ANOVA) were conducted from initial observations up to day 18 showed that treatment B (medium L-15) gave the best results white shrimp lymphoid cell cultures (39 x 106 cells/ml) were significantly different ( p < 0,05 ) with treatment C (medium TCM at 28.667 x 106 cells/ml) and treatment A (medium MEM at 22,333 x 106 cells/ml). Based on the calculation of all the cell viability still viable and better treatments to support survival of cultured cells which is above 95 % without contamination.
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT atas
limpahan rakhmat, taufiq dan hidayah-Nya, sehingga Skripsi tentang Respon
Pertumbuhan Kultur Sel Limfoid Udang Vaname (Litopenaeus vannamei) pada
Media yang Berbeda dapat penulis selesaikan. Laporan ini disusun berdasarkan
hasil penelitian yang telah dilaksanakan di Laboratorium In Vitro, Fakultas
Kedokteran Hewan, Universitas Airlangga pada bulan Februari 2014.
Penulis menyadari bahwa laporan ini masih jauh dari kesempurnaan,
sehingga kritik dan saran yang membangun sangat diharapkan demi perbaikan dan
kesempurnaan Skripsi ini. Akhirnya penulis berharap semoga Karya Ilmiah ini
bermanfaat dan memberikan informasi bagi semua pihak, khususnya bagi
Mahasiswa Fakultas Perikanan dan Kelautan Universitas Airlangga guna
kemajuan serta perkembangan ilmu dan teknologi dalam bidang perikanan,
terutama budidaya perairan.
Surabaya, Juli 2014
vii
UCAPAN TERIMA KASIH
Pada kesempatan ini, tidak lupa pula penulis mengucapkan terima kasih
yang tak terhingga kepada:
1. Ibu Prof. Dr. Hj. Sri Subekti, drh. DEA., selaku Dekan Fakultas Perikanan
dan Kelautan Universitas Airlangga Surabaya.
2. Ibu Dr. Endang Dewi Masithah, Ir. M.P. selaku Dosen Pembimbing Pertama
dan Ibu Dr. Widjiati, M.Si., drh. selaku Dosen Pembimbing Kedua yang
telah memberikan arahan, petunjuk dan bimbingan sejak penyusunan usulan
hingga selesainya Skripsi.
3. Bapak Moch. Amin Alamsjah., Ir. M.Si.,Ph.D., Ibu Rr. Juni Triastuti, S.Pi.,
M.Si., dan Ibu Dr. Gunanti Mahasri., Ir. M.Si. selaku Dosen Penguji yang
telah bersedia meluangkan waktu untuk menguji serta memberikan masukan
dan saran atas perbaikan laporan Skripsi.
4. Bapak Yudi Cahyoko., Ir. M.Si. dan Bapak Moch. Amin Alamsjah., Ir.
M.Si.,Ph.D. selaku Dosen Pembimbing Akademik yang senantiasa memberi
nasehat dan pengarahan selama masa perkuliahan.
5. Bapak/Ibu dosen dan staf pendidikan di Fakultas Perikanan dan Kelautan
Universitas Airlangga.
6. Kedua orangtua atas doa yang selalu terlantun dan nasehat bijak yang menjadi
penguat dalam studi.
7. Kedua kakakku tercinta atas doa dan dukungan yang diberikan.
8. Nur Faizah, Latifah dan Arlisa yang telah berjuang bersama dalam penelitian.
9. Azhar, Arifah, Dyah Sunaring, Januar, Onad, Sapron dan Sofi yang banyak
membantu dalam penyelesaian Skripsi ini, serta teman-teman seperjuangan
angkatan 2010 atas dukungan dan doa yang telah kalian berikan.
10.Teman-teman BLM FPK UA 2013, Mapanza 2010 dan paduan suara fakultas
yang telah memberi dukungan selama penyusunan Skripsi.
ix
2.1 Klasifikasi dan Morfologi Udang Vaname ... 4
2.2 Organ Limfoid... 5
2.3 Kultur Sel ... 7
2.4 Media Pertumbuhan Kultur Sel ... 7
2.4.1 Minimum Esensial Medium (MEM) ... 8
2.4.2 Leibovitz (L-15) ... 9
2.5.3 Tissue Culture Medium (TCM)/ Medium 199... 9
2.5 Kultur Sel Udang ... 10
2.6 Media Kultur Sel Udang ... 11
2.7 Teknik Aseptik ... 12
2.8 Faktor Pendukung Kultur Sel ... 13
2.8.1 Suhu ... 13
2.8.2 pH ... 14
4.3.1 Rancangan Penelitian ... 19
4.4 Prosedur Kerja ... ... 20
4.4.1 Persiapan Peralatan ... 20
4.4.2 Pembuatan Media Kultur Sel ... 21
4.4.3 Pengambilan Organ Limfoid... 21
4.4.4 Kultur Sel ... 22
4.4.5 Pengamatan ... 22
4.4.6 Parameter Penelitian ... 23
4.4.7 Analisis Data ... 24
V HASIL DAN PEMBAHASAN ... 25
5.1 Hasil ... 25
5.1.1 Pertumbuhan Kultur Sel Limfoid... 25
5.1.2 Viabilitas Sel Limfoid Udang Vaname ... 30
xi
DAFTAR TABEL
Tabel Halaman
5.1 Penghitungan Jumlah Sel Limfoid pada Media Berbeda ... 28
5.2. Viabilitas Sel Limfoid pada Media Berbeda ... 30
DAFTAR GAMBAR
Gambar Halaman
2.1. Morfologi Udang Vaname ... 5
2.2. Letak Organ Limfoid Udang Penaeid ... 6
3.1. Skema Kerangka Konseptual ... 18
4.1. Diagram Alir Penelitian ... 23
5.1. Pertumbuhan Sel Limfoid pada Hari Ketiga Kultur ... 26
5.2. Pertumbuhan Sel Limfoid pada Hari Keenam Kultur ... 27
5.3. Grafik Pertumbuhan Sel Limfoid Udang Vaname ... 29
5.4. Grafik Viabilitas Sel Limfoid Udang Vaname ... 31
xiii
DAFTAR LAMPIRAN
Lampiran Halaman
1. Komposisi Media MEM, TCM dan L-15 ... 40
2. Peralatan dan Bahan Penelitian ... 42
3. Pertumbuhan Kultur Sel Limfoid pada Media Berbeda ... 44
4. Hasil Analisis Data Pertumbuhan dengan SPSS ... 46
5. Hasil Analisis Data Viabilitas dengan SPSS ... 52
I PENDAHULUAN
1.1 Latar Belakang
Udang merupakan salah satu komoditas utama dalam program
industrialisasi perikanan budidaya dan merupakan andalan ekspor produk
perikanan budidaya disamping ikan tuna, tongkol, cakalang dan rumput laut.
ASEAN Free Trade Zone (AFTA) yang akan diterapkan pada tahun 2015,
mendorong peningkatan kualitas produk dalam negeri. Salah satu komoditas
unggulan yang saat ini menjadi pilihan pembudidaya udang adalah udang vaname
(Direktorat Jenderal Perikanan Budidaya, 2013). Rata-rata pertumbuhan produksi
udang vaname di Indonesia sekitar 25 persen/tahun antara tahun 2005 hingga
2010 (Smith et al., 2012). Prosentase peningkatan produksi tahun 2012 mencapai
32,87%, dari 400.385 ton pada tahun 2011 menjadi 457.600 ton pada tahun 2012
dan pada tahun 2014, ditargetkan adanya peningkatan produksi sebesar 200 ribu
ton (Hariyanto dan Maskur, 2013).
Masalah utama yang masih sulit dikendalikan pada budidaya udang
vaname hingga saat ini adalah munculnya penyakit yang disebabkan oleh virus,
bakteri dan jamur. Penyakit yang menyerang udang vaname dapat mengakibatkan
kematian sehingga menimbukan kerugian ekonomi yang besar (Harijanto, 2012).
Penyakit yang menyerang udang pada umumnya menyerang sistem kekebalan
tubuh dimana pada udang, sistem kekebalan tubuh ini diperankan oleh organ
limfoid (Kondo et al., 1994). Pencegahan dan pengendalian penyakit ini harus
dilakukan sedini mungkin agar tidak mewabah menjadi lebih besar (Alifuddin,
2
Informasi tentang karakteristik penyakit yang diperlukan untuk
pencegahan dan pengendalian penyakit pada udang belum banyak diketahui.
Salah satu cara yang bisa dipakai untuk mengetahui karakteristik penyakit adalah
dengan menggunakan kultur sel (Nuryati, 2000). Kultur sel ini nantinya bisa
membantu untuk menentukan dan memahami hubungan antara udang dan patogen
pada tingkat seluler dan molekuler. Selain itu, juga untuk memahami fungsi
kekebalan tubuh pada udang sehingga memberikan kemudahan dalam pencegahan
dan pengendalian penyakit yang menyerang udang (Claydon, 2009).
Pembuatan kultur sel udang memerlukan media yang tepat untuk
pertumbuhan dan perkembangan sel yang dikultur. Media kultur sel terdiri dari
sejumlah besar asam amino, vitamin, mineral, glukosa dan hormon dimana setiap
media kultur mempunyai kandungan nutrisi yang berbeda (Maurer, 1992). Media
yang digunakan untuk kultur sel limfoid udang harus dapat menyediakan nutrisi
yang dapat mendukung pertumbuhan dan kelangsungan hidup sel limfoid. Jenis
media yang digunakan dalam kultur sel limfoid udang masih bermacam-macam
tergantung keinginan peneliti. Menurut Toullec (1999) media yang sering
digunakan untuk kultur sel udang adalah media MEM, media L-15 dan media
TCM. Namun, sampai saat ini belum ada referensi khusus perihal media mana
yang dapat memberikan hasil terbaik terhadap pertumbuhan sel limfoid udang
yang sedang dikultur. Berdasarkan hal tersebut, maka penelitian tentang jenis
media pertumbuhan yang paling baik dalam kultur sel limfoid udang vaname
sangat diperlukan. Dengan begitu, akan didapatkan informasi tentang media
terbaik yang dapat dijadikan referensi dalam proses pembuatan kultur sel limfoid
udang vaname.
1.2 Rumusan Masalah
Berdasarkan latar belakang tersebut, maka terdapat dua rumusan masalah
sebagai berikut :
1. Apakah terdapat perbedaan pertumbuhan kultur sel limfoid udang vaname
(L. vannamei) pada media yang berbeda?
2. Pada media manakah kultur sel limfoid udang vaname (L. vannamei) yang
menunjukkan pertumbuhan paling baik?
1.3 Tujuan Penelitian
Berdasarkan rumusan masalah tersebut, maka tujuan penelitian sebagai
berikut :
1. Untuk mengetahui perbedaan pertumbuhan kultur sel limfoid udang
vaname (L. vannamei) pada media yang berbeda.
2. Untuk mengatahui media terbaik bagi pertumbuhan kultur sel limfoid
udang vaname (L. vannamei).
1.4 Manfaat Penelitian
Memberikan informasi mengenai perbedaaan pertumbuhan dan media
terbaik bagi pertumbuhan kultur sel limfoid udang vaname (L. vannamei) pada
media yang berbeda. Lebih jauh penelitian ini nantinya bisa dijadikan referensi
II TINJAUAN PUSTAKA
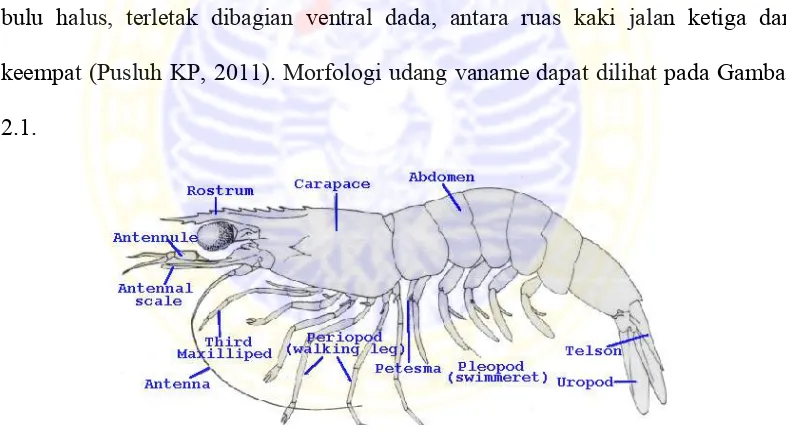
2.1 Klasifikasi dan Morfologi Udang Vaname
Wyban and Sweeney (1991) menyatakan bahwa udang vaname
Suborder : Dendrobranchiata Superfamily : Penaeoidea
Family : Penaeidae Genus : Penaeus Subgenus : Litopenaeus Species : L. vannamei
Udang vaname merupakan salah satu jenis udang penaeid yang tubuhnya
terdiri dari 19 segmen. Lima segmen membentuk kepala, delapan segmen terletak
di dada dan enam segmen di perut. Kepala dan dada yang menyatu disebut
cephalothorax, atau dikenal sebagai pereon. Pada ruas kepala terdapat mata
majemuk yang bertangkai dan memiliki dua buah antena (antena dan antennulae)
yang memeiliki fungsi sensorik (Ruppert dan Barnes, 1994; Budd, 2002) yang
dikutip oleh Corteel (2013). Pada bagian kepala terdapat mandibula yang
berfungsi untuk menghancurkan makanan yang keras dan dua pasang maxilla
yang berfungsi membawa makanan ke mandibula (Pusluh KP, 2011).
Masing-masing ruas pada bagian dada mempunyai sepasang anggota
badan disebut thoracopoda. Thoracopoda 1-3 disebut maxiliped yang berfungsi
dalam memegang makanan. Thoracopoda 4-8 berfungsi sebagai kaki jalan
(periopod). Periopod 1-3 mempunyai capit kecil yang merupakan ciri khas udang
penaeidae. Ruas 1-5 pada bagian abdomen memiliki sepasang kaki renang disebut
pleopod. Pada ruas keenam terdapat uropod dan telson yang berfungsi sebagai
kemudi (Pusluh KP, 2011).
Ciri khas dari udang vaname adalah pada rostrum terdapat dua gigi di sisi
ventral, dan sembilan gigi di sisi dorsal. Badan udang vaname tidak terdapat
rambut-rambut halus (setae). Pada jantan, petasma memiliki panjang 12 mm yang
tumbuh dari ruas pertama dari kaki jalan dan kaki renang (coxae). Pada betina
thelycum terbuka berupa cekungan yang ditepinya banyak ditumbuhi oleh
bulu-bulu halus, terletak dibagian ventral dada, antara ruas kaki jalan ketiga dan
keempat(Pusluh KP, 2011). Morfologi udang vaname dapat dilihat pada Gambar
2.1.
Gambar 2.1. Morfologi Udang Vaname (Bailey- Brock and Moss, 1992 yang dikutip olehGiang, 2012).
2.2 Organ Limfoid
Organ limfoid pertama kali diperkenalkan oleh Masao Oka pada tahun
1969, yang terdapat pada Penaeus orientalis sehingga organ limfoid juga sering
6
(2002) menjelaskan bahwa organ oka ini terdiri dari dua lobus, terletak di
dorso-anterior hepatopankreas dan ventro-lateral lambung dorso-anterior dan posterior.
Menurut Lu et al., (1995) organ limfoid memiliki letak yang unik dan relatif
kecil, sehingga tidak mudah untuk identifikasi dan pemotongan organ, apalagi
ketika udang yang digunakan ukurannya kurang dari 10 gram. Nuryati (2000)
mengatakan bahwa organ limfoid terletak di bagian depan hepatopankreas. Organ
ini terdiri atas dua lobus yang menyatu membentuk bulatan dengan diamater
kira-kira 3 mm berwarna putih.
Berdasarkan observasi yang dilakukan ditemukan adanya pembuluh aferen
dan eferen pada organ limfoid. Pembuluh aferen dihubungkan oleh arteri antena
yang membagi dua dan menjadi pusat dari tubula. Organ limfoid pada krustasea
memainkan peran penting dalam respon imun. Organ ini diketahui sebagai pusat
akumulasi benda-benda asing yang masuk ke tubuh udang termasuk patogen
(Oka, 1969).
Gambar 2.2. Letak Organ Limfoid Udang Penaeid (Giang, 2012)
2.3 Kultur Sel
Kultur sel adalah kultur sel-sel yang berasal dari organ atau jaringan yang
telah diuraikan secara mekanis atau enzimatis menjadi suspensi sel. Suspensi sel
ini selanjutnya dibiakkan secara in vitro di atas permukaan yang keras misalnya
botol, tabung atau cawan atau menjadi suspensi sel dalam media penumbuh
(Malole, 1990). Kultur primer mengacu pada tahap kultur setelah sel-sel yang
terisolasi dari jaringan kemudian dikembangbiakkan di bawah kondisi yang tepat
dan terkontrol sampai menempati semua substrat yang tersedia (yaitu, mencapai
konfluen). Pada tahap ini, sel-sel harus disubkultur dengan memindahkannya ke
dalam substat dan medium pertumbuhan yang baru sehingga memberikan lebih
banyak ruang untuk pertumbuhan selanjutnya (Gibco, 2011).
Sel yang telah dikultur biasanya tanpa struktur dan kehilangan bentuk
histotypic serta sifat biokimianya. Umumnya kultur sel tidak mencapai keadaan
stabil kecuali dalam kondisi tertentu. Kultur sel bisa diperbanyak dan terbagi
menjadi replikasi yang identik. Kultur sel dapat diawetkan dengan pembekuan
dan dapat dimurnikan dengan cara menumbuhkannya pada media selektif.
Pemisahan sel secara fisik atau kloning dilakukan untuk memberikan informasi
tentang karakteristik sel (Freshney, 1992).
2.4 Media Pertumbuhan Kultur Sel
Media kultur sel merupakan campuran dari karbohidrat, vitamin, asam
amino, hormon, mineral dan beberapa unsur yang lain. Formulasi nutrisi ini
bervariasi tergantung sel yang akan dikultur. Karbohidrat diberikan terutama
8
untuk mengurangi terbentuknya asam laktat karena metabolisme galaktosa
lambat. Sumber karbon yang lain misalnya asam amino (terutama L-glutamin)
dan piruvat (ATCC, 2012).
Media dapat membantu mempertahankan pH dan osmolaritas pada saat
kultur disamping penyedia nutrisi. pH dipertahankan dengan satu atau lebih buffer
misalnya CO2/ sodium bikarbonat, fosfat dan hydroxyetil piperazine ethane
sulfonic acid (HEPES). Serum biasanya juga digunakan sebagi buffer. Phenol red
sebagai indikator pH biasa ditambahkan dalam media untuk mengamati
perubahan pH dari warna media yang digunakan (ATCC, 2012). Berdasarkan
kandungan asam amino dan komponen lainnya media ini terdiri dari beberapa
jenis misalnya Eagle’s MEM, Ham’s F-12, CMRL 1066, RPMI 1640, medium
199/TCM, Leibovitz’s L-15 dan sebagainya (Maurer, 1992).
2.4.1 Minimum Esensial Medium (MEM)
MEM merupakan modifikasi dari Basal Medium Eagle (BME). Media ini
dikembangkan oleh Harry Eagle untuk memenuhi kebutuhan gizi spesifik subtipe
tertentu dari sel HeLa dan fibroblas mamalia normal. Konsentrasi asam amino
MEM yang tinggi sangat mendekati komposisi protein sel mamalia. MEM dapat
digunakan baik dengan garam Earle atau garam Hank dan bisa juga ditambah
suplemen dengan asam amino non-esensial. Media ini dapat lebih dimodifikasi
dengan menghilangkan kalsium untuk memfasilitasi pertumbuhan sel-sel pada
kultur suspensi (Himelab, 2011). Kandungan nutrisi yang ada di dalam media
MEM dapat dilihat pada Lampiran. 1.
2.4.2 Leibovitz (L-15)
Media Leibovitz secara khusus dirancang untuk menumbuhkan sel dalam
suasana bebas CO2. Sistem buffer sodium bikarbonat/CO2 diganti dengan
kombinasi dari asam amino dasar, buffer fosfat dan kadar galaktosa yang tinggi
dan sodium piruvat. Akibatnya, media tidak memerlukan suplementasi dengan
sodium bikarbonat dan dapat digunakan dalam kondisi bebas bertukar gas. Media
dapat digunakan untuk menumbuhkan sel-sel tumor manusia dan embrio sel dan
juga bisa digunakan untuk kultur sel yang stabil seperti HeLa dan Hep-2. Media
ini sering digunakan dalam diagnostik virologi di mana tissue cell lines atau strain
ditumbuhkan dalam sistem tertutup (Himelab, 2011). Kultur sel dapat tumbuh
pada inkubator CO2 asalkan tidak ada pertukaran udara antara media kultur dan
inkubator (ATCC, 2012). Kandungan nutrisi yang ada di dalam Leibovitz-15
dapat dilihat pada Lampiran. 1.
2.4.3 Tissue Culture Medium (TCM) / Medium 199
Medium 199 adalah media pertama yang dikembangkan oleh Morgan,
Morton, dan Parker pada tahun 1950. Media kompleks ini diformulasikan khusus
untuk penelitian nutrisi pada fibroblast primer embrio ayam tanpa adanya aditif.
Terlihat bahwa ekplantasi jaringan bisa bertahan pada Medium 199 tanpa serum
tapi untuk kultivasi sel dalam jangka panjang diperlukan suplementasi media
dengan serum. Medium 199 diformulasikan baik dengan garam Hank atau garam
Earle. Media yang disuplementasi dengan serum dapat digunakan untuk
pertumbuhan berbagai sel. Medium 199 saat ini digunakan untuk pemeliharaan
10
Kandungan nutrisi yang ada di dalam TCM/Medium 199 dapat dilihat pada
Lampiran. 1.
2.5 Kultur Sel Udang
Kultur sel krustasea khususnya udang penaeid pertama kali
didokumentasikan oleh Quiot et al pada tahun 1968. Pada penelitiannya, para
peneliti memperoleh sebagian besar fibroblas dari embrio dan ovari crayfih
(Astacus pallipes). Kultur monolayer tersebut dapat menjaga aktivitas mitotik sel
selama empat bulan dengan pergantian medium setiap lima hari sekali. Pada tahun
yang sama Quiot et al juga melaporkan kelangsungan hidup dan replikasi kultur
sel jantung dan perut dari kepiting laut Pachygrabsus marmoratus (Luedeman,
1990). Pada tahun 1986 Chen et al pertama kalinya melakukan kultur sel primer
dari grass prawn (P. monodon). Jaringan yang dikultur adalah hati, gonad, perut,
saraf, kulit dan hepatopankreas. Jaringan tersebut diambil dari udang muda
dengan berat 20 gr. Selanjutnya pada tahun 1989, Chen and Kou melakukan
penelitian tentang infeksi Monodon Baculovirus (MBV) pada kultur sel primer
dari organ limfoid P. monodon.
Spesies udang yang sering digunakan dalam kultur sel adalah P. monodon
karena penyebarannya yang luas dan termasuk komoditas akuakultur yang
memiliki nilai ekonomis tinggi. P. japonicus tercacat digunakan sebanyak delapan
kali penelitian kultur sel, P. stylirostris enam kali dan P. vannamei lima kali. Jenis
penaeid yang lain yang telah digunakan dalam kultur sel tercacat hanya satu atau
dua kali saja. Hanya empat jenis spesies krustasea lain selain udang yang telah
diteliti untuk kultur sel yakni kepiting pasir (Emireta asiatica), kepiting renang
(Liocarcinus depurator), North American lobster (Homarus americanus) dan
crayfish (Orconectus limosus) (Claydon, 2009).
Kultur sel udang dapat berfungsi untuk mengetahui efek patogen secara in
vitro dan untuk menambah pengetahuan dalam pengembangan dan proses
maturasi seksual atau regulasi endokrin pada krustasea (Toullec, 1999). Satu dari
tujuan utama dalam pengembangan kultur sel udang adalah diagnosis penyakit.
Oleh karena itu, cell line harus memiliki potensi yang mendukung pertumbuhan
penyakit secara in vitro. Organ limfoid merupakan target untuk banyak agen
infeksius, sehingga sel dari organ limfoid sesuai untuk mempelajari mekanisme
patogen yang menginfeksi udang. Inilah alasan mengapa organ limfoid paling
banyak digunakan dalam penelitian kultur sel udang (Claydon, 2009). Ovary
tissue juga banyak digunakan karena lokasinya yang mudah dan sangat
menjanjikan untuk pembentukan cell line karena selnya aktif membelah secara
mitosis(Luedeman and Lightner, 1992). Jaringan lain yang telah digunakan dalam
kultur sel krustasea adalah hepatopankreas, hati, embrio, haemosit,
haematopoietik, insang, saraf, mata, epitel, testis dan usus (Claydon, 2009).
2.6 Media Kultur Sel Udang
Banyak penelitian yang mencoba variasi formulasi media kultur
(kombinasi dari media basal dan suplemen) untuk kemampuan mereka dalam
mendukung replikasi atau pemeliharaan sel krustasea yang dikultur. Setidaknya
ada 25 media yang telah digunakan dalam kultur sel udang (Claydon, 2009).
Media yang sering digunakan dalam kultur sel udang adalah M199, L-15 dan
12
Tercatat beberapa peneliti kultur sel udang menggunakan media M199
(Maeda et al. 2003; Crane and William, 2002; Lang et al. 2002; Shimizu et al.
2001; Itami et al. 1999; Hu, 1990 dan Brody and Chang, 1989), media L-15
(Chen and Kou, 1989; Fuerst et al. 1991; Najafabadi et al. 1992; Tapay et al.
1995; Lu et al. 1995; Kasornchandra et al. 1999; Mulford et al. 2001; dan Uma et
al. 2002) dan media MEM (Neumann et al. 2000; Chen and Wang, 1999; Walton
and Smith, 1999; Puroshothaman et al. 1998; Frerichs, 1996; Rosenthal and
Diamant, 1990; dan Itami et al. 1989). Media lain yang pernah digunakan dalam
kultur sel udang adalah Grace’s medium, RPMI-1640, CMRL-1066, McCoy’s
5A medium, DMEM dan Ham F-12 (Claydon, 2009).
2.7 Teknik Aseptik
Metode aseptis pada kultur jaringan adalah upaya untuk memberikan batas
antara mikroorganisme yang banyak terdapat dalam lingkungan bebas dan
lingkungan kultur yang tidak terkontaminasi di dalam dish atau flask. Oleh karena
itu semua alat dan bahan yang akan berkontak langsung dengan lingkungan kultur
harus dalam kondisi steril (Boediono, 2002).
Pengerjaan kultur sel dalam Laminar Air Flow (LAF) adalah upaya untuk
memperkecil kemungkinan terjadinya kontaminasi selama penanganan sediaan
kultur. LAF yang digunakan dalam penelitian adalah LAF dengan tipe horizontal,
dimana aliran udara berasal dari arah depan mengalir paralel dengan permukaan
area kerja. Pada tipe ini aliran udara lebih stabil dan merupakan tipe yang ideal
untuk mencegah kontaminasi sediaan kultur jaringan (Boediono, 2002).
Kontaminasi merupakan permasalahan umum dan biasa ditemukan pada
kultur sel. Kontaminan ini terbagi atas dua jenis yaitu kontaminasi kimia dan
kontaminasi biologi. Kontaminasi kimia seperti yang disebabkan oleh serum,
kemurnian media, air, endotoksin, bahan plastik dan deterjen. Kontaminasi
biologi biasanya disebabkan oleh bakteri, jamur, ragi, virus, mycoplasma dan
kontaminasi silang oleh sel lain (Gibco, 2011).
Bakteri, ragi, jamur, lumut dan mycoplasma adalah jenis kontaminasi yang
sering terjadi melalui peneliti pelaksana, udara, area kerja, media dan sumber lain
yang memungkinkan kontak langsung dengan sistem kultur jaringan. Kontaminasi
bisa terjadi secara minor dan terbatas pada satu atau dua dish, namun bisa juga
menyebar pada sediaan yang lain bahkan bisa mengontaminasi seluruh pekerjaan
kultur jaringan dalam satu laboratorium (Boediono, 2002).
2.8 Faktor Pendukung dalam Kultur Sel 2.8.1 Suhu
Suhu optimal untuk kultur sel sangat tergantung pada suhu tubuh hewan
dari mana sel-sel tersebut diisolasi, dan untuk tingkat yang lebih rendah pada
variasi anatomi suhu (misalnya, suhu kulit mungkin lebih rendah dari suhu otot
rangka). Overheating adalah masalah yang lebih serius daripada underheating
untuk kultur sel, sehingga seringkali suhu di inkubator diatur sedikit lebih rendah
dari suhu optimal (Gibco, 2011). Temperatur yang direkomendasikan untuk
sebagian besar kultur sel mamalia adalah 370C, mendekati panas tubuhnya, tetapi
14
2.8.2 pH
Stabilitas pH pada media sangat penting untuk pertumbuhan dan
metabolisme sel. Sebagian besar kultur sel tumbuh dengan baik pada pH 7,4.
Meskipun pH optimum untuk pertumbuhan sel relatif bervariasi antara strain sel
yang berbeda. Beberapa sel fibroblas tumbuh baik pada pH 7,4-7,7, dan beberapa
sel fibroblas yang lain tumbuh lebih baik pada pH 7,0-7,4 (Gibco, 2011). Sel-sel
epidermis dapat tumbuh pada pH 5,5 tetapi tingkat ini belum diadopsi secara
universal (Eisinger et al., 1979 dalam Freshney, 2005).
Freshney (2005) menjelaskan bahwa phenol red umumnya digunakan
sebagai indikator pH. Media yang berwarna merah menunjukkan bahwa media
tersebut berada pada kisaran pH 7,4 dan warna orange pada pH 7,0, kuning pada
pH 6,5, lemon kuning di bawah pH 6,5, lebih merah muda pada pH 7,6 dan ungu
pada pH 7,8.
2.8.3 CO2
Sistem karbondiokasida-bikarbonat adalah sistem buffer yang biasa
terdapat dalam media. CO2 perlu ditambahkan pada ruangan di atas medium untuk
mencegah keluarnya CO2 yang dapat meningkatkan ion hidroksida sehingga
menyebabkan menurunnya pH media (Malole, 1990). CO2 yang biasa digunakan
dalam penelitian adalah 4-10% dan yang paling sering digunakan adalah 5-7%
CO2 (Gibco, 2011).
2.8.4 Metode Pemisahan Sel
Kultur sel primer dapat diperoleh dari pemisahan jaringan menjadi sel.
Pemisahan jaringan menjadi sel ini dapat dilakukan secara mekanis ataupun
enzimatis. Pemisahan secara mekanis dapat menggunakan magnetic stirrer atau
dengan diaspirasi menggunakan pipet atau syringe. Pemisahan secara enzimatis
menggunakan enzim tripsin, pronase, kolagenase atau enzim campuran seperti
kolagenase/dispase. Penggunaan enzim ini tidak aman untuk semua jaringan
karena bila enzim berlebihan atau tidak cocok malah akan merusak jaringan
III KERANGKA KONSEPTUAL DAN HIPOTESIS
3.1 Kerangka Konseptual
Perkembangan produksi udang Indonesia setiap tahun selalu menunjukkan
peningkatan, namun dalam proses budidayanya sering mengalami masalah.
Masalah utama yang masih sulit dikendalikan pada budidaya udang vaname
adalah munculnya penyakit. Penyakit yang menyerang udang pada umumnya
menyerang sistem kekebalan tubuh dimana pada udang sistem kekebalan tubuh ini
diperankan oleh organ limfoid (Kondo et al., 1994). Informasi tentang
karakteristik penyakit yang diperlukan untuk pencegahan dan pengendalian pada
udang belum banyak diketahui sehingga perlu adanya penyediaan biakan sel
udang (Nuryati, 2000).
Kultur sel limfoid udang merupakan cara yang bisa digunakan untuk
mengetahui karakteristik penyakit karena organ limfoid merupakan target dari
banyak agen infeksius, sehingga sel dari organ limfoid sesuai untuk mempelajari
mekanisme patogen yang menginfeksi udang (Claydon, 2009).Faktor lingkungan
yang berpengaruh terhadap keberhasilan kultur sel diantaranya adalah CO2, pH,
suhu dan media pertumbuhan. Dari faktor-faktor tersebut, media pertumbuhan
merupakan faktor yang berpengaruh langsung terhadap pertumbuhan sel.
Media kultur merupakan komponen terpenting pada kultur sel karena
media menyediakan kebutuhan nutrisi, faktor pertumbuhan dan hormon bagi
pertumbuhan sel, maupun regulasi pH dan tekanan osmotik pada kultur sel
(Gibco, 2011). Media pertumbuhan kultur sel ini terdiri dari berbagai macam
media. Berdasarkan kandungan nutrisinya, media yang sering digunakan dalam
kultur sel udang adalah M199, L-15 dan MEM (Toullec, 1999).
Adanya perbedaan nutrisi asam amino dan buffer yang terkandung dalam
setiap media akan menunjukkan media terbaik bagi pertumbuhan kultur sel
limfoid udang vaname. Media terbaik yang digunakan, akan menyebabkan sel
menjadi cepat tumbuh stabil dan konfluen. Kultur sel yang diperoleh diharapkan
dapat digunakan sebagai media dalam penelitian penyakit yang biasa menyerang
budidaya udang vaname di Indonesia. Adanya penelitian lanjutan akan diperoleh
informasi mengenai karakteristik penyakit. Informasi tersebut nantinya bisa
dijadikan referensi untuk pengembangan pengendalian penyakit udang sehingga
pada akhirnya masalah penyakit pada budidaya udang vaname dapat teratasi.
Skema konseptual dapat dilihat pada Gambar. 3.1.
3.2 Hipotesis
1. Terdapat perbedaan pertumbuhan kultur sel limfoid udang vaname (L.
vannamei) pada media yang berbeda.
2. Terdapat media terbaik bagi pertumbuhan kultur sel limfoid udang vaname
18
Gambar. 3.1. Skema Kerangka Konseptual Keterangan:
: Aspek yang diteliti : Aspek yang tidak diteliti
Udang vaname
Sel limfoid Penyakit
Kultur sel
Leibovitz L-15 Media kultur sel
MEM
CO2 pH Suhu
TCM
Asam amino dan buffer yang sesuai dengan kebutuhan sel limfoid
Kultur sel limfoid tumbuh cepat Lingkungan
Stabil Konfluen
IV METODOLOGI PENELITIAN
4.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium In Vitro, Fakultas Kedokteran
Hewan, Universitas Airlangga pada bulan Februari 2014.
4.2 Materi Penelitian 4.2.1 Bahan Penelitian
Bahan yang digunakan untuk penelitian ini adalah udang vaname berumur
2 bulan dengan panjang tubuh ± 8 cm, media MEM, media L-15, media TCM,
penicilin-streptomycin, amphoterycin B, Fetal Calf Serum (FCS), NaHCO3,
aquabidest, tripsin, phenol red, trypanblue dan larutan fiksatif.
4.2.2 Alat Penelitian
Peralatan penelitian yang digunakan adalah Petri dish, substrat, botol 250
ml, pinset, gunting, gelas ukur, centrifuge, mikroskop inverted, pipet Pasteur,
syringe injeksi, mikrofilter, timbangan, tally counter, penggaris, Laminar Air
Flow (LAF), inkubator CO2, autoclave dan lemari es.
4.3 Metode Penelitian
4.3.1 Rancangan Penelitian
Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap
(RAL) dengan asumsi media dan bahan percobaan sama dari pengambilan sampel
sampai dengan pengerjaan serta kondisi laboratorium. Perlakuan yang digunakan
20
Perlakuan A : menggunakan media kultur MEM
Perlakuan B : mengunakan media kultur L-15
Perlakuan C : menggunakan media kultur TCM
Variabel penelitian ini adalah:
Variabel bebas : media kultur MEM, L-15 dan TCM
Variabel tergantung : jumlah sel limfoid udang vaname dan viabilitas
Variabel kendali : inkubator anaerob, alat dan bahan yang digunakan
penelitian.
4.4 Prosedur Kerja 4.4.1 Persiapan Peralatan
Alat-alat yang akan digunakan disterilkan terlebih dahulu untuk mencegah
adanya kontaminasi. Sterilisasi peralatan yang tahan terhadap panas seperti pipet,
Petri dish, botol, gunting, pinset dan gelas ukur dapat dilakukan dengan metode
panas basah yaitu memanaskan alat ke dalam autoclave pada suhu 121°C selama
15 menit.
Sterilisasi untuk media kultur dilakukan secara mekanik yaitu dengan
metode filtrasi. Penyaringan dilakukan dengan menggunakan mikrofilter dengan
bantuan syringe injeksi. Sterilisasi area kerja dilakukan dengan menyemprot meja
menggunakan alkohol 70%, kemudian dilap. Selama proses pengerjaan, teknik
aseptis harus selalu diterapkan yakni dengan mencuci tangan dengan sabun
kemudian menyemprot alkohol 70% ke tangan sebelum dan sesudah melakukan
kegiatan.
4.4.2 Pembuatan Media Kultur Sel
Media merupakan salah satu hal terpenting dalam pertumbuhan kultur sel.
Media yang digunakan dalam penelitian kultur sel limfoid udang vaname adalah
MEM, L-15 dan TCM. Masing-masing media tersebut mempunyai kandungan
asam amino, vitamin dan garam mineral yang berbeda-beda. Cara membuat media
kultur sel yakni dengan mencampurkan media dalam 100 ml aquabidest, 0,1 µl
penicillin - streptomycin, 0,1 µl amphoterycin B, 0,2 gr NaHCO3 dan 3 ml FCS.
Semua bahan tersebut dimasukkan ke dalam botol 250 ml kemudian dikocok
hingga seluruh bahan tercampur. Setelah media tercampur selanjutnya disterilkan
dengan mikrofilter ukuran 0,22 µm.
4.4.3 Pengambilan Organ Limfoid
Udang vaname yang akan diambil organ limfoidnya disemprot dengan
alkohol 70% merata ke seluruh tubuh udang. Pisau maupun gunting yang
digunakan untuk membedah udang juga disemprot dengan alkohol 70%.
Pengambilan organ dilakukan dengan cara membuka bagian ventral udang
menggunakan gunting secara hati-hati sampai organ dalam udang terlihat. Organ
limfoid kemudian digunting dan dipisahkan dari organ lainnya. Pengambilan
organ limfoid harus dilakukan secepat mungkin untuk menghindari lamanya
kontak dengan udara bebas.
Organ limfoid yang terambil diletakkan pada cawan Petri steril dan diberi
media sebanyak 0,5 ml. Organ dipotong kecil-kecil selanjutnya dimasukkan ke
dalam tabung sentrifuge yang telah terisi 2 ml media dan disentrifuge selama 10
22
yang terbentuk ditambah dengan media 2 ml kemudian disentrifuge untuk kedua
kalinya.
4.4.4 Kultur Sel
Organ limfoid yang mengendap di dalam tabung sentrifuge ditambah
dengan 1 ml media kemudian dimasukkan ke dalam substrat dan ditambah media
sebanyak 2 ml. Substrat yang digunakan diberi label sesuai dengan nama
masing-masing media (MEM, L-15 dan TCM). Substrat yang telah terisi diinkubasi dalam
inkubator pada suhu 28°C dengan kadar CO2 5%.
4.4.5 Pengamatan
Pengamatan terhadap kultur sel limfoid udang vaname dilakukan setiap
tiga hari sekali menggunakan mikroskop inverted dengan perbesaran 400 kali.
Penghitungan sel dilakukan setiap enam hari sekali dengan menggunakan
haemocytometer. Pengamatan dan penghitungan sel dilakukan dalam LAF untuk
mengurangi risiko kontaminasi. Sel yang teramati di foto dan hasil penghitungan
yang didapat kemudian dibuat data. Menurut Phelan (1998), jumlah sel yang
tumbuh dapat dihitung dengan menggunakan rumus:
Penghitungan viabilitas sel dilakukan pada hari terakhir kultur. Viabilitas
sel dapat diketahui dengan cara menambahkan trypan blue sebanyak ± 0,5 ml ke
dalam substrat. Sel yang hidup bewarna bening dan yang mati bewarna biru. Hal
tersebut dikarenakan sel yang hidup tidak bisa menyerap trypan blue (Ott, 2004).
Viabilitas sel dihitung dengan menggunakan rumus (Butler, 2004). Sel/ml = jumlah sel x pengencer x 104
% sel yang hidup = Jumlah sel yang hidup + jumlah sel yang mati Jumlah sel yang hidup x 100 %
4.4.6 Parameter Penelitian
Pada penelitian ini parameter utama yang diamati adalah pertumbuhan sel
pada media kultur (sel mampu memperbanyak diri) serta viabilitas yang tinggi.
Parameter penunjang adalah ada tidaknya kontaminasi pada kultur sel. Bagan alir
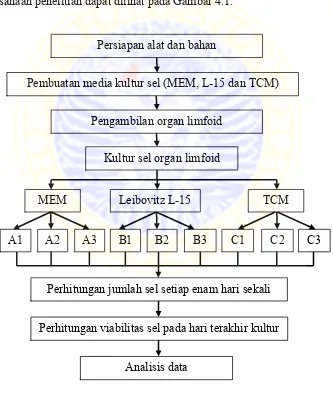
pelaksanaan penelitian dapat dilihat pada Gambar 4.1.
Gambar 4.1. Diagram Alir Penelitian Persiapan alat dan bahan
Pembuatan media kultur sel (MEM, L-15 dan TCM)
Pengambilan organ limfoid
Kultur sel organ limfoid
TCM
MEM Leibovitz L-15
Perhitungan jumlah sel setiap enam hari sekali
Analisis data
A1 A2 A3 B1 B2 B3 C1 C2 C3
24
4.4.7 Analisis Data
Data hasil penelitian disajikan dalam bentuk tabel dan gambar serta
dianalisis menggunakan ANAVA. Apabila hasil yang didapat menunjukkan
adanya perbedaan maka dilanjutkan dengan uji jarak berganda Duncan untuk
mengetahui perbedaan antara perlakuan yang satu dengan perlakuan yang lainnya
(Kusriningrum, 2012).
V HASIL DAN PEMBAHASAN
5.1Hasil
5.1.1 Pertumbuhan Kultur Sel Limfoid
Pertumbuhan sel limfoid udang vaname diamati di bawah mikroskop
inverted dengan perbesaran 400 X setiap tiga hari sekali. Hal ini bertujuan agar sel
dapat tumbuh baik dan menempel pada dasar plate. Hasil penelitian kultur sel
limfoid udang vaname pada media MEM, L-15 dan TCM menunjukkan
pertumbuhan yang berbeda pada setiap media.
Berdasarkan hasil pengamatan yang telah dilakukan, sel limfoid yang
tumbuh berbentuk bulat kecil dan tersebar di seluruh bagian plate. Pada semua
media yang diujikan, kultur sel limfoid udang vaname tumbuh di sekitar eksplan.
Hal ini menunjukkan bahwa ketiga media mampu menyediakan nutrisi yang
dibutuhkan sel limfoid untuk berproliferasi. Hasil pengamatan pertumbuhan sel
26
(a) (b)
(c)
Gambar 5.1. Pertumbuhan Sel Limfoid pada Hari Ketiga Kultur Keterangan : bagian yang ditunjuk anak panah adalah sel limfoid yang tumbuh
pada (a) Media MEM, (b) Media L-15, (c) Media TCM
Pada pengamatan selanjutnya yakni hari keenam dari penanaman sel,
kultur dalam media MEM, L-15 maupun TCM menunjukkan sel limfoid tumbuh
lebih padat dibandingkan saat pengamatan hari ketiga. Sel limfoid terlihat lebih
rapat dan jarak antar sel yang tumbuh menjadi semakin sempit. Beberapa sel yang
lain juga terlihat bertumpukan sehingga ketika diamati, sel menjadi tidak jelas
akibat tumpukan antar sel. Sel yang tumbuh padat (konfluen) kemudian dihitung
jumlah selnya dan selanjutnya dilakukan subkultur. Pengamatan mikroskopik
pertumbuhan sel limfoid udang vaname pada hari keenam dapat dilihat pada
Gambar 5.2.
(a) (b)
(c)
Gambar 5.2. Pertumbuhan Sel Limfoid pada Hari Keenam Kultur (a) Media MEM, (b) Media L-15, (c) Media TCM
Pada penelitian ini dilakukan subkultur sebanyak 3 kali setiap enam hari
sekali. Subkultur dilakukan untuk mempertahankan pertumbuhan sel dalam
kultur. Pada hari keenam kultur terlihat perubahan warna dari yang mulanya
berwarna merah menjadi oranye. Hal ini menunjukkan bahwa pH media menurun
dan kemungkinan nutrisi yang tedapat dalam media telah berkurang. Media juga
28
telah tumbuh padat sehingga apabila tidak dilakukan penggantian media atau
subkultur maka sel akan mati.
Pertumbuhan kultur sel secara in vitro dapat diketahui dengan cara
menghitung jumlah sel dibawah mikroskop pada interval waktu tertentu.
Penghitungan sel dilakukan dengan menggunakan haemocytometer dan hasil yang
didapat dimasukkan ke dalam rumus penghitungan. Penghitungan jumlah sel yang
tumbuh dilakukan ketika sel telah mencapai kondisi konfluen. Pada penelitian ini,
penghitungan dilakukan setiap enam hari sekali sebelum melakukan subkultur.
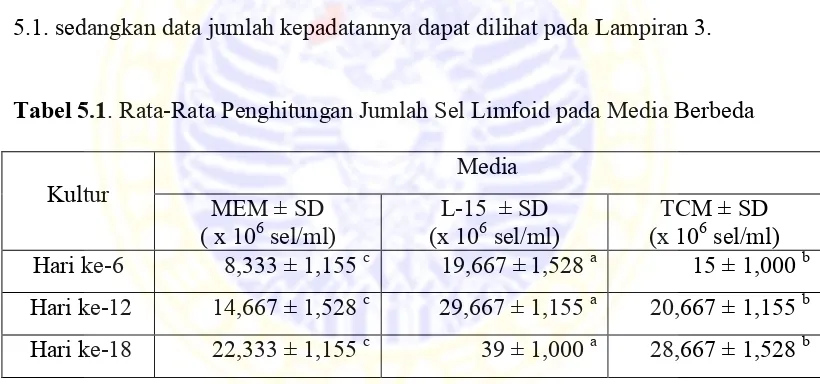
Hasil penghitungan jumlah sel limfoid pada ketiga media dapat dilihat pada Tabel.
5.1. sedangkan data jumlah kepadatannya dapat dilihat pada Lampiran 3.
Tabel 5.1.Rata-RataPenghitungan Jumlah Sel Limfoid pada Media Berbeda
Kultur MEM ± SD Media
( x 106 sel/ml) (x 10L-15 ± SD 6 sel/ml) (x 10TCM ± SD 6 sel/ml) Hari ke-6 8,333 ± 1,155 c 19,667 ±1,528 a 15 ± 1,000 b Hari ke-12 14,667 ± 1,528 c 29,667 ± 1,155 a 20,667 ± 1,155 b Hari ke-18 22,333 ± 1,155 c 39 ± 1,000 a 28,667 ± 1,528 b
Keterangan: perbedaan notasi pada kolom yang berbeda menunjukkan bahwa setiap perlakuan memberikan pengaruh yang berbeda signifikan (p<0,05)
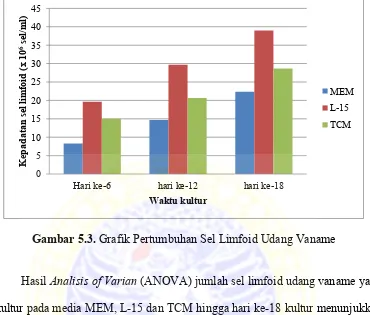
Grafik pertumbuhan sel limfoid udang vaname pada media MEM, L-15
dan TCM disajikan pada Gambar 5.3.
Gambar 5.3. Grafik Pertumbuhan Sel Limfoid Udang Vaname
Hasil Analisis of Varian (ANOVA) jumlah sel limfoid udang vaname yang
dikultur pada media MEM, L-15 dan TCM hingga hari ke-18 kultur menunjukkan
bahwa perlakuan media memberikan pengaruh yang berbeda nyata (p<0,05)
terhadap jumlah sel limfoid udang vaname. Hasil analisis data dapat dilihat pada
Lampiran 4. Uji statistika dilanjutkan dengan menggunakan Uji Jarak Berganda
Duncan. Hasil Uji Jarak Berganda Duncan pada hari ke-6, ke-12 dan ke-18 kultur
disimpulkan bahwa perlakuan B (media L-15) memberikan hasil kultur sel limfoid
udang vaname tertinggi yang berbeda nyata dengan perlakuan C (media TCM)
dan perlakuan A (media MEM). Sedangkan hasil kultur sel limfoid udang vaname
terendah diperoleh pada perlakuan A. Antara perlakuan A dan perlakuan C juga
30
5.1.2 Viabilitas Sel Limfoid Udang Vaname
Viabilitas sel limfoid udang vaname dihitung pada hari terakhir
pemeliharaan sel yakni pada hari ke-18. Viabilitas menggambarkan kemampuan
daya hidup dari sel yang dikultur. Penentuan viabilitas sel menggunakan
pewarnaan dengan trypan blue dan penghitungannya dilakukan dengan bantuan
handlycounter. Semua sel yang terlihat dalam satu lapang pandang dihitung baik
sel yang berwarna bening maupun sel yang berwarna biru. Sel yang bening
menunjukkan bahwa sel masih bertahan hidup sedangkan sel yang berwarna biru
menunjukkan bahwa sel tersebut telah mati. Hasil penghitungan sel yang hidup
dan mati kemudian dimasukkan dalam rumus viabilitas. Hasil prosentase
viabilitas sel pada ketiga media disajikan dalam Tabel. 5.2.
Tabel. 5.2 Viabilitas Sel Limfoid pada Media Berbeda
Ulangan MEM (%) Perlakuan L-15 (%) TCM (%)
1 98 97 97
2 97 98 98
3 98 99 97
Rata-rata ± SD 97,667 ± 0,577a 98 ± 1,000a 97,333 ± 0,577a
Keterangan: notasi yang sama pada kolom yang berbeda menunjukkan bahwa setiap perlakuan tidak memberikan pengaruh yang signifikan (p>0,05)
Hasil Analisis of Varian (ANOVA) viabilitas sel limfoid udang vaname
yang dikultur pada media MEM, L-15 dan TCM menunjukkan bahwa perlakuan
media tidak memberikan pengaruh yang nyata (p>0,05) terhadap viabilitas sel
limfoid udang vaname. Hasil analisis data dapat dilihat pada Lampiran 5. Grafik
viabilitas sel limfoid udang vaname pada media MEM, L-15 dan TCM disajikan
pada Gambar 5.4.
Gambar 5.4. Grafik Viabilitas Sel Limfoid Udang Vaname
Pada penelitian ini, berdasarkan hasil penghitungan viabilitas sel limfoid
pada media MEM, L-15 dan TCM menunjukkan hasil yang baik karena nilai
viabilitas pada ketiga media lebih dari 95 %. Hal ini ditunjukkan dengan warna sel
berwarna bening yang lebih dominan setelah diberi trypan blue (Gambar. 5.5).
Gambar. 5.5. Viabilitas Sel Limfoid
Keterangan: : sel yang hidup : sel yang mati
96,8 97 97,2 97,4 97,6 97,8 98 98,2
MEM L-15 TCM
32
5.2Pembahasan
Kultur sel merupakan istilah yang digunakan dalam pemeliharaan atau
pengembangan sel secara in vitro mencakup kultur sel tunggal. Pada kultur sel, sel
yang tumbuh tidak panjang seperti sel pada jaringan (ATCC, 2012). Sel yang
ditumbuhkan di dalam media kultur (in vitro) akan kehilangan sifat interaksi sel
yang spesifik serta menjadi mobile ketika sel menyebar dan mulai berproliferasi
sehingga populasi sel meningkat (Djuwita, 2002). Media merupakan faktor
terpenting bagi pertumbuhan dan perkembangan kultur sel. Pada penelitian ini,
media yang digunakan ada tiga macam yakni media MEM, media L-15 dan media
TCM. Metode aseptis harus selalu diterapkan dalam proses pembuatan kultur sel,
mengingat rawannya terjadi kontaminasi.
Pertumbuhan kultur sel limfoid udang vaname menunjukkan hasil yang
berbeda pada masing-masing media. Sel limfoid yang dikultur ini bisa tumbuh
setelah 24 jam inokulasi (Itami et al., 1999) dan mencapai monolayer pada hari
ke-7 hingga hari ke-8 (Lu et al., 1995). Proses pembelahan sel limfoid terbagi
dalam 12 tahap. Setelah pembelahan sel, sel turunan mereka berbentuk seperti sel
fibroblas atau epiteloid (Lang et al., 2002). Sel limfoid yang dikultur dapat
bertahan hingga 54 hari. Sel tidak bisa bertahan lama setelah diberi tripsin atau
kolagen yang digunakan saat pemisahan sel (Itami et al., 1999).
Sel limfoid udang vaname bisa tumbuh dengan baik kemungkinan karena
dipengaruhi oleh beberapa faktor misalnya suhu, CO2 dan nutrisi yang
terkandung dalam media. Pada penelitian kultur sel limfoid udang vaname, suhu
yang digunakan sebesar 280C. Menurut Hsu et al. (1995) dan Luedeman (1990),
pada suhu 280C kultur sel limfoid udang dapat tumbuh dengan baik. Pernyataan
ini didukung oleh Itami et al. (1999) yang menyatakan bahwa kultur sel limfoid
udang tumbuh baik pada suhu 250C - 300C dan akan tumbuh optimum pada suhu
300C. Pada penelitian ini kadar CO
2 yang digunakan sebesar 5%. Malole (1990)
menyebutkan penggunaan kadar CO2 sebesar 5% dapat digunakan sebagai
pengatur keseimbangan pH dalam media.
Umur udang juga bisa berpengaruh terhadap pertumbuhan kultur sel
limfoid udang. Semakin dewasa udang maka kemampuan regenerasi selnya
semakin melambat sehingga saat dikultur pertumbuhan selnya butuh waktu yang
agak lama. Kultur sel yang berasal dari jaringan muda akan mengandung lebih
banyak sel-sel prekursor dan memiliki kemampuan proliferasi serta daya tahan
yang lebih tinggi dibandingkan sel yang berasal dari jaringan dewasa (Djuwita,
2002). Lu et al., (1995) menyatakan ukuran udang optimal yang digunakan untuk
preparasi kultur primer sel Oka adalah 20 – 30 gram. Penggunaan udang yang
berukuran kurang dari 10 gram akan menyulitkan saat pengambilan organ limfoid.
Udang yang telah dewasa dan beratnya lebih dari 30 gram umumnya tidak
direkomendasikan karena sel dari organ-organnya terlihat lebih lambat saat
berproliferasi dan lebih cepat berdegenerasi walaupun terlihat organnya lebih
besar.
Pertumbuhan sel pada ketiga media yang diujikan menunjukkan hasil yang
baik karena viabilitas sel limfoid lebih dari 95%. Gibco (2011) menyatakan bahwa
media yang baik adalah yang dapat mempertahankan kelangsungan hidup sel yang
34
karena jumlah sel limfoid yang tumbuh pada ketiga media melebihi 104 sel/ml.
Menurut Phelan (1998) kultur sel yang tumbuh sebesar 104 sel/ml termasuk dalam
kategori rendah dan kultur sel dalam kategori tinggi ataupun bisa juga dikatakan
berhasil yakni bila sel yang dikultur tumbuh minimal 105 sel/ml.
Pertumbuhan kultur sel limfoid udang vaname yang tertinggi adalah pada
media L-15 dengan rata-rata jumlah sel sebesar 19,667 x 106 sel/ml pada hari
ke-6 dan menjadi 39 x 106 sel/ml pada hari ke-18 dengan viabilitas mencapai
98%. Data statistik menunjukkan bahwa pertumbuhan kultur sel limfoid udang
vaname pada media L-15 berbeda signifikan dengan pertumbuhan kultur sel
limfoid udang vaname pada kedua media lainnya (p < 0,05).
Crane and Williams (1997) menyatakan bahwa dari tiga media komersial
yakni MEM, L-15 dan TCM yang digunakan dalam kultur sel udang, L-15
merupakan media terbaik daripada kedua media lainnya. Pendapat ini didukung
oleh Toullec (1999) yang menyatakan media L-15 dan TCM bila digunakan
dalam kultur sel menunjukkan hasil yang berbeda jauh. TCM dan L-15 secara
konsisten berhasil menghasilkan kultur primer dari berbagai jaringan krustasea.
Kedua media ini memiliki komposisi dan konsentrasi komponen yang berbeda
secara signifikan (Lang et al., 2002). Baik TCM dan L-15 biasanya digunakan
sebagai media kultur sel ikan, tetapi L-15 lebih sering digunakan (Lee et al., 1993
dalam Claydon, 2009) dan dilaporkan lebih berhasil daripada TCM dalam
memulai kultur sel primer ikan (Schreera et al ., 2005 dalam Claydon, 2009).
Keberhasilan L-15 ini mungkin dikarenakan media ini memiliki kapasitas
buffer yang lebih besar daripada kedua media lainnya, sehingga memungkinkan
sel-sel untuk memanfaatkan asam amino bebas dan menggantikan glukosa dengan
galaktosa dan piruvat. Piruvat pada media ini memungkinkan sel untuk
meningkatkan produksi CO2 endogeneous sehingga tidak bergantung pada CO2
dan HCO3 eksogeneous (Griffiths, 1986). Walaupun TCM mengandung lebih
banyak jenis vitamin dan asam amino, namun vitamin dan asam amino yang
terdapat pada L-15 mempunyai konsentrasi yang lebih tinggi (Claydon, 2009).
Konsentrasi asam amino dan vitamin yang lebih tinggi mengakibatkan
kemampuan proliferasi sel limfoid udang vaname pada media L-15 lebih optimal
VI KESIMPULAN DAN SARAN
6.1 Kesimpulan
1. Kultur sel limfoid udang vaname bisa tumbuh pada ketiga media yang
diujikan (media MEM, media L-15 dan media TCM) dengan jumlah yang
berbeda.
2. Media L-15 merupakan media terbaik bagi kultur sel limfoid udang
vaname.
6.2 Saran
Media L-15 merupakan media terbaik bagi kultur sel limfoid udang
vaname. Untuk itu dalam pembuatan kultur sel limfoid udang vaname sebaiknya
menggunakan media L-15 sehingga akan didapatkan hasil pertumbuhan sel
limfoid yang optimal.
DAFTAR PUSTAKA
Alifuddin, M. 2002. Imunostimulasi pada Hewan Akuatik. Jurnal Akuakultur Indonesia, 1(2): 87-92.
American Type Culture Collection (ATCC). 2012. Animal Cell Culture Guide. Tips and Techniques for Continuous Cell Line. University Blvd. Manassas, VA 20110.
Boediono, A. 2002. Teknik Aseptis dan Upaya Mencegah Kontaminasi pada Kultur Jaringan. Modul VII. Pemanfaatan Teknik Jaringan dan Histokimia dalm Penelitian dan Terapan Bidang Biologi dan Biomedis. Direktorat Jenderal Pendidikan Tinggi. Departemen Pendidikan Nasional. 12 hal. Butler, M. 2004. Animal Cell Culture and Technology. Second Edition. BIOS
Scientific Publisher. New York: 1-78.
Chen, S.N., S.C. Chi, G .H. Kou, and I.C. Liao. 1986. Cell Culture from Tissues of Grass Prawn, Penaeus monodon. Fish Pathol. 21: 161-166.
Chen, S.N., and G.H. Kou. 1989. Infection of Cultured Cells from the Lymphoid Organ of Penaeus monodon Fabricius by Monodon-type Baculovirus (MBV). J. Fish Diseases 12: 73-76.
Claydon, K. 2009. Adavances in Crustacean Cell Culture. PhD Thesis. School of Veterinary and Biomedical Sciences. James Cook University.
Corteel, M. 2013. White Spot Syndrome Virus Infection in P. vannamei and M. rosenbergii: Experimental Studies on Susceptibility to Infection and Disease.Dissertation, Ghent University, Belgium: 7-34.
Crane, M. S. and L. M. Williams. 1997. Development of Continuous Prawn Cell Lines for Virus Isolation and Cultivation. Fisheries Research & Development Corporation. Australia. 39 p.
Direktorat Jenderal Perikanan Budidaya. 2013. Udang Vaname Nusantara 1, Mendukung Program Revitalisasi Tambak. Kementerian Kelautan dan Perikanan. http://www.djpb.kkp.go.id/berita.php?id=899. diakses 6 September 2013.
38
Freshney, R. I. 1992. Introduction to Basic Principles. Animal Cell Culture A Practical Approach Second Edition. Oxford University Press. New York. pp.1-14.
Freshney, R. I. 2005. Culture of Animal Cell. A Manual of Basic Technique Fifth Edition. John Wiley & Sons, Inc. pp. 115-128.
Giang, N. T. T. 2012. Pathogenesis of Gill Associated Virus Disease on Pacific White Shrimp (P. vannamei). Master’s Dissertation. Faculty of Bioscience Engineering. Universiteit Gent. Belgium. pp. 4-24.
Gibco. 2011. Cell Culture Basics. 56 p. www.invitogen.com.
Griffiths, J. 1986. Scaling-up of Animal Cell Cultures. In: R. I Freshney (Ed). Animal Cell Culture. IRL Press, Washington DC. pp. 36-69.
Harijanto. 2012. Kemampuan Proteksi Protein Membran Imunogenik
Zoothamnium penaei terhadap Zoothamniosis pada Udang Vannamei.
Thesis. Fakultas Perikanan dan Kelautan. Universitas Airlangga. Surabaya. hal. 1-4
Hariyanto, T. dan Maskur. 2013. Kerjasama Pencegahan Penyakit Udang untuk Mendukung Pencapaian Peningkatan Produksi. Direktorat Jenderal Perikanan Budidaya. Kementerian Kelautan dan Perikanan. http://www.kkp.go.id/index.php/arsip/c/9116/. diakses 6 September 2013. HiMedia Laboratories. 2011. HiMedia Cell Culture Enabling Breakthroughs.
Product Information. HiMedia Laboratories Pvt. Ltd. A-516. Mumbai. India.
Hsu, Y., Y. H. Yang, Y. C. Chen, M. C. Tung, J. L. Wu, M. H. Engelking and J. C. Leong. 1995. Development of an In Vitro Subculture System for the Oka Organ (Lymphoid Tissue) of Penaeus monodon. Aquaculture 136: 43-55.
Itami, T., M. Maeda, M. Kondo and Y. Takahashi. 1999. Primary Culture of Lymphoid Organ Cells and Haemocytes of Kuruma Shrimp (Penaeus japonicus). Methods in Cell Science 21: 237-244.
Kondo, M., T. Itami, Y. Takahashi, R. Fujii and S. Tomonaga. 1994. Structure and Function of the Lymphoid Organ in the Kuruma Prawn. Dev Comp Immunol 18(Suppl 1): S109
Kusriningrum. 2012. Buku Ajar Perancangan Percobaan. Cetakan Keempat. Dani Abadi. Surabaya. hal. 31-51.
Lang, G. H., N. Nomura, B. Z. Wang and M. Matsumura. 2002. Penaeid (Penaeus japonicus) Lymphoid Cells Replicate by Cell Division In Vitro. In Vitro Cell. Dev. Biol. Animal 38: 142-145.
Lu, Y., L. M. Tapay, P. C. Loh, J. A. Brock and R. Gose. 1995. Development of a Quantal Assay in Primary Shrimp Cell Culture for Yellow Head Baculovirus (YBV) of Penaeid Shrimp. J. Vir. Methods 52: 231-236. Luedeman, R. A. 1990. Development of an In Vitro Primary Cell Culture System
from the Penaeid Shrimp Penaeus stylirostris and Penaeus vannamei and Evaluation of Potential Application. Thesis. Faculty of the Department of Nutrition and Food Science. The University of Arizona. p 1-27.
Luedeman, R. A. and D. V. Lightner. 1992. Development of an In Vitro Primary Cell Culture System from the Penaeid Shrimp Penaeus stylirostris and
Penaeus vannamei. Aquaculture 101: 205-211.
Malole, M. B. 1990. Kultur Sel dan Jaringan Hewan. Pusat Antar Universitas Bioteknologi. Institut Pertanian Bogor. Bogor.
Maurer, H. R. 1992. Toward Serum-Free, Chemically Defined Media for Mammalian Cell Culture. In: R. I Freshney (Ed). Animal Cell Culture A Practical Approach Second Edition. Oxford University Press. New York. pp.15-46.
Nuryati, S. 2000. Penyediaan Biakan Sel Organ Limfoid (Oka) Udang Windu Penaeus monodon Secara In Vitro Sebagai Media Tumbuh bagi Virus. Tesis. Ilmu Perairan. Program Pascasarjana. Institut Pertanian Bogor. Oka, M. 1969. Studies on the Penaeus orientalis Kishinouye-VIII Structure of the
Newly Found Lymphoid Organ. Nagasaki University’s Academic Output SITE. Bull Jpn Soc Sci Fish 35: 245-250.
Ott, T. 2004. Tissue Culture of Fish Cell Line. Laboratory Procedure Manual. Second Edition. Chapter 10. Lacrosse Fish Health Center.
Phelan, M. C. 1998. Basic Techniques for Mammalian Cell Tissue Culture. Current Protocols in Cell Biology 1.1.1-1.1.10. John Wiley & Sons, Inc. Pusat Penyuluhan Kelautan dan Perikanan. 2011. Budidaya Udang Vaname
(Litopenaeus vannamei). Kementerian Kelautan dan Perikanan. Jakarta. hal. 3-13.
Smith, S. F., M. Briggs and W. Miao. 2012. Asia Pacific Fishery Commission. Regional Overview of Fisheries and Aquaculture in Asia and the Pacific 2012. Food and Agriculture Organization of the United Nations Regional Office for Asia and the Pacific. Bangkok. pp. 90-93.
Toullec, J. Y. 1999. Crustacean Primary Cell Culture. A Technical Approach. Methods in Cell Science, 21: 193-198.
Lampiran 1. Komposisi Media MEM, TCM dan L-15
Komponen Media
MEM TCM/M199 L-15
Asam Amino
L-alanine 2.8E-04 2.5E-03
L-arginine 6.0E-04 3.3E-04 2.9E-03
L-asparagine 3.0E-04 7.6E-05
L-aspartic acid 2.3E-04
L-cysteine 5.6E-07 9.9E-04
L-cystine 1.0E-04 9.9E-05
L-glutamic acid 4.5E-04
L-glutamine 2.0E-03 6.8E-04 2.1E-03
Glycine 6.7E-04 2.7E-03
L-histidine 2.0E-04 1.0E-04 1.6E-03
L-hidroxy-proline 7.6E-05
L-isoleucine 4.0E-04 1.5E-04 9.5E-04
L-leucine 4.0E-04 4.6E-04 9.5E-04
L-lysine HCl 4.0E-04 3.8E-04 5.1E-04
L-methionine 1.0E-04 1.0E-04 5.0E-04
L-phenylalanine 2.0E-04 1.5E-04 7.6E-04
L-proline 3.5E-04
L-serine 2.4E-04 1.9E-03
L-threonine 4.0E-04 2.5E-04 2.5E-03
L-tryptophan 4.9E-05 4.9E-05 9.8E-05
L-tyrosine 2.0E-04 2.2E-04 1.7E-03
L-valine 4.0E-04 2.1E-04 8.5E-4
Choline chloride 7.1E-06 3.6E-06 7.1E-06
Folic acid 2.3E-06 2.3E-08 2.3E-06
myo-Inositol 1.1E-05 2.8E-07 1.1E-05
Menadione 6.9E-08
Nicotinamide 8.2E-06 2.0E-07 8.2E-06
Nicotinic acid 2.0E-07
D-Ca pantothenate 4.2E-06 4.2E-08 4.2E-06
Pyridoxal HCl 4.9E-06 1.2E-07
Pyridoxine HCl 1.2E-07
Riboflavin 2.7E-07 2.7E-08 1.9E-07
Thiamin 3.0E-06 3.0E-08 2.4E-06
α-Tocopherol 2.3E-08
Retinol acetate 3.5E-07
Glutathione 1.5E-07
42
Lampiran 2. Peralatan dan Bahan Penelitian
Laminar Air Flow Inkubator CO2 Sentrifugerator
Oven Freezer Timbangan digital
Pipet Pasteur dan Mikropipet Haemocytometer dan Hand counter
Peralatan bedah Media MEM cair Media L-15 bubuk
Media L-15 cair Media TCM/M199 bubuk Media TCM/M199 cair
Aquabidest Larutan Fiksatif Phenol red
FCS dan NaHCO3 Trypan blue substrat (96-well plates)
44
Lampiran 3. Pertumbuhan Kultur Sel Limfoid pada Media Berbeda
Media MEM
Lampiran 3. (lanjutan)
Media TCM
No. Hari ke- Ulangan Jumlah sel yang
tumbuh (x 106 sel/ml) (x 10Rata-rata 6 sel/ml) 1.
6
1 16
15
2. 2 14
3. 3 15
4.
12
1 22
20,667
5. 2 20
6. 3 20
7.
18
1 30
28,667
8. 2 29
46
Lampiran 4. Hasil Analisis Data Pertumbuhan Sel Limfoid dengan SPSS
Hari ke-6
Media Sphericity Assumed 1.947E14 2 9.733E13 53.091 .001
Greenhouse-Geisser 1.947E14 1.039 1.874E14 53.091 .017
Huynh-Feldt 1.947E14 1.161 1.677E14 53.091 .012
Lower-bound 1.947E14 1.000 1.947E14 53.091 .018
Error(Media) Sphericity Assumed 7.333E12 4 1.833E12
Greenhouse-Geisser 7.333E12 2.077 3.530E12
Huynh-Feldt 7.333E12 2.321 3.159E12
Lower-bound 7.333E12 2.000 3.667E12
Kesimpulan: terdapat perbedaan yang signifikan (p<0,05) antara perlakuan dan pertumbuhan sel limfoid udang vaname.