EFEK HEPATOPROTEKTIF PEMBERIAN
INFUSA HERBA
Mimosa pigra
L. SELAMA ENAM HARI
PADA TIKUS JANTAN
TERINDUKSI KARBON TETRAKLORIDA
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Diajukan Oleh:
Cornelia Melinda
NIM: 108114109
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
i
EFEK HEPATOPROTEKTIF PEMBERIAN
INFUSA HERBA
Mimosa pigra
L. SELAMA ENAM HARI
PADA TIKUS JANTAN
TERINDUKSI KARBON TETRAKLORIDA
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Diajukan Oleh:
Cornelia Melinda
NIM: 108114109
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
iv
PERSEMBAHAN
Kupersembahkan Skripsi ini untuk :
Tuhan Yesus Kristus yang selalu memberi berkat luar biasa dalam hidupku,
menopangku ketika terjatuh, dan memberikan pengharapan tanpa henti.
Bapak Rio Nugroho, Ibu Maria Mulyani Sri Suprapti,
keluarga besar S.Y. Moelyono, dan Sastro Soemardjo yang telah memberikan
motivasi, perhatian, kasih sayang, serta doa.
Ignatius Bagas Rumekso, ST., dan teman-teman yang selalu
memberikan semangat,
vii PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkatNya sehingga penulis dapat menyelesaikan skripsi dengan judul “EFEK HEPATOPROTEKTIF PEMBERIAN INFUSA HERBA Mimosa pigra L.
SELAMA ENAM HARI PADA TIKUS JANTAN TERINDUKSI KARBON TETRAKLORIDA” yang disusun untuk memenuhi persyaratan memeperoleh gelar Sarjana Strata Satu Program Studi Farmasi (S.Farm) Universitas Sanara Dharma Yogyakarta yang dapat diselesaikan dengan baik dan lancar.
Skripsi ini dapat diselesaikan oleh penulis karena bantuan dari berbagai pihak, baik secara langsung maupun tidak langsung. Oleh karena itu penulis hendak mengucapkan terimakasih kepada:
1. Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Bapak Ipang Djunarko M. Sc., Apt., selaku Dosen Pembimbing skripsi, atas segala kesabaran untuk selalu membimbing, memberi motivasi, dan memberi masukan kepada penulis dalam penyusunan skripsi ini.
3. Bapak Dr. Prof. Dr. C. J. Soegihardjo, Apt. selaku Dosen Penguji Skripsi atas masukannya demi kemajuan skripsi ini.
4. Ibu Phebe Hendra, M.Si., Ph.D., Apt. selaku Dosen Penguji Skripsi atas masukannya demi kemajuan skripsi ini.
viii
penggunaan fasilitas laboratorium Farmakologi-Toksikologi, Farmakognosi-Fitokimia,dan Kimia Analisis sehingga skripsi ini dapat selesai.
6. Bapak Supardjiman selaku laboran Laboratorium Farmakologi-Toksikologi, Bapak Heru selaku laboran Laboratorium Biofarmasetika-Farmakokinetika, Bapak Kayatno selaku laboran Laboratorium Biokimia, Bapak Wagiran selaku laboran Laboratorium Farmakognosi-Fitokimia, Bapak Andri selaku laboran Kebun Obat, Bapak Suparlan selaku laboran Laboratorium Kimia Organik, dan Bapak Kunto selaku laboran Laboratorium Kimia Analisis atas segala bantuan serta kerjasamanya selama di laboratorium.
7. Tim Skripsi Mimosa pigra L. yaitu Lukas Surya Wijaya, S.Farm. dan Kelvin Nugroho yang senantiasa membantu, memberikan masukan, mengalami suka duka bersama selama pengerjaan skripsi ini.
8. Sahabat-sahabat penulis, Juana Merianti Simanjuntak, Brigitta Lynda Rakasiwi, Maria Malida Vernandes Sasadara, Hans Gani, Clara Niken Dwi Haryani, Theresia Tri Hastuti, anggota kelas FKK B 2010, mahasiswa-mahasiswi Fakultas Farmasi angkatan 2010 yang membantu penulis dalam penelitian serta penyusunan skripsi ini.
9. Tim PKM-P 2013 (Solar Friends), Restu Indra Gumelar, ST., Kristoforus Ade Yulianta, ST., Ida Bagus Murdhi, ST., Permana Panji, ST., yang selalu memberikan motivasi kepada penulis agar segera menyelesaikan skripsi ini. 10. Kelompok 34 KKN Dliring periode 22 Desember 2013 – 29 Januari 2014,
ix
Lie, Teresia S. Astri Bandur, Georgius Rocky Agasi, Margareta Ajeng K., B. Gracia Chandra, Yulius Dony yang memberikan semangat kepada penulis. 11. Mudika Santo Markus wilayah Mlati Utara, Paroki St.Aloysius Gonzaga
Mlati atas doa dan semangatnya untuk penulis.
12. Seluruh dosen, dan laboran Fakultas Farmasi Universitas Sanata Dharma Yogyakarta selama proses perkuliahan hingga diselesaikannya skripsi ini. 13. Pihak-pihak lain yang turut membantu penulis namun tidak dapat disebutkan
satu persatu.
Penulis menyadari bahwa skripsi ini jauh dari sempurna sehingga penulis menerima kritik dan saran dari banyak pihak agar skripsi ini lebih baik. Semoga skripsi ini dapat memberikan manfaat dan memberikan informasi yang berarti bagi pembaca.
Yogyakarta, 2014
x
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... v
PERNYATAAN KEASLIAN KARYA ... vi
xi
H. Metode Uji Hepatotoksik ... 20
I. Landasan Teori ... 21
J. Hipotesis ... 22
BAB III. METODE PENELITIAN... 23
A. Jenis dan Rancangan Penelitian ... 23
B. Variabel Penelitian ... 23
C. Definisi Operasional... 24
D. Bahan Penelitian... 24
xii
3. Pembuatan larutan karbon tetraklorida dalam olive oil... 27
4. Pembuatan infusa herba Mimosa pigra L. ... 27
5. Penetapan dosis infusa herba Mimosa pigra L. ... 28
6. Pembuatan suspensi ekstrak Silimarin ... 28
7. Uji pendahuluan ... 28
a. Penetapan dosis hepatotoksin ... 28
b. Penetapan waktu cuplikan darah ... 29
c. Penetapan waktu pemberian infusa herba Mimosa pigra L. ... 29
8. Pengelompokan dan perlakuan hewan uji ... 29
xiii
1. Penetapan dosis hepatotoksin ... 35
2. Penetapan dosis infusa herba Mimosa pigra L. ... 36
3. Penentuan dosis kontrol positif silimarin ... 36
4. Penentuan waktu pencuplikan darah ... 37
C. Efek Hepatoprotektif Infusa Herba Mimosa pigra L. Terhadap Tikus Jantan ... 42
1. Kontrol negatif ... 45
2. Kontrol hepatotoksin ... 46
3. Kontrol infusa Mimosa pigra L. ... 47
4. Efek hepatoprotektor berdasarkan perhitungan % hepatoprotektif ... 48
D. Rangkuman Pembahasan ... 54
BAB V. KESIMPULAN DAN SARAN ... 57
A. Kesimpulan ... 57
B. Saran ... 57
DAFTAR PUSTAKA ... 58
LAMPIRAN ... 62
xiv
DAFTAR TABEL
Tabel I. Kadar serum ALT setelah dilakukan pemberian karbon tetraklorida dengan dosis 2 mL/KgBB pada
rentang waktu 24, 48, dan 72 jam ... 37 Tabel II. Perbedaan peningkatan kadar serum ALT setelah
pemberian karbon tetraklorida dengan dosis
2 mL/KgBB pada rentang waktu 24, 48, dan 72 jam ... 39 Tabel III. Kadar serum AST setelah dilakukan pemberian
karbon tetraklorida dengan dosis 2 mL/KgBB
pada rentang waktu 24, 48, dan 72 jam ... 39 Tabel IV. Perbedaan peningkatan kadar serum ALT setelah
pemberian karbon tetraklorida dengan dosis 2 mL/KgBB
pada rentang waktu 24, 48, dan 72 jam ... 41 Tabel V. Pengaruh perlakuan infusa herba Mimosa pigra L. dilihat
dari aktifitas serum ALT dan AST pada berbagai peringkat dosis terhadap hepatotoksin karbon tetraklorida ... 42 Tabel VI. Hasil uji statistik aktifitas serum ALT tikus jantan pada
perlakuan berbagai peringkat dosis infusa
herba Mimosa pigra L. ... 43 Tabel VII. Hasil uji statistik aktifitas serum AST tikus jantan pada
perlakuan berbagai peringkat dosis infusa
xv
jam ke-24 ... 45 Tabel IX. Aktifitas kadar serum AST pada jam ke-0 dibandingkan
xvi
DAFTAR GAMBAR
Gambar 1. Metabolit karbon tetraklorida dan formasi metabolit
reaktif ... 14 Gambar 2. Tumbuhan putri malu ... 15 Gambar 3. 1. Tritofan; 2. Mirisitrin; 3. Kuersetin 3-O-heksosa;
4. Kuersetin 3-O-heksosa; 5. Kuersetin 3-O-pentosa;
6. Kuersitrin; 7. Kamferol 3-O-desoksiheksosa ... 17 Gambar 4. Diagram batang rata-rata kadar serum ALT setelah
dilakukan pemberian karbon tetraklorida dengan dosis 2 mL/KgBB pada rentang waktu 24, 48,
dan 72 jam ... 38 Gambar 5. Diagram batang rata-rata kadar serum AST setelah
dilakukan pemberian karbon tetraklorida dengan dosis 2 mL/KgBB pada rentang waktu 24, 48,
dan 72 jam ... 40 Gambar 6. Diagram batang aktifitas serum ALT tikus jantan
pada perlakuan berbagai peringkat dosis infusa herba
Mimosa pigra L. ... 43 Gambar 7. Diagram batang aktifitas serum AST tikus jantan
pada perlakuan berbagai peringkat dosis infusa herba
xvii
DAFTAR LAMPIRAN
Lampiran 1. Foto infusa herba Mimosa pigra L. ... 63
Lampiran 2. Foto suspensi silimarin dalam CMC-Na 1% ... 63
Lampiran 3. Surat tanaman Mimosa pigra L. ... 64
Lampiran 4. Surat ethical clearence ... 65
Lampiran 5. Hasil analisis statistik data ALT dan AST pada uji pendahuluan waktu pencuplikan darah hewan uji setelah induksi karbon tetraklorida (2 mL/KgBB) ... 66
Lampiran 6. Hasil statistik data ALT dan AST pada kelompok kontrol olive oil dosis 2 mL/KgBB ... 76
Lampiran 7. Hasil statistik data serum ALT kontrol hepatotoksin (CCl4), kontrol negatif (olive oil), kontrol infusa herba Mimosa pigra L., kontrol positif Silimarin, perlakuan infusa herba Mimosa pigra L. (dosis 1,26; 1,89; 2,835 g/KgBB) ... 80
Lampiran 8. Hasil statistik data serum AST kontrol hepatotoksin (CCl4), kontrol negatif (olive oil), kontrol infusa herba Mimosa pigra L., kontrol positif Silimarin, perlakuan infusa herba Mimosa pigra L. (dosis 1,26; 1,89; 2,835 g/KgBB) ... 97
xviii
INTISARI
Penelitian ini bertujuan untuk mengetahui efek hepatoprotektif infusa herba Mimosa pigra L. selama enam hari dan dosis optimum sebagai hepatoprotektor pada tikus yang terinduksi karbon tetraklorida.
Jenis penelitian ini adalah eksperimental murni dengan rancangan acak lengkap pola searah yang dilakukan dengan membagi 35 ekor tikus umur 2-3 bulan dan berat 130-200 gram. Kelompok I diberikan CCl4 dosis 2 mL/kg BB secara intraperitoneal sebagai kontrol hepatotoksin. Kelompok II diberi olive oil selama 6 hari berturut-turut secara intraperitoneal sebagai kontrol negatif. Kelompok III diberi infusa herba Mimosa pigra L. dosis 2,835 g/kg BB sebagai kontrol infusa selama 6 hari berturut-turut secara per oral. Kelompok IV diberikan suspensi ekstrak silimarin dosis 25 mg/kg BB secara per oral selama 6 hari berturut-turut kemudian pada hari ke-7 diberikan 2 mL/kgBB CCl4 dalam olive oil dengan perbandingan 1:1 secara intra peritonial. Setelah 24 jam perlakuan, tikus kelompok I-IV diukur aktivitas serum ALT dan AST. Kelompok V-VII diberi infusa herba Mimosa pigra L. dosis 1,260; 1,890; 2,835 g/kg BB secara per oral selama 6 hari berturut-turut kemudian hari ke-7 diberikan 2 mL/kgBB karbon tetraklorida dalam olive oil dengan perbandingan 1:1 secara intraperitoneal. Hari ke-8 diambil darahnya melalui vena orbitalis lalu diukur aktivitas serum ALT dan AST. Analisis data serum ALT dan AST menggunakan uji Kolmogorov-Smirnov untuk melihat distribusi data, dilanjutkan dengan uji Mann-Whitney untuk mengetahui perbedaan kadar serum ALT dan AST antar kelompok.
Hasil persentase hepatoprotektif dari kadar ALT dosis V-VII secara berturut-turut adalah 29,14; 6,38; dan 80,84% sedangkan hasil kadar AST berturut-turut 30,79; 16,67; dan 104,25%. Dosis optimum infusa herba Mimosa pigra L. adalah 2,835 g/kgBB.
xix ABSTRACT
This study aimed to determine the ability of administration infundation Mimosa pigra L. herb as hepatoprotector for six days and optimum dose in male rats induced carbon tetrachloride.
This research was experimental pure with complete randomized design conducted in the same direction by dividing 35 rats aged 2-3 months and weighed 130 – 200 grams. The first group was given CCl4 2 mL/KgBW intraperitoneally as hepatotoxin control. Group II was given olive oil for 6 consecutive days intraperitoneally as negative control. Group III was given infundation of Mimosa pigra L. herb dose 2.835 g/kgBW as infundation control for 6 consecutive days orally. Group IV was given a suspension of Silymarin extract dose 25 mg/KgBW p.o. for 6 consecutive days and then on 7th day rats was given 2 mL/ kgBW CCl4 diluted in olive oil with 1:1 ratio intraperitonially. Twenty-four hours later, the ALT and AST serum activity from groups I-IV were measured. Group V-VII
were given infundation of Mimosa pigra L. herb dose 1.260; 1.890; 2.835 g/kgBW p.o. for 6 consecutive days and then on 7th day given 2 mL/KgBW
of carbon tetrachloride diluted in olive oil intraperitoneally with 1:1 ratio. The blood was collected from orbital sinus eye on the 8th day and then ALT and AST serum activity were measured. Analysis of ALT and AST serum activity used Kolmogorov-Smirnov test to look at the distribution of the data, followed by the Mann-Whitney test to determine differences in ALT and AST serum activity between groups.
After calculating percentage of hepatoprotective effect, the hepatoprotective effect percentages of ALT activity from group V – VII were 29.14; 6.38; and 80.84% respectively. The results of the hepatoprotective effect precentages for AST activity were 30.79; 16.67; and 104.25% respectively. The optimum dose of infusion of Mimosa pigra L. herb was 2.835 g/KgBB.
1 BAB I
PENGANTAR
A. Latar Belakang
Organ intestinal paling besar dalam tubuh manusia adalah hati. Hati sangat berperan dalam proses metabolisme tubuh, karena dapat menyediakan secara tetap metabolit dan bahan-bahan pembentuk yang kaya energi bagi organisme seperti karbohidrat, protein, dan lemak. Selain itu dapat melakukan biosintesis senyawa-senyawa dalam tubuh agar dapat diekskresikan, serta detoksifikasi senyawa-senyawa toksik melalui biotransformasi. Obat dan toksin dimodifikasi oleh hati menjadi inaktif atau larut air dengan dikonjugasikan dengan senyawa kimia lain sehingga dapat diekskresikan melalui ginjal.
Mengingat pentingnya organ hati dalam tubuh, maka kita harus memberikan perhatian yang besar terhadap penanggulangan penyakit pada hati. Dewasa ini, banyak muncul kejadian hepatotoksisitas yang dikarenakan oleh reaksi obat yang tidak dikehendaki. Hasil penelitian periode 2006 – Februari 2009 pada pasien terapi antituberkulosis di RSUD Tangerang tahun 2010 ditemukan kejadian hepatotoksisitas sebesar 38,2% dari 55 pasien berdasarkan adanya peningkatan kadar AST/ALT serum. Kemudian penelitian di Rumah Sakit London Inggris, seseorang yang mengalami hepatotoksisitas apabila mengalami
periode 1 Juni 2006 – 31 Mei 2007. Dari 79% pasien yang melakukan test Hepatitis B diperoleh hasil 9% pasien positif, lalu 77% pasien melakukan test Hepatitis C diperoleh hasil 9% pasien positif. Kemudian dari 94 orang terdapat 15% (14 orang) kejadian hepatotoksisitas, 10% (9 orang) mengalami peningkatan kadar ALT/AST sebanyak 5 kali lipat dari batas normal (Walker et al., 2009).
Melihat banyaknya kasus hepatotoksisitas, dibutuhkan senyawa yang dapat berperan sebagai hepatoprotektor. Masyarakat kurang percaya dengan obat jadi melainkan lebih banyak mengkonsumsi obat herbal atau yang berasal dari tanaman karena mudah didapat.
Dalam penelitian ini penulis memilih tanaman Mimosa pigra L. sebagai tanaman yang diyakini memiliki senyawa sebagai hepatoprotektor karena mengandung mimosin dan asam pipekolinat (Apriyanto, Susanti, dan Linawati, 2000). Namun penelitian terbaru oleh Syamsudin, Rizikiyan, dan Darmono (2006) mengatakan bahwa mimosin dapat menghambat biosintesis protein dengan melakukan antagonis dengan tirosin, sehingga kemungkinan efek hepatoprotektif bukan berasal dari mimosin. Efek hepatoprotektif mengacu dari penelitian Rakatomalala et al. (2013), ekstrak hidrometanolik Mimosa pigra L. mengandung flavonoid yaitu mirisitrin dan kuersetin yang bertindak sebagai antioksidan untuk membersihkan radikal bebas dalam tubuh, menurunkan tekanan arteri pulmonari, dan sebagai antiinflamasi. Selain itu ekstrak etanol herba Mimosa pigra L. memiliki kemampuan sebagai antibakteri (Mbatchou, Ayebila, dan Apea, 2011).
antihepatotoksik juga menggunakan infusa herba Mimosa pigra L.. Selain itu, infusa lebih mudah diaplikasikan ke masyarakat luas karena pembuatannya hampir sama seperti merebus dan meskipun cara pengolahannya sederhana tetapi dapat mengambil banyak senyawa aktif di dalamnya.
Pada penelitian Apriyanto, dkk. (2000) digunakan paracetamol sebagai senyawa model yang mengakibatkan kerusakan hati pada tikus yaitu nekrosis, namun dalam penelitian ini digunakan CCl4 sebagai senyawa model. Penggunaan CCl4 ini dipilih karena CCl4 memberikan kerusakan sel hati yaitu perlemakan hati. Perlemakan hati terjadi akibat metabolisme CCl4 oleh sitokrom P450 yang menghasilkan radikal triklorometil. Trikolorometil dengan oksigen akan membentuk radikal triklorometil peroksi (CCl3O2) yang dapat menyerang lipid membran endoplasmik retikulum dengan kecepatan yang melebihi radikal bebas triklorometil. Selanjutnya, triklorometil peroksi akan menyebabkan peroksidasi lipid, sehingga mengganggu homeostasis Ca2+ dan akhirnya menyebabkan kematian sel.
Tikus jantan diberi praperlakuan infusa herba Mimosa pigra L. kemudian diinduksi CCl4 untuk dilihat kerusakan hati dan seberapa besar infusa herba Mimosa pigra L. dapat menekan kerusakan sel hati tersebut berdasarkan kadar AST dan ALT dari serum darah tikus jantan.
1. Perumusan masalah
a. Apakah infusa herba Mimosa pigra L. memiliki kemampuan sebagai senyawa hepatoprotektif terhadap tikus jantan yang terinduksi CCl4?
b. Berapakah dosis optimum agar infusa herba Mimosa pigra L. memberikan efek hepatoprotektif paling baik?
2. Keaslian penelitian
Sejauh pengamatan penulis, penelitian dengan judul “Efek Hepatoprotektif
Infusa Herba Mimosa pigra L. Selama Enam Hari pada Tikus Jantan Terinduksi
Karbon Tetraklorida” belum pernah dilakukan.
3. Manfaat penelitian
a. Manfaat teoritis
Memberikan pengetahuan dalam bidang farmasi mengenai obat herbal sebagai hepatoprotektif dalam mencegah perlemakan hati akibat induksi CCl4.
b. Manfaat praktis
Memberikan informasi mengenai dosis optimum infusa herba Mimosa pigra L. sebagai hepatoprotektif.
B. Tujuan Penelitian
1. Tujuan umum
Mengetahui tanaman sebagai senyawa hepatoprotektif pada tikus jantan yang terinduksi CCl4.
2. Tujuan khusus
a. Mengetahui kemampuan infusa herba Mimosa pigra L. sebagai senyawa hepatoprotektif terhadap tikus jantan yang terinduksi karbon tetraklorida.
6 BAB II
PENELAAHAN PUSTAKA
A. Anatomi dan Fisiologi Hati
Hati adalah organ terbesar, mencapai 2% - 3% dari berat badan. Hati terletak di kuadran kanan atas dari rongga perut bawah hemidiafragma, dilindungi oleh tulang rusuk (Sherif, Misih, dan Bloomston, 2010). Hati memiliki berat sekitar 1400 g pada orang dewasa dan dibungkus oleh suatu fibrosa.
(Martini, 2004). Di bagian dalam sinusoid ini terdapat sel yang berfungsi untuk menghancurkan sel darah merah dan bakteri yang melewatinya dalam darah. Sel ini disebut sel Kupffer (Sherwood, 2007).
Hati menerima hampir sekitar 1500 ml darah per menit melalui vena portal dan arteri hepatica (McPhee dan Ganong, 2005). Sel-sel hepar yang disebut hepatosit mendapat suplai darah dari vena porta hepatica yang kaya akan makanan dan tidak mengandung oksigen, namun terkadang bersifat toksik; serta dari arteria hepatica yang mengandung oksigen (Wibowo dan Paryana, 2009). Produk dari pencernaan yang diabsorbsi ke dalam kapiler darah di intestinal tidak secara langsung masuk ke sirkulasi seluruh tubuh melainkan dihantarkan terlebih dahulu ke dalam hati. Pembuluh kapiler pada saluran pencernaan mengalir ke dalam vena porta hepatica dengan membawa darah menuju kapiler di hati. Untuk menerima darah vena dari intestinal, hati juga menerima darah arteri melalui arteri hepatica (Fox, 2004).
Fungsi utama hati adalah metabolisme (Wibowo dan Paryana, 2009), aktifitas hati dalam fungsinya dalam regulasi metabolisme adalah sebagai berikut: 1. Metabolisme karbohidrat
sebagai glikogen, atau menggunakannya untuk mensintesis lipid yang dapat disimpan di jaringan yang lain atau hati (Martini, 2004).
2. Metabolisme lipid
Mengatur regulasi sirkulasi kadar trigliserida, asam lemak, dan kolestrol. Apabila kadarnya menurun, hati akan memecah cadangan lipid dan dikeluarkan ke aliran darah. Jika kadarnya meningkat, lipid akan dihilangkan dari penyimpanannya, karena sebagian besar lipid diabsorbsi melalui saluran pencernaan yang melewati sirkulasi portal hepatika, maka regulasi hanya dapat terjadi setelah kadar lipid meningkat pada seluruh sirkulasi (Martini, 2004). 3. Metabolisme asam amino
Hati dapat menurunkan peningkatan jumlah asam amino dalam sirkulasi darah. Asam amino dapat digunakan untuk mensintesis protein atau dapat diubah menjadi glukosa ataupun lipid untuk cadangan energi (Martini, 2004).
4. Detoksifikasi
Menghilangkan substansi yang merugikan bagi tubuh seperti alkohol dan obat (Cohen dan Wood, 2000).
5. Penyimpanan vitamin
Vitamin yang dapat larut dalam lemak (A, D, E, dan K) dan vitamin B12 dapat diabsorbsi dari darah dan disimpan di dalam hati (Martini, 2004).
6. Penyimpanan mineral
7. Inaktivasi obat
Hati dapat menghilangkan dan memecah sirkulasi obat tanpa menurunkan durasi dari efeknya (Martini, 2004).
Seperti banyak organ di tubuh, hati normalnya memiliki kapasitas cadangan yang besar untuk berbagai reaksi kimia yang dijalankannya dan kemampuan untuk membentuk kembali sel dengan tingkat deferensiasi sempurna sehingga dapat pulih total setelah cedera akut (McPhee dan Ganong, 2005).
B. Kerusakan Hati
Hepatotoksik merupakan kerusakan hati yang berhubungan dengan rusaknya fungsi hati karena paparan obat atau agen non-infeksi lainnya (Navarro, Senior, 2006). Agen hepatotoksik dapt bereaksi dengan komponen seluler dasar dan dapat menyebabkan induksi hampir seluruh tipe lesi (luka) pada hati (Grattaglino, Bonfrate, Wang, dan Portincasa, 2009).
Secara morfologi, hati merupakan organ sederhana dengan respon yang terbatas terhadap suatu cedera. Berikut adalah respon umum hati pada cedera tersebut:
1. Degenerasi dan akumulasi intraseluler
Kerusakan akibat gangguan toksik atau imunologik dapat menyebabkan pembengkakan hepatosit. Pembengkakan derajat sedang, masih bersifat reversibel. Untuk kerusakan yang lebih parah (degenerasi balon), hepatosit membengkak disertai penggumpalan organel sitoplasma dan terbentuknya ruang-ruang jerni yang besar. Akumulasi butir lemak trigliserida di dalam hepatosit dikenal sebagai steatosis. Butir-butir kecil yang tidak mendesak nukleus disebut steatosis mikrovisikel, sedangkan butiran besar yang mendesak nukleus dikenal dengan steatosis makrovisikel. Kedua steatosis baik steatosis mikrovisikel maupun makrovisikel dapat dijumpai pada perlemakan hati alkoholik. Di kelainan tersebut, steatosis menyerang hampir seluruh hepatosit (Kumar, Abbas, dan Fausto, 2009).
2. Nekrosis dan apoptosis
berupa infiltrasi neutrofil pada bagian yang rusak (Hodgson, 2010). Pada kematian sel apoptotik, hepatosi-hepatosit berkumpul dan menjadi sel-sel yang mengkerut, piknotik, dan sangat eusinofilik disertai nukleus yang terfragmentasi. 3. Inflamasi
Cedera hati yang menyebabkan influks sel radang akut atau kronik disebut hepatitis. Nekrosis hepatosit kronik atau iskemik akan memebangkitkan reaksi peradangan. Untuk cedera akibat toksik, peradangan dapat mendahului terjadinya inflamasi. Kerusakan sel hati penyaji antigen akibat limfosit sitotoksik merupakan mekanisme umum kerusakan hati, terutama pada infeksi virus. Hepatosit yang telah mati tidak memicu peradangan secara sendiri. Sel Kupffer dan monosit darah yang direkrut ke hati akan menelan fragmen-fragmen sel apoptotik dalam beberapa jam, dan membentuk gumpalan sel radang (Kumar, et al., 2009).
4. Regenerasi
5. Fibrosis
Jaringan fibrosa terbentuk sebgai respon terhadap peradangan atau kerusakan toksik langsung pada hati. Apabila terjadi fibrosis, hati akan terbagi menjadi nodul-nodul hepatosit proliferatif yang dikelilingi oleh jaringan parut yang disebut sirosis (Kumar, et al., 2009).
Steatosis merupakan akumulasi lemak terutama trigliserid yang tidak normal pada hepatosit akibat uptake ekstra hepatik tsigliserid dengan sekresi hepatik pada trigliserid yang berisi lipopretein dan katabolisme asam lemak yang tidak seimbang (Hodgson, 2010). Steatosis atau perlemakan hati dapat dianggap sebagai jenis cedera sitotoksik, tetapi juga dapat menjadi kerusakan hati kronis (Davis dan William, 2003).
Penyakit hati dapat bersifat reversibel atau ireversibel. Penyakit hati yang bersifat reversibel berasal langsung dari kerusakan akut sel fungsional hati, terutama hepatosit, tanpa gangguan kemampuan hati untuk melakukan regenerasi. Penyakit hati yang bersifat ireversibel adalah sirosis, akibat alkohol atau pejanan obat. Massa hepatosit dan kapasitas cadangan fungsional hati yang berkurang, mengakibatkan hati lebih peka terhadap cedera hati akut (McPhee dan Ganong, 2005).
C. Hepatotoksisitas
manusia serta hewan uji. Hepatotoksisitas idiosinkratik ditunjukkan pada perubahan metabolisme yang ditemukan pada gen pemetabolisme obat (Hodgson, 2010). Pada hepatotoksik intrinsik bergantung pada dosis sublethal (Roth dan Ganey, 2010).
Hepatotoksisitas idiosinkratik dibagi menjadi dua yaitu alergi dan non-alergi. Reaksi idiosinkratik alergi melibatkan partisipasi sistem imun adaptif, sedangkan reaksi idiosinkratik non alergi dibedakan berdasarkan ada tidaknya reaksi hipersensitivitas. Hepatotoksik idiosinkratik hanya dapat terjadi pada sebagian kecil individu yang terpapar suatu obat, faktor lingkungan dan genetik sangat mempengaruhi (Kaplowitz, 2005).
D. Karbon Tetraklorida
Kerusakan sel dapat diinisiasi oleh beberapa mekanisme antara lain penghambatan enzim, pengurangan metabolit atau kofaktor, pengurangan ATP, interaksi dengan reseptor, peningkatan intraseluler kalsium, pembentukan metabolit aktif, dan perubahan membran sel. Banyak faktor, termasuk obat dapat menyebabkan kerusakan sel melalui mekanisme aktifasi metabolit pada tingkatan yang lebih tinggi seperti radikal bebas, karbon, dan nitro akibat stres oksidatif (Hodgson, 2010).
Metabolisme CCl4 secara luas dilakukan penelitian in vivo dan in vitro pada mamalia. Tahap awal biotransformasi dari karbon tetraklorida adalah reduksi dehalogenisasi: pembelahan ikatan klorida karbon menjadi ion klorida dan radikal triklorometil (EPA, 2010). Triklorometil radikal (CCl3*) dapat berikatan kovalen dengan protein atupun lipid menyebabkan kerusakan membran (Klaassen, 2001).
Gambar 1. Metabolit karbon tetraklorida dan formasi metabolit reaktif (Hodgson, 2010).
E. Mimosa pigra L.
Gambar 2. Tumbuhan putri malu.
1. Morfologi
2. Klasifikasi tanaman
Kingdom : Plantae
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Dicotyledonae Ordo : Fabales Familia : Fabaceae Sub Familia : Mimosoideae Genus : Mimosa
Spesies : Mimosa pigra Linn (CABI, 2014). Author : Carolus Linnaeus
3. Nama lain
Mimosa asperata L., Mimosa asperata (Wild) Humb. Et Bonpl., Mimosa hispida Willd, Mimosa pallida Humb. & Bonpl. Ex Willd, Mimosa pellita Humb. & Bonpl. Ex Willd., Mimosa pigra var. Pigra (A. Gray ex Torr); B. L. Turner, Mimosa polycantha Willd (CABI, 2014).
4. Habitat
5. Kandungan kimia
Pada penelitian yang dilakukan oleh Mbatchou, et al. (2011) kandungan kimia yang terdapat pada Mimosa pigra L. antara lain adalah alkaloid, asam amino, antrakuinon, flavonoid, glikosida, saponin, steroid, tanin, dan terpenoid.
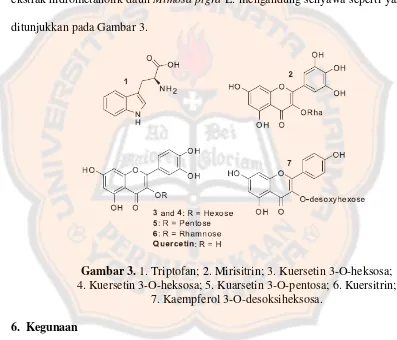
Penelitian yang dilakukan oleh Rakatomalala, et al. (2013) dilaporkan ekstrak hidrometanolik daun Mimosa pigra L. mengandung senyawa seperti yang ditunjukkan pada Gambar 3.
Gambar 3. 1. Triptofan; 2. Mirisitrin; 3. Kuersetin 3-O-heksosa; 4. Kuersetin 3-O-heksosa; 5. Kuarsetin 3-O-pentosa; 6. Kuersitrin;
7. Kaempferol 3-O-desoksiheksosa. 6. Kegunaan
ekspektoran, dan untuk gangguan pada gigi sedangkan daunnya sebagai pencahar dan tonic. Di Malaysia Mimosa pigra L. untuk mengobati gigitan ular, kemudian digunakan juga sebagai pupuk hijau, pagar hidup, dan bahan bakar (CABI, 2014).
Pada penelitian yang dilakukan oleh Apriyanto, dkk. (2001) infusa herba Mimosa pigra L. memiliki potensi sebagai hepatoprotektif pada tikus jantan. Ekstrak metanol herba Mimosa pigra L. juga memiliki kemampuan sebagai antibakteri pada penelitian yang dilakukan oleh Mbatchou, et al. (2011) menggunakan Salmonella typhi. Selanjutnya, ekstrak hidrometanolik daun Mimosa pigra L. dapat menurunkan tekanan arteri pulmonari, sebagai antioksidan serta antiinflamasi (Rakatomalala, et al., 2013).
Selain itu, infusa herba Mimosa pigra L. dengan dosis 1,26 g/KgBB juga memiliki aktivitas antihepatotoksik pada tikus jantan (Wijaya, 2013).
F. Silybum marianum
Silybum marianum mengandung silimarin yang terdiri dari flavanolignan silibin, silidianin, dan silikristin. Silibin merupakan kandungan yang paling aktif secara biologis. Silimarin ditemukan dalam konsentrasi tinggi pada buah Silybum marianum, namun juga ditemukan pada bagian daun dan biji. Bijinya mengandung betain, trimetil glisin, dan asam lemak essensial yang bermanfaat sebagai hepatoprotektif dan anti inflamasi (Kumar, et al., 2009). Mekanisme utama dari silimarin sebagai hepatoprotektif adalah antioksidatif, imunomodulator, anti inflamasi, dan anti fibrosis (Domitrovic, Jakovac, dan Blagojevic, 2011).
G. Infundasi
Metode infundasi digunakan untuk menyari kandungan aktif dari simplisia yang larut dalam air panas. Penyarian dengan cara ini menghasilkan sari yang tidak stabil dan mudah tercemar oleh bakteri dan jamur sehingga sari yang diperoleh dengan cara ini harus segera diproses sebelum 24 jam. Cara ini sangat sederhana dan sering digunakan oleh perusahaan obat tradisional. Pada umumnya proses dimulai dengan membasahi simplisia dengan air dua kali bobot bahan, untuk bunga empat kali bobot bahan dan untuk karagen sepuluh kali bobot bahan. Bahan baku ditambah dengan air, pada umumnya jika tidak dinyatakan lain diperlukan 100 bagian air untuk 10 bagian bahan kemudian dipanaskan selama
1 menit pada suhu 0 untuk infusa atau 0 menit untuk dekokta. en arian
Untuk memudahkan penyarian kadang-kadang perlu ditambah bahan kimia misalnya:
a. Asam sitrat untuk infusa kimia
b. Kalium atau natrium karbonat untuk infusa kelembak (Depkes RI, 1986).
H. Metode Uji Hepatotoksik
Ada dua teknik utama dikembangkan untuk pengukuran aktivitas serum
aminotransferase. Terhadap GOT, diukur perubahan asam aspartat dan asam α
-ketoglutarat menjadi asam glutamat dan asam oksaloasetat; terhadap GPT, diukur
perubahan alanin dan asam α-ketoglutarat menjadi asam glutamat dan asam
piruvat. Digunakan metode analisis UV, proses ubahan enzim tadi dilanjutkan dengan reaksi nicotinamide adenine dinucleotide (NAD) dikonversikan dari bentuk tereduksinya (NADH) menjadi bentuk teroksidasi (NAD). Akibat reaksi ini diikuti oleh penurunan resapan pada panjang gelombang 340 nm oleh proses oksidasi NADH (Plaa dan Charbonneau, 2001).
I. Landasan Teori
Fungsi utama hati adalah metabolisme. Hati memiliki struktur seragam yang memiliki klompok sel yang dipersatukan oleh sinusoid. Semua darah vena dari systemadigestorium akan mengalir ke dalam sinusoid ini. Sel-sel hepar mendapat suplai darah dari vena portae hepatis yang kaya akan makanan dan tidak mengandung oksigen, namun terkadang bersifat toksik; serta dari arteria hepatica yang mengandung oksigen (Wibowo dan Paryana, 2009).
Senyawa model yang digunakan sebagai hepatotoksin adalah karbon tetraklorida. CCl4 diubah menjadi radikal bebas triklorometil (CCl3*) oleh sitokrom P450 2E1 (CYP2E1). Triklorometil dengan oksigen akan membentuk radikal triklorometilperoxi yang dapat menyerang lipid membran endoplasmik retikulum dengan kecepatan yang melebihi radikal bebas triklorometil. Selanjutnya, triklorometilperoxi menyebabkan proksidasi lipid sehingga mengganggu homeostasis Ca2+, dan akhirnya menyebabkan kematian sel. Nekrosis yang terjadi karena CCl4 paling parah terjadi pada centrilobular sel hati yang banyak mengandung isozim CYP dalam konsentrasi tinggi yang bertanggung jawab mengaktifkan CCl4 (Hodgons, 2010).
Mimosa pigra L. diketahui memiliki kemampuan sebagai hepetoprotektif pada tikus terinduksi paracetamol (Apriyanto, dkk., 2000). Penelitian ini dilakukan untuk mengetahui apakah infusa Mimosa pigra L. dapat menekan peningkatan kadar ALT dan AST pada tikus yang terinduksi karbon tetraklorida.
model perlakuan untuk memproteksi hati dari radikal bebas karbon tetraklorida. Waktu konversi enam hari pada tikus akan menjadi ± 21 minggu (Sengupta, 2011).
J. Hipotesis
23 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam jenis penelitian eksperimental murni dengan menggunakan rancangan penelitian acak lengkap pola searah. Penelitian ini dilakukan di Laboratorium Farmakologi dan Toksikologi, Laboratorium Biokimia, dan Laboratorium Farmakognosi-Fitokimia Universitas Sanata Dharma Yogyakarta.
B. Variabel Penelitian
a. Variabel utama
1) Variabel bebas: peringkat dosis infusa herba Mimosa pigra L.
2) Variabel tergantung: aktivitas serum ALT dan AST pada tikus jantan terinduksi karbon tetraklorida.
b. Variabel pengacau terkendali 1) Subyek uji: tikus putih jantan
a) Galur Wistar
b) Berat badan 130 – 200 gram c) Umur 2 – 3 bulan
percabangan muda berwarna hijau pada tanaman yang masih terdapat daun, bunga, dan polong.
c. Variabel pengacau tak terkendali
Keadaan patologis tikus jantan sebelum perlakuan.
C. Definisi Operasional
1. Infusa herba Mimosa pigra L. adalah infusa yang diperoleh dengan mengekstraksi herba segar Mimosa pigra L. dengan berat 11,34 g yang direbus dalam 50 mL aquadest selama 1 menit pada suhu 0 .
2. Efek hepatoprotektif adalah kemampuan suatu senyawa dalam melindungi sel hati dari kerusakan yang diinduksi oleh karbon tetraklorida sebagai senyawa model.
3. Herba Mimosa pigra L. adalah bagian tumbuhan di atas tanah, tidak termasuk batang utama dan merupakan percabangan muda berwarna hijau pada tanaman yang masih terdapat daun, bunga, dan polong.
4. Dosis optimum adalah dosis yang mampu mengembalikan fungsi hati paling besar yang paling mendekati fungsi normal ditinjau dari aktivitas serum ALT dan AST.
D. Bahan Penelitian
2. Bahan uji: infusa herba Mimosa pigra L. yang diperoleh dari tanah lapang di depan Student Resident Sanata Dharma, Paingan, Krodan, Maguwoharjo, Depok, Sleman, D. I. Yogyakarta pada pagi hari pukul 07.00 WIB.
3. Senyawa hepatotoksin adalah karbon tetraklorida Merck® berbentuk cair yang diperoleh dari Laboratorium Kimia Analisis Fakultas Farmasi Universitas Yogyakarta.
4. Kontrol negatif dan pelarut karbon tetraklorida: olive oil (minyak zaitun) Filippo Berio® berbentuk cair yang dibeli dari swalayan Indogrosir jalan Parangtritis Yoryakarta.
5. Kontrol positif: Silimarin berbentuk serbuk yang diperoleh dari Naturex France distributor PT. Megasetia Agung Kimia.
6. Pensuspensi Silimarin: CMC Na berbentuk serbuk yang diperoleh dari Laboratorium Farmakologi-Toksikologi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
7. Pelarut infusa herba Mimosa pigra L.: Aquadest yang diperoleh dari Laboratorium Farmakognosi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
8. Blanko untuk pengujian kadar GOT dan GPT: Aqua Bidestilata PT. Ikapharmindo Putramas Jakarta.
9. Pereaksi siap pakai untuk mengukur kadar ALT dan AST: reagen ALT dan AST DiaSys® yang dibeli dari Alfa Kimia Yogyakarta.
a. Komposisi reagen ALT adalah: R1: TRIS pH 7,15 140 mmol/L
LDH (lactatedehydrogenase) 2300 U/L R2: 2-Oxoglutarate 85 mmol/L
NADH 1 mmol/L Pyridoxal-5-phosphate
FS: Good’s buffer pH ,6 100 mmol/L Pyridoxal-5-phosphate 13 mmol/L b. Komposisi reagen AST adalah:
R1: TRIS pH 7,65 110 mmol/L L-Aspartate 320 mmol/L
MDH(malatedehydrogenase) 800 U/L LDH(lactatedehydrogenase) 1200 U/L R2: 2-Oxoglutarate 65 mmol/L
NADH 1mmol/L Pyridoxal-5-phosphate
FS: Good’s buffer pH 9,6 100 mmol/L Pyridoxal-5-phosphate 13mmol/L
E. Alat Penelitian
Alat yang digunakan pada perlakuan hewan uji adalah jarum tuberkulin dan spuit injeksi, pada saat pengambilan darah digunakan pipa kapiler dan Eppendorff. Penetapan aktivitas GPT-serum dan GOT-serum digunakan alat gelas, tabung reaksi, mikropipet, sentrifuge, dan micro-Vitalab.
F. Tata Cara Penelitian
1. Determinasi tanaman
dilakukan di Laboratorium Farmakognosi dan Fitokimia Universitas Sanata Dharma Yogyakarta menggunakan buku karangan Backer (1963).
2. Pengumpulan bahan uji
a. Hewan uji
Tikus jantan yang digunakan berasal dari Laboratorium Imono Universitas Sanata Dharma Yogyakarta dengan umur 2 – 3 bulan dan berat 130 – 200 g.
b. Herba Mimosa pigra L.
Tanaman yang digunakan adalah herba Mimosa pigra L. yang masih segar, berwarna hijau terdapat daun, bunga, dan polong. Diperoleh dari tanah lapang di depan Student Resident Sanata Dharma, Paingan, Krodan, Depok, Sleman, D. I. Yogyakarta
3. Pembuatan larutan karbon tetrakloridadalam olive oil
Dengan perbandingan karbon tetraklorida dengan olive oil 1:1, keduanya diambil dengan seksama dan dicampur hingga homogen di dalam gelas kimia.
4. Pembuatan infusa herba Mimosa pigra L.
Herba Mimosa pigra L. ditimbang sebanyak 11,34 g kemudian direndam dengan 50 mL aquadest dalam gelas stainless steel. Gelas direndam dalam panci berisi aquadest kemudian dipanaskan hingga suhu di gelas stainless steel mencapai 0 , lalu pada suhu tersebut dipertahankan hingga
menggunakan aquadest panas hingga tanda batas pada labu ukur tersebut melalui herba yang tertahan di kertas saring, untuk mengganti aquadest yang hilang selama infundasi.
5. Penetapan dosis infusa herba Mimosa pigra L.
Penetapan dosis berdasarkan bobot tertinggi tikus dan setengah dari volume pemberian maksimum tikus, yaitu 2,5 mL. Perhitungan dosis menggunakan rumus sebagai berikut
D x BB (bobot tertinggi tikus) = C (g/mL) x V(mL) Dosis x Bobot tertinggi tikus = Konsentrasi Ekstrak (g/mL) x 2,5 mL Hasil dari perhitungan tersebut dibagi 1,5 untuk sebagai dosis II, kemudian dibagi 2,25 sebagai dosis I.
6. Pembuatan suspensi ekstrak Silimarin
Terlebih dahulu membuat larutan CMC-Na 1% dengan cara melarutkan 1 g CM-Na yang telah ditimbang seksama ke dalam 100 mL aquadest pada labu ukur. Kemudian 50 mL CMC-Na 1% disuspensikan dengan serbuk ekstrak kering silimarin lalu dilakukan penggojogan agar serbuk ekstrak kering silimarin dapat tersuspensi dengan baik.
7. Uji pendahuluan
a. Penetapan dosis hepatotoksin
tersebut terjadi kenaikan ALT dan AST pada tikus jantan galur wistar namun tidak mengalami kematian.
b. Penetapan waktu cuplikan darah
Sebanyak 2 mL/KgBB karbon tetraklorida dipejankan pada tikus jantan pada 0, 24, 48, 72 jam kemudian dilihat waktu yang menyebabkan kenaikan kadar ALT dan AST yang paling tinggi atau 3 kali dari batas normal (Walker et al., 2009) maka waktu tersebut ditetapkan sebagai waktu pencuplikan dalam penelitian ini.
c. Penetapan waktu pemberian infusa herba Mimosa pigra L.
Pemberian infusa dilakukan 6 hari berturut-turut dengan jam yang sama disetiap harinya kemudian pada hari ke tujuh dilakukan pemejanan dengan karbon tetraklorida (Apriyanto, dkk., 2000).
8. Pengelompokan dan perlakuan hewan uji
perlakuan, tikus kelompok I-IV diambil darahnya melalui vena orbitalis untuk mendapatkan serumnya kemudian diukur aktivitas serum ALT dan AST.
Tikus kelompok V diberi infusa herba Mimosa pigra L. peringkat dosis terendah, yaitu 1,260 g/KgBB secara per oral. Tikus kelompok VI diberi infusa herba Mimosa pigra L. peringkat dosis kedua, yaitu 1,890 g/KgBB secara per oral. Tikus kelompok VII diberi infusa herba Mimosa pigra L. peringkat dosis tertinggi, yaitu 2,835 g/KgBB secara per oral. Tikus kelompok V, VI, dan VII diberikan infusa herba Mimosa pigra L. selama enam hari berturut-turut kemudian hari ke-7 dipejan dengan 2 mL/KgBB karbon tetra klorida dalam olive oil dengan perbandingan 1:1 secara intraperitoneal. Pada hari ke-8 diambil darahnya melalui vena orbitalis untuk mendapatkan serumnya. Masing-masing cuplikan ditentukan aktivitas ALT dan AST serumnya secara spektrofotometer.
9. Pembuatan serum
Tikus jantan galur Wistar diambil darahnya melalui vena orbitalis mata kemudian darah ditampung ke dalam Eppendorff melalui dinding untuk menghindari lisis, kemudian disentrifuge selama 10 menit dengan kecepatan 5000 rpm dan diambil supernatannya (serum).
10. Penetapan aktifitas ALT dan AST
reaksi. Diamkan selama Operating Time (OT), yaitu 1 menit kemudian diukur aktifitas serum ALT. Pengukuran AST dilakukan dengan mengambil serum sebanyak 100 µL, ditambahkan reagen I (TRIS pH 7.65, L-Alanin, dan Laktat Dehidrogenase) sebanyak 1000 µL kemudian ditambah reagen II (2-oksoglutarat dan NADH) sebanyak 250 µL, divortex dalam tabung reaksi. Diamkan selama OT, yaitu 1 menit kemudian diukur aktifitas serum AST.
Pengukuran kadar ALT dan AST dilakukan di Laboratorium Biokimia dan Fisiologi Manusia Fakultas Farmasi Universitas Sanata Dharma menggunakan Mikro Vitalab-2000 pada panjang gelombang 340 nm, dan dinyatakan dengan satuan U/L.
Perhitungan persen efek hepatoprotektif terhadap hepatotoksin karbon tetraklorida diperoleh dengan rumus:
[ ]
[ ]
(Wakchaure, Jain, Singhai, dan Somani, 2013). 11. Analisis hasil
yang berbeda bermakna, sedangkan jika diperoleh hasil p>0,05 artinya terdapat kelompok yang berbeda tidak bermakna.
33 BAB IV
HASIL DAN PEMBAHASAN
Tujuan dari penelitian ini adalah untuk mengetahui efek hepatoprotektif infusa herba Mimosa pigra L. pada tikus jantan yang terinduksi suatu senyawa model yaitu karbon tetraklorida. Penelitian yang dilakukan merupakan pengembangan dari penelitian sebelumnya mengenai infusa herba Mimosa pigra L. dengan senyawa penginduksi paracetamol. Pada penelitian ini akan diukur secara kuantitatif aktivitas serum ALT dan AST sebagai indikator kerusakan hati yang terjadi pada tikus jantan.
A. Penyiapan Bahan
1. Hasil determinasi tanaman
2. Pembuatan infusa herba Mimosa pigra L.
Dalam penelitian ini, pembuatan infusa herba Mimosa pigra L. menggunakan metode infundasi. Pemilihan metode infundasi dikarenakan metode ini secara empiris sama seperti yang dilakukan oleh masyarakat yaitu merebus tanaman segar, sehingga mudah diaplikasikan dalam kehidupan sehari-hari. Dalam penelitian yang dilakukan oleh Xu, Chen, Xhang, Jiang, dan Ye (2008) menunjukkan bahwa senyawa fenolik dan flavonoid dapat terekstrak dengan baik menggunakan pelarut air panas, yaitu menggunakan metode infundasi. Selain itu pada penelitian Apriyanto, dkk. (2001) juga menggunakan metode infusa.
Proses infundasi yang pertama dilakukan adalah menimbang herba segar Mimosa pigra L. sebanyak 11,34 g kemudian direndam dengan 50 mL aquadest pada gelas stainless steel, pastikan bahwa seluruh herba terendam oleh aquadest agar seluruh metabolit sekunder dapat terekstrak dengan baik. Gelas stainless steel digunakan agar kandungan flavonoid pada herba Mimosa pigra L. tidak rusak apabila menggunakan gelas dari bahan aluminium. Bahan herba Mimosa pigra L. diambil setiap pagi hari jam 07.00 WIB. Tanaman segar juga memiliki kelebihan dibandingkan dengan yang sudah melewati pengeringan karena pada fase pengeringan banyak sekali mendegradasi kandungan senyawa kimia yang terkandung di dalam tanaman tersebut. Kemudian tanaman Mimosa pigra L. yang digunakan adalah seluruh tanaman atau herba agar kandungan kimia yang didapat dari tanaman Mimosa pigra L. banyak.
aktu ang dibutuhkan selama proses infundasi adalah 1 menit,
penangas kemudian dilakukan penyaringan menggunakan corong dan kertas saring ke dalam labu ukur 50 mL. Kemudian untuk mengganti pelarut yang hilang selama pemanasan maka ditambahkan aquadest panas melewati ampas herba Mimosa pigra L. hingga batas tanda. Penambahan aquadest harus melewati ampas herba Mimosa pigra L. yang tertahan di kertas saring bertujuan agar dapat mengekstrak herba yang masih tersisa.
Metode infundasi juga memiliki kelemahan yaitu tidak dapat digunakan jika sudah melebihi waktu 24 jam. Hal ini disebabkan oleh kandungan air yang tinggi pada infusa sehingga memungkinkan mikroorganisme terutama kapang dan khamir untuk berkembang. Pada penelitian ini pembuatan infusa dilakukan setiap hari sebelum melakukan pemejanan.
B. Uji Pendahuluan
1. Penetapan dosis hepatotoksin
Pemberian secara intraperitoneal dimaksudkan agar karbon tetraklorida dapat bereaksi lebih cepat jika dibandingkan dengan pemberian per oral, karena pada pemberian per oral dimungkinkan senyawa tersebut rusak oleh enzim pencernaan. 2. Penetapan dosis infusa Mimosa pigra L.
Pada penelitian ini dosis infusa herba Mimosa pigra L. yang digunakan mengacu penelitian Apriyanto, dkk. (2000). Namun pada penelitian Apriyanto, dkk. (2000) menggunakan 4 peringkat dosis dengan dosis terendah sebesar 0,84 g/KgBB, dosis tersebut tidak digunakan dalam penelitian ini karena hasil penelitian dari dosis 0,84 g/KgBB tidak lebih baik dari dosis 1,26 g/KgBB sehingga hanya digunakan 3 peringkat dosis, yaitu 1,26 g/KgBB, 1,89 g/KgBB, dan 2,835g/KgBB.
3. Penentuan dosis kontrol positif Silimarin
dalamnya. Digunakan CMC-Na karena ekstrak Silimarin sulit larut oleh air karena kelarutannya dalam air hanya 0,04 mg/mL (Javed, Kohli, dan Ali, 2011).
4. Penentuan waktu pencuplikan darah
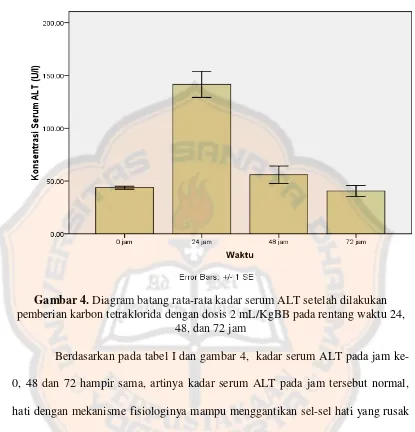
Untuk menentukan waktu pencuplikan dilakukan orientasi dengan memberikan hepatotoksin karbon tetraklorida dosis 2 mL/KgBB pada rentang waktu 24, 48, dan 72 jam, pada masing-masing waktu tersebut tikus diambil darahnya lalu diukur kadar serum ALT dan AST. Sebelum dilakukan pemejanan karbon tetraklorida, tikus diambil darahnya untuk melihat kadar serum ALT dan AST pada jam ke-0 atau keadaan normal, sehingga daapt diketahui peningkatan kadar serum ALT dan AST setelah pemejanan karbon tetraklorida. Tujuan penentuan waktu pencuplikan darah adalah untuk mengetahui waktu terjadinya peningkatan kadar serum ALT dan AST yang paling tinggi sebagai indikator kerusakan hati paling parah. Kemudian waktu tersebut digunakan sebgai acuan untuk pencuplikan darah tikus dalam penelitian ini.
Berikut adalah hasil orientasi untuk kadar serum ALT.
Tabel I. Kadar serum ALT setelah dilakukan pemberian karbon tetraklorida dengan dosis 2mL/KgBB pada rentang waktu 24, 48, dan 72 jam
Keterangan: SE=Standard Error
Selang Waktu (jam) Purata Kadar Serum ALT ± SE (U/L)
0 43,8 ± 1,4
24 141,6 ± 12,4
48 56,0 ± 8,3
Gambar 4.Diagram batang rata-rata kadar serum ALT setelah dilakukan pemberian karbon tetraklorida dengan dosis 2 mL/KgBB pada rentang waktu 24,
48, dan 72 jam
tiga kali dari normal adalah perlemakan hati. Kerusakan hati juga dapat diinduksi menggunakan senyawa model lain seperti Galaktosamin. Galaktosamin memiliki mekanisme seperti virus hepatitis dan mengakibatkan nekrosis pada hati. Galaktosamin akan membentuk metabolit galaktosamin-1-pospat yang akan menghambat pembentukan polisakarida, glikogen, dan glukoronat ( Keppler dan Decker, 1969). Berikut adalah hasil uji statistik kadar serum ALT pada waktu pencuplikan jam ke-24, 48, dan 72 (Tabel 2).
Tabel II. Perbedaan peningkatan kadar serum ALT setelah pemberian karbon tetraklorida dengan dosis 2 mL/KgBB pada rentang waktu 24, 48, dan 72 jam
Jam 0 Jam 24 Jam 48 Jam 72
Jam 0 BB BTB BTB
Jam 24 BB BB BB
Jam 48 BTB BB BTB
Jam 72 BTB BB BTB
Keterangan: BB= Berbeda bermakna (p<0.05); BTB= Berbeda tidak bermakna (p>0,05).
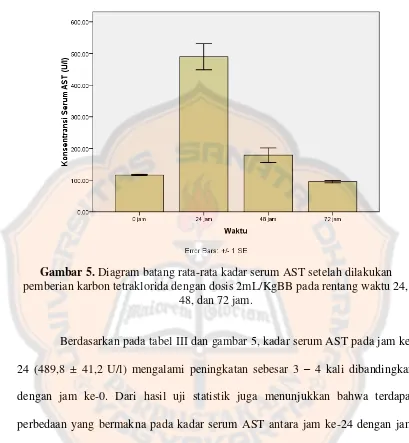
Pada kadar serum AST juga dilakukan orientasi, berikut adalah hasil orientasinya. Tabel III. Kadar serum AST setelah dilakukan pemberian karbon tetraklorida
dengan dosis 2mL/KgBB pada rentang waktu 24, 48, dan 72 jam
Keterangan: SE=Standard Error
Selang Waktu (jam) Purata Kadar Serum AST ± SE (U/L)
0 116,2 ± 2,2
24 489,8 ± 41,2
48 179,0 ± 22,7
Gambar 5.Diagram batang rata-rata kadar serum AST setelah dilakukan pemberian karbon tetraklorida dengan dosis 2mL/KgBB pada rentang waktu 24,
48, dan 72 jam.
terdapat juga di organ lainnya seperti otot rangka dan jantung (Fancher, Kamboj, dan Onate, 2007). Stres oksidatif tidak hanya terjadi pada hati namun pada otot rangka dan jantung. Selain itu, organ yang memiliki kemampuan untuk melakukan regenerasi sel hanya hati. Pada uji statistik jam ke-72 kadar serum AST juga memberikan hasil yang berbeda bermakna dengan jam ke-0, namun sebenarnya kadar serum AST sudah turun ke batas normal dengan kata lain peningkatan paling besar hanya pada jam ke-24. Digunakannya data kadar serum AST meskipun aktivitasnya tidak secara spesifik di hati ini bertujuan untuk digunakan sebagai data pendukung terjadinya kerusakan hati.
Tabel IV. Perbedaan peningkatan kadar serum AST setelah pemberian karbon tetraklorida dengan dosis 2mL/KgBB pada rentang waktu 24, 48, dan 72 jam
Jam 0 Jam 24 Jam 48 Jam 72
Jam 0 BB BB BB
Jam 24 BB BB BB
Jam 48 BB BB BB
Jam 72 BB BB BB
Keterangan: BB= Berbeda bermakna (p<0.05); BTB= Berbeda tidak bermakna (p>0,05).
C. Efek Hepatoprotektif Infusa Herba Mimosa pigra L. terhadap Tikus Jantan
Kelompok perlakuan pada penelitian ini akan diberikan infusa herba
Mimosa pigra L. dengan 3 peringkat dosis yaitu dosis 2,835, 1,89, dan 1,26 g/KgBB secara per oral selama 6 hari berturut-turut pada jam yang sama.
Setelah itu pada hari ke-7 diberikan hepatotoksin karbon tetraklorida secara intraperitoneal, kemudian setelah 24 jam hewan uji diambil darahnya dan diukur kadar serum ALT dan AST. Waktu pencuplikan darah 24 jam didasarkan pada orientasi yang sudah dilakukan sebelumnya.
Tabel V. Pengaruh perlakuan infusa herba Mimosa pigra L. dilihat dari aktivitas serum ALT dan AST pada berbagai peringkat dosis terhadap hepatotoksin karbon
tetraklorida
Kelompok I : Kontrol Hepatotoksin (Karbon tetraklorida) 2 mL/KgBB Kelompok II : Kontrol Negatif (olive oil) 2 mL/KgBB
Kelompok III : Kontrol Infusa Herba Mimosa pigra L. dosis 2,835 g/KgBB Kelompok IV :Kontrol Positif Silimarin 25 mg/KgBB + CCl4 2 mL/KgBB Kelompok V :Perlakuan Infusa Herba Mimosa pigra L. dosis 1,26 g/KgBB +
CCl4 2 mL/KgBB
Kelompok VI :Perlakuan Infusa Herba Mimosa pigra L. dosis 1,89 g/KgBB + CCl4 2 mL/KgBB
Gambar 6. Diagram batang aktivitas serum ALT tikus jantan pada perlakuan berbagai peringkat dosis infusa herba Mimosa pigra L.
Tabel VI. Hasil uji statistik aktivitas serum ALT tikus jantan pada perlakuan berbagai peringkat dosis infusa herba Mimosa pigra L
Kelompok I II III IV V VI VII
I BB BB BB BTB BTB BB
II BB BB BB BB BB BB
III BB BB BTB BB BB BB
IV BB BB BTB BTB BTB BB
V BTB BB BB BTB BTB BB
VI BTB BB BB BTB BTB BB
VII BB BB BB BB BB BB
Keterangan : BB= Berbeda bermakna; BTB = Berbeda tidak bermakna Kelompok I : Kontrol Hepatotoksin (Karbon tetraklorida) 2 mL/KgBB Kelompok II : Kontrol Negatif (olive oil) 2 mL/KgBB
Kelompok III : Kontrol Infusa Herba Mimosa pigra L. dosis 2,835 g/KgBB Kelompok IV :Kontrol Positif Silimarin 25 mg/KgBB + CCl4 2 mL/KgBB Kelompok V :Perlakuan Infusa Herba Mimosa pigra L. dosis 1,26 g/KgBB +
CCl4 2 mL/KgBB
Kelompok VI :Perlakuan Infusa Herba Mimosa pigra L. dosis 1,89 g/KgBB + CCl4 2 mL/KgBB
Gambar 7. Diagram batang aktivitas serum AST tikus jantan pada perlakuan berbagai peringkat dosis infusa herba Mimosa pigra L.
Tabel VII. Hasil uji statistik aktivitas serum AST tikus jantan pada perlakuan berbagai peringkat dosis infusa herba Mimosa pigra L.
Kelompok I II III IV V VI VII
I BB BB BB BTB BTB BB
II BB BTB BTB BB BB BTB
III BB BTB BB BB BB BTB
IV BB BTB BB BTB BB BB
V BTB BB BB BTB BTB BB
VI BTB BB BB BB BTB BB
VII BB BTB BTB BB BB BB
Keterangan : BB= Berbeda bermakna; BTB = Berbeda tidak bermakna Kelompok I : Kontrol Hepatotoksin (Karbon tetraklorida) 2 mL/KgBB Kelompok II : Kontrol Negatif (olive oil) 2 mL/KgBB
Kelompok III : Perlakuan Infusa Herba Mimosa pigra L. dosis 2,835 g/KgBB Kelompok IV :Kontrol Positif Silimarin 25 mg/KgBB + CCl4 2 mL/KgBB Kelompok V :Perlakuan Infusa Herba Mimosa pigra L. dosis 1,26 g/KgBB +
CCl4 2 mL/KgBB
Kelompok VI :Perlakuan Infusa Herba Mimosa pigra L. dosis 1,89 g/KgBB + CCl4 2 mL/KgBB
1. Kontrol negatif
Penggunaan kontrol negatif memiliki tujuan untuk melihat apakah pelarut dari hepatotoksin karbon tetraklorida dapat mempengaruhi peningkatan kadar serum ALT dan AST jam ke-24 tikus jantan pada penelitian ini. Seperti yang sudah dijelaskan sebelumnya bahwa waktu pencuplikan darah yaitu jam ke-24. Kontrol negatif yang digunakan adalah olive oil dengan dosis seperti dosis hepatotoksin yaitu 2 mL/KgBB, pemberian dilakukan secara intraperitoneal.
Kadar serum ALT yang diperoleh pada jam ke-24 adalah 41,40 ± 3,0 U/l, kemudian dengan uji statistik menggunakan uji T berpasangan menunjukkan bahwa terdapat perbedaan yang tidak bermakna kadar serum ALT pada jam ke-24 dengan jam ke-0 (p=0,312) (Tabel VIII). Kadar serum AST pada jam ke-24 diperoleh hasil 113 ± 4,6 U/l, uji statistik menggunakan uji T berpasangan juga menunjukkan perbedaan yang tidak bermakna dengan jam ke-0 (p=0.096) (tabel IX). Hasil uji statistik kadar serum ALT dan AST antara jam ke-24 dengan jam ke-0 dapat dilihat pada Tabel VIII dan Tabel IX.
Tabel VIII. Aktivitas kadar serum ALT pada jam ke-0 dibandingkan dengan jam ke-24
Jam ke-0 Jam ke-24
Jam ke-0 BTB
Jam ke-24 BTB
Keterangan: BTB = Berbeda tidak bermakna
Tabel IX. Aktivitas kadar serum AST pada jam ke-0 dibandingkan dengan jam ke-24
Jam ke-0 Jam ke-24
Jam ke-0 BTB
Berdasarkan hasil tersebut, kadar serum ALT dan AST setelah diberikan olive oil 2 mL/KgBB terdapat perbedaan yang tidak bermakna dengan sebelum dilakukan pemejanan. Hal ini dapat dikatakan bahwa pelarut hepatotoksin karbon tetraklorida yaitu olive oil tidak mempengaruhi peningkatan kadar serum ALT dan AST pada tikus jantan galur Wistar pada penelitian ini.
2. Kontrol hepatotoksin
Kelompok kontrol hepatotoksin merupakan kelompok tikus jantan yang dipejan dengan hepatotoksin karbon tetraklorida dosis 2 mL/KgBB secara intraperitoneal. Tujuan dilakukannya kontrol hepatotoksin adalah untuk melihat sejauh mana kerusakan hati akibat pemejanan hepatotoksin karbon tetraklorida dosis 2 mL/KgBB yang dikaji dari peningkatan kadar serum ALT dan AST pada jam ke-24. Hasil pengukuran pada jam ke-24 menunjukkan kadar serum ALT sebesar 141,6 ± 12,4 U/l dengan peningkatan 3 kali dibanding kontrol negatif olive oil (41,4 ± 3,0 U/l) sedangkan kadar serum AST sebesar 489,8 ± 41,2 U/l dengan peningkatan lebih dari empat kali dibanding kontrol negatif olive oil.
dan AST kontrol negatif (p=0,009). Selanjutnya, peningkatan kadar serum ALT dan AST akibat hepatotoksin karbon tetraklorida 2 mL/KgBB secara intraperitoneal digunakan untuk menghitung seberapa besar infusa herba Mimosa pigra L. pada penelitian ini dapat melindungi hati dari kerusakan hati akut yaitu perlemakan hati.
3. Kontrol infusa Mimosa pigra L.
(Hughes dan Cook, 1996). Untuk penelitian selanjutnya dapat digunakan ekstrak etanol atau metanol agar senyawa kimia yang tersari lebih spesifik, atau dengan kata lain mengandung lebih banyak flavonoid karena flavonoid dalam herba Mimosa pigra L. merupakan senyawa kimia yang diyakini memiliki kemampuan sebagai hepatoprotektif sehingga dosis yang diberikan dapat lebih kecil untuk mencapai efek yang sama. Aktivitas serum AST pada jam ke-24 juga dilakukan pengukuran dan diperoleh hasil 104,2 ± 1,99 U/l. Hasil uji statistik pada aktivitas serum AST kontrol infusa herba Mimosa pigra L. dengan kontrol minyak adalah berbeda tidak bermakna (p=0,094). Berdasarkan hasil yang diperoleh diatas, dapat disimpulkan bahwa infusa herba Mimosa pigra L. dosis 2,835 g/KgBB dapat meningkatkan kadar serum ALT namun tidak meningkatkan kadar AST tikus jantan.
4. Efek hepatoprotektor berdasarkan perhitungan % hepatoprotektif
Untuk mengetahui % hepatoprotektif infusa herba Mimosa pigra L. dari penelitian ini terlebih dahulu dilakukan perhitungan menggunakan rumus.
aktivitas serum ALT dan AST. Dari hasil uji statistik kadar serum ALT dan AST pada tikus yang diberikan olive oil dengan kadar serum ALTdan AST pada tikus jam ke-0 memberikan perbedaan yang tidak bermakna sehingga dapat digunakan dalam perhitungan % hepatoprotektif.
Kontrol positif pada penelitian ini dilakukan dengan cara memberikan suspensi ekstrak Silimarin 25 mg/KgBB dalam CMC-Na 1% selama 6 hari berturut-turut lalu pada hari ke-7 diberikan hepatotoksin karbon tetraklorida 2 mL/KgBB, setelah 24 jam diambil darahnya dan diukur kadar serum ALT yang diperoleh sebesar 103,2 ± 12,0 U/l, serum ASTnya sebesar 203,6 ± 38,2 U/l. Hasil uji statistik jika dibandingkan dengan kontrol hepatotoksin karbon tetraklorida, aktivitas serum ALT (p=0,047) dan AST (p=0,009) menunjukkan perbedaan yang bermakna, kemudian jika dibandingkan dengan kontrol minyak olive oil menyatakan bahwa terdapat perbedaan yang bermakna pada kadar serum ALT (p=0,09), namun terdapat perbedaan yang tidak bermakna pada kadar AST (0,465). Dengan hasil yang diperoleh tersebut dapat disimpulkan bahwa Silimarin memiliki kemampuan untuk menurunkan kadar ALT dengan % hepatoprotektif 38,2 % dan tidak dapat menurunkan kadar AST hingga batas normal. Dalam penelitian ini kontrol positif Silimarin merupakan kontrol potensi di pasaran, sehingga dapat diketahui apakah infusa herba Mimosa pigra L. memiliki kemampuan yang lebih buruk, lebih baik, atapun sama dengan Silimarin yang sudah dikonsumsi oleh masyarakat luas.
berturut-turut lalu pada hari ke-7 diberikan hepatotoksin karbon tetraklorida 2 mL/KgBB secara intraperitonial, setelah 24 jam dilakukan pengukuran kadar
ALT dan AST. Diperoleh kadar ALT sebesar 112,4 ± 11,05 U/l dengan % hepatoprotektif sebesar 29,14%, jika dibandingkan dengan kontrol hepatotoksin
hasil berbeda bermakna (p=0,009), hal ini menunjukkan bahwa infusa herba Mimosa pigra L. dosis 1,89 g/KgBB tidak memiliki efek hepatoprotektif yang sama dengan suspensi ekstrak Silimarin. Dapat disimpulkan bahwa infusa herba Mimosa pigra L. dosis 1,89 g/KgBB memiliki kemampuan menurunkan kadar ALT dan AST pada tikus jantan terinduksi karbon tetraklorida.
Kelompok VII merupakan kelompok hewan uji pada penelitian ini yang diberikan peringkat dosis paling tinggi yaitu 2,835 g/KgBB selama 6 hari selama 6 hari berturut-turut lalu pada hari ke-7 diberikan hepatotoksin karbon tetraklorida 2 mL/KgBB secara intraperitonial, setelah 24 jam dilakukan pengukuran kadar
ALT dan AST. Diperoleh kadar ALT sebesar 60,6 ± 2,92 U/l dengan % hepatoprotektif 80,84 %. Uji statistik dilakukan untuk membandingkan dengan
Aktivitas serum AST juga dilakukan pengukuran, hasilnya sebesar 97 ± 6,79 U/l dengan % hepatoprotektif 104,25%. Berdasarkan hasil uji statistik dibandingkan dengan kontrol hepatotoksin karbon tetraklorida 2 mL/KgBB diperoleh hasil berbeda bermakna (p=0,009) sedangkan ketika dibandingkan dengan kontrol minyak olive oil diperoleh hasil berbeda tidak bermakna (p=0,075), maka dapat dikatakan bahwa infusa herba Mimosa pigra L. memiliki kemampuan menurunkan kadar serum AST sampai ke batas normal. Meskipun parameter aktivitas serum AST bukan yang utama namun dilihat dari hasil penelitian ini dicurigai infusa herba Mimosa pigra L. dosis 2,835 g/KgBB memiliki kemampuan sebagai kardioprotektor dan neuroprotektor karena dapat menurunkan kadar AST sampai batas normal, dimana AST tidak hanya diproduksi di hati saja namun juga diproduksi di otot rangka dan otot jantung. Uji statistik juga dilakukan untuk membandingkan dengan kontrol positif Silimarin 25 mg/KgBB, diperoleh hasil berbeda bermakna (p=0,047). Hal ini menunjukkan bahwa infusa herba Mimosa pigra L. memiliki kemampuan sebagai hepatoprotektif yang lebih baik dalam menurunkan kadar AST jika dibandingkan Silimarin 25 mg/KgBB. Dapat disimpulkan bahwa infusa herba Mimosa pigra L. dosis 2,835 g/KgBB memiliki kemampuan menurunkan kadar ALT dan AST dengan prosentase yang cukup besar dan lebih baik dari kontrol positif Silimarin 25 mg/KgBB.
L. yang bertindak sebagai hepatoprotektif adalah golongan flavonoid mirisitrin dan kuersetin, untuk mengetahui seberapa besar kandungan flavonoid dalam infusa herba Mimosa pigra L. dosis 2,835 g/KgBB yang dapat menurunkan kada ALT dan AST maka dapat dilakukan uji flavonoid total.
D. Rangkuman Pembahasan
Tujuan dari penelitian ini adalah untuk mengetahui efek hepatoprotektif infusa herba Mimosa pigra L. pada tikus jantan yang terinduksi suatu senyawa model yaitu karbon tetraklorida. Dalam penelitian ini digunakan tiga peringkat dosis infusa herba Mimosa pigra L. yaitu 1,26; 1,89; 2,835 g/KgBB untuk melihat kemampuan hepatoprotektif berdasarkan perhitungan % hepatoprotektif. Secara berturut-turut hasil perhitungan % hepatoprotektif kadar ALT dari peringkat dosis 1,26; 1,89; 2,835 g/KgBB adalah 29,14%; 6,38%; dan 80,84% sedangkan hasil perhitungan % hepatoprotektif kadar AST berturut-turut 29,14%; 16,67%; dan 104,25%. Hasil ini sesuai dengan hipotesis penelitian ini bahwa infusa herba Mimosa pigra L. memiliki kemampuan sebagai senyawa hepatoprotektif terhadap induksi karbon tetraklorida yang dilihat dari kadar ALT dan AST.
hasilnya lebih tinggi dari normal (kontrol minyak olive oil). Dapat disimpulkan bahwa peningkatan kadar serum ALT dan AST pada tikus jantan disebabkan oleh senyawa model karbon tetraklorida saja.
Dosis optimum infusa herba Mimosa pigra L. adalah pada peringkat dosis tertinggi yaitu 2,835 g/KgBB. Hal ini didasarkan pada uji statistik yang dilakukan ketika dibandingkan dengan kontrol negatif (olive oil) pada kadar ALT memberikan hasil berbeda tidak bermakna (p=0,009) dan pada kadar AST memberikan hasil berbeda bermakna (p=0,075). Dosis infusa herba Mimosa pigra L. 2,835 g/KgBB paling baik hasilnya karena selain % hepatoprotektif paling tinggi, pada dosis 1,26 dan 1,89 g/KgBB terdapat perbedaan yang tidak bermakna dengan kontrol hepatotoksin karbon tetraklorida 2 mL/KgBB. Kemudian dilihat
dari presentase hepatoprotektif yang diperoleh pada dosis optimum 2,835 g/KgBB, % hepatoprotektif pada aktivitas AST lebih baik daripada % hepatoprotektif aktivitas AST sehingga dapat dilakukan penelitian lebih lanjut mengenai uji efek kardioprotektor dan neuroprotektor karena enzim AST tidak hanya diproduksi di hati namun juga diproduksi di otot rangka dan otot jantung.