BAB 2
TINJAUAN PUSTAKA
2.1. Meningioma
2.1.1. Sejarah dan Definisi
Meningioma adalah sebuah penamaan yang diberikan oleh Harvey Cushing pada tahun 1922 untuk mendeskripsikan suatu tumor jinak pada selaput
otak susunan saraf pusat (Al-Rodhan dan Laws, 1991).
Pada abad 18 dan 19 meningioma hanya dapat terdiagnosa pada pasien bila pasien tersebut mengalami perubahan pada tulang tengkorak yang didekatnya, sehingga tampak pada inspeksi maupun palpasi. Hanya sedikit usaha pembedahan yang dilakukan untuk mengangkat lesi ini, dan hanya sedikit saja yang menguntungkan pasien. Dari 13 operasi yang dilakukan antara tahun 1743 dan 1896, 9 pasien mengalami kematian.
Pada 1894 John Cleland, seorang profesor anatomy di Glasgow menemukan bahwa dua tumor meningioma yang ditemukannya di ruang diseksi, berasal dari arachnoid dan bukan duramater. Pada 1915 pendapat ini kembali ditegaskan oleh Cushing dan Weed (Louis et al, 2000).
2.1.2. Epidemiologi
Pada penelitian di Rochester, Minnesota, Amerika Serikat, yang dilakukan pada tahun 1935 hingga 1977, meningioma terdistribusi sebanyak 40%, tetapi penelitian epidemiologi tahun 1985 di negara yang sama melaporkan 20% dari tumor intrakranial adalah meningioma dengan insiden kejadian meningioma yang semakin meningkat seiring dengan pertambahan usia, sebesar 4,4 per 100.000 orang pertahun. Meningioma terdiagnosis pada rata-rata penderita berumur 63 tahun (Marwin et al, 2010) dengan predominasi perempuan
terhadap laki-laki dengan rasio sebesar 2 : 1. Pada anak-anak, meningioma kerap terjadi 1% hingga 4% dari semua tumor otak. Umur rata-rata pada saat terdiagnosis adalah 11,6 tahun, dibandingkan dengan umur 6,3 tahun untuk tumor-tumor intrakranial lainnya pada anak (Otsuka et al, 2004; Al-Mefty et al, 2011).
2.1.3. Patologi
Meningioma biasanya berbentuk globular dan berkapsul. Tumor ini melekat pada dura dan dapat menekan jaringan otak yang berdekatan tanpa menginvasinya. Walaupun invasi dura dan sinus biasa terjadi, meningioma biasanya mudah dipisahkan dari pia mater (Al-Mefty et al, 2011). Meningioma berasal dari lapisan neuroektodermal yang membentuk arachnoid cap cells, yang membentuk lapisan luar dari selaput araknoid dan vili araknoid. Seiring dengan pertambahan umur, kelompok-kelompok arachnoid cap cell akan menjadi lebih jelas, membentuk whorls dan psammoma bodies yang identik dengan meningioma (Psammos dalam bahasa Yunani memiliki pengertian ‘pasir’). Meningioma memiliki tampilan mesenkimal (sel berbentuk spindle dan produksi stroma kolagen) dan epitelial (sitologi bulat atau poligonal, adanya sejumlah
Pada gambaran struktur ultra yang tampak pada mikroskop elektron, meningioma memiliki gambaran yang menyerupai vili arachnoid normal: interdigitasi yang prominen dari membran plasma, filamen intermediate sitoplasma yang sangat banyak dan secara imunohistokimia konsisten dengan vimentin, dijumpainya hemidesmosome, dan deposit interselular fokal yang terdiri dari material granular yang kaya elektron. Arachnoid dan sel meningioma terhubung oleh epithelial cadhenrins (E-cadherins), yang merupakan molekul adhesi yang tergantung Ca2+, dan keduanya mengekspresikan
gluotathione-independent prostaglandin D2 synthase.
Gambaran histologi meningioma meningothelial (syncytial) memiliki ciri sel yang tersusun rapat dengan batas sitoplasma yang tidak jelas.
2.1.4. Klasifikasi
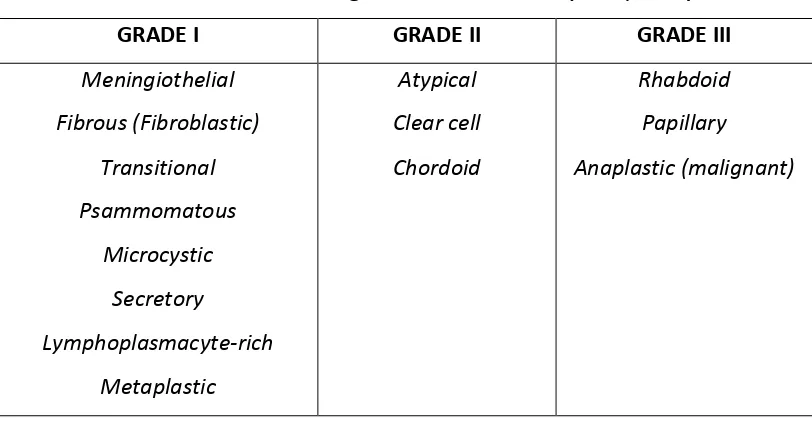
Pada tahun 2000, WHO mengklasifikasikan meningioma pada bagian tumor-tumor dari susunan saraf pusat (Tumors of the nervous system) di bawah bagian tumor dari meninges dan sub-bagian tumor dari sel-sel meningothelial. WHO mengenal tiga derajat berdasarkan kriteria patologinya dan risiko rekurensi serta pola pertumbuhannya (Al-Mefty et al, 2011).
Menurut klasifikasi WHO, meningioma dibagi menjadi 3 grade, yaitu Jinak (Benign : Grade I), Atipikal (Atypical : Grade II), dan Ganas (Malignant :
infratentorial (13%), dan lain-lain (4%) (Otsuka, 2004; Louis, 2000; Marwin et al, 2010).
Lokasi umum meningioma primer dari urutan paling sering adalah parasagital, cavernous, tubercullum sellae, lamina cribrosa, foramen magnum, zona torcular, tentorium cerebelli, sudut serebelopontin, dan sinus sigmoid. Meningioma dengan frekuensi lebih rendah dapat terjadi di medula spinalis, intraventricular, orbita (optic nerve sheath dan foramina opticum), intraoseus (tulang temporal petrosa), pineal, ekstrakalvaria, dan ektopik (cavum nasi, sinus
paranasal, glandula parotis, paru-paru, glandula adrenal, dan mediastinum (Chou dan Miles, 1991; Otsuka, 2010).
Selain yang telah disebutkan di atas, berdasarkan Bitzer et al (1998), lokasi meningioma dapat diklasifikasikan berdasarkan lokasinya pada konveksitas, falx, sphenoid wing, frontobasal, temporobasal, supraselar, tentorial, infratentorial, dan lainnya.
Berdasarkan pola pertumbuhannya, meningioma dapat tumbuh sebagai suatu masa (en masse) atau tumbuh memanjang seperti karpet (en plaque). Varian en plaque pada awalnya dideskripsikan oleh Cushing sebagai suatu karakteristik tipikal meningioma sphenoid ridge, yang dapat juga disebut sebagai “hyperostosing en plaque meningiomas”. Deskripsi ini kemudian direvisi oleh Bonnal pada tahun 1980, dengan tipe-tipe dari meningioma sphenoid ridge
Tabel 2.1. Grade meningioma menurut WHO (Louis, 2000)
Secara mikroskopis, meningioma fibroblastic menunjukkan gambaran sel
spindel yang memanjang dan tersusun berlapis-lapis. Stroma terdiri dari serat reticulin dan kolagen. Meningioma transitional merupakan kombinasi tipe meningothelial dan fibroblastic. Tipe ini memiliki ciri kumparan selular, yang dipisahkan oleh sel spindel yang memanjang. Variasi pada histologi meningioma dapat menunjukkan mutasi pada lokus genetik yang berbeda, dimana loss of
heterozytosity pada kromosom 22 lebih umum dijumpai pada tipe fibroblastic dibanding varian meningothelial (Chou dan Miles, 1991).
Banyak varian meningioma lain yang telah dilaporkan termasuk psammomatous, angiomatous, microcystic (humid), xanthomatous, lipoblastic, myxoid (myxomatous), osteoblastic, chondroblastic, secretory, melanotic, lymphofollicular, chordoid, hemangiopericytic, oncocytic, dan papillary. Tidak semua istilah untuk varian ini digunakan pada saat ini.
tak berpola atau sheetlike growth, dan fokus nekrosis. Untuk varian ini, peningkatan aktifitas mitosis telah dideskripsikan sebagai empat atau lebih mitosis per 10 kali pembesaran kuat (high power field). (Otsuka, 2010).
Definisi pasti dari meningioma maligna dan anaplastik masih menjadi perdebatan. Satu ciri khusus yang tidak diragukan lagi menjadi ciri meningioma maligna adalah: metastasis ekstraneural jauh. Tempat tersering yang menjadi metastase meningioma adalah liver, paru, pleura, dan lymph nodes.
Pemeriksaan epithelial membrane antigen (EMA) adalah positif pada 80%
meningioma. Hasil pewarnaan S-100 adalah cukup bervariasi. Meningioma juga mengekspresikan marker untuk fibroblasts (vimentin) dan sel epitel (EMA dan cytokeratins). Antileu7, merupakan antibody yang ditemuaka pada schwannoma, tidak ditemukan pada meningioma. Glial fibrillary acidic protein (GFAP) juga negatif pada meningioma. Meningioma meningothelial dan syncytial mengekspresikan E-cadherin. (Talacchi et al, 2011).
2.1.5. Radiologi
Foto polos pada meningioma menunjukkan tiga temuan khas: hyperostosis, peningkatan gambaran vaskularisasi, dan kalsifikasi. Pada CT non kontras, meningioma secara tipikal menunjukkan gambaran isodense sampai sedikit hyperdense. Kalsifikasi dapat dijumpai. Meningioma biasanya menyangat kontras dengan homogen dan kuat. Tumor ini berbatas tegas dan biasanya terletak pada struktur tulang atau pun dura. Manifestasi perubahan tulang yang sering dijumpai adalah hyperostosis. Sekitar 15% meningioma benigna memiliki gambaran yang tidak khas, termasuk nekrosis sentral atau dijumpainya kavitasi kista (cystic meningioma). Edema peritumoral yang mengelilingi meningioma bervariasi. Dura mater yang melekat dapat menunjukkan penyangatan kontras, temuan ini dikenal sebagai dural tail.
Gambaran hyperintense pada T2WI mengindikasikan tingginya kandungan air,
sering dijumpai pada meningioma meningothelial, vaskular, atau yang agresif.
2.1.6. Terapi pembedahan dan rekurensi tumor
Terapi definitif satu-satunya untuk meningioma adalah reseksi bedah total. Semakin sedikit tumor yang tersisa, akan memberikan kesempatan rekurensi tumor yang lebih kecil. Pada 1957 Simpson memperkenalkan lima tingkatan klasifikasi untuk reseksi bedah pada meningioma (Tabel 2.2.).
Tabel 2.2. Simpson Grading Sistem (Simpson, 1957)
GRADE DESCRIPTION 10 Years Recurrence
I Macroscopically complete tumor remofal with excision of the
tumor’s dural attachment and any abnormal bone
9 %
II Macroscopically complete tumor removal with coagulation of its
dural attachment
19%
III Macroscopicallay complete removal of the intradural tumor
without resection of coagulation of its dural attachment or
extradural extension
29%
IV Subtotal removal of the tumor 40%
V Simple decompression of the tumor
Rekurensi untuk grade I adalah sekitar 10%; tumor dengan grade II memiliki angka rekurensi dua kali lebih tinggi. Angka rekurensi tumor jauh lebih tinggi sesuai dengan Simpson grade. Reseksi tumor yang menyertakan reseksi tambahan pada dura mater sejauh 2 cm dikenal sebagai grade 0. Pada satu studi disebutkan bahwa tidak dijumpai rekurensi pada pasien yang mendapatkan reseksi dengan Simpson grade 0. (Talacchi et al, 2011)
2.1.7. Prognosis
pada ala sphenoidalis atau invasi struktur yang penting seperti sinus venosus akan menimbulkan kesulitan dalam total removal dari tumor sehingga menimbulkan angka rekurensi yang tinggi. Walaupun meningioma yang berbatas tegas dapat diangkat secara keseluruhan, meningioma yang memiliki ekstensi ke ruang subdural (10% kasus) akan sulit untuk direseksi seluruhnya, seperti pada meningioma en plaque. Selain dari invasi parenkim dan lokasi anatomi, rekurensi juga kerap terjadi pada meningioma yang memiliki profil ganas, seperti pada pola hemangiopericytic atau papiler. Kriteria selular keganasan adalah adanya mitosis,
peningkatan selularitas, polimorfisme inti sel, dan nekrosis fokal. Indeks mitosis yang tinggi juga salah satu aspek yang mengarah pada keganasan (Al-Mefty et al, 2011).
2.2. Protein S100
Anggota dari ‘S100 protein family’ merupakan protein multifungsional dengan berbagai peran dalam proses selular. Protein S100 bekerja dengan perantaraan ikatan kalsium, walaupun nampaknya Zn2+ dan Cu2+ juga memiliki peranan dalam aktifitas biologis protein ini.
Anggota ‘S100 protein family’ yang paling banyak dipelajari adalah protein S100B, yang memiliki aktifitas neurotropik (pada konsentrasi fisiologis) atau neurotoksik (pada konsentrasi tinggi). Ekspresi protein ini baik pada serum maupun pada pewarnaan imunohistokimia dijumpai pada berbagai kelainan klinis. Ekspresi imunohistokimia protein ini telah secara umum dikenal sebagai petanda untuk tumor schwannoma dan melanoma.
2.2.1. Struktur dan Fungsi Protein S100
‘S100 protein family’ memiliki subgrup lengan EF pengikat Ca2+. Protein ini disebut S100 dikarenakan kelarutannya dalam ammonium sulfat pada pH normal sebesar 100%. Protein ini pertama kali diidentifikasi oleh B.W.Moore pada 1965 (Moore, 1965).
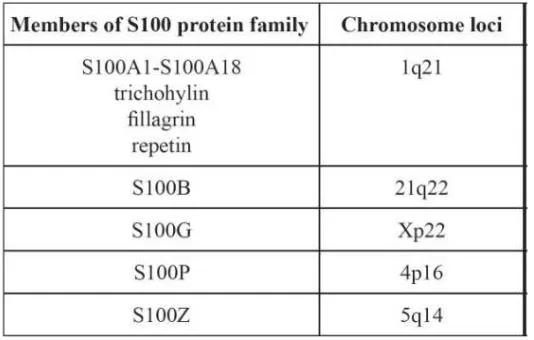
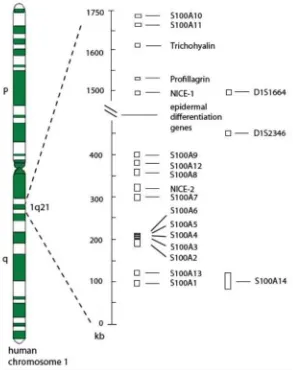
region’ dengan panjang yang bervariasi dan juga domain N- dan C- terminal. Berbeda dengan gen S100 yang sangat banyak terdapat pada vertebrata, protein ini tidak dijumpai pada invertebrata. Sampai sekarang ini terdapat paling sedikit 25 protein yang telah teridentifikasi sebagai anggota S100 protein family, dimana 21 diantaranya memiliki gen pada kromosom lokus 1q21. Kelompok gen ini dikenal sebagai kompleks diferensiasi epidermal (Marenholz, 2004; Donato, 2003).
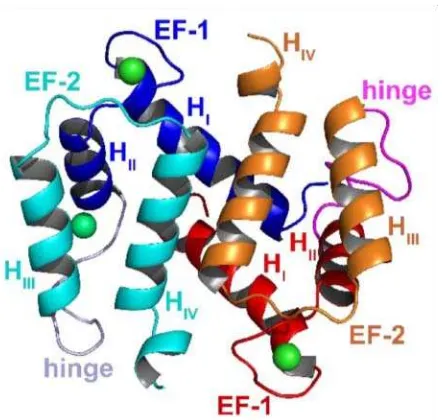
Gambar 2.1. Struktur dimer protein S100. Protein S100 dapat dijumpai dalam bentuk homodimer, heterodimer, dan oligodimer. Setiap monomer terdiri dari dua lengan EF yang dihubungkan oleh hinge region (Heizmann, 2002).
2.2.2. Anggota dari S100 protein family dan lokasinya pada berbagai gen spesifik
sitoskeleton, proteksi sel terhadap kerusakan sel oksidatif, fosforilasi protein dan sekresi (Santamaria, 2006).
Variasi fungsi protein S100 ini nampaknya disebabkan oleh:
1. Diversifikasi yang luas pada anggota protein S100 (25 anggota pada manusia)
2. Perbedaan ikatan metal ion yang berbeda-beda pada setiap protein S100 3. Distribusi ruang pada kompartemen intraselular spesifik atau
kompartemen ekstraselular
4. Kemampuan protein S100 untuk membentuk homodimer dan heterodimer non kovalen, sehingga memungkinkan pertukaran subunit S100
Protein S100 tidak memiliki kapasitas katalis intrinsik. Protein ini secara umum memiliki cara kerja yang mirip dengan calmodulin dan troponin C, yang mengalami perubahan struktur dan memodulasi aktifitas biologis melalui ikatan kalsium (Ikura 1996).
Gambar 2.2. Gen S100 yang terdapat pada kromosom 1q21. Kebanyakan gen S100 pada manusia terletak pada kompleks diferensiasi epidermal pada kromosom 1q21, yang merupakan area yang rentan terhadap penyusunan ulang. Protein S100B, S100P, S100Z dan S100G terletak pada kromosom 21q22, 4p16, 5q14 dan Xp22 (Heizmann, 2002).
S100B yang merupakan salah satu protein pada S100 protein family yang paling banyak dipelajari, interaksi protein ini dengan RAGE (Receptor for
Advanced Glycation Endproduct) telah terdokumentasi (Donato, 2007; Donato et al., 2008; Leclerc et al., 2009).
menghasilkan efek neurotropik dan neurotoksik yang tergantung pada konsentrasinya pada sel neuron (Donato et al., 2008).
S100 juga mengaktifasi microglia, dan mungkin berperan dalam patogenesis kelainan neurodegeneratif. S100B diekspresikan berlebih pada astrositoma dan glioblastoma (Camby et al., 1999), schwannoma dan melanoma (Salama et al., 2008).
2.2.3 Metode dan Pengukuran
Protein S100 dapat dideteksi dengan berbagai metoda analisa seperti immunoradiometric assay (IRMA), mass spectroscopy, western blot, ELISA (enzyme linked immunosorbent assay), electrohemiluminence dan PCR kuantitatif, dapat mendeteksi perubahan ekspresi imunohistokimia atau pada serum dengan sensitifitas tinggi, sehingga dapat menjadi alat ukur penting pada diagnosa klinis (Sangtec Medical, 2000).
Protein S100B (homodimer dari subunitβ) memiliki berat molekul sebesar 21kD dan dikodekan dari lengan panjang kromosom 21 (21q22.3). Waktu paruh dari S100B adalah sekitar 30 menit. Peningkatan kadar serum protein S100 secara persisten mengindikasikan adanya pelepasan secara terus menerus dari jaringan yang terlibat. Protein S100 dieliminasi melalui ginjal (Wild, 2001).
Penyakit yang berhubungan dengan perubahan ekspresi protein S100 dapat diklasifikasikan dalam 4 kategori.
1. Kelainan Neurologis
Sebagaimana GFAP (glial fibrillary acidic protein), protein S100B diproduksi oleh astrosit pada CNS, peningkatan ekspresi protein ini menandakan adanya aktifitas astrosit (Steiner, 2007).
Sekresi S100B merupakan proses awal respon sel glia terhadap cedera metabolik (kekurangan oksigen, serum, glukosa). Hubungan antara kondisi stress (cedera otak, gangguan sawar darah otak, iskemik) dan kadara serum S100 nampaknya tergantung glucocorticoid (Scaccianoce, 2004).
Traumatic brain injuries (TBI) result in an increase in S100B levels in blood and CSF.
Cedera otak traumatik akan mengakibatkan peningkatan kadar S100 pada serum dan juga pada cairan serebrospinal. Setelah terjadinya cedera otak
traumatik, terjadi peningkatan konsentrasi S100B dan S100A1B pada 31% dan 48% pasien, tanpa hubungan yang signifikan dengan tanda dan gejala gangguan kognitif.
S100B juga dihasilkan oleh jaringan ekstraserebral, terutama sel lemak dan kondrosit, oleh karena itu interpretasi peningkatan kadar serum S100B sebagai marker cedera otak harus dilakukan secara berhati-hati.
Kenaikan kadar serum S100B tergantung pada integritas sawar darah otak. Oleh karena itu peningkatan dini S100 setelah cedera otak traumatik berhubungan baik dengan gangguan sawar darah otak maupun ekspresi aktif dari jaringan otak yang terlibat pada reaksi inflamasi sistemik.
Peranan S100 pada cedera otak merupakan bidang yang sedang diteliti secara luas, beberapa studi menunjukkan indikasi bahwa S100B dapat menurunkan cedera neuronal dan/atau berperan dalam proses perbaikan neuron setelah cedera otak traumatik, memicu penyembuhan luka pada trauma dan memiliki aktifitas tropik parakrin pada jaringan disekitarnya (Sedaghat, 2008).
2. Kelainan Neoplastik
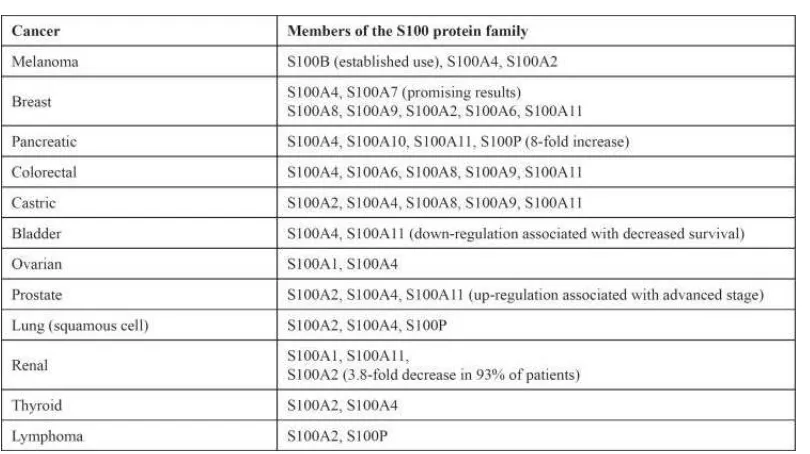
Terdapat berbagai tumor yang menunjukkan ekspresi protein S100; antara lain S100B, S100A2, S100A4, S100A6, dan S100P (Hsieh, 2003).
RAGE rendah akan mengalami akselerasi apoptosis, penurunan aktifasi NFκB dan secara signifikan mengakibatkan gangguan proliferasi (Semov, 2005).
Peningkatan kadar S100A4 (metastasin) berhubungan dengan survival rate yang rendah pada pasien dengan kanker payudara, dan pada tikus terbukti menginduksi metastase. Peningkatan konsentrasi serum S100A4 juga ditemukan pada tumor esofagus dan kolon, pankreas, paru, kandung kemih dan berhubungan dengan hasil akhir yang lebih buruk dan aktifitas tumor yang lebih agresif (Semov, 2005).
Terdapat sekresi S100B yang tinggi pada melanoma maligna, yang berhubungan dengan stadium dan prognosa tumor. Kadar serum S100B digunakan sebagai petanda untuk deteksi dini dan rekurensi tumor (Von, 1996).
Hubungan antara anggota S100 protein family dan beberapa jenis kanker tampak pada tabel 2.4.
Tabel 2.4. Hubungan antara anggota S100 protein family dan beberapa jenis kanker
gen supressor tumor p53 dan menghambat fosforilasi, sehingga mengakibatkan down regulation p53 yang tergantung kalsium.
Berbagai studi telah dilakukan untuk mengetahui peranan p53 wild type
pada neoplasma yang berhubungan dengan S100B melalui inhibisi interaksi p53 dan S100B.
Protein S100 lain menghasilkan efek berbeda terhadap aktifitas p53 (S100A2 memicu aktifitas transkripsi p53, dan sebagainya)
3. Kelainan Jantung
S100A1 secara spesifik diekspresikan dalam konsentrasi tinggi pada miokardium mamalia, dimana protein ini memodulasi kontraktilitas jantung melalui interaksi protein ini dengan filamen kontraktil dan dengan protein pada retikulum sarkoplasma (Ehlermann, 2000).
Kombinasi Skala Koma Glasgow (<6 poin) dengan peningkatan
konsentrasi serum dari NSE (>65ng/mL) dan S100 (> 1.5μg/l) pada 48-72 jam setelah resusitasi kardiopulmonar pada pasien yang mengalami cardiac arrest, merupakan faktor prediktor hasil akhir neurologis dan gangguan kognitif dengan spesifitas 100% (sensitifitas 42%) (Ekmektzoglou, 2007; Grubb, 2007).
Peningkatan S100 sendiri meningkatkan risiko kematian dan persistent vegetative state sebesar 12,6 kali lipat (Carrier, 2006).
4. Penyakit Inflamasi
S100A8, S100A9, dan S100Al2, diekspresikan secara predominan pada sel fagosit dan berhubungan kuat dengan fungsi proinflamasi. Protein-protein ini disekresikan terutma pada tempat inflamasi. Konsentrasi serum dari protein S100 berhubungan dengan aktifitas penyakit inflamasi; seperti rheumatoid arthritis, bronkhitis kronis, dan sistik fibrosis (Foell, 2004).
Peningkatan kadar S100B pada urin yang ditemukan pada bayi baru lahir dengan gangguan pertumbuhan dalam rahim pada minggu pertama sesudah kelahiran berhubungan dengan tingkat kerusakan otak. Kadar S100B berhubungan dengan derajat gangguan neurologis bayi tersebut (Florio, 2006).
2.2.4. S100 dan Meningioma
Marker diagnostik meningioma terpenting adalah imunoreaktifitas membaran terhadap EMA (Epithelial Membrane Antigen) (Abramovich, 1999;
Burger 2007)
Dari subtipe dasar meningioma, pewarnaan imunohistokimia EMA mungkin lebih jelas pada tipe meningothelial dan transisional dibandingkan pada tipe fibrous.
Sekitar 20% meningioma reaktif terhadap pewarnaan S100, dimana meningioma tipe fibrous merupakan varian yang paling reaktif terhadap pewarnaan ini. (Burger, 2007; Sav 2010)
Dari semua anggota keluarga S100, hanya ekspesi S100A5 yang berhubungan dengan nilai prognostik signifikan terhadap rekurensi tumor. Analisa regresi Cox menunjukkan nilai prognostik yang signifikan ini independen terhadap usia pasien. Kombinasi dari usia pasien dan pewarnaan S100A5 memungkinkan identifikasi kelompok pasien yang memiliki risiko tinggi mengalami rekurensi tumor. Hancq S et al menyimpulkan bahwa S100A5 mungkin memiliki peranan terhadap rekurensi meningioma grade I WHO yang telah direseksi total (Hancq, 2004).
Dijumpainya protein S100 pada beberapa tipe meningioma bukan merupakan hal yang tidak terduga. Spesimen baru meningioma kadang-kadang menunjukkan jejak atau reaksi positif terhadap protein S100 pada microcomplement fixation assay.
berasal dari sel neural crest embryo, sementara sel meningen lain adalah fibroblast yang berasal dari jaringan mesenkim disekitarnya. Penjelasan ini memudahkan pengertian mengapa meningioma memiliki berbagai tampilan histologi, dan mengapa meningioma sering menjadi bagian kelainan displasia sel selubung saraf yang dikenal sebagai penyakit von Recklinghausen (Neurofibromatosis tipe I).
Alasan mengapa distribusi protein S100 yang berbeda diantara subgrup meningioma belum dapat dimengerti sepenuhnya. Peneliti menduga sel glia yang
terletak berdekatan dengan meningioma mungkin terlibat dalam pembentukan tumor dan mengalami stimulasi untuk proliferasi oleh sel tumor. Namun tampaknya teori ini tidak sesuai dengan sifat meningioma yang tumbuh lambat, globular, dan sangat jarang menginfiltrasi jaringan otak.Teori lain menyebutkan meningioma yang berasal dari prekursor non neuronal mungkin mensintesa protein S100 de novo sebagai akibat ekspresi gen yang berubah menjadi maligna. Teori ini juga memiliki kelemahan karena kenyataannya meningioma adalah tumor yang secara biologis bersifat jinak.
Teori histogenesis menjelaskan bahwa meningioma terdiri dari berbagai tumor dengan berbagai histogenesis yang berbeda. Meningioma yang menunjukkan ekspresi protein S100 dapat berasal baik dari komponen neuroectodermal maupun mesenkim.
Beberapa penulis menduga bahwa beberapa sel pada pachymeninx mungkin dapat mensekresikan protein S100, karena studi imunohistokimia sebelumnya gagal menunjukkan protein S100 disekresikan oleh leptomeninx. (Tabuchi, 1984)
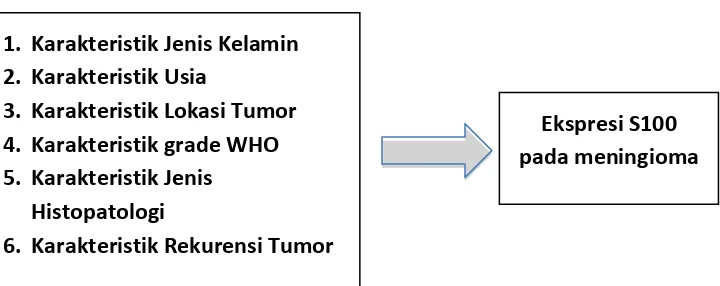
2.3. Kerangka Konseptual
Gambar 2.3. Kerangka konsep penelitian
Ekspresi S100 pada meningioma 1. Karakteristik Jenis Kelamin
2. Karakteristik Usia
3. Karakteristik Lokasi Tumor 4. Karakteristik grade WHO 5. Karakteristik Jenis
Histopatologi