I.
I. TUJUANTUJUAN
Mengetahui jumlah khlor yang dibutuhkan untuk air baku dengan kualitas Mengetahui jumlah khlor yang dibutuhkan untuk air baku dengan kualitas tertentu sehingga tercapai titik
tertentu sehingga tercapai titik breakpoint chlorinationbreakpoint chlorination (BPC)(BPC) II.
II. DASAR TEORIDASAR TEORI 1.
1. KlorinasiKlorinasi
Klorinasi adalah proses desinfeksi dengan menggunakan Klor pada Klorinasi adalah proses desinfeksi dengan menggunakan Klor pada pengolahan air bersih maupun air limbah. Proses klorinasi dimaksudkan untuk pengolahan air bersih maupun air limbah. Proses klorinasi dimaksudkan untuk membunuh bakteri yang ada yang dapat membahayakan kesehatan kita. Dalam membunuh bakteri yang ada yang dapat membahayakan kesehatan kita. Dalam klorinasi dikenal istilah
klorinasi dikenal istilah Chlorine Dosage, Chlorine Demand, Chlorine ResidualChlorine Dosage, Chlorine Demand, Chlorine Residual,, Ketersediaan residu klorin bebas, dan Residu Klorin
Ketersediaan residu klorin bebas, dan Residu Klorin terkobinasi.terkobinasi. Chlorine dosageChlorine dosage adalah jumlah klorin yang ditambahkan, biasanya dinyatakan dalam mg/L. adalah jumlah klorin yang ditambahkan, biasanya dinyatakan dalam mg/L. Chlorine demand
Chlorine demand adalah jumlah klorine yang tidak tersedia sebagai desinfektanadalah jumlah klorine yang tidak tersedia sebagai desinfektan sebagai akibat reaksi dari berbagai senyawa.
sebagai akibat reaksi dari berbagai senyawa. Chlorine residualChlorine residual adalah jumlahadalah jumlah klorin sebagai desinfektan setelah waktu kontak tertentu. Ketersediaan residu klorin sebagai desinfektan setelah waktu kontak tertentu. Ketersediaan residu klorin bebas adalah jumlah dari residu klorin yang tersedia di dalam air bersih klorin bebas adalah jumlah dari residu klorin yang tersedia di dalam air bersih dan air limbah. Sementara residu klorin terkombinasi adalah jumlah dari residual dan air limbah. Sementara residu klorin terkombinasi adalah jumlah dari residual klorin yang telah terkombinasi dengan ammonia atau organik nitrogen lainnya klorin yang telah terkombinasi dengan ammonia atau organik nitrogen lainnya seperti cloroamine dan masih
seperti cloroamine dan masih memiliki kekuatan desinfeksimemiliki kekuatan desinfeksi 2.
2. Reaksi Kimia pada KlorinasiReaksi Kimia pada Klorinasi
Klorin yang umum digunakan ada dalam bentuk klorin bebas atau dalam Klorin yang umum digunakan ada dalam bentuk klorin bebas atau dalam bentuk hypochlorite. Keduannya merupakan agen oksidasi potensial yang bentuk hypochlorite. Keduannya merupakan agen oksidasi potensial yang biasanya sebagian akan hilang dalam reaksi sehingga di perlukan perhitungan biasanya sebagian akan hilang dalam reaksi sehingga di perlukan perhitungan chlorine demand.
chlorine demand. 2.1.Reaksi dengan air 2.1.Reaksi dengan air
Klorin be
Klorin beraksi raksi dengan dengan air memair membentuk abentuk asam sam hypochlorous hypochlorous dan adan asamsam hydrochloric hydrochloric Cl Cl22+ H+ H22O O HOCl HOCl + + HH++ + Cl+ Cl --HH++ClCl−−[H[HOCOCll ]] [Cl [Cl22]]
=
= 4
4 x
x 1
10
0
− −44 (at 25(at 25oo C) C)Pada pH 2 sampai 3 reaksi diatas didominasi oleh klorin bebas. Hal ini bisa Pada pH 2 sampai 3 reaksi diatas didominasi oleh klorin bebas. Hal ini bisa menyebabk
menyebabkan terbentuknya trian terbentuknya trikloroamin (NClkloroamin (NCl33). Untuk meminimalisasi efek ). Untuk meminimalisasi efek ini maka diperlukan air dengan kualitas yang bagus sebelum masuk ke tahap ini maka diperlukan air dengan kualitas yang bagus sebelum masuk ke tahap klorinasi. Sementara pada larutan encer dan pH diatas 4 reaksi diatas klorinasi. Sementara pada larutan encer dan pH diatas 4 reaksi diatas bergeser ke arah kanan dan hanya ada sedikit sekali Cl
Hypochlorous adalah asam lemah dan hanya sedikit terdisosiasi pada pH Hypochlorous adalah asam lemah dan hanya sedikit terdisosiasi pada pH dibawah 6.
dibawah 6.
HOCl H
HOCl H++ + OCl+ OCl
--HH++OClOCl−− [H [HOCOCll ]]
=
= 2.
2.7 x
7 x 10
10
− −88 ( at 20( at 20oo C) C)Dibawah ini merupakan grafik hubungan antara pH dengan konsentrasi Dibawah ini merupakan grafik hubungan antara pH dengan konsentrasi HOCl dan OCl
HOCl dan OCl
--2.2. Reaksi dengan Impurities dalam Air 2.2. Reaksi dengan Impurities dalam Air
Klorin dan asam hypochlorous bereaksi dengan berbagai macam substrat, Klorin dan asam hypochlorous bereaksi dengan berbagai macam substrat, termasuk ammonia dan material
termasuk ammonia dan material humus.humus. a.
a. Reaksi dengan AmoniaReaksi dengan Amonia Amonia ada didalam air
Amonia ada didalam air sebagai kesetimbangasebagai kesetimbangan antara ion n antara ion amonium danamonium dan hidrogen. Amonia bereaksi dengan klorin atau asam hypochlorous hidrogen. Amonia bereaksi dengan klorin atau asam hypochlorous membentuk monokloramin, dikloramin, dan trikloramin tergantung membentuk monokloramin, dikloramin, dan trikloramin tergantung jumlah relatif masing
jumlah relatif masing msing komponen msing komponen dan pH reaksdan pH reaksi.i. NH
NH33 + + HOCl HOCl NHNH22Cl Cl + + HH22O O (Monokloramin)(Monokloramin) NH
NH22Cl Cl + + HOCl HOCl NHClNHCl22 + + HH22O O (Dikloramin)(Dikloramin) NHCl
Monokloramin dan dicloramin memiliki kekuatan desinfeksi yang kuat Monokloramin dan dicloramin memiliki kekuatan desinfeksi yang kuat sehingga menjadi pertimbangan dalam perhitungan residu klorin
sehingga menjadi pertimbangan dalam perhitungan residu klorin b.
b. Reaksi LainnyaReaksi Lainnya
Klorin bereaksi dengan berbagai maca material. Sebagian besar bereaksi Klorin bereaksi dengan berbagai maca material. Sebagian besar bereaksi dengan reduktor. Hasil samping dari reaksi
dengan reduktor. Hasil samping dari reaksi ini harus diperhatikan karenaini harus diperhatikan karena kadang kadang hasil samping reaksinya berbahaya untuk
kadang kadang hasil samping reaksinya berbahaya untuk kesehatan kita.kesehatan kita. Sebagai contoh, klorin bereaksi dengan organik membentuk Sebagai contoh, klorin bereaksi dengan organik membentuk trihalometane (THM) yang merupakan senyawa karsinogenik. Klorin trihalometane (THM) yang merupakan senyawa karsinogenik. Klorin bereaksi dengan H
bereaksi dengan H22S membentuk HCl dan S. Klorin juga bereaksiS membentuk HCl dan S. Klorin juga bereaksi dengan Fe
dengan Fe2+2+, Mn, Mn2+2+, dan NO, dan NO2-2- . Klorin bereaksi dengan ion bromida. Klorin bereaksi dengan ion bromida membentuk HOBr dan Cl
membentuk HOBr dan Cl --Br
Br-- + + HOCl HOCl HOBr HOBr + + ClCl
--HOBr juga merupakan desinfektan, tetapi bereaksi lebih cepat HOBr juga merupakan desinfektan, tetapi bereaksi lebih cepat dibandingkan dengan klorin. Ketika air mengandung bromida, klorin dibandingkan dengan klorin. Ketika air mengandung bromida, klorin akan menjadi lebih reaktif. HOBr
akan menjadi lebih reaktif. HOBr juga bereaksi dengan organik.juga bereaksi dengan organik.
Klorin juga bereaksi dengan phenol membentuk mono-, di-, Klorin juga bereaksi dengan phenol membentuk mono-, di-, triklorophenol yang merupakan penyebab rasa dan bau pada
triklorophenol yang merupakan penyebab rasa dan bau pada air.air. 3.
3. Sifat Khlor dan KloraminSifat Khlor dan Kloramin 3.1.Khlor
3.1.Khlor
Khlor merupakan unsur halogen dengan nomor atom 17. Khlor yang biasa Khlor merupakan unsur halogen dengan nomor atom 17. Khlor yang biasa digunakan dalam proses desinfeksi adalah klorin (Cl
digunakan dalam proses desinfeksi adalah klorin (Cl22), Kaporit (Ca(OCl)), Kaporit (Ca(OCl)22),), NaOCl, dan asam hipoklorit. Klorin merupkan gas yang reaktif yang bisa NaOCl, dan asam hipoklorit. Klorin merupkan gas yang reaktif yang bisa mengoksidasi hampir semua senyawa. Khlor adalah bahan desinfektan mengoksidasi hampir semua senyawa. Khlor adalah bahan desinfektan yang efektif untuk air yang jernih dan pH
yang efektif untuk air yang jernih dan pH tidak asam. Saat ini tidak asam. Saat ini penggunaanpenggunaan klorin paling banyak digunakan dibandingkan desinfektan lainnya karena klorin paling banyak digunakan dibandingkan desinfektan lainnya karena harganya yang murah dan cukup efektif. Selain itu klorin
harganya yang murah dan cukup efektif. Selain itu klorin akan menyisakanakan menyisakan residu yang akan menjamin air tetap
residu yang akan menjamin air tetap steril selama proses distribusisteril selama proses distribusi 3.2.Kloramin
3.2.Kloramin
Khloramin adalah senyawa khlor hasil reaksi dengan amonia. Denyawa Khloramin adalah senyawa khlor hasil reaksi dengan amonia. Denyawa yang termasuk kloramin adalah mono-, di-, dan trikloramin. Pembentukan yang termasuk kloramin adalah mono-, di-, dan trikloramin. Pembentukan senyawa kloramin dari klorin dengan amonia dipengaruhi oleh beberapa senyawa kloramin dari klorin dengan amonia dipengaruhi oleh beberapa faktor antara lain perbandingan mol dan pH. Apabila perbandingan mol faktor antara lain perbandingan mol dan pH. Apabila perbandingan mol antara klorin dengan amonia adalah 1 : 1 maka akan terbentuk mono-, dan antara klorin dengan amonia adalah 1 : 1 maka akan terbentuk mono-, dan dikloramin. Sementara, pada pH rendah pembentukan dikloramin lebih dikloramin. Sementara, pada pH rendah pembentukan dikloramin lebih
dominan. Apabila rasio mol klorin terhadap amonia 1.5 atau lebih, maka dominan. Apabila rasio mol klorin terhadap amonia 1.5 atau lebih, maka akan terbentuk trikloramin, N
akan terbentuk trikloramin, N22 dan NOdan NO2-2- . pH juga merupakan parameter. pH juga merupakan parameter penting, dalam hal ini pH berpengaruh pada rasio mol klorin terhadap penting, dalam hal ini pH berpengaruh pada rasio mol klorin terhadap amonia dan apakah akan terbentuk trikloramin, N
amonia dan apakah akan terbentuk trikloramin, N22atau NOatau NO2- 2-4.
4. Mekanisme atau Cara Kerja KhlorMekanisme atau Cara Kerja Khlor
Senyawa klorin bekerja membunuh bakteri yang ada di dalam air. Klorin Senyawa klorin bekerja membunuh bakteri yang ada di dalam air. Klorin membunuh dengan merusak striktur sel bakteri.
membunuh dengan merusak striktur sel bakteri. KerusakKerusakan yang diakibatkan olehan yang diakibatkan oleh klorin adalah
klorin adalah 4.1.Perusaka
4.1.Perusakan Kn Kemampuan Permeabilitas Selemampuan Permeabilitas Sel
Khlor bebas merusak membran dari sel bakteri, hal ini menyebabkan sel Khlor bebas merusak membran dari sel bakteri, hal ini menyebabkan sel kehilangan permeabilitasnya dan merusak fungsi sel lainnya. Paparan Khlor kehilangan permeabilitasnya dan merusak fungsi sel lainnya. Paparan Khlor menyebabkan kebocoran protein, RNA dan DNA. Sel mati merupakan hasil menyebabkan kebocoran protein, RNA dan DNA. Sel mati merupakan hasil pelepasan TOC dan material yang menyerap sinar UV, pengurangan sintesis pelepasan TOC dan material yang menyerap sinar UV, pengurangan sintesis protein dan DNA. Perusakan kemampuan permeabilitas oleh khlor juga protein dan DNA. Perusakan kemampuan permeabilitas oleh khlor juga penyebab kerusakan spora bakteri
penyebab kerusakan spora bakteri 4.2. Perusakan Asam Nukleat dan Enzim 4.2. Perusakan Asam Nukleat dan Enzim
Klorin juga bisa merusak asam nukleat dan enzim bakteri. Enzim merupakan Klorin juga bisa merusak asam nukleat dan enzim bakteri. Enzim merupakan katalis alami dari berbagai macam reaksi sel. Salah satu akibat pengurangan katalis alami dari berbagai macam reaksi sel. Salah satu akibat pengurangan aktifitas katalis adalah penghambatan akumulasi hidrogen peroksida yang aktifitas katalis adalah penghambatan akumulasi hidrogen peroksida yang merupakan senyawa racu didalam tubuh
merupakan senyawa racu didalam tubuh bakteri.bakteri. 5.
5. Grafik Klorinasi dan Breakpoint ChlorinationGrafik Klorinasi dan Breakpoint Chlorination Grafik klorinasi merupakan grafik
Grafik klorinasi merupakan grafik yang menggambarkyang menggambarkan hubungan antaraan hubungan antara dosis klorin dengan residu klorin. Grafik tersebut dapat digambarkan sebagai dosis klorin dengan residu klorin. Grafik tersebut dapat digambarkan sebagai berikut:
Seperti terlihat di grafik diatas pada zona I terjadi oksidasi klorin. Pada Seperti terlihat di grafik diatas pada zona I terjadi oksidasi klorin. Pada zona II terjadi pembentukan Kloramin. Klormain terbentuk sebagai hasil reaksi zona II terjadi pembentukan Kloramin. Klormain terbentuk sebagai hasil reaksi asam hypochlorous dan klorin bebas dengan amonia. Pada tahap ini juga terjadi asam hypochlorous dan klorin bebas dengan amonia. Pada tahap ini juga terjadi pembentukan
pembentukan senyawa chloro-orgasenyawa chloro-organik. Pada zona III kloroamnik. Pada zona III kloroamin mulai terurai danin mulai terurai dan berkurang. Pada tahap ini juga terdapat BPC (
berkurang. Pada tahap ini juga terdapat BPC ( breakpoint chlorinationbreakpoint chlorination) atau titik ) atau titik retak klorinasi.
retak klorinasi. Break Point Chlorina Break Point Chlorinationtion (titik retak klorinasi) adalah jumlah klor(titik retak klorinasi) adalah jumlah klor yang dibutuhkan sehingga :
yang dibutuhkan sehingga :
semua zat yang dapat dioksidasi semua zat yang dapat dioksidasi teroksidasiteroksidasi
amoniak hilang sebagai gas Namoniak hilang sebagai gas N22
masih ada residu klor aktif terlarut yang konsentrasinya dianggap perlumasih ada residu klor aktif terlarut yang konsentrasinya dianggap perlu
untuk pembasmian kuman-kuman selama proses distribusi untuk pembasmian kuman-kuman selama proses distribusi
Pada zona IV terjadi pembentukan klorin bebas. Klorin bebas memiliki Pada zona IV terjadi pembentukan klorin bebas. Klorin bebas memiliki kekuatan desinfeksi yang sangant kuat, tetapi keberadaan mereka hanya sesaat kekuatan desinfeksi yang sangant kuat, tetapi keberadaan mereka hanya sesaat karena klorin sangat reaktif sehingga cepat sekali hilang keberadaannya didalam karena klorin sangat reaktif sehingga cepat sekali hilang keberadaannya didalam air. Karena alasan inilah free klorin harus dibiarkan bereaksi dulu agar air. Karena alasan inilah free klorin harus dibiarkan bereaksi dulu agar membentuk mono-, dan dikloramin yang bertahan lebih lama
6.
6. Macam Macam DesinfektanMacam Macam Desinfektan 6.1. Residu Klorin
6.1. Residu Klorin
Residu Klorin ada desinfektan yang dibahas dalam laporan praktikum ini. Residu Klorin ada desinfektan yang dibahas dalam laporan praktikum ini. Klorin merupakan de
Klorin merupakan desinfektan yang efesinfektan yang efektif pada air yang jernih, dan ktif pada air yang jernih, dan pH tidak pH tidak alkalin. Saat ini penggunaan klorin paling banyak digunakan dibandingkan alkalin. Saat ini penggunaan klorin paling banyak digunakan dibandingkan desinfektan lainnya karena harganya yang murah dan cukup efektif. Selain itu desinfektan lainnya karena harganya yang murah dan cukup efektif. Selain itu klorin akan menyisakan residu yang akan menjamin air tetap steril selama klorin akan menyisakan residu yang akan menjamin air tetap steril selama proses distribusi
proses distribusi 6.2. Klorin dioksida 6.2. Klorin dioksida
Klorin dioksida merupakan agen pengoksidasi yang lebih kuat daripada klorin. Klorin dioksida merupakan agen pengoksidasi yang lebih kuat daripada klorin. Proses desinfeksi menggunakan klorin dioksida tidak terlalu bergantung Proses desinfeksi menggunakan klorin dioksida tidak terlalu bergantung dengan pH seperti pada penggunaan klorin. Hal
dengan pH seperti pada penggunaan klorin. Hal ini menyebabkan residu klorinini menyebabkan residu klorin lebih tahan lama dalam air. Akan tetapi penggunaan klorin dioksida kurang lebih tahan lama dalam air. Akan tetapi penggunaan klorin dioksida kurang efektif untuk desinfeksi agen virus sehingga penggunaannya terbatas. Klorin efektif untuk desinfeksi agen virus sehingga penggunaannya terbatas. Klorin dioksida terutama digunakan sebagai kontrol rasa dan bau. Klorin dioksida dioksida terutama digunakan sebagai kontrol rasa dan bau. Klorin dioksida tidak akan bereaksi dengan amonia sehingga penggunan klorin dioksida pada tidak akan bereaksi dengan amonia sehingga penggunan klorin dioksida pada air yang mengandung amonia jauh lebih efektif dibandingkan dengan klorin. air yang mengandung amonia jauh lebih efektif dibandingkan dengan klorin. Kelemahan utama klorin dioksida adalah klorin dioksida tidak stabil dan harus Kelemahan utama klorin dioksida adalah klorin dioksida tidak stabil dan harus dibuat ditempat dengan reaksi klorin dalam sodium klorida. Selain itu klorin dibuat ditempat dengan reaksi klorin dalam sodium klorida. Selain itu klorin dioksida juga harganya lebih mahal
dioksida juga harganya lebih mahal dibandingkan klorindibandingkan klorin 6.3.Ozone
6.3.Ozone Ozone (O
Ozone (O33) adalah gas yang kurang stabil dan hanya sedikit larut dalam air.) adalah gas yang kurang stabil dan hanya sedikit larut dalam air. Ozon adalah desinfektan yang efektif, ozon hampir membunuh semua bakteri Ozon adalah desinfektan yang efektif, ozon hampir membunuh semua bakteri dan mikroba yang ada didalam air, tetapi karena kondisinya yang kurang stabil dan mikroba yang ada didalam air, tetapi karena kondisinya yang kurang stabil sehingga ozon tidak akan meninggalkan residu didalam air seperti klorin sehingga ozon tidak akan meninggalkan residu didalam air seperti klorin sehingga harus ditambahkan klorin untuk membunuh mikroba selama proses sehingga harus ditambahkan klorin untuk membunuh mikroba selama proses distribusi. Kerugian lain dari penggunaan ozon adalah harganya yang jauh distribusi. Kerugian lain dari penggunaan ozon adalah harganya yang jauh lebih mahal daripada klorin.
lebih mahal daripada klorin. 6.4.Sinar UV
6.4.Sinar UV
Ultraviolet merupakan suatu bagian dari spektrum elektromagnetik dan tidak Ultraviolet merupakan suatu bagian dari spektrum elektromagnetik dan tidak membutuhkan medium untuk merambat. Ultraviolet mempunyai rentang membutuhkan medium untuk merambat. Ultraviolet mempunyai rentang
panjang gelombang antara 400-100 nm yang berada di antara spektrum sinar panjang gelombang antara 400-100 nm yang berada di antara spektrum sinar X dan cahaya tampak . Secara umum
X dan cahaya tampak . Secara umum sumber ultraviolet dapat diperoleh secarasumber ultraviolet dapat diperoleh secara alamiah dan buatan, dengan sinar matahari merupakan sumber utama alamiah dan buatan, dengan sinar matahari merupakan sumber utama ultraviolet di alam. Sumber ultraviolet buatan umumnya berasal dari lampu ultraviolet di alam. Sumber ultraviolet buatan umumnya berasal dari lampu fluorescent khusus, seperti lampu merkuri tekanan rendah (low pressure) dan fluorescent khusus, seperti lampu merkuri tekanan rendah (low pressure) dan lampu merkuri tekanan sedang (medium pressure). Lampu merkuri medium lampu merkuri tekanan sedang (medium pressure). Lampu merkuri medium pressure mampu menghasilkan output radiasi ultraviolet yang lebih besar pressure mampu menghasilkan output radiasi ultraviolet yang lebih besar daripada lampu merkuri low pressure.
daripada lampu merkuri low pressure.
Radiasi ultraviolet merupakan suatu sumber energi yang mempunyai Radiasi ultraviolet merupakan suatu sumber energi yang mempunyai kemampuan untuk melakukan penetrasi ke dinding sel mikroorganisme dan kemampuan untuk melakukan penetrasi ke dinding sel mikroorganisme dan mengubah komposisi asam nukleatnya. Absorbsi ultraviolet oleh DNA ( atau mengubah komposisi asam nukleatnya. Absorbsi ultraviolet oleh DNA ( atau RNA pada beberapa virus) dapat menyebabkan mikroorganisme tersebut tidak RNA pada beberapa virus) dapat menyebabkan mikroorganisme tersebut tidak mampu melakukan replikasi akibat pembentukan ikatan rangkap dua pada mampu melakukan replikasi akibat pembentukan ikatan rangkap dua pada molekul-molekul pirimidin (Snider et al, 1991). Sel yang tidak mampu molekul-molekul pirimidin (Snider et al, 1991). Sel yang tidak mampu melakukan replikasi akan kehilangan sifat patogenitasnya. Radiasi ultraviolet melakukan replikasi akan kehilangan sifat patogenitasnya. Radiasi ultraviolet yang diabsorbsi oleh protein pada membran sel akan menyebabkan kerusakan yang diabsorbsi oleh protein pada membran sel akan menyebabkan kerusakan membran sel dan kematian sel. Namun perlu diperhatikan bahwa beberapa membran sel dan kematian sel. Namun perlu diperhatikan bahwa beberapa mikroba khususnya bakteri memang mempunyai suatu system metabolik mikroba khususnya bakteri memang mempunyai suatu system metabolik fungsional y
fungsional yang bervariasi dang bervariasi dalam mekanalam mekanisme untuk meisme untuk memperbaiki mperbaiki kerusakankerusakan asam nukleatnya . Adanya kemampuan mikroba untuk memperbaiki asam nukleatnya . Adanya kemampuan mikroba untuk memperbaiki kerusakan selnya. Pengaruh Intensitas Sinar Ultraviolet dan Pengadukan akan kerusakan selnya. Pengaruh Intensitas Sinar Ultraviolet dan Pengadukan akan dapat mempengaruhi efisiensi proses desinfeksi. Namun, mekanisme r
dapat mempengaruhi efisiensi proses desinfeksi. Namun, mekanisme r eaktifasieaktifasi mikroorganisme tersebut dapat diatasi dengan penggunaan dosis UV yang mikroorganisme tersebut dapat diatasi dengan penggunaan dosis UV yang sesuai. Tingkat inaktifasi mikroorganisme sangat tergantung pada dosis UV sesuai. Tingkat inaktifasi mikroorganisme sangat tergantung pada dosis UV yang digunakan. Kinetika inaktifasi mikroorganisme pada desinfeksi yang digunakan. Kinetika inaktifasi mikroorganisme pada desinfeksi menggunak
menggunakan ultraviolet mengikuti an ultraviolet mengikuti Hukum Chick, pada persamaan berikut Hukum Chick, pada persamaan berikut :: N = N0 . e-k.I.t
N = N0 . e-k.I.t dengan :
dengan : N
N : : jumlah jumlah mikroorganisme mikroorganisme setelah setelah dipapari dipapari UV UV pada pada waktu waktu pemaparanpemaparan (t)
(t) N0
N0 : : jumlah jumlah mikroorganisme mikroorganisme awal awal (t (t = = 0)0) k
k : : koef. koef. tingkat tingkat inaktifasi inaktifasi mikroorganisme mikroorganisme selama selama waktu waktu tertentutertentu (tergantung pada faktor kualitas air)
(tergantung pada faktor kualitas air) I
Bryan
Bryan et al. et al. (1992) me(1992) memodifikasi pemodifikasi persamaan rsamaan tersebut menjatersebut menjadi persamadi persamaanan tersebut sebagai berikut :
tersebut sebagai berikut :
ln N/N
ln N/N00 = = -k . I -k . I . t. t
Tanda negatif pada persamaan tersebut mengindikasikan adanya penurunan Tanda negatif pada persamaan tersebut mengindikasikan adanya penurunan dari jumlah
dari jumlah mikroorganisme mikroorganisme setelah wsetelah waktu tertentu aktu tertentu (Bryan (Bryan et al., et al., 1992).1992). Berdasarkan pada persamaan Hukum Chick, maka jumlah mikroorganisme Berdasarkan pada persamaan Hukum Chick, maka jumlah mikroorganisme yang tersisa dapat dihitung sebagai fungsi dosis dan
yang tersisa dapat dihitung sebagai fungsi dosis dan waktu pemaparan (White,waktu pemaparan (White, 19925; USEPA, 1996).
19925; USEPA, 1996).
Disinfeksi menggunakan radiasi UV umumnya digunakan dalam aplikasi Disinfeksi menggunakan radiasi UV umumnya digunakan dalam aplikasi pengolaha
pengolahan air n air dan air limbah dadan air limbah dalam menemukalam menemukan peningkatan peningkatan penggunaann penggunaan dalam pengolahan air minum. Banyak mata air menggunakan peralatan dalam pengolahan air minum. Banyak mata air menggunakan peralatan disinfeksi UV untuk mensterilkan air pada mata air tersebut. Disinfeksi air disinfeksi UV untuk mensterilkan air pada mata air tersebut. Disinfeksi air dengan tenaga surya adalah proses menggunakan botol PET dan sinar dengan tenaga surya adalah proses menggunakan botol PET dan sinar matahari untuk melakukan proses mendisinfeksi air. Sebagai contoh, New matahari untuk melakukan proses mendisinfeksi air. Sebagai contoh, New York City telah menyetujui pembangunan galon AS sebanyak 2 miliar per hari York City telah menyetujui pembangunan galon AS sebanyak 2 miliar per hari (7.600.000 m3/d) untuk fasilitas air minum dengan proses desinfeksi (7.600.000 m3/d) untuk fasilitas air minum dengan proses desinfeksi ultraviolet. Dahulu, disinfeksi UV dianggap lebih efektif untuk bakteri dan ultraviolet. Dahulu, disinfeksi UV dianggap lebih efektif untuk bakteri dan virus dibandingkan patogen yang yang memiliki lapisan luar berbentuk kista virus dibandingkan patogen yang yang memiliki lapisan luar berbentuk kista yang lebih besar dan melindungi DNA mereka dari sinar UV. Namun, yang lebih besar dan melindungi DNA mereka dari sinar UV. Namun, baru-baru ini ditemukan bahwa radiasi ultraviolet efektif untuk mengobati baru ini ditemukan bahwa radiasi ultraviolet efektif untuk mengobati Cryptosporidium mikroorganisme. Temuan ini membuat penggunaan radiasi Cryptosporidium mikroorganisme. Temuan ini membuat penggunaan radiasi UV menjadi metode yang layak untuk pengolahan air minum
UV menjadi metode yang layak untuk pengolahan air minum 6.5.Iodine
6.5.Iodine
Apabila air tidak keruh, iodine merupakan desinfektan yang efektif dan lebih Apabila air tidak keruh, iodine merupakan desinfektan yang efektif dan lebih stabil dibandingkan dengan klorin. Iodine banyak digunakan untuk desifektan stabil dibandingkan dengan klorin. Iodine banyak digunakan untuk desifektan volume kecil atau penggunaan pribadi. Tetapi untuk desinfektan skala besar volume kecil atau penggunaan pribadi. Tetapi untuk desinfektan skala besar iodine tidak menguntungkan secara ekonomi karena harganya yang lebih iodine tidak menguntungkan secara ekonomi karena harganya yang lebih mahal dibandingkan dengan kaporit. Iodine hanya sedikit bereaksi dengan mahal dibandingkan dengan kaporit. Iodine hanya sedikit bereaksi dengan organik sehingga resiko pembentukan halometane menjadi minimal, selain itu organik sehingga resiko pembentukan halometane menjadi minimal, selain itu iodine juga tidak bereaksi
iodine juga tidak bereaksi dengan amonia.dengan amonia.
Untuk desinfeksi per 1 liter air biasanya diperlukan 2 % larutan iodine dalam Untuk desinfeksi per 1 liter air biasanya diperlukan 2 % larutan iodine dalam etanol dengan waktu kontak kurang dari 30 menit. Penggunaan iodine etanol dengan waktu kontak kurang dari 30 menit. Penggunaan iodine
melebihi 2 mg/L membuat akan
melebihi 2 mg/L membuat akan menyebabkmenyebabkan air agak berasa dan air agak berasa dan berbau khasan berbau khas iodine. Penggunaa
iodine. Penggunaan iodin diatas 4 n iodin diatas 4 mg/L dapat menimbulkan reaksi alergi padamg/L dapat menimbulkan reaksi alergi pada beberapa individu.
beberapa individu. 7.
7. Metode Penentuan Total Chlorine ResidualMetode Penentuan Total Chlorine Residual 7.1. Metode Iodometri
7.1. Metode Iodometri
Metode ini berdasar pada kemampuan klorin dan residual klorin untuk Metode ini berdasar pada kemampuan klorin dan residual klorin untuk mengoksida
mengoksidasi si II-- menjadi Imenjadi I22. reaksi yang terjadi sebagai berikut:. reaksi yang terjadi sebagai berikut: Cl
Cl22+ 2I+ 2I-- II22 + 2Cl+ 2Cl-- (1)(1) II22 + + amilum amilum blue blue colour colour (test (test kualitatif) kualitatif) (2)(2)
Pembentukan I
Pembentukan I22 yang ditandai dengan warna biru ketika diberi amilumyang ditandai dengan warna biru ketika diberi amilum dapat dijadikan bukti keberadaan residual klorin tetapi tidak dapat dapat dijadikan bukti keberadaan residual klorin tetapi tidak dapat dijadikan indikasi jumlah residual klorin di dalam sampel. Untuk dijadikan indikasi jumlah residual klorin di dalam sampel. Untuk menentukan jumlah residual klorin yang ada diperlukan titrasi dengan menentukan jumlah residual klorin yang ada diperlukan titrasi dengan larutan tiosulfat standar. Titrasi dilakukan sampai warna biru tepat hilang. larutan tiosulfat standar. Titrasi dilakukan sampai warna biru tepat hilang. Warna biru yang hilang menandakan semua iodin telah bereaksi. Apabila Warna biru yang hilang menandakan semua iodin telah bereaksi. Apabila larutan terlalu pekat (Iodine > 1mg/L) maka titrasi dilakukan sebelum larutan terlalu pekat (Iodine > 1mg/L) maka titrasi dilakukan sebelum penambahan amilum dan apabila larutan sudah encer (Iodine <1 mg/L ) penambahan amilum dan apabila larutan sudah encer (Iodine <1 mg/L ) ditambahkan amilum untuk kemudian dititrasi lagi dengan larutan standar ditambahkan amilum untuk kemudian dititrasi lagi dengan larutan standar tiosulfat. Reaksi yang terjadi adalah
tiosulfat. Reaksi yang terjadi adalah
II22 + 2Na+ 2Na22SS22OO33 NaNa22SS44OO66+ + 2NaI 2NaI (3)(3) II22 + 2S+ 2S22OO332-2- SS44OO662-2- + 2I+ 2I-- (4)(4)
Jumlah larutan tiosulfat yang digunakan dapat digunakan untuk Jumlah larutan tiosulfat yang digunakan dapat digunakan untuk mencari jumlah iodin dengan menggunakan perbandingan mol reaksi (3) mencari jumlah iodin dengan menggunakan perbandingan mol reaksi (3) dan (4). Jumlah iodin inilah yang digunakan untuk menentukan jumlah dan (4). Jumlah iodin inilah yang digunakan untuk menentukan jumlah residual klorin menggunakan perbandingan mol reaksi (1)
residual klorin menggunakan perbandingan mol reaksi (1) 7.2. Metode Orthotolidine
7.2. Metode Orthotolidine Pada tahun 1909
Pada tahun 1909 Phelps mengajukan penggunaan orthotolidine sebagaiPhelps mengajukan penggunaan orthotolidine sebagai indikator klorometrik untuk residual klorin. Hasil yang diperoleh dari uji indikator klorometrik untuk residual klorin. Hasil yang diperoleh dari uji ini kurang akurat dan diketahui bahwa orthotolidane merupakan senyawa ini kurang akurat dan diketahui bahwa orthotolidane merupakan senyawa toxic sehingga saat ini
8.
8. Faktor yang Mempengaruhi KlorinasiFaktor yang Mempengaruhi Klorinasi
8.1. Konsentrasi Desinfektan dan Waktu Kontak 8.1. Konsentrasi Desinfektan dan Waktu Kontak
Inaktivasi mikrooorganisme patogen oleh senyawa desinfektan dalam Inaktivasi mikrooorganisme patogen oleh senyawa desinfektan dalam hal ini adalah klorin/residual klorin
hal ini adalah klorin/residual klorin bertambah sesuai dengan waktu kontak,bertambah sesuai dengan waktu kontak, dan idealnya mengikuti kinetika reaksi orde satu. Inaktivasi terhadap dan idealnya mengikuti kinetika reaksi orde satu. Inaktivasi terhadap waktu mengikuti garis lurus apabila data diplot
waktu mengikuti garis lurus apabila data diplot pada kertas log-log.pada kertas log-log. N
N /N /Ntt oo = = ee-kt-kt Dimana
Dimana N
Noo = Jumlah mikroorganisme pada waktu = 0= Jumlah mikroorganisme pada waktu = 0 N
Ntt = Jumlah mikroorganisme pada waktu = t= Jumlah mikroorganisme pada waktu = t K
K == decay constant decay constant atau konstanta pemusnahan (waktuatau konstanta pemusnahan (waktu-1-1)) t
t = = WaktuWaktu
Namun demikian data inaktivasi di lapangan menunjukan deviasi dari Namun demikian data inaktivasi di lapangan menunjukan deviasi dari kinetik orde satu seperti grafik
kinetik orde satu seperti grafik berikut:berikut:
Gambar 7.1 : Kurva inaktivasi mikroorganisme didalam proses desinfeksi Gambar 7.1 : Kurva inaktivasi mikroorganisme didalam proses desinfeksi
Kurva C pada grafik diatas
Kurva C pada grafik diatas menunjukan deviasi dari kinetika orde satu.menunjukan deviasi dari kinetika orde satu. Bagian ujung kurva merupakan akibat adanya subpopulasi dari populasi Bagian ujung kurva merupakan akibat adanya subpopulasi dari populasi heterogen mikroorganisme yang resisten terhadap desinfektan. Kurva A heterogen mikroorganisme yang resisten terhadap desinfektan. Kurva A menunjukan populasi mikroorganisme homogen yang sensitif terhadap menunjukan populasi mikroorganisme homogen yang sensitif terhadap desinfektan. Sedangkan kurva B menunjukan populasi mikroorganisme desinfektan. Sedangkan kurva B menunjukan populasi mikroorganisme yang agak resisten terhadap desinfektan.
yang agak resisten terhadap desinfektan.
Efektifitas desinfektan dapat digambarkan sebagai C.t. C adalah Efektifitas desinfektan dapat digambarkan sebagai C.t. C adalah konsentrasi desinfektan dan t adalah waktu yang diperlukan untuk proses konsentrasi desinfektan dan t adalah waktu yang diperlukan untuk proses inaktivasi sejumlah presentasi tertentu dari populasi pada kondisi tertentu inaktivasi sejumlah presentasi tertentu dari populasi pada kondisi tertentu
(pH dan suhu). Hubungan antara populasi desinfektan dengan waktu (pH dan suhu). Hubungan antara populasi desinfektan dengan waktu kontak diberikan oleh hukum
kontak diberikan oleh hukum watson sebagai berikut:watson sebagai berikut: K = C
K = Cnntt Dimana
Dimana K
K = Konsta= Konstanta mikroorganisme nta mikroorganisme tertentu yang tertentu yang terpapar desterpapar desinfektan padainfektan pada kondisi tertentu
kondisi tertentu C
C = = Konsentrasi Konsentrasi desinfektan desinfektan (mg/L)(mg/L) t
t = = waktu waktu yang yang diperlukan diperlukan untuk untuk memusnahkamemusnahkan n prosentase prosentase tertentu tertentu daridari populasi (menit)
populasi (menit) n
n = = koefisien koefisien pelarutpelarut
Apabila t diplot terhadap C pada kertas logaritma ganda (log-log), n Apabila t diplot terhadap C pada kertas logaritma ganda (log-log), n adalah slope atau kemiringan dari garis lurus. Nilai n menunjukan adalah slope atau kemiringan dari garis lurus. Nilai n menunjukan pentingnya konsentrasi desinfektan atau waktu kontak dalam proses pentingnya konsentrasi desinfektan atau waktu kontak dalam proses inaktivasi mikroorganisme. Apabila n < 1 proses desinfeksi lebih inaktivasi mikroorganisme. Apabila n < 1 proses desinfeksi lebih dipengaruhi oleh waktu kontak dibandingkan dengan konsentrasi dipengaruhi oleh waktu kontak dibandingkan dengan konsentrasi desinfektan. Apabila n > 1 konsentrasi desinfektan merupakan faktor desinfektan. Apabila n > 1 konsentrasi desinfektan merupakan faktor dominan yang mempengaruhi proses desinfeksi. Namun demikian nilai n dominan yang mempengaruhi proses desinfeksi. Namun demikian nilai n umumnya mendekati 1.
umumnya mendekati 1.
Penentuan nilai C.t dapat melibatkan temperatur dan pH dari medium Penentuan nilai C.t dapat melibatkan temperatur dan pH dari medium suspensi. Sebagai contoh persamaan dikembangkan untuk mengetahui suspensi. Sebagai contoh persamaan dikembangkan untuk mengetahui inaktivasi kista dari
inaktivasi kista dari Giardia LambiaGiardia Lambia pada proses pengolahan denganpada proses pengolahan dengan desinfektan khlor (Clark, 1989; Hubler, 1987)
desinfektan khlor (Clark, 1989; Hubler, 1987)
.. == 0.0.989847470.17580.17582.75192.7519−−0.14670.1467 Dimana:
Dimana: C
C = = Konsentrasi Konsentrasi khlor (C khlor (C < 4< 4,23 ,23 mg/L)mg/L) t
t = = waktu waktu untuk untuk inaktivasi inaktivasi 99.99 99.99 % % kistakista pH = pH (antara 6
pH = pH (antara 6 – – 8)8) T
T = = temperatur temperatur (antara (antara 0.50.5 – – 55 ooC)C)
Nilai C.t untuk mikroorganisme patogen dapat dilihat pada tabel dibawah Nilai C.t untuk mikroorganisme patogen dapat dilihat pada tabel dibawah ini:
Tabel: Harga Ct untuk inaktivasi mikroba dengan desinfektan khlor (T = Tabel: Harga Ct untuk inaktivasi mikroba dengan desinfektan khlor (T =
5
5ooC, pH = 6.0)C, pH = 6.0)
Cara lain untuk menggambarkan efektifitas desinfektan tertentu adalah Cara lain untuk menggambarkan efektifitas desinfektan tertentu adalah dengan mengetahui koefisien kematian (
dengan mengetahui koefisien kematian ( Lethality Lethality coefficient coefficient ) dan) dan persamaanny
persamaannya ditunjukan sebagai berikut a ditunjukan sebagai berikut (Moris, 1975)(Moris, 1975) λ = 4,6 / Ct
λ = 4,6 / Ct9999 Dimana: Dimana: 4,6
4,6 = = natural natural log log of of 100100 C
C = = konsentrasi konsentrasi sisa sisa desinfektan desinfektan (mg/L)(mg/L)
tt9999 = waktu kontak sampai inaktivasi 99 % = waktu kontak sampai inaktivasi 99 % mikroorganismemikroorganisme 8.2. Pengaruh pH
8.2. Pengaruh pH
Dalam hal desinfeksi dengan senyawa khlor, pH akan sangat Dalam hal desinfeksi dengan senyawa khlor, pH akan sangat mengontrol jumlah HOCl (asam hipoklorit) dan OCl
mengontrol jumlah HOCl (asam hipoklorit) dan OCl-- (ion hipoklorit)(ion hipoklorit) dalam larutan. HOCl 80 kali
dalam larutan. HOCl 80 kali lebih efektif dibandingkan OCllebih efektif dibandingkan OCl--untuk E. Coli.untuk E. Coli. Didalam proses desinfeksi dengan khlor, harga Ct meningkat sejalan Didalam proses desinfeksi dengan khlor, harga Ct meningkat sejalan dengan kenaikan pH. Sebaliknya inaktivasi bakteri, virus, dan kista dengan kenaikan pH. Sebaliknya inaktivasi bakteri, virus, dan kista protozoa umumnya lebih efektif pada pH tinggi. Pengaruh pH pada protozoa umumnya lebih efektif pada pH tinggi. Pengaruh pH pada inaktivasi mikroba dengan kloramin tidak diketahui secara pasti karena inaktivasi mikroba dengan kloramin tidak diketahui secara pasti karena adanya hasil yang bertentangan.
adanya hasil yang bertentangan. 8.3.Temperatur
8.3.Temperatur
Inaktivasi patogen dan parasit meningkat sejalan dengan meningkatnya Inaktivasi patogen dan parasit meningkat sejalan dengan meningkatnya temperatur.
temperatur. 8.4.Pengaru
Beberapa senyawa kimia yang dapat mempengaruhi proses desinfeksi Beberapa senyawa kimia yang dapat mempengaruhi proses desinfeksi antara lain adalah senyawa nitrogen anorganik maupun organik, besi, antara lain adalah senyawa nitrogen anorganik maupun organik, besi, mangan, dan hidrogen sulfida. Senyawa organik terlarut juga menambah mangan, dan hidrogen sulfida. Senyawa organik terlarut juga menambah kebutuhan khlor dan keberadaanya menyebabkan penurunan efisiensi kebutuhan khlor dan keberadaanya menyebabkan penurunan efisiensi proses desinfeksi.
proses desinfeksi.
Kekeruhan didalam air disebabkan adanya senyawa anorganik (misal Kekeruhan didalam air disebabkan adanya senyawa anorganik (misal lumpur, tanah liat, oksida besi) dan zat organik serta sel sel mikroba. lumpur, tanah liat, oksida besi) dan zat organik serta sel sel mikroba. Kekeruhan dapat menurunkan daya desinfeksi dari khlor karena partikel Kekeruhan dapat menurunkan daya desinfeksi dari khlor karena partikel kekeruhan dapat menghalangi khlor berkontak dengan mikroba. Untuk itu kekeruhan dapat menghalangi khlor berkontak dengan mikroba. Untuk itu sebelum proses desinfeksi air harus diolah dulu untuk menghilangkan sebelum proses desinfeksi air harus diolah dulu untuk menghilangkan kekeruhan. Gabungan TOC (
kekeruhan. Gabungan TOC (Total Organic CarbonTotal Organic Carbon) dan kekeruhan akan) dan kekeruhan akan meningkatkan kebutuha
meningkatkan kebutuhan khlor n khlor sehingga tidak ekonomis.sehingga tidak ekonomis. 9.
9. Baku Mutu KhlorBaku Mutu Khlor
Tidak ada baku mutu khlor yang digunakan. Hal ini disebabkan karena Tidak ada baku mutu khlor yang digunakan. Hal ini disebabkan karena jumlah khlor atau
jumlah khlor atau desinfektan ydesinfektan yang dipakai berdaang dipakai berdasarkan kebutuhasarkan kebutuhan kita. Tetapin kita. Tetapi pada umumnya pengguanaa
pada umumnya pengguanaan khlor untuk n khlor untuk desinfektan harus memenuhi kriteria:desinfektan harus memenuhi kriteria:
Semua zat yang dapat Semua zat yang dapat dioksidasi teroksidasidioksidasi teroksidasi
Amoniak hilang sebagai gas NAmoniak hilang sebagai gas N22
masih ada residu klor masih ada residu klor aktif terlarut aktif terlarut yang konsentrasinyyang konsentrasinya dianggap perlua dianggap perlu
untuk pembasmian kuman-kuman selama proses distribusi untuk pembasmian kuman-kuman selama proses distribusi
Tetapi, Organisasi kesehatan dunia (WHO) mengeluarkan standard Tetapi, Organisasi kesehatan dunia (WHO) mengeluarkan standard residual klorin yang harus tersisa didalam sistem distribusi untuk membunuh residual klorin yang harus tersisa didalam sistem distribusi untuk membunuh mikroba selama proses pendistribusian seperti tabel
mikroba selama proses pendistribusian seperti tabel dibawah inidibawah ini Saluran
Saluran Distribusi Distribusi Residual Residual klorin klorin (mg/L)(mg/L) At
At all all points points in in a a piped piped supply supply 0.50.5 At
At standposts standposts and and wells wells 1.01.0 In
10.
10. Aplikasi Data Klorin dan Breakpoint ChlorinationAplikasi Data Klorin dan Breakpoint Chlorination
Penentuan kebutuhan deinfektan pada pengolahan air bersih dan air Penentuan kebutuhan deinfektan pada pengolahan air bersih dan air limbah merupakan pertimbangan penting dalam pendesainan. Hal ini karena limbah merupakan pertimbangan penting dalam pendesainan. Hal ini karena data ini akan menjadi pertimbangan ukuran kapasitas unit desinfeksi, jumlah data ini akan menjadi pertimbangan ukuran kapasitas unit desinfeksi, jumlah kebutuhan desinfektan, bentuk penampung, dan sebagainya
kebutuhan desinfektan, bentuk penampung, dan sebagainya
Pada desain instalasi pengolahan, dosis desinfektan jumlahnya harus Pada desain instalasi pengolahan, dosis desinfektan jumlahnya harus tepat. Tepat dalam hal ini harus menguntungkan secara ekonomi, dapat tepat. Tepat dalam hal ini harus menguntungkan secara ekonomi, dapat membunuh semua mikroba selama proses pengolahan dan distribusi serta membunuh semua mikroba selama proses pengolahan dan distribusi serta tidak meninggalkan senyawa berbahaya. Dosis klorin yang optimum tidak meninggalkan senyawa berbahaya. Dosis klorin yang optimum didapatkan dari percobaan iodometri ini. Karena setiap air memiliki didapatkan dari percobaan iodometri ini. Karena setiap air memiliki kandungan yang berbeda maka diperlukan
kandungan yang berbeda maka diperlukan Quality controlQuality control dalam pengolahandalam pengolahan air bersih dan air
air bersih dan air limbah yang diukur setiap periode waktu tertentu.limbah yang diukur setiap periode waktu tertentu.
III.
III. ALAT DAN BAHANALAT DAN BAHAN 1. 1. AlatAlat
--
Buret 25 mLBuret 25 mL--
Pipet 5 mL, 1 mLPipet 5 mL, 1 mL--
Kertas pHKertas pH--
Karet penghisapKaret penghisap2.
2. BahanBahan
--
Asam asetat (glacial) yang pekatAsam asetat (glacial) yang pekat--
Kalium iodida KI kristal (hablur)Kalium iodida KI kristal (hablur)--
Standar natrium tiosulfat NaStandar natrium tiosulfat Na22SS22OO33--
Indikator kanjiIndikator kanji--
Air HujanAir HujanIV.
IV. PROSEDUR PERCOBAANPROSEDUR PERCOBAAN
Ambil
Ambil sampel sampel (air h(air hujan)ujan) Pindahkan ke botolPindahkan ke botol winkler @100 ml (9 winkler @100 ml (9 botol) botol) Tambahkan Kaporit 0.5; 1.0; Tambahkan Kaporit 0.5; 1.0; 1.5; 2.0; 2.5; 3.0; 3.5 ml pada 1.5; 2.0; 2.5; 3.0; 3.5 ml pada botol 1-7 botol 1-7 Diamkan 30 menit Diamkan 30 menit
@ 5 ml asam asetat pekat, @ 5 ml asam asetat pekat, dikocok, cek pH (pH 3-4) dikocok, cek pH (pH 3-4) Tambahkan KI @ 1 Tambahkan KI @ 1 gram gram Titrasi dengan Na Titrasi dengan Na22SS22OO330.01 N0.01 N
sampai warna kuning hampir sampai warna kuning hampir hilang (botol 1-7)
hilang (botol 1-7)
tambahkan kanji 3 tetes tambahkan kanji 3 tetes (botol 1-7)
(botol 1-7)
Titrasi sampai warna biru Titrasi sampai warna biru hilang (botol 1-7)
Membuat Blanko & penentuan BPC Membuat Blanko & penentuan BPC
V.
V. DATA PENGAMATANDATA PENGAMATAN Waktu detensi 30 menit Waktu detensi 30 menit
Botol
Botol Titrasi NaTitrasi Na22SS22OO33Awal Awal Titrasi Titrasi NaNa22SS22OO33AkhirAkhir Total NaTotal Na22SS22OO33 (mL) (mL) Vawal
Vawal Vakhir Vakhir Vawal Vawal VakhirVakhir 1 1 - - - - 36 36 36.3 36.3 0.30.3 2 2 36.3 36.3 36.5 36.5 36.5 36.5 36.9 36.9 0.60.6 3 3 36.9 36.9 37.6 37.6 37.6 37.6 38 38 1.11.1 4 4 38 38 38.6 38.6 38.6 38.6 39.4 39.4 1.41.4 5 5 39.4 39.4 40.1 40.1 40.1 40.1 40.4 40.4 11 6 6 40.4 40.4 41.5 41.5 41.5 41.5 42.9 42.9 2.52.5 7 7 42.9 42.9 44.8 44.8 44.8 44.8 46.3 46.3 3.43.4 100 ml air keran
100 ml air keran 5 ml asam asetat pekat + 35 ml asam asetat pekat + 3 tetes indikator kanji
tetes indikator kanji
Apabila warna biru keluar Apabila warna biru keluar titrasi dengan larutan standar titrasi dengan larutan standar Na
Na22SS22OO33, jika tidak keluar, jika tidak keluar
titrasi dengan iodine 0.0282 N titrasi dengan iodine 0.0282 N sampai warna biru dan titrasi sampai warna biru dan titrasi dengan Na
dengan Na22SS22OO33 standarstandar
sampai warna hilang sampai warna hilang
Ulangi langkah untuk botol Ulangi langkah untuk botol 8 & 9 tetapi dengan waktu 8 & 9 tetapi dengan waktu kontak 5 menit dan 2 jam kontak 5 menit dan 2 jam Evaluasi waktu kontak
Evaluasi waktu kontak 5, 30 menit, dan 2 jam 5, 30 menit, dan 2 jam terhadap BPC
Blanko Blanko
Titrasi
Titrasi Iodin Iodin Titrasi Titrasi TiosulfatTiosulfat
Vawal Vakhir Vawal Vakhir
Vawal Vakhir Vawal Vakhir
15.8 16.3 46.3 47.6
15.8 16.3 46.3 47.6
Total
Total 0.5 0.5 1.31.3
Titrasi Tiosulfat > titrasi Iodin maka blanko bernilai Positif Titrasi Tiosulfat > titrasi Iodin maka blanko bernilai Positif Waktu detensi 5 menit
Waktu detensi 5 menit Botol
Botol Titrasi NaTitrasi Na22SS22OO33Awal Awal Titrasi Titrasi NaNa22SS22OO33 AkhirAkhir Total NaTotal Na22SS22OO33 (mL) (mL) Vawal
Vawal VakhirVakhir VawalVawal VakhirVakhir 8
8 48 48 48.8 48.8 48.8 48.8 50 50 22 Waktu detensi 2 jam
Waktu detensi 2 jam
Botol
Botol Titrasi NaTitrasi Na22SS22OO33Awal Awal Titrasi Titrasi NaNa22SS22OO33 AkhirAkhir Total NaTotal Na22SS22OO33 (mL) (mL) Vawal
Vawal VakhirVakhir VawalVawal VakhirVakhir 9
9 50 50 50.6 50.6 50.6 50.6 51.2 51.2 1.21.2
VI.
VI. PENGOLAHAN DATAPENGOLAHAN DATA
Pengolahan data bteakpoint chlorination Pengolahan data bteakpoint chlorination Botol 2 Botol 2 mg ClO mg ClO22 /L = /L = − − 3545335453 = = 0.60.6−−0.40.4 0.0870.087 3545335453 11 100 100 = 6.17 mg/l = 6.17 mg/l Botol 3 Botol 3 mg ClO mg ClO22 /L = /L = − − 3545335453 = = 1.11.1−−0.40.4 0.0870.087 3545335453 11 100 100 = 21.6 mg/l = 21.6 mg/l Botol 4 Botol 4 mg ClO mg ClO22 /L = /L = − − 3545335453 = = 1.41.4−−0.40.4 0.0870.087 3545335453 11 100 100
= 30.48 mg/l = 30.48 mg/l Botol 5 Botol 5 mg ClO mg ClO22 /L = /L = − − 3545335453 = = 11−−0.40.4 0.0870.087 3545335453 11 100 100 = 18.51 mg/l = 18.51 mg/l Botol 6 Botol 6 mg ClO2/L = mg ClO2/L = − − 3545335453 = = 2.52.5−−0.40.4 0.0870.087 3545335453 11 100 100 = 64.77 mg/l = 64.77 mg/l Botol 7 Botol 7 mg ClO2/L = mg ClO2/L = − − 3545335453 = = 3.43.4−−0.40.4 0.0870.087 3545335453 11 100 100 = 92.53 mg/l = 92.53 mg/l
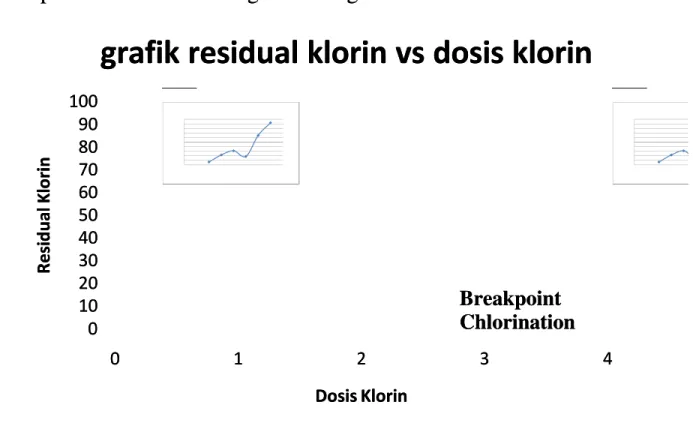
Data yang diperoleh kemudian di plot ke dalam gravik dosis Klorin vs Data yang diperoleh kemudian di plot ke dalam gravik dosis Klorin vs Residual klorin Residual klorin 0 0 10 10 20 20 30 30 40 40 50 50 60 60 70 70 80 80 90 90 100 100 0 1 2 3 4 0 1 2 3 4 R R e e s s i i d d u u a a l l K K l l o o r r i i n n Dosis Klorin Dosis Klorin
grafik residual klorin vs dosis klorin
grafik residual klorin vs dosis klorin
Breakpoint Breakpoint Chlorination Chlorination
Pengolahan data hubungan waktu kontak dengan klorinasi Pengolahan data hubungan waktu kontak dengan klorinasi
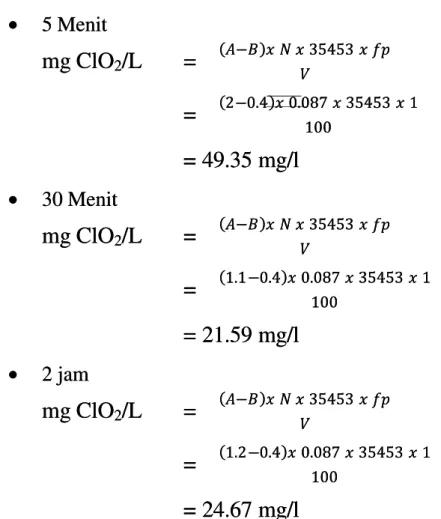
5 Menit5 Menit mg ClO mg ClO22 /L /L == − − 3545335453 = = 22−−0.40.4 0.0870.087 3545335453 11 100 100 = 49.35 mg/l = 49.35 mg/l 30 Menit30 Menit mg ClO mg ClO22 /L /L == − − 3545335453 = = 1.11.1−−0.40.4 0.0870.087 3545335453 11 100 100 = 21.59 mg/l = 21.59 mg/l 2 jam2 jam mg ClO mg ClO22 /L /L == − − 3545335453 = = 1.21.2−−0.40.4 0.0870.087 3545335453 11 100 100 = 24.67 mg/l = 24.67 mg/l
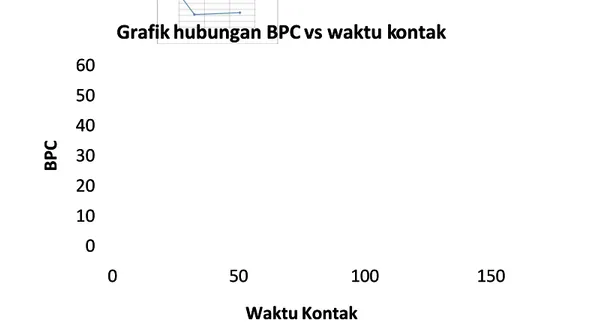
Grafik hubungan waktu kontak terhadap titik BPC Grafik hubungan waktu kontak terhadap titik BPC
0 0 10 10 20 20 30 30 40 40 50 50 60 60 0 0 5500 110000 115500 B B P P C C Waktu Kontak Waktu Kontak Grafik
VII.
VII. ANALISISANALISIS 1.
1. Analisis PercobaanAnalisis Percobaan
Percobaan ini bertujuan untuk mengetahui jumlah khlor yang Percobaan ini bertujuan untuk mengetahui jumlah khlor yang dibutuhkan untuk air baku dengan kualitas tertentu sehingga tercapai titik dibutuhkan untuk air baku dengan kualitas tertentu sehingga tercapai titik breakpoint chlorination
breakpoint chlorination (BPC). Sebelum melakukan percobaan praktikan(BPC). Sebelum melakukan percobaan praktikan melakukan persiapan yaitu mengumpulkan sampel air hujan. Alasan melakukan persiapan yaitu mengumpulkan sampel air hujan. Alasan penggunaan air hujan karena air hujan memiliki kualitas yang hampir sama penggunaan air hujan karena air hujan memiliki kualitas yang hampir sama dengan air olahan yang siap untuk diklorinasi dalam pengolahan air bersih. dengan air olahan yang siap untuk diklorinasi dalam pengolahan air bersih. AirAir hujan yang dipakai oleh kelompok praktikan adalah air hujan dari talang di hujan yang dipakai oleh kelompok praktikan adalah air hujan dari talang di gedung K Fakultas Teknik, Universitas Indonesia. sampel yang diambil gedung K Fakultas Teknik, Universitas Indonesia. sampel yang diambil sebanya
sebanyak minimal k minimal 900 mL.900 mL.
Setelah melakukan persiapan, praktikan melakukan pengujian untuk Setelah melakukan persiapan, praktikan melakukan pengujian untuk mengetahui
mengetahui breakpoint chlorinationbreakpoint chlorination (BPC). Pertama praktikan memasukan(BPC). Pertama praktikan memasukan 100 mL sampel kedalam botol Winkler. Setelah itu praktikan menambahkan 100 mL sampel kedalam botol Winkler. Setelah itu praktikan menambahkan larutan kaporit kedalam masing masing sampel sebanyak 0,5; 1,0;
larutan kaporit kedalam masing masing sampel sebanyak 0,5; 1,0; 1,5; 2,0; 2,5;1,5; 2,0; 2,5; 3,0; 3,5 mL kemudian botol winkler ditutup dan sampel dihomogenkan 3,0; 3,5 mL kemudian botol winkler ditutup dan sampel dihomogenkan dengan cara mengocoknya. Kaporit (Ca(OCl)
dengan cara mengocoknya. Kaporit (Ca(OCl)22) ini akan segera larut dan) ini akan segera larut dan terionisasi menurut reaksi
terionisasi menurut reaksi Ca(OCl)
Ca(OCl)22 CaCa2+2+ + 2OCl+ 2OCl --Selanjutnya OCl
Selanjutnya OCl – – akan membentuk kesetimbangan dengan air menurut reaksiakan membentuk kesetimbangan dengan air menurut reaksi
HOCl H
HOCl H++ + OCl+ OCl --Pada 20
Pada 20ooC reaksi ini C reaksi ini memiliki konstanta kesetimbangan 2,7 x 10memiliki konstanta kesetimbangan 2,7 x 10-8-8
Sampel kemudian didiamkan selama 30 menit. Pendiaman sampel 30 menit Sampel kemudian didiamkan selama 30 menit. Pendiaman sampel 30 menit iniini disebut waktu kontak. Penggunaan waktu 30 menit karena menyesuaikan disebut waktu kontak. Penggunaan waktu 30 menit karena menyesuaikan waktu kontak yang ada di dalam sistem
waktu kontak yang ada di dalam sistem pengolahan air minum.pengolahan air minum.
Setelah itu, praktikan kemudian menentukan konsentrasi dari khlor Setelah itu, praktikan kemudian menentukan konsentrasi dari khlor aktif. Caranya, pertama tambahkan asam asetat pekat (glacial) sebanyak 5 ml aktif. Caranya, pertama tambahkan asam asetat pekat (glacial) sebanyak 5 ml ke dalam masing-masing sampel. Tujuan penambahan asam asetat pekat ini ke dalam masing-masing sampel. Tujuan penambahan asam asetat pekat ini adalah agar kondisi sampel asam dengan pH 3-4 (pH diukur dengan kertas adalah agar kondisi sampel asam dengan pH 3-4 (pH diukur dengan kertas pH) . Hal ini karena reaksi oksidasi iodin oleh residual klorin optimum pada pH) . Hal ini karena reaksi oksidasi iodin oleh residual klorin optimum pada kondisi tersebut. optimum karena pada pH tersebut senyawa yang akan kondisi tersebut. optimum karena pada pH tersebut senyawa yang akan mengoksidasi klorin ada pada jumlah yang paling banyak. Kemudian mengoksidasi klorin ada pada jumlah yang paling banyak. Kemudian tambahkan KI sebanyak 1 gram, dan homogenkan lagi sampel dengan cara tambahkan KI sebanyak 1 gram, dan homogenkan lagi sampel dengan cara mengocokny
kuning kecoklatan. Hal ini terjadi karena terjadi oksidasi ion iodida dari KI kuning kecoklatan. Hal ini terjadi karena terjadi oksidasi ion iodida dari KI menjadi iodin (I
menjadi iodin (I22) menurut reaksi:) menurut reaksi: OCl
OCl-- + + 2 2 KI KI + + 2 2 HAs HAs II22+ 2 KAs + Cl+ 2 KAs + Cl--+ 2 H+ 2 H22OO NH
NH22Cl Cl + + 2 2 KI KI + + 2 2 HAs HAs II22+ KAs + KCl + NH+ KAs + KCl + NH44AsAs Atau dapat disederhanakan dalam persamaan ion bersih
Atau dapat disederhanakan dalam persamaan ion bersih menjadimenjadi Cl
Cl22+ 2I+ 2I-- II22 + 2Cl+ 2Cl
--Iodin yang terbentuk akan semakin banyak dengan pertambahan Iodin yang terbentuk akan semakin banyak dengan pertambahan jumlah kaporit.
jumlah kaporit. Hal Hal ini ini ditunjukan dengan semakin ditunjukan dengan semakin kuning larutan kuning larutan pada botolpada botol sampel dengan jumlah kaporit lebih banyak. Iodin yang terbentuk ini akan sampel dengan jumlah kaporit lebih banyak. Iodin yang terbentuk ini akan semakin jelas dengan penambahan indikator amilum. Setelah ditambah semakin jelas dengan penambahan indikator amilum. Setelah ditambah amilum iodin akan berubah menjadi biru tua.
amilum iodin akan berubah menjadi biru tua. II2 2 ++kanji kanji (strach) (strach) warna warna birubiru
Warna biru tua ini diakibatkan dari iodin yang terperangkap didalam Warna biru tua ini diakibatkan dari iodin yang terperangkap didalam rantai spiral polisakarida (Amilum adalah polisakarida yang merupakan rantai spiral polisakarida (Amilum adalah polisakarida yang merupakan strukrur polimer kompleks). Larutan yang encer kemudian dititrasi dengan strukrur polimer kompleks). Larutan yang encer kemudian dititrasi dengan larutan standard tiosulfat sampai warna biru
larutan standard tiosulfat sampai warna biru tepat hilang. Penyebab warna birutepat hilang. Penyebab warna biru hilang karena iodin (berwarna biru) tepat habis bereaksi dengan tiosulfat. hilang karena iodin (berwarna biru) tepat habis bereaksi dengan tiosulfat. Tetapi apabila larutan sampel pekat (kuning kecoklatan) sebelum diberi Tetapi apabila larutan sampel pekat (kuning kecoklatan) sebelum diberi indikator amilum harus dititrasi dahulu dengan larutan standard tiosulfat untuk indikator amilum harus dititrasi dahulu dengan larutan standard tiosulfat untuk mengurangi kepekatan iodin (sampai warna kuning muda). Penurunan mengurangi kepekatan iodin (sampai warna kuning muda). Penurunan kepekatan ini karena iodin akan bereaksi dengan tiosulfat. Setelah itu larutan kepekatan ini karena iodin akan bereaksi dengan tiosulfat. Setelah itu larutan bisa ditambahkan indikator amilum. Larutan yang sudah diberi indikator bisa ditambahkan indikator amilum. Larutan yang sudah diberi indikator amilum kemudian di titrasi lagi dengan larutan standard tiosulfat. mL titran amilum kemudian di titrasi lagi dengan larutan standard tiosulfat. mL titran merupakan akumulasi dari mL tiosulfat yang digunakan dalam satu kali titrasi merupakan akumulasi dari mL tiosulfat yang digunakan dalam satu kali titrasi yaitu pada sebelum penambahan amilum dan setelah penambahan amilum. yaitu pada sebelum penambahan amilum dan setelah penambahan amilum. Iodine yang berikatan lemah dengan amilum akan segera lepas ketika dititrasi Iodine yang berikatan lemah dengan amilum akan segera lepas ketika dititrasi karena ikatan tersebut didesak oleh tiosulfat.
karena ikatan tersebut didesak oleh tiosulfat. Reaksi kimia yang terjadi selamaReaksi kimia yang terjadi selama titrasi adalah reaksi redoks yang mengubah I
titrasi adalah reaksi redoks yang mengubah I22 menjadi Imenjadi I-- menurut reaksi:menurut reaksi: II22 + 2Na+ 2Na22SS22OO33 NaNa22SS44OO66+ 2NaI+ 2NaI
Atau dapat dituliskan dalam persamaan ion bersih sebagai berikut: Atau dapat dituliskan dalam persamaan ion bersih sebagai berikut:
II22 + 2S+ 2S22OO332-2- SS44OO662-2- + 2I+ 2I
--Setelah didapatkan ml titran praktikan kemudian membuat larutan Setelah didapatkan ml titran praktikan kemudian membuat larutan blanko dengan air keran. Syarat larutan blanko adalah tidak mengandung blanko dengan air keran. Syarat larutan blanko adalah tidak mengandung senyawa khlor didalamnya dan air keran dianggap tidak mengandung khlor senyawa khlor didalamnya dan air keran dianggap tidak mengandung khlor karena air keran di FT UI berasal dari air tanah. Larutan blanko diperlakukan karena air keran di FT UI berasal dari air tanah. Larutan blanko diperlakukan sama dengan larutan sampel. Hanya saja blanko tidak ditambahkan kaporit sama dengan larutan sampel. Hanya saja blanko tidak ditambahkan kaporit dan setelah ditambahkan amilum, larutan dititrasi dengan larutan iodin. Hal dan setelah ditambahkan amilum, larutan dititrasi dengan larutan iodin. Hal iniini karena didalam larutan blanko tidak t
karena didalam larutan blanko tidak terdapat iodin sebagai hasil reaksi denganerdapat iodin sebagai hasil reaksi dengan kaporit. Tujuan penambahan iodin hanya dijadikan sebagai indikator yang kaporit. Tujuan penambahan iodin hanya dijadikan sebagai indikator yang ditandai dengan warna biru. Larutan kemudian dititrasi dengan larutan ditandai dengan warna biru. Larutan kemudian dititrasi dengan larutan standard tiosulfat sampai warna biru tepat hilang.
standard tiosulfat sampai warna biru tepat hilang.
Data yang diperoleh kemudian diolah dengan menggunakan rumus Data yang diperoleh kemudian diolah dengan menggunakan rumus yang ada dan direpresentasikan dalam grafik dosis klorin vs khlor
yang ada dan direpresentasikan dalam grafik dosis klorin vs khlor aktif.aktif.
Setelah didapatkan grafik BPC maka praktikan menentukan dosis Setelah didapatkan grafik BPC maka praktikan menentukan dosis kaporit dimana terjadi BPC. Pada dosis tersebut diuji lagi dengan cara yang kaporit dimana terjadi BPC. Pada dosis tersebut diuji lagi dengan cara yang sama tetapi dengan waktu kontak yang berbeda. Hal ini digunakan untuk sama tetapi dengan waktu kontak yang berbeda. Hal ini digunakan untuk menguji pengaruh lamanya waktu kontak terhadap klorinasi.
menguji pengaruh lamanya waktu kontak terhadap klorinasi. 2.
2. Analisis HasilAnalisis Hasil
Data yang diperoleh berupa ml titran, ml blanko, volume sampel, Data yang diperoleh berupa ml titran, ml blanko, volume sampel, normalitas tiosulfat, dan faktor pengenceran diolah menggunakan rumus normalitas tiosulfat, dan faktor pengenceran diolah menggunakan rumus
− − 3545335453
. Dari pengolahan diperoleh data mg ClO2/l yang. Dari pengolahan diperoleh data mg ClO2/l yang
direpresentas
direpresentasikan didalam ikan didalam grafik sebagai berikut:grafik sebagai berikut:
0 0 10 10 20 20 30 30 40 40 50 50 60 60 70 70 80 80 90 90 100 100 0 1 2 3 4 0 1 2 3 4 R R e e s s i i d d u u a a l l K K l l o o r r i i n n Dosis Klorin Dosis Klorin
grafik residual klorin vs dosis klorin
grafik residual klorin vs dosis klorin
Breakpoint Breakpoint Chlorination Chlorination
Dari grafik diatas kita
Dari grafik diatas kita bisa menganalisanybisa menganalisanya sebagai berikuta sebagai berikut
Pada zona 1 terjadi oksidasi klorin. Klorin yang memiliki biloks 0 Pada zona 1 terjadi oksidasi klorin. Klorin yang memiliki biloks 0 dioksidasi menjadi hipoklorit yang memiliki biloks +1. Tahap ini tidak selalu dioksidasi menjadi hipoklorit yang memiliki biloks +1. Tahap ini tidak selalu ada karen
ada karena khlor yang diga khlor yang digunakan tidak sunakan tidak selalu dalam kondisi seelalu dalam kondisi sebagai bagai klorin.klorin. Selanjutnya pada zona II merupakan terjadi pembentukan kloramin dan Selanjutnya pada zona II merupakan terjadi pembentukan kloramin dan senyawa kloro-organik (bila sampel mengandung zat organik). Kloramin juga senyawa kloro-organik (bila sampel mengandung zat organik). Kloramin juga biasa disebut dengan
biasa disebut dengan combined chlorine residualcombined chlorine residual. Kloramin yang mungkin. Kloramin yang mungkin terbentuk
terbentuk adalah adalah mono-, di-, mono-, di-, dan trikloradan trikloramin. pembenmin. pembentukan intukan ini tergantungi tergantung ketersediaan khlor dan amonia sebagai penyusun utamanya. Kemungkinan ketersediaan khlor dan amonia sebagai penyusun utamanya. Kemungkinan reaksi pembentukan kloramin adalah sebagai berikut:
reaksi pembentukan kloramin adalah sebagai berikut: NH
NH33 + + HOCl HOCl NHNH22Cl Cl + + HH22O O (Monokloramin)(Monokloramin) NH
NH22Cl Cl + + HOCl HOCl NHClNHCl22 + + HH22O O (Dikloramin)(Dikloramin) NHCl
NHCl22 + + HOCl HOCl NClNCl33 + H+ H22O O (Trikloramin)(Trikloramin)
Mono-, dan dikloramin mempunyai kekuatan desinfeksi yang Mono-, dan dikloramin mempunyai kekuatan desinfeksi yang signifikan sehingga menjadi pertimbangan dalam perhitungan residual klorin. signifikan sehingga menjadi pertimbangan dalam perhitungan residual klorin. Apabila perbandingan mol antara klorin dengan amonia adalah 1 : 1 maka Apabila perbandingan mol antara klorin dengan amonia adalah 1 : 1 maka akan terbentuk mono-, dan dikloramin. Pembentukan ini juga
akan terbentuk mono-, dan dikloramin. Pembentukan ini juga bergantung padabergantung pada pH sampel. Pada pH rendah pembentukan dikloramin lebih dominan. pH sampel. Pada pH rendah pembentukan dikloramin lebih dominan. Sementara apabila rasio mol klorin terhadap amonia 1.5 atau
Sementara apabila rasio mol klorin terhadap amonia 1.5 atau lebih, maka akanlebih, maka akan terbentuk trikloramin, N
terbentuk trikloramin, N22 dan NOdan NO2-2- . pH juga merupakan parameter penting,. pH juga merupakan parameter penting, dalam hal ini pH berpengaruh pada rasio mol klorin terhadap amonia dan dalam hal ini pH berpengaruh pada rasio mol klorin terhadap amonia dan
0 0 10 10 20 20 30 30 40 40 50 50 60 60 70 70 80 80 90 90 100 100 0 1 2 3 4 0 1 2 3 4 R R e e s s i i d d u u a a l l K K l l o o r r i i n n Dosis Klorin Dosis Klorin
grafik residual klorin vs dosis klorin
grafik residual klorin vs dosis klorin
Breakpoint Breakpoint Chlorination Chlorination Breakpoint Breakpoint Chlorination Chlorination Z
apakah akan terbentuk trikloramin, N
apakah akan terbentuk trikloramin, N22 atau NOatau NO2-2-. Pada zona III terjadi. Pada zona III terjadi penurunan residu klorin terkombinasi. Penurunan residu klorin dengan penurunan residu klorin terkombinasi. Penurunan residu klorin dengan penambahan klorin ini disebabkan oleh dekomposisi kloramin menjadi gas penambahan klorin ini disebabkan oleh dekomposisi kloramin menjadi gas nitrogen (N
nitrogen (N22). Penurunan ini suatu saat akan mencapai nilai minimum yang). Penurunan ini suatu saat akan mencapai nilai minimum yang kemudian disebut dengan
kemudian disebut dengan breakpoint chlorinationbreakpoint chlorination (klorinasi titik retak). Pada(klorinasi titik retak). Pada titik ini jumlah residual klorin, amonia dan klorin terkombinasi ada pada titik ini jumlah residual klorin, amonia dan klorin terkombinasi ada pada jumlah
jumlah paling paling minimum. minimum. BPC BPC digunakan digunakan untuk untuk memperoleh memperoleh free free chlorinechlorine residual yang memiliki kekuatan desinfeksi lebih baik apabila supplai air residual yang memiliki kekuatan desinfeksi lebih baik apabila supplai air mengandung amonia. BPC juga digunakan sebagai metode untuk mengandung amonia. BPC juga digunakan sebagai metode untuk menghilangkan amonia pada pengolahan air limbah. Pada zona IV, terlihat menghilangkan amonia pada pengolahan air limbah. Pada zona IV, terlihat bahwa residu klorin jumlahnya semakin besar seiring dengan penambahan bahwa residu klorin jumlahnya semakin besar seiring dengan penambahan klorin. Hal ini
klorin. Hal ini karena senyawa senyawa yang mungkin bereaksi dengan klorinkarena senyawa senyawa yang mungkin bereaksi dengan klorin seperti amonia, besi dan mangan sudah tidak ada lagi, sehingga tidak akan seperti amonia, besi dan mangan sudah tidak ada lagi, sehingga tidak akan menggangg
mengganggu pembentukan residu klorin u pembentukan residu klorin bebas (bebas ( free chlorine free chlorine residualresidual).). Pada pengolahan air bersih jumlah klorin (
Pada pengolahan air bersih jumlah klorin (Chlorine Demand Chlorine Demand ) menjadi) menjadi parameter yang penting. Hal ini untuk memastikan air yang terdistribusikan parameter yang penting. Hal ini untuk memastikan air yang terdistribusikan tidak mengandung bahan atau mikroba yang berbahaya. Penentuan jumlah tidak mengandung bahan atau mikroba yang berbahaya. Penentuan jumlah klorin untuk tiap air sangat bervariasi. Hal ini disebabkan oleh kandungan air klorin untuk tiap air sangat bervariasi. Hal ini disebabkan oleh kandungan air seperti jumlah amonia, besi, mangan dan lain-lain yang berbeda beda antara seperti jumlah amonia, besi, mangan dan lain-lain yang berbeda beda antara satu tempat dengan tempat lainnya.Penggunaan klorin sebagai desinfektan satu tempat dengan tempat lainnya.Penggunaan klorin sebagai desinfektan harus mampu membunuh seluruh mikroba yang ada dan masih menyisakan harus mampu membunuh seluruh mikroba yang ada dan masih menyisakan residu klorin bebas yang memiliki kekuatan desinfeksi selama proses residu klorin bebas yang memiliki kekuatan desinfeksi selama proses distribusi untuk membunuh mikroba yang selama proses distribusi mungkin distribusi untuk membunuh mikroba yang selama proses distribusi mungkin hadir.
hadir. Residu yang Residu yang masih tersisa masih tersisa untuk proses untuk proses distribusi harus distribusi harus memenuhimemenuhi syarat berikut ini:
syarat berikut ini: Saluran
Saluran Distribusi Distribusi Residual Residual klorin klorin (mg/L)(mg/L) At
At all all points points in in a a piped piped supply supply 0.50.5 At
At standposts standposts and and wells wells 1.01.0 In
Sementara pengujian selanjutnya setelah didapatkan BPC adalah pengujian Sementara pengujian selanjutnya setelah didapatkan BPC adalah pengujian waktu kontak terhadap konsentrasi residu klorin
waktu kontak terhadap konsentrasi residu klorin
Grafik diatas adalah grafik dari BPC terhadap waktu kontak. Tujuan Grafik diatas adalah grafik dari BPC terhadap waktu kontak. Tujuan dari pengujian adalah ini untuk mengetahui hubungan waktu kontak terhadap dari pengujian adalah ini untuk mengetahui hubungan waktu kontak terhadap BPC (Residu klorin). Dari grafik terlihat bahwa semakin lama waktu kontak BPC (Residu klorin). Dari grafik terlihat bahwa semakin lama waktu kontak BPC makin kecil (residu klorin makis sedikit). Hal ini disebabkan karena BPC makin kecil (residu klorin makis sedikit). Hal ini disebabkan karena semakin lama waktu kontak maka klorin akan semakin banyak bereaksi semakin lama waktu kontak maka klorin akan semakin banyak bereaksi dengan senyawa-senyawa yang ada di dalam sampel. Senyawa yang sudah dengan senyawa-senyawa yang ada di dalam sampel. Senyawa yang sudah bereaksi sebagian tidak bisa lagi mengoksidasi Iodine sebagai indikator atau bereaksi sebagian tidak bisa lagi mengoksidasi Iodine sebagai indikator atau dasar perhitungan klorin aktif sehingga jumlahnya semakin menurun terhadap dasar perhitungan klorin aktif sehingga jumlahnya semakin menurun terhadap waktu.
waktu.
Dalam pengolahan air bersih waktu kontak menjadi pertimbangan yang Dalam pengolahan air bersih waktu kontak menjadi pertimbangan yang sangat penting. Hal ini karena proses desinfeksi sebanding dengan Ct. C sangat penting. Hal ini karena proses desinfeksi sebanding dengan Ct. C adalah konsentrasi desinfektan dan t adalah waktu kontak. Semakin lama adalah konsentrasi desinfektan dan t adalah waktu kontak. Semakin lama waktu kontak maka jumlah mikroba yang terbunuh akan semakin banyak. waktu kontak maka jumlah mikroba yang terbunuh akan semakin banyak. Tetapi ada
Tetapi ada trade off trade off yang membatasi lamanya waktu kontak. Penentuanyang membatasi lamanya waktu kontak. Penentuan lamanya waktu kontak ini nantinya berhubungan dengan desain dan kapasitas lamanya waktu kontak ini nantinya berhubungan dengan desain dan kapasitas bak penampungan dan debit yang akan debit kebutuhan. Penentuan waktu bak penampungan dan debit yang akan debit kebutuhan. Penentuan waktu kontak dipilih yang paling optimum secara ekonomi dan masih memenuhi kontak dipilih yang paling optimum secara ekonomi dan masih memenuhi standar yang ada.
standar yang ada. 3.
3. Analisis KesalahanAnalisis Kesalahan
Ada beberapa kesalahan didalam praktikum yang menyebabkan data Ada beberapa kesalahan didalam praktikum yang menyebabkan data yang diperoleh tidak sesuai dengan literatur. Ketidaksesuaian tersebut antara yang diperoleh tidak sesuai dengan literatur. Ketidaksesuaian tersebut antara
0 0 10 10 20 20 30 30 40 40 50 50 60 60 0 0 5500 110000 115500 B B P P C C Waktu Kontak Waktu Kontak Grafik