6 BAB II
KAJIAN PUSTAKA A. Deskripsi Teoritik
1. Titanium Dioksida (TiO2)
Titanium dioksida (TiO2) juga bisa disebut Titania atau Titanium (IV) oksida
merupakan bentuk oksida dari titanium secara kimia dapat dituliskan TiO2.
Senyawa ini dimanfaatkan secara luas dalam bidang anatas sebagai pigmen, bakterisida, pasta gigi, fotokatalis dan elektroda dalam sel surya [1]. Titanium dioksida (TiO2) dapat dihasilkan dari reaksi antara senyawa titanium tetraklorida
(TiCl4) dan O2 yang dilewatkan melalui lorong silika pada suhu 700oC. Senyawa
TiO2 bersifat amfoter, terlarut secara lambat dalam H2SO4(aq) pekat, membentuk
kristal sulfat dan menghasilkan produk titanat dengan alkali cair. Sifat senyawa TiO2 adalah tidak tembus cahaya, mempunyai warna putih, lembam, tidak
beracun, dan harganya relatif murah. Titanium dioksida dapat dihasilkan dari proses sulfat ataupun klorin [38].
Titanium dioksida (TiO2) memiliki tiga fase struktur kristal, yaitu anatas,
rutil, brookit. Akan tetapi hanya anatas dan rutil saja yang keberadaanya di alam cukup stabil [6]. Kemampuan fotoaktivitas semikonduktor TiO2 dipengaruhi oleh
morfologi, luas permukaan, kristanilitas dan ukuran partikel. Anatas diketahui sebagai kristal titania yang lebih fotoaktif daripada rutil. Hal ini disebabkan harga Eg TiO2 jenis anatas yang lebih tinggi yaitu sebesar 3,2 eV sedangkan rutil
sebesar 3,0 eV. Harga Eg yang lebih tinggi akan menghasilkan luas permukaan aktif yang lebih besar sehingga menghasilkan fotoaktivitas yang lebih efektif [18]. Bentuk titanium dioksida yang stabil adalah rutil, dimana bentuk lain titanium dioksida berubah pada suhu tinggi. Rutil mempunyai struktur kristal mirip dengan anatas, dengan pengecualian bahwa Ti-O oktahedral patungan 4 sisi bukan 4 sudut. Struktur rutil dan anatas dapat digambarkan sebagai rantai oktahedral TO6 kedua struktur kristal dibedakan oleh distorsi oktahedral dan pola susunan
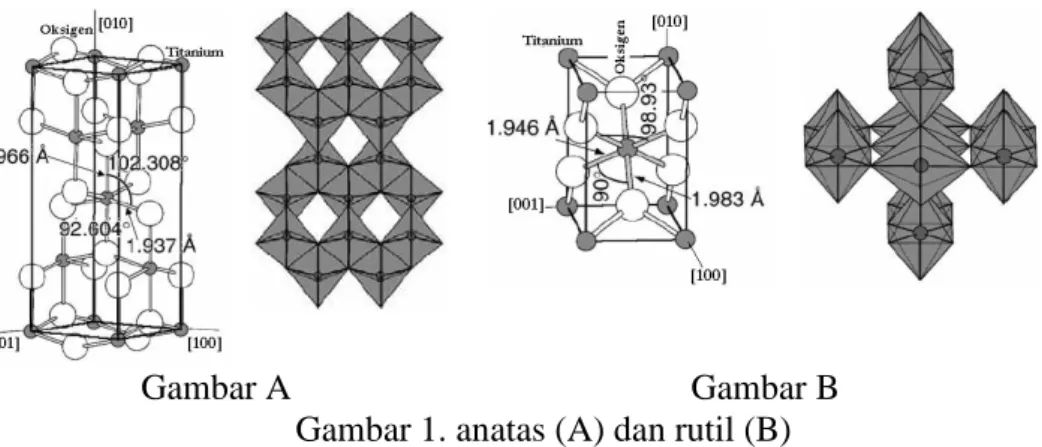
rantai oktahedralnya. Penataan tersebut menghasilkan terbentuknya rantai yang tersusun dalam simetri empat lipat seperti ditunjukan oleh Gambar 1 [39].
7
Gambar A Gambar B
Gambar 1. anatas (A) dan rutil (B)
Perbandingan sifat struktur TiO2 jenis rutil dan anatas dapat dilihat pada
Tabel 1.
Tabel 1. Perbandingan sifat TiO2 jenis rutil dan anatas
Sifat Rutil Anatas
Bentuk kristal Tetragonal Tetragonal
Tetapan kisi a 4,58 Å 3,78 Å Tetapan kisi c 2,95 Å 4,49 Å Berat jenis 4,2 3,9 Indeks bias 2,71 2,52 Kekerasan 6,0-7,0 5,5-6,0 Permitivitas 114 31
Titik didih 1858 °C Berubah jadi rutil pada
suhu tinggi
Serbuk TiO2 dengan struktur rutil paling luas penggunaanya karena indeks
biasnya yang tinggi, warna yang kuat, dan sifat kimianya yang inert. Struktur anatas lebih baik untuk aplikasi sel surya berbasis sensitiser zat warna pada lapis tipis TiO2 .
2. Fotokatalis TiO2
Fotokatalis adalah reaksi yang melibatkan cahaya (fotoreaksi) dan mengalami peningkatan kecepatan reaksi akibat adanya katalis yang mengabsorbsi energi cahaya ultraviolet (UV) sehingga menghasilkan senyawa pereduksi dan pengoksidasi pada permukaan katalis. Proses di atas didasarkan pada kemampuan ganda suatu material semikonduktor (misalnya TiO2, ZnO, Fe2O3, CdS, ZnS)
untuk menyerap foton dan melakukan reaksi transformasi antar muka material secara simultan.
8
Salah satu tipe kristal dari TiO2 adalah anatas. TiO2 tipe anatas memiliki
aktivitas fotokatalisis terbaik dibandingkan dengan struktur kristal rutil dan brookit. TiO2 merupakan semikonduktor yang memiliki celah pita yang luas,
celah pita energi rutil adalah 3,00 ev sedangkan celah pita energi anatas adalah 3,23 ev. TiO2 tipe anatas biasa digunakan dalam fotokatalis karena dapat
menunjukkan aktivitas fotokatalik yang tinggi. Keterbatasan semikonduktor sebagai fotokatalis dapat diatasi dengan memodifikasi permukaan semikonduktor dengan penambahan logam misalnya dengan penambahan perak ke permukaan TiO2 dapat meningkatkan aktivitas fotokatalis.
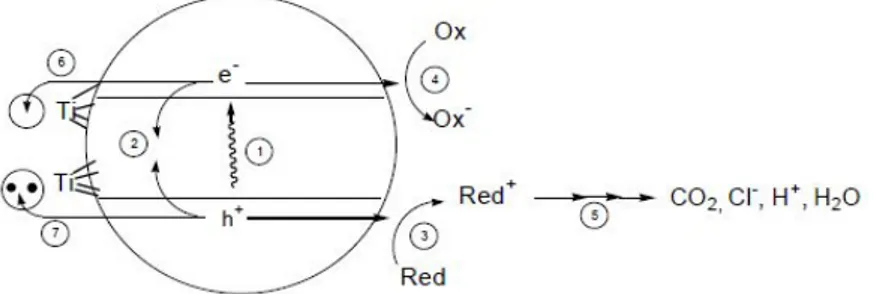
Secara umum, fenomena fotokatalitik pada permukaan semikonduktor dapat dipahami dengan penjelasan seperti ditunjukkan oleh Gambar 2 [22]. Jika suatu semikondutor tipe n dikenai cahaya (hυ) dengan energi yang sesuai, maka elektron (e-) pada pita valensi akan pindah ke pita konduksi, dan meninggalkan lubang positif (hole, disingkat sebagai h+) pada pita valensi. Sebagian besar pasangan e- dan h+ ini akan berekombinasi kembali, baik di permukaan atau di
dalam bulk partikel. Sementara itu sebagian pasangan e- dan h+ dapat bertahan
sampai pada permukaan semikondutor. Dimana h+ dapat menginisiasi reaksi
oksidasi dan dilain pihak e- akan menginisiasi reaksi reduksi zat kimia yang ada
disekitar permukaan semikonduktor [40].
Gambar 2. Skema fotoeksitasi yang diikuti oleh deeksitasi pada permukaan semikonduktor
Mekanisme yang menggambarkan efek fotokatalitik dari TiO2 dapat diamati
9
Gambar 3. Mekanisme perpindahan elektron karena adanya pengaruh cahaya pada TiO2
Gambar. 3 menunjukkan tahapan utama mekanisme fotokatalitik pada semikonduktor TiO2 yang meliputi :
a. Pembentukan muatan oleh foton: jika fotokatalis dikenai radiasi foton (hυ) dengan energi hυ yang besarnya sama atau melebihi energi celahnya (Eg), maka satu elektron akan tereksitasi ke dalam pita konduksi (ecb-) dengan
meninggalkan kekosongan pada pita valensi (hvb+). Reaksi tersebut dapat
dituliskan sebagai berikut.
TiO2 + hυ hvb+ + ecb
-b. Rekombinasi pembawa muatan: kekosongan (lubang pada pita valensi (hvb+)).
dapat bertindak sebagai oksidator yang cukup kuat dan dapat bergabung dengan elektron pada pita konduksi (ecb-) sambil melepas panas. Reaksi
tersebut dapat dituliskan sebagai berikut. ecb- + {>TiIV OH } >TiIV OH
hvb+ + {>TiIV OH } >TiIV OH
c. Jika dalam sistem terdapat substrat yang dapat teroksidasi maka lubang pada pita valensi (hvb+) akan menginisiasi reaksi oksidasi terhadap substrat
tersebut.
d. Jika di dalam sistem terdapat suatu oksidator (misal oksigen) maka dapat terjadi inisiasi reaksi reduksi oleh elektron pada pita konduksi (ecb-).
e. Reaksi fotoreduksi terkatalis dan reaksi termal lanjutan (misal reaksi hidrolisis atau reaksi dengan oksigen aktif) akan menghasilkan gas CO2, H+,
10
f. Penjebakan(trapping) elektron pada pita konduksi (ecb-) ke permukaan
fotokatalis TiIV OH membentuk TiIIIOH. Reaksi tersebut dapat dituliskan sebagai berikut:
ecb- + >TiIV OH {>TiIV OH }
ecb- + TiIV TiIII
g. Penjebakan (trapping) lubang pada pita valensi (hvb+) ke dalam permukaan
gugus titanol menghasilkan OH•. OH• pada permukaan TiIVOH dapat bertindak sebagai oksidator. Reaksi tersebut dapat dituliskan sebagai berikut.
hvb++ >TiIV OH {>TiIV OH }+
3. Fotodegradasi
Fotodegradasi adalah reaksi pemecahan senyawa oleh adanya cahaya. Proses fotodegradasi memerlukan suatu fotokatalis, yang umumnya merupakan bahan semikonduktor. Prinsip fotodegradasi adalah adanya loncatan elektron dari pita valensi ke pita konduksi pada logam semikonduktor jika dikenai suatu energi foton. Loncatan elektron ini menyebabkan timbulnya hole (lubang elektron) yang dapat berinteraksi dengan pelarut (air) membentuk radikal OH•. Radikal bersifat aktif dan dapat berlanjut untuk menguraikan senyawa organik target.
Proses fotodegradasi akan diawali dengan oksidasi ion OH- dari H2O
membentuk radikal, setelah suatu semikonduktor (sebagai contoh adalah TiO2)
menyerap cahaya membentuk hole. Mekanisme reaksi yang diusulkan adalah sebagai berikut [41] :
TiO2 + hυ à hole+ + e
-hole+ + OH- à OH• OH• + substrat à produk
Sedangkan reaksi fotodegradasi metilen biru dapat dituliskan sebagai berikut : C16H18N3SCl + 51/2 O2 HCl + H2SO4 + 3HNO3 + 16CO2 + 6H2O
Diantara beberapa logam fotokatalis, oksida Ti dilaporkan memiliki aktivitas yang cukup besar dan efektif selain murah dan non toksik. Dalam reaksi fotokatalis dengan TiO2 dalam bentuk kristal anatas TiO2 dilaporkan sebagai komponen
11
TiO2 dengan bentuk kristal anatas dan rutil jika dikenai suatu sinar UV
dengan λ <385 nm untuk anatas dan λ = 405 nm untuk rutil, akan menghasilkan spesies ditunjukkan H+ pada permukaannya. Oleh karenanya TiO2 mampu
mengoksidasi spesies kimia yangmempunyai potensi redoks yang lebih kecil. Pengurangan ukuran kristal berguna untuk menekan rekombinasi fotoeksitasi elektron (e-) dan lubang (H+) [42].
4. Perak (Ag)
Perak merupakan logam putih dapat dilihat dan ditempa. Rapatannya tinggi (10,5 g ml-1), tidak larut dalam asam klorida, asam sulfat encer, tetapi dapat larut dalam asam nitrat pekat. Perak murni memiliki konduktivitas kalor dan listrik yang sangat tinggi diantara semua logam dan memiliki resistansi kontak yang sangat kecil. Perak meleleh pada suhu 960oC dalam suasana karbon monoksida, menguap pada suhu sekitar 850oC dan mendidih pada suhu 1955oC.
Penempelan logam pada permukaan semikonduktor merupakan salah satu metode modifikasi permukaan semikonduktor. Logam dapat meningkatkan produk fotokatalitik atau meningkatkan kecepatan reaksi fotokatalitik. Mekanisme migrasi elektron pada permukaan semikonduktor yang termodifikasi logam melalui tahap eksitasi elektron dari pita valensi ke pita konduksi dan setelah mengalami eksitasi, elektron bermigrasi menuju logam dan terperangkap dalam logam (Gambar 4) [43], sehingga rekombinasi electron-hole dapat ditekan, dan
hole leluasa berdifusi ke permukaan semikonduktor di mana pada permukaan
tersebut akan terjadi oksidasi senyawa-senyawa yang didegradasi. Logam sendiri mempunyai aktifitas katalitik dan memodifikasi sifat fotokatalitik semikonduktor melalui perubahan distribusi elektronnya.
Gambar 4. Migrasi elekron dari perak (Ag) ke pita konduksi (PK) TiO2
12
Modifikasi elektronik permukaan semikonduktor melalui deposisi logam dapat dilakukan dengan menggunakan beberapa logam mulia (logam yang tidak mudah teroksidasi) atau logam transisi seperti platina (Pt), paladium (Pd), emas (Au), perak (Ag), nikel (Ni), cobal (Co), timah (Sn) dan tembaga (Cu). Secara umum pemilihan logam sebagai penjebak elektron didasarkan pada sifatnya yang tidak mudah teroksidasi atau yang mempunyai potensial reduksi tinggi, sehingga logam-logam tersebut bertindak sebagai akseptor elektron. Misalnya logam tembaga (Cu) yang mempunyai potensial reduksi 0,340 volt, dan logam Ag yang memiliki potensial reduksi 0,799 volt. Nanopartikel TiO2 yang tersensitifkan Ag
menunjukkan perubahan potensial negatif dan arus anoda dalam merespon penyinaran cahaya tampak, sehingga atas dasar ini dapat diaplikasikan untuk fotovoltaik, fotokatalis, dan sensor plasmon.
5. Metilen Biru
Metilen biru, juga juga dikenal sebagai kapas biru, helvetia biru, asam biru 93, atau CI 42780, adalah senyawa kimia aromatis heterosiklik dengan rumus molekul C16H18N3SCl. Metilen biru merupakan pewarna thiazine yang kerap
digunakan sebagai pewarna sutra, wool, tekstil, kertas, peralatan kantor, kosmetik dan fungsida pada akuarium [39]. Di beberapa tempat penggunaan bahan ini sudah semakin tidak populer karena diketahui mempunyai pengaruh buruk terhadap filtrasi biologi dan kemampuan warnanya untuk melekat pada kulit, pakaian, dekorasi akuarium dan peralatan lainnya termasuk lem akuarium. Senyawa ini berupa kristal berwarna hijau gelap pada suhu kamar. Ketika dilarutkan dalam air atau alkohol akan menghasilkan larutan berwarna biru. Larutan metilen biru dapat memberikan warna biru apabila berada pada lingkungan dengan tingkat oksidasi yang tinggi. Memiliki berat molekul 319.86 gr/mol, dengan titik lebur di 105oC dan daya larut sebesar 4,36 x 104 mg/L [39].
Reaksi substitusi aromatik eletrofilik, misalnya fenol dan amina aromatik bereaksi dengan elektrofilik arildiazonium dan akan menghasilkan senyawa azo, senyawa azo memiliki gugus azo –N=N–. Semua senyawa azo berwarna, seperti metilen jingga dan metilen biru. Metilen biru merupakan fotosensitizer yang
13
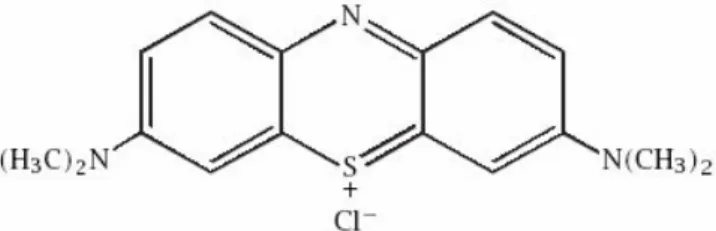
digunakan untuk membuat oksigen singlet apabila terkena oksigen dan cahaya. Hal ini digunakan untuk membuat peroksida organik oleh reaksi Diels-Alder. Struktur metilen biru ditunjukkan pada Gambar. 5 [39].
Gambar 5. Struktur Metilen Biru 6. Difraksi Sinar-X
Difraksi sinar-X adalah teknik analitik yang serbaguna untuk menentukan kristal suatu padatan, seperti keramik, logam, material elektronik, organik, dan polimer. Difraksi sinar-X terjadi pada hamburan elastis foton-foton sinar-X oleh atom dalam sebuah kisi periodik. Hamburan monokromatis sinar-X dalam fasa tersebut memberikan interferensi yang konstruktif.
Dasar dari penggunaan difraksi sinar-X untuk mempelajari kisi kristal adalah berdasarkan persamaan Bragg: n.λ = 2.d.sinθ ; n = 1,2,... Dengan λ adalah panjang gelombang sinar-X yang digunakan, d adalah jarak antara dua bidang kisi, θ merupakan sudut antara sinar yang terjadi dengan penampang lapisan sehingga lebih dikenal sebagai sudut Bragg, dan n adalah bilangan bulat yang disebut sebagai orde pembiasan. Ketika panjang garis edar kristal (2d sin θ) merupakan multi panjang gelombang, interferensi yang menguatkan terjadi dan intensitas difraksi dapat ditentukan. Intensitas difraksi berhubungan dengan puncak yang akan menentukan tipe dan pengaturan atom-atom pada setiap lapisan.
Berdasarkan persamaan Bragg, jika seberkas sinar-X di jatuhkan pada sampel kristal, maka bidang kristal itu akan membiaskan sinar-X yang memiliki panjang gelombang sama dengan jarak antar kisi dalam kristal tersebut. Sinar yang dibiaskan akan ditangkap oleh detektor kemudian diterjemahkan sebagai sebuah puncak difraksi. Makin banyak bidang kristal yang terdapat dalam sampel, makin kuat intensitas pembiasan yang dihasilkannya. Tiap puncak yang muncul pada
14
pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi. Ilustrasi Hukum Bragg dapat dilihat pada Gambar 6 [44].
Gambar 6. Ilustrasi Hukum Bragg
Puncak yang melebar menunjukkan kristalinitas rendah (amorf), sedangkan puncak yang meruncing menunjukkan kristalinitas yang lebih baik [45]. Difraksi sinar-X sangat penting pada identifikasi senyawa kristalin. Kekuatan dari cahaya yang terdifraksi tergantung pada kuantitas material kristalin yang sesuai di dalam sampel sehingga sangat mungkin mendapatkan analisa kuantitatif dari sejumlah relatif konstituen dari campuran senyawa padatan [46].
7. Transmission Electron Microscopy (TEM)
Transmission Electron Microscopy (TEM) merupakan mikroskop elektron
yang cara kerjanya mirip dengan proyektor slide dimana elektron ditembuskan ke dalam objek. TEM digunakan untuk menentukan bentuk dan ukuran partikel yang sangat teliti karena memiliki resolusi yang tinggi serta untuk mengetahui keteraturan lapisan tipis pada permukaan partikel. Partikel dengan ukuran beberapa nanometer dapat diamati dengan jelas menggunakan TEM.
Prinsip kerja dari TEM adalah sampel ditempatkan di mikroskop dan kemudian dibombardir dengan elektron yang berenergi tinggi. Ukuran sampel biasanya harus lebih tipis dari ~ 2000 Å. Proses yang terjadi saat sampel dibombardir dengan elektron seperti pada Gambar 7 [47].
15
Gambar 7. Proses Sampel yang Dibombardir dengan Elektron
Komponen dasar dari TEM terdiri dari elektron gun, lensa kondenser, sampel, objek lensa, bidang difraksi, intermediate image, lensa proyektor, dan layar fluorescen. Elekton dipancarkan dari filamen tungsten (electron gun) yang dipercepat melalui tegangan tinggi (50 ke 1000 kV). Hubungan panjang gelombang dengan percepatan tegangan adalah.
λ = һ (2meV)-1/2
dimana m dan e adalah massa dan muatan elektron, pada tegangan tinggi kecepatan elektron mendekati kecepatan cahaya, m meningkat karena adanya efek relativistik.
8. Spektroskopi UV-Vis
Spektrofotometer sinar tampak dan Ultraviolet ( UV-Vis) merupakan suatu alat yang melibatkan spectra energi dan spektrofotometri. Prinsip dasar spektroskopi UV-Vis adalah terjadinya transisi elektronik yang disebabkan penyerapan sinar UV-Vis yang mampu mengeksitasi elektron dari orbital yang kosong. Umumnya, transisi yang paling mungkin adalah transisi pada tingkat tertinggi (HOMO) ke orbital molekul yang kosong pada tingkat terendah (LUMO). Pada sebagian besar molekul, orbital molekul terisi pada tingkat energi terendah adalah orbital σ, sedangkan orbital π berada pada tingkat energi yang lebih tinggi. Orbital non ikatan (n) yang mengandung elektron–elektron yang belum berpasangan berada pada tingkat energi yang lebih tinggi lagi, sedangkan orbital–orbital anti ikatan yang kosong yaitu σ* dan π* menempati tingkat energi yang tertinggi.
16
Absorpsi cahaya UV-Vis mengakibatkan transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan dasar yang berenergi tinggi. Panjang gelombang cahaya UV-Vis bergantung pada mudahnya promosi elektron. Senyawa yang menyerap cahaya pada daerah tampak (yaitu senyawa yang berwarna) mempunyai elektron yang lebih mudah dipromosikan daripada senyawa yang menyerap pada panjang gelombang UV yang lebih pendek.
Terdapat dua jenis pergeseran pada spektra UV-Vis, yaitu pergeseran ke panjang gelombang yang lebih besar disebut pergeseran merah (red shift), yaitu menuju tingkat energi yang lebih rendah, dan pergeseran ke panjang gelombang yang lebih pendek disebut pergeseran biru (blue shift), yaitu menuju ke tingkat energi yang lebih tinggi [48].
Intensitas penyerapan dijelaskan dengan hukum lambert-beer. Hukum Lambert menyatakan bahwa proporsi berkas cahaya datang yang diserap oleh suatu bahan/medium tidak bergantung pada intensitas berkas cahaya yang datang. Hukum Lambert ini tentunya hanya berlaku jika di dalam bahan/medium tersebut tidak ada reaksi kimia ataupun proses fisis yang dapat dipicu atau diimbas oleh berkas cahaya datang tersebut.
A = ε b c Keterangan:
A = Absorbansi
ε = absorptivitas molar (dalam L mol-1
cm-1) c = konsentrasi molar (mol L-1)
b = panjang/ketebalan dari bahan/medium yang dilintasi oleh cahaya (cm).
Dengan menggunakan metode kurva kalibrasi, yaitu dengan membuat grafik absorbansi versus konsentrasi dapat diperoleh suatu kurva linier. Melalui pengukuran absorbansi suatu sampel dan menginterpolasikaanya ke kurva kalibrasi, maka konsentrasi sampel dapat ditentukan [49].
17 9. Spektroskopi Serapan Atom (AAS)
Atomic Absorption Spectroscopy atau disebut AAS merupakan penentuan
kadar unsur-unsur logam dan unsur yang bersifat logam dan semi logam yang terdapat dalam suatu cuplikan yang berkadar rendah [50]. Dasar metodenya adalah interaksi antara tenaga radiasi dengan atom yang dianalisis. Jika atom menyerap tenaga foton dari sinar tampak atau ultraviolet yang sesuai maka elektron valensi dari atom akan dipindahkan dari tingkat tenaga dasar ke tingkat tenaga tereksitasi. Setiap atom akan memiliki panjang gelombang serapannya juga berbeda. Besarnya serapan merupakan fungsi dari banyaknya atom yang ada.
Sensitivitas dan batas deteksi merupakan 2 parameter yag sering digunakan dalam SSA. Sensitivitas didefinisikan sebagai konsentrasi suatu unsur dalam larutan air (g/mL) yang mengabsorpsi 1% dari intensitas radiasi yang datang. Sedangkan batasan deteksi adalah konsentrasi suatu unsur dalam larutan yang memberikan sinyal setara denga 2 kali deviasi standar dari suatu seri pengukuran standar yag konsentrasinya mendekati blangko atau sinyal latar belakang [51].
Prinsip kerja dari spektrofotometer serapan atom adalah larutan sampel yang mengandung unsur logam ion perak diatomisasi membentuk molekul dalam fase gas oleh burner dan nebulizer. Molekul yang teratomisasi merupakan atom netral yang berada dalam keadaan dasar. Sumber radiasi yang berupa lampu elektroda cekung memancarkan frekuensi radiasi resonansi dari unsur ion perak, kemudian sinar diteruskan pada monokromator. Monokromator akan menyeleksi sinar yang dikehendaki sehingga diperoleh sinar resonansi. Sinar resonansi diteruskan ke detektor yang akan mengubah intensitas sinar menjadi pulsa listrik yang kemudian menuju amplifier dan sistem pembacaan (pencatat).
B. Penelitian yang Relevan
Penelitian Titanium dioksida (TiO2) merupakan semikonduktor dengan beda
energi antar pita (Eg) 3,0 - 3,3 eV dan transparan di daerah sinar tampak. Beda energi antar pita (Eg) TiO2 tergantung dari rasio bentuk kristalnya [52], dimana
bentuk kristal anatas memiliki Eg 3,2 eV lebih besar dibandingkan kristal rutil (Eg=3,0 eV). Dengan harga Eg pada kisaran tersebut, fotoaktivitas TiO2
18
mengabsorbsi energi foton pada daerah ultra violet (UV) yang ada pada kisaran λ = 290-400 nm [53]. Absorbsi energi foton pada daerah visibel (λ = 400-800 nm) kurang efektif untuk proses transisi elektron dari pita valensi ke pita konduktor TiO2 sehingga dapat dikatakan TiO2 tidak memiliki respon di daerah sinar
tampak.
Modifikasi elektronik permukaan semikonduktor melalui deposisi logam dapat dilakukan dengan menggunakan beberapa logam mulia (logam yang tidak mudah teroksidasi). Hasim berhasil mendeposisikan logam Ag pada permukaan semikonduktor TiO2. Pada kondisi optimal dengan arus elektrodeposisi 0,30 A
pada penelitian tersebut diperoleh nilai %IPCE sebesar sebesar 13,1.10-2% [54]. Ohko et al. menunjukkan bahwa ketika film TiO2-nanopartikel tersensitifkan
Ag-nanopartikel, warna film dapat berubah dari tidak berwarna menjadi abu-abu kecoklatan disinari ultraviolet. Hal ini dikarenakan terjadi oksidasi Ag oleh O2
pada sinar tampak dan reduksi Ag+ pada sinar ultraviolet [55].
Naoi et al. berhasil memperoleh informasi bahwa sifat fotokromik fim TiO2
tersensitifkan Ag dapat ditingkatkan melalui iradiasi secara simultan selama proses deposisi Ag dengan sinar ultraviolet [56]. Hasil penelitian Nino-Martinez tentang TiO2-nanopartikel tersensitifkan Ag dengan perbandingan mol TiO2 : Ag
= 1:25, memiliki aktivitas yang tinggi sebagai material anti-bakteri [57]. Film nanopori TiO2 terdispersikan nanopartikel Ag menunjukkan perubahan potensial
negatif dan arus anoda dalam merespon penyinaran cahaya tampak, sehingga atas dasar ini adapat diaplikasikan untuk fotovoltaik, fotokatalis, dan sensor plasmon [58].
Produk TiO2/Ag tidak akan didapatkan pada suhu 120oC, setelah suhu
dinaikkan 1500C maka terjadi pembentukan shell anatas TiO2 yang tersupportkan
perak, hal ini ditandai dengan munculnya puncak difraksi pada 2θ = (38.1, 44.2, 64.3, dan 77.30 ) sesuai untuk perak, dan puncak (25.2 ,38.1, 47.8, 54.3, 62.8, dan 69.00) sesuai untuk fasa anatas murni. Pada TEM Ag/anatas menunjukkan bahwa terdapat nanopartikel bulat dengan diameter sekitar 6 nm, sedangkan pada UV-vis ditunjukkan dengan adanya spektrum penyerapan larutan toluena dari Ag/TiO2
19 C. Kerangka Berpikir
Titanium dioksida merupakan fotokatalitik yang mampu mendegradasi berbagai senyawa organik. Karakter dari TiO2 yang berpengaruh secara signifikan
terhadap kemampuan fotokatalitik untuk mendegradasi suatu senyawa meliputi ukuran dan bentuk partikel, struktur kristal, dan energi gap. Sebagai contoh, kemampuan fotokatalitik TiO2 akan meningkat apabila memiliki ukuran partikel
dalam kisaran nanometer. Sedangkan faktor lingkungan meliputi panjang gelombang dan intensitas sinar yang diterima.
TiO2 yang digunakan sebagai fotokatalis lingkungan dapat dioptimalkan
aktivitasnya dengan melakukan modifikasi material. Karakter TiO2 dapat
dimodifikasi dengan mendispersikan zat pensensitif Ag pada saat sintesis. TiO2
merupakan suatu bahan fotokatalis sedangkan Ag adalah sensitizer. Nanopartikel TiO2 yang tersensitifkan Ag menunjukkan perubahan potensial negatif dan arus
anoda dalam merespon penyinaran cahaya tampak, sehingga atas dasar ini dapat diaplikasikan untuk fotovoltaik, fotokatalis, dan sensor plasmon. Proses fotokatalitik untuk mendegradasi metilen biru dapat diamati menggunakan spektrofotometer sinar tampak.