LAPORAN HASlL
PENELlTlAN FUNDAMENTAL
TAHUN ANGGARAN 2006
h
A
kiih
PERUBAHAN STRUKTUR SITOSKELETON BERBASIS
MIKROTUBULUS DAN ULTRASTRUKTUR 00SIT
PASCA KRIOPRESERVASI DENGAN
METODE VlTRlFlKASl
Oleh
Dr.
Ir.
Sri Wahjuningsih, MSi.
Dr.lr. M.Sasmito Djati,MS
Dibiayai oleh birekorat Penelitin dan Pengabdian Kepada Nlwyarakat Di~ektorat Jenderal Pendidikan Tinggl
Departemen Pendidikan Nasional
Dengan Sural Pe janjian Pelaksanaan Penelitian Nomor :3231SPIPPIDP2M/Il/2006
FAKULTAS PETERNAKAN
UNlVERSlTAS BRAWIJAYA
Halaman Pengesahan
Laporan Hasil Penelitian Fundamental
1. J~rdul Penelitian : Perubahan Struktur Sitoskeleton f3efbasis Mikrotubulus a n Ultrastruktur Oosit Pasca Kriopreservasi bngan Metode Vitrifikasi
2. Ketua Peneliti
a.Nama : Dr. Ir. Sri Wahjuningsih,MSi
bdenis kelamin : Perernpuan
c.NIP : 131 759 598
d.PangkaVGolongan
:
Penata Tk illll-de.Jabatan fungsional : Lektm
f. Jurusan/Faku#as/Pusat Penelitjan : Produksi TemaWPetemakan g.Perguruan Tinggi : Universitas Bfawiijaya
3. Jurnlah Tim Peneliti 4. Lokasi Peneltitian
5. Kerjasarna dengan lnstitusi lain a. Narna lnstansi
b, Alarnat
6. Masa Penelitian 7. Biaya
yang diperlukan
: 2 orang
: Labaratoriurn Kultur Jaringan Jurusan Biologi FMlPA Unibraw
-
-
: 8 bulan: Rp 30.000.000 (Tiga puluh
juta
rupiah)Malann. 31 OktoBer 2006
Dr. It. Sri Wahjuningsi NIP.131 759 598
PERUBAHAN STRUKTUR SITOSKELETON BERBASIS MIKROTUBULUS DAN ULTRASTRUKTUR OOSIT PASCA KRIOPRESERVASI DENGAN
METOM: VlTRlFlKASl
Sri Wahjuningsih dan M Sasmito Djati
RING KASAN
Tujuan Penelitian tahun pertarna adalah : mengkaji kualitas oosit pasca vitrifikasi tfwhadap mwfologi, viabilitas, serta struktur sitoskeleton oosit berbasis mikrotubulus dan mempelajari faktor yang menyebabkan tejadinya penurunan kualitas oosit Dasca vitaifkasi melalui evaluasi morfoloai, viabilitas
serta
analisa mikrotubulus &sit menggunakan metode irnunohistolri~~,Materi penelitian adalah oosit kambing yang blah dilakukan maturasi in vitm selama 24 jam. Rancangan percobaan adalah : (1)rancangan acak lengkap pola faktorial 6 x 3, dengan perlakuan konsentrasi EG 0,10, 20, 30,40, dan 50 % dan lama paparan 1,3,5 menit untuk evalwasi morfologi dan viabititas dan (2) deskriptif wntuk analisa struktur sitoskeleton.
Hasil penelitian rnenunjukkan bahwa konsentrasi EG dan lama paparan berpengaruh terhadap morfologi dan viabilitas (pc0.01). Persentase oosit dengan morfologi normal dan omit Mdwp tertinggi serta vitrifikasi menggunakan 30 % EG dan lama paparan 3 rnenit, masing-masing sebesar 86.6% dan 78.7 %. Konsentrasi EG 30 % dan lama paparan 3 menit merupakan perlakuan terbaik untuk melindumgi oosit pada proses vitrifikasi. Hasil pengamatan terhadap sitoskeleiton berbasis mikrotubulus rnenggunakan metode imunohistokimia diperoleh gambar yang rnenunjukkan adanya perbedaan struktur sitoskeleton oosit kontrol dan oosit hasil vitrifikasi. Pada perlakuan kotrol struktulr sitoskeleton berbasis mikrotubul tampak seperti benang-benang berwarna kecoklatan. Hasil penelitian menunjukkan bahwa setetah proses vitrifikasi strwktur sitoskeleton mengalami perubahan.
Kesimpulan dari penelitian ihi adalah vitrifikasi menggunakan 30 % EG dan lama paparan 3 rnenit dapat rnenghambat kerusakan morfologi omit dan penumnan viabilitas yang disebabkan oleh proses vitrifikasi Untuk menjaga fungsl oosit, struktur sitoskeleton berbasis mikratubulus hams dapat dipertahankan. EG sebesar 30 % terbukti dapat mencegah kerusakan lebih lanjut dari sitoskeleton. Struktur sitoskeleton pada perlakuan 30 % EG tampak seperti benang yang beratti rnasih bisa mengatami recovery, sedangkan pada konsentrasi EG yang lain, sitoskeleton oasit tampak mengalami kmsakan. Terdapat hubungan antara morfologi, viabilitas oosit dan struktur sitoskeleton berbasis mikrotubulus. Disarankan melakukan analisa ultrastruktur oosit rnenggunakan Transmiss~on
Electron
Micmscopy agar dapat menjawab mengapa terjadi penurunan kualitas oosid pasca vitrifikasi.THE CHANGE OF CYTOSCELETON STRUCTURE BASED ON MICROTUBULUS AWD OOCYTE ULTRASTRUCTURE AFTER
CRYOPRESERVATION USING VITRlFICATION METHOD
SUMMARY
The aim of this m r c h far
first
year was to : study the quality of oocyte after Wriffcation to morphology, viability and also oocyte eytoskeleton s-re basedon
m i ~ b u l u s and study theW
r
that causing the happening of oocyte quality degradation afbr ' i M o nby
morphology evaluation, viability and ako analyseoucyie
micratubulwo s-e after vitrification using i m u n o h ~ e r n i ~ method.The material of t
h
i
s
research was used goat w
e which have been maturated by in vitm during24
hours. The research use (1) random complete design with factorial pattern 6 x 3, with treatment m m t r a t i o n of Ethylene Glywl (EG)were
0, 10, 20. 30.40 and 50 % with the time of exposure during 1 3 3 minutes for the morphology and viability evaluation and (2) descriptive for the sh&re of cytoskelebn.The results of the research showed that concentration of EG and the time of expwure influenee morphology and viabitity (pcO.01). Percentage of aocyte with normal mc~pholagy and highest life
oocyte and
also uitrif~cationuse
30% EG and the tkne of exposure during 3 minutes, eaGhcff
86.6% and78.7%.
ConcenWon of EG 30% and the time of exposure during 3 minutes werethe
best treatment to protect oocyte in process of vitrification. The resultof
obsewtion to cytmceleton based on microtubulus use imunohiiochemisQ method was obtained picture that showingthe
dirence existence of cytoscekton struwre of oocyte contml and cryop~e~ewed cmyte. In the control treatment, the structure of cyuDscaleton based on micxbtubulus looked like bmwn yam. The result of this research showed thatafter
theprocess
of vitrification, structure of cytoskeieton has a change.The rx3Rolusian of this research was that vitrification use 30% EG and the @me of exposure during 3 minutes can pursue darna@e of oocyke morphology and viability which is caused by the process of vitrification. To
safe
the function of oocyte, cyt08~~letan stnrGtu~e based on microtubutus have to eam lobe
defended.EG
equal to 30% g r o w can prevent further damage of q&osceleton. cytosceletan structure in the treatment of 30% EG looked like yam means that it still can recovery, white in the otherc o n a m o n
of EG, visible oocyte cyihceleton experienceaf
damage. Theream
relation between morpkolugy, mcyte viability and cytmceleton sbucturebased on microtubulus.
PRAKATA
Puji dan syukur kehadirat Allah SVVT karena berkat rahrnat dan karuniaNYA, pelaksanaan penelitian dan pernbuatan laparan penelitian Fundamental tahun pertama ini dapat diselesaikan.
Penelitian ini dibiayai dengaR dana dari DireMorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional, Kontrak Nornor: 323lSP/PP/DP2MA3/2006 Tanggal 21 Pebruari 2006.
Pada kesempatan ini karni menyampaikan terirna kasih kepada yang morrnat:
1. Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional. 2. Rektor Universitas Brawijaya
3. Ketua Lembaga Penelitian Unibraw 4. Dekan Fakultas Peternakan Unibraw
5. Ketua dan Staf Lab. Fisiologi, Kultur Jaringan dan Mikroteknik FMIPA- Unibraw
6. Semua pihak yang telah memberikan rekomendasi, menyetujui dan membantu pelaksanaan serta penyusunan laporan peneliian ini.
Sernoga h a i l penelitian yang dituangkan dalam laporan ini bermanfaat bagi pihak-pihak yang mernerlwkan.
Malang, 31 Oktober 2006
DAFTAR
I
S
1
Halaman MALAMAN PENGESAHAN
RINGKASAN DAN SUMMRY PRAKATA
DAFTAR IS1
DAFTAR GAMBAR
BAB I. PENDAHULUAN BAB It. TINJAUAN PUSTAKA
2.1. Morfologi dan karakteristik Oosit
2.2. Kriopreservasi Oosit Menggunakan Metode Vitrifikasi
2.3. Kualitas Oosit Pasca Vitrifikasi 2.4.
Struktuf Sitoskeleton Oosit
BAB Ill. TUJUAN DAN MANFAAT PENELITPAN BAB IV. METODE PENELITIAN
BAB V. HASlL DAN PEMBAHASAN
5.1. Evaluasi Morfologi Oosit Mt-11 Setelah Vitrifikasi dalam Berbagai Konsentrasi Etilen Glikol dam Lama Paparan.
5.2. Tingkat Viabliis Oosit Mt-ll setelah Vitrifikasi dalam berbagai Konsentrasi Etilen Glikol dan
Lama Paparan
5.3. Analisa Strukrur sitoskeleton loerbasis Mikrotubulus rnenggunakan Metode Imunohistokimia
BAB VI. KESIMPULAN DAN SARAN 6.1. Kesimpulan
6.2. Saran DAFTAR PUSTAKA
Garnbar
DAFTAR GAMEAR
Malaman
1 Skerna Analisis Struktwr Sitosketeton Oosit 14 krbasis mikrotubulus
2 Morfologli oosit Normal dart Abnormal Hasil Vitrifikasi 17 Menggunakan EG
3 Persenlase Oosit Normal Hasil Vitrifikasi dengan 17 Variasi Konsentrasi
EG
dan Lama Paperan4 Persentase Oosit Hidup Hesit Vifikasi dengan 21 Variasi Konsentrasi EG dan Lama Paparan
5 Strukfur Sitaskeleton Berbasis Mikrotubulus W i t 25 Pasca Virifikasi
I. PENDAHULUAN
Salah satu kernajuan iEmu pengetahuan dan teknologi di bidang biologi repmdlrksi adalah teknologi transfsr embrio. Salah satu hambatan dalam pelaksanaan program transfer embrio (TE) pada temak di Indonesia adalah faktor ketersedtaan ernbrio yang berkualitas unggul. Upaya
(hi
dapat diperoleh dari beberapa surnber (7) kolekgi embrio dari temak betina donor yang disuperovutasi (2) produksi ernbrio mefalui proses fet'titilisasi in @ro (FIV). Produksi embrio secara in vivo memeriukan biaya yang relatif tinggi dan jurnlahnya sangat tqbatas, khususnya jika rnemproduksl embrio yang diioleksi dari saluran reproduksi betha donor yang disuperovutasi. Produksi embrio in vitro rnerupakan alternatif yang bisa dimanfaatkan untuk rnendapatkan embrio. Secara wmum ptoduksi ernbriosecara
h vitro yang meliputi mwrasi oosit, fertilisasi dan kultur in vitro telah dilaprkan pada hewan ternak kambing dan sapi (Djati, 1999; Wahjuningsih dkk, 2001)Teknologi FlV saat ini
di
lndonesia dilakukan dengan mmanfaatkan oosit segar yang diperoleh langsung dan Rurnah Rotang Hewan (RPH). Namun dernikian, kendala yang dihadapi adalah oosit mamalia memiliki daya tahan hidup yang sangat terbatas sehingga Wak dapat disirnpan &lam waktu yang lama pada suhu kamar. Keterbatasan waktu simpan ini dapat diatasi dengan teknik penpimpananb k u
atau krioprese~aai oosit untuk mernpertahankan kelangsungan hidup sel sehingga viabiliis oosit dapat dipertahankan ,Teknolqi rekayasa reproduksi khususnya ktioprwwasi telah diiembangkan untuk spermatozoa dan embrio, namltn sejauh ini keberhasilan kriopmewasi w i t yang telah dllaporkan masih sangat terbatas dhn variatif. Penggunaan pmedur kriopreservasi oasit secara komersial masih sangat tefbatas (Vajta, 2000). Bada awal studi tantang krbpreservasi, dilakukan kriopresenrasi menggunakan metode kwwensional, namun saat ini metode viwlikasi lebih sering dia~fikasikan~ Metode tersebut sederhana, murah dan tidaln memdiukan alat khusus untuk menurunkan suhu secara bertahap dan dapat meminimalkan pembentukan kristal es sehingga mudah diaplikasikan di tempat yang memiliki kontainer nitrogen cair. (Shaw st a/., 2000).
Selama proses kriopreservesi diperlukan suatu kriopratektan. Kriopmtektan selain &pat melindungi sel juga temyata diduga dapat rnenimbulkan kerusakan pada sel akibat pengaauh toksisitasnya. Derajat proteksi dari bahan kriopratektan terhadap proses kristaiisasi pada masa pembekuan tergantung dari jenis dan konsentmsi ktiopratektan yang
dipakai serrta lama paparan (Leoni et a/., 2002). Dari beberapa penelitian tentang kriopreservasi oosit, diketahui ada bemacam-macam krioprotektan yang dapat dipergunakan untuk vitrifikasi oosit, narnun demikian telah diketahui bahwa etilen gtikol (EG) mernpunyai efek toksik yang lebih rendah dibapdingkan ktiopmtektan yang lain (Gordon, 1994;; Mochi eta/., 1995).
Beberapa penelitian kriopreservasi oosit telah dihkukan dengan hasil yang bervariasi dalam persentase morfologi normal, viatilitas dan tingkat +asti%lit (Acker et a/., 2003 Wahjuningsih dkk.., 2002). Evaluasi pengeruh sitologis setelah perlakuan menunjukkan kerusakan yang permanen ymg tidak tmpak setelah paparan k-tutektan (Han et a/. ,2004).
Dalarn peneliiian tahun pertama struktur sitogkeleton berbasis mikrotubulus menggunakan teknik imunohistokimia akan dikaji untuk menjelaskan m a p a terjadi perubahan kualitas oosit pasca kriopresenrasi. Dengan rnengetahui perubahan stnrkfur sitoskeleton berbasis mikrotubulus akanl mernbuka peluang un'tuk meningkatkan keberhasilan kriopresewasi -it secara komersial dan ha1 hi akan menjadi topik yang sangat menarik unfuk peneliian berikutnya.
II. TINJAUAN PUSTAKA
2.1. Morfologi
dan
Karakteristik oositOosit mamalia merupakan sel tunggal dan dibandingbn dengan sel tubuh lainnya, ukuran oosit relatif sangat besar serta rnemiliki karakteristik rnoflologik dan fungsional yang unik. Keadaan ukuran, struktur dan morfologi sangat berkait erat dengan fungsi biologis (Vajta, 2000).
Sebelum dilakukan FIV, oosit immature hasil aspilrasi dari ovarilnm harus mengalami IVM (In Wtro Maturasi) dalam medium kultur.. Untuk rnendapatkan medium maturasi yang menghasilkan inti mencapai tahap rnetafase II, peneliti utarna (Wahjuningsih, 2003, Wahjuningsih,2004) rnendapatkan hasil bahwa swplementasi kornbinasi PMSG dan HCG dalam medium dasar TCM 199 dan FCS kornbinaainya dapat menstimulus ekspansi kumulus. Oosit yang telah matang, kumulus oophorusnya akan mengernbang dan ikatan sesama kumulus oophorus akan melonggar. Persentase yang tinggi dari sel kurnulus terekspansi sempurna pada perlakuan yang rnendapat suplementasi PMSG dan HCG rnenunjukkan bahwa kedua horrnon ini rnemberikan pengaruh positip secara sinergis dan rnemberikan persentase oosit mencapai Metafase II.
2.2. Kriopreservasi oosit menggunakan metode vitrifikasi
Secara garis besar ada dua metoale kriopreservasi yaitu konvensional
(slow
freezing) dan metode vitvifikasi. Perbedaan yang rnendasar diantara kedua metode tersebut adalahpada
metode konvensio~~al terjadi pernadatancairan melalui pembentukan kristal es, sedangkan pada vitrifikasi pernadatan cairan tanpa melalui psmbentukan kristal es intraseluler (Men et a/, 2003). Kriopresefvasi dengan metoda konvensional memerlukan peratatan freezing machine (cry~cetl) yang harganya sangat mahat untuk menurunkan suhu secara bertahap, proses kriopresewasi memerlukan waktu yang relatif lama serta tehentuk kristall es intraseluler sehingga merusak organel oosit. Dibandingkan sistim konvensiional, keuntungan kriopresewasi secara vitrifikasi adatah tidak memerlukan
f-ng
machine (Cryocell) dan proses kriopresevasi cepat, namun kelemahannya adalah seringkali terjadi tokisitas karena tingginya osmolaritas larutan vitrifikasi (Acker et a/., 2003; Han et el., 2004)Tidak seperti pada krioprese~asi embrio, penggunaan pmsedur kriopresewasi oosit S a r a komersial masih sangat terbatas. Sifat yang berbeda pada oosit dan ernbrio seperti ukuran, bentuk, perrneahilitas, kualitas dan sensitivitas, tergantung pada spesies, tahap perkembangan akan menentukan kondisi yang paling tepai untuk keberhasilan kriopreservasi (Vajta,2OOO; Quello et a/., 2004)
Pada proses vitrifikasi dibutuhkan kriopmtektan. Ada dua sisi yang berlawanan dari penggunaan krioprotektan, yaitu selain dapat melindungi sel,
kriopmtektan
dapat menimbulkan kerusakan pads sel akibat pengaruh toks~sitasnya. Konsentras~ krioprotektan yang rendah dnlam medium krioprotektan akan menyebabkan kerusakan oosit akibat terbentuknya kristal- kristal es intraeluler, akan tetapi konsentrasi krioprotektan yang tinggi dapat bersifat toksik dan menyebabkan kerusakan osmotik pada oasit. Diantarakrioprotektan intraseluler, etilen glikol merupakan yang paling hanyak digunakan dalam proses pembekuan (Saha et a!., 1995). Dibandingkan dengan gliserol dan propilen glikol, etilen glikol merniliki toksisitas yang lebih rendah karena etilen glikol paling mwdah menyerap air dalam oosit dibandingkan krioprotektan lainnya (Hotamisligil et al., 1996, Wahjuningsih, 2002). Penggunaan M e n glikol sebagai krioprotektan intraseluler juga diungkqpken oleh Gordon (I 994).
2.3. Kuabitas oosit pasca kriopfiesewasi
Hasil penelitian Kuwayama et a/., (1999) pada oosit manusia bahwa metode vitrifikasi dengan eampuran 30 % EG dan 0.5 M Sukrosa dapat menjaga viabilitas oosit setetah dibekukan sebesar 90%. Kasai (1996) membuktikan bahwa penambahan 30% EG pada larutan PBS meningkatkan tingkat kelangsungan hidup atau survival rate in vifm oosit tikus sampai dengan 98%. Namun demikian penelitin ini berbeda dibandingkan dengan hasil penelitian Otoi et al. (1998) yang menunjukkan bahwa penggunaan krioprotektan EG 40 % dalarn larutan vitrifikasi lebih baik pengaruhnya terhadap viabilitas dibandlngkan EG 30 %. Perbedaan ini disebabkan lama paparan yang berbeda.
2.4. Struktur Sitoskeleton Omit
Sitoskeleton merupakan suatu sistem dalam sel berfungsi sebagal kerangka Clan alat gerak yang memiliki struktur sebagai anyaman benang- benang halus. Sebagian besar sel hewan mernpunyai empat struktur
sitoskeleton dengan protein penyusun yang berbeda yaitu filamen aktin, mikrotubul, filarnen mtermdiat dan protein aksesori (Yarp, 1984; Subowo, 1995). Mikrotubul berperan penting dafarn organisasi struktur intraseluler, transport intraseluler dan pembentukan sentriol. Mikrotubul merupakan sistern penopang yang kuat dalam sel untuk mempertahankan bentuk sel, bagian perluasan membmn sel seperti flagela dan silia serta membantu pergerakan kromosom selama pembelahan sel. Jenis sel yang befbeda akan mempunyai struktur sibskeleton yang berbeda (Kimball, 1994; Childs, 1996).
Pretein yang membentuk rnikrotubul disebut tubulin. Ada dua macarn yaitu a-tubulin dan ptubulin. Kedvranya mempunyai ukuran yang hampir sarna, masing-masing dengan berat rnolekul sekitar 55.000 dalton, bergabung secara nonkovalen untuk rnembentuk dimer. Dirner ini adalah bbk bangunan untuk rnendirikan mikrotubul. Menurut Childs (1996) a- dan P-tubulin jafang dalam bentuk terpisah pada kondisi normal. Ditarnbahkan oleh Maciver (2001) bahwa protein tubulin dalarn bentuk dimer bersifat stabil karena stuktur ikatannya sangat kuat. Lane (1999) dan Picton (2000) menyatakan bahwa mikrotubvl yang menyusun spindel aosit sangat sensitif terhadap ketusakan akibat proses pendinginan. Aman dan Parks (1994) menyatakan bahwa pendinginan oosit sapi 4% atau 2 5 ' ~ menyebabkan sehagian atau seluruh spindel mengalami kerusakan dan bebrapa kromoson rnenyebar atau teturai
Mikrotubul rnerupakan polimer non-kovalen dari protein tubulin yang ditemukan pada semua sel eukariota yang sedang rnernbelah dan pada sebagian b e a r seCsel yang telah mengalami diferensiasi. Selarna pemklahan
sel,
stwktur mikmtubul beTfungsi memisahkan kromosom dan menyusunnya pada Mdang pembelahan. %dasel
yang tidak sectang membelah mkrotubul temrgamisir pada sitoplasma, mengatur posisi nukleus dan organel-organel serta bertindak ssbagai struktur daaar elemen flagela dan sila (Desai, 1997). Sitoskelebn sangat dinamis, dapat mengalami depolimetisasi, polimerisasi dan bergerak dalam sitoplasma (Karp. 1984; Kimball, 1994)3.1. Tujuan Penelitian
Mengkaji kualltas oosit pasca vitrifikasi menggunakan berbagai konsentrasi EG dan lama paparan tel"hadap morfologi, viabilitas, serta struktur sitoskeleton oosit berbasis rnikratubulus.
Mengetahui apakah terdapat hubungan antara morfologi, vibilitas dan struktur sibskeleton oosit
.
32.
Manfaat PenelitianMmperoleh informasi konsentrasi EG dan lama paparan yang sesuai untuk vitrifikasil omit yang dipelajari dari fenomena morfologi, viabilitas, struktur sitoskeletan oosit berksis mikmtubulws
Dapat menjelaskan hubungan antara morfologi, vlbilibs dan struktur siloskeleton oosit.
IV. METQDE PENELlTlAN
Lokasi
dan Waktu Pe~elitian
Penelitian ini dilaksanakan di Laboratorium Fisiologi dan Kultur jaringan FMlPA Unibraw mulai bulan April sampai September 2006.
Kobksi
omit:
Ovarium dikumpulkan dari RPH Sukun dalam keadaan segar dan dimasukkan dalam medium berisi NaCl 0,9%
+
Penisitin 100 1U+
Streptomisin 100 IU pada suhu 35°C. Koleksi oosit dengan cara aspirasi. dari folikel menggunakan jarum dengan ukuran spuit 18 G. Medium aspirasi yang digunakan TCM 199 powder (CIBCO, Cat no 212000760) dimbahkan Hepes dan NaHC03, media ini dififtrasi dengan menggunakan membran filter berukuran diameter 0.22 urn. Medium aspirasi disiapkan dan diinkubasikan minimal dua jam sebelum dipergunakan. Evaluasi kualitas oosit immature dilakukan berdasarkan kriteria Hozumi (2001).A = Sitoplasma kompak secara sempurna dengan sel-sel kumulus beraturan rnenempel di keselunrhan bagian oosit
B = Sitoplasrna kompak secara sempurna dengan sel-sel kurnulus beraturan menempel di sebagian oosit.
C
=
Sitoplasma kompak sempurna tanpa ada sel-sel kwmulus menernpell pada oosit.Hanya oosit berkualitas A yang digunakan untuk penelitian selanjutnya.
Matuwi omit
in
vStroSetelah dilakukan klasifikasi kualitas oosit, rnaka oosit yang berkualitas A dimaturasi secara in v i h dengen medium TCM199 + FCS 10% + PMSG 10 IU + HCG 10 IU selama 24 jam datam inkubator pada suhu 3g°C dan 5% COz, kelernbaban 95%.
Kriopreservasi oosit menggunakan metode vitrifibsi
Oosit hasil IVM dipaparkan ke dalam larutan vitrifikasi yang berbeda (etiien glikol 10, 20, 30, 40, dan 50 %) ditambah 0.5 M Sukrosa dengan lama waklu paparan yang berbeda (1,3,5 menit). Oosit dirnasukkan ke dalam
ministraw transparant 0.25
cc
(French straw) yang telah mengalami OPS (open pulled straw) masing-ming berisi 10 oosit. Setelah pemaparan di dalam uap nitrogen selama 10 detik, ministraw yang berisi oosit dimasukkan dalarn kontainer nitrogen cair dan disimpan selama 2 rninggu untuk analisa lebih lanjut.Thawing oosit
Setelah
oosit
dalam ministraw disimpan dalam kontainer selama 2 rninggu, ooslt yang telah mengalami vitrifikasi dilakukan thawing dengancara
penghangatan (warming) dl uclara selama 10 detik kernudian dirnasukkan dalam penangas air suhu35%
selama 1 rnenit lsi ministraw dituangkan ke dalam cawan petri dan oosit dibilas dua kali dengan sukrosa 0.5M
untukmenghilangkan krioprotektan seperti prosedur yang dilakukan oleh Sun et a1.(1995).
Evaluasi morfologi
oosit
Setelah vitrifikasi dsngan metode OPS dan fhawing, oosit dievaluasi terhadap morfologi dengan menggunakan mikroskop inverted dengan pembesaran 400 X. Morfologi oosit diklasifikasikan normal jika menunjukkan bentuk bulat dengan membran plasma utuh dan sitoplasma bulat dengan granulasj kompak homogen. Sedangkan morfologi abnormal jika menunjukkan bemtuk yang tidak bulat, zona pelusida fraktur, sitoplasma tidak bulat dan terjadi degenerasi (desintegrasi membran plasma dan sitoplasma tidak homogen).
Evaluasi viabititas Oosit
dengan
PewarnaanHaescht
33342Setelah diamati morfologinya, oosit hasii vitrifikasi dari berbagai konsentrasi EG dan tama paparan yang berbeda diamati viabilitasnya. Pewarnaan bizbenzimidazole (Hoechst 33342,Sigma.USA) dilakukan untuk mengetahui viabilitas oosit. Oosit dicuci dengan PBS dan dimasukkan dalam larutan PBS yang mengandung bizbenzimidamle dengan konsentrasi 10 uglml dan selanjutnya dilakukan pemeriksaan di bawah mikroskop ffuom~ent (Nikon, Japan).
Oosit
dengan kromosom yang berpendar menunjukkan oosit hidup. Tingkat vlabilitas omit dihitung dari jumlah oosit yang hidup per jumlah oosit yang diwamalAnalisa Sltoskeletan Ooslt berbasis mikrotubulus dengan lmunohistokimia
Analisis mikrdubulus dilakukan dengan menggunakan metode imunohistokimia berdasarkar: Ito et a/., (1994) dengan modifikasi. Sel kumulus pada oosit kontrol dan oosit yang mengalami vitrifikasi dan thawing dihilangkan sel kumulus dengan cara dipipet berulang-ulang dengan pipet pasteur. Oosit yang sudah dihilangkan sel kumulusnya difiksasi selama 30 menit dalam drop yang berisi larutan fiksatif pada cawan ptri. Setelah itu oosit dicuci tiga kali dalam drop berisi PBS masing-masing 5 menit. Selanjutnya oosit dimasukkan dalam drop hidrogen peroksida 1 % selama 5 menit dan dlanjutkan dengan pencucian menggunakan PBS tiga kali masing-masing selama 5 menit. Oosit dimasukkan dalam 0.3 % Triton X-100 dan 2 % brmaldehid dalam PBS selama
1 jam. Selanjutnya oosit diletakkan dalam 7.5 % FBS =lama 10 menit dalam suhu ruang an selanjutnya dimasukkan dalam drop antibodi primer (1:200) seiama 8 jam {overnight). Setelah itu dilakukan pencucian dengan PBS sebanyak 3 kali, masing-masing selama 5 menit. Selanjutnya dirnasukkan antibodi antibodi sekunder (1:200) setama 30 menit. Selanjutnya oosit dkuci da4am PBS sebanyak 3 kali masing-masing 5 menit dan dimasukkan SA-HRP selama 20 menit. Oosit dicuci PBS 3 kali, masing-masing 5 menit kernudian dimasukkan dalam drop DAB selarna 5 menit. Langkah berikutnya oosit dicuci dengan akuades 2 kali masing-msing 5 menit dan dilanjutkan dengan mounting
Oosit diletakkan datarn
d'rop
entelan pada gelas obyek dan ditutup dengan covermenggvnakan mikroskop cahaya. Skema analisis sitoskeleton adalah sebagai berikut :
oosl
metafase II[
stabiriasiI
1
+---- d i c ~ r ~ i PBS 3% I@ 5 menit1
1% Hz02 seiama 5 mf?nit I d c u c i PBS 3s @s
menit dimasukkan medium permeabilisasE 0,3% Wton X-100dan 2% formaldetrid dalam PBS 1 jam I
.
f
7.5%
FBS pada suhu ruang] Ir
ditambah antip
tubulin (1:200)>
djam l-meiPBS
3s
@ 5 mcoitI
Ab Sekunder (1:200) selama 30 +nit1
V iPBS 3x @ 5 menit[
SA HRP selama 20 m$it1
d e u c i PlfS 3x @ 5 menit -1
kromogen DAB1
.
r
Mounting dengan e1
Analfsis Data
Rancangan penelitian yang digumkan adalah rancangan acak lengkap pola faktorial 6x3 rnenggunakan 6 kali ulangan. Faktor pertana adalah konsentrasi krioprotektan Etilen Glikol, yaitu kontml 10 %; 20 %,30 %,40 % dan
50%. Faktor kedua adaiah lama paparan, yaitu 1. 3 dan 5 menit. Analisis ragarn digunakan untuk rnenguji p e n g a ~ h konsentrasi EG dan lama paparan terhadap
morfologi dan viabilitas. Analisa data rnenggunakan program
SPSS.
Untuk rnenganalisa gambar stwktulr struktursitoskeleton berbasis mikrofubulus dilakukansecara
deskriptifV.
HASlL
DAN P E M W S A N5.1. Evaluasi Morforogi Oosit Mt-ll
Setelah
Vdrifikasi dalam Berbagai Kmentrasi Etilen Glikol dan Lama Paparan.Penelitian vitrifikasi ini menggunakan krioprotektan intraseluler etilen glikal dalam b e h g a i konsentrasi (10,20,30,40
dan
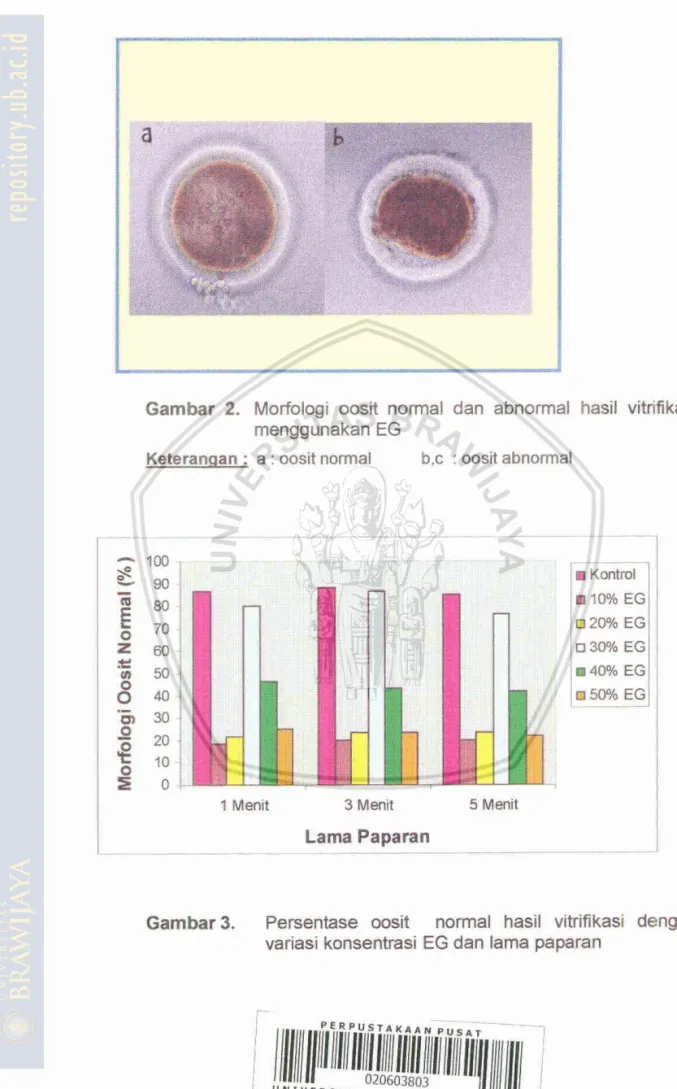
50 %) dan sukrosa 0.5 M sebagai krioprotektan ekstraseluler dengan lama papamn 1,s dan 5 menit. Hasil vitrifikasi wsit menggunakan berbagai konsentrasi EG dan lama paparan yang berbeda menghasilkan morfologi oosit yang berkeda Morfologi oosit dikelarnpokkan menjadi 2 yaitu morfologi normai dan abnormal (Gambar 2). Morfologi oosit diklasifikasikan normal apabila menunjukkan bentuk bulat dengan rnembran plasma utuh dan sibplasma bulat dengan granulasi kompak homogen. Sedangkan morfologi abnormal jika menunjukkan bentuk yang tidak bulat, zona pelusida fraktur,sitoplasma tidak butat dan terjadi degenerasi.Hasil penelitian menunjukkan bahwa konsentrasi EG berpenga~h nyata telfiadap rnorfologi oosit normal (p<O,OI), sedangkan lama paparan tidak berpengaruh nyata (pz0,Ol). Terdapat interaksi antara konsentrasi EG dan lama paparan (pc0,Ol). Konsentrasi 30 % dengan lama paparan menit 3 menit menghasilkan morfologi normal cusit sebesar 86.6 % apabila dibandingkan dengan kontrol (oosit yang tldak mengalami vitrifikasi) yang mempunyai morfologi normal sebesar 88.3 %, keduanya menunjukkan tidak ada perbedaan yang bermakna (p>O,Ol).
Gambar
2. MorfoEogiomit
normal dan abnormalhaail
vimkasi mengaunakan EGKetecanaan : a : oosit normal b , ~
:
oosit abnmalGarnbar 3. Peisentase
oosit
n o m l hasif vitriikasi dengan variasi konsentrasi EG dan lama paparanPersentase morfalogi oosit normal berbeUa pada konsentrasi den lama paparan yang berbeda, Lama papamn 3 menit dan konsentmi EG 30 % memberikan morfologi normal terbaik. Perlakuan EG 10% dengan lama paparan 1 (menit dan EG 50% dengan lama paparan 5 menit rnenunjukkan nllai morfologi oosit normal yang terendah, masing-rnasing 18.3 % dan 21.7 %.
ApaMla dibandingkan dengan konsentrasi krioprobkbn yang lailn, yaitu EG 10 %, EG 20 %, EG
4Q
%,EG 50 %, rnaka EG 30 % menghasilkan nilai morfnlogt normal yang tertinggi. Hal ini membuktiian bahwa konsen2tasi EG 30 % rnempakan komntrasi optimum untuk vitrifikasi oosit karnbing.Medium
vitrifikasi 30 % EG sebagai kriaprotektan intraseluler dan 0.5 M sukrosa sebagai krioprotektan ekstraseluler dapat rnengharnbat kerusakan oosit yang disebabkan deh proses vitrifikasi. Kriopmtektan dangan konmtrasi 30 % dapat rnencegah terbentuknya kris3ales
intraseluler sehingga mencegah kerusakan sel. Molekul-molekul air di dalam sel blah keluar dari sel dan krioprotektan intraseluler masuk ke dalam sel hingga tidak terjadi pernbentukan kristal6s
intraseluler (Dinnyes et al.. 2000).Hasil penelian ini menunjukkan bahwa pada konsentwi EG 110 % dan 20
%EG,
w i t banyak mengalami kerusakan. Path konsentrasi rendah kriopmtektan fidak mampu metindungi omit selama proses vitrifikasi berlangsung sehingga oosit rusak saat terkena paparan suhu dingin. Pada konseltrasi EG 10% dan EG 20%, lingkungan hidrofobikyang hilang Bdak sepenuhnya terganti aieh eZilen glikol. Vajta
(20QO)
manwmukakan bahwa pada konsentrasi y n g terlalu rendah krioprotektan tidak dapat menoegah terjadinya pembentukan kristales
intraseluler akibat penunrmn suhu yang sangat cepat dan mengakibatkan kerusakan sel. Pada konsentrasi krioprotektan EG 40% dan SO%, oosit banyak mengalami kerusgkan temarna pada konsentrasi 50% EG. Hal ini disebabkan konsentrasi krioprotektan yang terlalu tinggi dapat beMat toksik den merusak sitoplasma sel
(MI,
1996; Kwwayama, 1999: Shaw e t d2000).
Fakbr pembentukan kristal es dan bksisitas merupakan faktor utama dalam kriopreservasj dengan metode vitrifikasi. Keseimkngan antara pencapaian keeepatan pendinginan (cooling
rate)
maksimum untuk menoegah pembentukan kristale$
dan penggunaan sekecil mungkin konsentrasi krioprotektan yang bersifat taksik tefhadap sel merupakandm
ha1 penting yang h a w diperhaiikan.Kewsakan yang terjadi pada ooplasma disebabkan karena terbentuknya kristal es intmseluher sehingaa organel yang terdapat di dalm sel pecah akibal ekspansi
es.
Faktqr lain yang dapat menyebabkan terjadinya kerusakan pada ooplasma adalah karena terjadinya dehidrasi baik dari suspensi media intra dan ekstmseluler sehingga oosit mengalami pengkenttan rnaupun pembengkakan (sweiliflg). Strategi yang diunakan untuk menghindaa bksisitas larutan vitrifikasi adalah memperpendek wktu pernaparan clenganlarutan. Namun jika waktu pemaparan terlalu pendek, maka penyerapan knopmtektan tidak cukup, sehingga es intraseluler mgsih &pat terbentuk. Oleh karena iltu waktu pamaparan optimal untuk kebrhasilan vitrifikasi diprlukan sebagai petTimbangan untuk mempertahankan dari toksisitas dan menjaga agar tidak tefbentuk es ekstraseluler (Triwulanningsih, 1997).
Kasai (1996) dan Wetzels (1996) mengemukakan bahwa kerusakan sel dapat terjadi akibat dari peningkatan osmolaritas
m @ i
krioprewasi sehingga krioprotektam rnenjadi bersht racun, kerusakan fisik kamna terbentuknya kristal es ekstraseluler, atau terjadinya osmotic suvelliingL.2. Tingkat Viabilitas Omit Mt-ll Setelah VWfikasi dalam berbagai konsentrasi Etilen Glikol dan Lama paparan.
Viabilitas oosit dinyatakan dalarn persentase jumlah oosit hidup per seluruh jumlah dosilt yang diamati. Pengamatan viabilitas dilakukan dengan pewaman menggunakan Hoechst 33342 dan diamati dibawah mikroskop ff uorescent
Hasil analisis ragam menunjukkan bahwa perlaltuan konsentrasi EG betpengaruh sangat nyata (p<0,01) terhadap oosit yang hidup, sedangkan lama paparan tidak mempunyai pengaruh (p>0,01) terhadap oosit yang hidup.
Hasil penetitian ini sesuai dangan hasil yang dipemleh Kuwayama
ef
af., (1999) pada oosit manusla bahwa metode vitrifikasi dengan campuram 30 % EG dan 0.5 M. Sukrosa dapat men- viabilitas msit setelah dibekuken sebesar 90%. Kasai (1996) mbuktikan h t w a pnambahan 30% EG pada llarwtan PBS meningkatkan tinskat kelangsungan hidup ataus-val
rate in vitro uosit tiltus sampai dengan 98%. Marnun demikian penelitian ini berbeda dibandingkandengan
hasil penelitien Otoi ef al. (1998) yang rnenuFjuWCgn bahwa penggunaan krioprotekpan EG 40 % dalam larutan viZriSrkasi lebh &k pengatuhnya tefiadap viabilltae dibandingkan EG 3D %. Perbedam ini disebabkan lama paparan yang berbeda.Paparan krioproteklan pada msit sapii seperti penelian CRoi eel a/. (1998) menunjukkan hasil bahwa waW pernapran 1 menit, 5 menitdan 10 men~l trdak menampakkan petbedaan yang signifikan. Penelitian Dhali
el
al.
(ZUOU) menunjukkan bahwa waktu paparan 3 menit cukup baik digunakan wntuk viPifikasi wit kerbau, sedangkan Rayoset
a/. (1 994) melaporkan bahwa waktu paparan 10 rnenEt menunjukkan hasil yang baik terhadap rnorfolagi oosit tikus dibandingkan dengan waktu paparan 5 menit.Perlakuan vitrifikasi pada media vitrifikasi 40% EG dan 50% EG ooeit banyak mengalami kematian tenrtama pada konsentrasi 50% EG
Hal ini dikarenakan krioprokktan dengan Ronsentrasi pekat dapat bersifat toksik bagi Wsit 6an dapa* menyebabkan kematian sel (Kasai, 1396).
Hasil penelitian Arav
et
a/., (1993) mnunjukkan bahwasel
yang mengalami ktTopwemsi dapat menimbulkan stres osmatik ataupun keracunan kirniawi yang Bisebabkan tinggimya komsentrasi krioprotektan yang digunakan sehingga organel sel akan w a k dan mengganmu proses metabolisme.Shaw
et
a/.,( 2000) dan Kasai (2002) mengemwkakan bahwkl secara garis beSar dapat dlkmukakan tiga faktor yang dapat menyebabkan sel berdegenerasi atau mati karmaproses
pemaparan dalam Mopreservasi, yaitu: a. keruwkan mekanis dengan tirnbulnya pembsntukan kristal es intraseluler yang dapat mmpengmhi s%ruktur sel; b. dehidrasi dlari swpansi media intfa maupun ekstrasebler sehingga konsentrasi menjadi toksik dan ktal. Dehidrasi juga dapat menimbulkan presfpiW, koagulasi, kenaikan prmeabilitas dan viskositas ~6rta gangguan keseimbangan ion. c.perubahan fisika-kimiawi diarrtaranya kehilapgan sifat-sifat a M f atau sifplt-sffat pengikatan air setta interaksi dad ketiga fplktor tersebut.5.3.. Analisa Struktur Sitoskeleton Oosit EkFtMsis Mikrohrbulus mengg~unakan Metode lmunohi6tokirnia
Pengamatan sitoskeleton baik oosit segar maupun msit hasil vitrifikasi menggunakan metode imunahistokimia. Hasil pengamatan rnenunjukkan adanya perbedaan struktur mikmtubul oosit kmtrol dan oosit hasil vihifikasi. MikPatubul m p a k a n struktur
sel
penymm spindel mebtik yang berpem penting dalam pembelahan sel. Padaonsit
kontrolmikrotubul tampek
sepefti
benang-benang m a m a k d l a t a n (Qambar 5). Pada konsentrasi EG 1046, 20%. 40%, dan 50% stfuktur rnikm'tubulustidak tampak seperti pada kontrol, tetapi menunjukkan adanya
deplimerisasi. Untuk rnenjaga fungsi oosit, struktur sitoskeleton berbasis mikrotubulus haws dapat dipertahankan, untuk in1 EG sehesar 30 %
brbukti
&pat
rnencegah
ke~usakan lebih lanjut dari sitoskeletcm. Seperti tampak pada Gamhr 6, oosit dengan pertakuan EG 30 %, struk.tur sitoskeleton tampak sepvti benang yang berati mash b i a mengalamirecovefy,
sedangkan pada konsentrasiEG
yang lain, &ibkeleton oosit UKnpaK mengabmi kewkan.Hasil penelitian ini menunjukkan bahwa ada hubwrgan antara morfologi dengan viabilitas aosit, bahwa pada konsentlgsi EG 30 % oosit menunjukkan persentase morfologi normal yang tertinggi (86.6%) dan persentase oosit hidup tartrnggi ( 78.7 %) dibandingkan konsentrasi EG yang laih. Vlabilitas oosR temyata juga ada hubungan dengan smktur
sitmkelelon berbasis mikrotubulus. Struktur sitoskeleton oosit pada vitrifkasi dengan 30 % EG menunjukkan tingkat kerusakan yang paling rendah dibandingkan pada konsentrasi EG yang lain
Hasil penelitian ini menunjukkan bahwa pada konsentrasi EG 10 % dan 20 %EG, msit banyak mengalami kerusakan. Pada konsentrasi
rendah krioprotektan tidak rnarnpu melindungi oosit selama proses vitrifikasi berlangsung sehingga oosit rusak saat terkena paparan suhu
dingin. Pada konsantrasi EG 10% dan EG 20%, lingkungan hjdrofobik
yang hilang tidak sepenuhnya terganti oleh etilen glikol. Vajta (2000) mengernukakan bahwa pada konsentrasi yang terlalu rendah krioprotektan
tidak
dapat mencegah tejadinya pernbentukan kristal es intraseluler akibat penurunan suhu yang sangat -at dan mengakibatkan kerusakan sel. Pada konsentrasi krioprotektan EG 40% den 50%, mslt banyak mengalami kerusakan terutarna pada konsentrasi 50% EG Hal inidisebabkan konsentrasi krioprotektan yang telllalu tingar dapal bersifat
toksik dan merusak sitoplasma sel (Kasai, 1996; Kuwayama, 1999; Shaw et el, 2000).
Ditambahkan oleh Kasai (1996) bahwa karena toksisiias lawtan, pengenceran cepat pada larutan vitrifikasi setelah pewairan adakah penting. Ketika oosit dipemneasi oleh krioprotektan, oosit terancarn ke~sakan dari pembengkakan osrnotik karena air melakukan penneasi jauh lebih cepat dibandingkan dengan kriopmtektan rnelalukan difosi
keluar.
Penelitian Shaw ef a/. (2000) dan Ermlu et a/., (1998) menunjukkan bahw proses pend~nginan merupakan rnasalah dalam kriopreservasi oosif rnarnalia. Semua oosit tahap M-ll rentan terhadap
kerusaitan pendinginan karena spindel yang menarik kromosorn
pada
bidang rnetafase dan rnengalami depolirnerisasi ketika suhu diunmkan. Lane (1999) dan Picton (2000) rnenyatakan bahwa rnikrotubul yang rnenyusun spindel oosit sangat sensitif terhadap kewsakan akibat proses pendinginan. Arnan dan Paks (1994) rnenyatakan bahwa pendinginanm S i t sapi 4 ' ~ atau 2 5 ' ~ rnenyebabkan sebagian atau seluruh spindel rnengalami kerusakan dan beberapa krmoson rnenyebar atau terupai.
Mekanisme kerusakan rnikrotubul oosit akibgt proses vitrifikasi disebabkan oleh banyak faktor. Beberapa penelitian rnenyatakan bahva kerusakan tersebut terjadi karena depolirnerisasi tubuiin yang rnenyusun ~mikrotubul. Menurut
Karp
(1984) rnikrotubul dalarn set rnerniiiki stablitasyang
berbeda rneskipunsecara
rnorfologi kdihatan =ma. Mikrotubul spindel rneiotik dan sitoskeleton sangat labil sehingga sensitif tethadap kerusakan, sedangkan rnikrotubul pada silia dan flagela relatif lebih stabil strukturnya. Sifat labil rnikrotubul spindel rneiotik dan sbkeleton rnenunjukkan bahwa mikrotubul merupakan suatu polirner yang terbentuk rnehlui ikatan nonkovalen pada subunit rnonornemya. Perlakuan yang rnenyebabkan hilangnya struktur tersebut biasanya disebabkan depolimerisasi rnikrotubul. Hal ini dirnungkinan karena depolinetisasi dapat menyebabkan kondisi rnikrotubul oosit yang mendapat pedakuan vitrifikasi terurai rnenjadi bentuk monamer.kwsakan rnikrotubul oosit hasil vitriflkasi juga dapat diibabkan oleh paparan kriopmtektan yang digunakan. Menurut Agca et a!. (2000)
krioprotektan mernpunyai efek merwgikan pada organisasi sistem mikrotubul oosit tikus. Paparan -it tikus menggunakan 1,5 M OMSO tanpa pendinginan menyebabkan terjadinya aneuploidi pada embrio. Lim, et a/.. (1999) menyatakan bahwa oosit sapi yang telah rnencapai tahap metafase II sangat sensitif terhadap kriopmtekkn dan didapatkan spindel rnetafase II abnormal setelah papamn kriaprotektan selarna satu menit. Saunders dan Parks (1999) berpendapet
bahwa
kornbinasi papamn oosit sapi dengan knopmtekn EG yang disertai pendinginan dapat mengacaukan organisasi mikrotubul dibandingkan hanya melalui pendinginan. Selain itu EG dilaporkan dapat rneningkatkan terbenbknya spindelyang
abnomml dan merusak konfigurasi kromosom.Faktor lain yang rnempengaruhi tejadinya kerusakan mikrotubul adalah kemampuan memperbaiki kerusakan. Penelitian ini menggunakan oosit yang telah mengalami maturasi yang &@an besar pada tahap pembelahan metafase II, dimana pada tahap ini oosit mengalami maturasi inti dan matumsi sitoplasmik, polar bodi keluar dan kromoson mengalami kondensasi serta tersusun pada spindel metafase. Mikmtubul spindel meiotik tldak terlindung oleh membran inti seperti pada M a p GV sehingga lebih mudah mengalami kerusakan akibat proses pendinginan dan pernapawn larutan kriprotektan. Menurut Arav et al.,(1993) o s i t yang sudah rnencapai tahap metafase II mempunyai struktur spesifik seperti spindel meiosis yang sangat sensitive terhadap paparan kripmtektm, suhu sangat rendah yang rnengakibatkan terjadinya
depolirnerisasj tubulin. Picton et a/., (2000) menyatakan bahwa pendinginan msit pada suhu 2 0 ' ~ dapat menyebabkan kewsakan permanen pada spindel meiotik, sedangkan pada suhu d i w a h o°C tejadi depolimaerisasi spindel dengan cepat. Kerusakan yang tejadi akibat pendlnginan oosit metafase meiosis I1 rneliputi reduksi spindel, disorganisasi mikrotubul (Pickering eta/., 1990), hilangnya kromosom dan splndel meiotik (Wood et al., 1997)
den
hilangnya kestabilan ikatan kromomn (Fabri et al., 2001).Kerusakan rnikrotubul oosit pada perlakuan vitrifikasi dapat menyebabkan abnormalitas pada kromosom. Hal itu bemubungan denganl peranan miklntubul dalam pembelahan sel. organisasi mikrotubul sangat penting untuk penyatuan yang tepat dan pemisahan kromosom ketika pembentukan spindel kembali pada saat suhu kembali normal (Wcton et a1.,2000). Selanjutnya Shaw et a/., (2000) dan Newton (2001). menyatakan bahwa meskipwn mikrotubul dapat mengalami perakin kembali setelah suhu normal kembali, pendinginan dapat meningkatkan terjadinya aneuploidi karena kromosom tidak tersusun dengan bener pada spindel yang baru terbentuk.
VI. KESIMPULAN DAN SARAN
6.1. Kesimpulan
1. Vitrifikasi rnenggunakail 30 9/0 EG dan lama papawn 3 rnenit dapat mengharnbat kerusakan rnorfolrrgi oosit dan viabilitas yang disebabkan oleh proses vitrifikasi,
2 Wntuk rnenjaga fungsi oosit, struktur sitoskeleton berbasis rnikrotubulus hams dapat dipertahankan. EG sebesar 30 YO terbukti d a p t mencegah
kerusakan lebih lanjut dgri sitoskelefon. Struktur sitoskelelon pada perlakuan 30 % EG tampak seperti benang yang berarti masih bisa mengalami recovery, sedangkan pada konsentrasi EG yang lain. sitoskeleton oosit tampak mengalami kerusakan.
3. Terdapat hubungan antara morfologi, viabilitas oosit a n struktur sitoskeleton berbasis rnikrotubulus.
6,2. Saran
1. Untuk melakukan ktiopfesenrasi oosit secara vitrifikasi disarankan menggunakan Etilen Glikol30 % dengan lama paparan 3 rnenit.
2. Disarankan melakukan analisa ultrastruktur oosit menggunakan Transmission Electron Microscopy agar dapat menjawab mengapa terjadi penurunan kwlitas oosit pasca vitrifikasi.
Acker,J.P. and LQcksley, E.M. 2003. Protect'~ve effect of intradtular ice during freezing ?. Cryobiology 46 : 797-202
Agca. Y. 2000. Clyopressnratian sf oocyte and ovarian tissue.
http:/www4.nas.edufclsfijhme.nsf/OpenD0~ument.
Aman: R.R. and Parks, J.E. 1994. Effect of cooling and rewarming on the meiotic spindle and chmmosorne of in vitm matutured bovine oocytes. Biol. Reprod. 1994; 50 : 103-1 10.
Arav, A., Zemn Y., and Ocheretny, A., 2000. A new device and method for vitrification incmase the cooling rate and allows successful cryopresewation of bovine oocytes. Theriogenology 53:248. Arav, A., D. Shebu, and Wttioli, M. 1993. Osmotic and cytotoxic study of
vitrification of immature bovine
oocytes.
J. Reprod and Fert. 99~353-358Childs, G.V. 1996. Structure and Function of Microtubules.
p
.
Desai, A. dan T.J. Mitchison. 1997. Micmtubule Polimerization Dinamics.
-arg
Dhali, A., Manik R.S. Das, S.K. Singla and Palta. P. 2000. Effect of ethylene glycol concentration and exposure time on post vitrification survival and in vitm maturation rate of buffalo oocytes. Theriogencvlogy 53:253.
Djati, M.S., 1999. Pengaruh suplementasi PMSG dan hCG pada proses fertilisasi in vitm dan kultur klon embrio sqpi dengan IGF-I. D l s e W i 'hat 25. Pmgram Pascasa jana lnstitut Pertanian Bogor, Bogor
Eroglu, A
,
Toth, T.L and TOner,M. 1998. Alterations of the cytoskeleton and polyptoidy induced by cryopmervation of metaphase II mouse c&yte.- Fert and~Gril.
65.:944- 957Fabri, R., Porcu, E., Marsella. T, Rwhetta, G. Venturoli and Flamcgni, C.. 2001. Human oocyte cryopresenration: New perspectives regarding oocyte survival.
http://www.3ou~,m.uWesh,relpress-
reIease/free~df.l16041 1 pdf.Fukui, E.J., Xia, L. and Downey, B.R., 1995. UltrastWral changes in bovine oocyte cryoprese~ed by vitrification. Cyobiology 32(2):139156.
Gordon, 1. 11994, Laboratory production of cattle embryos. Cab. International. Cambridge. 55-65
Han, B and Bischof,J.C. 2004. Direct dl injury associated with eutectic crystallization during freezing. Cryobiology 48 : 8-21
Hochi, S.,
Kimra,
K., lto, K, Wirabayashi, Mi 1996. Effect of nuclear stages during in vitro maturation on the survival of bovine w e s following vitdfication. Theriogenology 46345.Hochi, S., Fujimoto,T., and Oguri, N. 1995. Viability of immature horse
oocytes cryopreselved by vitrification. Theriogenology 42:236 Hotarnisligil, S., Toner, M. and Power, R.D. 1996. Changes in membrane
integrity, cytoskeletal structure, and develqpmental potential of murine oocytes after vitrification in ethylene glycol. Binlogy Reproduction. 55:161-168.
Hozumi,
J.
2001. Reproductive Biology and Biotechnobgy. Japan International Cooperation Agency. lndonesia.22-27Hyttel,
P.,
Vajta, G. and Callasen, H. 2000. Vitrification of bovine oocytes with theopt?n
pulled straw method : Ultra-structural consequences. Md. Reprod and Dev 56:80-88Ito ,K., Masuda, M., Fujiwara.
K
and Sato, H. 1994. Do astral microtubules play rode in metaphase chromosome pasitioning?. J.BologyWluler.
82:95-102Karp, G. 1984. Cell Biology. Mc Graw-Hill Book Company. New York. Kasai, M. 2002. Advances in the cryopreselvation of mammalian oocytes
and embFyos: Development of ultrarapid vitrification. Reproductive Medicine and Biology. Rev 1:l-9. http:llrwvw.Mackwell-synergy .corn/
links/doi/lO.I 046/j.l445781.2002.00004.
Kasai, M. 1996. Simple and efficient methads for vitrification of mamaltan embryos. Anim. Reprod. Sci 42:67-75.
Kutwta, C., Yang, X., Dinnyes, A,. Todomki, J, Yamakuchi, H, tvli~shita, K, I n h e , S, Tabara, J. 1998. In vitro and In vivo survival of frozen-thawed bovine o w e s after IVF, nuclear transfer and parthenogenetic activation. Mol Reprod. And Dev 51:281-286. Kuwayama, M. and Kato, 0. 1999. All-round vitrification methods for
human oocytes and embryos. Kato Ladies Clinic. Tokyo 160- 0023, Japan.
Lane, M.B., Bavister,B.D., Lyons and Forest. KT. 1999. Containerless vitrification
of
mammalians oocytes and embryos. hftp:llwww.biotech.nature.com.Le Gal, F. 1996. In Wtro maturation and ferfilizatbn of goat
ooqks
at the germinal vesicle stage. Theriogenology 45:2177-1185.Leoni, G., Bol;rlioli,L., beWnguer, F.. Rosati, I., Pintus, P.P.. ledda. S., ~aitana. S. 2002. -befined media for vitrification, warming and rehydration : effects on post-thaw protein synthesis and viability of in v h derived ovine &bryos. ~Gobioi& :2W212.
Lim, J.M, Fukui, Y. and Ono, H. 1992. Developmental competence of bovine oocytes frozen at various maturation stages followed by in vitro rnatu&ion and fertilization. ~heriogfmolag~ 37:351-362 Lim, J.M.,. KO. J.J., Hwang..W.S., Chung,H.M. and Nawa, K. 1999.
Development of In Vitro Matured Bovine Oowtes After
Macimr, S.K. 2001. Cytoskektal Dynamiw. h~Jotherrlsmaciver/CS2.pdf Men, H., Monson, R.L., Parrih, J.J., and Rutledge, J.J. 2003. degeneration of c!yopreseNed bovine
ocqtes
via apoptosis during subsequent cufture. Cryobiology 47 : 73-81.Newton. H. 2001. The cryoprese~ation of ovarian tissue as a strategy for preserving the fertility of cancer patients.
httD:/lwww.3.ou~,co.uWhuup/hdbNol~me04/I~~~e03I040237.sgm.
abs.html.Otol. T., Yamamoto, K., Koyama,N., Tachikawa, S. and Suzuki, T. 1998. Cryopreservation of mature bovine by vitrification in straws. Cryobiology 37 : 77
-
85Patk J,E. Ruffing, N.A. 1992. Factors affecting low temperature survival of mammalia
oacytes.
Theriogenology 37: 5973.Pickering, S.J., Braude, P.R., Johnson, Cant, A and Cunie, J. 1990. Transient cooling to room temperature can
cause
irreversible disruption ofThe
meiotic spindle in the human oocyte.h t t p : / ~ . n c b i . n l m . n i h . a o v / e n t r e z / a ~ e r y . f ~ i ~ ~ ~ e v e & d b = p
ubmed&
Pictan, H. M., Gosden, R.G. and L&h, S.P. 2000. Cryoprese~ation of
ocytes and ovarian tissue.hitp://www.who,inl/reprodud~vehealth/
inkrtilill7.pdf
Richardson, R.R. and
Parks,
J.E.
1992.Eftects
of chilling onthe
meioticspindle-of bovine ova. Theriogenology 37: 284-287.
Saha, S., Otoi, T and Suzuki, T. 1996. The efficiency of ethylene gly&,trehalose and polyvinilpyrrolidone for su~essful 'vitsificafioll of IVF bovine embryos. J. of Reprod. And Dev. 42:163-169.
Saunders, K.M and Parks, J.E. 1999. Effects of in vltro-matured bovine
~ e s . h t t p : / ~ . b i ~ r o d . o 1 + 1 / ~ i I ~ ~ n t e n t / f u l I / 6 1 1 1 1 1 7 8 .
Shaw,
J.M., Omnratnachai, A. and Trounson, A.O. 2000. Fundamentaloryobiology of mammalian oocytes and ovarian tissue. Theriogenology 53-.59-72.
Subowo.ZP95. Biologi Sel. Angkasa. Bandung
Stoddart. N.R and Fleming, S.D. 2000. Viability of oacytes after ICSI. human reprodudm l5(7):1580-1585.
Sun,Q.Y., Yang, Q.Z.,Liu, G.Y., Feng, H.L. and Qin, P.C. 1905. Cryoprese~ations of bovine oocytes matured in vitro Theriogenology 42:329.
Triwulanningsih, E. 1997. Pembekuan embrio dengan berbagai krioprotektan dan metode pembekuan. Prosiding Seminar Nasional P e t e m a n dan Veteriner. Balai Penelitian Temak. Bogor
Vajta, G. 2000. Vitrification of bavine ooqtes and embryo. Embryo Technology Center, Danish lhstitute of Agricultural Sciences. Denmark.
Wahjuningsih, S dan Dja3, M.S. 2003. Krioprese~asi oasit -pi Madura untuk pebtarian plasma nu&h Indonesia, Makalah seminar Indonesia Toray Science Foundation, Jakarta 4 Pebruafi 2003. Wahjuningsih, S. 2002. In vitro maturation of bovine oocytes derived from
clyopteservation of dimetyl .%Ifoxide (DMSO). Glyml, and ethylen glycol (EG).
Journal
of Reprotech, vol. I.No.
2:93-96 Wdhjlmingsih, S. Nurul, I., Ciptadi,G., Suyadi, DjM, MS. 2001. Kuaiitas-it sap yang dibekukan dengan kriopmtektan etilen glikol m l e h pmses maturasi in vitm. Jumai llmu Hayati. Vd 13 No. 2 : 9-15.
Wahjuningsih, 2004. finalisis isngamh Wtr#ikasi terhadap viabilkas dan
Struktur Oosit Sapi. Disertasi.
Pascasa
jana. UniversitasAirlangga Surabaya.
Wetzels, AM.M. 1996. Cryopresewation theory. In :
M.
Bras
(editor). IVF Labratory aspects of in vPtro fertilization. N.V. Organon\ Netherlands.Wood, C.E., Shaw, J.M dan Tmunm, A.O. 1997. Potential reproductive inSUranCe