BAB II
TINJAUAN PUSTAKA
2.1 Bunga Rosela (Hibiscus sabdariffa L.) 2.1.1 Klasifikasi Tanaman
Divisi : Magnoliophyta Kelas : Magnoliopsida Sub Kelas : Dilleniidae
Ordo : Malvales
Famili : Malvaceae
Genus : Hibiscus
Spesies : Hibiscus sabdariffa L.
(Cronquist, 1981). 2.1.2 Deskripsi Tanaman
Rosela merupakan tumbuhan semak umur satu tahun, tinggi tumbuhan mencapai 2,4 m. Batang berwarna merah, berbentuk bulat dan berbulu. Bunga tunggal, kuncup bunga tumbuh dari bagian ketiak daun, berbentuk lonceng; mahkota bunga berlepasan, mahkota bunga berbentuk bulat telur terbalik (Backer and Bakhuizen, 1963). Tanaman bunga Rosela ditunjukkan pada gambar 2.1.
Gambar 2.1. Bunga Rosela (Hibiscus sabdariffa L.) (Sukwattanasinit, 2008).
2.1.3 Kandungan Kimia Tanaman
Kandungan kimia tanaman ini adalah alohidroksi asam sitrat lakton, asam malat dan asam tartrat. Antosianin yang menyebabkan warna merah pada tanaman ini mengandung delfinidin-3-siloglukosida, delfinidin-3-glukosida, sianidin-3-siloglukosida, sedangkan flavonoidnya mengandung gosipetin dan mucilage
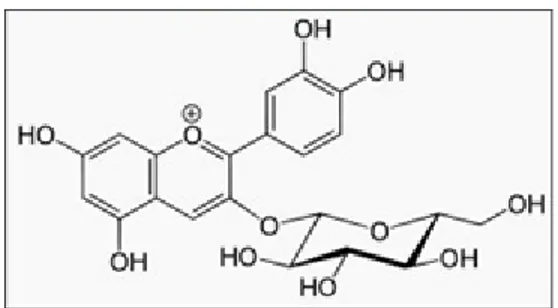
(rhamnogalakturonan, arabinogalaktan, arabinan) (Gruenwald et al., 2004). Bunga Rosela adalah seluruh perhiasan bunga Hibiscus sabdariffa L. suku Malvaceae, mengandung antosianin tidak kurang dari 0,02% dihitung sebagai glukosida. Senyawa identitas pada bunga rosela adalah sianidin-3-O-glukosida. Ekstrak kental bunga rosela berwarna merah hati dan rasa asam (Depkes RI, 2011). Struktur kimia dari sianidin-3-O-glukosida dapat dilihat pada gambar 2.2.
Gambar 2.2. Struktur Kimia Sianidin-3-O-Glukosida (Depkes RI, 2011)
2.1.4 Khasiat Tanaman
Tanaman Rosela tumbuh berkembang di seluruh dunia, terutama di daerah tropis. Tanaman ini banyak dibudidayakan di Eropa (Jones and Luchsinger, 1986). Secara tradisional, setiap bagian tanaman ini memiliki beberapa manfaat. Serat batang rosela secara tradisional digunakan sebagai bahan pembuatan karung goni, daun digunakan untuk kosmetik dan makanan, sedangkan bijinya untuk peluruh air seni, gangguan pencernaan dan makanan (Kasahara and Hemmi, 1995). Kelopak bunga rosela berkhasiat sebagai obat mual, memperlancar buang air besar, mengurangi nafsu makan, gangguan pernafasan yang disebabkan flu, dan rasa tidak enak di perut (Syamsuhidayat dan Hutapea, 2000; Cronquist, 1981; Gruenwald et al, 2004).
Penelitian yang telah dilakukan oleh Alaga et al. (2014) menunjukkan bahwa ekstrak rosela memiliki aktivitas antimikroba yang ditunjukkan dengan aktivitasnya terhadap beberapa patogen uji seperti pada penyakit diare, disentri, serta infeksi mulut dan gigi. Selain itu, efek farmakologi dari rosela antara lain sebagai antimikroba, antihipertensi, antikanker, Hypocholesterolemic dan
antioksidan (Alaga et al. 2014; Arellano et al., 2007; Hirunpanich et al., 2006; García et al., 2008).
2.2 Antosianin
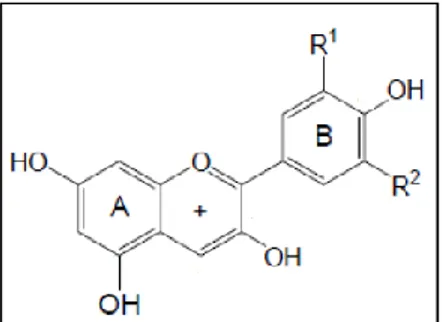
Antosianin termasuk ke dalam golongan flavonoid dan merupakan salah satu dari kelompok pigmen utama pada tanaman. Pigmen antosianin sebagian besar terdapat pada tanaman yang berbunga dan menghasilkan warna merah tua, ungu dan biru pada bunga, buah dan daun (Harborne and Grayer, 1988). Molekul antosianin disusun dari sebuah aglikon (antosianidin) yang teresterifikasi dengan satu atau lebih gula (glikon). Antosianin memiliki warna yang kuat dan relatif stabil dalam air pada pH asam. Stabilitas antosianin biasanya antara pH 2 - 4, terutama dalam keadaan tanpa oksigen (Markakis, 1982). Rumus struktur antosianin ditunjukkan pada gambar 2.3.
Gambar 2.3. Rumus Struktur Antosianin (Jordheim, 2007).
Antosianin terdapat dalam enam bentuk yaitu pelargonidin, sianidin, peonidin, delfinidin, petunidin dan malvidin. Gugus gula pada antosianin bervariasi namun kebanyakan dalam bentuk glukosa, ramnosa, galaktosa atau arabinosa. Gugus gula ini bisa dalam bentuk mono atau disakarida dan dapat
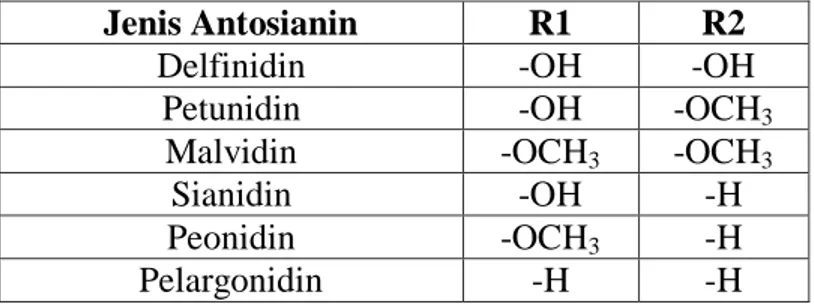
diasilasi dengan asam fenolat atau asam alifatis (Cretu et al., 2013). Rantai samping penyusun senyawa golongan antosianin ditampilkan pada tabel 2.1. Tabel 2.1. Rantai Samping Penyusun Senyawa Golongan Antosianin (Jordheim,
2007).
Jenis Antosianin R1 R2
Delfinidin -OH -OH
Petunidin -OH -OCH3
Malvidin -OCH3 -OCH3
Sianidin -OH -H
Peonidin -OCH3 -H
Pelargonidin -H -H
Antosianin merupakan senyawa yang tidak stabil dalam suasana netral atau basa. Oleh karena itu, prosedur ekstraksi biasanya dilakukan dengan menggunakan pelarut asam yang dapat merusak jaringan tanaman (Andersen dan Markham, 2006).
Laleh et al. (2006) dalam penelitiannya tentang stabilitas antosianin menyebutkan bahwa peningkatan paparan cahaya, pH, dan suhu dapat merusak molekul antosianin. Paparan cahaya dapat memperbesar degradasi yang terjadi pada molekul antosianin. Penyebab utama kehilangan pigmen warna berhubungan dengan hidrolisis antosianin (Ozela et al., 2007).
Selain mempengaruhi degradasinya, pH juga mempengaruhi warna antosianin, dimana dalam suasana asam akan berwarna merah dan suasana basa berwarna biru. Antosianin lebih stabil dalam suasana asam daripada dalam suasana basa ataupun netral (Rein, 2005).
Analisis senyawa antosianin dapat dilakukan dengan mengidentifikasi spektrum serapan UV-Vis dari senyawa terebut. Spektrum serapan UV-Vis
antosianin dapat diperoleh dengan menggunakan metode KLT-spektrofotodensitometri. Pada pengukuran spektrum dengan rentang 190-600 nm, antosianin memiliki panjang gelombang maksimum 520-540 nm (Escribano et al., 2004).
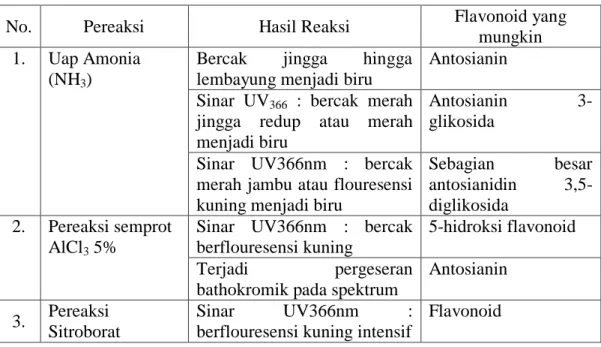
Untuk dapat mengidentifikasi adanya flavonoid pada suatu sampel dapat dilakukan dengan menggunakan KLT-pereaksi semprot atau analisis spektroskopi UV. Identifikasi senyawa flavonoid dapat dilihat pada tabel 2.2.
Tabel 2.2. Reaksi Flavonoid (Markham, 1988; Depkes RI, 1995)
No. Pereaksi Hasil Reaksi Flavonoid yang
mungkin 1. Uap Amonia
(NH3)
Bercak jingga hingga lembayung menjadi biru
Antosianin Sinar UV366 : bercak merah
jingga redup atau merah menjadi biru
Antosianin
3-glikosida Sinar UV366nm : bercak
merah jambu atau flouresensi kuning menjadi biru
Sebagian besar antosianidin 3,5-diglikosida
2. Pereaksi semprot AlCl3 5%
Sinar UV366nm : bercak berflouresensi kuning
5-hidroksi flavonoid Terjadi pergeseran
bathokromik pada spektrum
Antosianin 3. Pereaksi
Sitroborat
Sinar UV366nm :
berflouresensi kuning intensif
Flavonoid
2.3 KLT-Spektrofotodensitometri 2.3.1 Kromatografi Lapis Tipis (KLT)
Kromatografi Lapis Tipis (KLT) merupakan metode yang paling sederhana dari banyak metode kromatografi lainnya. Dengan teknik optimasi, tersedianya bahan dan instrumen maka pemisahan yang sangat efisien dan kuantifikasi akurat dan tepat dapat tercapai (Sherma dan Fried, 2005). Prinsip umum KLT yaitu
pemisahan campuran karena adanya pergerakan solven melewati permukaan datar, komponen–komponen tersebut akan bermigrasi dengan kecepatan yang berbeda–beda tergantung dari kelarutannya, adsorpsi, ukuran molekul, muatan dan elusi (Fifield dan Kealey, 2000).
Fase diam yang paling sering digunakan pada KLT adalah silika gel dan serbuk selulosa, sementara mekanisme sorpsi-desorpsi (suatu mekanisme perpindahan solut dari fase diam ke fase gerak atau sebaliknya) yang utama pada Kromatografi Lapis Tipis adalah partisi dan adsorbsi (Rohman, 2009). Jarak migrasi senyawa pada plat silika gel tergantung pada polaritasnya. Senyawa yang paling polar bergerak naik dengan jarak paling dekat dari titik awal penotolan, sedangkan senyawa dengan polaritas paling kecil bergerak paling jauh dari titik awal penotolan tersebut. Silika gel merupakan fase diam polar yang paling sering digunakan, meskipun demikian silika gel juga banyak dijumpai dalam bentuk yang termodifikasi (Watson, 2009).
Fase gerak pada KLT dipilih dari pustaka, sistem yang paling sederhana adalah dengan menggunakan campuran 2 pelarut organik sehingga pemisahan dapat terjadi secara optimal. Pada saat pemilihan fase gerak, fase gerak harus mempunyai kemurnian yang sangat tinggi karena Kromatografi Lapis Tipis (KLT) merupakan teknik pemisahan yang sangat sensitif. Daya elusi dari fase gerak yang dipilih harus dapat memberikan harga Rf analit diantara 0,2-0,8 untuk memaksimalkan pemisahan. Polaritas fase gerak untuk menentukan nilai Rf analit pada pemisahan menggunakan KLT (Rohman, 2009).
Pengembangan pelarut biasanya dilakukan dengan cara menaik (ascending), yang mana ujung lempeng dicelupkan ke dalam pelarut pengembang. Untuk menghasilkan reprodusibilitas kromatografi yang baik, wadah fase gerak harus dijenuhkan dengan uap fase gerak (Rohman, 2009). Plat dicelupkan dalam fase gerak kira – kira 0,5 cm. Untuk meyakinkan bahwa bejana kromatografi telah jenuh, maka dinding dalam bejana dapat dilapisi dengan lembaran kertas saring yang ujungnya direndam dalam fase gerak (Sastrohamidjojo, 1985).
Reprodusibilitas Rf puncak-puncak kromatogram dipengaruhi oleh berbagai faktor, seperti plat KLT yang digunakan, kadar analit yang ditotolkan, jarak pengembangan, derajat kejenuhan chamber, suhu lingkungan, dan senyawa ikutan pada ekstraksi (coextracting substance). Metode KLT merupakan metode analisis yang praktis, sederhana, efektif, cepat, tervalidasi dan sensitif (Flanagan et al., 2007).
2.3.2 Spektrofotodensitometri
Spektrofotodensitometri merupakan metode yang umum digunakan untuk mendapatkan infomasi pada setiap bercak pada KLT. Spektrofotodensitometer digunakan dengan menghubungkan pada suatu perangkat komputer (PC) yang dikendalikan dengan suatu program evaluasi. PC akan menampilkan hasil kalkulasi, protokol pendukung, menyediakan data dari semua parameter dari peralatan dan program evaluasi serta data hasil yang berupa angka dan grafik (Deinstrop, 2007).
Prinsip kerja spektrofotodensitometri berdasarkan interaksi antara radiasi elektromagnetik dari sinar UV-Vis dengan analit yang merupakan noda pada plat.
Radiasi elektromagnetik yang datang pada plat diabsorpsi oleh analit, ditransmisi atau diteruskan jika plat yang digunakan transparan. Radiasi elektromagnetik yang diabsorpsi oleh analit atau indikator plat dapat diemisikan berupa flouresensi dan fosforesensi (Sherma dan Fried, 2005). Detektor akan memberikan respon terhadap konsentrasi analit dalam bercak-bercak dari plat setelah pemisahan. Sinyal yang didapat kemudian diplotkan sebagai sebuah fungsi dari jarak yang ditempuh analit dan konsentrasi analit dalam bercak, sehingga didapatkan suatu rangkaian puncak-puncak yang disebut kromatogram (Skoog dan West, 2004).
Beberapa faktor yang dapat menjadi parameter baik atau tidaknya suatu kromatogram pada umumnya adalah daya pisah atau resolusi (Rs) dan faktor asimetri atau tailling factor (Tf).
a. Resolusi (Rs)
Tingkat pemisahan komponen dalam suatu campuran dengan metode kromatografi direfleksikan dalam kromatogram yang dihasilkan. Untuk hasil pemisahan yang baik, puncak-puncak dalam kromatogram harus terpisah secara sempurna dari puncak lainnya dengan sedikit tumpang tindih (overlapping) atau tidak ada tumpang tindih sama sekali. Tingkat pemisahan antara puncak-puncak kromatografi yang bersebelahan merupakan fungsi jarak antara puncak maksima dan lebar puncak yang berhubungan. Untuk puncak Gaussian, hal ini cukup digambarkan dengan resolusi atau daya pisah puncak (Gandjar dan Rohman, 2008). Nilai resolusi dapat dihitung dengan menggunakan persamaan 1.
Sebagaimana ditunjukkan oleh persamaan di atas, resolusi komponen-komponen dalam kromatografi tergantung pada waktu retensi relatif (tR) pada sistem kromatografi tertentu dan tergantung pada lebar puncak (Wb). Untuk mengoptimalisasi parameter-parameter ini agar diperoleh resolusi yang maksimal, maka diperlukan suatu pemahaman terhadap sifat faktor-faktor yang mempengaruhinya (Gandjar dan Rohman, 2008). Harga Rs yang baik adalah > 1,5 (Ahuja dan Dong, 2005).
b. Faktor Asimetri atau Tailling Factor (Tf)
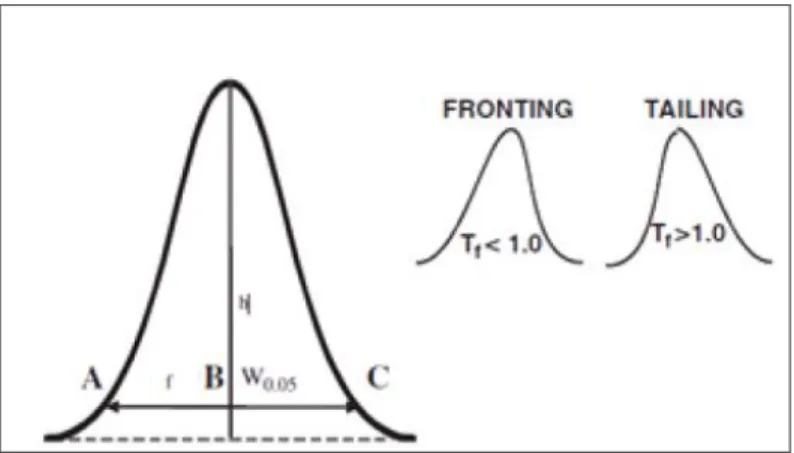
Suatu situasi yang menunjukkan kinerja kromatografi yang kurang baik adalah ketika ditemukan suatu puncak yang mengalami pengekoran (tailing) sehingga menyebabkan puncak tidak simetris. Jika puncak yang akan dikuantifikasi tidak simetris (asimetri), maka suatu perhitungan asimetrisitas merupakan cara yang berguna untuk mengontrol atau mengkarakterisasi sistem kromatografi. Puncak asimetri muncul karena berbagai faktor. Peningkatan puncak yang asimetri akan menyebabkan penurunan resolusi, batas deteksi, dan presisi. Contoh puncak asimetri dapat dilihat pada gambar 2.4.
Gambar 2.4. Perhitungan Tailling Factor (Tf) (Ahuja and Dong, 2005). Berdasarkan gambar tersebut, nilai Tailling Factor (Tf) dapat dihitung dengan persamaan 2.
Tf = W0,05/2f = AC/2AB ... (2) Dalam kondisi ideal, puncak kromatografi akan memiliki bentuk puncak Gaussian yaitu puncak simetri sempurna. Pada kenyataannya, sebagian besar puncak dapat mengalami tailing. Seperti ditunjukkan dalam Gambar 2.4, Tailling factor (Tf) adalah ukuran dari puncak asimetri. Dalam perhitungan ini digunakan lebar puncak pada ketinggian puncak 5% (W0,05). Tailling factor untuk sebagian besar puncak harus jatuh antara 0,9 dan 1,4, dengan nilai 1,0 mengindikasikan puncak simetris sempurna. Puncak tailing biasanya disebabkan oleh adsorpsi atau interaksi kuat lain dari analit dengan fase diam sementara puncak sepertinya dapat disebabkan oleh kolom overloading, reaksi kimia atau isomerisasi selama proses kromatografi (Ahuja dan Dong, 2005).
2.4 Chromatographic Fingerprint (CFP)
Chromatographic Fingerprint (CFP) merupakan metode yang digunakan untuk standardisasi produk herbal di negara maju dalam upaya kontrol kualitas (Palanisamy dan Natesan, 2012). Beberapa informasi penting tentang produk herbal yang diperoleh dari CFP seperti: integritas, kejelasan, dan kualitas dari produk herbal yang diteliti (MacLennan, 2002). Jumlah konstituen aktif dalam suatu tanaman umumnya banyak sehingga sulit untuk menjamin keamanan, kendali mutu dan konsistensi dari suatu produk herbal (Liang et al., 2004). CFP dapat menggambarkan persamaan dan perbedaan yang ada pada suatu ekstrak tanaman dari variasi tanaman dan identifikasi keaslian dari suatu tanaman dapat dilakukan secara akurat. Syarat-syarat suatu fingerprint adalah kompak,
reprodusible, serta repeatable (Giri et al., 2010).
Teknik kimia dan kromatografi dapat digunakan untuk membantu dalam identifikasi dari suatu bahan herbal atau ekstrak. Teknik kromatografi seperti High Performance Liquid Chromatography (HPLC), Thin Layer Chromatography
(TLC) atau Kromatografi Lapis Tipis (KLT) dan Gas Chromatography (GC) serta metode spektroskopi seperti IR, NMR, dan UV juga dapat digunakan untuk
fingerprint (Gautam et al., 2010). KLT merupakan metode yang paling banyak digunakan untuk analisis fingerprint karena mempunyai beberapa kelebihan yaitu mudah dalam preparasi sampel, sederhana dalam prosedur kerja, volume pelarut yang digunakan sedikit, selektif dan sensitif, serta kromatogramnya dapat diamati secara visual (Cie’sla dan Hajnos, 2009).
2.4.1 Pemanfaatan KLT-Spektrofotodensitometri dalam Chromatographic Fingerprint
Penggunaan KLT dapat dibantu dengan menggunakan spektrofotodensitometer untuk memperoleh informasi kualitatif dan kuantitatif dari plat KLT tersebut (Liang et al. 2004). Data CFP yang dapat direkam menggunakan KLT-spektrofotodensitometer adalah kromatogram, nilai-nilai Rf, spektrum, panjang gelombang maksimum dan noda dengan penampak bercak. Hal tersebut merupakan profil sidik jari (fingerprint) sampel dalam KLT (Liang et al., 2004).
Pola puncak kromatogram yang diperoleh dari analisis dengan KLTSpektrofotodensitometri dapat digunakan sebagai fingerprint untuk menentukan tingkat kesamaan sampel herbal yang dianalisis. Setiap puncak pada kromatogram memiliki rasio luas puncak yang berperan penting dalam fingerprint
(Feng dan Runyi, 2006). Selain kromatogram, spektrum UV-Vis suatu senyawa juga merupakan komponen CFP dengan KLT-spektrofotodensitometri. Setiap senyawa memiliki spektrum UV-Vis yang spesifik. Spektrum dapat memberikan informasi mengenai identitas suatu senyawa maupun data stabilitas senyawa tersebut. Karakteristik spektrum suatu senyawa meliputi panjang gelombang maksimum, rasio absorbansi dan jumlah puncak yang muncul (Feng dan Runyi, 2006).
2.4.2 Pemanfaatan Cross Correlation Function dalam Chromatographic
Fingerprint (CFP)
Untuk membandingkan bentuk spektrum senyawa penanda sampel satu dengan sampel lainnya digunakan analisis fungsi korelasi silang “cross correlation function”. Nilai koefisien korelasi (r)dihitung dengan:
Dimana xi dan yi adalah harga absorban unit dari dua spektrum yang dibandingkan pada suatu panjang gelombang, penjumlahan dilakukan pada rentang panjang gelombang yang sesuai dengan analit (Harmita, 2004).
2.4.3 Pemanfaatan Cosine Function dalam Chromatographic Fingerprint (CFP)
Cosine function (fungsi kosinus) ditentukan untuk menyatakan hubungan kedekatan antara dua vektor dalam hal ini adalah hubungan kedekatan antara dua buah sampel. Fungsi kosinus ini diterapkan dalam kromatografi fingerprint untuk menentukan hubungan kedekatan sampel yang satu dengan sampel yang lainnya (Esseiva et al., 2003). Chromatographic Fingerprint mencirikan pola kimia yang terdiri dari puncak-puncak yang menyajikan komposisi yang unik dari suatu sampel dalam kromatogram dengan memanfaatkan semua komponen kimia yang terdeteksi oleh instrumen untuk dianalisis. Hal ini juga ditetapkan bahwa sampel dengan pola kimia yang sama mungkin memiliki sifat yang mirip. Pengukuran kesamaan tersebut antar kromatogram (vektor) dapat direpresentasikan dalam ... (3)
tetapan Euclidean, koefisien korelasi Pearson, atau kosinus sudut dan rasio kesamaan untuk perbandingan yang objektif (Luo, 2003).
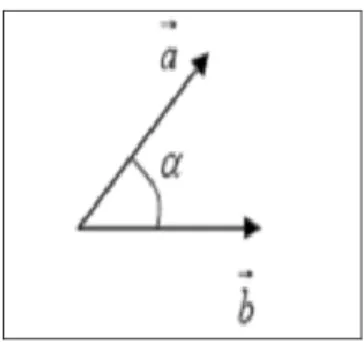
Puncak-puncak kromatogram dan luas area di bawah puncak adalah karakteristik untuk setiap senyawa penyusun sampel. Korelasi antar sampel dapat dihitung dengan memanfaatkan data tersebut dan memasukkan ke dalam fungsi kosinus. Hubungan antar sampel ditentukan oleh koefisien korelasi antar sampel (Esseiva et al., 2003). Hubungan tersebut dapat digambarkan sebagai sudut pada suatu vektor yang dapat dilihat pada gambar 2.5.
Gambar 2.5. Sketsa Sudut Diantara Dua Vektor (Esseiva el al., 2003). Gambar 2.5 menggambarkan dua vektor dan dengan sudut α. Untuk menentukan kedekatan antara dua vektor tersebut, dilakukan penghitungan sudut yang terdapat di antara dua vektor tersebut. Perhitungan fungsi kosinus dilakukan dengan aturan vektor untuk memperkirakan kedekatan antara dua vektor, sudut yang ada di antara kedua vektor tersebut dihitung. Dengan mengikuti aturan vektor, nilai korelasi antara dua kromatogram dapat dihitung dengan persamaan 4.
Dimana a1, a2, a3, …, an menyatakan besaran atau nilai dari variabel 1-n untuk kromatogram a, dan b1, b2, …, bn menyatakan besaran variabel 1-n untuk ... (4)
kromatogram b. Nilai korelasi adalah angka tanpa dimensi, auto normalized, dan mandiri dari panjang vektor yang menunjukkan aturan dari sampel (Esseiva et al., 2003). Dari data kromatogram beberapa sampel kemudian dibangun hubungan antar sampel dengan memanfaatkan korelasi fungsi kosinus (C). Sampel yang memiliki hubungan kedekatan yang baik adalah yang memberikan nilai korelasi C mendekati 100 (Dufey et al., 2006). Fungsi kosinus memiliki keuntungan yaitu mudah memproses hasil dari perhitungan dan memberikan nilai data tunggal dibandingkan nilai hasil grafik. Hasil perhitungan fungsi kosinus ini secara langsung akan menunjukkan hubungan antara suatu sampel dengan sampel yang lainnya (Esseiva et al., 2003).