PENINGKATAN RESISTENSI UDANG WINDU
Penaeus monodon TERHADAP PENYAKIT WHITE SPOT
SYNDROME VIRUS MELALUI TRANSFER
GEN Penaeus monodon ANTIVIRAL
ANDI PARENRENGI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Dengan ini saya menyatakan bahwa disertasi “Peningkatan Resistensi Udang Windu Penaeus monodon Terhadap Penyakit White Spot Syndrome Virus Melalui Transfer Gen Penaeus monodon Antiviral” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juli 2010
Andi Parenrengi NIM C161070061
SUMANTADINATA, ALIMUDDIN, and SUKENDA.
Shrimp is one of the most important species in aquaculture. Tiger shrimp Penaeus monodon, an indigenous crustacean species in Indonesia, has been widely reared in brackish water pond. During the last decade, the worldwide shrimp culture was greatly puzzled by diseases caused by viruses and suffered significant economic losses. White spot syndrome virus (WSSV) is the most threatening infectious agent in shrimp aquaculture. Production of diseases-resistant shrimp by genetic manipulation is an alternative way to elucidate the problem. Therefore, the aim of this study was to improve the shrimp resistance to WSSV by introducing an antiviral gene isolated from tiger shrimp P. monodon. ProAV promoter and cDNA of PmAV antiviral gene were isolated from tiger shrimp using PCR and RT-PCR methods, respectively. The results showed the success in isolating the tiger shrimp ProAV promoter sequence of 368 bp in length. BLAST-N analysis showed that the promoter has high similarity (95-98%) compared with the other promoters presented in the GeneBank. The existence of the important transcription factors in promoter regulation such as TATA box, MRE, TCF-1, SP-1, GAL-4, and GATA-1 were identified in the promoter. The PmAV antiviral cDNA of 513 bp in length that consists of 170 amino acid residues has also been successfully isolated from tiger shrimp. BLAST-N analysis showed the high similarity (100%) compared with the other antiviral genes deposited at the GeneBank. Amino acid deduction analysis (BLAST-P) of PmAV cDNA revealed a C-type lectin-like domain (CTLD) that is similar with the C-type lectin gene isolated from several crustacean species. Furthermore, the isolated ProAV and PmAV sequences were ligated to pEGFP-N1 and pBluescript-SK, respectively to construct pProAV-EGFP and pProAV-PmAV expression vectors. Expression vectors were transferred into embryos by transfection method using JetPEI reagent. ProAV promoter activity was determined by analyzing EGFP gene expression as a reporter using RT-PCR method. The result showed that ProAV promoter was able to drive EGFP gene expression on embryo and larvae of tiger shrimp. Transient EGFP expression analysis showed a similar pattern with the PmAV gene expression, where they started to express at 12 hours after transfection (hat), the peak expression level at 24 hat, and then decreased slightly at 30 hat. Thus, pProAV-PmAV was then constructed, and F0 transgenic shrimp was produced to examine the PmAV activity against WSSV infection.
Result of challenge test showed that PmAV gene expression in F0 transgenic PL-25 was
up-regulated during WSSV infection, and over-expression of PmAV cDNA increased the survival rate of 24.5% in transgenic shrimp (95.6% survived) compared to the control shrimp (71.1% survived) against WSSV. The body weight and length of 1.5 months transgenic shrimp did not show significantly difference with the non-transgenic shrimp. Therefore, the use of transgenic shrimp over-expressing PmAV cDNA may be helpful to recovery Indonesian shrimp aquaculture.
Dibimbing oleh KOMAR SUMANTADINATA, ALIMUDDIN, dan SUKENDA.
Udang windu Penaeus monodon merupakan salah satu spesies krustase lokal yang dikembangkan sebagai komoditas utama budidaya tambak di Indonesia. Sejak tahun 1990-an, budidaya udang windu mengalami berbagai kendala, baik akibat lingkungan perairan yang kurang mendukung maupun adanya serangan penyakit bakteri dan virus. Virus bintik putih (white spot syndrome virus, WSSV) merupakan penyebab utama berbagai kasus kematian udang windu, yang hingga kini belum dapat diatasi secara tuntas. Kasus penyakit udang akibat serangan virus tidak hanya terjadi di Indonesia, tetapi juga terjadi di negara lain seperti India, Korea, Cina, dan Amerika.
Penanggulangan penyakit pada budidaya udang windu telah dilakukan termasuk penggunaan antibiotik, vaksin, immunostimulan, dan teknologi seleksi. Meskipun demikian, metode tersebut memiliki kelemahan, antara lain: dapat menyebabkan berkembangnya strain bakteri yang resisten terhadap antibiotik, residu antibiotik memberikan dampak negatif pada lingkungan akuatik, pemberian vaksin dan imunostimulan harus dilakukan setiap siklus produksi, serta teknologi seleksi membutuhkan waktu, biaya, dan tenaga yang relatif banyak untuk memproduksi keturunan udang tahan penyakit. Sebuah metode baru yang dikenal dengan istilah transgenesis diharapkan dapat mengatasi kelemahan metode sebelumnya. Organisme transgenik yang tahan terhadap patogen dapat diproduksi dengan mengintroduksi gen yang berperan dalam sistem imun dan gen penyandi protein imunogenik dari patogen. Pada penelitian ini dilakukan introduksi gen penyandi protein antivirus udang windu (Penaeus monodon antiviral gene, PmAV) dengan tujuan untuk menghasilkan udang windu yang memiliki resistensi yang tinggi terhadap penyakit virus khususnya WSSV.
Dalam rangkaian penelitian untuk memproduksi udang windu transgenik, sebagai tahap awal dilakukan isolasi, karakterisasi, dan kloning promoter antivirus ProAV dan cDNA gen antivirus PmAV dari udang windu sebagai penyusun konstruksi gen yang akan diintroduksi. Sekuen nukleotida promoter dan gen antivirus hasil isolasi dianalisis menggunakan program Genetyx Versi 7 untuk mendapatkan kemiripan (similaritas) sekuen, deduksi asam amino, dan keberadaan motif faktor transkripsi. Analisis kemiripan gen dilakukan melalui penyejajaran (alignment) sekuen pada Bank Gen menggunakan basic local alignment search tool (BLAST-N untuk sekuen nukleotida dan BLAST-P untuk sekuen deduksi asam amino).
Sekuen promoter ProAV hasil isolasi selanjutnya diligasi dengan gen EGFP (enhanced green fluorescent protein) sebagai penanda untuk membuat konstruksi gen pProAV-EGFP yang digunakan dalam analisis aktivitas promoter ProAV. Konstruksi gen yang kedua, yaitu pProAV-PmAV dibuat dengan menyambungkan promoter ProAV dan cDNA pProAV-PmAV yang digunakan untuk memproduksi udang transgenik keturunan nol (F0) dan analisis ekspresi gen antivirus pada embrio
dan larva. Konstruksi gen pProAV-EGFP ditransfer ke embrio udang windu menggunakan metode transfeksi dengan larutan jetPEI. Aktivitas promoter ProAV diketahui dengan mengamati ekspresi gen penanda EGFP pada embrio dan larva udang windu. Ekspresi gen EGFP dianalisis secara berkala, yakni 12, 18, 24, dan 30 jam setelah transfeksi (jst) menggunakan UV- transilluminator dan metode RT-PCR. Selanjutnya, konstruksi gen pProAV-PmAV ditransfer ke embrio udang windu menggunakan metode yang sama dengan pProAV-EGFP. Ekspresi gen PmAV juga dianalisis menggunakan metode RT-PCR pada rentang waktu sama dengan yang dilakukan pada gen EGFP. Pengamatan performa udang transgenik F0 dilakukan dengan cara uji tantang dengan
virus WSSV untuk melihat kelangsungan hidup larva dan pola ekspresi transgen PmAV, serta bobot dan panjang tubuh udang. Data ekspresi gen EGFP dan PmAV dianalisis secara deskriptif. Data kelangsungan hidup udang windu dianalisis ragam (ANOVA) menggunakan program Statistix Versi 3.0 dan dilanjutkan dengan uji beda nyata terkecil pada taraf 5%.
Hasil penelitian menunjukkan bahwa promoter ProAV berhasil diisolasi dari udang windu dengan panjang sekuen 368 bp. Analisis BLAST-N memperlihatkan bahwa promoter ProAV memiliki kemiripan yang tinggi (95-98%) dengan sekuen promoter udang windu referensi pada Bank Gen. Keberadaan motif faktor transkripsi yang berperan penting dalam regulasi promoter, misalnya kotak TATA, MRE, TCF-1, SP-1, GAL-4, dan GATA-1 telah diidentifikasi pada sekuen
identik (100%) dengan gen antivirus dari udang windu yang ada di Bank Gen. Komposisi asam amino penyusun gen PmAV yang paling besar adalah serina (10,00%), sedangkan yang terkecil adalah asam amino prolina dan lisina masing-masing 1,76%. Analisis sekuen deduksi asam amino (BLAST-P) memperlihatkan adanya C-type lectin-like domain (CTLD) yang memiliki kemiripan dengan gen C-type lectin yang diisolasi dari beberapa spesies krustase.
Dua konstruksi gen berhasil dibuat, yakni konstruksi gen pProAV-EGFP pada vektor pEGFP-N1, dan pProAV-PmAV pada vektor pBluescript-SK. Transfer gen EGFP dan antivirus PmAV ke embrio udang windu telah berhasil dilakukan dengan menggunakan metode transfeksi. Penggunaan larutan jetPEI dan DNA plasmid tidak berpengaruh nyata (P>0,05) terhadap derajat penetasan telur udang windu. Hasil tersebut berimplikasi bahwa penggunaan larutan jetPEI dan DNA plasmid dari konstruksi gen tidak berbahaya bagi kelangsungan hidup embrio udang windu. Uji aktivitas promoter menunjukkan bahwa promoter ProAV memperlihatkan aktivitas dalam mengatur gen EGFP pada embrio dan larva udang windu. Ekspresi gen EGFP pada embrio dan larva udang windu mulai terlihat 12 jam setelah transfeksi (jst), dan mencapai puncak ekspresi pada 24 jst, dan selanjutnya tingkat ekspresi gen menurun pada pengamatan 30 jst. Hasil tersebut menunjukkan bahwa promoter ProAV hasil isolasi adalah aktif dan dapat digunakan dalam upaya pengembangan udang windu transgenik dengan menggunakan gen target yang diinginkan.
Ekspresi gen antivirus PmAV memperlihatkan pola yang serupa dengan ekspresi gen EGFP. Ekspresi gen antivirus PmAV mulai terlihat pada pengamatan 12 jst dan selanjutnya meningkat sampai mencapai puncak pada 24 jst dan kemudian terjadi penurunan tingkat ekspresi pada 30 jst. Persentase udang windu yang membawa transgen PmAV berkisar antara 37,5-75,0%. Ekspresi gen antivirus PmAV meningkat (up-regulated) ketika udang windu transgenik F0
ditantang dengan WSSV, dimana tingkat ekspresi gen antivirus meningkat sejak 6 jam sampai dengan hari ke-4, dan selanjutnya menurun pada hari ke-5 setelah uji tantang. Pada udang non-transgenik, ekspresi gen PmAV meningkat pada hari pertama, kemudian melemah sejak hari ke-2 setelah uji tantang sampai dengan akhir penelitian. Hasil uji tantang dengan virus WSSV menunjukkan bahwa udang windu transgenik F0 memperlihatkan resistensi (kelangsungan hidup
95,6%) lebih tinggi (P<0,05) dibandingkan dengan udang kontrol non-transgenik (kelangsungan hidup 71,1%). Pengamatan berat dan panjang total tubuh udang windu transgenik umur 1,5 bulan tidak memperlihatkan perbedaan yang signifikan (P>0,05) dengan udang windu non-transgenik (kontrol).
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber:
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
Penaeus monodon TERHADAP PENYAKIT WHITE SPOT
SYNDROME VIRUS MELALUI TRANSFER
GEN Penaeus monodon ANTIVIRAL
ANDI PARENRENGI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Penguji pada Ujian Tertutup : Prof. Dr. Ir. Ronny Rachman Noor, M.Rur.Sc. Dr. Ir. Odang Carman, M.Sc.
Penguji pada Ujian Terbuka : Dr. Ir. Endhay Kusnendar Kontara, M.S. Dr. Ir. Utut Widyastuti, M.Si.
Nama : Andi Parenrengi
NIM : C161070061
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Komar Sumantadinata, M.Sc. Ketua
Dr. Alimuddin, S.Pi, M.Sc. Dr. Ir. Sukenda, M.Sc. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Akuakultur
Prof. Dr. Ir. Enang Harris, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Nya sehingga disertasi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah teknologi transgenesis pada udang, dengan judul Peningkatan Resistensi Udang Windu Penaeus monodon Terhadap Penyakit White Spot Syndrome Virus Melalui Transfer Gen Penaeus monodon Antiviral. Penelitian ini dilaksanakan dari bulan Agustus 2008 sampai dengan
bulan Desember 2009 di Balai Riset Perikanan Budidaya Air Payau (BRPBAP), Maros, Sulawesi Selatan dan Laboratorium Reproduksi dan Genetika Organisme Akuatik, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor (IPB), di Bogor.
Dua Bab dari disertasi ini merupakan pengembangan dari naskah yang telah dipublikasikan di jurnal ilmiah terakreditasi A. Bab II telah diterbitkan di Indonesian Aquaculture Journal 4(1):1-7, tahun 2009 dengan judul Cloning Of ProAV Promoter Isolated From Tiger Prawn Penaeus monodon, sedangkan Bab III telah diterbitkan di Jurnal Riset Akuakultur 4(1):1-13, tahun 2009 dengan judul Karakteristik Sekuen cDNA Pengkode Gen Anti Virus dari Udang Windu, Penaeus monodon. Selain itu, sebagian hasil penelitian telah dipresentasikan pada Workshop Jaringan Perbenihan dan Pemuliaan Induk Ikan, pada tanggal 5-8 Agustus 2009 di Yogyakarta, dan Bab IV telah dipresentasikan pada Forum Inovasi Akuakultur Indonesia (FITA) pada tanggal 20-23 April 2010 di Bandar Lampung.
Terima kasih penulis ucapkan kepada Komisi Pembimbing: Bapak Prof. Dr. Ir. Komar Sumantadinata, M.Sc., Bapak Dr. Alimuddin, S.Pi, M.Sc., dan Bapak Dr. Ir. Sukenda, M.Sc., atas segala bimbingan dalam penyusunan proposal, pelaksanaan penelitian, dan penulisan disertasi. Kepada Bapak Prof. Dr. Ronny Rachman Noor, M.Rur.Sc. dan Dr. Ir. Odang Carman, M.Sc. sebagai penguji luar komisi pada ujian tertutup, serta Bapak Dr. Ir. Endhay Kusnendar Kontara, M.S. dan Dr. Ir. Utut Widyastuti, M.Si. sebagai penguji luar komisi pada ujian terbuka, kami ucapkan terima kasih atas saran/kritik terhadap pelaksanaan penelitian dan penulisan disertasi. Penulis mengucapkan terima kasih kepada Ibu Dr. Munti Yuhana, S.Pi., M.Si. dan Ibu Dr. Dinamella Wahyuningrum, M.Si. selaku penguji luar pada ujian prakualifikasi program Doktor.
Penulis mengucapkan terima kasih kepada Badan Riset Kelautan dan Perikanan (BRKP) dan Pusat Pendidikan dan Pelatihan (PUSDIKLAT), Kementerian Kelautan dan Perikanan (KKP) yang telah menyediakan beasiswa untuk program doktor (S3) di IPB. Di samping itu, penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Rachman Syah, M.S., Kepala BRPBAP Maros beserta seluruh staf yang telah menyediakan dukungan dana, fasilitas, dan motivasi selama pelaksanaan penelitian ini dan khususnya kepada Ibu Andi Tenriulo, S.Si., Bapak Ir. Syarifuddin Tonnek, M.S., dan Ibu Dra. Emma Suryati, M.Si.
Ucapan terima kasih pula diucapkan kepada Prof. Dr. Enang Harris, M.S., ketua Program Mayor Ilmu Akuakultur dan seluruh staf pengajar dan pegawai Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, khususnya staf Laboratorium Reproduksi dan Genetika Organisme Akuatik.
Ungkapan terima kasih yang mendalam disampaikan kepada ayahanda: H. Andi Mangumpara; ibunda: Hj. Andi Mukmin; mertua: Ir. H. Andi Abdul Rasjid
Muh. Ataillah Asyraf, dan Andi Alifiah Aldilah Islamiah; serta seluruh keluarga atas segala bantuan dana, doa, dan kasih sayangnya.
Terima kasih secara khusus disampaikan kepada rekan-rekan mahasiswa Pasacasarjana IPB khususnya Mayor Ilmu Akuakultur Angkatan 2007: Ir. Usman, M.Si.; Ir. O.D. Hasan Subhakti, M.S.; Ir. Ahmad Ghufron Mustofa, M.S.; Ir. Mulyana, M.S.; Raden Roro Puji Sinarni Dewi, S.Pi., M.S.; Ir. Ilmiah, M.S.; Yulintine, S.Pi., M.Sc.; dan Hesti Wahyuningsih, S.Si., M.S. atas kebersamaan dan persahabatan selama menempuh studi di IPB, serta semua pihak yang tidak sempat penulis sebutkan satu persatu dalam tulisan ini.
Semoga disertasi ini bermanfaat untuk kepentingan penelitian dan kemajuan ilmu pengetahuan.
Bogor, Juli 2010
lima bersaudara dari pasangan ayah Andi Mangumpara dan ibu Andi Mukmin. Pendidikan sarjana ditempuh di Program Studi Budidaya Perikanan, Fakultas Peternakan, Universitas Hasanuddin (UNHAS) di Makassar, dan lulus pada tahun 1991. Pada tahun 1999, penulis melanjutkan pendidikan pada Program Studi Perikanan (Fisheries and Wildlife), di Universiti Putra Malaysia (UPM) di Malaysia, dan berhasil lulus pada tahun 2001. Kesempatan untuk melanjutkan pendidikan program doktor (S3) di Institut Pertanian Bogor (IPB) di Bogor diperoleh pada tahun 2007 pada Mayor Ilmu Akuakultur, dengan beasiswa dari Badan Riset Kelautan dan Perikanan, dan Pusat Pendidikan dan Pelatihan, Kementerian Kelautan dan Perikanan.
Penulis mulai bekerja sebagai peneliti di Balai Besar Riset Perikanan Budidaya Laut, Gondol-Bali sejak tahun 1992. Pada tahun 1993, penulis pindah tugas ke Balai Riset Perikanan Budidaya Air Payau (BRPBAP), Maros dan sampai saat ini, penulis telah meraih jabatan fungsional Peneliti Madya dalam bidang penelitian perbenihan, genetika, dan bioteknologi perikanan budidaya air payau. Selain itu, penulis pernah dipercayakan memangku jabatan struktural Kepala Sub Seksi Program di BRPBAP dari tahun 2003-2007.
Penulis telah mempublikasikan karya ilmiah pada beberapa jurnal nasional dan internasional, serta berpartisipasi aktif pada berbagai kegiatan seminar misalnya sebagai presenter pada World Aquaculture Society (WAS) di Denpasar pada tahun 2005, dan World Ocean Conference (WOC) di Manado pada tahun 2009. Sebagai peneliti, penulis selalu berusaha meningkatkan pengetahuan dan keterampilan dengan cara mengikuti training yang terkait, baik di dalam maupun di luar negeri, misalnya: The Quantitative Genetics to Aquaculture di Filipina (1995), Quantitative Genetics and Selection Breeding di Indonesia (1996), The Coastal Aquaculture Technology di Korea Selatan (2004), dan Fisheries and Aquaculture Development di Spanyol (2006).
DAFTAR TABEL ………...… xv
DAFTAR GAMBAR ………..………...…… xvi
DAFTAR LAMPIRAN ………. xviii
DAFTAR ISTILAH ……… xx
I PENDAHULUAN UMUM ... 1
Latar Belakang ... 1
Kerangka Pemikiran ... 5
Tujuan dan Kegunaan ... 7
Kebaruan Penelitian ... 7
II ISOLASI DAN KARAKTERISASI PROMOTER GEN ANTIVIRUS DARI UDANG WINDU Penaeus monodon .... 8
Abstrak ... 8
Abstract ... 9
Pendahuluan ... 9
Bahan dan Metode ... 11
Hasil dan Pembahasan ... 19
Kesimpulan ... 24
III ANALISIS SEKUEN cDNA GEN ANTIVIRUS DARI UDANG WINDU Penaeus monodon ... 25
Abstrak ... 25
Abstract ... 26
Pendahuluan ... 26
Bahan dan Metode ... 29
Hasil dan Pembahasan ... 32
Kesimpulan ... 41
IV AKTIVITAS PROMOTER ANTIVIRUS PADA UDANG WINDU Penaeus monodon MENGGUNAKAN GEN EGFP (ENHANCED GREEN FLUORESCENT PROTEIN) SEBAGAI PENANDA ... 42
Bahan dan Metode ... 48
Hasil dan Pembahasan ... 50
Kesimpulan ... 57
V EKSPRESI GEN ANTIVIRUS PADA EMBRIO DAN LARVA UDANG WINDU Penaeus monodon ... 58
Abstrak ... 58
Abstract ... 59
Pendahuluan ... 59
Bahan dan Metode ... 61
Hasil dan Pembahasan ... 65
Kesimpulan ... 75
VI PEMBAHASAN UMUM ... 76
VII KESIMPULAN UMUM DAN SARAN ... 87
Kesimpulan Umum ... 87
Saran ... 87
VIII DAFTAR PUSTAKA ... 88
1 Similaritas sekuen promoter ProAV yang diisolasi dari udang windu P. monodon dengan sekuen total gen antivirus PmAV pada Bank Gen (kode
aksesi DQ641258-1) …...………... 22
2 Similaritas sekuen gen antivirus PmAV udang windu P. monodon dengan gen
antivirus pada Bank Gen ... 34 3 Daya tetas embrio, jumlah telur berpendar, deteksi DNA dan cDNA pada
udang windu P. monodon hasil transfeksi konstruksi gen pProAV-EGFP
... 53 4 Daya tetas embrio, deteksi DNA dan cDNA pada embrio dan larva udang
windu P. monodon hasil transfeksi konstruksi gen pProAV-PmAV
... 68 5 Kelangsungan hidup larva udang windu P. monodon pada perlakuan uji
1 Hasil elektroforesis DNA genom dan fragmen tunggal promoter antivirus
ProAV yang diisolasi dari udang windu P. monodon .... 19 2 Seleksi koloni putih-biru, cracking, dan plating klon bakteri pembawa
promoter antivirus ProAV ... 20 3 Alignment sekuen promoter ProAV yang diisolasi dari udang windu P.
monodon dengan sekuen promoter dari Bank Gen (kode aksesi DQ641258-1)
... 21 4 Distribusi motif faktor transkripsi pada sekeun promoter antivirus ProAV
yang diisolasi dari udang windu P. monodon ... 23
5 Hasil elektroforesis fragmen DNA gen antivirus PmAV yang diisolasi dari
cDNA hepatopankreas udang windu P. monodon .. 32
6 Seleksi koloni putih-biru, cracking, dan plating klon bakteri pembawa gen
antivirus PmAV ... 33 7 Sekuen nukleotida dan deduksi asam amino penyandi gen antivirus PmAV
yang diisolasi dari udang windu P. monodon .... 35
8 Alignment deduksi asam amino gen antivirus PmAV yang diisolasi dari udang windu P. monodon dengan asam amino yang ada pada Bank Gen
... 37
9 Hasil analisis cracking dan PCR konstruksi gen pProAV-EGFP.. 51
10 Konstruksi gen pProAV-EGFP yang digunakan dalam uji aktivitas promoter
pada udang windu P. monodon ... 51 11 Analisis DNA genom dan ekspresi gen EGFP pada udang windu P. monodon
... 58
12 Hasil analisis cracking dan PCR konstruksi gen pProAV-PmAV.. 66
13 Konstruksi gen pProAV-PmAV yang digunakan dalam transfeksi gen
antivirus PmAV ke embrio udang windu P. monodon ... 67 14 Ekspresi gen antivirus PmAV pada embrio dan larva udang windu P.
monodon ... 68 15 Kelangsungan hidup larva udang windu P. monodon yang ditantang dengan
WSSV ... 70 16 Ekspresi gen antivirus PmAV pada hepatopankreas larva udang windu P.
monodon yang ditantang dengan WSSV ... 73
20 Penampilan secara morfologi udang windu P. monodon transgenik (A) dan
1 Skema ekstraksi DNA genom udang windu menggunakan metode fenol kloroform ………...……...
2 Skema purifikasi fragmen DNA dari gel menggunakan kit GF-1 Gel DN Recovery (Vivantis) ...………..
3 Seleksi koloni putih-biru untuk identifikasi transforman pada kloning ge (A), dan tanda panah pada inzet (B) menunjukkan bakteri koloni biru da koloni putih ...
4 Skema pelaksanaan kloning promoter ProAV dan gen antivirus PmAV p vektor pGEM-T Easy ...
5 Skema isolasi DNA plasmid dengan menggunakan kit GF-1 Plasmid DN Extraction (Vivantis) ...
6 Skema ekstraksi RNA total dan sintesis cDNA menggunakan kit Ready-Go You-Prime First Strand Beads dengan teknik Reverse Transcription Polymerase Chain Reaction (RT-PCR) ...
7 Skema pembuatan konstruksi gen pProAV-EGFP pada vektor pEGFP ………...
8 Bak konikal pemijahan induk udang windu volume 300 L yang dilengka dengan lubang diameter 15 cm (tanda panah) pada kedua sisi yang berlawanan, dengan pencahayaan menggunakan lampu pijar 5 Watt …...
9 Skema prosedur transfeksi gen ke embrio udang windu menggunakan l jetPEI ……….………...………
10 Wadah percobaan transfeksi gen EGFP dan PmAV di Instalasi Pembeni BRPBAP di Barru (A), dan uji tantang larva dengan WSSV di Laborato Patologi BRPBP di Maros (B) …...
11 Skema pembuatan konstruksi gen pProAV-PmAV pada vektor pBluescri . ...
12 Perkembangan embrio udang windu P. monodon ...
13 Pelaksanaan kloning promoter ProAV dan gen antivirus PmAV di Laboratorium Reproduksi dan Genetika Organisme Akuatik, FPIK-IPB ...
14 Pengambilan sampel embrio dan larva udang windu pada malam (A siang (B) hari untuk analisis DNA genom dan ekspresi gen EGFP dan P serta penghitungan daya tetas larva udang windu ...
BLAST-N : basic local alignment search tool-nucleotide BLAST-P : basic local alignment search tool-protein
bp : base pair
cDNA : complementary DNA
CMV : cytomegalovirus
CRD : carbohydrate-recognition domain
CTLD : C-type lectin-like domain
DEPC : diethylpyrocarbonate
DNA : deoxyribonucleic acid
dsRNA : double-stranded RNA
EDTA : ethylenediaminetetraacetic acid
EGFP : enhanced green fluorescent protein
GH : growth hormone
GST-PAP : glutathione-S-transferase-phagocytosis activating p IHNV : infectious hematopoetic necrosis virus
IPTG : isopropanoltio-β-D-galaktopiranosida jst/hat : jam setelah transfeksi/hour after transfection
LB : Luria Bertani
MAS : marker assisted selection MCS : multiple cloning site
mRNA : messenger RNA
ORF : open reading frame
PAMP : pathogen-associated molecular pattern
PCR : polymerase chain reaction
PmAV : Penaeus monodon antiviral
ProAV : promoter antivirus
ProPEN : promoter penaeidin
PRR : pattern recognition receptor
RFP : red fluorescent protein
RNA : ribonucleic acid
RT-PCR : reverse transcription-polymerase chain reaction
SD : standar deviasi
SDS : sodium dodecyl sulfate
SDW : sterile distilled water
SPF : specific pathogen free
SPR : specific pathogen resistance
TF : transcription factor
TSV-CP : taura syndrome virus-coat protein
UTR : untranslated region
WSSV : white spot syndrome virus YFP : yellow fluorescent protein
Udang windu Penaeus monodon merupakan salah satu spesies krustase lokal yang dibudidayakan di tambak-tambak air payau di Indonesia dan telah menghasilkan devisa negara yang cukup signifikan. Meskipun demikian, sejak tahun 1990-an, budidaya udang windu mengalami berbagai kasus kematian, baik akibat lingkungan perairan yang kurang mendukung maupun adanya serangan penyakit bakteri dan virus. Sedikitnya 20 jenis virus penyebab penyakit pada budidaya udang telah dilaporkan (Zhang et al. 2004). Virus bintik putih merupakan jenis virus penyebab utama berbagai kasus kematian udang windu, yang dikenal sebagai penyakit white spot syndrome virus (WSSV) yang hingga kini belum dapat diatasi secara tuntas. Kasus penyakit virus WSSV tidak hanya terjadi di Indonesia (Atmomarsono 2004), tetapi juga terjadi di negara lain seperti India (Sathish et al. 2004; Rout et al. 2005), Korea (Kim et al. 2004), Cina (Zhan et al. 2004), dan Amerika (Galavis-Silva et al. 2004; Guevara & Meyer 2005).
Berbagai upaya penanggulangan penyakit pada budidaya udang windu telah dilakukan misalnya penggunaan antibiotik atau bahan kimia. Kedua metode tersebut dapat menyebabkan berkembangnya strain bakteri yang resisten terhadap antibiotik (Tendencia & Pena 2001) dan memberikan dampak negatif pada lingkungan akuatik serta residunya dapat membahayakan kesehatan manusia yang mengkonsumsinya (Reed et al. 2004). Upaya penanggulangan lainnya adalah pendekatan peningkatan ketahanan tubuh melalui penggunaan imunostimulan dan vaksin yang diharapkan dapat merangsang peningkatan kekebalan non-spesifik pada udang windu. Strategi peningkatan ketahanan tubuh melalui pemberian vaksin dan imunostimulan memiliki kelemahan seperti aplikasi harus dilakukan setiap siklus produksi. Upaya lain yang dapat dilakukan adalah pendekatan genetik melalui teknologi seleksi yang ditujukan untuk meningkatkan resistensi udang terhadap patogen penyebab penyakit (Cock et al. 2009). Akan tetapi, metode perbaikan genetik melalui seleksi membutuhkan waktu, biaya, dan tenaga yang relatif banyak. Sebuah metode baru yang dikenal dengan istilah teknologi transgenesis diharapkan dapat mengatasi kelemahan atau memperbaiki metode
sebelumnya. Teknologi transgenesis adalah suatu teknologi rekayasa gen dengan mengintroduksikan satu atau lebih DNA asing ke hewan uji dengan tujuan untuk memanipulasi genotipenya ke arah yang lebih baik dan selanjutnya dapat ditransmisikan ke keturunannya (Beaumont & Hoare 2003). Aplikasi transgenesis diharapkan dapat memperbaiki karakter-karakter yang berguna bagi akuakultur seperti peningkatan laju pertumbuhan, perbaikan kualitas daging, peningkatan daya tahan ikan terhadap lingkungan yang ekstrim dan penyakit.
Pada umumnya, tahap pertama dalam transgenesis adalah penyediaan konstruksi gen yang akan diintroduksi. Konstruksi gen minimal mengandung sebuah promoter, gen target, dan signal poliadenilasi. Pada awal perkembangan transgenesis pada ikan, konstruksi gen yang digunakan berasal dari hewan mamalia atau hewan tingkat rendah, yang umumnya memperlihatkan tingkat ekspresi gen sangat kecil. Untuk mengatasi masalah tersebut dan dengan pertimbangan aspek keamanan pangan (biosafety), akhir-akhir ini telah dikembangkan konstruksi gen dengan komponen penyusunnya berasal dari ikan (all-fish gene construct) (Alimuddin et al. 2003). Hal tersebut telah berhasil dilakukan pada ikan salmon transgenik menggunakan promoter methallothionein dan gen hormon pertumbuhan (growth hormone, GH) yang diisolasi dari ikan salmon, ikan nila transgenik menggunakan promoter β-aktin medaka dan gen GH dari ikan nila (Yoskowiak et al. 2006), serta ikan mud loach transgenik menggunakan promoter β-aktin dan GH dari ikan mud loach (Nam et al. 2001). Oleh karena itu, dalam rangkaian penelitian produksi udang windu transgenik, sebagai tahap pertama dilakukan kloning promoter gen antivirus ProAV yang diisolasi dari udang windu sebagai salah satu penyusun konstruksi gen yang akan diintroduksi. Selanjutnya, aktivitas promoter ProAV dianalisis dengan mengamati ekspresi gen penanda EGFP (enhanced green fluorescent protein) pada embrio dan larva udang windu.
Gen GH merupakan salah satu gen target yang paling banyak digunakan dalam transgenik ikan. Transfer gen GH telah diaplikasikan pada ikan salmon sehingga dapat tumbuh lebih cepat dari ikan normal (Devlin et al. 2006), ikan mud loach dengan kecepatan tumbuh 32 kali lebih cepat (Nam et al. 2001), dan ikan nila dengan pertumbuhan 2-7 kali lebih cepat (Kobayashi et al. 2007). Introduksi
gen AFP (anti-freeze protein) pada ikan koki dapat meningkatkan toleransinya terhadap suhu dingin sampai dengan 0oC (Wang et al. 1995) dan injeksi gen AFP pada juvenil ikan nila dan bandeng dapat meningkatkan toleransinya terhadap suhu lingkungan yang rendah (13oC) (Wu et al. 1998). Transfer gen GFP (green fluorescent protein), YFP (yellow fluorescent protein), dan RFP (red fluorescent protein) dapat menghasilkan ikan zebra berwarna-warni yang dapat dilihat pada kondisi cahaya biasa (Gong et al. 2003a).
Penerapan teknologi transgenesis dalam peningkatan resistensi ikan atau udang terhadap serangan penyakit atau patogen merupakan salah satu alternatif yang diharapkan dapat memecahkan masalah penyakit pada akuakultur. Sebagai hewan dari kelompok krustase (invertebrata), udang windu diketahui tidak mempunyai sistem kekebalan adaptif (adaptive immunity) tetapi tergantung pada sistem kekebalan non-spesifik atau alami (innate immunity) dalam mempertahankan diri terhadap serangan patogen. Kekebalan alami yang dimiliki oleh krustase mampu mendeteksi pola molekuler yang merupakan ciri spesifik suatu patogen (Sritunyalucksana 2001), misalnya lipopolisakarida (LPS) dari bakteri gram negatif, glikolipid dari mycobacteri, asam lipoteichoic dari bakteri gram positif, mannans dari khamir, ß-1,3-glukan dari jamur dan rantai ganda dari RNA virus. Krustase, termasuk udang windu mempunyai mekanisme respons imun yang diransang oleh reseptor yang mengenal molekul yang berassosiasi dengan patogen (pathogen-associated molecular pattern, PAMPs) melalui reseptor PRRs (pattern recognition receptors) (Arts et al. 2007). Pendeteksian substansi mikroba dari patogen oleh PRPs akan mengaktifkan beberapa molekul biologis yang bertanggung jawab dalam sistem kekebalan tubuh termasuk protein peptida antimikroba (antimicrobial peptides) (Sritunyalucksana 2001).
Penemuan gen-gen pengontrol ketahanan tubuh pada krustase yang memiliki respons antimikroba, seperti: lizosim (Somboonwiwat et al. 2006; Burge et al. 2007; Wang et al. 2007), proPO (Sritunyalucksana et al. 1999; Wang et al. 2006, 2007; Jiravanichpaisal et al. 2007; Perdomo-Morales et al. 2007; Okumura 2007; Ai et al. 2008; Yeh et al. 2009), penaeidin (Destoumieux et al. 1997, 2000a, 2000b; Munoz et al. 2003; Jiravanichpaisal et al. 2007, Okumura 2007, Wang et al. 2007), hemosianin (Zhang et al. 2004), dan lektin (Denish et al. 2003; Luo et
al. 2006; Ma et al. 2007; Sun et al. 2007; Kong et al. 2008; Zhang et al. 2009; Zhao et al. 2009) memberikan harapan dalam strategi penanggulangan penyakit udang di masa depan. Demikian pula halnya dengan gen yang diisolasi dari bakteri atau virus seperti glikoprotein virus, dapat digunakan untuk keperluan peningkatan resistensi melalui teknologi rekombinan DNA. Injeksi gen pengkode glikoprotein IHNV (infectious hematopoetic necrosis virus) menggunakan promoter CMV (cytomegalovirus) pada ikan salmon, menunjukkan proteksi yang signifikan setelah 8 minggu, dan masih tetap resisten serta menunjukkan antibodi penetral virus sampai 12 minggu berikutnya (Traxler et al. 1999). Transfer gen cecropin juga dapat meningkatkan daya tahan ikan medaka terhadap Pseudomonas fluorescens dan Vibrio anguillarum (Sarmasik et al. 2002).
Penerapan teknologi transgenesis pada udang belum banyak dilaporkan. Introduksi gen penyandi TSV-CP (taura syndrome virus-coat protein) telah dilakukan pada udang vaname Litopenaeus vannamei dengan menggunakan metode elektroporasi, mikroinjeksi dan transfeksi (Sun et al. 2005). Lu & Sun (2005) telah membuktikan bahwa aplikasi teknologi transgenesis dengan introduksi gen TSV-CP dapat meningkatkan resistensi udang vaname transgenik sampai dengan 39% kelangsungan hidup lebih tinggi dibandingkan dengan udang normal (kontrol). Penelitian pada udang windu P. monodon masih terbatas pada isolasi dan identifikasi gen pengontrol antivirus oleh Luo et al. (2003) dan hemosianin oleh Zhang et al. (2004). Oleh karena itu, pengembangan transgenesis udang windu untuk meningkatkan resistensi terhadap penyakit khususnya penyakit WSSV perlu dilakukan dengan mengintroduksikan gen pengontrol antivirus dari udang windu. Penggunaan gen antivirus dari udang windu merupakan salah satu upaya pembuatan konstruski gen yang semuanya berasal dari udang (all-shrimp construct). Oleh karena itu, sebagai tahap selanjutnya dalam rangkaian penelitian ini dilakukan kloning gen antivirus (Penaeus monodon antiviral gene, PmAV) yang diisolasi dari udang windu khususnya pada udang yang hidup (survivor) setelah terserang penyakit WSSV dari tambak-tambak udang windu di Sulawesi Selatan. Selanjutnya gen antivirus PmAV disambungkan dengan promoter ProAV untuk membuat konstruksi gen pProAV-PmAV. Pada tahap akhir dilakukan transfer gen pProAV-PmAV pada embrio udang windu
melalui metode transfeksi dengan menggunakan larutan jetPEI, analisis ekspresi gen antivirus PmAV, dan uji tantang udang transgenik menggunakan virus WSSV. Kerangka Pemikiran
Kebutuhan protein hewani termasuk ikan hasil budidaya semakin bertambah dengan semakin meningkatkannya populasi penduduk. Di lain pihak, hasil tangkapan udang di alam cenderung menurun, produktivitas tambak rendah, kualitas air lingkungan menurun, dan kegagalan panen akibat serangan penyakit merupakan penyebab utama menurunnya produksi udang. Untuk menanggulangai masalah tersebut, diperlukan adanya upaya diversifikasi spesies budidaya, perbaikan sistem budidaya, pengelolaan sumberdaya alam yang lestari, dan pemeliharaan strain unggul. Pada kasus budidaya udang windu, teknologi penyediaan induk dan benih yang berkualitas tinggi dan tahan penyakit merupakan aspek yang harus segera dibenahi agar usaha budidaya dapat berjalan dengan baik. Serangkaian penelitian dapat dilakukan dalam rangka penyediaan induk dan benih berkualitas tinggi melalui teknik konvensional seperti perkawinan silang dan seleksi karakter tertentu, namun teknik tersebut memerlukan waktu yang relatif lama. Sementara itu, penerapan teknologi non-konvensional atau teknik modern melalui implantasi sel atau jaringan, dan transgenesis memerlukan waktu relatif lebih singkat. Teknologi transgenesis pada ikan memperlihatkan potensi yang besar dalam pengembangan hasil dan efesiensi produksi akuakultur, misalnya dalam meningkatkan fenotipe ikan seperti: laju pertumbuhan, efisiensi pakan, ketahanan pada lingkungan dan resistensi terhadap penyakit.
Dari beberapa kemungkinan perbaikan kualitas induk dan benih udang windu melalui teknologi transgenesis, maka transfer gen antivirus merupakan hal yang prioritas dilakukan untuk meningkatkan ketahanan tubuhnya (resistensi) untuk melawan serangan penyakit. Patogen sangat mudah masuk atau menyerang udang yang memiliki daya tahan tubuh yang rendah. Serangan penyakit virus khususnya WSSV merupakan penyebab utama kematian udang selama sepuluh tahun terakhir ini. Infeksi virus tersebut umumnya dapat menyebabkan kematian massal dalam waktu 3-6 hari, ataupun kalau masih ada yang tersisa hanya sekitar 5-10% (Suprapto & Murdjani 2004). Hal tersebut merupakan fenomena yang
sangat menarik untuk diketahui bagaimana udang windu bertahan hidup dari serangan WSSV.
Udang windu yang bertahan hidup dari serangan penyakit virus diduga memiliki pertahanan tubuh yang kuat yang secara genetik disandikan oleh gen pengontrol antivirus PmAV (Luo et al. 2003) yang dikendalikan oleh promoter antivirus ProAV. Dalam teknologi transgenesis, penyediaan promoter dan gen target yang sesuai merupakan kunci utama keberhasilan produksi organisme transgenik. Oleh karena itu, promoter yang digunakan dalam penelitian ini adalah promoter antivirus ProAV yang diisolasi dari udang windu tanpa mengandung sekuen mikrosatelit. Modifikasi tersebut didasarkan laporan Luo et al. (2007) bahwa, promoter yang tidak mengandung mikrosatelit memperlihatkan aktivitas yang lebih tinggi dibandingkan dengan promoter yang mengandung mikrosatelit.
Dengan bioteknologi molekuler, promoter ProAV dan gen antivirus PmAV tersebut dapat diisolasi, dikloning, dan selanjutnya dibuat konstruksi gen yang nantinya dapat ditransfer ke embrio udang lainnya secara in vivo. Pemilihan metode transfer gen berperan penting dalam kesuksesan produksi udang windu transgenik. Dengan pertimbangan ukuran telur udang windu yang kecil dengan perkembangan embrio yang relatif cepat, metode transfer gen yang dipilih dalam penelitian ini adalah metode transfeksi menggunakan larutan jetPEI. Metode transfeksi telah terbukti lebih efektif dibandingkan dengan metode mikroinjeksi dan elektroporasi pada udang vaname (Sun et al. 2005).
Aktivitas promoter dapat diketahui dengan menggunakan gen berpendar EGFP sebagai gen pelapor atau penanda. Apabila promoter memperlihatkan aktivitas dalam mengendalikan gen EGFP, maka promoter tersebut dapat digunakan sebagai regulator gen target lainnya. Transfer gen antivirus PmAV dapat dilakukan pada embrio udang windu dengan metode yang sama seperti pada gen EGFP. Keberhasilan transfer gen antivirus dapat diketahui melalui analisis DNA genom dengan teknik PCR (polymerase chain reaction) semi-kuantitatif, dan ekspresi gen antivirus PmAV menggunakan teknik RT-PCR (reverse transcription-polymerase chain reaction) sehingga keterlibatan gen antivirus tersebut dalam respons imun udang windu dapat diketahui. Dengan teknologi transgenesis tersebut, sifat udang windu yang resisten terhadap penyakit virus
akan dimiliki udang transgenik, yang pada akhirnya dapat meningkatkan kelangsungan hidupnya sehingga produksi udang windu melalui budidaya tambak dapat ditingkatkan.
Tujuan dan Kegunaan
Penelitian ini bertujuan untuk menghasilkan udang windu P. monodon transgenik yang memiliki resistensi terhadap WSSV yang lebih tinggi dibandingkan dengan udang non-transgenik melalui over-ekspresi gen antivirus PmAV. Secara khusus penelitian ini bertujuan untuk:
1. Menganalisis karakteristik sekuen promoter gen antivirus ProAV yang diisolasi dari udang windu.
2. Menganalisis sekuen dan deduksi asam amino cDNA gen antivirus PmAV yang diisolasi dari udang windu.
3. Mendapatkan konstruksi gen antivirus “all-shrimp” dari udang windu. 4. Mengkaji aktivitas promoter ProAV pada embrio dan larva udang windu. 5. Mengkaji ekspresi gen antivirus PmAV pada embrio dan larva udang
windu.
6. Mengkaji performa larva udang windu transgenik.
Keberhasilan teknologi transgenesis pada udang windu diharapkan dapat menjadi salah satu alternatif pemecahan masalah keterpurukan budidaya udang windu akibat serangan penyakit WSSV. Hasil penelitian ini diharapkan dapat berguna dalam upaya peningkatan produksi perikanan akuakultur Indonesia khususnya produksi udang windu di tambak.
Kebaruan Penelitian
Kebaruan (novelty) dalam penelitian ini adalah meliputi: konstruksi gen antivirus “all-shrimp construct” dari udang windu, transfer gen antivirus pada udang windu menggunakan metode transfeksi dengan jetPEI, dan udang windu transgenik F0 hasil introduksi gen antivirus PmAV.
ABSTRAK
Promoter adalah sekuen DNA spesifik yang berperan dalam mengendalikan transkripsi gen yang terletak di sebelah hulu dari bagian struktural suatu gen. Isolasi promoter sangat diperlukan dalam upaya analisis sekuen dan faktor transkripsi yang akan berperan sebagai regulator gen. Penelitian ini dilakukan untuk mengetahui karakteristik promoter gen antivirus ProAV yang diisolasi dari udang windu Penaeus monodon. Isolasi promoter dilakukan dengan menggunakan teknik PCR dan karakterisasi sekuen dilakukan dengan program BLAST-N dan Genetyx Versi 7. Hasil penelitian menunjukkan bahwa promoter antivirus ProAV telah berhasil diisolasi dari udang windu dengan panjang fragmen 368 bp. Analisis BLAST-N memperlihatkan bahwa promoter tersebut memiliki similaritas yang tinggi (95-98%) dengan sekuen promoter pada Bank Gen. Keberadaan motif faktor transkripsi yang berperan penting dalam regulasi promoter, misalnya: kotak TATA, MRE, TCF-1, SP-1, GAL-4, dan GATA-1 telah diidentifikasi pada sekuen promoter tersebut, yang diduga memiliki peran penting dalam mengendalikan gen target. Keberadaan faktor transkripsi tersebut berimplikasi bahwa promoter tersebut berpotensi dalam mengatur gen antivirus. Kata kunci: isolasi, karakterisasi, promoter, faktor transkripsi, udang windu.
---
*) Bab ini telah dipublikasi dengan judul: Cloning of ProAV Promoter Isolated from Tiger Prawn Penaeus monodon, pada jurnal Indonesian Aquaculture Journal 2009; 4 (1): 1-7.
ISOLATION AND CHARACTERIZATION OF
ANTIVIRAL GENE PROMOTER FROM TIGER SHRIMP
Penaeus monodon
ABSTRACT
Promoter is a specific DNA sequence involved in the transcription regulator of gene, where the promoter is usually located in the upstream of structural gene. Isolation of promoter is essentially needed in order to establish the sequence analysis and transcription factor that are functioned in the gene regulator. The research was conducted to analyze the characteristics of antiviral gene promoter isolated from tiger prawn Penaeus monodon. ProAV promoter was isolated by PCR method and its sequence was characterized by using the BLAST-N and Genetyx Version 7. The results showed the success in isolating a promoter from tiger prawn at fragment position of 368 bp in length. BLAST-N showed that the promoter had high similarity (95-98%) compared with the other promoters in the GeneBank. The existence of the important transcription factors in promoter regulation, such as TATA box, MRE, TCF-1, SP-1, GAL-4, and GATA-1 were identified from the promoter sequence. The existence of the transcription factors implied that the promoter would be useful in the gene transcription regulator. Keywords: isolation, characterization, promoter, transcription factor, tiger
shrimp.
PENDAHULUAN
Promoter merupakan sekuen DNA spesifik yang berperan dalam pengendalian transkripsi gen yang terletak di daerah hulu struktural gen. Oleh karena itu, promoter berperan aktif dalam pengaturan tingkat ekspresi suatu gen target (Hoare & Beaumont 2003). Kesesuain promoter merupakan elemen paling penting dalam kesuksesan penerapan sistem transformasi gen, karena promoter mengatur kapan, dimana, dan kondisi apa, serta target gen yang diaktifkan. Promoter yang sesuai dengan kepentingan akuakultur dan dapat diterima oleh konsumen sebaiknya diisolasi dari sumber yang tidak berpotensi dalam resiko kesehatan.
Proses transkripsi suatu gen sangat dipengaruhi oleh karakteristik sekuen promoter yang mengaturnya. Proses transkripsi suatu gen umumnya diawali oleh penempelan faktor transkripsi (transcription factor, TF) dan kompleks enzim RNA polimerase yang berada pada daerah promoter. Oleh karena itu, promoter berperan penting dalam penerapan teknologi transgenesis, sehingga pemilihan promoter yang sesuai akan sangat menentukan tingkat ekspresi transgen dari karakter gen target yang diintroduksi .
Pada awal perkembangan teknologi transgenesis pada ikan, konstruksi gen dengan komponen promoter dan gen target yang digunakan berasal dari hewan mamalia dan hewan tingkat rendah. Penggunaan konstruksi gen tersebut tidak memberikan pengaruh nyata pada pertumbuhan ikan, dimana penggunaan promoter yang bukan berasal dari ikan menghasilkan ekspresi transgen yang rendah atau bahkan tidak terekspresi. Alam et al. (1996), Hanley et al. (1998), dan Alimuddin et al. (2003) telah membuktikan bahwa promoter yang diisolasi dari ikan memiliki aktivitas yang lebih tinggi dalam pengaturan ekspresi transgen dibandingkan dengan promoter yang diisolasi dari mamalia atau virus. Peningkatan pertumbuhan yang signifikan diperoleh setelah promoter dan gen GH yang digunakan berasal dari ikan (all-fish gen construct), misalnya pada ikan salmon transgenik menggunakan promoter methallothionein dan gen GH dari ikan salmon (Yaskowiak et al. 2006) dan ikan transgenik mud loach menggunakan promoter β-aktin dan GH dari ikan mud loach (Nam et al. 2001). Ikan nila hitam transgenik yang menggunakan promoter β-aktin dari ikan medaka Jepang, Oryzias latipes dengan GH ikan nila hitam juga memiliki kecepatan tumbuh yang tinggi yakni 7 kali lebih besar dibandingkan dengan ikan bukan transgenik pada umur 1 tahun (Kobayashi et al. 2007). Pada umumnya, promoter memiliki elemen penting misalnya kotak CCAAT yang berfungsi dalam peningkatan ekspresi dengan stimulasi tertentu, unit CC(A/T)6GG yang lebih dikenal dengan istilah motif CarG yang berperan dalam pengaturan ekspresi sementara, dan kotak TATA yang berperan dalam mengarahkan proses transkripsi berlangsung pada posisi yang benar (Takagi et al. 1994).
Penerapan transgenenis pada krustase khususnya pada udang masih sangat sedikit, sehingga informasi penggunaan promoter juga sangat terbatas.
Transgenesis pada udang telah dilaporkan pada udang vaname L. vannamei dengan mengintroduksikan gen pengkode TSV-CP (taura syndrome virus-coat protein) dengan menggunakan promoter β-aktin udang (pβactP2) (Sun et al. 2005; Lu & Sun 2005), dan pada udang windu P. monodon dengan menggunakan promoter CMV (cytomegalovirus) (Arenal et al. 2008). Luo et al. (2007) telah mengisolasi tujuh promoter dari udang windu, tetapi hanya dua diantaranya memperlihatkan aktivitasnya secara in vitro menggunakan gen reporter GFP (green fluorescent protein). Selain itu, Ho & Song (2009) telah berhasil mengisolasi promoter gen antimikroba penaeidin dari udang windu dan secara in vitro dengan menggunakan gen berpendar Renilla luciferase, telah dilaporkan bahwa promoter tersebut memperlihatkan aktivitas yang tinggi pada embrio udang windu. Oleh karena itu, pada penelitian ini dilakukan isolasi dan karakterisasi promoter antivirus ProAV dari udang windu dalam rangka pembuatan konstruksi gen all shrimp yang akan digunakan dalam produksi udang windu tahan penyakit. Penelitian itu bertujuan untuk mengetahui tingkat similaritas sekuen nukleotida promoter antivirus dengan promoter lainnya yang ada dalam Bank Gen sebagai uji konfirmasi kebenaran promoter yang telah diisolasi. Selain itu, penelitian ini ditujukan untuk mengetahui keberadaan motif-motif faktor transkripsi dan sekuen spesifik promoter yang dilibatkan dalam mengatur gen target.
BAHAN DAN METODE
Sampel Udang Windu Penaeus monodon
Udang windu P. monodon berukuran 10,1-74,4 g dikoleksi dari beberapa tambak udang di Sulawesi Selatan, termasuk dari tambak yang telah terserang penyakit virus bintik putih (white spot syndrome virus, WSSV). Sampel udang dikoleksi secara hidup dan selanjutnya dibawa ke Laboratorium Bioteknologi, Balai Riset Perikanan Budidaya Air Payau (BRPBAP) Maros untuk pengambilan otot (daging) udang secara aseptik sebagai bahan untuk ekstraksi DNA genom.
Ekstraksi DNA Genom
DNA genom udang windu diekstraksi dengan menggunakan metode fenol-kloroform yang telah dikembangkan pada ikan kerapu (Parenrengi et al. 2000) dengan sedikit modifikasi. Sebanyak 20-25 mg daging udang diambil secara aseptik dan dimasukkan ke dalam tabung steril 1,5 mL. Sampel ditambahkan dengan 250 µL buffer lisis (0,5 M NaCl; 0,001 M EDTA; 1% SDS; 0,8% Triton-X; dan 0,1 Tris-HCl pada pH 9,0) kemudian 40 µL 10% SDS dan 40 µL Proteinase K (larutan 20 mg/mL). Sampel diinkubasi pada suhu 55oC selama 1-3 jam sampai lisis sempurna. Kemudian sampel ditambahkan 25 µL RNase (larutan 20 mg/mL) dan dibiarkan pada suhu ruangan selama 15-30 menit. Sampel ditambahkan 500 µL fenol:kloroform:isoamil-alkohol (25:24:1) dan selanjutnya dihomogenkan dengan vorteks. Sampel dibiarkan pada suhu ruangan selama 10 menit sebelum disentrifugasi pada kecepatan 13.000 rpm selama 4 menit. Supernatan yang terbentuk dipindahkan ke tabung mikro baru, kemudian ditambahkan lagi 500 µL fenol:kloroform:isoamil-alkohol (25:24:1) dan disentrifugasi kembali pada kecepatan 13.000 rpm selama 4 menit. Supernatan ditambahkan dengan satu kali volume kloroform:isoamil-alkohol (24:1) dan selanjutnya disentrifugasi dengan kecepatan 13.000 rpm selama 2 menit. Supernatan dipresipitasi dengan etanol absolut dingin dengan membolak-balikkan tabung mikro kemudian disentrifugasi pada kecepatan 6.000 rpm selama 30 menit. Pelet yang terbetuk dicuci dengan 1 mL etanol 70% dan kemudian disentrifugasi pada kecepatan 6.000 rpm selama 15 menit. Pelet DNA dikering-udarakan sekitar 20 menit, kemudian ditambahkan dengan 50 µL sterile distilled water (SDW) agar pelet DNA dapat larut sempurna dan selanjutnya disimpan dalam freezer (suhu -20oC) sampai digunakan untuk peroses selanjutnya.
Kualitas dan kuantitas DNA genom hasil isolasi dapat diketahui melalui analisis kemurnian dan kandungan DNA dengan menggunakan UV-spektrofotometer. Kemurnian genom hasil ekstraksi selain dianalisis secara kualitatif dengan metode elektroforesis juga diukur secara kuantitatif melalui metode UV-spektrofotometer pada rasio absorpsi 260 nm dan 280 nm (OD260/OD280). Sedangkan konsentrasi genom DNA dihitung berdasarkan rumus Linacero et al. (1998). Kualitas DNA genom hasil ekstraksi dilihat melalui
analisis eletroforesis pada gel agarosa 0.7%. Skema ekstrkasi DNA genom udang windu menggunakan metode fenol-kloroform disajikan pada Lampiran 1.
Isolasi Promoter
Isolasi promoter antivirus ProAV dilakukan dengan menggunakan teknik PCR. DNA genom yang telah diisolasi dari udang windu digunakan sebagai cetakan DNA (templat) pada proses PCR. Metode isolasi promotor mengacu pada metode yang telah dikembangkan oleh Luo et al. (2007), dengan menggunakan primer forward ProAV-F: 5’- gtc gga tcc agt ccc aca ctc cat caa -3’ dan primer reverse ProAV-R: 5’- ctg gga tcc ctg aaa gga ata tta ata tct tg -3’. Kedua primer tersebut dilengkapi dengan situs restriksi BamHI (nukleotida yang digarisbawahi) untuk membantu proses kloning ke dalam vektor ekspresi. Amplifikasi fragmen promoter dilakukan pada mesin PCR GeneAmp PCR System 2700 (Applied Biosystem). Reaksi PCR yang digunakan adalah kit PureTaq Ready-To-Go PCR Beads (GE Healtcare) dan primer masing-masing 1 uL (50 ρmol/µL) serta SDW untuk mencapai volume akhir 25 µL. Kit tersebut mengandung 2,5 unit Taq Polimerase; 10 mM Tris-HCl pH 9; 50 mM KCl; 1,5 mM MgCl2; dan 200 μM setiap dNTP-mix.
Proses PCR dijalankan pada suhu pre-denaturasi 94oC selama 3 menit; 35 siklus untuk (denaturasi 94oC selama 1 menit, annealing 56oC selama 45 detik, ekstensi 72oC selama 1 menit); dan final ekstensi 72oC selama 5 menit. Untuk mengetahui keberhasilan isolasi promoter, hasil PCR dielektroforesis pada gel agarose 1,0% untuk melihat pita tunggal yang terbentuk pada gel. Fragmen DNA pada gel agarosa didokumentasi dengan Gel Documentation System (Biometra). Untuk menentukan berat molekul fragmen DNA digunakan marker VC 100bp Plus DNA Ladder (Vivantis).
Kloning Promoter
Purifikasi Promoter. Purifikasi fragmen DNA promoter dilakukan dengan menggunakan kit GF-1 Gel DNA Recovery (Vivantis) sesuai dengan manual kit yang digunakan. Fragmen DNA yang telah dipotong dari gel dicampur
dengan buffer GB dengan rasio 1:1, kemudian diinkubasi pada suhu 50oC sampai gel larut sempurna. Larutan ditransfer ke kolom spin dalam tabung mikro, kemudian disentrifugasi pada kecepatan 10.000 rpm selama 1 menit. Kolom selanjutnya dicuci dengan 750 µL wash buffer, kemudian disentrifugasi dengan kecepatan 10.000 rpm selama 1 menit atau sampai kering. Kolom dipindahkan ke tabung mikro baru, kemudian ditambahkan 30-50 µL elution buffer dan diinkubasi selama 2 menit di suhu ruang, kemudian disentrifugasi pada kecepatan 10.000 rpm selama 1 menit. Skema purifikasi fragmen DNA dari gel agarosa menggunakan kit GF-1 Gel DNA Recovery dapat dilihat pada Lampiran 2.
Ligasi Promoter ke Vektor pGEM-T Easy. Fragmen DNA hasil purifikasi dari promoter yang telah berhasil diisolasi, disisipkan ke dalam vektor kloning T Easy (Promega) mengikuti prosedur manufaktur. Vektor pGEM-T Easy dan control insert DNA disentrifugasi agar kandungannya terkumpul pada dasar tabung, selanjutnya reaksi ligasi dicampur pada tabung mikro dengan komposisi: 1,3 µL 2 x rapid ligase buffer; 0,5 µL vektor pGEM-T Easy (50 ng); 1 µL T4 DNA ligase (3 unit/µL); produk PCR sebanyak 5 µL; dan SDW 5,2 µL. Inkubasi dilakukan selama dua jam pada suhu ruang dan dilanjutkan dengan diinkubasi semalam di dalam refrigerator (suhu berkisar 4 oC).
Pembuatan Bakteri Kompeten Escherichia coli DH5α. Sebuah koloni bakteri E.coli DH5α diambil dari biakan murni dan dikultur dalam 25 mL media cair Luria Bertani (LB) (1% tripton; 0,5% ekstrak khamir; dan 1% NaCl) dalam tabung 50 mL sebagai sub kultur dan selanjutnya diinkubasi pada inkubator bergoyang pada suhu 37oC selama 16-18 jam dengan kecepatan 250 rpm. Hasil sub kultur sebanyak 2,5 mL (1%) dimasukkan ke dalam erlenmeyer 25 mL yang mengandung media cair LB dan selanjutnya diinkubasi pada inkubator bergoyang pada suhu 37oC selama 3 jam. Kultur bakteri langsung diletakkan di atas es selama 30 menit. Sebanyak 1,5 mL dimasukkan ke dalam tabung mikro 1,5 mL kemudian disentrifugasi dengan kecepatan 5.000 rpm selama 2 menit pada suhu 4oC. Setelah supernatan dibuang, pelet ditambahkan lagi 1,5 mL cairan kultur bakteri dan selanjutnya disentrifugasi dengan kecepatan 5.000 rpm selama 2 menit. Supernatan dibuang dan pelet dicuci dengan buffer NaCl2 dingin. Larutan disentrifugasi dengan kecepatan 5.000 rpm selama 2 menit pada suhu 4oC.
Supernatan dibuang dan pelet dicuci dengan 1 mL CaCL2 dingin, selanjutnya diinkubasi pada suhu ruangan selama 20 menit. Larutan disentrifugasi dengan kecepatan 5.000 rpm selama 2 menit pada suhu 4oC dan supernatan yang terbentuk dibuang, dan pelet disuspensi dengan 200 µL CaCl2 dingin yang kemudian diinkubasi di es selama 20 menit sampai 1 jam. Bakteri yang tersuspensi siap untuk digunakan untuk transformasi.
Transformasi. Transformasi vektor kloning ke bakteri dilakukan dengan menggunakan bakteri kompeten E. coli DH5α yang telah dibuat sebelumnya. Sebanyak 4-5 µL hasil reaksi ligasi dicampur ke dalam tabung mikro yang telah berisi 200 µL bakteri kompeten dan selanjutnya diinkubasi dalam es selama 20-30 menit. Campuran tersebut diberi kejutan panas pada suhu 42oC selama 45 detik, kemudian diletakkan dalam es selama 2 menit. Hasil kejutan panas ditambahkan 800 uL larutan SOC yang mengandung 970 µL buffer SOB (2 g tripton; 0,5 g ekstrak kamir; 1 mL NaCL 1 M; 0,25 mL KCl 1 M; dalam 97 mL SDW); 10 µL MgSO4.7H2O; 10 µL MgCl2.6H2O; dan 10 µL glukosa 1M, yang selanjutnya diinkubasi pada suhu 37oC pada inkubator bergoyang dengan kecepatan 200 rpm selama 1,5 jam. Sekitar 100-150 µL bakteri tersebut disebar pada media selektif 2xYT (1,6% tripton; 1% ekstrak khamir; 0,5% NaCl; dan 1,8% bakto agar dalam SDW) yang mengandung ampisilin 1 µL/1 mL agar (100 mg/mL); IPTG (isopropanoltio-β-D-galaktopiranosida) 0,1M (10 µL/cawan); dan 2% X-gal (50 µL/cawan). Biakan bakteri diinkubasi pada suhu 37oC selama sekitar 14 jam. Untuk menyeleksi adanya insersi gen dalam plasmid pada situs pengklonan (multiple cloning site, MCS), bakteri yang mengandung plasmid akan membentuk koloni berwarna putih, sedangkan bakteri yang mengandung plasmid tetapi di dalam MSC-nya tidak tersisipi fragmen DNA akan menghasilkan koloni warna biru (lihat Lampiran 3). Bakteri yang tidak mengandung plasmid akan mati (tidak membentuk koloni). Koloni bakteri warna putih yang tumbuh diperbanyak dalam medium LB yang mengandung antibiotik ampisilin (100 µg/mL) dan diinkubasikan pada suhu 37oC untuk dipersiapkan dalam perbanyakan plasmid.
Identifikasi Transforman
Cracking Bakteri. Seleksi koloni bakteri yang membawa plasmid hasil
ligasi dilakukan dengan metode cracking. Koloni bakteri warna putih diambil menggunakan tusuk gigi steril dan dioleskan ke dasar tabung mikro 1,5 mL dan dilanjutkan dengan menggoreskannya ke dalam master plate, yang merupakan sumber koloni bakteri untuk tahap penelitian berikutnya. Master plate berisi bakteri diinkubasi pada suhu 37oC selama 8 jam. Ke dalam tabung mikro yang berisi bakteri ditambahkan 10 μL buffer cracking (0,2 g sakarosa; 40 µL NaOH 5 M; 50 µL SDS 10%; dan sisanya SDW sehingga volume larutan menjadi 1 mL), 10 μL larutan EDTA 10 mM. Gabungan campuran larutan antara 2 µL 6 X buffer loading DNA dengan KCl 4 M dengan perbandingan volume 1:1 diletakkan di bagian dalam penutup tabung mikro. Setelah diinkubasi sekitar 5 menit, larutan di-spin down pada kecepatan 5.000 rpm selama 3 detik dan kemudian divorteks. Larutan disentrifugasi pada kecepatan 12.000 rpm selama 5 menit pada suhu 4oC. Sebanyak 10 µL supernatan yang terbentuk digunakan untuk elektroforesis menggunakan gel agaroasa 0,7%. Untuk mengetahui koloni bakteri yang membawa DNA dalam plasmid, bakteri biru digunakan sebagai kontrol. Ukuran DNA plasmid koloni bakteri yang membawa insersi akan lebih besar dibandingkan dengan kontrol.
Teknik PCR. Klon-klon bakteri yang memperlihatkan indikator positif pada uji cracking dilanjutkan dengan uji konfirmasi fragmen DNA yang terinsersi melalui teknik PCR, dengan menggunakan primer ProAV-F dan ProAV-R dimana templat DNA yang digunakan adalah larutan hasil cracking sebanyak 0,5 μL. Amplifikasi fragmen DNA target gen dilakukan seperti yang dijelaskan dalam isolasi promoter sebelumnya. Klon-klon bakteri rekombinan yang positif membawa promoter antivirus digoreskan ke dalam media agar yang mengandung ampisilin (100 µg/mL) untuk dikoleksi sebagai sumber plasmid untuk kegiatan selanjutnya. Skema pelaksanaan kloning promoter antivirus ProAV pada vektor pGEM-T Easy disajikan pada Lampiran 4.
Penderetan Nukleotida Promoter
Isolasi Plasmid. Plasmid pGEM-T Easy yang mengandung promoter antivirus ProAV diisolasi dari bakteri E. coli dengan menggunakan kit GF-1 Plasmid DNA Extraction Kit (Vivantis) dengan prosedur yang sesuai dengan manual kit yang digunakan. Satu koloni bakteri yang mengandung plasmid rekombinan ditumbuhkan di dalam 10 mL media LB (10 g/L tripton, 5 g/L ekstrak khamir, 10 g/L NaCl, pH 7,5) yang mengandung ampisilin 100 mg/L pada inkubator bergoyang dengan kecepatan 250 rpm pada suhu 37oC selama semalam (sekitar 16-18 jam). Bakteri diendapkan dalam tabung mikro secara bertahap dengan sentrifugasi pada kecepatan 10.000 rpm pada suhu 4oC selama 10 menit. Supernatan dibuang dan pelet dilarutkan dengan 250 μL larutan S-1, kemudian divorteks pelan atau pipeting sampai pelet larut sempurna. Suspensi larutan ditambah dengan 250 μL larutan S-2 kemudian dicampur dengan pelan dengan cara tabung mikro dibolak-balik selama 4-6 kali dan diinkubasi di suhu ruangan tidak lebih dari 5 menit. Larutan dinetralkan dengan penambahan 250 μL buffer NB (neutralizing buffer) dan dicampur dengan pelan dengan cara tabung mikro dibolak-balik selama 6-10 kali kemudian disentrifugasi dengan kecepatan 14.000 rpm selama 10 menit. Supernatan dipindah ke kolom spin dan disentrifugasi dengan kecepatan 10.000 rpm selama 1 menit. Kolom spin dicuci dengan 700 μL wash buffer kemudian disentrifugasi dengan kecepatan 10.000 rpm selama 1 menit. Plasmid DNA diresuspensi dengan 100 μL SDW dan dibiarkan selama 1 menit, kemudian disentrifugasi dengan kecepatan 10.000 rpm selama 1 menit untuk melarutkan DNA, dan selanjutnya disimpan dalam freezer -20oC untuk digunakan pada tahap selanjutnya. Kuantitas dan kualitas isolat plasmid diukur dengan menggunakan UV-VIS spektrofotometer pada panjang gelombang 260 nm dan 280 nm seperti yang dijelaskan pada tahapan ekstraksi DNA genom sebelumnya. Skema isolasi DNA plasmid dengan menggunakan kit GF-1 Plasmid DNA Extraction disajikan pada Lampiran 5.
Penderetan Sekuen Nukleotida. Hasil PCR promoter gen antivirus ProAV dari plasmid dipurifikasi dengan menggunakan kit Gel/PCR DNA Fragment Extraction (Geneaid). Secara singkat, potongan gel agarosa ditambah dengan 500 µL buffer DF kemudian divorteks, dan selanjutnya diinkubasi pada
suhu 55oC selama 10-16 menit sampai agarosa larut sempurna. Sebanyak 700 µL larutan sampel dipindahkan ke kolom DF, kemudian disentrifugasi pada kecepatan 13.000 rpm selama 1 menit. Kolom DF ditambahkan dengan 600 µL wash buffer, kemudian disentrifugasi dengan kecepatan 13.000 rpm selama 1 menit. Setelah larutan dibuang, kolom DF ditempatkan ke dalam tabung mikro baru, dan disentrifugasi dengan kecepatan 13.000 rpm selama 3 menit. DNA dilarutkan dengan menambahkan 50 µL SDW kemudian disentrifugasi dengan kecepatan 13.000 rpm selama 3 menit. Amplifikasi PCR untuk sekuensing dilakukan dengan menggunakan campuran larutan (3 µL 5 X buffer sekuensing, 2 µL primer (1,6 ρmol/µL), 1 µL Big Dye, 4 µL templat DNA) dengan program PCR adalah suhu 96oC selama 2 menit, 96oC selama 10 menit, 55oC selama 5 menit, dan 60oC selama 4 menit. Hasil PCR dipurifikasi dengan menambahkan 10 µL air bebas DNA dan RNA, dan 5 µL EDTA 125 mM, 5 µL natrium asetat 3 M, 60 µL etanol absolut. Sampel diinversi sebanyak 4 kali dan diinkubasi pada suhu ruang selama 15 menit, kemudian disentrifugasi dengan kecepatan 3.000 rpm selama 30 menit. Supernatan dibuang dan pelet ditambah dengan 70 µL etanol 70%, kemudian disentrifugasi dengan kecepatan 3.000 rpm selama 30 menit. Setelah supernatan dibuang, pelet dikering-anginkan dan kemudian dilarutkan dengan 10 µL air bebas DNA dan RNA. Sampel selanjutnya siap untuk disekuensing dengan menggunakan alat sekuenser automatis AB-3130 (Applied Biosystem). Hasil sekuensing dilihat secara manual dengan menggunakan program sequence navigator.
Analisis Data
Untuk mengetahui kemiripan (similaritas) promoter yang dihasilkan, sekuen promoter disejajarkan (alignment) dengan sekuen promoter yang telah ada di dalam Bank Gen dengan menggunakan program BLAST-N (basic local alignmen search tool-nucleotide). Sekuen promoter hasil penderetan dianalisis dengan menggunakan program Genetyx Versi 7 (Genetyx Coorporation) untuk mendapatkan similaritas sekuen, motif faktor transkripsi (regulator), dan keberadan sekuen spesifik promoter antivirus. Data hasil analisis disajikan secara deskriptif.
HASIL DAN PEMBAHASAN
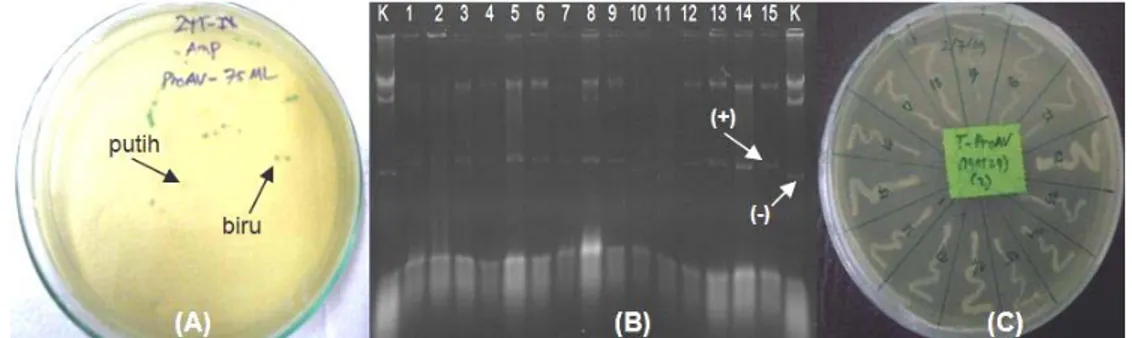
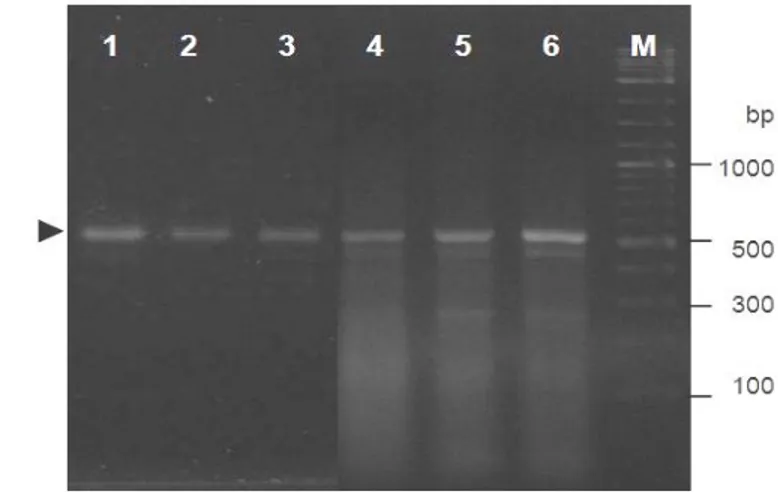
DNA genom yang berasal dari beberapa sampel udang windu telah berhasil diisolasi yang ditandai dengan keberadaan pita tunggal pada gel eletroforesis (Gambar 1A). Dengan menggunakan DNA genom tersebut sebagai templat dan primer spesifik promoter gen antivirus ProAV, promoter udang windu telah berhasil diisolasi pada posisi fragmen sekitar 0,4 kb (368 bp) (Gambar 1B).
Gambar 1 Hasil elektroforesis DNA genom (A) dan fragmen tunggal promoter ProAV (B) yang diisolasi dari udang windu P. monodon. M=marker DNA, 1-5= sampel udang windu, dan tanda panah mengindikasikan fragmen DNA genom dan promoter ProAV.
Promoter antivirus ProAV yang berhasil diisolasi dari DNA genom udang windu, selanjutnya dikloning ke dalam vektor pGEM-T Easy. Keberhasilan dalam mengkloning gen dapat diketahui dengan cara mengidentifikasi masuknya gen atau DNA pada bakteri inang (transforman). Hasil seleksi koloni bakteri warna putih-biru menunjukkan adanya insersi gen yang diindikasikan dengan adanya koloni bakteri warna putih yang ditumbuhkan pada media agar dan adanya penambahan berat molekul plasmid DNA bakteri inang yang digunakan pada teknik cracking (Gambar 2). Proses masuknya vektor rekombinan pembawa gen ke dalam sel kompeten (bakteri) diketahui dengan mengamati ekspresi gen penanda yang dibawa oleh vektor tersebut. Kobolak & Muller (2003) memberikan gambaran penggunaan vektor pGEM-T Easy pada bakteri E. coli yang memiliki marker gen LacZ dan marker gen resisten ampisilin, dimana LacZ sebagai gen bp 1000 500 300
pelapor (reporter gene). Selanjutnya Toha (2001) menyatakan bahwa apabila dalam media terdapat IPTG, gen LacZ yang mengkode enzim β-galaktosidase dapat diketahui karena mampu menguraikan 5-bromo-4-kloro-3-indolil-β-D-galaktopiranosida (X-gal) menjadi galaktosa dan 5-bromo-4-kloroindigo, sehingga menghasilkan koloni bakteri berwarna biru. Oleh karena itu, apabila terjadi insersi gen atau fragmen DNA pada MCS, maka gen LacZ tidak dapat berfungsi sebagai mana mestinya sehingga tidak terjadi penguraian X-gal menjadi galaktosa yang menyebabkan koloni bakteri tetap berwarna putih.
Gambar 2 Seleksi koloni putih-biru, cracking, dan plating klon bakteri pembawa promoter antivirus ProAV. A=seleksi koloni klon bakteri yang ditumbuhkan pada media agar dimana tanda panah menunjukkan koloni putih dan biru, dan B=hasil cracking klon bakteri pembawa promoter pada gel agarosa dimana tanda panah menunjukkan indikator positif sebagai pembawa promoter dan negatif sebagai kontrol bakteri koloni biru, dan C=hasil plating klon bakteri pembawa promoter ProAV pada media agar.
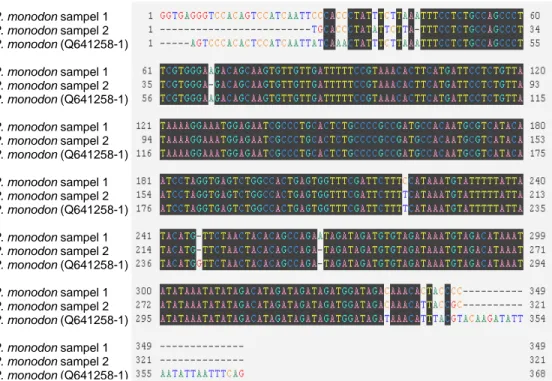
Untuk memastikan apakah fragmen DNA tersebut merupakan target promoter ProAV yang diinginkan, maka fragmen DNA dipurifikasi dari gel agarosa kemudian dilakukan pembacaan nukleotidanya atau dikenal dengan istilah sekuensing. Dari beberapa sampel yang berhasil diisolasi, dua di antaranya diambil secara acak untuk dilakukan analisis lebih lanjut melalui sekuensing nukleotida promoter. Berdasarkan hasil pembacaan sekuen nukleotida yang diperkirakan memiliki panjang fragmen DNA sekitar 0,4 kb (368 bp). Dari hasil pembacaan tersebut dilakukan penyejajaran (alignment) sekuen (Gambar 3) dengan referensi sekuen yang telah ada dalam Bank Gen, untuk memastikan kebenaran promoter yang telah diisolasi.
Gambar 3 Alignment sekuen promoter ProAV yang diisolasi dari udang windu P. monodon dengan sekuen promoter PmAV referensi dari Bank Gen (kode aksesi DQ641258-1). Nomor pada awal dan akhir nukleotida menunjukkan urutan nukleotida, A=adenina, C=sitosina, G=guanina, dan T=timina.
Hasil penyejajaran sekuen promoter yang telah diisolasi tersebut menunjukkan tingkat kemiripan yang tinggi dengan sekuen promoter yang telah ditemukan oleh Luo et al. (2007) pada udang windu di Cina. Dari dua sample sekuen promoter yang dianalisis, didapatkan tingkat similaritas 95-98% (Tabel 1). Tingginya tingkat similaritas tersebut memberikan keyakinan akan keberhasilan dalam mengisolasi promoter antivirus ProAV dari udang windu dari tambak Sulawesi Selatan, Indonesia.
Hasil analisis BLAST-N terhadap nukleotida promoter ProAV udang windu menunjukkan adanya variasi nuklotida dengan sekuen gen promoter udang windu P. monodon referensi Bank Gen yang umumnya didapatkan pada bagian awal dan akhir sekuen nukleotida. Analisis faktor transkripsi menunjukkan keberadaan sekuen spesifik promoter, misalnya TATAAA atau dikenal sebagai kotak TATA (TATA-box) dan TGCACCC atau dikenal sebagai MRE, atau dikenal sebagai TFIID, serta sekuen [A/C]A[A/C]AG atau dikenal dengan TCF-1
P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1) P. monodon sampel 1 P. monodon sampel 2 P. monodon (Q641258-1)