STUDI SITOTOKSISITAS EKSTRAK DAUN RENGAS
(Gluta renghas L) SEBAGAI ANTIBAKTERI
MAKALAH SEMINAR HASIL
OLEH:
ENDA DESRIANSYAH AZIZ
BP: 1310411023
JURUSAN S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS ANDALAS
HALAMAN PENGESAHAN
“Studi Sitotoksisitas Ekstrak Daun Rengas (Gluta renghas L) sebagai Antibakteri” merupakan makalah seminar hasil oleh Enda Desriansyah Aziz (1310411023) diajukan sebagai syarat untuk memenuhi Tugas Akhir II (TA II) Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Andalas, Padang.
Disetujui Oleh : Pembimbing I
Prof. Dr. Sanusi Ibrahim NIP. 194910021977101001
Pembimbing II
Dr. Suryati
INTISARI
STUDI SITOTOKSISITAS EKSTRAK DAUN RENGAS (Gluta renghas L) SEBAGAI ANTIBAKTERI
Oleh:
Enda Desriansyah Aziz (BP 1310411023) Prof. Dr. Sanusi Ibrahim*, Dr. Suryati*
*Pembimbing
Secara umum, Gluta renghas L dikenal karena getahnya sangat beracun yang dapat menyebabkan iritasi berat pada kulit. Meski bersifat iritan, getah rengas punya khasiat untuk membasmi jamur. Berdasarkan penelitian sebelumnya, dilaporkan terkandung senyawa ursiol, rengol, glutarengol, laccol dan thitsiol pada getah rengas. Pada bagian kulit batang dilaporkan mengandung senyawa golongan steroid, lipid, benzenoid dan flavonoid. Sedangkan pada bagian daun, dilaporkan mengandung zat anticholinesterase dan dapat menurunkan laju hidrolisis dari asetilkolin. Ekstraksi daun rengas telah dilakukan. Daun rengas mengandung senyawa fenol, steroid dan kumarin pada ekstrak metanol, flavonoid, fenol dan saponin pada ekstrak etil asetat serta steroid pada ekstrak heksan. Pada penelitian kali ini dilakukan uji aktivitas sitotoksisitas dan antibakteri dari ekstrak daun rengas. Hasilnya menunjukkan bahwa aktivitas sitotoksisitas yang terbaik oleh ekstrak etil asetat yang memiliki nilai LC50 yaitu
123.718 mg/L (R2 0.9882). Sedangkan aktivitas antibakteri yang terbaik
ditunjukkan oleh ekstrak metanol 1000 mg/L dengan diameter zona inhibisi sebesar 19,02 mm (Staphylococcus aureus) dan 16,06 mm (Escherichia coli).
ABSTRACT
CITOTOXICITY STUDY OF LEAF EXTRACTS OF RENGAS (Gluta renghas L) AS ANTIBACTERIAL
By:
Enda Desriansyah Aziz (BP 1310411023) Prof. Dr. Sanusi Ibrahim*, Dr. Suryati*
*Supervisor
In general, Gluta renghas L is known as highly toxic sap that can cause severe irritation to the skin. Although it is an irritant, the sap of rengas has efficacy to eradicate the fungus. Based on previous research, reportedly contained the ursiol, rengol, glutarengol, laccol and thitsiol compounds on rengas sap. On woody trunk was reported to contain flavonoid, benzenoid, lipid, and steroid compounds. While on the leaves, were reported shows that the leaves of Gluta renghas contain an anticholinesterase substance and can be reduced the rate of hydrolysis of acetylcholine. Extract of the leaves of rengas has been carried out. It has been shown phenols, steroids, and coumarins compounds in methanol extract, flavonoids, phenols and saponins compounds in ethyl acetate extract and steroids compounds in hexane. In the present, cytotoxicity and antibacterial activity have been tested. The results show that the best cytotoxicity activity by ethyl acetate extracts which have an LC50 value is 123,718 mg/L (R2 0.9882). While the activity of antibacterial which is best to be shown by methanol extract 1000 mg/L with inhibition zones equal to 19,02 mm (Staphylococcus aureus) and 16,06 mm (Escherichia coli).
DAFTAR ISI
2.1 Tinjauan Botani Gluta renghas L...3
2.2 Tinjauan Kandungan Kimia Gluta renghas L...4
2.3 Uji Sitotoksisitas...6
2.4 Metode Perhitungan Nilai LC50...7
2.5 Uji Aktivitas Antibakteri...8
3.4 Persiapan dan Identifikasi Sampel Daun Rengas...13
3.5 Uji Kandungan Metabolit Sekunder Sampel Daun Rengas...13
3.6 Ekstraksi Sampel Daun Rengas...15
3.7 Uji Sitotoksisitas dengan Metode Brine Shrimp Lethality Test...15
3.7.1 Pembiakkan Larva Artemia salina...15
3.7.2 Pembuatan Larutan Uji...16
3.7.3 Pengujian Sitotoksisitas Larutan Uji...16
3.8 Uji Aktivitas Antibakteri dengan Metoda Difusi Cakram...16
3.8.1 Pembuatan Media Mueller-Hinton Agar...16
3.8.2 Pembuatan Media Nutrient Agar...16
3.8.3 Peremajaan Bakteri Uji...17
3.8.4 Pengujian Aktivitas Antibakteri...17
BAB IV HASIL DAN PEMBAHASAN...18
4.1 Persiapan dan Identifikasi Sampel Daun Rengas...18
4.3 Ekstraksi Sampel Daun Rengas...19
4.4 Uji Sitotoksisitas dengan Metode Brine Shrimp Lethality Test...20
4.5 Uji Aktivitas Antibakteri dengan Metoda Difusi Cakram...22
BAB V KESIMPULAN DAN SARAN...24
5.1 Kesimpulan...24
5.2 Saran...24
DAFTAR TABEL
Tabel 2.1 Nilai LC50 untuk senyawa sitotoksik 8
Tabel 4.1 Hasil uji fitokimia daun rengas 18
Tabel 4.2 Hasil pengamatan uji sitotoksisitas ekstrak daun rengas 20
DAFTAR GAMBAR
Gambar 2.1 Tanaman Gluta renghas L 3
Gambar 4.1 Persentase kadar ekstrak yang dihasilkan 19
DAFTAR LAMPIRAN
Lampiran 1 Hasil Identifikasi Sampel 28
Lampiran 2 Uji Kandungan Metabolit Sekunder (Fitokimia) 29
Lampiran 3 Ekstraksi Daun Rengas dengan Metoda Maserasi 32 Lampiran 4 Uji Sitotoksisitas dengan Metoda Brine Shrimp Lethality Test 33
Lampiran 5 Uji Aktivitas Antibakteri dengan Metode Difusi Cakram 34
Lampiran 6 Hasil Uji Profil Fitokimia Daun Rengas 36
Lampiran 7 Persentase kadar ekstrak yang dihasilkan 38
Lampiran 8 Tabel Nilai Probit Sesuai Persentase Kematian 39
Lampiran 9 Pembuatan Larutan Uji Sitotoksisitas Berbagai Konsentrasi 40 Lampiran 10 Penentuan nilai LC50
41
Lampiran 11 Pembuatan Larutan Uji Antibakteri Berbagai Konsentrasi 44
Lampiran 12 Gambar Zona Inhibisi dari Ekstrak Daun Rengas
BAB I. PENDAHULUAN
1.1 Latar BelakangIndonesia merupakan salah satu negara tropis yang tumbuh-tumbuhannya termasuk dalam pabrik bahan kimia raksasa. Hal ini disebabkan oleh 17 % dari seluruh spesies yang ada di permukaan bumi terdapat di Indonesia. Sehingga Indonesia memiliki biodiversity yang luar biasa. Sebagian dari tumbuhan itu telah digunakan sebagai bahan obat tradisional. Penggunaan tumbuh-tumbuhan ini sebagai obat tradisional adalah merupakan warisan yang diterima secara turun temurun1.
Jumlah tumbuhan berkhasiat obat di Indonesia diperkirakan sekitar 1.260 jenis tumbuhan. Tumbuhan menghasilkan metabolit sekunder yang berpotensi sebagai antioksidan, zat perwarna, penambah aroma makanan, parfum, insektisida dan obat. Ada 150.000 metabolit sekunder yang sudah diidentifikasi dan ada 4000 metabolit sekunder baru tiap tahunnya2. Pemanfaatan tumbuhan
oleh masyarakat kebanyakan masih merupakan hasil pengalaman saja dan belum merupakan hasil kajian secara ilmiah. Untuk itu penelitian secara ilmiah perlu dilakukan, dimana perlu dikaji apa kandungan kimianya dan bagaimana bioaktivitasnya serta pemanfaatannya secara farmakologi3.
Rengas (Gluta renghas L) merupakan salah satu jenis tumbuhan yang ada di Indonesia. Tumbuhan jingah/rengas termasuk dalam famili
Anacardiaceae yang memiliki peran penting dalam bidang furniture. Batang kayu rengas merupakan sumber kayu yang penting di Indonesia. Selain bermanfaat dalam bidang furniture, spesies ini juga dikenal karena getahnya sangat beracun yang dapat menyebabkan iritasi berat pada kulit4. Meski
bersifat iritan, namun getah rengas punya khasiat untuk membasmi jamur. Melihat keunikan dari tumbuhan tersebut, maka dirasa perlu untuk meneliti lebih lanjut akan kandungan dari tumbuhan rengas tersebut. Selain itu, studi untuk memberikan penjelasan secara ilmiah mengenai kandungan komponen aktif yang terdapat dalam tumbuhan dan penjelasan terhadap bioaktivitasnya juga perlu dikembangkan.
rengol, glutarengol, laccol dan thitsiol5. Penelitian pada kayu rengas dilaporkan
mengandung senyawa golongan steroid, lipid, benzenoid dan flavonoid6,
sedangkan penelitian pada bagian tumbuhan lainnya belum banyak dilaporkan. Salah satunya ialah daun. Meskipun telah dilaporkan pada penelitian sebelumnya, akan tetapi belum dilakukan studi yang mendalam akan kandungan senyawa kimia dan bioaktivitas dari daun rengas. Oleh karena itu, pada penelitian ini dilakukan studi sitotoksisitas terhadap ekstrak daun Gluta renghas L serta kemampuannya sebagai antibakteri.
1.2 Rumusan Masalah
Permasalahan yang akan dijawab melalui penelitian ini ialah sebagai berikut:
1. Apa saja kandungan senyawa metabolit sekunder yang terkandung dalam
ekstrak daun Gluta renghas L ?
2. Apakah ekstrak dari daun Gluta renghas L memiliki aktivitas antibakteri dan sitotoksisitas ?
1.3 Tujuan Penelitian
Tujuan dari penelitian ini ialah sebagai berikut :
1. Menentukan senyawa metabolit sekunder yang terdapat pada ekstrak daun Gluta renghas L.
2. Menentukan aktivitas antibakteri dan sitotoksisitas dari ekstrak daun Gluta renghas L.
1.4 Manfaat Penelitian
BAB II. TINJAUAN PUSTAKA
2.1 Tinjauan Botani Gluta renghas LAnacardiaceae merupakan salah satu family dari tumbuhan yang dikenal dengan kulit batangnya yang mengandung damar. Famili Anacardiaceae terdiri dari 70 genus dan 600 spesies pohon yang umunya terdiri dari pohon tinggi dan semak belukar4. Rengas (Gluta renghas L) ialah salah satu spesies dari famili
Anacardiaceae. Tumbuhan yang memiliki nama lain jingah banyak ditemukan didataran rendah (0-300 m dpl) seperti di lahan rawa baik pasang surut maupun
rawa lebak walaupun umumnya rengas tumbuh dipinggiran sungai5. Namun di
Palembang dijumpai dalam hutan dengan ketinggian 800 m dpl6.
Tumbuhan rengas tersebar luas di Indonesia seperti pada Pulau Sumatra,
Jawa, Sulawesi, Kalimantan dan Pulau Seram6. Tanaman dengan ketinggian
sedang ini memiliki batang yang berwarna kemerahan (darah), bergaris-garis, dan dapat bertahan lama bila dibiarkan (tidak lapuk)7.Tanaman ini menjadi
salah satu sumber kayu yang penting di Indonesia5 karena banyak
dimanfaatkan dalam pembuatan komponen bangunan seperti segitiga atap, tangga rumah, lantai, dinding, pintu, jendela serta bingkai pintu maupun jendela. Selain di Indonesia, tumbuhan ini juga tersebar luas di berbagai negara lain seperti semenanjung Malaysia, Madagaskar, India, Andaman, Indocina, Burma, Thailand dan Malaysia6,8. Gambar tumbuhan Gluta renghas L. dapat
dilihat pada Gambar 2.1
a. Tanaman Gluta renghas L b. Daun Gluta renghas L
Gambar 2.1 Tanaman Gluta renghas L (a) daun Gluta renghas L (b)
Kingdom : Plantae
Tumbuhan rengas termasuk kedalam famili Anacardiaceae yang sering sering menimbulkan gatal-gatal jika terkena getahnya baik itu dari daun, ranting, maupun dahan. Rengas hanyalah salah satu dari banyak tanaman beracun/menyebabkan alergi pada kulit jika tersentuh langsung. Spesies ini dikenal karena getahnya sangat beracun yang dapat menyebabkan iritasi berat pada kulit dan dapat melumpuhkan orang. Kadang-kadang penduduk asli menggunakan getahnya sebagai racun untuk berburu binatang5.
2.2 Tinjauan Kandungan Kimia Gluta renghas L.
Tumbuhan rengas tergolongkan kedalam lima Genus dimana keseluruhannya
merupakan famili dari Anacadiaceae9. Jenis yang paling umum ditemukan ialah
Gluta renghas L dimana bersifat mengakibatkan iritasi bila terkena kulit secara langsung. Diketahui kandungan getah pada bagian biji ialah alkil monoetenoid katekol, glutarenghol10. Di samping itu, buah dari tumbuhan ini diklaim menjadi
penyebab iritasi yang hebat pada pencernaan jika dimakan oleh manusia11.
Ekstrak akuades dari kulit batang rengas dilaporkan mengandung dosis yang mematikan jika tertelan dan getah dari daun dan batang telah digunakan sebagai racun di negara Indonesia dan Malaysia. Namun, belum diketahui apa saja efek yang ada pada glutarenghol. Hasil penyelidikan menunjukkkan ekstrak akuades dari daun rengas memiliki nilai aktivitas farmakologis12.
Selain itu, spesies ini dikenal karena getahnya sangat beracun yang dapat menyebabkan iritasi berat dan alergi pada kulit serta dapat melumpuhkan orang13. Meski bersifat iritan, getah rengas punya khasiat untuk membasmi
jamur. Berdasarkan studi pustaka, pada getah rengas dilaporkan terkandung senyawa ursiol, rengol, glutarengol, laccol dan thitsiol10. Penelitian pada kayu
flavonoid14. Penelitian serupa juga telah dilakukan oleh Copriady (2002)
dimana diperoleh senyawa flavonoid, benzenoid, lipid dan steroid pada bagian batang kayunya15. Lily (2016) memberikan informasi bahwa kayu rengas
sebagai sumber antioksidan alami dan agen antihyperglycemic. Tingginya aktivitas mungkin kuat kaitannya dengan adanya senyawa fenolik yang diketahui dari UPLC (Ultra Performance Liquid Chromatography). Ekstrak kayu kemudian diketahui sebagai antioksidan yang sangat kuat16.
Salah satu studi tentang daun rengas telah dilakukan oleh Lin dan Whittow (1960) dimana dilakukan percobaan mengenai pengaruh getah regas terhadap kulit. Batang muda rengas digosokkan pada lengan bawah untuk 10 detik. Efek dari getah terhadap kulit memberikan dampak yang serius, iritasi yang diberikan oleh getah rengas tersebut mampu bertahan selama 3 minggu dan harus mendapatkan pertolongan klinik17. Selain itu, Lin dan Whittow (1960)
juga menambahkan bahwa ekstrak akuades daun rengas mengandung zat
anticholinesterase dan dapat menurunkan laju hidrolisis dari asetilkolin17.
Jauh sebelum dilakukan penelitian tentang senyawa aktif dalam tumbuhan rengas, masyarakat pedalaman telah menggunakan getahnya sebagai racun untuk berburu binatang5. Menurut Asikin dan Thamrin (2002)
bahwa tanaman jingah ini cukup efektif dalam mengendalikan hama penggerek batang padi yaitu mencapai 75%18. Melihat akan sifat keracunan dari getah
rengas tersebut, memungkinkan penggunaan getah regas sebagai insektisida alami. Hal ini diperkuat oleh Zuharah (2015) bahwa ekstrak batang rengas memberikan aktivitas terhadap nyamuk Aedes aegypti dan Aedes albopictus
dengan dosis rendah19. Ekstrak rengas juga telah terbukti lebih efektif
menghambatan aktivitas pertumbuhan larva nyamuk Aedes aegypti di musim kemarau. Efek ini hampir sama dengan perlakuan abate20. Dengan demikian,
dapat disimpulkan bahwa tumbuhan rengas dapat digunakan untuk insektisida alami yang aman pada kesehatan dan ramah lingkungan sehingga ini bisa menjadi salah satu kemampuan baru dalam bidang biopestisida21.
menjadi perhatian khusus saat ini. Hal ini mendorong para peniliti untuk mencari tumbuhan yang memiliki senyawa aktif terhadap aktifitas toksisitas sehingga dapat digunakan sebagai pestisida alternatif yang tidak berbahaya pada kesehatan dan ramah lingkungan. Untuk meminimalisir ancaman yang diperoleh dari penggunaan insektisida buatan, beberapa penelitian tentang uji toksik pada binatang seperti nyamuk secara luas telah dikembangkan sejak abad ke-20an22. Tumbuh-tumbuhan yang aktif sebagai fitokimia dapat
digunakan untuk menggantikan insektisida kimia23. Fitokimia suatu senyawa
dapat menjadi alternatif yang lebih baik untuk insektisida buatan dan dapat digunakan dalam vektor program kontrol dengan kemungkinan keberhasilan yang seimbang dengan insektisida buatan24.
2.3 Uji Sitotoksisitas
Uji sitotoksisitas merupakan uji invitro dengan menggunakan kultur sel yang digunakan untuk mendeteksi tingkat ketoksikan suatu senyawa. Sistem tersebut merupakan uji kualitatif dengan menetapkan kematian sel. Dasar dari percobaan tersebut antara lain bahwa sistem penetapan aktivitas biologis seharusnya memberikan kurva dosis respon yang menunjukkan hubungan lurus dengan jumlah sel25.
Uji sitotoksik digunakan untuk menentukan parameter nilai LC50 . Nilai LC50
menunjukkan nilai konsentrasi yang menghasilkan hambatan proliferasi sel 50 % dan menunjukkan potensi ketoksikan suatu senyawa terhadap sel. Nilai LC50
yang menunjukkan potensi ketoksikan suatu senyawa. Semakin besar harga LC50 maka senyawa tersebut semakin tidak toksik. Senyawa sitotoksik adalah
senyawa yang bersifat toksik pada sel. Uji sitotoksik dapat memberikan informasi konsentrasi obat yang masih memungkinkan sel mampu bertahan hidup. Akhir dari uji sitotoksik adalah memberikan informasi langsung tentang perubahan yang terjadi pada fungsi sel secara spesifik26.
Brine Shrimp Lethality Test pertama kali dilakukan oleh Meyer dkk (1982)39
dan dapat digunakan sebagai petunjuk untuk senyawa sitotoksik, amtiparasit, dan insektisida27. Pada pengujian aktivitas dengan metode Brine Shrimp
dan tergolong ke dalam kelas Crustaceae dan sub kelas Branchiapoda. Kista
Artemia salina merupakan telur yang terbungkus oleh cangkang yang disebut dengan korion. Dalam keadaan kering, kista ini mempunyai ketahanan yang tinggi terhadap kondisi ekstrim sekalipun. Ketika kista-kista tersebut dimasukkan kedalam air laut, akan mengalami proses embriogenesis dan menetas dalam 16-36 jam. Embrio tersebut awalnya masih ditutupi oleh membran luar, namun dengan cepat akan menjadi larva udang yang aktif dan dikenal dengan nama nauphilus yang bebas berenang27,28.
Metode uji toksisitas ini sering digunakan untuk penapisan awal terhadap senyawa aktif yang terkandung didalam suatu ekstrak karena cepat, mudah, sederhana dan dapat dipercaya. Secara umum senyawa yang bersifat sitotoksis juga menunjukkan sifat toksiknya terhadap Artemia salina. Uji toksisitas akut dengan hewan uji Artemia salina Leach dapat digunakan sebagai uji pendahuluan pada penelitian yang mengarah ke uji sitotoksik, karena ada kaitan antara uji toksisitas akut dengan uji sitotoksik jika harga LC50
dari uji toksisitas akut < 1000 mg/L.
2.4 Metode Perhitungan Nilai LC50
Metode ini menggunakan kertas log probit yang didesain untuk perhitungan respon. Garis vertikal menyatakan nilai probit dan persentase respon. Nilai probit pada sisi kiri, garis horizontal menyatakan dosis atau konsentrasi terhadap nilai probit yang akan menghasilkan kurva berupa garis lurus.
Selanjutnya pengujian efek toksik dihitung dengan menentukan nilai LC50. Untuk mendapatkan nilai LC50, terlebih dahulu menghitung mortalitas dengan cara jumlah akumulasi mati dibagi jumlah akumulasi hidup dan mati (total) dikali 100%29. Salah satu metode analisis statistika yang digunakan untuk
persamaan garis regresi linear yang diperoleh adalah y = a + bx dengan a menunjukkan konstanta persamaan (intercept) dan b menunjukkan kemiringan (slope), maka nilai LC50 merupakan nilai anti-logaritma dari x saat nilai y yang dimasukkan ke persamaan garis sebesar 5030.
Berdasarkan dari beberapa literatur dijelaskan bahwa tingkat toksisitas untuk senyawa tertera pada tabel 2.130.
Tabel 2.1 Nilai LC50 untuk senyawa sitotoksik No. Nilai LC50 (mg/L) Sifat sitotoksik
1. > 1000 Tidak toksik
2. 30-1000 Toksik
3. < 30 Sangat toksik
2.5 Uji Aktivitas Antibakteri
Antibakteri adalah zat yang dapat menghambat pertumbuhan31. Dalam
penggolongannya antibakteri dikenal dengan antiseptik dan antibiotik. Berbeda dengan antibiotik yang tidak merugikan sel-sel jaringan manusia, daya kerja antiseptik tidak membedakan antara mikroorganisme dan jaringan tubuh. Namun pada dosis normal praktis tidak bersifat merangsang kulit 32.
Antibiotik adalah zat-zat kimia yang dihasilkan oleh bakteri dan fungi, yang memiliki khasiat mematikan atau menghambat pertumbuhan kuman. Obat yang digunakan untuk menghambat pertumbuhan bakteri penyebab infeksi pada manusia dan harus memiliki toksisitas selektif yang tinggi 31,32.
Daya kerja antibakteri dapat terjadi dengan cara menghambat pertumbuhan bakteri sehingga jumlah bakteri yang hidup tetap, tetapi pertumbuhan bakteri akan berlangsung kembali bila kontak dengan obat dihentikan (bakteriostik) atau dengan cara membunuh bakteri secara permanen, akibatnya bakteri tidak dapat berproduksi kembali meskipun kontak dengan obat dihentikan (bakteriosidal)33,34.
Salah satu sasaran senyawa antibakteri dalam menghambat pertumbuhan atau mematikan bakteri adalah dengan cara menghambat sintesis dinding sel atau merusak dinding sel35. Ada beberapa metode yang dilakukan untuk uji
Metode yang sering digunakan adalah metode difusi agar36. Pada metode ini,
penentuan aktivitas didasarkan pada kemampuan difusi zat antimikroba dalam lempeng agar yang telah diinokulasi dengan mikroba uji. Aktivitas antimikroba diamati melalui adanya zona hambat (daerah bening) yang terbentuk disekeliling zat antimikroba pada masa inkubasi.
2. Metode dilusi
Metode ini menggunakan tabung reaksi, dimana senyawa uji dilarutkan dengan medium cair dalam berbagai konsentrasi kemudian diinkubasi37. Pengamatan
dilakukan terhadap kekeruhan yang terjadi setelah masa inkubasi. Tidak adanya kekeruhan, menunjukkan tidak terjadinya pertumbuhan bakteri38.
Adapun bakteri yang sering diujikan ialah bakteri patogen seperti
Staphylococcus aureus dan Escherichia coli. Karakteristik dan habitat bakteri uji adalah sebagai berikut :
a. Staphylococcus aureus
Staphylococcus merupakan bakteri gram positif berbentuk bulat biasanya tersusun dalam bentuk menggerombol yang tidak teratur. Staphylococcus
bertambah dengan cepat pada beberapa tipe media dengan aktif melakukan metabolisme, melakukan fermentasi karbohidrat dan menghasilkan bermacam-macam pigmen dari warna putih hingga kuning gelap. Staphylococcus cepat menjadi resisten terhadap beberapa antimikroba.
Klasifikasi Staphylococcus aureus adalah sebagai berikut38.
Kingdom : Procaryota
Spesies : Staphylococcus aureus
bersifat patogen dan toksik. Dinding selnya mengandung fosfor organik, ribitol, glukosamin, asam muramat, glisina, lisina dan sedikit threonina, prolina, valina dan leusina.
b. Escherichia coli
Escherichia coli merupakan bakteri gram negatif yang termasuk dalam famili
Enterobacteriaceae, bakteri ini merupakan flora normal yang terdapat dalam usus dan merupakan kelompok besar yang berbentuk batang, bersifat anaerob fakultatif dan habitat alaminya adalah saluran usus manusia dan hewan. Morfologinya berupa koloni yang bundar, cembung dan tipis. Organisme ini tersebar luas di alam biasanya lazim terdapat dalam sel pencernaan manusia dan hewan. Spesies E. coli tidak dapat mengurangi asam sitrat dan garam asam sitrat sebagai sumber karbon tunggal dan tidak menghasilkan pigmen, tetapi kadang-kadang menghasilkan pigmen berwarna kuning.
Klasifikasi Eschericia coli adalah sebagai berikut38.
Kingdom : Procaryota
Divisio : Gracilicutes
Kelas : Scotobacteria
Ordo : Eubacteriales
Genus : Escherichia
Spesies : Escherichia coli
Escherichia coli tersebar di seluruh dunia dan ditularkan bersama air atau makanan yang terkontaminasi oleh fases. Escherichia coli berbentuk batang, tebal 0,5 µm, panjang antara 1,0–3,0 µm, bervariasi dari bentuk koloid sampai berbentuk seperti filamen yang panjang, tidak berbentuk spora, bersifat gram negatif. Escherichia coli aerob atau kualitatif anaerob, dapat tumbuh pada media buatan. Beberapa sifat Escherichia coli antara lain pertumbuhan optimum pada suhu 37°C, dapat tumbuh pada suhu 15°C - 45°C, tumbuh baik pada pH 7,0 tapi tumbuh juga pada pH yang lebih tinggi. Escherichia coli
BAB III. METODE PENELITIAN
3.1 Waktu dan Tempat PenelitianPenelitian dilakukan pada bulan Oktober sampai Maret di Laboratorium Kimia Organik Bahan Alam Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam.
3.2 Alat dan Bahan 3.2.1 Alat
Peralatan yang digunakan adalah Rotary Evaporator, lampu UV (365 nm), micropipet, botol vial, neraca analitik, batang L, incubator, test tube, autoclave,
petri dish, laminar air flow, jangka sorong digital, serta peralatan gelas yang umum digunakan dalam laboratorium.
3.2.2 Bahan
Bahan yang digunakan pada penelitian ini adalah sampel daun rengas, asam klorida, asam sulfat, besi (III) klorida, kloroform, natrium hidroksida, pelarut teknis yang telah didistilasi yaitu heksan, etil asetat, metanol dan akuades. Bahan yang digunakan untuk uji fitokimia yaitu pereaksi Mayer dan amoniak-kloroform untuk identifikasi alkaloid, pereaksi Liebermann-Burchard (asam asetat anhidrat dan asam sulfat pekat) untuk identifikasi triterpenoid dan steroid, sianidin test (bubuk magnesium dan asam klorida pekat) untuk identifikasi flavonoid, besi (III) klorida untuk identifikasi fenolik, natrium hidroksida untuk identifikasi kumarin, kertas saring, air laut, media MHA, media NA, DMSO (Dimetil Sulfoksida).
3.3 Pembuatan Reagen 3.3.1 Pereaksi Mayer
Sebanyak 2,27 gram raksa (II) klorida dilarutkan dengan akuades hingga volume 100 mL (larutan I). Pada wadah lain, dilarutkan 50 gram kalium iodida dengan akuades hingga volume 100 mL (larutan II) dalam labu ukur. Diambil 60 mL dari larutan I dan dicampurkan dengan 10 mL larutan II, campuran ini ditambahkan akuades hingga volume 100 mL dalam labu ukur.
Sebanyak 5 gram besi (III) klorida dilarutkan dengan akuades hingga volume 100 mL dalam labu ukur.
3.3.3 Asam Klorida 2 N
Sebanyak 17 mL asam klorida pekat (12 N) dilarutkan dengan akuades hingga volume 100 mL dalam gelas piala.
3.3.4Asam Sulfat 2 N
Sebanyak 5,5 mL asam sulfat p.a (36,4 N) diencerkan dengan akuades hingga volume 100 mL dalam gelas piala.
3.3.5Amoniak-Kloroform 0.05 M
Sebanyak 1 ml amoniak dilarutkan kedalam 250 ml kloroform.
3.3.6Pereaksi Liebermann-Burchard
Ditambahkan 5 ml asam asetat anhidrat ke dalam 5 ml asam sulfat pekat pelan-pelan, kemudian dengan hati-hati pula ditambah etanol absolut sampai volume 50 ml, lalu didinginkan dengan air es.
3.3.7Natrium Hidroksida 1 %
Sebanyak 10 ml larutan NaOH 10% dilarutakan kedalam 100 ml akuades.
3.4 Persiapan dan Identifikasi Sampel Daun Rengas
Tumbuhan rengas diperoleh dari pinggiran sungai daerah Solok. Sampel daun sebanyak 3000 gram dirajang halus kemudian dikering anginkan pada udara terbuka yang tidak terkena cahaya matahari langsung. Setelah sampel tersebut kering, selanjutnya dijadikan bubuk dengan menggunakan grinder kemudian ditimbang. Sampel yang telah berupa bubuk ± 1100 gram digunakan untuk tahapan selanjutnya. Sebanyak 4 gram daun digunakan untuk identifikasi senyawa metabolit sekunder. Sedangkan untuk Identifikasi tumbuhan dilakukan di Laboratorium Herbarium Universitas Andalas.
3.5 Uji Kandungan Metabolit Sekunder Sampel Daun Rengas
Uji fitokimia dilakukan untuk mengetahui kandungan metabolit sekunder yang terdapat pada tumbuhan daun rengas. Metabolit sekunder yang diuji yaitu berupa senyawa kumarin, alkaloid, steroid, triterpenoid, saponin, flavonoid dan fenolik (Lampiran 1).
Untuk menguji adanya senyawa kumarin dalam sampel, sampel dirajang halus dan diekstrak dengan pelarut metanol. Hasil ekstrak ditototlkan pada garis awal plat KLT dengan menggunakan pipa kapiler, dibiarkan kering di udara terbuka. Setelah itu dielusi dalam bejana yang berisi 10 mL eluen etil asetat 100%. Noda dimonitor dibawah lampu UV 365 nm. Adanya fluoresensi biru setelah disemprotkan NaOH 1% menunjukkan positif kumarin.
b. Uji Alkaloid
Pemeriksaan alkaloid dilakukan menurut metode Culvenor-Fitzgerald. Daun rengas diambil secukupnya kemudian dipotong kecil-kecil, digerus dalam lumpang dengan bantuan pasir bersih, dibasahi dengan 10 mL kloroform, kemudian tambahkan 10 mL amoniak-kloroform 0,05 M, digerus ditambah asam sulfat 2 N, dikocok perlahan dan biarkan sehingga terbentuk pemisahan lapisan asam dan kloroform. Diambil lapisan asam sulfat dan pindahkan ke dalam tabung reaksi lain, kemudian tambahkan beberapa tetes pereaksi Mayer. Reaksi positif ditandai dengan kabut putih hingga gumpalan putih/endapan.
c. Uji Flavonoid, Fenolik, Saponin,Triterpenoid, dan Steroid,
Daun rengas diambil secukupnya kemudian dipotong kecil, dimasukkan kedalam tabung reaksi dan ditambahkan metanol. Setelah itu ditambahkan kloroform dan akuades dengan perbandingan 1:1 dan diaduk dengan baik lalu dibiarkan sejenak hingga terbentuk dua lapisan yaitu lapisan kloroform dan lapisan air. Lapisan atas (akuades) digunakan untuk pemeriksaan flavonoid, saponin dan fenolik. Lapisan bawah (kloroform) digunakan untuk pemeriksaan senyawa triterpenoid dan steroid.
1. Uji flavonoid
Lapisan akuades yang telah dipisahkan diambil 1 mL dimasukkan kedalam tabung reaksi kecil lalu ditambahkan asam klorida pekat dan beberapa butir serbuk magnesium. Terbentuk orange sampai merah menandakan positif flavonoid.
2. Uji fenolik
klorida 5%. Ciri khas fenolik membentuk kompleks dengan besi (III) klorida menimbulkan warna biru atau ungu tua.
3. Uji saponin ditambahkan Pereaksi LB dan plat 2 ditambahkan kloroform saja sebagai pembanding. Pewarnaan merah atau merah ungu memberikan positif triterpenoid sementara cincin warna hijau atau hijau biru memberikan positif steroid.
3.6 Ekstraksi Sampel Daun Rengas
Sampel daun rengas yang telah menjadi bubuk (± 1100 gram) dimaserasi secara bertahap dengan menggunakan pelarut n-heksan, etil asetat dan metanol pada suhu ruang dengan sesekali diaduk. Selanjutnya filter yang didapat disaring dengan kertas saring dipekatkan dengan menggunakan rotary evaporator pada suhu 400C dan diperoleh ektrak pekat daun rengas dari
masing-masing pelarut. Setiap ekstrak dilakukan uji fitokimia, uji sitotoksisitas dan uji antibakteri.
3.7 Uji Sitotoksisitas dengan Metode Brine Shrimp Lethality Test
Uji sitotoksisitas dari daun rengas ialah dengan menggunakan metode Brine Shrimp Lethality Test (BSLT). Metode ini dilakukan untuk skrining awal toksisitas ekstrak yang didapatkan mengacu pada prosedur kerja yang dilakukan oleh Meyer dkk (1982)39. (Lampiran 3).
3.7.1 Pembiakkan Larva Artemia salina
Air laut yang telah disaring selanjutnya dimasukkan kedalam wadah pembiakkan yang terdiri dari dua bagian yaitu bagian terang dan bagian gelap. Telur Artemia salina dimasukkan kedalam wadah pembiakkan pada bagian gelap dan dibiarkan selama 48 jam hingga terbentuk larva Artemia salina.
3.7.2 Pembuatan Larutan Uji
masing-masing sampel ditimbang dan dilarutkan hingga 10 mL dengan metanol, sehingga diperoleh konsentrasi larutan induk 1000 mg/L. Kemudian dibuat beberapa variasi konsentrasi sampel dengan cara pengenceran bertingkat yaitu 100; 50; 25; 12,5; dan 6,25 mg/L.
3.7.3 Pengujian Sitotoksisitas Larutan Uji
Larutan uji yang telah disiapkan dengan variasi konsentrasi 100; 50; 25; 12,5; dan 6,25 mg/L diambil sebanyak 5 mL kemudian diuapkan pelarutnya, kemudian ditambahkan 50 µL DMSO serta 2 mL air laut. Hal yang sama juga dilakukan terhadap kontrol. Sebanyak 10 ekor larva udang yang telah ditetaskan selama 48 jam dimasukkan kedalam larutan uji dan kontrol. Setelah itu volume masing-masing larutan uji dan kontrol dicukupkan hingga 5 mL dengan air laut. Jumlah larva yang mati dihitung setiap 4 jam selama 24 jam. Data yang diperoleh digunakan untuk menghitung nilai LC50 menggunakan uji
probit dan persamaan regresi.
3.8 Uji Aktivitas Antibakteri dengan Metoda Difusi Cakram
Uji aktivitas antibakteri dari daun rengas ialah dengan menggunakan metode difusi cakram.
3.8.1 Pembuatan Media Mueller-Hinton Agar
7,2 gram Mueller-Hinton Agar dilarutkan dalam 200 mL akuades, kemudian dipanaskan dan diaduk sampai larut. Media agar disterilkan di autoklaf. Media agar didinginkan kemudian dimasukkan ke dalam petri dish masing-masing sebanyak 15 mL dan dibiarkan memadat pada suhu kamar.
3.8.2 Pembuatan Media Nutrient Agar
Tiga gram media nutrient agar dilarutkan dalam 100 mL akuades, kemudian dipanaskan dan diaduk sampai larut. Media agar disterilkan di autoklaf. Media agar didinginkan kemudian dimasukkan ke dalam tabung reaksi masing-masing sebanyak 10 mL dan dibiarkan memadat pada suhu kamar dalam keadaan miring.
3.8.3 Peremajaan Bakteri Uji
3.8.4 Pengujian Aktivitas Antibakteri
Media Mueller-Hinton Agar yang telah disterilkan dimasukkan ke dalam petri
dish masing-masing sebanyak 15 mL dan dibiarkan memadat pada suhu kamar.
BAB IV. HASIL DAN PEMBAHASAN
4.1 Persiapan dan Identifikasi Sampel Daun RengasBerdasarkan hasil identifikasi tumbuhan di Herbarium Universitas Andalas (ANDA) Padang melalui surat Nomor 03/K-ID/ANDA/I/2017 diketahui bahwa sampel yang dgunakan termasuk kedalam family Anacardiaceae, spesies
Gluta renghas L. Hasil identifikasi ini dapat dilihat pada Lampiran 1
4.2 Uji Kandungan Metabolit Sekunder Sampel Daun Rengas
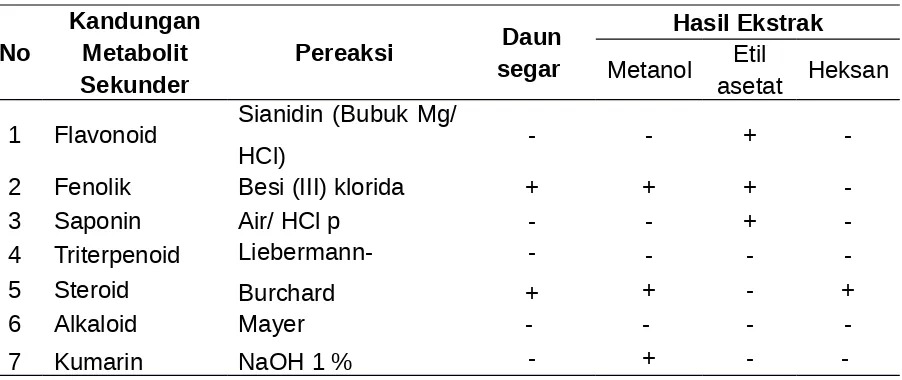
Uji profil fitokimia dilakukan pada bagian daun rengas segar dan ekstrak daun rengas. Hasil pengujian tertera pada tabel 4.1, sedangkan hasil pengamatan dapat dilihat pada Lampiran 6.
Tabel 4.1. Hasil uji fitokimia daun rengas
No
1 Flavonoid Sianidin (Bubuk Mg/
HCl) - - +
-Keterangan : + (mengandung metabolit sekunder) - (tidak mengandung metabolit sekunder)
Berdasarkan data tabel di atas, diketahui bahwa sampel segar daun rengas mengandung beberapa senyawa metabolit sekunder yaitu fenolik, steroid dan triterpenoid. Sedangkan hasil ekstrak dari daun rengas, memiliki hasil yang berbeda-beda dimana ekstrak metanol mengandung senyawa metabolit sekunder yaitu fenolik, steroid dan kumarin. Ekstrak etil asetat mengandung senyawa metabolit sekunder yaitu flavonoid, fenolik dan saponin. Ekstrak heksan mengandung senyawa metabolit sekunder hanya steroid.
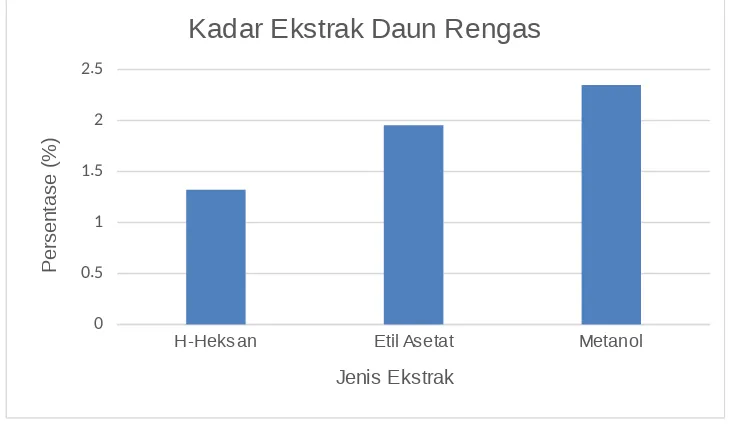
Sampel bubuk daun rengas sebanyak 1100 gram diekstrak secara bertahap dengan menggunakan pelarut metanol, etil asetat dan n-heksan. Ekstraksi dilakukan dengan meningkatan kepolaran pelarut dari pelarut non polar ke pelarut polar. Massa ekstrak pekat yang diperoleh dari masing-masing pelarut berbeda. Hal ini disebabkan oleh perbedaaan komponen yang ada didalam sampel daun rengas. Selain itu, jumlah pengekstrakan setiap pelarut tidak sama. Pada pelarut n-heksan dilakukan 8 kali ekstraksi, pelarut etil asetet 7 kali ekstraksi dan metanol 3 kali ekstraksi (Lampiran 7). Hasil ekstraksi daun rengas dapat dilihat pada gambar 4.1
Gambar 4.1. Persentase kadar ekstrak yang dihasilkan.
Berdasarkan tabel diatas dapat dilihat bahwa ekstrak metanol memiliki kadar yang lebih besar dibanding ekstrak heksan dan etil asetat. Hasil ini memperlihatkan jumlah senyawa yang bersifat non polar lebih sedikit dibanding senyawa yang bersifat polar. Ini dapat terlihat dari perbandingan kadar ekstrak metanol dan ekstrak heksan, dimana ekstrak metanol 2.348% dengan 3 kali ekstraksi sedangkan ekstrak heksan 1.320% dengan 8 kali ekstraksi. Begitu juga dengan kadar dari ekstrak etil asetat 1.955% dengan 7 kali ekstraksi. Dengan demikian, dapat diketahui bahwa sampel rengas memiliki komponen senyawa polar yang lebih banyak dibanding senyawa non polar.
Uji sitotoksisitas dari daun rengas dilakukan dengan menggunakan metode
Brine Shrimp Lethality Test (BSLT). Metode ini dilakukan untuk skrining awal toksisitas dari ekstrak yang didapatkan dengan menggunakan nilai LC50.
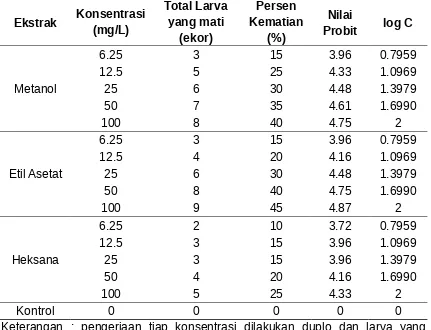
Konsentrasi masing-masing ekstrak dibuat menjadi 5 variasi konsentrasi yaitu 6.25 mg/L, 12,5 mg/L, 25 mg/L, 50 mg/L, dan 100 mg/L. Pembuatan konsentrasi larutan uji dapat dilihat pada lampiran 1. Hasil pengamatan uji sitotoksisitas dari ekstrak daun rengas dan penentuan LC50 dapat dilihat pada
Tabel.4.2 (Lampiran 10).
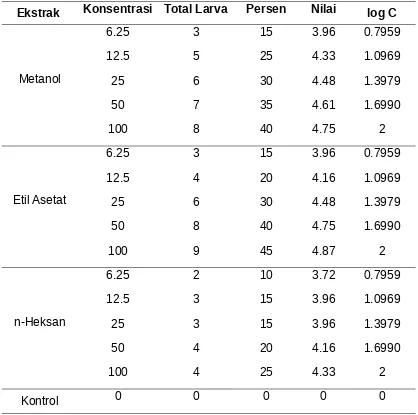
Tabel 4.2 Hasil pengamatan uji sitotoksisitas ekstrak daun rengas
Ekstrak Konsentrasi dimasukkan ke dalam tiap vial berjumlah 10 ekor.
konsentrasi yang berbeda namun jumlah udang yang mati sama. Pada masing-masing ekstrak menunjukkan jumlah kematian udang yang berbeda-beda, dimana ekstrak etil asetat lebih berpotensi sebagai sitotoksik dibanding ekstrak lainnya. Hal ini dapat dilihat dari nilai LC50 masing-masing ekstrak. Nilai LC50
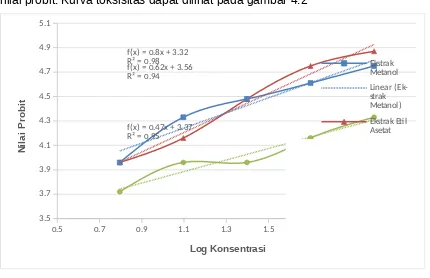
dihitung berdasarkan nilai persamaan regresi antara log konsentrasi dengan nilai probit. Kurva toksisitas dapat dilihat pada gambar 4.2
0.5 0.7 0.9 1.1 1.3 1.5 1.7 1.9 2.1 masing-masing ekstrak, dapat dihitung nilai LC50. Nilai LC50 dapat dilihat pada
Tabel 4.2. Nilai LC50 menunjukkan bahwa ekstrak etil asetat memiliki aktivitas
sitotoksik yang tinggi dengan nilai LC50 123.718 mg/L (R2 = 0.9822). Hal ini
sesuai dengan nilai LC50 ekstrak kecil dari 1000 mg/L yang berdasarkan teori
menunjukkan bahwa ekstrak ini aktif sebagai sitotoksik30.
4.5 Uji Aktivitas Antibakteri dengan Metoda Difusi Cakram
Uji aktivitas antibakteri dilakukan terhadap bakteri gram positif, yaitu
Staphylococcus aureus dan bakteri gram negatif, yaitu Escherichia coli.
Pengujian ini dilakukan untuk melihat potensi antibakteri yang dimiliki oleh ekstrak daun rengas. Sebagai pembandingnya digunakan gentamycin dengan konsentrasi 40 mg/L sebagai kontrol positif dan sebagai kontrol negatif digunakan metanol dan etil asetat distilat.
Konsentrasi masing-masing ekstrak dibuat menjadi 5 variasi konsentrasi yaitu 62.4 mg/L, 125 mg/L, 250 mg/L, 500 mg/L, dan 1000 mg/L. Pembuatan konsentrasi larutan uji dapat dilihat pada lampiran 10. Hasil pengamatan antibakteri dari ekstrak daun rengas dapat dilihat pada Tabel.4.3.
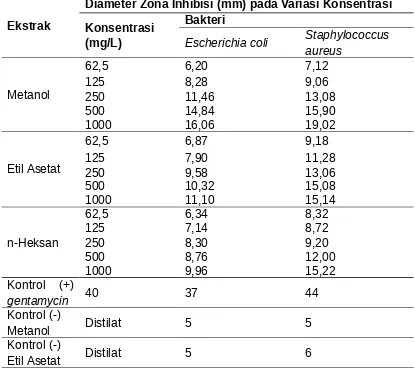
Tabel 4.3 Hasil pengamatan uji antibakteri ekstrak daun rengas
Ekstrak
melarutkan ekstrak etil asetat dan ekstrak n-heksan. Berdasarkan data tabel 4.3, dapat di lihat besarnya zona inhibisi yang terbentuk pada masing-masing bakteri uji dengan konsentrasi yang berbeda-beda. Hasil terbaik untuk bakteri
Staphylococcus aureus adalah pada ekstrak metanol dengan besarnya zona inhibisi yaitu pada konsentrasi 1000 mg/L memiliki diameter zona inhibisi sebesar 19,02 mm. Sedangkan untuk bakteri Escherichia coli zona inhibisi terbaik didapatkan pada ekstrak metanol yaitu pada konsentrasi 1000 ppm dengan zona inhibisi sebesar 16,06 mm.
Jika dibandingkan dengan kontrol positif, kemampuan ekstrak sebagai antibakteri masih jauh lebih rendah. Hal ini dapat terlihat dari zona inhibisi yang diberikan oleh kontrol positif dengan konsentrasi 40 mg/L yaitu 37 mm (Escherichia coli) dan 44 mm (Staphylococcus aureus), sedangkan pada ekstrak dengan konsentrasi 1000 mg/L hanya memberikan zona inhibisi tertinggi yaitu 19,02 mm (Staphylococcus aureus) dan 16,06 mm (Escherichia coli).
Dari hasil pengukuran zona inhibisi terlihat bahwa pada bakteri uji
Staphylococcus aureus dan Escherichia coli zona inhibisi yang diberikan tidak konstan terhadap kenaikan konsentrasi. Perbedaan peningkatan dan penurunan zona inhibisi terhadap konsentrasi ekstrak ini dikarenakan komponen zat-zat yang terkandung dalam ekstrak rengas dapat saling memperlemah, memperkuat, memperbaiki atau merubah sama sekali. Selain itu, kualitas dan kuantitas zat-zat yang yang ada dalam sampel ditentukan oleh faktor-faktor lingkungan tempat tumbuh seperti iklim, tanah, sinar matahari, dan kondisi pertumbuhan35. Dari tabel diatas, dapat disimpulkan bahwa ekstrak
BAB V. KESIMPULAN DAN SARAN
5.1 KesimpulanBerdasarkan hasil penelitian yang telah dilakukan terhadap daun rengas, dapat disimpulkan bahwa senyawa metabolit sekunder yang terkandung dalam ekstrak metanol yaitu fenolik, steroid dan kumarin. Ekstrak etil asetat mengandung senyawa metabolit sekunder yaitu flavonoid, fenolik dan saponin. Sedangkan ekstrak heksan hanya mengandung senyawa metabolit sekunder steroid. Aktivitas sitotoksisik yang terbaik ditunjukkan oleh ekstrak etil asetat yang memiliki nilai nilai LC50 123.718 mg/L (R2 = 0.9822). Sedangkan aktivitas
antibakteri yang terbaik ditunjukkan oleh ekstrak metanol 1000 mg/L dengan diameter zona inhibisi sebesar 19,02 mm (Staphylococcus aureus) dan 16,06 mm (Escherichia coli), sehingga dapat disimpulkan bahwa ekstrak daun rengas memiliki kemampuan yang cukup dalam menghambat pertumbuhan bakteri baik bakteri gram positif maupun bakteri gram negatif.
5.2 Saran
Beberapa saran untuk penelitian lanjutan diantaranya yaitu:
1. Untuk melakukan isolasi dan karakterisasi senyawa metabolit sekunder dari ekstrak etil asetat karena ekstrak ini memiliki aktivitas sitotoksisitas yang paling baik.
2. Untuk melakukan isolasi dan karakterisasi senyawa metabolit sekunder dari ekstrak metanol karena ekstrak ini memiliki aktivitas antibakteri yang paling baik
3. Untuk melakukan uji bioaktivitas lainnya seperti DPPH, total fenolik dari masing-masing ekstrak.
DAFTAR PUSTAKA
1. Achmad, S.A.: Kimia Organik Bahan Alam. Universitas Terbuka: Jakarta, 1990.
2. G. Indrayanto.: Prospek (Kimia) Bahan Alam untuk Penemuan Obat Baru.
Seminar Umum Pendidikan. Universitas Mulawarman, 2006.
3. Arbain, D.: Survey Fitokimia Salah Satu Cara Pendekatan, Proyek HEDS. USAID. Universitas Andalas: Padang, 1995.
4. Zuharah, W.F.; Fadzly, N.; Ali, Y.; Zakaria, R.; Juperi, S.; Asyraf, M.; Dieng, H.: Larvicidal Efficacy Screening of Anacardaciae Crude Extracts on the Dengue Hemorrhagic Vector, Aedes Aegypti. Tropical Biomedicine 2014, 31, 2, 297–304.
5. Heyne, K.: Tumbuhan Berguna Indonesia Jilid I dan II. Terj. Badan Libang Kehutanan: Jakarta, 1987, 403-452.
6. Supriatna, Nana; Tatang Kelana: Informasi Singkat Benih Renghas (Gluta renghas L), Balai Pembenihan Tanaman Hutan Jawa dan Madura, 116, 2011.
7. Menon, S.: Current Uncertainties In Assessing Aerosol Effects On Climate.
Annual Review of Environment and Resource. 2004, 29, 1-30.
8. Ahmad, W.Y.W.; Razis Rahim; M. Rozi Ahmad; M. Ismail A.K.; M. Iqbal Misnon: The Application of Gluta Aptera Wood (Rengas) as Natural Dye on Silk and Cotton Fabrics. Universal Journal of Environmental Research and Technology 2011, 4, 1, 545-551.
9. Corner, E. J. H. Wayside Trees of Malaya. Government Printing Office: Singapore, 1940, 1, 1, 116.
10. Backer, H. J., and Haack, N. H.: Le Prinsiple Toxique de Gluta Renghas Linn. Recueil des Travaux Chimiques des Pays-Bas 1941, 60, 656-660.
11. Burkill, I. H.. A Dictionary of the Economic Products of the Malay Peninsula. Crown Agents for the Colonies: London, 1935,1 1, 1079-1080.
12. Lin, R.C.Y. and G.C. Whittow: Pharmacological Activity Of An Aqueous Extract Of The Leaves Of The Malayan Rengas Tree Gluta renghas. Asian Pacific Journal of Tropical Biomedicine 1960, 15, 440.
14. Imamura, H. Okta; H. Kiriyama; S. Ohashi, H.: Heart Wood Constituent of Renghas, Gluta sp. Res, Bull. Gifu University: Japan, 1979, 117-122.
15. Copriady, J; Miharty; Herdini,; Gallokatekin: Senyawa Flavonoid lainya dari Kulit Batang Rengas (Gluta renghas Linn.)”. Jurnal Natur Indonesia 2002, 4, 1, 1–6.
16. Ang, L.Z.P.; Rokiah H.; Shaida F.S; Ahmed Y.C.; Othman S.; Fumio K.; Kushairi M.S.: In Vitro Antioxidant And Antidiabetic Activites Of Gluta Torquata. Industrial Crops and Products 2015,76, 755–760
17. Lin, R.C.Y. and G.C. Whittow: Pharmacological Activity Of An Aqueous Extract Of The Leaves Of The Malayan Rengas Tree Gluta renghas. British Journal of Pharmacology 1960, 15, 440.
18. Asikin. S; M. Thamrin. Bahan Tumbuhan Sebagai Pengendali Hama Ramah Lingkungan. Seminar Nasional Lahan Kering Dan Lahan Rawa 18-19 Desember 2002. BPTP Kalimantan Selatan dan Balittra. Banjar Baru. 2002
19. Zuharah, W.F.; Chan, J.L.; Zulkifly, N; Fadzly, N.: Toxicity and sub-lethal effects of endemic plants from Family Anacardaciae on oviposition behavior of Aedes albopictus. Asian Pacific Journal of Tropical Biomedicine 2015. 5, 8, 612-618.
20. Zuharah, W.F. and Ali Y.: Assessment of Gluta renghas L. and Mangifera indica L. (Sapindales: Anacardiaceae) Extracts on the Sublethal Effects of Dengue Vector. Journal of Asia-Pacific Entomology 2016.
21. Yousaf, Ali and Wan F.Z.: Lethal Response of the Dengue Vectors to the Plant Extracts from Family Anacardiaceae. Asian Pacific Journal of Tropical Biomedicine 2015, 5, 10, 812–818.
22. Shaalan E.A.; Canyon D.V.: Aquatic Insect Predators and Mosquito Control.
Tropical Biomedicine 2009, 26, 223.
23. Ramar M.; Paulraj M.G.; Ignacimuthu S.: Preliminary Screening of Plant Essential Oils Against Larvae of Culex Quinquefasciatus Say (Diptera: Culicidae). African Journal of Biotechnology 2013, 12, 6480.
24. Kedia, A.; Prakash B.; Mishra P.K.; Singh P.; Dubey N.K.: Botanicals As Eco Friendly Biorational Alternatives of Synthetic Pesticides Against Callosobruchus spp. (Coleoptera: Bruchidae)-a Review. Journal Food Science Technology 2015, 52, 3, 1239.
26. Amalina, N.: Uji Sitotoksisitas Ekstrak Etanol 70% Buah Merica Hitam (Piper ningrum L.) Terhadap Sel HeLa, Skripsi, Fakultas Farmasi, Universitas Muhammadiyah, Surakarta, Surakarta, 2008.
27. Silverstein, R.M.; G.C. Bessler and T.C. Moril,: Spektrometric Identification of Organic Compound (Penyidikan Spektroskopi Senyawa Organik),
terjemahan A.J. Hartono dan Any Victor Purba, Penerbit Erlangga: Jakarta, 1989.
28. Titis, M.; Fachriyah, E,; Kusrini, D.: Isolasi Identifikasi dan Uji Aktifitas Senyawa Alkaloid Daun Binahong (Anredera cordifolia (Tenore) Steenis).
Skripsi, Jurusan Kimia FSM, Universitas Diponegoro, Semarang, 2013.
29. Agustian, R.; Yudiati, E.; Sedjati, S.: Uji Toksisitas Pigmen Kasar Mikroalga
Spirulina platensis dengan Metode Uji BSLT (Brine Shrimp Lethality Test), Journal of Marine Research 2013, 1, 2, 25-31.
30. Arifuddin, M: Uji Toksisitas Akut Ekstrak Metanol Daun Laban Abang (Aglaia elliptica BLUME) Terhadap Larva Udang (Artemia salina LEACH) dengan Metode Brine Shrimp Lethality Test (BSLT), Skripsi, Fakultas Kedokteran dan Ilmu Kesehatan, UIN Syarif Hidayatullah, Jakarta, 2014.
31. Syahrurachman, A.: Buku Ajar mikrobiologi Kedokteran, Staf Pengajar Fakultas kedokteran Universitas Indonesia: Jakarta, 1994. 103, 177.
32. Sastroamidjojo, S.: Obat Asli Indonesia, Dian Rakyat: Jakarta, 1967.
33. Ganiswara: Farmakologi Dan Terapi edisi IV, Universitas Indonesia: Jakarta, 1995.
34. Bonang, G.; Koeswardono: Mikrobiologi Kedokteran Untuk Laboratorium dan Klinik, Gramedia: Jakarta, 1982, 8-9.
35. Pelczar, M.J.: Elements of Microbiology, McGraw-Hill: New York. 1981.
36. Cappurino, J.G.; Sherman N. Microbiology: A Laboratory Manual, The Benyamin/Cummings Publishing Company. Inc. 1992, 250-252.
37. Edberg, S.C.; Berger: Tes Kerentanan Antimikroba In Vitro. Penerbit Buku Kedokteran: Jakarta, 1986, 199-211.
39. Meyer, B.N.; N.R. Ferrigni; J.E. Putnam; J. L. Nicols and McLaughlin: Brine Shrimp: A Convenient General Bioassay for Active Plant Constituents.
Journal of Medicinal Plant Reseach 1982, 45, 31-32. Lampiran 1
Lampiran 2
Uji Kandungan Metabolit Sekunder (Fitokimia)
a. Uji Kumarin
b. Uji Alkaloid
Sampel daun rengas
- dirajang sampai halus - diekstraksi dengan metanol
Filtrat Ampas
- ditotolkan pada plat KLT
- dielusi dengan 10 mL etil asetat didalam chamber
- dimonitor dibawah lampu UV 365 nm - hasil KLT disemprot dengan NaOH 1 %
Fluoresensi biru terang Positif kumarin
- dirajang dan digerus dalam lumpang dengan bantuan pasir
- ditambahkan 10 mL kloroform
- ditambahkan 10 mL amoniak- kloroform 0,05 M
- diaduk dan disaring
Filtrat Ampas
- diambil dan dimasukkan kedalam tabung reaksi
- ditambahkan asam sulfat 2 N - dikocok dan diamkan
Lapisan kloroform
d. Uji triterpenoid dan steroid
Lapisan kloroform
- diambil 1 pipet diteteskan kedalam dua lubang pada plat tetes
- dibiarkan kering
- lubang pertama ditambahkan pereaksi LB - lubang kedua dijadikan pembanding
Warna hijau atau hijau biru positif steroid
Lampiran 3
Ekstraksi Daun Rengas dengan Metoda Maserasi
Sampel bubuk daun rengas
- dimaserasi dengan heksana (8x) - disaring
- dipekatkan dengan
rotary eveporator
- dimaserasi dengan etil asetat (7x) - disaring
heksan Ekstrak etil asetat Ampas
Ekstrak metanol
Lampiran 4
Uji Toksisitas dengan Metoda Brine Shrimp Lethality Test Artemia Salina
- diambil sebanyak 5 mL lalu diuapkan
- ditambahkan 50 µL DMSO
- dilarutkan
- ditambahkan 2 mL air laut - dimasukkan 10 ekor larva udang
- ditambahkan air laut hingga volumenya 5 mL
- dihitung jumlah udang yang mati setiap 4 jam selama 24 jam
Nilai LC50
Ekstrak pekat 10 mg
Larutan induk 1000 mg/L
Lampiran 5
Uji Aktivitas Antibakteri dengan Metode Difusi Cakram
a. Pembuatan Media Mueller-Hinton Agar
b. Pembuatan Media Nutrient Agar
c. Peremajaan Bakteri Uji
d. Pengujian Aktivitas Antibakteri Media MHA steril
- dilarutkan 7,2 gram dalam 200 mL akuades - dipanaskan dan diaduk sampai larut
- disterilkan dalam autoklaf
-diambil dengan ose
-dimasukan ke dalam tabung berisi 10 ml media nutrient agar miring
-dibiakkan pada media NA miring selama 24 jam
Bakteri Uji (E.coli dan
Staphylococcus aureus)
- dituang ke dalam media MHA steril padat yang telah dimasukkan ke dalam petri dish
- diratakan dengan menggunakan cotton bud
- didiamkan hingga kering selama 15 menit Agar Mueller-Hinton
Bakteri Uji (E.coli dan
Staphylococcus aureus)
Bakteri Uji Media NA steril
- dilarutkan 3 gram dalam 100 mL akuades - dipanaskan dan diaduk sampai larut - disterilkan dalam autoklaf
- diamati dan diukur dengan menggunakan jangka sorong digital.
Diameter Zona Bening
Zona Bening Sekitar Cakram
- kertas cakram steril (d=5 mm) diteteskan ekstrak dengan konsentrasi 62,5 mg/L, 125 mg/L, 250 mg/L, 500 mg/L, dan 1000 mg/L, kontrol positif gentmycin 40 μg dan kontrol negatif etil asetat dan metanol distilat. - diletakkan pada media berisi bakteri
Lampiran 6
Hasil Uji Profil Fitokimia Daun Rengas
1. Sampel segar daun rengas
No. Kandungan
Metabolit Sekunder Pereaksi Pengamatan Hasil
1 Flavonoid Sianidin (Bubuk
Mg/ HCl)
-2 Fenolik Besi (III) klorida +
3 Saponin Air/ HCl p
-4 Triterpenoid
Liebermann-Burchard +
5 Steroid
Liebermann-Burchard +
-7 Kumarin NaOH 1%
fluoresensi UV
2. Ekstrak daun rengas
No KandunganMetabolit Sekunder
Pereaksi Pengamatan
Hasil Ekstrak
Metano
l asetatEtil Heksan
1 Flavonoid
Sianidin (Bubuk Mg/ HCl)
- +
-2 Fenolik Besi (III)klorida + +
-3 Saponin Air/ HCl p - +
-4 Triterpenoid
Liebermann -Burchard
- -
-5 Steroid + - +
6 Alkaloid Mayer - -
Lampiran 7
Persentase kadar ekstrak yang dihasilkan
Ekstrak Berat sampe awal (g) Berat ekstrak (g) Kadar (%)
Metanol 1100 25.827 2.348
Etil asetat 1100 21.50 1.955
Lampiran 8
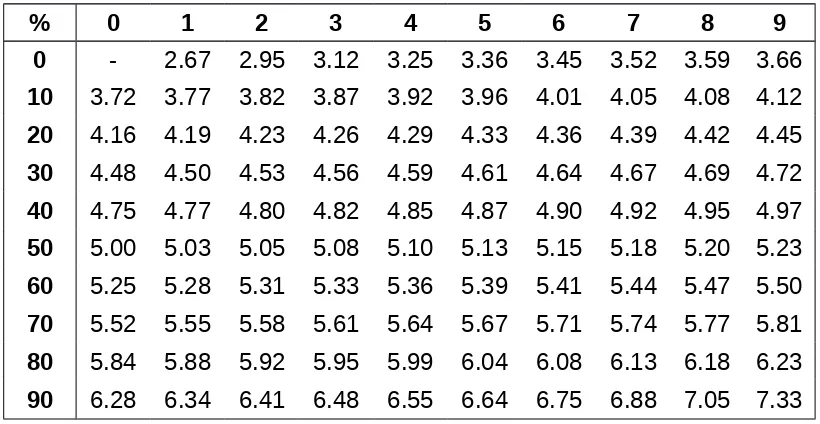
Tabel Nilai Probit Sesuai Persentase Kematian
% 0 1 2 3 4 5 6 7 8 9
0 - 2.67 2.95 3.12 3.25 3.36 3.45 3.52 3.59 3.66
10 3.72 3.77 3.82 3.87 3.92 3.96 4.01 4.05 4.08 4.12
20 4.16 4.19 4.23 4.26 4.29 4.33 4.36 4.39 4.42 4.45
30 4.48 4.50 4.53 4.56 4.59 4.61 4.64 4.67 4.69 4.72
40 4.75 4.77 4.80 4.82 4.85 4.87 4.90 4.92 4.95 4.97
50 5.00 5.03 5.05 5.08 5.10 5.13 5.15 5.18 5.20 5.23
60 5.25 5.28 5.31 5.33 5.36 5.39 5.41 5.44 5.47 5.50
70 5.52 5.55 5.58 5.61 5.64 5.67 5.71 5.74 5.77 5.81
80 5.84 5.88 5.92 5.95 5.99 6.04 6.08 6.13 6.18 6.23
Lampiran 9
Pembuatan Konsentrasi Larutan untuk Uji Sitotoksisitas Larutan Stok (1000 mg/L)
Berat ekstrak kering : 10 mg
Volume metanol : 10 mL
Konsentrasi : 1000 mg/L
Larutan Uji
- Pembuatan larutan uji 100 mg/L
M1 . V1 = M2 . V2
1000 mg/L . V1 = 100 mg/L . 10 mL
V1 = 1 mL
- Pembuatan larutan uji 50 mg/L
M1 . V1 = M2 . V2
100 mg/L . V1 = 50 mg/L . 10 mL
V1 = 5 mL
- Pembuatan larutan uji 25 mg/L
M1 . V1 = M2 . V2
50 mg/L . V1 = 25 mg/L . 10 mL
V1 = 5 mL
- Pembuatan larutan uji 12,5 mg/L
M1 . V1 = M2 . V2
25 mg/L . V1 = 12,5 mg/L . 10 mL
V1 = 5 mL
- Pembuatan larutan uji 6,25 mg/L
M1 . V1 = M2 . V2
6,25 mg/L . V1 = 12,5 mg/L . 10 mL
Lampiran 10
Penentuan nilai LC50
Tabel hasil pengamatan uji sitotoksisitas ekstrak daun rengas
Ekstrak Konsentrasi
Keterangan: pengerjaan tiap konsentrasi dilakukan duplo dan larva yang dimasukkan ke dalam setiap vial berjumlah 10 ekor
Perhitungan nilai LC50
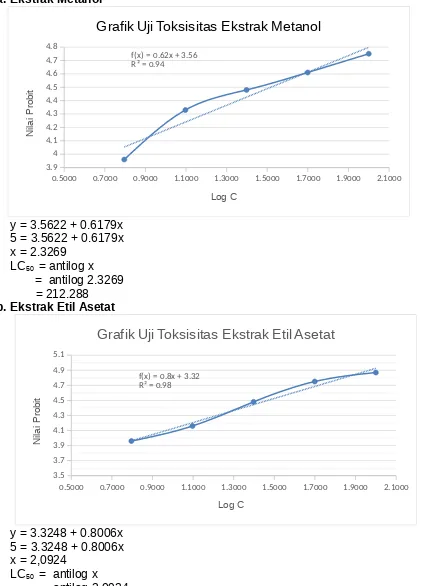
a. Ekstrak Metanol
0.5000 0.7000 0.9000 1.1000 1.3000 1.5000 1.7000 1.9000 2.1000 3.9
0.5000 0.7000 0.9000 1.1000 1.3000 1.5000 1.7000 1.9000 2.1000 3.5
Grafik Uji Toksisitas Ekstrak Etil Asetat
0.5000 0.7000 0.9000 1.1000 1.3000 1.5000 1.7000 1.9000 2.1000 3.5
3.6 3.7 3.8 3.9 4 4.1 4.2 4.3 4.4
f(x) = 0.47x + 3.37 R² = 0.95
Grafik Uji Toksisitas Ekstrak n-Heksan
Log C
N
ila
i P
ro
bi
t
y = 3.3666 + 0.4717x 5 = 3.3666 + 0.4717x x = 3.4628
LC50 = antilog x
Lampiran 11
Pembuatan Larutan Uji Antibakteri dengan Berbagai Konsentrasi Larutan Stok Ekstrak Metanol (1000 mg/L)
Berat ekstrak kering : 10 mg
Volume metanol : 10 mL
Konsentrasi : 1000 mg/L
Larutan Stok Ekstrak Etil Asetat dan n-Heksan (1000 mg/L)
Berat ekstrak kering : 10 mg
Volume metanol : 10 mL
Konsentrasi : 1000 mg/L
Larutan Uji
- Pembuatan larutan uji 500 mg/L
M1 . V1 = M2 . V2
1000 mg/L . V1 = 500 mg/L . 10 mL
V1 = 5 mL
- Pembuatan larutan uji 250 mg/L
M1 . V1 = M2 . V2
500 mg/L . V1 = 250 mg/L . 10 mL
V1 = 5 mL
- Pembuatan larutan uji 125 mg/L
M1 . V1 = M2 . V2
250 mg/L . V1 = 125 mg/L . 10 mL
V1 = 5 mL
- Pembuatan larutan uji 62,5 mg/L
M1 . V1 = M2 . V2
125 mg/L . V1 = 62,5 mg/L . 10 mL
Lampiran 12
Gambar Zona Inhibisi dari Ekstrak Daun Rengas
Staphylococcus aureus Escherichia coli
a. Ekstrak n-heksan
b. Ekstrak Etil asetat
d. Kontrol +