BAHAN DAN METODE
Tempat dan Waktu
Seluruh tahap pelaksanaan penelitian dilakukan di perusahaan dan berlangsung mulai Oktober 2007 hingga Mei 2008. Analisa kimia dan mikrobiologi dilakukan di laboratorium perusahaan dan Laboratorium Balai Besar Industri Agro - Bogor.
Tahapan Kajian
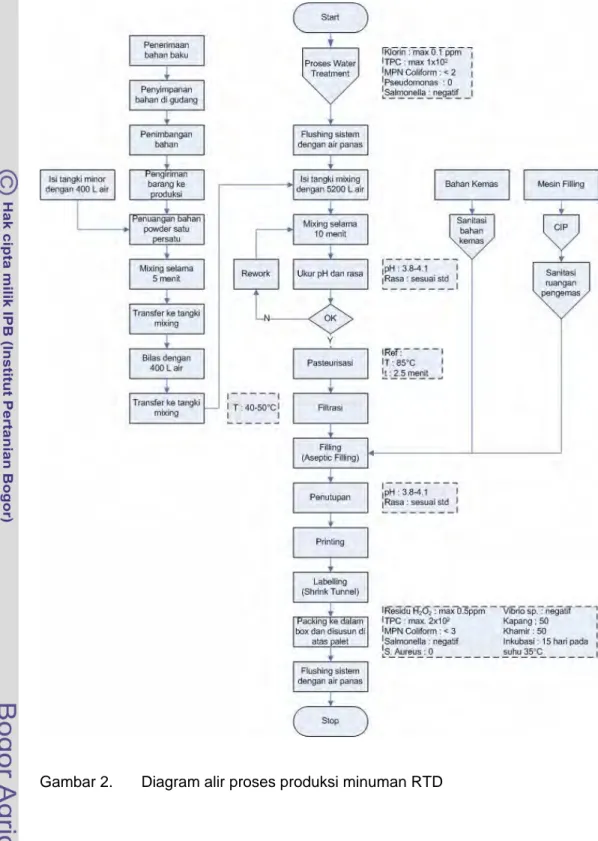
Proses produksi minuman RTD dapat dijabarkan sebagai berikut. Air yang digunakan sebagai ingredient utama diperoleh dari proses water treatment yang berasal dari air hidrofor (air sumur). Proses pengolahan aseptiknya terdiri dari proses mixing bahan yang berlanjut ke proses thermal (pasteurisasi) lalu ditransfer ke mesin pengemasan. Kemasan yang digunakan (botol PET dan tutup botol PP) disetrilisasi terlebih dahulu sebelum digunakan. Proses sterilisasi ini secara otomatis dilakukan pada mesin pengemasan. Mesin pengemasan juga disterilisasi sebelum digunakan (CIP dan flushing air panas). Proses pengemasan dan penutupan botol dilakukan dalam kondisi aseptik. Sterilisasi dilakukan sebelumnya terhadap ruang pengemasan dan ruang mesin pengemasan. Setelah keluar mesin pengemasan, produk diberi kode produksi dan expired date pada bagian tutup dan diberi label melalui shrink tunnel. Proses produksi minuman RTD berasam tinggi skala industri secara lengkap dapat dilihat pada Gambar 2.
Kajian Awal Penyiapan Prosedur
Pada tahapan ini dilakukan kajian terhadap tahapan proses produksi minuman RTD berasam tinggi skala industri untuk menyiapkan Sanitation Standard Operating Procedure (SSOP) dan Standard Operating Procedure (SOP)-nya. Kajian ini dilakukan dengan mereview prosedur GMP dan SSOP yang telah diterapkan sebelumnya di perusahaan.
Penyiapan Sanitation Standard Operating Procedure (SSOP) Keamanan Air
Tahapan ini bertujuan untuk menyiapkan SSOP keamanan air sehingga diperoleh air yang dapat digunakan untuk proses produksi. Pada tahapan ini terlebih dahulu dilakukan pembuatan draft SSOP keamanan air. Draft SSOP ini mencakup masalah monitoring yang menjadi panduan apa, bagaimana (rujukan instruksi kerja), dimana, kapan dan siapa; termasuk juga tindakan koreksi serta dokumentasinya. Dari draft SSOP ini kemudian dibandingkan dengan prosedur yang sudah ada untuk kemudian disesuaikan. Prosedur ini kemudian harus divalidasi agar bisa menjadi prosedur yang baku.
Air baku berasal dari air hidrofor (sumur) di perusahaan yang berasal dari 3 titik sumur. Proses pengolahan air baku yang sudah berjalan terdiri dari proses filtrasi (sand filter dan carbon filter) dan pelunakan sedangkan proses disinfeksi belum dibuat proses standarnya. Oleh karena itu, pada tahapan ini dilakukan penelitian terhadap prosedur disinfeksi yang akan digunakan.
Pada kajian awal dilakukan analisa terhadap 3 sumber air (air hidrofor 1, 2 dan 3) yang digunakan dalam proses pengolahan air baku. Air campuran ketiga air hidrofor dan air yang telah melalui proses filtrasi dan pelunakan juga dianalisa. Semua sampel ini dianalisa kondisi fisik, kimia dan mikrobiologinya, kemudian dibandingkan dengan standar yang ditetapkan. Ketiga air hidrofor diambil dari masing-masing titik sumur sedangkan air campuran hidrofor dan air yang sudah melalui proses penyaringan karbon dan pasir serta pelunakan diambil dari area proses WTP (Water Treatment Plant). Lini sistem pengairan dapat dilihat pada Lampiran1.
Kajian dilanjutkan dengan menganalisa kebutuhan klorin (chlorine demand) pada tangki penampung air akhir untuk menentukan dosis klorin yang ditambahkan. Sampel air diambil dari area proses WTP untuk air yang sudah melalui proses penyaringan karbon dan pasir serta pelunakan. Debit air pada saat kajian adalah 17 m3/jam, sampel diambil dari tangki penampungan air akhir kapasitas 11 m3. Analisa klorin demand ini dilakukan dengan metode perhitungan kebutuhan klorin untuk menentukan titik patah klorinasi (break point chlorination).
Setelah diketahui jumlah chlorine demand, dicoba 3 konsentrasi dosis klorin (1, 1.5 dan 2 ppm) yang ditambahkan pada proses pengolahan air. Analisa ini dilakukan dengan skala laboratorium, jumlah sampel yang dicoba sebanyak
500 ml untuk masing-masing 3 konsentrasi dosis klorin dan 1 sampel blanko (tanpa klorinasi). Parameter yang dianalisa adalah uji mikrobiologi (TPC, MPN Coliform, Salmonella dan Pseudomonas).
Dari dosis klorin yang diperoleh kemudian dilakukan proses pengujian skala produksi dengan waktu kontak 30 menit terhadap air proses WTP. Pengujian ini dilakukan di WTP pada Storage Treated Water Tank dengan kapasitas tangki 11 m3. Proses pemberian larutan stok klorin pada pengamatan ini dilakukan secara manual, larutan stok klorin dituang pada tangki pada saat tangki setengah penuh dengan debit air 17m3/jam.
Penyiapan Sanitation Standard Operating Procedure (SSOP) Kebersihan Permukaan yang Kontak dengan Makanan
Tahapan ini bertujuan untuk menyiapkan SSOP kebersihan permukaan yang kontak dengan makanan yang akan diterapkan pada peralatan, bahan kemas dan ruangan yang digunakan dalam proses pengolahan dan pengemasan aseptik. Pada tahapan ini terlebih dahulu dilakukan pembuatan draft SSOP kebersihan permukaan yang kontak dengan makanan.
Dalam sistem aseptik, proses produksi dilakukan dalam sistem tertutup. Kebersihan dan sanitasi peralatan yang kurang baik dapat mempengaruhi mutu dan keamanan produk akhir. Jadi, kajian pada tahap ini adalah penentuan jumlah dan konsentrasi larutan pada proses pembersihan di tempat (clean in place : CIP) mesin.
Pada tahap ini dilakukan pengujian terhadap jumlah dan konsentrasi basa, asam dan sanitaiser (campuran klorin dan amonium kuartener) serta lamanya holding time yang akan digunakan dalam proses CIP. Pengujian dilakukan dengan melakukan proses CIP sejumlah total 1800 liter larutan, termasuk didalamnya air yang digunakan untuk pre-wash dengan air panas. Keseluruhan proses dimulai dari area penuangan bahan, mixing, pasteurisasi hingga mesin pengemasan. Setiap jenis larutan disirkulasi hingga larutan habis, kecuali untuk larutan sanitaiser, larutan ditahan pada holding tube selama 10 menit. Pengujian dilakukan terhadap air bilasan terakhir pada setiap interval perlakuan dengan mengukur kadar mikroorganisme total yang masih hidup (Total Plate Count : TPC).
Penyiapan Sanitation Standard Operating Procedure (SSOP) Pencegahan Kontaminasi Silang
Tahapan berikutnya adalah penyiapan SSOP sanitasi ruangan pengemasan agar kondisi aseptik pada saat pengemasan produk dalam wadah pengemas tercapai. Kondisi proses pengisian produk yang aseptik sangat menunjang proses pengolahan produk secara keseluruhan, agar tidak terjadi kontaminasi silang dari udara ke produk.
Dalam sistem pengemasan aseptik, untuk menjaga proses pengemasan dalam kondisi aseptik dapat dilakukan dengan menyaring udara yang masuk ke dalam area pengemasan (filtrasi) atau disinfeksi udara dengan sanitaiser. Desain proses sanitasi udara pada penelitian ini dilakukan dengan penyemprotan sanitaiser. Oleh karena itu, pada tahap ini dilakukan pengujian terhadap jumlah dan konsentrasi sanitaiser dan lamanya holding time yang akan digunakan dalam proses sanitasi ruang pengemas aseptik dengan metode pengembunan (fogging). Pengujian dilakukan dengan menggunakan fogger dengan kapasitas 1.5 liter larutan sanitaiser (campuran klorin dan amonium kuartener) pada ruangan pengemasan seluas 96 m2 dan ruang mesin pengemasan yang berada dalam ruang pengemasan. Lay out ruang proses Ready to Drink (RTD) ini dapat dilihat pada Lampiran 2.
Pengujian dilakukan dengan menguji total mikroba udara dengan menggunakan metode permukaan (Total Plate Count : TPC) untuk kondisi sebelum dan sesudah proses sanitasi. Waktu proses pengemasan diperkirakan paling lama 6 jam dari kondisi optimal jalannya mesin pengemasan (5900 botol per jam) dengan batch size sebesar 6 m3. Pengujian kondisi setelah fogging pada ruangan pengemasan dilakukan dengan interval waktu 2 jam sedangkan pada ruangan mesin pengemasan dengan interval waktu 1 jam. Pada saat pengujian, mesin dikondisikan hidup dengan setting sesuai kondisi proses sebenarnya. Penempatan Cawan Petri berisi agar Plate Count Agar (PCA) di ruangan pengemasan adalah di area yang masih kosong sedangkan di ruangan mesin pengemasan di bawah area pengisian produk.
Tahapan terakhir dari prinsip ini adalah penyiapan SSOP sanitasi bahan kemas sehingga diperoleh wadah yang steril untuk digunakan dalam pengemasan aseptik. Bahan kemas perlu disanitasi agar tidak terjadi kontaminasi silang dari bahan kemas ke dalam produk. Kemasan yang kontak
langsung dengan produk adalah botol dengan bahan plastik PET ukuran 140 ml dan tutup botol dengan bahan plastik PP diameter 28 mm. Oleh karena itu, pada tahap ini dilakukan pengujian terhadap konsentrasi dan jumlah sanitaiser yang akan digunakan dalam proses sanitasi botol dan juga pengujian terhadap sanitasi tutup botol menggunakan sinar UV. Botol tanpa perlakuan dianalisa kondisi mikrobiologinya (TPC) dengan metode bilas. Tutup botol tanpa perlakuan dianalisa kondisi mikrobiologinya dengan metode swab. Sampel botol dan tutup botol diambil dari 2 kali kedatangan dengan jumlah sampel mengikuti Military Standard 105 E. Pengujian sanitasi kemasan botol saat trial produksi dilakukan pada 2 kecepatan mesin filling untuk melihat efektivitas sanitasi. Botol dengan perlakuan sanitasi (rinsing) dengan jumlah dan konsentrasi sanitaiser (peracetic acid) yang telah ditetapkan dianalisa kondisi mikrobiologinya (TPC). Tutup botol dengan perlakuan penyinaran dengan sinar UV dikaji kondisi mikrobiologisnya (TPC).
Penyiapan Standard Operating Procedure (SOP) Pengendalian Proses dan Produk Akhir
Tahapan ini bertujuan untuk menyiapkan SOP pengolahan minuman RTD dengan proses pengolahan dan pengemasan aseptik. Untuk proses pengolahan dengan proses thermal, suhu referensi yang digunakan 85°C dengan nilai z 8.9°C dan nilai D = 0.5 menit. Untuk menghitung kecukupan proses pasteurisasi digunakan konsep 5D. Dengan mengatur kecepatan pompa di holding tube, maka holding time dapat dihitung.
Agar proses pasteurisasi bisa seimbang dengan proses pengemasan produk, maka ditentukan kecepatan optimum dari proses pengemasan produk. Dari kecepatan optimum proses pengemasan ini dapat diketahui debit aliran produk di PHE sehingga diketahui lamanya holding time. Dua variasi kombinasi suhu dan holding time ini akan dijadikan variabel untuk melihat kecukupan proses thermal.
Pengujian proses thermal dilakukan dengan trial produksi dengan batch size 1500 liter yang dibagi 2 untuk tiap variasi kombinasi suhu dan holding time. Produk hasil mixing dan hasil pasteurisasi dua variasi kombinasi suhu dan holding time dianalisa pH, kadar vitamin C dan parameter mikrobiologinya (TPC, MPN Coliform, Salmonella, S. aureus, Kapang dan Khamir). Parameter uji yang
akan dikaji pada produk jadi adalah pertumbuhan mikroorganisme setelah produk diinkubasi pada suhu 35°C selama 5, 10 dan 15 hari.
Metode Pengamatan
Penetapan Kadar Sisa Klorin (Klorin Bebas) Metode Spektofotometri (SNI 01-3554-2006; Cara Uji Air Minum Dalam Kemasan) (BSN 2006b)
Bila N, N-dietil-p-fenilendiamin (DPD) sebagai indikator dibubuhkan pada suatu larutan mengandung sisa klor aktif (bebas) akan membentuk warna merah. Warna yang terjadi dapat diukur dengan spektrofotometer pada panjang gelombang 515 nm.
Sebelum digunakan, spektrofotometer dikalibrasi dengan air. Kemudian dilakukan pembuatan kurva standar menggunakan larutan klorin standar yang mempunyai konsentrasi 0.05 mg/l – 4.0 mg/l. Jumlah contoh yang akan ditetapkan disesuaikan dengan kepekaan spektrofotometer. Sejumlah 0.5 ml buffer fosfat dimasukkan ke dalam tabung kuvet dan diberi beberapa tetes indikator DPD, kemudian ditambahkan sebanyak 10 ml contoh dan dikocok. Absorbansi dibaca pada panjang gelombang 515 nm. Pembacaan ini akan menunjukkan jumlah klorin bebas.
Perhitungan kebutuhan klorin (chlorine demand) (American Water Works Association; Greenberg et al. 2005)
Sebanyak 10 bagian contoh dengan jumlah yang sebanding dimasukkan ke dalam botol-botol bertutup berukuran 1000 ml dan berwarna coklat. Kemudian ditambahkan sejumlah klorin dengan dosis yang meningkat dengan pengadukan (0.1-1 mg/l untuk kebutuhan klorin yang rendah dan 1-10 mg/l untuk kebutuhan klorin yang tinggi). Waktu kontak dan kondisi suhu disamakan seperti yang dilakukan di proses. Selama periode kontak, contoh dilindungi dari sinar matahari langsung. Pada akhir periode kontak, total sisa klorin dihitung dengan metode spektrofotometri.
Jumlah klorin yang dibutuhkan (chlorine demand) merupakan selisih antara dosis klorin yang ditambahkan dan sisa klorin. Grafik yang menghubungkan
antara dosis klorin (sumbu x) dan sisa klorin (sumbu y) dibuat untuk menentukan break point chlorination.
Perhitungan Total Mikroba Metode APC (Aerobic Plate Count, Pour Plate) (Bacteriological Analytical Manual Online; USFDA 2001)
Dengan pipet steril, sampel diambil dari campuran yang sudah disiapkan dengan pengenceran 10-2, 10-3, 10-4 dan pengenceran lain dengan mengambil 10 ml pengenceran sebelumnya ke dalam 90 ml larutan pengencer. Pengambilan sampel berbentuk busa harus dihindari. Campuran dikocok sebanyak 25 kali dalam jangkauan 30 cm selama 7 detik. Kemudian dipipet sebanyak 1 ml tiap campuran ke dalam petri terpisah yang tepat dan sudah diberi tanda dan dilakukan duplo. Pengocokan dilakukan kembali jika campuran tidak diambil sampelnya lebih dari 3 menit. Plate count agar (PCA, suhu 45 ± 1°C) ditambahkan sebanyak 12-15 ml ke masing-masing petri dalam waktu 15 menit dari campuran asal. Campuran sampel dan agar segera dicampur hingga seragam dengan menggerakkan petri rotasi bolak-balik dan gerakan maju-mundur pada permukaan yang rata kemudian agar dibiarkan membeku. Petri yang sudah dingin dibalikkan dan diinkubasikan dengan benar selama 48 ± 2 h pada suhu 35°C. Petri jangan ditumpuk ketika agar dituang atau ketika agar dibekukan.
Untuk menghindari impresi fiksi dari akurasi dan ketepatan analisa, dilaporkan hanya dua angka penting pertama. Jika dari semua pengenceran tidak ada koloni yang tumbuh, APC dilaporkan sebagai kurang dari 25 koloni. Angka kedua dibulatkan ke atas jika digit ketiga adalah angka 6, 7, 8, atau 9; dan dibulatkan ke atas jika digit ketiga adalah angka 1, 2, 3 atau 4. Jika digit ketiga adalah angka 5, dibulatkan ke atas jika digit kedua adalah angka ganjil dan dibulatkan ke bawah jika digit kedua adalah angka genap.
1. Petri dengan jumlah koloni 25-250 a. APC dihitung dengan rumus :
N = C / [ (1 * n1) + (0.1 * n2) ] * (d)
Dimana :
N = Jumlah koloni per ml atau g produk
C = Jumlah koloni pada semua petri yang dihitung
n2 = Jumlah petri pada pengenceran kedua yang dihitung
d = Pengenceran dimana hitungan pertama diperoleh
b. Jika hitungan dari salah satu petri diluar dari kisaran 25-250, digunakan hanya data yang berasal dari kisaran ini.
2. Semua petri dengan jumlah koloni kurang dari 25, dilaporkan jumlah aktual koloni sebagai kurang dari 25 x 1/d (d adalah faktor pengenceran dimana hasil hitungan diperoleh)
3. Jika petri dari dua pengenceran hasil hitungan koloninya masing-masing lebih dari 250 (tapi kurang dari 100/cm2), hasilnya ditentukan dari hitungan yang mendekati 250 x 1/d (d adalah faktor pengenceran dimana hasil hitungan diperoleh)
4. Seluruh petri dengan koloni menyebar dan atau koloni karena insiden lab dilaporkan sebagai Spreader (SPR) atau Laboratory Accident (LA)
5. Seluruh petri dengan rata-rata lebih dari 100/cm2. APC dientukan sebagai lebih dari 100 x pengenceran tertinggi x luas area petri.
Perhitungan Total Mikroba Metode Permukaan (Surface Plate)
Cawan petri disiapkan dengan media PCA yang telah disteril dan dibiarkan beku. Petri ditempatkan dalam keadaan terbuka selama 10 menit di area yang dikehendaki, setelah selesai petri ditutup. Petri diInkubasikan selama 48 ± 2 h pada suhu 35°C dan koloni dihitung mengikuti metode APC (USFDA 2001).
Perhitungan Total Mikroba Metode Bilas
Sebanyak 20-100 ml larutan pengencer steril dituangkan ke dalam kemasan botol yang hendak diuji, kemudian dikocok agar homogen. Sebanyak 1 atau 0.1 ml sampel dipipet ke dalam cawan petri steril, kemudian dimasukkan PCA cair dan diinkubasikan selama 48 ± 2 h pada suhu 35°C dan koloni dihitung mengikuti metode APC (USFDA 2001).
Perhitungan Total Mikroba Metode Oles (Swab)
Swab diperas dengan cara menekankan pada dinding tabung bagian atas sambil diputar-putar. Swab dioleskan pada permukaan yang dikehendaki,
kemudian swab dimasukkan kembali ke dalam tabung, diaduk dan tabung diputar menggunakan kedua tangan selama 2 menit. Swab diperas kembali pada dinding tabung, kemudian dikeluarkan dari tabung. Sebanyak 1 atau 0.1 ml sampel dipipet ke dalam cawan petri steril kemudian dimasukkan PCA cair dan diinkubasikan selama 48 ± 2 h pada suhu 35°C dan koloni dihitung mengikuti metode APC (USFDA 2001).
Perhitungan Bakteri Coliform Metode APM (Angka Paling Mungkin) (SNI 01-2897-1992, Cara Uji Cemaran Mikroba) (BSN 1992)
Pada pengujian MPN Coliform digunakan medium Lactose Broth atau MacConkey Broth tergantung sampel yang akan dianalisa. Pada pengamatan ini digunakan Lactose Broth (single dan double strength) dengan analisis Tabung Seri 5. Sebanyak 10 ml sampel dipipet ke dalam 5 tabung berisi 10 ml Lactose broth double strength. Kemudian dipipet sebanyak 1 dan 0.1 ml sampel ke dalam 5 tabung yang kedua dan ketiga yang berisi 5 ml Lactose broth single strength.
Semua tabung reaksi diberi kode dan diinkubasi pada suhu 36+1°C selama 24-48 jam. Setelah 24 jam, catat tabung yang membentuk gas pada masing-masing pengenceran kemudian diinkubasikan kembali tabung yang tidak membentuk gas pada suhu 36+1°C selama 24 jam. Jumlah tabung yang membentuk gas dicatat. Nilai MPN Coliform dapat dihitung dengan melihat pada tabel MPN (Most Probable Number atau Angka Paling Mungkin disingkat APM).
Untuk uji konfirmasi, sebanyak 1 sengkelit dari tiap tabung yang membentuk gas dipindahkan pada media Lactose Broth ke dalam tabung berisi 10 ml media Brilliant Green Lactose Bile Broth 2% (BGLBB 2%). Semua tabung dimasukkan ke dalam inkubator suhu 36+1°C selama 24-48 jam. Adanya gas pada tabung BGLBB memperkuat adanya bakteri koliform dalam contoh. Angka Paling Mungkin dari Coliform dilihat pada b Daftar APM Coliform.
Perhitungan Bakteri Staphylococcus aureus Metode Plate Count (SNI 01-2897-1992, Cara Uji Cemaran Mikroba) (BSN 1992)
Pengujian bakteri Staphylococcus aureus menggunakan media Baird-Parker Agar (BPA) dengan pengujian lanjutan dengan uji koagulase. Sebanyak 0.1 ml sampel dari setiap pengenceran dipipet ke atas permukaan BPA dan
sebarkan merata dengan menggunakan spreader. Keringkan permukaan agar sebelum diinkubasi pada suhu 36+1°C selama 30-48 jam. Pilih cawan Petri yang mengandung koloni 20-200 dan hitung tersangka koloni Staphylococcus aureus yaitu koloni berwarna hitam mengkilat dengan lingkaran cerah di sekelilingnya. Pemeriksaan dilanjutkan dengan uji koagulase.
Koloni tersangka dipindahkan ke dalam tabung berisi 5 ml Brain Heart Infusion (BHI) Broth kemudian diinkubasikan pada suhu 36+1°C selama 20-24 jam. Plasma darah kelinci sebanyak 0.3 ml disiapkan dalam tabung steril dan ditambahkan sebanyak 0.1 ml biakan dalam BHI Broth yang berumur 1 malam, kemudian diinkubasikan pada suhu 36+1°C selama 2-6 jam. Amati ada tidaknya koagulasi, bila tidak ada koagulasi inkubasi dilanjutkan pada suhu kamar selama 24 jam dan diamati kembali ada tidaknya koagulasi. Jumlah Staphylococcus aureus dihitung dalam 1 gram atau 1 ml contoh yang memberikan reaksi koagulase positif (jumlah koloni dalam cawan dikalikan factor pengenceran).
Pengujian Bakteri Salmonella (SNI 01-2897-1992, Cara Uji Cemaran Mikroba) (BSN 1992)
Prinsip metode ini adalah pertumbuhan Salmonella pada perbenihan selektif yang dilanjutkan dengan uji biokimia dan uji serologi.
Pra-pengkayaan : sampel yang telah dihomogenasi dipindahkan secara aseptik ke dalam botol 500 ml kemudian diinkubasikan pada suhu 36+1°C selama 16-20 jam.
Pengkayaan : Sebanyak 10 ml biakan pra-pengkayaan dipipet ke dalam 100 ml Selenite Cystine Broth kemudian diinkubasikan pada suhu 36+1°C selama 24 jam. Sebanyak 10 ml biakan pra-pengkayaan dipipet ke dalam 100 ml Tetrathionate Brilliant Green Broth kemudian diinkubasikan pada suhu 43°C selama 24 jam.
Penanaman pada perbenihan selektif : biakan pengkayaan dipindahkan dengan cara menggoreskan masing-masing biakan dengan sengkelit ke dalam cawan petri yang berisi BGA dan BSA atau perbenihan lainnya (XLD, HE agar, SS agar) kemudian diinkubasikan pada suhu 37°C selama 24 jam. Tersangka koloni Salmonella diamati pada media dengan ciri-ciri spesifik masing-masing media. Konfirmasi (Uji Biokimia) : Sebanyak 2-5 koloni tersangka dipilih dan digoreskan pada permukaan NA dalam cawan Petri kemudian diinkubasikan pada suhu 37°C
selama 20-24 jam. Dari koloni yang diisolasi pada NA kemudian dipindahkan ke dalam media TSI agar, urea agar, lysine decarboxylation medium, beta-galactosidase reagent, V.P. medium dan Indol medium. Perubahan yang terjadi diamati dengan ciri-ciri spesifik pada masing-masing media.
Uji serologi : uji serologi dilakukan bila reaksi biokimia menunjukkan ada Salmonella. Sebanyak 1 sengkelit biakan dari TSI agar diambil dan dioleskan pada gelas sediaan kemudian diteteskan sedikit antisera di samping biakan. Dengan menggunakan sengkelit, tetesan antisera dicampur dengan kultur hingga homogen. Penggumpalan yang terjadi menunjukkan uji positif. Jika reaksi biokimia menunjukkan adanya Salmonella dan uji serologi positif, maka Salmonella dinyatakan positif.
Perhitungan Pseudomonas aeruginosa (SNI 01-6241-2000, Air Demineral) (BSN 2000)
Prinsip metode ini adalah pertumbuhan P. aeruginosa pada penyaringan membrane dengan penampakan rata dengan pinggiran luar terang/cerah dan bintik coklat sampai hijau hitam di tengah setelah diinkubasi pada suhu 41.5 + 0.5°C selama 72 jam dalam pembenihan yang cocok.
Uji Pendugaan : peralatan penyaring membrane yang terdiri dari corong, membrane penyaring dan penampung yang telah disterilkan lebih dahulu dipasang dan dihubungkan dengan sistem vakum. Sebanyak 200 ml contoh dimasukkan ke dalam corog dari alat penyaring dengan menggunakan pipet atau gelas ukur steril. Vakum digunakan untuk menyaring sampel. Seluruh permukaan dalam corong penyaring dibilas dengan air pengencer atau air suling steril yang jumlahnya sama dengan jumlah sampel yang disaring kemudian cairan pembilas disaring. Vakum dihentikan dan peralatan penyaring dibuka kembali. Membrane penyaring diambil dengan pinset steril kemudian diletakkan di atas perbenihan M-PA (diusahakan tidak ada gelembung udara di bawah membran). Inkubasikan pada posisi terbalik pada suhu 41.5 + 0.5°C selama 72 jam. Amati koloni yang diduga P. aeruginosa dengan ciri-ciri sebagai berikut : koloni dengan diameter 0.8-2.2 mm, penampakan rata dengan pinggiran luar terang dan bintik coklat sampai hijau hitam di tengah. Koloni yang diduga dihitung dari membran penyaring yang mengandung 20-80 koloni.
Uji Penegasan : koloni yang diduga digores di atas permukaan perbenihan agar susu sepanjang 2-4 cm kemudian diinkubasi dengan posisi terbalik pada suhu 35 + 1.0°C selama 24 jam. P. aeruginosa menghidrolisis kasein dan menghasilkan diffusible pigment yang berwarna kuning sampai hijau.
Perhitungan Kapang dan Khamir (SNI 01-2897-1992, Cara Uji Cemaran Mikroba) (BSN 1992)
Prinsip metode ini adalah perhitungan kapang dan khamir dalam media yang cocok, setelah diinkubasikan pada suhu 25°C atau suhu kamar selama 5 hari. Sebanyak 1 ml masing-masing pengenceran dipipet ke cawan Petri steril secara simplo-duplo. PDA yang telah dicairkan atau perbenihan lainnya (suhu 45+1°C) dituangkan sebanyak 15-20 ml ke dalam cawan petri dan cawan petri digoyangkan sedemikian rupa sehingga campuran tersebar merata. Setelah membeku, cawan petri dibalikkan dan diinkubasikan pada suhu 25°C atau suhu kamar selama 5 hari. Koloni kapang dan khamir dihitung setelah 5 hari (koloni kapang biasanya buram dan berbulu sedangkan koloni khamir berwarna putih, licin dan berbau asam).
Pengukuran pH dengan pH meter
Sebelum digunakan elektroda selalu dibilas dulu dengan air destilata dan dikeringkan. Kalibrasi pH meter dilakukan dengan buffer pH 4 dan pH 7. Setelah pH meter siap digunakan, elektroda dimasukkan ke dalam sampel hingga elektoda terendam. Hasil pengukuran pH sampel dibaca setelah display pH meter stabil. Elektroda dibilas dengan air destilata, dikeringkan kemudian disimpan kembali ke tempatnya semula.
Pengukuran Kadar Vitamin C Metode High Performance Liquid
Chromatography (HPLC)
Persiapan Larutan Standar
Ditimbang dengan teliti sebanyak 50 mg Vitamin C standar, lalu dilarutkan dalam labu ukur menjadi 250 ml dengan air demineralisasi. Sebanyak 5.0 ml dan 10 ml larutan tersebut dipipet ke dalam masing-masing labu ukur 100 ml,
kemudian diencerkan hingga menjadi 100 ml. Kemudian masing-masing larutan standar disaring menggunakan membrane filter 0.45 μm. Hasil saringan awal digunakan untuk membilas, dan hasil saringan selanjutnya siap digunakan untuk injekdi ke HPLC.
Persiapan Larutan Contoh untuk Produk
Ditimbang dengan teliti sejumlah contoh sesuai dengan tabel, kemudian dilarutkan dalam labu ukur 50 ml dengan air demineralisasi hingga 3/4 nya volume labu ukur . Ditambahkan 1.0 ml larutan Carrez I dan 1.0 ml larutan Carrez II. Campuran kemudian di aduk dan Ultrasonic selama 5 menit.. Kemudian campuran diencerkan kembali dengan air demineralisasi hingga menjadi 50 ml. Larutan kemudian di sentrifugasi dengan kecepatan 2000 rpm selama 10 menit, lalu diambil larutan jernihnya untuk kemudian disaring menggunakan membrane filter 0.45μm. Hasil saringan awal digunakan untuk membilas, dan hasil saringan selanjutnya siap digunakan untuk injekdi ke HPLC.
Kondisi HPLC
HPLC dikondisikan dengan parameter berikut : - Kecepatan Aliran : 1,0 ml per menit. - Tekanan : ± 68 kg f / cm2. - Panjang Gelombang : 268 nm. - Ukuran Contoh : 20μl. Perhitungan
Kadar Vitamin C dalam contoh dihitung dengan membandingkan luas area peak / tinggi peak contoh dan luas area peak / tinggi peak standar.
A Cth C Std % Vitamin C =
A Std X C Cth X 100 %
A cth : luas area /tinggi peak contoh A std : luas area/tinggi peak standar C std : Konsentrasi standar
C cth : Konsentrasi contoh
Keseluruhan analisa dalam pengujian ini dilakukan dengan dua kali ulangan dan masing-masing ulangan dianalisa duplo.