OPTIMASI KONSTANTA KINETIKA PENYERAPAN OBAT
PADA MODEL COMPARTMENT ABSORPTION AND TRANSIT
MENGGUNAKAN ALGORITMA PARTICLE SWARM
OPTIMIZATION
KEMAL PRABOWO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Optimasi Konstanta Kinetika Penyerapan Obat pada Model Compartment Absorption and Transit Menggunakan Algoritma Particle Swarm Optimization adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2016
Kemal Prabowo
RINGKASAN
KEMAL PRABOWO. Optimasi Konstanta Kinetika Penyerapan Obat pada Model
Compartment Absorption and Transit Menggunakan Algoritma Particle Swarm Optimization. Dibimbing oleh AGUS KARTONO dan TONY IBNU SUMARYADA.
Simulasi konstanta laju kinetika obat pada pemodelan obat oral Compartment
Absorption and Transit (CAT) menggunakan algoritma Particle Swarm Optimization
(PSO) algoritma telah dilakukan. Penelitian ini melakukan optimasi nilai konstanta laju kinetika obat oral menggunakan algoritma PSO untuk mendapatkan nilai konstanta transport terbaik pada persamaan CAT yang dapat memprediksi konsentrasi obat dalam plasma terhadap waktu. Nilai dari konstanta laju kinetika obat atenolol dengan dosis 25 mg/kg bobot badan (BB), 50 mg/kg BB dan 100 mg/kg BB adalah
K10, K12, K21, K13 dan K31 dengan masing-masing nilai untuk dosis 25 mg/kg BB adalah
0.8195, 0.4689, 0.1203, 0.8382 dan 1.000; 50 mg/kg BB adalah 0.8370, 0.8463, 0.2789, 0.2370, dan 1.000; 100 mg/kg BB adalah 0.8061, 0.8004, 0.2316, 0.4532, dan 1.000 telah diperoleh sehingga meningkatkan nilai koefisien determinasi (R2) dan korelasi (R) dari model CAT.
Data eksperimen konsentrasi plasma obat yang digunakan adalah Atenolol, koefisien determinasi (R2) yang diperoleh dari simulasi atenolol 25 mg/kg BB tanpa PSO adalah 0.8170 dan dengan PSO adalah 0.9228; Atenolol 50 mg/kg BB tanpa PSO adalah 0.8125 dan dengan PSO adalah 0.9318; Atenolol 100 mg/kg BB tanpa PSO adalah 0.9108 dan tanpa PSO adalah 0.9622. Hasil dari pemodelan dengan dan tanpa menggunakan algoritma PSO menghasilkan pola grafik yang tidak jauh berbeda antara hasil simulasi dengan data eksperimen sehingga dapat juga dilihat dari nilai korelasi (R) yang didapatkan pada variabel konstanta laju kinetika untuk semua subjek melebihi 0.9 dimana model diusulkan cocok dengan data eksperimen. Berdasarkan hasil simulasi konstanta laju kinetika obat model CAT dengan bantuan PSO dapat memprediksi konsentrasi obat pada plasma lebih baik daripada model CAT tanpa pengunaan PSO.
Kata kunci: Atenolol, Compartment Absorption and Transit, Farmakokinetik, Obat oral, Particle Swarm Optimization
SUMMARY
KEMAL PRABOWO. Constant Optimization Of Oral Drug Absorption Kinetics in The Compartment Absorption and Transit Models Using Particle Swarm Optimization Algorithm. Guided by AGUS KARTONO and TONY IBNU SUMARYADA.
Simulation of kinetic rate constants in oral drug Compartment Absorption and Transit (CAT) model using an algorithm Particle Swarm Optimization (PSO) algorithm has been performed. This research will be carried out optimization of kinetic constant value oral drug use PSO algorithm to obtain the best transport constant values for CAT equation that can predict drug concentration in plasma against time. The value of the rate constant kinetics of the drug atenolol 25 mg / kg body weight (BW), 50 mg/kg and 100 mg/kg is K10, K12, K21, K13 and K31 with respective values for drug dosage 25 mg / kg BW is 0.8195, 0.4689, 0.1203, 0.8382 and 1.000; 50 mg / kg was 0.8370, 0.8463, 0.2789, 0.2370, and 1.000; 100 mg/kg was 0.8061, 0.8004, 0.2316, 0.4532, and 1.000 have been obtained thus increasing the coefficient of determination (R2) and correlation (R) of the model CAT.
Experimental data plasma concentrations of the drug used is Atenolol, the coefficient of determination (R2) obtained from simulation atenolol 25 mg / kg body weight without PSO is 0.8170 and using PSO is 0.9228; Atenolol 50 mg/kg body weight without PSO is 0.8125 and using PSO is 0.9318; Atenolol 100 mg/kg body weight without PSO is 0.9108 and using 0.9622. The results of modeling with and without using the algorithm PSO produce a chart pattern that is not much different between the simulation results with experimental data so that it can also be seen from the correlation value (R) obtained in the variable rate constant kinetics for all subjects exceeds 0.9 where a model is proposed to fit the data experiment. Based on the simulation results of drug kinetic rate constants CAT modelswith the use of PSO can predict drug concentration in plasma better than CAT models without the use of PSO.
Keywords: Atenolol, Compartment Absorption and Transit, Oral Drug, Particle
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biofisika
OPTIMASI KONSTANTA KINETIKA PENYERAPAN OBAT
PADA MODEL COMPARTMENT ABSORPTION AND TRANSIT
MENGGUNAKAN ALGORITMA PARTICLE SWARM
OPTIMIZATION
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2014 ini ialah farmakokinetika, dengan judul Optimasi Konstanta Kinetika Penyerapan Obat pada Model Compartment Absorption and Transit Menggunakan Algoritma Particle
Swarm Optimization.
Terima kasih penulis ucapkan kepada Bapak Dr Agus Kartono dan Bapak Dr Tony Ibnu Sumaryada selaku pembimbing, serta Ibu Dr Laksmi Ambarsari yang telah banyak memberi saran. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2016
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi 1 PENDAHULUAN 1 Latar Belakang 1 Perumusan Masalah 2 Tujuan Penelitian 2 Manfaat Penelitian 2Ruang Lingkup Penelitian 2
2 TINJAUAN PUSTAKA 2
Kinetika Obat pada Tubuh 2
Model Compartment Absorption and Transit 4
Atenolol 6
Model Terbuka Tiga Kompartemen 6
Particle Swarm Optimization 7
3 METODE 8
Alat 8
Prosedur Analisis Data 8
Modifikasi Persamaan CAT di Usus Halus 9
Solusi Persamaan CAT di Usus Halus 9
Analisis Hasil Keluaran 11
4 HASIL DAN PEMBAHASAN 11
Prediksi Konsentrasi Obat pada Plasma 12
5 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 21
DAFTAR TABEL
1 Parameter persamaan model CAT 6
2 Parameter model terbuka tiga kompartemen 7
3 Parameter hasil simulasi model CAT terbuka tiga kompartemen 13
DAFTAR GAMBAR
1 Mekanisme obat dalam tubuh 3
2 Transit linier dan kinetika absorpsi pasif pada model Compartment
Absorption and Transit (CAT) 4
3 Skema model terbuka tiga kompartemen dengan eliminasi kompartemen
sentral 7
4 Model CAT tanpa PSO obat atenolol 25 mg/kg BB, R2=0.8170 15 5 Model CAT tanpa PSO obat atenolol 50 mg/kg BB, R2=0.8125 15 6 Model CAT tanpa PSO obat atenolol 100 mg/kg BB, R2=0.9108 15 7 Model CAT dengan PSO obat atenolol 25 mg/kg BB, R2=0.9228 16 8 Model CAT dengan PSO obat atenolol 50 mg/kg BB, R2=0.9318 16 9 Model CAT dengan PSO obat atenolol 100 mg/kg BB, R2=0.9622 17
DAFTAR LAMPIRAN
1 Data eksperimen konsentrasi obat atenolol 22 2 Listing program matlab R2014a untuk persamaan CAT obat atenolol 23
1 PENDAHULUAN
Latar BelakangObat adalah semua zat baik dari alam seperti hewan maupun tumbuhan atau kimiawi yang dalam takaran (dosis) yang tepat dan dapat menyembuhkan, meringankan, atau mencegah penyakit. Adapun cara pemberian obat dapat secara oral, parental, topikal dan inhalasi. Hal tersebut didasarkan pada bentuk atau desain obat serta efek yang diinginkan baik fisik maupun mental (Richard and Miller 2014).
Proses farmakokinetik yang pertama dialami obat adalah proses absorpsi. Absorpsi merupakan perpindahan obat atau molekul obat dari tempat aplikasinya untuk menuju ke sirkulasi sistemik. Agar obat dapat diabsorpsi, zat bahan aktif obat harus dilepas dari bentuk sediaannya. Absorpsi obat dalam tubuh melalui saluran pencernaan sangat kompleks dan sering tidak terkarakterisasi dengan baik. Absorpsi obat secara oral dipengaruhi oleh karakteristik obat itu sendiri dan fisiologi sistem pencernaan yang meliputi pelarutan obat atau terlepas dari bentuk dosis, cara di mana obat tersebut akan berinteraksi dengan membran dan lingkungan yang encer, serta penghapusan irreversibel oleh organ yang sekali dilewatkan misalnya usus halus, dan hati. Sehingga berdasarkan kompleksitas dan keheterogenan absorpsi obat dalam sistem saluran pencernaan, model matematika telah dikembangkan untuk memperkirakan absorpsi obat secara oral serta mempelajari satu atau semua proses yang bersangkutan dengan absorpsi obat secara oral, yaitu model Compartment Absorption and Transit (CAT). Model
Compartment Absorption and Transit (CAT) dibuat untuk mendeskripsikan aliran
transit obat pada usus halus manusia. Model ini dapat menjelaskan persoalan kinetika obat, konsentrasi plasma dan memperkirakan absorpsi obat secara oral (Yu et al. 1996).
Metode optimasi yang umum digunakan adalah metode Genetic Algorithms (GAs) dan Particle Swarm Optimization (PSO). Dalam mengoptimasi nilai konstanta mikroskopik transfer obat pada model Compartement Absorption and
Transit (CAT), peneliti menggunakan metode optimasi Particle Swarm Optimization (PSO). Metode PSO merupakan metode optimasi yang terinspirasi
oleh perilaku hewan ternak seperti gerakan ikan, hewan herbivora dan segerombolan burung. Setiap objek hewan nantinya akan dianggap sebagai partikel dan sebuah partikel dalam ruang memiliki posisi yang dikodekan sebagai kordinat vektor (Kennedy dan Eberhart 1995). Vektor posisi ini akan dianggap sebagai keadaan yang ditempati oleh partikel dalam ruang pencarian. Alasan peneliti menggunakan metode PSO karena memiliki kelebihan diantaranya, mudah diimplementasikan dan hanya membutuhkan sedikit parameter, PSO lebih efisien karena membutuhkan sedikit komputasi. Jika dibandingkan GAs dan metode heuristik lainnya, PSO lebih fleksibel dalam menjaga keseimbangan antara pencarian global dan lokal terhadap pencarian ruangnya. Oleh karena itu, PSO telah menjadi optimizer populer dan telah banyak diterapkan dalam pemecahan masalah (Kennedy 2001). Untuk saat ini masih belum ada penelitian yang melakukan optimasi konstanta mikroskopik transfer obat dengan menggunakan PSO, sehingga hal ini memandu peneliti untuk mengoptimasi model Compartment Absorption and
2
kinetika obat dari suatu kompartemen ke kompartemen lainnya. Aplikasi penentuan parameter farmakokinetik sangat luas dan penting, salah satunya dapat menentukan atau merancang aturan dosis secara individual sehingga meminimalkan kemungkinan efek sampingnya.
Dengan demikian, untuk memahami fenomena dan proses farmakokinetik diatas, perlu dipelajari proses-proses yang terjadi pada model Compartment
Absorption and Transit (CAT). Dalam penelitian ini akan dilakukan perumusan
ulang model Compartment Absorption and Transit (CAT) dalam menentukan parameter farmakokinetik yaitu konstanta laju kinetika obat menggunakan metode PSO dengan asumsi beberapa parameter penting seperti pH yang dianggap netral serta tidak meninjau efek disolusi obat.
Perumusan Masalah Adapun perumusan masalah dari penelitian ini adalah:
1. Bagaimana algoritma PSO dapat mengoptimalkan model CAT dan memprediksikan obat pada plasma?
2. Bagaimana prediksi konsentrasi plasma yang dihasilkan model CAT dengan dan tanpa menggunakan algoritma PSO?
3. Apakah penggunaan algoritma PSO pada model CAT di usus halus memberikan prediksi yang lebih mendekati hasil eksperimen?
Tujuan Penelitian
Tujuan penelitian ini adalah mempelajari kinematika absorpsi obat oral menggunakan model CAT yang dioptimasi oleh algoritma PSO.
Manfaat Penelitian
Dengan bantuan algoritma PSO pada model CAT termodifikasi ini diharapkan mampu memberikan gambaran yang tepat mengenai aktivitas farmakokinetik serta memprediksi konsentrasi obat oral yang diperlukan.
Ruang Lingkup Penelitian
Pada penelitian ini, ruang lingkup penelitian meliputi sistem kinetika obat, persamaan diferensial orde satu dan teori optimasi menggunakan algoritma Particle Swarm Optimization (PSO) untuk obat yang diaministrasi secara oral berdasarkan model Compartment Absorption and Transit (CAT).
2 TINJAUAN PUSTAKA
Kinetika Obat pada Tubuh
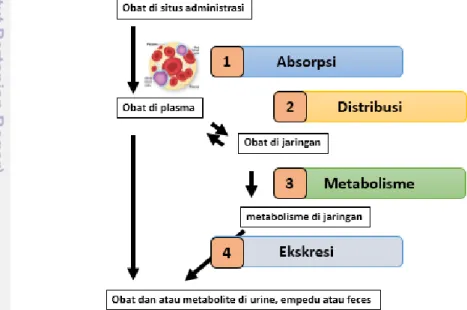
Farmakokinetik adalah ilmu yang membahas mengenai aktivitas kinetika suatu obat dalam tubuh. Farmakokinetik mencakup empat proses, yaitu proses absorpsi, distribusi, metabolisme dan ekskresi (Wagner 1993). Gambar 1
3 menerangkan kinetika obat di dalam tubuh. Absorpsi merupakan proses masuknya obat ke dalam darah melalui saluran cerna, kulit, otot dan lain-lain. Cakupan absorpsi obat meliputi proses obat masuk ke dalam tubuh hingga masuk ke sistem sirkulasi darah. Pada tahap ini, obat akan diabsorpsi dengan metode transpor aktif dan transpor pasif. Kecepatan absorpsi meningkat apabila pembatas antara obat aktif dan sirkulasi sistemik hanya memiliki sedikit sel. Beberapa faktor yang mempengaruhi absorpsi obat diantaranya aliran darah ke tempat absorpsi, luas permukaan tempat absorpsi dan waktu kontak permukaan absorpsi (Yu et al. 1995). Proses selanjutnya setelah absorpsi adalah distribusi obat, dimana obat akan dihantarkan ke suatu jaringan atau cairan dalam tubuh. Setelah sampai ke aliran darah, obat akan terdistribusi ke organ berdasarkan jumlah aliran darahnya. Beberapa organ yang memiliki aliran darah terbesar adalah jantung, hati dan ginjal (Mathias dan Hussain 2010), sedangkan untuk aliran darah yang lebih lambat meliputi kulit, lemak dan otot. Setelah melewati tahapan ini, obat akan mengalami metabolisme atau biotransformasi dimana tubuh akan merubah komposisi obat sehingga menjadi lebih larut air untuk dapat dibuang dari tubuh. Obat akan bermetabolisme melalui dua cara yaitu menjadi metabolit inaktif kemudian dieksresikan atau mejadi metabolit aktif dengan artian obat akan memiliki kerja famakologi tersendiri dan memiliki metabolisme lanjutan (Shargel et al. 2012). Tujuan utama metabolisme obat adalah mengubah obat yang larut lemak menjadi larut air agar dapat diekskresikan melalui empedu atau ginjal.
Gambar 1 Mekanisme obat dalam tubuh (Shargel et al. 2012)
Tahapan terakhir dari kinetika obat adalah ekskresi. Obat akan mengalami proses eliminasi atau pembuangan dari tubuh. Proses ini terjadi di tubuh oleh ginjal dan melalui urin. Obat juga dapat tereliminasi melalui eksokrin seperti keringat, saliva dan kulit. Organ terpenting ekskresi obat adalah ginjal. Eksresi obat dapat berupa bentuk utuh atau bentuk aktif melalui ginjal. Ekskresi melalui ginjal melibatkan 3 proses yaitu filtrasi glomerulus, reabsorpsi dan augmentasi (Harvey 2012)
4
Model Compartment Absorption and Transit (CAT)
Model Compartment Absorption and Transit (CAT) dibuat untuk mendeskripsikan aliran transit obat pada usus halus manusia. Model ini menjelaskan bahwa obat melintasi sebuah deret segmen atau kompartemen pada usus halus dan setiap segmen diasumsikan dengan kinetika transfer linier. Tiap segmen memiliki volume dan laju aliran yang berbeda namun memiliki Kt (konstanta transit) yang sama (Yu et al. 1996).
Perbedaan asumsi dan model pada pembagian deretan segmen yang dipakai untuk mensimulasikan dan menjelaskan absorpsi obat secara oral akan mempengaruhi hasil tersimulasi. Pada model satu kompartemen, obat menganggap tubuh seperti satu ruang yang sama dimana obat secara tepat terdistribusi ke semua jaringan. Sedangkan pada model dua kompartemen, obat menganggap tubuh seperti dua bagian yaitu, kompartemen sentral dimana organ vital yang memiliki aliran darah yang cepat seperti hati dan ginjal dan kompartemen perifer dimana organ memiliki perfusi darah yang lambat seperti otot, lemak dan lainnya. Dalam model dua kompartemen akan terjadi proses distribusi. Proses distribusi ini tidak akan terlihat jelas pada model satu kompartemen. (Jambhekar and Breen 2009)
Pada model CAT yang disimulasikan dalam penelitian ini, saluran pencernaan dibagi menjadi tiga kompartemen yaitu lambung, usus halus dan usus besar. Pada usus halus manusia pembagian tujuh segmen juga diterapkan dengan tranfer obat dari satu segmen ke kompartemen lainnya terjadi pada orde pertama (Dokumetzidis et al. 2005).
Gambar 2 mendeskripsikan model CAT untuk menghitung aliran transit pada duodenum, lambung, jejunum, ileum dan usus besar (Yu et al. 1996). Saat obat masuk ke dalam tubuh obat tidak langsung diuraikan secara cepat, sehingga pemodelan transit dan absorpsi saluran pencernaan dapat dirumuskan sebagai berikut.
Gambar 2 Transit linier dan kinetika absorpsi pasif pada model
Compartment Absorption and Transit (CAT) (Yu et al.
5 Persamaan di lambung : ge s s s s T K M K dt dM 1 dimana, , (1)
Persamaan di usus besar:
, a t c M K dt dM (2)
Jumlah obat yang diabsorbsi oleh usus halus:
7 ,..., 1 , 7 1
n M K dt dM a n a a (3)Persamaan di usus halus:
dan 32 3 7 7 2 dimana, , , , , , , , 0 7 7 6 7 6 6 5 6 5 5 4 5 4 4 3 4 3 3 2 3 2 2 1 2 1 1 1 s s t si t eff a a t s a t s a t s a t s a t s a t s a t s s M K M K jam . / /T *R), K /(P K M K M K M K dt dM M K M K M K dt dM M K M K M K dt dM M K M K M K dt dM M K M K M K dt dM M K M K M K dt dM M K M K M K dt dM (4)
6
Tabel 1 Parameter persamaan model CAT
Model CAT yang disimulasikan akan menghitung laju persentase obat yang diabsoprsi dari usus halus ke sirkulasi sistemik plasma yang ditunjukkan oleh persamaan (3). Selanjutnya dapat dikaitkan dengan model farmakokinetik tiga kompartemen terbuka dengan eliminasi dari kompartemen pusat.
Atenolol
Atenolol adalah obat yang diperuntukkan bagi penderita angina atau angin duduk, tekanan darah tinggi dan gangguan detak jantung. Obat ini akan melambatkan kerja jantung. Obat atenolol yang terabsorpsi secara oral hanya mencapai 50-60% sedangkan bioavabilitasnya sekitar 45-60 %.
.
Model Terbuka Tiga Kompartemen
Definisi “terbuka” pada gambar 3 adalah obat yang diadministrasi secara oral akan dibuang melalui mekanisme ekskresi. Model tiga kompartemen ini diantaranya kompartemen satu merupakan kompartemen sentral, kompartemen dua dan tiga merupakan kompartemen perifer. Kompartemen sentral dimana organ vital yang memiliki perfusi darah yang cepat seperti hati dan ginjal sedangkan kompartemen perifer dimana organ memiliki perfusi darah yang lambat seperti otot, lemak dan lainnya.
Simbol Satuan Keterangan
Ms mg Massa obat di lambung
Mn mg Massa obat ke-m kompartemen di usus halus Ma mg Massa obat yang diabsorpsi
Mc mg Massa obat di usus besar
Ks jam-1 Konstanta laju pengosongan obat di lambung Ka jam-1 Konstanta laju transit di usus halus
Kt jam-1 Konstanta laju absorpsi di usus halus Peff cm/jam Permeabilitas efektif usus halus pada obat Tge jam Waktu pengosongan lambung
Tsi 3.32 jam Waktu transit rata-rata di usus halus R 1.75 cm Jari-jari usus halus
7
Gambar 3 Skema model terbuka tiga kompartemen dengan eliminasi kompartemen sentral
Yu menyajikan persamaan model tiga kompartemen sebagai berikut (Yu et al. 1996): 3 31 2 21 1 10 13 12 1 1 ) ( 1 C k C k C k k k dt dM V dt dC a (5) 2 21 1 12 2 C k C k dt dC (6) 3 31 1 13 3 C k C k dt dC (7)
Tabel 2 Parameter model terbuka tiga kompartemen
Simbol Satuan Keterangan
k10 jam-1 Konstanta laju eliminasi pada kompartemen 1
k12 jam-1 Konstanta transfer obat dari kompartemen 1 ke kompartemen 2 k13 jam-1 Konstanta transfer obat dari kompartemen 1 ke kompartemen 3 k21 jam-1 Konstanta transfer obat dari kompartemen 2 ke kompartemen 1 k31 jam-1 Konstanta transfer obat dari kompartemen 3 ke kompartemen 1
V1 L Volume di kompartemen sentral C1 mg/ml Konsentrasi kompartemen sentral
C2 mg/ml Konsentrasi kompartemen perifer dengan perfusi cepat C3 mg/ml Konsentrasi kompartemen perifer dengan perfusi rendah
Particle Swarm Optimization (PSO)
Particle Swarm Optimization (PSO), yang diperkenalkan oleh Kennedy dan
8
penting(Kennedy et al. 2001). PSO menggunakan mekanisme sederhana yang meniru perilaku kawanan burung berkelompok dan ikan untuk memandu partikel untuk mencari solusi optimal global (Franken dan Engelbrecht 2005). Implementasi algoritma PSO menjadikan PSO sebagai optimizer yang popular dan sukses diterapkan di berbagai bidang. Salah satunya struktur jaringan bayesian (Gheisari dan Meybodi 2016), pemodelan multiskala segmentasi pembuluh retina (Sreejini dan Govindan 2015) dan optimasi pada filter akustik (Renato et al. 2015). Studi teoritis dan perbaikan kinerja algoritma penting dan menarik untuk dilakukan. Beberapa perbaikan yang telah dilakukan antara lain, analisis konvergensi dan stabilitas optimasi (Clerc dan Kennedy 2001), (Trelea 2003), (Yasuda et al. 2003), (Kadirkamanathan 2006), dan (van den Bergh dan Engelbrecht 2006). Sedangkan penelitian tentang peningkatan kinerja PSO termasuk studi parameter, kombinasi dengan operasi tambahan, dan struktur topologi telah banyak dilakukan (Krohling dan Santos 2006), (Liu et al. 2007).
Dalam PSO, segerombolan partikel direpresentasikan sebagai himpunan permasalahan dan masing-masing partikel terkait dengan dua vektor, yaitu, vektor
kecepatan dimana
D
i i i
i v v v
V 1 2,...., dan vektor posisi
D
i i i
i x x x
X 1 2,...., ,
dimana D adalah dimensi ruang solusi. Kecepatan dan posisi setiap partikel yang diawali dengan vektor acak dalam rentang yang sesuai.
3 METODE
Penelitian ini dilakukan pada bulan Mei 2015 sampai bulan Maret 2016. Penelitian ini dilakukan di Laboratorium Fisika Teori dan Komputasi, Departemen Biofisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Alat
Peralatan yang digunakan pada penelitian ini adalah berupa laptop dengan spesifikasi procesor Intel CoreTM i5-4210U dengan memori 4GB, HDD 500 GB. Operating System yang digunakan adalah Microsoft Windows 7 Ultimate (licensed) dan software yang dibutuhkan meliputi Microsoft Office 2013 (licensed) dan MATLAB R2014a (licensed). Pendukung penelitian ini berupa daftar pustaka, yaitu jurnal-jurnal ilmiah, tesis dan sumber lain yang relevan.
Prosedur Analisis Data
Tahapan prosedur analisis data diawali dengan studi pustaka jurnal nasional dan internasional dilanjutkan perumusan ulang dan modifikasi model Compartment
Absorption and Transit (CAT) di usus halus. Setelah itu pembuatan program
menggunakan Matlab dan menganalisis hasil keluaran berupa fit grafik kadar konsentrasi obat di plasma terhadap waktu pada satuan jam.
Perhitungan secara numerik digunakan untuk menyelesaikan model persamaan CAT dengan menggunakan bahasa pemrograman (lihat lampiran 1), kemudian dari data yang diperoleh diplot dalam grafik dengan menggunakan program MATLAB. Solusi numerik didapatkan sebagai model CAT termodifikasi
9 Modifikasi Persaman CAT di Usus Halus
Pada penelitian ini dilakukan pendekatan farmakokinetik non-linier pada usus halus. Modifikasi model CAT pada usus halus yang kami usulkan pada penelitan ini adalah , / * * ) ( , / * * ) ( , / * * ) ( , / * * ) ( , 2 , 2 , / ) ( 7 0 2 7 2 6 7 6 0 2 6 2 5 6 5 0 2 5 2 4 5 4 0 2 4 2 3 4 3 3 2 3 2 2 1 2 1 0 2 1 2 1 M K M F b M K M K dt dM M K M F b M K M K dt dM M K M F b M K M K dt dM M K M F b M K M K dt dM M K M K M K dt dM M K M K M K dt dM M K M M K M K dt dM a t s a t s a t s a t s a t t a t t a t s s (8)
dimana F merupakan konstanta bioavaibilitas obat (0<F<1) dan b merupakan konstanta tidak berdimensi yang merupakan hasil perkalian permeabilitas efektif obat dengan rasio antara waktu transit dan panjang ileum di usus halus.
cm 400 dan 9 . 1 dimana 0475 . 0 * ileum ileum eff ileum ileum eff l jam t P l t P b (9)
Solusi Persamaan CAT di Usus Halus
Perubahan keadaan sistem farmakokinetik obat tiap saat (bergantung waktu) dapat dilihat melalui persamaan (5) dan (8). Pada persaman yang disajikan Yu terdapat tiga persaman differensial orde pertama yang saling terkopel, sedangkan pada persamaan di usus halus terdapat tujuh persamaan yang saling mempengaruhi proses kinetika obat. Solusi persamaan differensial tersebut (persamaan (5) dan (8)) dapat diselesaikan dengan menggunakan metode Runge-Kutta Susunan Keempat
(Fourth Order).
Metode Runge-Kutta merupakan alternatif lain dari metode deret Taylor yang tidak membutuhkan perhitungan turunan. Metode ini berusaha mendapat derajat ketelitian yang lebih tinggi, dan sekalius menghindarkan keperluan mencari turunan yang lebih tinggi dengan jalan mengevaluasi fungsi 𝑓(𝑥, 𝑦) pada titik terpilih dalam setiap selang langkah
10
Misalkan ada N set persamaan diferensial orde pertama yaitu dengan variabel Y j
dengan j=1, N; ) ,..., , , ( 1 2 3 1 1 F Y Y Y YN Y ) ,..., , , ( 1 2 3 2 2 F Y Y Y YN Y ) ,..., , , ( 1 2 3 3 3 F Y Y Y YN Y (10) ) ,..., , , ( 1 2 3 N N N F Y Y Y Y Y
Metode Runge Kutta akan memperkirakan harga Yjpada t+h sebagai berikut:
) 2 2 2 ( 6 1 ) ( 1 ) 1 ( 1i Y i Kal Kbl Kcl Kdl Y ) 2 2 2 ( 6 1 2 2 2 2 ) ( 2 ) 1 ( 2 i Y i Ka Kb Kc Kd Y ) 2 2 2 ( 6 1 3 3 3 3 ) ( 3 ) 1 ( 3 i Y i Ka Kb Kc Kd Y (11) ) 2 2 2 ( 6 1 ) ( ) 1 (i N i aN bN cN dN N Y K K K K Y Dengan ) ,... , , ( 1 2 3 N j aj hF Y Y Y Y K ) 5 . 0 ... 5 . 0 , 5 . 0 5 . 0 ( 1 a1 2 a2 3 a3 N aN j bj hF Y K Y K Y K Y K K (12) ) 5 . 0 ... 5 . 0 , 5 . 0 5 . 0 ( 1 a1 2 a2 3 a3 N aN j cj hF Y K Y K Y K Y K K Dengan j=1,N
Setelah solusi dari persamaan (5) dan (8) diperoleh, kemudian algoritma PSO pada model CAT termodifikasi diterapkan. Dalam PSO kecepatan dan posisi partikel dalam dimensi D diperbarui sebagai berikut menjadi (Kadirkamanathan et
al. 2006);
d
i d i d d i d i d d i di v c rand pBest x c rand pBest x
v 1 1 2 2 (13) d i d i d i x v x (14)
dimana adalah berat inersia, c1 dan c2 adalah konstanta akselerasi kelompok (Eberhart 1995) dan RandD 1 dan 2 RandD adalah dua nomor acak terdistribusi seragam independen yang dihasilkan dalam [0, 1] untuk dimensi ke D (Costa 2001). Dalam persamaan (13), pBest adalah posisi dengan kondisi terbaik
yang ditemukan sejauh ini untuk partikel ke i, dan nBest adalah posisi terbaik di
lingkungan. Pemanggilan fungsi CAT pada saat menggunakan algoritma PSO dilakukan untuk menyesuaikan dan membuat fit grafik oleh optimasi algoritma PSO dengan data eksperimen yang disediakan.
Hasil optimasi konstanta penyerapan obat yang didapatkan akan berbeda mengingat optimasi ini bersifat probabilistik. Solusi persamaan termodifikasi dan
11 perbandingan nilai koefisien determinasi R2 antara model CAT tanpa dan dengan
PSO diperoleh sebagai hasil keluaran fit grafik. Analisis Hasil Keluaran
Hasil analisis koefisien determinasi R2 menunjukkan bahwa persentase variabel penjelas (konstanta laju kinetika obat, massa obat waktu transit dan lainnya) memberikan pengaruh yang signifikan pada variabel respon (konsentrasi obat dalam plasma). Dalam hubungannya dengan korelasi, maka R2 merupakan
kuadrat dari koefisien korelasi R yang berkaitan dengan variabel bebas (X) dan variabel respon (Y).
Adapun interpretasi mengenai kekuatan korelasi sebagai berikut (Draper 1998) :
Nol (0) : tidak ada korelasi antara variabel
>0 – 0,25 : korelasi sangat lemah
>0,25 – 0,5 : korelasi cukup
>0,5 – 0,75 : korelasi kuat
> 0,75 – 0,99 : korelasi sangat kuat
Satu (1) : korelasi sempurna
2 2 2 ) ( ) ˆ ( 1 % 100 1 y y y y x SST SSE R i i i (15) dimana, i y = pengamatan ke i y = rataan iyˆ = pengamatan respon ke-i
4 HASIL DAN PEMBAHASAN
Pada model CAT yang disimulasikan dalam penelitian ini, saluran pencernaan dibagi menjadi tiga kompartemen yaitu lambung, usus halus dan usus besar. Pada usus halus manusia, pembagian tujuh segmen atau kompartemen diterapkan dengan transfer obat dari satu kompartemen ke kompartemen lainnya terjadi pada orde pertama (Yu et al. 1996).
Kinetika obat yang terjadi setelah obat diadministrasi secara oral adalah obat masuk ke dalam tubuh hingga lambung, kemudian obat pada lambung mengalami transit secara non-linier ke bagian usus halus. Usus halus dibagi menjadi tujuh kompartemen, di tiap kompartemen inilah terjadi kinetika obat yang pertama yaitu absorpsi obat. Pada bagian jejunum yang dianggap sebagai kompartemen dua dan tiga mengalami proses absorpsi yang meningkat, obat mengalami transit secara
12
linier dikarenakan pada bagian ini tidak berdekatan dengan organ yang berbeda dan kinetika absorpsi ini dimodifikasi menjadi dua kali lipatnya. Selanjutnya untuk kompartemen empat hingga tujuh, obat ditransitkan secara non-linier yang merupakan bagian ileum usus halus. Pada kompartemen ini laju obat yang terabsorpsi diperkecil karena diasumsikan sedikit obat yang masuk dan terserap disini. Hal ini juga bersesuaian dengan proses sebelumnya bahwa pada bagian jejunum obat terabsoprsi lebih banyak dibandingkan dengan ileum dan dinyatakan pada persamaaan CAT termodifikasi dengan memperkecil tetapan laju pada persamaan non-linier yaitu bagian ileum usus halus. Jumlah obat yang terabsorpsi nantinya menentukan prediksi konsentrasi obat pada plasma. Modifikasi persamaan CAT pada bagian usus halus dilakukan karena di kompartemen inilah asumsi fenomena transit non-linier dapat terjadi sedangkan laju absorpsi tidak dimodifikasi. Obat yang diadministrasi secara oral akan mengalami transit secara linier
Prediksi Konsetrasi Obat pada Plasma
Data eksperimen konsentrasi obat atenolol dengan rute administrasi oral dalam penelitian ini diambil dari penelitian (Mason et al. 1979). Terdapat 12 voluntir orang sehat dengan massa rata-rata 73.5 kg yang diberikan tablet atenolol dosis 25, 50 dan 100 mg/kg bobot badan voluntir. Pemberian masing-masing dosis dipisahkan paling lambat satu minggu dan volume plasma rata-rata 12 voluntir adalah 12.7155 L. Untuk pengukuran konsentrasi obat, diambil sampel darah pada waktu tertentu yaitu 0.5, 1, 1.5, 2, 2.5, 3, 4, 5.9, 7.7, 10, 11.95, 14, 16 dan 23.9 jam. Adapun waktu pengosongan lambung (Tge) untuk obat berbentuk tablet adalah 2-3
jam (Lacotelli, 2010)
Fasa absorpsi ditunjukkan dengan kenaikan konsentrasi obat. Adanya perfusi darah dari saluran cerna mempengaruhi fasa absorpsi ini. Titik dimana koordinat awal hingga titik puncak pada absis menunjukkan waktu maksimum (Tmax) yang diperlukan untuk mencapai kadar maksimum setelah pemberian obat (Gambar 4 hingga gambar 9). Dosis atenolol 25, 50 dan 100 mg/kg berat badan menunjukkan fit grafik hasil simulasi dengan data eksperimen.
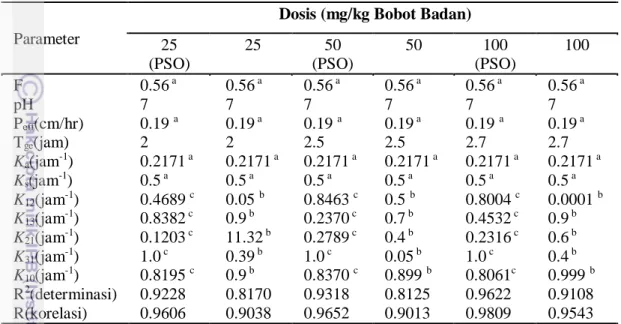
Nilai konstanta penyerapan obat K10, K12, K21, K13 dan K31 dengan
masing-masing nilai telah ditunjukkan pada Tabel 3 yang merupakan parameter farmakokinetik yang disimulasikan pada obat atenolol dosis 25, 50 dan 100 mg/kg BB. Semakin besar dosis maka waktu pengosongan lambung (Tge) semakin besar.
Permeabilitas efektif (Peff) ditentukan sebesar 0.19 cm/jam yang menjelaskan
kemampuan obat untuk dilewatkan pada dinding usus halus. Bioavabilitas (F) dan pH netral diasumsikan pada simulasi ini dengan memasukkan nilai kondisi awal sebesar 0,56 dan pH 7 (Amidon et al. 1995).
Simulasi optimasi model CAT menggunakan PSO berjalan dengan mekanisme stokastik. Dimana simulasi akan menentukan inputan random seperti nilai konstanta laju kinetika obat pada kompartemen terbuka. Saat algoritma PSO dijalankan, random input konstanta laju kinetika obat seperti yang tertera pada tabel 3 akan menghasilkan output yang random pula. Setiap menjalankan ulang program PSO yang diterapkan pada model CAT, nilai konstanta penyerapan obat dan koefisien determinasi juga akan berubah. Probabilitas partikel dalam hal ini mencari posisi terbaik saat simulasi dijalankan, hal ini bersesuaian dengan program akan mencari konstanta laju kinetika terbaik untuk ketiga dosis obat atenolol.
13 Saat simulasi optimasi tanpa menggunakan PSO dijalankan, simulasi membutuhkan inputan yang perlu diestimasi terlebih dahulu. Estimasi ini dilakukan dan disesusaikan dengan keluaran fit grafik dan koefisien determinasi pada tabel 3, mengingat nilai konstanta penyerapan obat ini saling terkopel satu sama lain. Tabel 3 Parameter hasil simulasi model CAT terbuka tiga kompartemen
Parameter
Dosis (mg/kg Bobot Badan)
25 (PSO) 25 50 (PSO) 50 100 (PSO) 100 F pH Peff(cm/hr) Tge(jam) Ka(jam-1) Ks(jam-1) K12(jam-1) K13(jam-1) K21(jam-1) K31(jam-1) K10(jam-1) R2(determinasi) R(korelasi) 0.56 a 7 0.19 a 2 0.2171 a 0.5 a 0.4689 c 0.8382 c 0.1203 c 1.0 c 0.8195 c 0.9228 0.9606 0.56 a 7 0.19 a 2 0.2171 a 0.5 a 0.05 b 0.9 b 11.32 b 0.39 b 0.9 b 0.8170 0.9038 0.56 a 7 0.19 a 2.5 0.2171 a 0.5 a 0.8463 c 0.2370 c 0.2789 c 1.0 c 0.8370 c 0.9318 0.9652 0.56 a 7 0.19 a 2.5 0.2171 a 0.5 a 0.5 b 0.7 b 0.4 b 0.05 b 0.899 b 0.8125 0.9013 0.56 a 7 0.19 a 2.7 0.2171 a 0.5 a 0.8004 c 0.4532 c 0.2316 c 1.0 c 0.8061c 0.9622 0.9809 0.56 a 7 0.19 a 2.7 0.2171 a 0.5 a 0.0001 b 0.9 b 0.6 b 0.4 b 0.999 b 0.9108 0.9543 a Yu et al (1999). b estimasi.
c Menggunakan PSO dengan batas atas dan bawah yang ditentukan dari 0 hingga 1. Pada gambar 4 hingga gambar 9, obat mengalami tahapan absorpsi dan obat diserap dengan laju penyerapan yang tinggi. Sesuai asumsi awal bahwa obat terserap pada bagian jejunum yaitu kompartemen dua dan tiga di usus halus. Hal ini bersesuaian dengan persamaan CAT termodifikasi saat laju penyerapan dibuat dua kali lipatnya. Pemilihan dosis yang diberikan pada pasien perlu memperhatikan beberapa faktor. Meski tubuh membutuhkan asupan yang tinggi dalam menjaga kesehatan, pemakaian obat yang berlebihan akan mengganggu kesehatan. Dengan konsumsi obat dengan dosis berlebih akan merusak kinerja ginjal dalam memproses obat untuk terserap dalam tubuh secara sempurna. Oleh karena itu pemilihan dosis obat yang diberikan akan disesuaikan dengan kondisi pasien itu sendiri.
Pada tahap awal kenaikan grafik pada gambar 4 hingga gambar 9, dosis obat yang diberikan tidak semuanya akan masuk ke dalam sirkulasi sistemik. pada rute obat yang diadministrasi secara oral, pertama obat akan diabsorpsi dan sejumlah obat akan hilang. Hilang diartikan obat tidak terabsorpsi sempurna. Molekul obat harus melarut dalam cairan lumen usus sebelum terabsorpsi.
Dalam menetapkan dosis dan skema penakaran yang tepat, perlu adanya informasi parameter farmakokinetik yang didapatkan di simulasi ini seperti laju penyerapan obat pada kompartemen perifer dan pusat. Khususnya mengenai kadar obat di tempat suatu target dan dalam darah, serta perubahan kadar ini dalam waktu tertentu. Pada gambar 4 hingga gambar 9, turunnya kadar plasma obat tergantung pada kecepatan metabolisme dan ekskresi seperti yang ditunjukkan oleh grafik yang menurun. Kedua faktor ini menentukan kecepatan eliminasi obat yang dinyatakan
14
dengan waktu paruh (t1/2) yaitu rentang waktu dimana kadar obat plasma pada fasa
eliminasi menurun separuhnya. Kecepatan eliminasi obat dan waktu paruhnya dipengaruhi oleh kecepatan biotransformasi dan ekskresi. Obat dengan metabolisme cepat waktu paruhnya akan pendek. Sebaliknya zat yang tidak mengalami biotransformasi atau diresorpsi kembali oleh tubuli ginjal, waktu paruhnya akan panjang.
AUC (Area Under Curve) pada gambar 4 hingga gambar 9 menjelaskan naik turunnya kadar plasma sebagai fungsi waktu. Dalam penelitian ini bioavabilitas tidak dihitung secara matematis untuk ketiga dosis atenolol 25, 50 dan 100 mg/kg berat badan. Dibutuhkan data sekunder lain seperti dosis intravaskuler pada pengujian in vitro untuk menghitung rasio dosis intravaskuler terhadap dosis oral sehingga didapatkan ukuran bioavibilitas suatu obat. Untuk menentukan dosis dan frekuensi pemberian obat yang rasional, dosis yang yang terlalu tinggi atau terlalu frekuen dapat menimbulkan efek toksik, sedangkan dosis dengan ukuran rendah dapat menimbulkan efek resistansi pada tubuh. Obat dengan waktu paruh panjang, umumnya obat diberikan dosis satu kali sehari agar kadar plasmanya tetap tinggi. Dalam penelitian ini, prediksi dosis obat atenolol yang dianjurkan untuk diminum pasien adalah dosis satu kali sehari. Hal ini terlihat dari grafik simulasi model CAT termodifikasi dan simulasi menggunakan algoritma PSO bahwa fasa akhir eliminasi obat berada di sekitar waktu 24 jam. Waktu konsentrasi plasma untuk mencapai puncak dapat diartikan sama dengan waktu yang diperlukan untuk mencapai konsentrasi obat maksimum setelah pemberian obat secara oral. Pada waktu tmax
absorpsi obat adalah yang terbesar dan laju absorpsi obat sama dengan laju eliminasinya. Proses absorpsi akan berlangsung setelah tmax tercapai, tetapi dengan
laju yang lebih lambat dari sebelumnya.
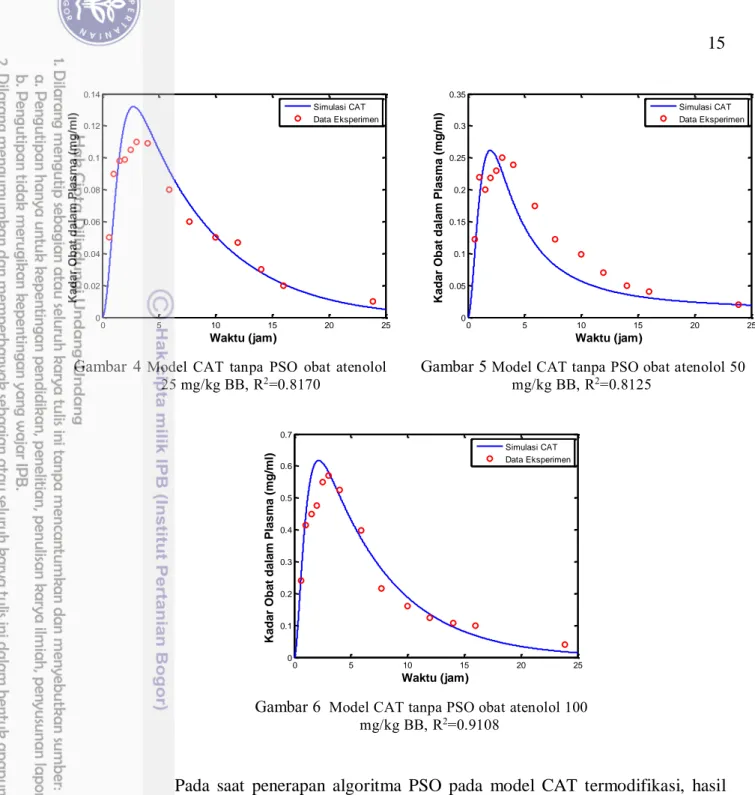
Pada gambar 4 nilai koefisien determinasi yang diperoleh adalah 0.8170. Hal ini menunjukkan bahwa sebesar 81.70% persentase variabel penjelas seperti konstanta laju kinetika obat, massa obat waktu transit dan lainnya memberikan pengaruh yang signifikan pada variabel respon seperti konsentrasi obat dalam plasma. Artinya sebesar 18.3% variabel varian lainnya dapat dijelaskan oleh faktor lain. Dalam hubungannya dengan korelasi, maka R2 merupakan kuadrat dari koefisien korelasi R yang berkaitan dengan variabel penjelas dengan variabel respon memberikan korelasi yang sangat kuat yaitu sebesar 0.9038 sesuai dengan interpretasi kekuatan korelasi yang dicantumkan pada bagian metode sebelumnya. Pada Gambar 5 dan 6, nilai koefisien determinasi yang diperoleh yaitu 0.8125 dan 0.9108 memberikan pengaruh yang signifikan pada variabel respon kadar obat dalam plasma. Dalam hal ini korelasi yang diperoleh berbanding lurus yakni dalam rentang sangat kuat yaitu 0.9013 dan 0.9543 . Hal ini mengindikasikan bahwa model CAT sebelum penggunaan algoritma PSO masih dalam rentang kekuatan korelasi yang kuat.
15
Gambar 4 Model CAT tanpa PSO obat atenolol 25 mg/kg BB, R2=0.8170
Gambar 5 Model CAT tanpa PSO obat atenolol 50 mg/kg BB, R2=0.8125
Gambar 6 Model CAT tanpa PSO obat atenolol 100 mg/kg BB, R2=0.9108
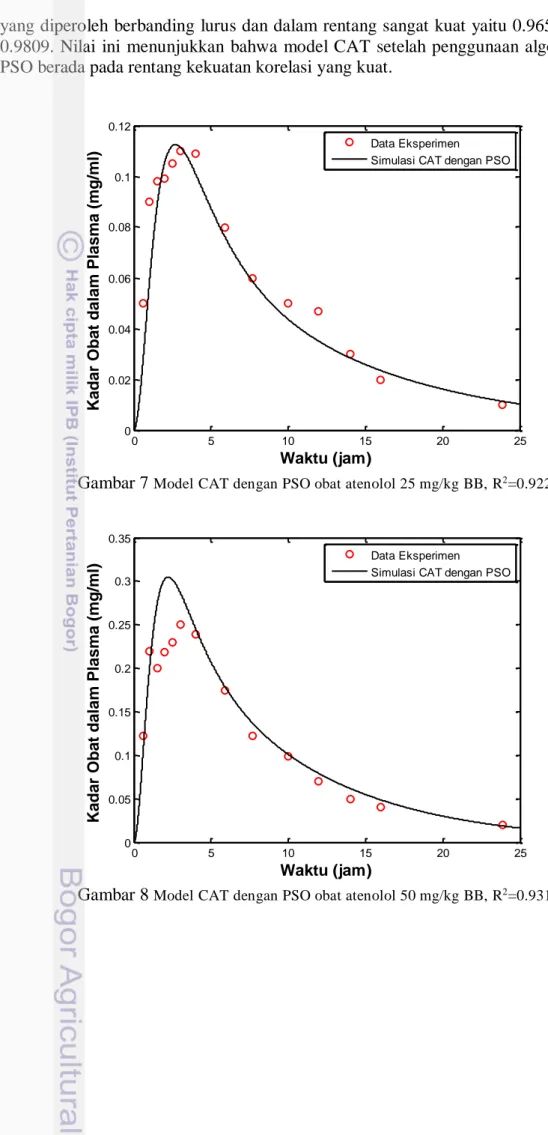
Pada saat penerapan algoritma PSO pada model CAT termodifikasi, hasil simulasi cocok dan lebih mendekati data eksperimen. Hal ini ditunjukkan dengan koefisien determinasi dan nilai korelasi yang meningkat pada gambar 7, 8 dan 9.
Pada gambar 7 nilai koefisien determinasi yang diperoleh adalah 0.9228. Hal ini menunjukkan bahwa sebesar 92.28% persentase variabel penjelas seperti konstanta laju kinetika obat, massa obat waktu transit dan lainnya memberikan pengaruh yang signifikan pada variabel respon seperti konsentrasi obat dalam plasma. Artinya sebesar 7.72% variabel varian lainnya dapat dijelaskan oleh faktor lain. Dalam hubungannya dengan korelasi, maka R2 merupakan kuadrat dari koefisien korelasi R yang berkaitan dengan variabel penjelas dengan variabel respon memberikan korelasi yang sangat kuat yaitu sebesar 0.9606 sesuai dengan interpretasi kekuatan korelasi. Peningkatan nilai koefisien determinasi pada (Gambar 8 dan 9) diperoleh sebesar 0.9318 dan 0.9622 memberikan pengaruh yang signifikan pada variabel respon kadar obat dalam plasma. Dalam hal ini korelasi
0 5 10 15 20 25 0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 Waktu (jam) Kadar O bat da lam Plasm a (m g/ml ) Simulasi CAT Data Eksperimen 0 5 10 15 20 25 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 Waktu (jam) Kadar O bat da lam Plasm a (m g/ml ) Simulasi CAT Data Eksperimen 0 5 10 15 20 25 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 Waktu (jam) Kadar O bat da lam Plasm a (m g/ml ) Simulasi CAT Data Eksperimen
16
yang diperoleh berbanding lurus dan dalam rentang sangat kuat yaitu 0.9652 dan 0.9809. Nilai ini menunjukkan bahwa model CAT setelah penggunaan algoritma PSO berada pada rentang kekuatan korelasi yang kuat.
Gambar 7 Model CAT dengan PSO obat atenolol 25 mg/kg BB, R2=0.9228
Gambar 8 Model CAT dengan PSO obat atenolol 50 mg/kg BB, R2=0.9318
0 5 10 15 20 25 0 0.02 0.04 0.06 0.08 0.1 0.12 Waktu (jam) Kadar O bat da lam Plasm a (m g/ml ) Data Eksperimen
Simulasi CAT dengan PSO
0 5 10 15 20 25 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 Waktu (jam) Kadar O bat da lam Plasm a (m g/ml ) Data Eksperimen
17
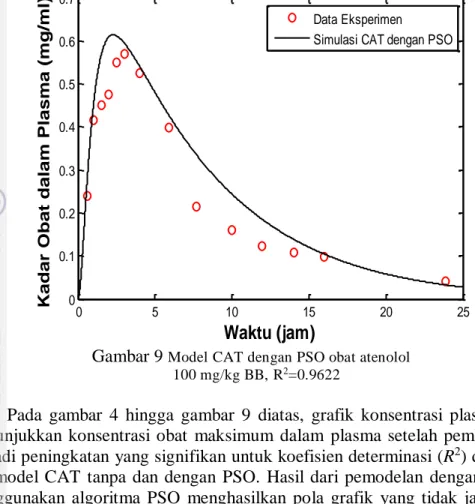
Gambar 9 Model CAT dengan PSO obat atenolol 100 mg/kg BB, R2=0.9622
Pada gambar 4 hingga gambar 9 diatas, grafik konsentrasi plasma puncak menunjukkan konsentrasi obat maksimum dalam plasma setelah pemberian oral. Terjadi peningkatan yang signifikan untuk koefisien determinasi (R2) dan korelasi (R) model CAT tanpa dan dengan PSO. Hasil dari pemodelan dengan dan tanpa menggunakan algoritma PSO menghasilkan pola grafik yang tidak jauh berbeda antara hasil simulasi dengan data eksperimen sehingga dapat juga dilihat dari nilai korelasi (R) yang didapatkan pada variabel konstanta laju kinetika terhadap variabel konsentrasi plasma melebihi 0.9 dimana model diusulkan cocok dengan data eksperimen. Simulasi model CAT dengan penerapan algoritma PSO diperoleh suatu hubungan antara efek farmakologi obat dan konsentrasi dalam plasma.
Hasil simulasi saat menggunakan PSO memberikan gambaran bahwa pemberian dosis terbaik yang diberikan kepada pasien adalah 25 mg/kg BB. Berdasarkan profil durasi kerja obat dari semua grafik berkisar 1 hingga 8 jam maka penentuan dosis terbaik harus menggunakan dosis terkecil mengingat ginjal harus mengekskresikan sisa obat dalam jumlah sedikit dibandingkan saat menggunakan dosis tinggi. Dengan menggunakan dosis yang terkecil maka ginjal tidak akan bekerja terlalu keras dibandingkan saat menggunakan dosis tinggi. Dengan bantuan PSO, grafik konsetrasi plasma puncak dapat memberikan prediksi lebih tepat bahwa obat hanya diabsorpsi secara sistemik untuk memberikan respon terapik. Selain itu konsentrasi plasma puncak juga akan memberikan prediksi dari kemungkinan adanya kadar toksis dalam tubuh.
Berdasarkan hasil simulasi dan gambar 4 hingga gambar 9 diatas, obat mengalami tiga tahapan proses yaitu fase absorpsi, fase pasca absorpsi dan fase eliminasi. Fase absorpsi obat yang ditunjukkan oleh peningkatan konsentrasi obat dan terjadi pada organ usus halus, dan fase pasca absorpsi ditunjukkan oleh penurunan konsentrasi obat. Pada bagian fasa pasca absorpsi terjadi pada retikulum endoplasma sel-sel hati. Metabolisme obat juga terjadi di sel-sel epitel pada saluran
0 5 10 15 20 25 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 Waktu (jam) Kadar O bat da lam Plasm a (m g/ml ) Data Eksperimen Simulasi CAT dengan PSO
18
pencernaan, paru-paru, ginjal, dan kulit
.
Tahap terakhir adalah fase eliminasi yang terjadi pada empedu dan ginjal, ditandai dengan penurunan obat mendekati nol yang artinya obat terserap sampai habis. Hal ini ditunjukkan dengan hasil simulasi nilai konstanta penyerapan obat K31 bernilai 1 artinya massa obat seluruhnyaterserap habis oleh tubuh. Berdasarkan hasil keluaran model CAT yang dioptimasi oleh algoritma PSO, hasil ini cocok untuk memprediksi konsentrasi obat dalam plasma. Dan model ini bisa diaplikasikan oleh semua obat generik apapun dengan mencocokan hasil simulasi dan data eksperimen yang tersedia.
5 SIMPULAN DAN SARAN
SimpulanSimulasi konstanta laju kinetika obat pada model Compartment Absorption
and Transit (CAT) dapat dioptimasi menggunakan algoritma Particle Swarm Optimization (PSO). Dari penelitian ini diperoleh bahwa penggunaan algoritma
PSO dalam Model CAT mampu meningkatkan kualitas prediksi aktivitas farmakokinetika obat oral (Atenolol) secara signifikan.
Hasil simulasi saat menggunakan PSO memberikan gambaran bahwa pemberian dosis terbaik yang diberikan kepada pasien berdasarkan profil durasi kerja obat dari semua grafik berkisar 1 hingga 8 jam adalah 25 mg/kg BB. Penentuan konstanta laju kinetika dalam model CAT menggambarkan transfer obat dari satu kompartemen ke kompartemen lain sehingga pemodelan ini dapat digunakan untuk memprediksi penyerapan obat plasma terhadap waktu. Peningkatan koefisien determinasi dan korelasi diperoleh setelah algoritma PSO digunakan. Hasil dari pemodelan dengan dan tanpa menggunakan algoritma PSO menghasilkan pola grafik yang tidak jauh berbeda antara hasil simulasi dengan data eksperimen sehingga dapat juga dilihat dari nilai korelasi (R) yang didapatkan pada variabel konstanta laju kinetika terhadap variabel konsentrasi plasma melebihi 0.9 dimana model diusulkan cocok dengan data eksperimen. Nilai koefisien determinasi (R2) saat menggunakan PSO lebih besar daripada R2 metode CAT yang
diusulkan. Hal ini menunjukkan bahwa model CAT dengan bantuan PSO dapat memprediksi konsentrasi obat pada plasma lebih baik daripada model CAT tanpa penggunaan PSO.
Saran
Penelitian lebih lanjut diharapkan dapat menguatkan validasi dari optimasi model CAT menggunakan algoritma PSO dan perlu memperhitungkan beberapa faktor lain seperti disolusi obat dan penggunaan lebih dari satu obat untuk mendapatkan hasil yang lebih valid. Perlu juga dilakukan perhitungan matematis untuk menentukan bioavabilitas dan waktu paruh dari obat.
19
DAFTAR PUSTAKA
Amidon GL et al. 1995. A Theoretical basis for a biopharmaceutics drug
classification: the correlation of in vitro drug product dissolution and in vivo bioavaibility. Pharm Res. 12:413-420.
Clerc M and Kennedy J. 2002. The particle swarm-explosion, stability and
convergence in a multidimensional complex space. IEEE Trans. Evol. Comput.,
vol. 6(1):58–73.
Costa P, Jose MSL. 2001. Modeling and Comparison of Dissolution Profiles. J Pharm. 13:123-133.
Dokumetzidis K, Kosmas A , Panos M. 2005. Modeling and monte carlo
simulations in oral drug absorption. JPT. 96:200-205.
Draper NR and Smith H. 1998. Applied Regression Analysis, Third Edition. Canada. John Wiley and Sons.
Eberhart RC and Kennedy J. 1995. A new optimizer using particle swarm theory,
in Proc. 6th Int. Symp. Micromachine Human Sci., Nagoya, Japan, : 39–43
Eberhart RC and Shi YH. 2001. Particle swarm optimization: Developments,
applications and resources, in Proc. IEEE Congr. Evol. Comput., Seoul, Korea:
81–86.
Franken N and Engelbrecht AP. 2005. Particle swarm optimization approaches to
coevolve strategies for the iterated prisoner’s dilemma, IEEE Trans. Evol.
Comput., vol. 9 (6) : 562–579.
Gheisari S, Meybodi MR. 2016. BNC-PSO: Structure learning of Bayesian
networks by Particle Swarm Optimization. Information Sciences, Vol. 348: 272–
289.
Harvey RA. 2012. Pharmacology 5th ed. China: Wolters Kluwer.
Jambhekar SS, Breen PJ. 2009. Basic Pharmacokinetics. London, UK: Pharmaceutical Press
Kadirkamanathan V, Selvarajah K, and Fleming PJ. 2006. Stability analysis of the
particle dynamics in particle swarm optimizer, IEEE Trans. Evol. Comput., vol.
10 (3) : 245–255.
Kennedy J and Eberhart RC. 1995. Particle Swarm Optimization, in
Proc. IEEE Int. Conf. Neural Netw., Perth, Australia, vol. 4: 1942–1948.
Krohling RA and Dos Santos Coelho L. 2006. Coevolutionary particle swarm
optimization using Gaussian distribution for solving constrained optimization problems, IEEE Trans. Syst., Man, Cybern. B, Cybern., vol. 36 (6): 1407–1416.
Lacotelli et al. 2010. Gastric emptying of non-disintegrating solid drug
delivery systems in fasted state: relevance to drug dissolution. Expert Opin
Drug Deliv. 7 (8) : 967-976.
Li XD and Engelbrecht AP. 2007. Particle swarm optimization: An introduction
and its recent developments, in Proc. Genetic Evol. Comput. Conf : 3391–3414.
Liu B, Wang L, and Jin YH. 2007. An effective PSO-based memetic algorithm for
20
37(1) :18–27.
Mason, W D. 1979. Kinetics and absolute bioavailability of atenolol. Clin Pharmacol Ther. 25:408-41
Mathias NR, Hussain MA. 2010. Non-Invasive systemic drug delivery:
developability considerations for alternate routes of administration, J Pharm Sci;
99:1-20.
Renato B, Nilson B, Fonseca, DL .2015. Some application of the PSO for
optimization of acoustic filters. Applied Acoustics, Vol. 89: 62-70.
Richard J and Miller. 2014. Drugged: The Science and Culture Behind
Psychotropic Drugs. Oxford University Press.
Shargel L, Andrew Y, Susanna WP. 2012. Biopharmaceutics an Pharmacokinetics 6th ed. North California: Mc Graw Hill.
Sreejini KS, Govindan VK. 2015. Improved multiscale matched filter for retina
vessel segmentation using PSO algorithma. Egyptian Informatics Journal
Vol.16: 253–260.
Trelea IC. 2003. The particle swarm optimization algorithm: Convergence analysis
and parameter selection, Inf. Process. Lett., vol. 85(6): 317–325.
Van den Bergh F and Engelbrecht AP. 2006. A study of particle optimization
particle trajectories, Inf. Sci., vol. 176(8): 937–971,
Wagner JG. 1993. Pharmacokinetics For Pharmaceutical Scientist. Switzerland: Technomic Publishing. Inc.
Yasuda K, Ide A, and Iwasaki N. 2003. Stability analysis of particle swarm
optimization, in Proc. 5th Metaheuristics Int. Conf. : 341–346.
Yu LX, Amidon GL. 1995. A compartemental absorption and transit model for
estimating oral drug absorption. J Pharm. 186:119-125.
Yu LX, Crison JR, and Amidon GL. 1995. A Strategic Approach For Predicting
Drug Absorption. Pharm.Res.12.
Yu LX, Crison JR, Amidon GL. 1996. Transport Approaches To The
Biopharmaceutical Design Of Oral Drug Absorption. ADV Drug Del Rev.
22
Lampiran 1 Data eksperimen konsetrasi obat atenolol
Waktu (jam) Konsentrasi Obat Atenolol 25mg/kg BB pada plasma Konsentrasi Obat Atenolol 50mg/kg BB pada plasma Konsentrasi Obat Atenolol 25mg/kg BB pada plasma 0.6 1 1.5 2 2.5 3 4.0 5.9 7.7 10 11.95 14 16 23.9 0.05 0.09 0.098 0.099 0.105 0.11 0.109 0.08 0.06 0.05 0.047 0.03 0.02 0.01 0.1225 0.22 0.2 0.219 0.23 0.25 0.239 0.175 0.122 0.099 0.07 0.05 0.04 0.02 0.24 0.415 0.45 0.475 0.55 0.57 0.525 0.399 0.215 0.16 0.123 0.108 0.099 0.04
23 Lampiran 2 Listing program matlab R2014a untuk persamaan CAT obat atenolol
function xp=CATmodif_4_atenolol(t,x)
Peff = 0.19; R = 1.75;% radius usus halus Tsi = 3.32; Tge = 2; Ks = 1/Tge; % 1/h Kt = 7/Tsi; % 1/h Ka = 2*Peff/R; % 1/h K10=0.8999; K12=0.5 ; K13=0.7; K21=0.4 ; K31=0.05; V=12.7155; a=Peff*114/24000; xp=zeros(13,1); xp(1)= - Ks * x(1); Lambung xp(2) = ((((Ks* x(1).^2) - (Kt* x(2).^2))/25)) - Ka*x(2); xp(3) = (Kt * x(2) - Kt * x(3)) - 2 * Ka * x(3); xp(4) = (Kt * x(3) - Kt * x(4)) - 2 * Ka * x(4); xp(5) = ((((Kt* x(4).^2) - (Kt* x(5).^2))*0.52*a/25)) - Ka*x(5); xp(6) = ((((Kt* x(5).^2) - (Kt* x(6).^2))*0.52*a/25)) - Ka*x(6); xp(7) = ((((Kt* x(6).^2) - (Kt* x(7).^2))*0.52*a/25)) - Ka*x(7); xp(8) = ((((Kt* x(7).^2) - (Kt* x(8).^2))*0.52*a/25)) - Ka*x(8); Usus Besar xp(9) = Kt * x(8); % penyerapan pada plasma
xp(10)= Ka * (x(2)+x(3)+x(4)+x(5)+x(6)+x(7)+x(8)); %kompartemen lain xp(11)=((Ka * (x(2)+x(3)+x(4)+x(5)+x(6)+x(7)+x(8)))/V)-((K12+K13+K10)*x(11))+(K21 * x(12))+(K31* x(13)); xp(12) = K12 * x(11) - K21 * x(12); xp(13) = K13 * x(11) - K31 * x(13); xp=[xp(1); xp(2); xp(3); xp(4); xp(5); xp(6); xp(7);... xp(8); xp(9); xp(10);xp(11);xp(12);xp(13)];
24
Lampiran 3 Diagram alir penelitian
Mulai Penyusunan
literatur
Sudah Siap
Pembuatan Algoritma PSO Analisis Persamaan Cat dan Modifikasi Persamaan
CAT di usus halus
Simulasi dengan program Matlab Analisis hasil keluaran Penyusunan Laporan Selesai
25
RIWAYAT HIDUP
Penulis dilahirkan di Cimahi, Jawa Barat pada tanggal 14 Agustus 1991 sebagai anak kedua dari empat bersaudara pasangan Purwo Sutopo dan Pipin Supiatin.
Penulis telah menempuh masa studi mulai dari TK Parikesit Cimahi Jawa Barat, SDN 13 kota cimahi Jawa Barat lulus pada tahun 2003, MTs Mazniyah Kota Jambi lulus pada tahun 2006 dan SMAN 2 Kota Bengkulu lulus pada tahun 2009. Selanjutnya, penulis diterima di Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB pada tahun 2009. Penulis melanjutkan studi program Magister Departemen Biofisika, Fakultas Matematika dan Ilmu pengetahuan Alam, Institut Pertanian Bogor pada tahun 2014.
Selama menjalani studi di IPB, penulis pernah menjadi asisten praktikum Fisika Dasar I dan II pada tahun 2010/2011 dan 2012/2013. Asisten praktikum Fisika Modern dan Eksperimen Fisika I pada tahun 2011/2012. Asisten Visual
Molecular Dynamics (VMD) pada tahun 2014/2015. Penulis juga aktif pada
kepanitian Pesta Sains 2010/2011, menjadi tentor Fisika TPB 2011/2012 dan kordinator fisika bimbingan belajar IPB 2013/2014.