Potensi Desikator untuk Inkubator
Anaerob
DOSEN PEMBIMBING:
Dr. rer.nat. Maya Shovitri, M.Si
Nengah Dwianita Kuswytasari, S.Si., M.Si
DISUSUN OLEH:
Siti Humaidah
NRP. 1506 100 030
PROGRAM STUDI BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT TEKNOLOGI SEPULUH NOPEMBER
LATAR BELAKANG
Mikroorganisme anaerob 1. Louis Pasteur (1877 ) 2. Brewer (1940 ) 3. HungateAnaerob jar saat
ini aplikasi teknik Hungate dan penambahan paladium metode khusus MAHAL ANAEROB JAR DESIKATOR
PERMASALAHAN
apakah desikator yang sudah vakum dapat
digunakan sebagai inkubator kultur bakteri
anaerob?
Desulvofibrio
Escherichia coli
Pseudomonas aeruginosa
BATASAN MASALAH
Gas yang berada di
head space desikator
divakum dengan menggunakan pompa
Untuk mengetahui potensi
desikator sebagai inkubator
kultur bakteri anaerob.
Tujuan
berpotensi positif anaerob
jar yang murah dan aplikatif
Penelitian bakteri anaerob
dapat dikembangkan
Waktu dan Tempat Penelitian
Mei - Oktober 2010
Laboratorium Mikrobiologi dan
Bioteknologi Biologi ITS.
Isolat Uji
Desulvofibrio
Escherichia coli
Pembuatan Medium
Media thioglikolat 1000 ml akuades Diaduk hingga homogen Diautoklaf 15 menit, suhu 121°C , tekanan 1,5 atm KULTUR ANAEROB:2 gr MgSO4. 7H2O sebagai elektron akseptor dan 300 ml sodium laktat sebagai
elektron donor
dituang ke tabung reaksi sebanyak 7,5 ml
Desikator Sebagai Anaerob Jar
Tabung reaksi yang berisi media Diinokulasi dgn isolat uji Diletakkan dalam desikator dihisap dengan pompa (Haiou®, Cina) selama 1 menit Inkubasi slama 72 jam Data??? Parameter Tabel 3.1 Pompa vakum Selang penghubung DesikatorTempat masuknya gas pada desikator
Teknik Hungate pada tabung reaksi
tabung reaksi yang berisi media Bakteri uji diinokulasikan Tabung reaksi ditutup dengan penutup sumbat karet
tabung rx dialiri gas selama 2 menit
diinkubasi pada suhu ruang selama 72 jam. Parameter pengamatan seperti pada (Tabel 3.1). Sumbat karet Medium padat/cair Jarum untuk mengalirkan gas Panel
on/off Pipa yang
terhubung dengan sumber gas Arah aliran gas
Konfirmasi Isolat Uji Setelah Inkubasi
Pengamatan
makroskopik
Pengamatan
mikroskopik
Uji
Pembentukan
Hidrogen
Sulfida (H
2S)
/uji TSIA
Pertumbuhan bakteri aerob (kiri), fakultatif
(tengah) dan obligat anaerob (kanan).
Pengamatan mikroskopik
Diamati dengan perbesaran 1000X Desulfovibrio: koma P.aeruginosa: batang E.coli: batangUji Pembentukan Hidrogen Sulfida (H
2
S)
Jarum tanam tajam yg terdapat bakteri
Triple Sugar Iron Agar (TSIA)
Inkubasi 24 jam
Hasil positif :
Desufovibrio: endapan hitam di dalam media
E.coli: perubahan warna menjadi kuning pada seluruh bagian media dan
menghasilkan gas yang ditandai dengan sedikit terangkatnya bagian bawah media biakan
P. aeruginosa: adanya perubahan warna menjadi kuning pada bagian bawah
Rancangan Penelitian
-
Tiga kali pengulangan.
- dianalisa metode deskriptif.
- parameter pada (Tabel 3.1).
Tabel 3.1 Parameter keberadaan oksigen
Bakteri Obligat Aerob Bakteri Fakultatif Bakteri Obligat Anaerob KeteranganHidup Hidup Mati O2 masih tinggi dan masih dapat mendukung
pertumbuhan bakteri obligat aerob
Mati Hidup Mati O2 masih ada, tetapi hanya dapat mendukung
pertumbuhan bakteri fakultatif sedangkan bakteri obligat anaerob masih belum dapat tumbuh.
Mati Hidup Hidup O2 tidak ada sehingga bakteri anaerob dapat tumbuh dan bakteri fakultatif masih dapat hidup.
Mati Mati Hidup O 2 tidak ada sehingga hanya bakteri obligat anaerob yang dapat hidup dan tidak mendukung pertumbuhan bakteri fakultatif.
Gambar 4.1 (a) Inkubasi di desikator vakum dan
(b) Inkubasi di suhu ruang pada teknik Hungate
(a)
(b)
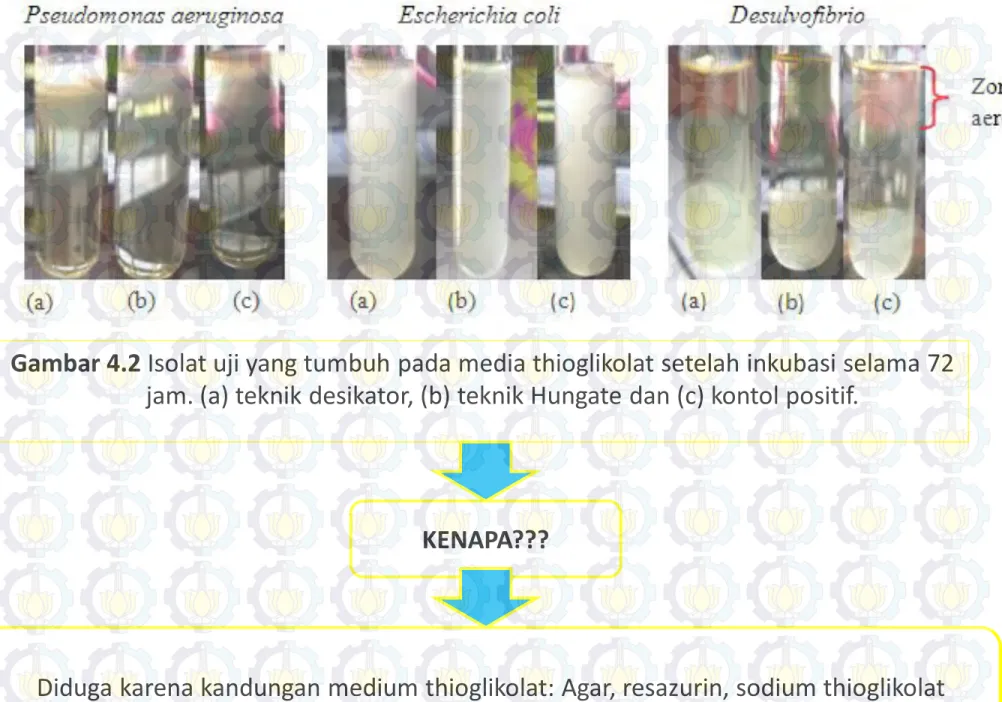
Gambar 4.2 Isolat uji yang tumbuh pada media thioglikolat setelah inkubasi selama 72
jam. (a) teknik desikator, (b) teknik Hungate dan (c) kontol positif.
KENAPA???
Agar 0,075% menghambat difusi oksigen dari permukaan media ke dasar media
Low O2 High
O2
Pertumbuhan bakteri aerob (kiri), fakultatif (tengah) dan obligat anaerob (kanan).
Resazurin pada media thioglikolat merupakan indikator redoks yang akan berubah warna menjadi merah muda jika terdapat oksigen (Turoski, 2001). KONTROL Zona aerob a b c Ket: a. E. coli b. P. aeruginosa c. Desulfovibrio Sangat tampak pada
Desulfovibrio.
E. coli tertutup biomassa sel.
P. aeruginosa warna pudar tertutup bimassa sel
DESIKATOR VAKUM terjadi perubahan warna
oksigen masih terdapat di head space tabung reaksi meskipun telah diinkubasi pada wadah yang telah beratmosfir
kosong. Hal ini ditandai dengan tumbuhya P. aeruginosa dengan tebalnya biomassa sel (Gambar 4.3).
HUNGATE tidak terjadi perubahan warna
Tetapi ternyata P. aeruginosa masih dapat tumbuh setelah aplikasi teknik Hungate
diduga penukaran gas oksigen dengan gas nitrogen belum dapat menghilangkan semua gas oksigen dalam headspace
Biomasa sel
Pseudomonas aeruginosa
(d) (a) (b) (c)
Gambar 4. 3 Pseudomonas aeruginosa setelah inkubasi 72 jam pada (a) teknik desikator,
(b) kontrol positif, (c) teknik Hungate, dan (d) kontrol negatif.
Menurut Ortega (2007) dengan konsentrasi O2 0,4% saja P. aeruginosa masih bisa tumbuh dengan waktu paruh 138 ± 20 menit. Lamanya waktu paruh ini bisa dilihat dari tipisnya biomassa sel pada teknik Hungate jika dibandingkan dengan desikator vakum dan kontrol positif (Gambar 4.3). Selain itu ternyata menurut Ramsdell (1935), kadar oksigen kurang dari 0,3 ml dalam media tidak mengakibatkan perubahan warna pada resazurin. Rendahnya kadar oksigen dalam teknik Hungate ini mungkin sebagai penyebab tidak terdeteksinya keberadaan oksigen oleh resazurin.
Secara kualitatif, biomassa isolat uji yang tumbuh dari
dua metode anaerob tersebut tidak berbeda nyata,
tetapi secara kuantitatif diduga memiliki perbedaan
biomassa sel.
Sebagai contoh pada isolat uji Desulfovibrio (Gambar
4.2). Pertumbuhan isolat uji pada teknik Hungate,
desikator vakum dan kontrol menunjukan kesamaan
ketinggian biomassa sel bila dilihat dari dasar media.
Tetapi apabila diuji secara kuantitatif, mungkin jumlahnya
tidak sama. Uji kuantitatif yang bisa dilakukan adalah
secara turbidimetrik yaitu perhitungan massa sel
berdasarkan kekeruhan (Waluyo, 2008).
Semua tumbuh Apakah kontaminan ?? Dilakukan uji TSIA
fermentasi dari E. coli dan P. aeruginosa serta dapat membuktikan adaya gas H2S pada bakteri yang mereduksi
Terjadi fermentasi laktosa dan
glukosa sehingga terjadi
penurunan pH menjadi asam
yang ditandai dengan terjadi
perubahan warna dari merah
menjadi kuning pada seluruh
bagian media dan menghasilkan
gas yang ditandai dengan
terangkatnya bagian bawah
media biakan (Gambar 4.4).
Escherichia coli.
a b c
Gambar 4.4 Uji TSIA pada
Escherichia coli. (a) teknik
desikator, (b) teknik Hungate dan (c) kontol positif.
Pseudomonas aeruginosa.
memfermentasi glukosa
saja yang ditandai
dengan adanya
perubahan warna
merah menjadi kuning
pada bagian bawah agar
(Gambar 4.5) (Harley
and Prescott, 2002).
a b c
Gambar 4.5 Uji TSIA pada
Pseudomonas aeruginosa. (a)
teknik desikator, (b) teknik Hungate dan (c) kontol positif.
Desulfovibrio
Widdle and Bak (1991) menyatakan bahwa substrat yang
toksik bagi Desulfovibrio adalah yang mengandung indol atau
phenol yang dapat menghambat pertumbuhan Desulfovibrio
dan mengakibatkan tidak terbentuknya H
2S pada media.
Sedangkan media TSIA mengandung phenol red sebanyak
0,024 gr per liter (Harley and Prescott, 2002). Selain itu
Desulfovibrio adalah bakteri yang bersifat obligat anaerob;
media TSIA yang digunakan walaupun telah ditambahkan
MgSO
4.7H2O sebagai elektron akseptor dan sodium laktat
sebagai elektron donor tetapi tidak dikondisikan secara
anaerob.
TIDAK TERBETUK FeS reaksi dari H2S dengan ferous sulfat
Dari hasil penelitian diketahui bahwa desikator berpotensi sebagai inkubator kultur anaerob ditandai dengan tumbuhnya isolat
Desulfovibrio (anaerob obligat). Namun
terdapat kelemahan dalam pemanfaatan desikator vakum ditandai dengan hidupnya isolat P. aeruginosa (aerob obligat) dan E. coli (fakultatif anaerob) yang diduga masih
terdapat oksigen di head space tabung reaksi
Kesimpulan
Untuk mengetahui potensi desikator vakum sebagai alternatir anaerob jar perlu diperhatikan kemungkinan
kebaradaan oksigen dalam head space tabung reaksi.