BAB II
LANDASAN TEORI
2.1 Baterai
Baterai adalah perangkat yang mengandung sel listrik yang dapat menyimpan energi yang dapat dikonversi menjadi daya. Baterai menghasilkan listrik melalui proses kimia. Baterai atau akkumulator adalah sebuah sel listrik dimana didalamnya berlangsung proses elektrokimia yang reversible (dapat berkebalikan ) dengan efisiensinya yang tinggi. Yang dimaksud dengan reaksi elektrokimia reversibel adalah didalam baterai dapat berlangsung proses pengubahan kimia menjadi tenaga listrik ( proses pengosongan ) dan sebaliknya dari tenaga listrik menjadi tenaga kimia ( proses pengisian ) dengan cara proses regenerasi dari elektroda - elektroda yang dipakai yaitu, dengan melewatkan arus listrik dalam arah polaritas yang berlawanan didalam sel.
Baterai terdiri dari dua jenis yaitu, baterai primer dan baterai sekunder. Baterai primer merupakan baterai yang hanya dapat dipergunakan sekali pemakaian saja dan tidak dapat diisi ulang. Hal ini terjadi karena reaksi kimia material aktifnya tidak dapat dikembalikan. Sedangkan baterai sekunder dapat diisi ulang, karena material aktifnya didalam dapat diputar kembali. Kelebihan dari pada baterai sekunder adalah harganya lebih efisien untuk penggunaan jangka waktu yang panjang.
2.1.1. Jenis – jenis baterai
A. Baterai Asam (Lead Acid Storage Acid)
Baterai asam yang bahan elektrolitnya adalah larutan asam belerang (sulfuric acid = H2SO4) . Didalam baterai asam, elektroda – elektroda nya terdiri dari plat –
plat timah peroksida PbO2 (Lead Peroxide) sebagai anoda (kutub positif) dan timah murni Pb (lead sponge) sebagai katoda (kutub negatif). Ciri – ciri umumnya:
a. Tegangan nominal per sel 2 volt
c. Nilai berat jenis elektrolit sebanding dengan kapasitas baterai.
d. Suhu elektrolit sangat mempengaruhi terhadap nilai berat jenis elektrolit, semakin tinggi suhu elektrolit semakin rendah berat jenis dan sebaliknya.
e. Nilai jenis berat standart elektrolit tergantung dari pabrik pembuatnya.
f. Umur baterai tergantung pada operasi dan pemeliharaan biasanya bisa mencapai 10 – 15 tahun.
g. Tegangan pengisian per sel harus sesuai dengan petunjuk operasi dan pemeliharahan dari pabrik pembuat. Sebagai contoh adalah:
- Pengisian awal (Initial Charge) : 2,7 Volt
- Pengisian Floating : 2,18 Volt
- Pengisian Equalizing : 2,25 Volt
- Pengisian Boozting : 2,37 Volt
- Tegangan pengosongan per sel (Discharge ) : 2,0 – 1,8 Volt
B. Baterai Basa / Alkali (Alkaline Storage Battery)
Baterai alkali bahan elektrolitnya adalah larutan alkali ( Potassium Hydroxide ) yang terdiri dari:
a. Nickel iron alkaline battery Ni-Fe Battery. b. Nickel cadmium alkaline battery Ni Cd Battery
Pada umumnya yang paling banyak digunakan adalah baterai alkali admium ( Ni-Cd )
Ciri- ciri umum ( tergantung pabrik pembuat ) adalah sebagai berikut: a. Tegangan nominal per sel adalah 1,2 volt
b. Nilai jenis berat elektroit tidak sebanding dengan kapasitas baterai.
c. Umur baterai tergantung pada penggunaan dan perawatan, biasanya dapat mencapai 15 - 20 tahun.
d. Tegangan pengisian per sel harus sesuai dengan petunjuk operasi dan pemeliharahan dari pabrik pembuat. Sebagai contoh adalah:
- Pengisian awal (Initial Charge) : 1,6 – 1,9 Volt - Pengisian Floating : 1,40 – 1,42 Volt - Pengisian Equalizing : 1,45 Volt
2.1.2 Kapasitas Baterai
Kapasitas baterai merupakan kemampuan baterai menyimpan daya listrik atau besarnya energi yang dapat disimpan dan dikeluarkan oleh baterai. Besarnya kapasitas, tergantung dari banyaknya bahan aktif pada plat positif maupun plat negatif yang bereaksi, dipengaruhi oleh jumlah plat tiap-tiap sel, ukuran, dan tebal plat, kualitas elektrolit serta umur baterai. Kapasitas energi suatu baterai dinyatakan dalam ampere jam (Ah), misalkan kapasitas baterai 100 Ah 12 volt artinya secara ideal arus yang dapat dikeluarkan sebesar 5 ampere selama 20 jam pemakaian.
Besar kecilnya tegangan baterai ditentukan oleh besar / banyak sedikitnya sel baterai yang ada di dalamnya. Sekalipun demikian, arus hanya akan mengalir bila ada konduktor dan beban yang dihubungkan ke baterai. Kapasitas baterai juga menunjukan kemampuan baterai untuk mengeluarkan arus (discharging) selama waktu tertentu, dinyatakan dalam Ah (Ampere – hour). Berarti sebuah baterai dapat memberikan arus yang kecil untuk waktu yang lama atau arus yang besar untuk waktu yang pendek. Pada saat baterai diisi (charging), terjadilah penimbunan muatan listrik. Jumlah maksimum muatan listrik yang dapat ditampung oleh baterai disebut kapasitas baterai dan dinyatakan dalam ampere jam (Ampere - hour), muatan inilah yang akan dikeluarkan untuk menyuplai beban ke pelanggan. Kapasitas baterai dapat dinyatakan dengan persamaan dibawah ini :
Ah = Kuat Arus (ampere) x waktu (hours) 2.1
Dimana : Ah = kapasitas baterai aki I = kuat arus (ampere) t = waktu (jam/sekon)
2.1.3 Konstruksi baterai aki
Aki yang ada dipasaran ada 2 jenis yaitu aki basah dan aki kering. Aki basah media penyimpanan arus listrik ini merupakan jenis aki yang paling umum digunakan. Aki jenis ini masih perlu diberi air aki yang dikenal accu zuur.
Sedangkan jenis aki kering merupakan jenis aki yang tidak memakai cairan, mirip seperti baterai telepon seluler. Aki ini tahan terhadap getaran dan suhu rendah.
Dalam aki ini terdapat jenis elemen dan sel untuk menyimpan arus yang mengandung asam sulfat (H2SO4). Tiap sel berisikan pelat positif dan negatif.
Pada pelat positif terkandung oksidal timbal coklat (Pbo2), sedangkan pelat
negatif mengandung timbal (Pb). Pelat-pelat ditempatkan pada batang penghubung. Pemisah atau separator menjadi isolasi diantara pelat itu, dibuat agar baterai acid mudah beredar disekeliling pelat. Bila ketiga unsur kimia ini berinteraksi, maka akan muncullah arus listrik.
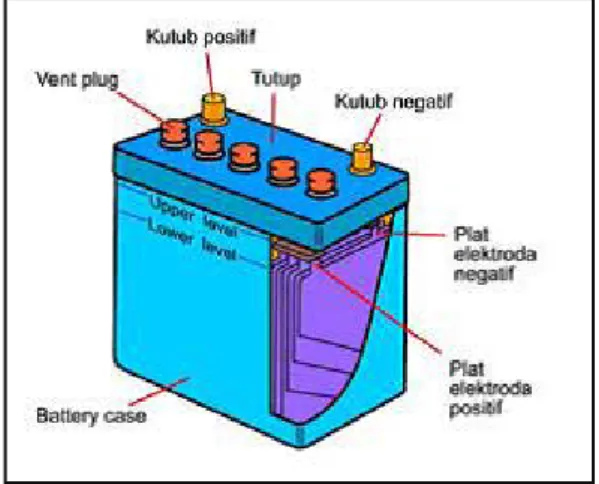
Gambar 2.1 Sel Aki
Aki memiliki 2 kutub / terminal, kutub positif dan kutub negatif. Biasanya kutub positif (+) lebih besar atau lebih tebal dari kutub negatif (-), untuk menghindarkan kelalaian bila aki hendak dihubungkan dengan kabel-kabelnya. Pada aki terdapat batas minimum dan maksimum tinggi permukaan air aki untuk masing-masing sel. Bila permukaan air aki di bawah level minimum akan merusak fungsi sel aki. Jika air aki melebihi level maksimum, maka akan mengakibatkan air aki menjadi panas dan meluap keluar melalui tutup sel.
1. Plat positif dan negatif
Plat positif dan plat negatif merupakan komponen utama suatu aki. Kualitas plat sangat menentukan kualitas suatu aki, plat-plat tersebut terdiri dari rangka yang terbuat dari paduan timbal antimon yang di isi dengan suatu bahan
aktif. Bahan aktif pada plat positif adalah timbal peroksida yang berwarna coklat, sedang pada plat negatif adalah spons - timbal yang berwarna abu abu
Rangka Material
Gambar 2.2 Plat Sel Aki
2. Separator dan lapisan serat gelas
Antara plat positif dan plat negatif disisipkan lembaran separator yang terbuat dari serat cellulosa yang diperkuat dengan resin. Lembaran lapisan serat gelas dipakai untuk melindungi bahan aktif dari plat positif, karena timbal peroksida mempunyai daya kohesi yang lebih rendah dan mudah rontok jika dibandingkan dengan bahan aktif dari plat negatif. Jadi, fungsi lapisan serat gelas disini adalah untuk memperpanjang umur plat positif agar dapat mengimbangi plat negatif, selain itu lapisan serat gelas juga berfungsi melindungi separator
Pulp
Fibber
Glass
Gambar 2.3 Lapisan Serat Gelas
3. Elektrolit
Cairan elektrolit yang dipakai untuk mengisi aki adalah larutan encer asam sulfat yang tidak berwarna dan tidak berbau. Elektrolit ini cukup kuat untuk
merusak pakaian. Untuk cairan pengisi aki dipakai elektrolit dengan berat jenis 1.260 pada 20° C.
4. Penghubung antara sel dan terminal
Aki 12 volt mempunyai 6 sel, sedang Aki 6 volt mempunyai 3 sel. Sel merupakan unit dasar suatu Aki dengan tegangan sebesar 2 volt. Penghubung sel (conector) menghubungkan sel sel secara seri. Penghubung sel ini terbuat dari paduan timbal antimon. Ada dua cara penghubung sel - sel tersebut. Yang pertama melalui atas dinding penyekat dan yang kedua melalui (menembus) dinding penyekat. Terminal terdapat pada kedua sel ujung (pinggir), satu bertanda positif (+) dan yang lain negatif (-). Melalui kedua terminal ini listrik dialirkan penghubung antara sel dan terminal
5. Sumbat
Sumbat dipasang pada lubang untuk mengisi elektrolit pada tutup aki, biasanya terbuat dari plastik. Sumbat pada Aki motor tidak mempunyai lubang udara. Gas yang terbentuk dalam Aki disalurkan melalui slang plastik/ karet. Uap asam akan tertahan pada ruang kecil pada tutup aki, kemudian asamnya dikembalikan kedalam sel.
6. Perekat bak dan tutup
Ada dua cara untuk menutup aki, yang pertama menggunakan bahan perekat lem, dan yang kedua dengan bantuan panas (Heat Sealing). Yang pertama untuk bak polystryrene sedang yang kedua untuk bak polipropylene.
2.1.4 Prinsip kerja baterai
1. Proses pengosongan ( discharge ) pada sel berlangsung menurut gambar. Jika sel dihubungkan dengan beban maka, elektron mengalir dari anoda melalui beban melalui beban katoda, kemudian ion – ion negatif mengalir ke anoda dan ion – ion positif mengalir ke katoda.
2. Pada proses pengisian menurut gambar dibawah ini adalah bila sel dihubungkan dengan power supply maka elektroda positif menjadi anoda dan elektroda negatif menjadi katoda dan proses kimia yang terjadi adalah sebagai berikut:
Aliran Ion Positif Elektrolit Ion Negatif Load Aliran A N O D A K A T O D A Aliran Ion Positif Elektrolit Ion Negatif DC Power Supply Aliran K A T O D A K A A N O D A
Gambar 2.4 Proses pengosongan dan pengisian baterai
- Aliran elektron menjadi terbalik, mengalir dari anoda melalui power supply ke katoda.
- Ion – ion negatif mengalir dari katoda ke anoda. - Ion – ion positif mengalir dari anoda ke katoda
Jadi, reaksi kimia pada saat pengisian (charging) adalah kebalikan dari saat pengosongan (discharging).
2.1.5 Berdasarkan elektrolitnya
Jenis baterai berdasarkan jenis elektrolitnya terdiri dari sel basah ( baterai basah ) dan sel kering ( baterai kering ). Baterai basah mempunyai ciri – ciri antara lain elektrolitnya berbentuk cair, kapasitas umumnya besar dan bentuk fisik umumnya besar. Sedangkan, baterai kering mempunyai ciri – ciri antara lain elektrolitnya berbentuk pasta, bentuk fisik umumnya lebih kecil dari baterai basah.
2.1.6. Cara – cara pengisian baterai a. Pengisian awal ( Initial Charge )
Pengisian ini dimaksud untuk pembentukan sel baterai, cara ini hanya dilakukan pada singel sel atau baterai stationer dan hanya dilakukan sekali saja
b. Pengisian kembali ( Recharging )
Recharging dilakukan secara otomatis setelah baterai mengalami pengosongan. Lamanya pengisian kembali disensor oleh rectifier sehingga apabila baterai sudah penuh maka dilanjutkan dengan pengisian trickle.
c. Pengisian equalizing / penyesuaian
Pengisian penyesuaian / equalizing dimaksudkan untuk mendapatkan kapasitas penuh pada setiap sel seimbang dengan kata lain memulihkan kapastas baterai. Pengisian ini juga dilakukan pada saat baterai setelah adanya penambahan aquadest.
d. Pengisian perbaikan / treatment
Pengisian perbaikan / treatment dimaksudkan untuk memulihkan kapasitas baterai yang berada dibawah standart setelah baterai dilakukan perbaikan, apabila setelah diadakan perbaikan hasilnya belum dapat dicapai maka dapat dilakukan beberapa kali.
e. Pengisian khusus / Boost Charge
Pengisian khusus / boost charge dimaksudkan untuk memulihkan baterai secara cepat setelah adanya pengosongan yang banyak, misalnya pada sistem operasi charge dan disharge yang belum mendapat catu PLN.
f. Pengisian kompensasi floating / trickle charge
Pengisian kompensasi dimaksudkan untuk menjaga kapasitas baterai selalu dalam kondisi penuh akibat adanya pengosongan diri ( self discharge ) yang besarnya 1% dari kapasitas baterai.
2.1.7 Prinsip Pengisian Baterai A. Baterai Asam – Timah
Bila sel baterai tidak dibebani maka setiap molekul cairan elektrolit asam sulfat (H2SO4) dalam sel tersebut pecah menjadi dua yaitu ion hydrohen yang
bermuatan positif (2H+) dan ion sulfat yang bermuatan negatif (SO4-).
H2SO4 2H+ + SO4-
Bila baterai dibebani maka tiap ion negatif sulfat (SO4) akan bereaksi
dengan plat timah murni (Pb) sebagai katoda menjadi timah sulfat (PbSO3) sambil
melepaskan dua elektron. Sedang sepasang ion hidrogen (H+) akan beraksi dengan plat timah peroksida (PbO2) sebagai anoda menjadi timah sulfat (PbSO4) sambil
mengambil dua elektron dan bersenyawa dengan satu atom hidrogen untuk membentuk air (H2O). Pengambilan dan pemberian atom elektron dalam proses
kimia ini menyebabkan timbulnya beda potensial listrik antara kutub – kutub sel baterai.
Proses tersebut terjadi secara simultan dengan reaksinya dapat dinyatakan dengan: PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O
Sebelum proses Setelah proses
PbO2 : Timah peroxida ( kutub positif / anoda)
Pb : Timah murni (kutub negatif / katoda ) 2H2SO4 : Asam sulfat (elektrolit)
PbSO4 : Timah sulfat (kutub positif dan negatif setelah proses
pengosongan.
H20 : Air setelah proses pengosongan
Jadi, pada proses pengosongan baterai akan timah sulfat (PbSO4) pada
kutub negatif dan positif, sehingga mengurangi reaktifitas dari cairan elektrolit karena asamnya menjadi timah, sehingga tegangan baterai antar kutub – kutub nya menjadi lemah.
Proses pengisian:
Proses ini adalah kebalikan dari proses pengosongan dimana arus listrik dialirkan yang arahnya berlawanan, dengan arus yang terjadi pada saat pengosongan. Pada proses ini setiap molekul air terurai dan tiap pasang ion hidrogen (2H+) yang dekat plat negatif bersatu dengan ion negatif sulfat SO4-. Pada plat negatif untuk membentuk asam sulfat. Sedangkan ion oksigen yang bebas bersatu dengan tiap atom pb pada plat positif membentuk timah peroksida PbO3. Proses reaksi kimia yang terjadi adalah sebagai berikut:
PbSO4 + PbSO4 + 2H2O PbO2 + Pb + 2H2SO4
Setelah pengosongan Setelah pengisian
B. Prinsip kerja baterai basa / alkali
Baterai alkali menggunakan potasium hydroxide sebagai elektrolit, selama proses pengosongan (discharge) dan pengisian (charge) dari sel baterai alkali secara praktis tidak ada perubahan berat jenis cairan elektrolit. Fungsi utama cairan elektrolit pada baterai alkali adalah bertindak sebagai konduktor untuk memindahkan ion – ion hydroxide dari satu elektroda ke elektroda lainnya tergantung pada prosesnya pengosongan atau pengisian, sedangkan selama proses pengisian dan pengosongan komposisi kimia material aktif pelat – pelat baterai akan berubah. Proses reaksi kimia saat pengsongan dan pengisian pada elektroda – elektroda sel baterai alkali sebagai berikut:
Untuk baterai Nickel – Cadmium
2NiOOH + Cd + 2H2O 2Ni(OH)2 + Cd(OH)2
Pengosongan Pengisian
2NiOOH : Incomplate Nickelic – Hydroxide (plat positif atau anoda) Cd : Cadmium (Plat negatif atau katoda)
2Ni(OH)2 : Nickelus Hydroxide (plat positif)
Cd(OH)2 : Cadmium Hydroxide (plat negatif)
2.2 Sistem pengisian battery lead acid secara adaptive
Pada penelitian yang dilakukan oleh (P Aurino adityawan, 2009) jenis baterai yang digunakan adalah baterai berjenis lead-acid yang dalam bahasa sehari hari disebut aki. Aki yang digunakan dalam proyek akhir ini memiliki spesifikasi sebagai berikut:
a. Memiliki tegangan sebesar 12 Volt b. Kapasitas 45 AH
Pertimbangan penggunaan aki basah pada pembuatan proyek penelitian ini adalah karena baterai dengan spesifikasi di atas banyak digunakan oleh masyarakat serta harganya yang terjangkau dibandingkan jenis-jenis baterai lain.
2.2.1 Rangkaian Charging
Rangkaian charging yang digunakan pada penelitian ini adalah rangkaian power supply yang digunakan untuk memberikan tegangan listrik pada baterai. Metode charging yang digunakan untuk mengisi daya baterai adalah dengan memberikan tegangan dan arus yang tetap pada tiap mode. Metode seperti ini disebut dengan metode constant current and voltage. Spesifikasi rangkaian power supply yang digunakan pada proyek akhir ini adalah memiliki tegangan output hingga 13,8 volt dan Arus output berkisar hingga 5 ampere.
2.2.2 Rangkaian Kontrol
Rangkaian kontrol yang dimaksud dalam system charging ini sebenarnya merupakan rangkaian switch menggunakan relay 12 Volt sebagai penggerak kontaknya yang nantinya akan dikendalikan oleh mikrokontroller. Rangkaian control ini berfungsi sebagai selector mode pengisian baterai berdasarkan besar arus yang dibutuhkan oleh baterai sesuai dengan kondisi tegangannya. Rangkaian ini bekerja dengan membagi output dari rangkaian charging dan men-spesifikasinya dengan komponen hambatan yang memiliki nilai tertentu sehingga menghasilkan saluran-saluran dengan besaran arus tertentu dengan nilai arus maksimal 5A seperti yang dihasilkan oleh rangkaian charging. Dengan begitu didapatkan selector output dengan nilai arus yang berbeda.
2.2.3 Cara-cara pengujian baterai a.Pengujian Discharge Baterai.
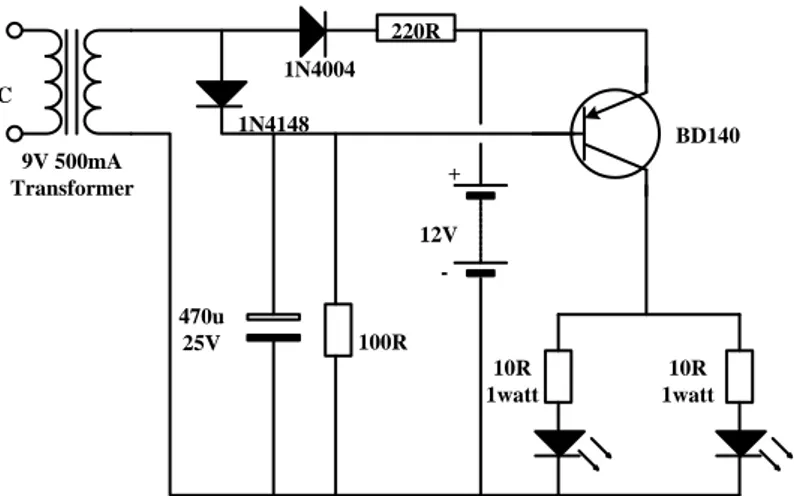
Pada pengujian discharge (pengosongan) baterai pada penelitian ini dimaksudkan untuk mengetahui seberapa besar daya tahan energi listrik mampu disimpan oleh baterai. Pengujian ini dilakukan dengan memberikan beban pada baterai yaitu 2 buah lampu halogen yang dipasang secara parallel. Untuk lebih jelasnya bisa dilihat pada gambar di bawah ini
220R 9V 500mA Transformer 470u 25V 100R 12V BD140 1N4004 1N4148 + 10R 1watt 10R 1watt 230V AC
-Gambar 2.5 : Rangkaian Pengujian Discharge Baterai (sumber : P Aurino adityawan :2009)
Setelah melakukan pengujian discharging baterai maka didapatkan data-data sebagai berikut:
Tabel 2.1 : Data Pengujian Discharging Baterai (sumber : P Aurino adityawan : 2009)
No Waktu Pengukuran Besar Tegangan(V) 1 awal(tanpa beban) 12.5 2 awal(dengan beban) 12.14 3 30 menit 11.99 4 60 menit 11,82 5 90 menit 11.67 6 120 menit 11.40 7 akhir(tanpa beban) 12.12
Pada tabel 2.1 (sumber : P Aurino adityawan : 2009) di atas dapat kita lihat bagaimana kondisi tegangan baterai ketika digunakan atau pada saat kondisi discharge. Nilai tegangan yang terukur pada voltmeter digital terlihat menurun seiring dengan berjalannya waktu pemakaian. Hal ini menunjukkan bahwa kapasitas listrik di dalam baterai mulai berkurang karena nilai tegangan yang terukur merupakan representasi dari daya listrik yang tersisa pada baterai.
b.Pengujian charging baterai.
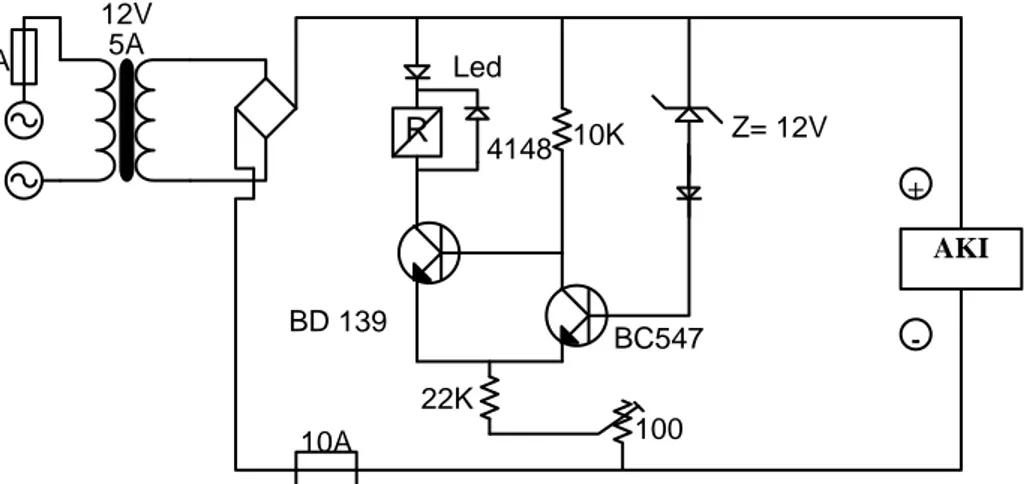
Untuk pengujian ini yang dilakukan adalah pengujian charging (pengisian) baterai lead-acid dengan menggunakan rangkaian charging yang dapat di ubah-ubah arus chargingnya. Berikut ini ditunjukkan gambar rangkaian pada saat melakukan pengujian charging baterai lead-acid.
1A 12V AKI R + -10K 12V 4148 Led BD 139 22K 10A Z= 12V 100 BC547 5A
Gambar 2.6 : Rangkaian Pengujian Charging Baterai (sumber : P Aurino adityawan :2009)
Pada pengujian baterai kali ini, digunakan rangkaian power supply dengan spesifikasi tegangan 13,8 Volt dan Arus maksimum 5 Ampere dari transformator. Keadaan baterai yang diisi pada kondisi kapasitas 70%. Indicator yang diukur pada pengujian ini adalah hubungan antara arus charging dengan waktu pengisian energi listrik pada baterai. Berikut ini merupakan data hasil pengujian charging baterai.
Arus Charging 1 Ampere (Slow Charging) Waktu yang dibutuhkan : 13,5 jam
Arus Charging 2 Ampere (Fast Charging) Waktu yang dibutuhkan : 6,75 jam
Dari data pengujian di atas dapat kita lihat bagaimana perbedaan antara pengisian baterai dengan mode slow dan mode fast, seperti yang telah dijelaskan sebelumnya, perbedaan antara mode slow dan fast pada sistem charging adaptive ini terletak pada arus charging yang diberikan untuk mengisi daya listrik pada
baterai. Dari hasil di atas dapat kita amati bahwa semakin besar kuat arus pada saat proses charging, maka semakin cepat pengisian baterai dilakukan. Hal ini dikarenakan energi listrik yang dialirkan dengan arus listrik yang besar lebih banyak dan lebih cepat dibandingkan dengan kuat arus yang kecil.
Setelah melakukan pembuatan sistem pengisian baterai lead acid secara adaptive dan juga telah melakukan serangkaian pengujian-pengujian pada bab-bab sebelumnya, maka kita dapat menarik kesimpulan sebagai berikut:
1. Rangkaian charging dapat bekerja dengan arus yang masih berada dalam batas aman.
2. Kondisi baterai (dalam hal ini tegangan)
mempengaruhi mode charging yang dilakukan terhadap baterai. 3. Semakin besar kuat arus yang diberikan saat
melakukan pengisian, semakin cepat proses charging dilakukan.
4. Kondisi baterai dapat mengalami penurunan karena factor usia baterai.
2.3 Sensor
Dalam pendeteksian suatu sensor tidak akan terlepas dari istilah tranduser. Tranduser adalah sebuah alat yang bila di gerakkan oleh energi di dalam sebuah sistem transmisi menyalurkan energi dalam bentuk yang sama atau dalam bentuk yang berlainan ke sistem transmisi kedua. Transmisi energi ini bisa listrik, mekanik, kimia, optik (radiasi) atau termal (panas). Definisi tranduser yang luas mencakup alat-alat yang mengubah gaya atau perpindahan mekanis menjadi sinyal elektrik.
Pada dasarnya sensor dan tranduser mempunyai definisi sama yaitu menerima rangsangan (gejala fisis) dari luar dan mengubahnya menjadi sinyal listrik. Proses fisis yang merupakan stimulus atau rangsangan sensor dapat berupa fluks magnetik, gaya, arus listrik, temperatur, cahaya, tekanan dan proses fisis lainnya. Sensor dan tranduser mempunyai perbedaan yang sangat kecil yaitu pada koefisien konversi energi. Sensor itu sendiri terdiri dari tranduser atau tanpa penguat atau pengolah sinyal yang terbentuk dalam satu indera.
Berdasarkan prinsip kelistrikannya sensor dapat dikelompokkan menjadi dua yaitu sensor pasif dan sensor jenis pembangkit sendiri (self generating type).
Sensor pasif menghasilkan perubahan dalam parameter listrik seperti halnya tahanan, kapasitansi dan lain-lain yang dapat diukur sebagai suatu perubahan tegangan atau arus. Dan sensor ini memerlukan daya luar, sedangkan sensor jenis pembangkit sendiri menghasilkan suatu 33 tegangan atau arus analog bila dirangsang dengan suatu bentuk fisis energi. Sensor ini tidak memerlukan daya luar.
2.3.1 Sensor Arus ACS712
ACS712 menyediakan solusi ekonomis dan tepat untuk pengukuran arus AC atau DC di dunia industri, komersial, dan sistem komunikasi. Perangkat terdiri dari rangkaian sensor efek-hall yang linier, low-offset, dan presisi. Saat arus mengalir di jalur tembaga pada bagian pin 1-4, maka rangkaian sensor efek-hall akan mendeteksinya dan mengubahnya menjadi tegangan yang proporsional.
Gambar 2.7 Konfigurasi pin dari IC ACS712
Berikut ini adalah karakteristik dari sensor suhu ACS712.
Memiliki sinyal analog dengan sinyal-ganguan rendah (low-noise)
Ber-bandwidth 80 kHz
Total output error 1.5% pada Ta = 25°C
Memiliki resistansi dalam 1.2 mΩ Tegangan sumber operasi tunggal 5.0V
Sensitivitas keluaran: 66 sd 185 mV/A
Tegangan keluaran proporsional terhadap arus AC ataupun DC
Fabrikasi kalibrasi
Tegangan offset keluaran yang sangat stabil
Hysterisis akibat medan magnet mendekati nol
2.3.2 Sensor Pembagi Tegangan
Pembagi tegangan merupakan rangkaian sederhana yang dapat mengubah tegangan yang tinggi menjadi tegangan yang lebih rendah. Dengan hanya menggunakan dua resistor yang dipasang secara seri dan dengan sebuah input tegangan, kita dapat membuat tegangan output yang mana teganan output ini merupakan hasil perhitungan dari tegangan input.
2.4 Adaptor
Pengertian Adaptor secara garis besar yaitu piranti elektronik yang bisa mengubah tegangan listrik (AC) yang tinggi jadi tegangan listrik (DC) yang rendah, namun ada juga jenis adaptor yang bisa mengubah tegangan listrik yang rendah jadi tegangan listrik yang tinggi, dan ada banyak lagi macam-macam adaptor.
Dengan cara umum adaptor yaitu alat elektronika yang bisa sesuaikan atau mengubah tegangan listrik, tujuannya yaitu mengubah sumber tegangan listrik utama yakni dari PLN jadi tegangan listrik yang bisa dipakai untuk sesuai dengan piranti elektronik yang bakal digunakan seperti Tv, Radio, gadget dan peralatan elektronik lainnya.
2.4.1 Adaptor Power Supply
Adaptor power supply adalah adaptor yang bisa mengubah tegangan listrik AC yang besar jadi tegangan DC yang kecil. Misalnya: Dari tegangan 220v AC jadi tegangan 6v, 9v, atau 12v DC. Adaptor power supply di buat untuk menukar manfaat baterai atau accu supaya lebih ekonomis. Adaptor power supply ada yang di buat sendiri, namun ada yang di buat jadikan satu dengan rangkaian lain. Misalnya dengan rangkaian Radio Tape, Tv, dan lain-lain.
Gambar 2.8 Adaptor Power Supply
2.5 Interface RS232
RS232 biasanya merupakan saluran bebas yang dibuat untuk dua arah (full-duplex) komunikasi. RS232 memiliki garis atau jalur jalur yang banyak (terutama digunakan dengan modem), dan juga menetapkan protokol komunikasi.Interface RS-232 yang mengandaikan kesamaan antara DTE dan DCE. Ini adalah asumsi yang masuk akal ketika sebuah kabel pendek menghubungkan DTE ke DCE, tapi dengan garis-garis panjang dan koneksi antar perangkat yang mungkin pada bus listrik yang berbeda dengan alasan yang berbeda, ini tidak mungkin benar. Untuk +12 volt menunjukkan "ON” sedangkan A -3 hingga -12 volt menunjukkan "OFF". Peralatan komputer modern mengabaikan tingkat negatif dan menerima tingkat tegangan nol. Bahkan, keadaan "ON" dapat dicapai dengan potensi positif yang lebih rendah. Sirkuit Ini berarti didukung oleh 5 VDC mampu mengemudi sirkuit RS232 secara langsung, bagaimanapun, rentang keseluruhan bahwa sinyal RS232 dapat dikirim / diterima dapat dikurangi secara dramatis.
Db9 USB Serial Conventer
Tabel 2.2 Interface RS232
2.6 Mikrokontroler
Mikrokontroler adalah mikrokomputer chip-tunggal yang dirancang secara spesifik untuk aplikasi-aplikasi kontrol dan bukan untuk aplikasi-aplikasi serbaguna. Aplikasi-aplikasi yang tipikal meliputi kontrol perangkat perangkat-perangkat peripheral seperti motor, penggerak, printer, dan komponen-komponen subsistem minor.
Mikrokontroller sesuai dengan namanya adalah suatu alat atau komponen pengontrol atau pengendali yang berukuran mikro atau kecil. Bila dibandingkan dengan mikroprosesor, mikrokontroller jauh lebih unggul karena terdapat berbagai alasan diantaranya :
1. Tersedianya Input/Outout
I/O dalam mikrokontroller sudah tersedia, sementara pada mikroprosesor dibutuhkan IC tambahan untuk menangani I/O tersebut, IC yang dimaksud adalah PPI 8255.
2. Memori Internal
Memori merupakan media untuk menyimpan program dan data sehingga mutlak harus ada. Mikroprosesor belum memiliki memori internal sehingga memerlukan IC memori eksternal
Dengan kelebihan-kelebihan diatas mikroprosesor tetap digunakan sebagai dasar dalam mempelajari mikrokontroller. Inti kerja dari keduanya adalah sama, yakni sebagai pegendali suatu sistem.
1. Sistem elektronik akan menjadi lebih ringkas.
2. Rancang bangun sistem elektronik akan lebih cepat karena sebagian besar dari sistem adalah perangkat lunak yang mudah dimodifikasi.
3. Pencarian gangguan lebih mudah ditelesuri karena sistemnya yang kompak. Namun tidak sepenuhnya mikrokontroller bisa komponen IC TTl dan CMOS yang sering kali masih diperlukan untuk aplikasi kecepatan tinggi atau sekedar menambah jumlah saluran input dan output (I/O) dengan kata lain, mikrokontroller adalah versi mini atau mikro dari sebuah komputer karena mikrokontroller sudah mengandung beberapa bagian yang langsung dimanfaatkan, misalnya port paralel, port serial, komparator, konversi digital ke analog (DAC), konversi analog ke digital (ADC), dan sebagainya hanya menggunakan Sistem Minimum yang tidak rumit.
Mikrokontroller adalah otak dari suatu sistem elektronika seperti halnya mikroprosesor sebagai otak komputer. Namun mikrokontroller memiliki nilai tambah karena didalamnya sudah terdapat memori dan sistem input/output dalam suatu kemasan IC. Mikrokontroller AVR (Alf and Vegard’s RISC processor) standart memiliki arsitektur 8-bit, dimana semua instruksi dikemas dalam kode 16-bit dan sebagian besar instriksi dieksekusi dalam satu siklus clock. Berbeda dengan instruksi MCS-51 yang membutuhkan 12 siklus clock karena memiliki arsitektur CISC (seperti komputer).
Secara umum, AVR dapat dikelompokkan menjadi 4 kelas, yaitu keluarga ATTiny, keluarga AT90Sxx, keluarga ATMega dan AT89RFxx. Pada dasarnya yang membedakan masing-masing kelas adalah memori, peripheral, dan fungsinya. Dari segi arsitektur dan instruksi yang digunakan, mereka dikatakan hampir sama. Oleh karena itu, dipergunakan salah satu AVR produk Atmel, yaitu ATMega8535. Selain mudah didapatkan dan lebih murah ATMega 8535 juga memiliki fasilitas yang lebih lengkap. Untuk tipe AVR ada 3 jenis yaitu ATTiny, AVR klasik, dan ATMega. Perbedaannya hanya pada fasilitas dan I/O yang tersedia serta fasilitas lainnya seperti ADC, EEPROM, dan lain sebagainya. Salah satu contohnya adalah ATMega8535. Memiliki teknologi RISC dengan kecepatan maksimal 16 MHz membuat ATMega 8535 lebih cepat bila dibandingkan dengan varian MCS51. Dengan fasilitas yang lengkap tersebut menjadikan ATMega 8535
sebagai mikrokontroller yang powerfull.
Kapabilitas detail dari ATMega 8535 adalah sebagai berikut:
1. Sistem mikroprosesor 8 bit berbasis RISC dengan kecepatan maksimal 16 MHz. 2. Kapasitas memori flash 8 Kb, SRAM sebesar 512 byte, dan EEPROM
(Electrically Erasable Programmable Read Only Memory) sebesar 512 byte. 3. ADC internal dengan fidelitas 10 bit sebanyak 8 channel.
4. Portal komunikasi serial (USART) dengan kecepatan maksimal 2,5 Mbps. 5. Enam pilihan mode sleep menghemat penggunaan daya listrik.
2.6.1 Konfigurasi PIN ATMega 8535
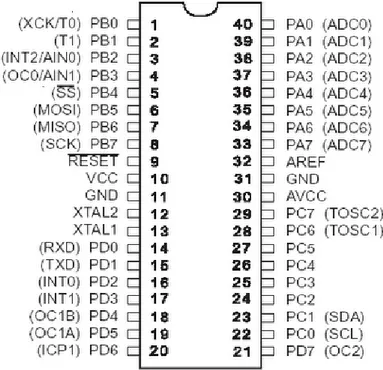
Mikrokontroller ATMega 8535 mempunyai pin sebanyak 40 buah, dimana 32 pin diantaranya untuk keperluan port I/O yang dapat menjadi pin input/output sesuai konfigurasi. Pada 32 tersebut terbagi atas 4 bagian (port), yang masing-masing terdiri dari 8 pin. Pin lainya digunakan untuk keperluan rangkaian osilator, supplay tegangan, reset, serta tegangan reverensi untuk ADC. Konfigurasi pin ATMega 8535 digambarkan sebagai berikut:
Gambar 2.10 Konfigurasi Pin ATMega 8535
8535 adalah sebagai berikut :
VCC merupakan pin yang berfungsi sebagai pin masukan catu daya. GND merupakan pin ground.
Port A (PA0..PA7) merupakan pin I/O dua arah dan pin masukan ADC
Port B (PB0..PB7) merupakan pin I/O dua arah dan pin fungsi khusus, yaitu Timer/Counter, komparator analog dan SPI.
Port C (PC0..PC7) merupakan pin I/O dua arah dan pin fungsi khusus, yaitu TWI, komparator analog dan Timer Oscilator.
Port D (PD0..PD7) merupakan pin I/O dua arah dan pin fungsi khusus, yaitu komparator analog, interupsi eksternal dan komunikasi serial.
RESET merupakan pin yang digunakan untuk me-reset mikrokontroler. XTAL1 dan XTAL2 merupakan pin masukan clock eksternal.
AVCC merupakan pin masukan tegangan untuk ADC. AREF merupakan pin masukan tegangan referensi ADC.
2.6.2 Peta Memori ATMega 8535
ATMega memiliki dua jenis memori yaitu Data Memory dan Program Memory ditambah satu fitur tambahan yaitu EEPROM Memory untuk menyimpan data.
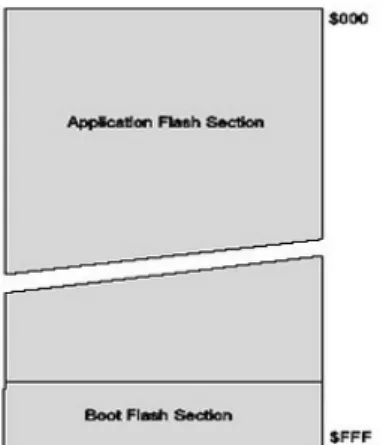
2.6.3 Program Memory
ATMega memiliki On-Chip In-System Reprogrammable Flash Memory untuk menyimpan program. Untuk alasan keamanan, program memory dibagi menjadi dua bagian, yaitu Boot Flash Section dan Application Flash Section. Boot Flash Section digunakan untuk menyampaikan program Boot Loader, yaitu program yang harus dijalankan pada saat AVR reset atau pertama kali diaktifkan.
Application Flash Section digunakan untuk menyampaikan program aplikasi yang dibuat user. AVR tidak dapat menjalankan program aplikasi ini sebelum menjalankan program Boot Loader. Berdasarkan memori Boot Flash Section dapat deprogram dari 128 word sampai 1024 word tergantung setting pada
konfigurasi bit di register BOOTSZ. Jika Boot Loader diproteksi, maka program pada Application Flash Section juga sudah aman.
Gambar 2.11 Peta Memori Program
2.6.4 EEPROM Data Memori
ATMega 8535 memiliki EEPROM 8 bit sebesar 512 byte untuk menyimpan data. Lokasinya terpisah dengan sistem address register, data register dan control register yang dibuat khusus untuk EEPROM. Alamat EEPROM dimulai dari $000 sampai $1FF.
EEPROM
$000
$01FF Gambar 2.12 EEPROM Data Memori
2.7 LCD (Liquid Crystal Display)
LCD (Liquid Crystal Display) adalah modul penampil yang banyak digunakan karena tampilannya menarik. LCD yang paling banyak digunakan saat ini ialah tipe M1632. LCD M1632 merupakan modul LCD dengan tampilan 2×16 (2 baris x 16 kolom) dengan konsumsi daya rendah. Modul tersebut dilengkapi
dengan mikrokontroler yang didesain khusus untuk mengendalikan LCD. Untuk rangkaian interfacing, LCD tidak banyak memerlukan komponen pendukung. Hanya diperlukan satu variable resistor untuk memberi tegangan kontras pada matriks LCD. Dalam LCD CHAR 2 x 16 kita akan menemukan indeks baris dan indeks kolom yang masing-masing dimulai dari indeks 0.
Pada LCD sebagai tampilan tegangan pada baterai Aki untuk mempermudah mengetahui hasil yang didapatkan. Lcd hanya menampilkan data, tidak dapat menyimpan data yang kita butuhkan. Maka, sebagai memenuhi kebutuhan digunakan PC (Personal Computer) sebagai tampilan data tegangan pada baterai Aki dan dapat menyimpan data tersebut.
Gambar 2.13 LCD CHAR 2x16
2.8 PC (Personal Computer)
Personal Komputer (PC) adalah seperangkat komputer yang digunakan oleh satu orang saja/ pribadi. Fungsi utama dari PC adalah untuk mengolah data input dan menghasilkan output berupa data/informasi sesuai dengan keinginan user (pengguna).
Dalam pengambilan data menganalisa Kapasitas Baterai AKI, data tegangan, data arus. Dengan kondisi suhu 40oC, 30 oC, 25 oC dan suhu es (OoC). Seluruh data yang diperoleh dari analisa tersebut disimpan oleh PC (Personal Computer) yang divisualisasi dengan Program Microsoft Visual Basic.