LAPORAN PRAKTIKUM KIMIA ELEKTRO
EKSPERIMEN SERTA IDENTIFIKASI SEL ACCU DAN BATERAI Disusun untuk memenuhi tugas mata kuliah Kima Elektro
Dosen Pengampu : Dr. IGM Sanjaya, M.Si.
Disusun oleh kelompok 1 :
1. Risma Jamilatul Inayah 14030234022 2. Bareta Bunga Arom 14030234005 3. Dea Sawitri F 14030234024
4. Raga Agung Perdana P 14030234020 5. Vahemas Aditya Pamila Putra 14030234038
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI SURABAYA
2016
II. TANGGAL PERCOBAAN: 26 Februari 2016 III. TUJUAN PERCOBAAN :
1. Untuk mengetahui komponen-komponen dalam sel accu dan baterai.
2. Untuk mengetahui anoda, katoda, elektrolit, reaksi, dan voltase dalam sel accu dan baterai.
IV. DASAR TEORI :
Accumulator atau sering disebut aki, adalah salah satu komponen utama dalam kendaraan bermotor, baik mobil atau motor, semua memerlukan aki untuk dapat menghidupkan mesin mobil (mencatu arus pada dinamo stater kendaraan). Aki mampu mengubah tenaga kimia menjadi tenaga listrik. Di pasaran saat ini sangat beragam jumlah dan jenis aki yang dapat ditemui. Aki untuk mobil biasanya mempunyai tegangan sebesar 12 Volt, sedangkan untuk motor ada tiga jenis yaitu, dengan tegangan 12 Volt, 9 volt dan ada juga yang bertegangan 6 Volt. Selain itu juga dapat ditemukan pula aki yang khusus untuk menyalakan tape atau radio dengan tegangan juga yang dapat diatur dengan rentang 3, 6, 9, dan 12 Volt. Tentu saja aki jenis ini dapat dimuati kembali (recharge) apabila muatannya telah berkurang atau habis. Dikenal dua jenis elemen yang merupakan sumber arus searah (DC) dari proses kimiawi, yaitu elemen primer dan elemen sekunder. Elemen primer terdiri dari elemen basah dan elemen kering.
Reaksi kimia pada elemen primer yang menyebabkan elektron mengalir dari elektroda negatif (katoda) ke elektroda positif (anoda) tidak dapat dibalik arahnya. Maka jika muatannya habis, maka elemen primer tidak dapat dimuati kembali dan memerlukan penggantian bahan pereaksinya (elemen kering). Sehingga dilihat dari sisi ekonomis elemen primer dapat dikatakan cukup boros. Contoh elemen primer adalah batu baterai (dry cells). Allesandro Volta, seorang ilmuwan fisika mengetahui, gaya gerak listrik (ggl) dapat dibangkitkan dua logam yang berbeda dan dipisahkan larutan elektrolit. Volta mendapatkan pasangan logam tembaga (Cu) dan seng (Zn) dapat membangkitkan ggl yang lebih besar dibandingkan pasangan logam lainnya (kelak disebut elemen Volta). Hal ini menjadi
prinsip dasar bagi pembuatan dan penggunaan elemen sekunder. Elemen sekunder harus diberi muatan terlebih dahulu sebelum digunakan, yaitu dengan cara mengalirkan arus listrik melaluinya (secara umum dikenal dengan istilah disetrum). Akan tetapi, tidak seperti elemen primer, elemen sekunder dapat dimuati kembali berulang kali. Elemen sekunder ini lebih dikenal dengan aki.
Dalam sebuah aki berlangsung proses elektrokimia yang reversibel (bolak-balik) dengan efisiensi yang tinggi. Yang dimaksud dengan proses elektrokimia reversibel yaitu di dalam aki saat dipakai berlangsung proses pengubahan kimia menjadi tenaga listrik (discharging). Sedangkan saat diisi atau dimuati, terjadi proses tenaga listrik menjadi tenaga kimia (charging).
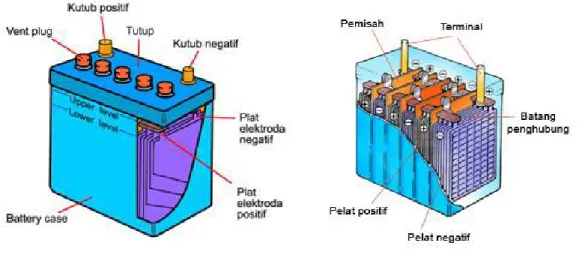
Jenis aki yang umum digunakan adalah accumulator timbal. Secara fisik aki ini terdiri dari dua kumpulan pelat yang dimasukkan pada larutan asam sulfat encer (H2SO4). Larutan elektrolit itu ditempatkan pada wadah atau bejana aki yang terbuat dari bahan ebonit atau gelas. Kedua belah pelat terbuat dari timbal (Pb), dan ketika pertama kali dimuati maka akan terbentuk lapisan timbal dioksida (Pb02) pada pelat positif. Letak pelat positif dan negatif sangat berdekatan tetapi dibuat untuk tidak saling menyentuh dengan adanya lapisan pemisah yang berfungsi sebagai isolator (bahan penyekat).
Aki yang ada di pasaran ada 2 jenis yaitu aki basah dan aki kering. Aki basah media penyimpan arus listrik ini merupakan jenis paling umum digunakan. Aki jenis ini masih perlu diberi air aki yang dikenal dengan sebutan accu zuur. Sedangkan aki kering merupakan jenis aki yang tidak memakai cairan, mirip seperti baterai telepon selular. Aki ini tahan terhadap getaran dan suhu rendah.
Gambar Sel Accu
Dalam aki terdapat elemen dan sel untuk penyimpan arus yang mengandung asam sulfat (H2SO4). Tiap sel berisikan pelat positif dan pelat negatif. Pada pelat positif terkandung oksid timbal coklat (Pb02), sedangkan pelat negatif mengandung timbal (Pb). Pelat-pelat ditempatkan pada batang penghubung. Pemisah atau separator menjadi isolasi diantara pelat itu, dibuat agar baterai acid mudah beredar disekeliling pelat. Bila ketiga unsur kimia ini berinteraksi, muncullah arus listrik.
Aki memiliki 2 kutub/terminal, kutub positif dan kutub negatif . Biasanya kutub positif (+) lebih besar atau lebih tebal dari kutub negatif (-), untuk menghindarkan kelalaian bila aki hendak dihubungkan dengan kabel-kabelnya. Pada aki terdapat batas minimum dan maksimum tinggi permukaan air aki untuk masing-masing sel. Bila permukaan air aki di bawah level minimum akan merusak fungsi sel aki. Jika air aki melebihi level maksimum, mengakibatkan air aki menjadi panas dan meluap keluar melalui tutup sel.
Pada saat aki digunakan, tiap molekul asam sulfat (H2SO4)
pecah menjadi dua ion hidrogen yang bermuatan positif (2H+) dan ion
sulfat yang bermuatan negatif (S04). Tiap ion SO4 yang berada dekat
lempeng Pb akan bersatu dengan satu atom timbal murni (Pb) menjadi timbal sulfat (PbSO4) sambil melepaskan dua elektron.
dioksida (PbO2), mengambil dua elektron dan bersatu dengan satu
atom oksigen membentuk molekul air (H20). Dari proses ini terjadi pengambilan elektron dari timbal dioksida (sehingga menjadi positif) dan memberikan elektron itu pada timbal murni (sehingga menjadi negatif), yang mengakibatkan adanya beda potensial listrik di antara dua kutub tersebut. Proses tersebut terjadi secara simultan, reaksi secara kimia dinyatakan sebagai berikut :
PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O ...
( 1 )
Di atas ditunjukkan terbentuknya timbal sulfat selama penggunaan (discharging). Keadaan ini akan mengurangi reaktivitas dari cairan elektrolit karena asamnya menjadi lemah (encer), sehingga tahanan antara kutub sangat lemah untuk pemakaian praktis. Sementara proses kimia selama pengisian aki (charging) terjadi setelah aki melemah (tidak dapat memasok arus listrik pada saat kendaraan hendak dihidupkan). Kondisi aki dapat dikembalikan pada keadaan semula dengan memberikan arus listrik yang arahnya berlawanan dengan arus yang terjadi saat discharging. Pada proses ini, tiap molekul air terurai dan tiap pasang ion hidrogen yang dekat dengan lempeng negatif bersatu dengan ion S04 pada lempeng negatif membentuk molekul asam sulfat. Sedangkan ion oksigen yang bebas bersatu dengan tiap atom Pb pada lempeng positif membentuk Pb02. Reaksi kimia yang terjadi adalah :
2PbSO4 + 2H2O PbO2 + Pb + 2H2SO2 ... ( 2 )
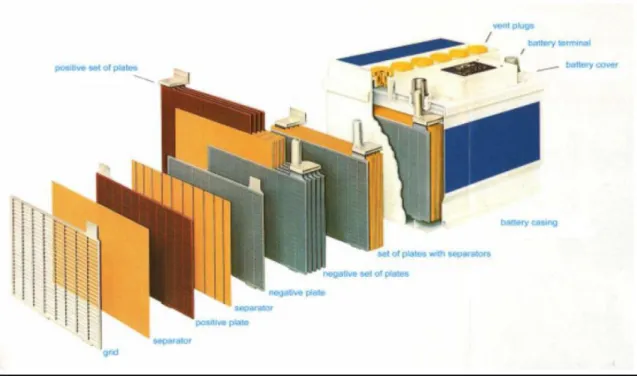
Aki kendaraan bermotor modern memiliki komposisi antara lain boks PP (polypropylen), plate (grid dan paste), kutub (poles), penghubung (bridges) dan separator PP sebagai penyekat antara plat positif dan negatif (gambar 2.4). Paste terdiri dari Pb, PbO2 dan PbSO4. Tipe aki kendaraan bermotor yang lama memiliki boks yang terbuat dari karet keras serta separator PVC (polyvinylchloride) dan PP selain boks.
Gambar Design Accu
Komposisi material dari aki beragam tergantung pada tipe aki, ukuran dan desainnya. Komponen dari aki yang memiliki kandungan timbal ditunjukkan pada gambar berikut :
Grid untuk aki tipe lama memiliki kandungan Antimon (Sb) yang lebih tinggi (~ 4 %) daripada aki modern (~ 2 %), dimana selain itu masih ditambahkan Kalsium (Ca) pada paduan grid sebesar < 0,5 %. Larutan elektrolit dalam accu yaitu cairan pada baterai merupakan Gb. Komposisi Accu yang
Mengandung Timbal Gambar Komposisi
campuran antara asam sulfat (H2SO4) dan air (H2O). Secara kimia, campuran tersebut bereaksi dengan bahan aktif pada plat baterai untuk menghasilkan listrik. Baterai yang terisi penuh mempunyai kadar 36% asam sulfat dan 64% air. Larutan elektrolit mempunyai berat jenis (specific gravity) 1,270 pada 200C (680F) saat baterai terisi penuh. Berat jenis merupakan perbandingan antara massa cairan pada volume tertentu dengan massa air pada volume yang sama. Makin tinggi berat jenis, makin kental zat cair tersebut. Berat jenis air adalah 1 dan berat jenis asam sulfat adalah 1,835. Dengan campuran 36% asam dan 64% air, maka berat jenis larutan elektrolit pada baterai sekitar 1,270.
Baterai adalah perangkat yang mengandung sel listrik yang dapat menyimpan energi yang dapat dikonversi menjadi daya. Baterai menghasilkan listrik melalui proses kimia. Baterai atau akkumulator adalah sebuah sel listrik dimana didalamnya berlangsung proses elektrokimia yang reversible (dapat berkebalikan) dengan efisiensinya yang tinggi. Yang dimaksud dengan reaksi elektrokimia reversibel adalah didalam baterai dapat berlangsung proses pengubahan kimia menjadi tenaga listrik (proses pengosongan) dan sebaliknya dari tenaga listrik menjadi tenaga kimia (proses pengisian) dengan cara proses regenerasi dari elektroda - elektroda yang dipakai yaitu dengan melewatkan arus listrik dalam arah polaritas yang berlawanan didalam sel.
Gambar baterai dan komponennya
Baterai terdiri dari dua jenis yaitu, baterai primer dan baterai sekunder. Baterai primer merupakan baterai yang hanya dapat dipergunakan sekali pemakaian saja dan tidak dapat diisi ulang. Hal ini terjadi karena reaksi kimia material aktifnya tidak dapat dikembalikan. Sedangkan baterai sekunder dapat diisi ulang, karena material aktifnya didalam dapat diputar kembali. Kelebihan dari pada baterai sekunder adalah harganya lebih efisien untuk penggunaan jangka waktu yang panjang. Jenis – jenis baterai :
1. Baterai Asam (Lead Acid Storage Acid)
Baterai asam yang bahan elektrolitnya adalah larutan asam belerang (sulfuric acid = H2SO4). Didalam baterai asam, elektroda
– elektroda nya terdiri dari plat – plat timah peroksida PbO2 (Lead
Peroxide) sebagai anoda (kutub positif) dan timah murni Pb (lead sponge) sebagai katoda (kutub negatif). Ciri – ciri umumnya :
a. Tegangan nominal per sel 2 volt
b. Ukuran baterai per sel lebih besar dibandingkan dengan baterai alkali. c. Nilai berat jenis elektrolit sebanding dengan kapasitas baterai.
d. Suhu elektrolit sangat mempengaruhi terhadap nilai berat jenis elektrolit, semakin tinggi suhu elektrolit semakin rendah berat jenis dan sebaliknya. e. Nilai jenis berat standart elektrolit tergantung dari pabrik pembuatnya.
f. Umur baterai tergantung pada operasi dan pemeliharaan biasanya bisa mencapai 10 – 15 tahun.
g. Tegangan pengisian per sel harus sesuai dengan petunjuk operasi dan pemeliharahan dari pabrik pembuat.
2. Baterai Basa / Alkali (Alkaline Storage Battery)
Baterai alkali bahan elektrolitnya adalah larutan alkali ( Potassium Hydroxide ) yang terdiri dari :
a. Nickel iron alkaline battery Ni-Fe Battery. b. Nickel cadmium alkaline battery Ni Cd Battery
Pada umumnya yang paling banyak digunakan adalah baterai alkali admium ( Ni-Cd ) Ciri- ciri umum ( tergantung pabrik pembuat ) adalah sebagai berikut :
a. Tegangan nominal per sel adalah 1,2 volt
b. Nilai jenis berat elektroit tidak sebanding dengan kapasitas baterai.
c. Umur baterai tergantung pada penggunaan dan perawatan, biasanya dapat mencapai 15 - 20 tahun.
d. Tegangan pengisian per sel harus sesuai dengan petunjuk operasi dan pemeliharahan dari pabrik pembuat.
Prinsip kerja baterai alkalin : Baterai Alkalin menggunakan Kalium Hidroksida sebagai elektrolit, selama proses pengosongan (Discharging) dan pengisian (Charging) dari sel baterai alkali. Reaksi yang terjadi :
Anoda Zn (-) : Zn → Zn2+ + 2e–
Katoda C (+) : 2MnO2 + H2O + 2e- → Mn2O3 + 2OH–
Reaksi total : Zn + 2MnO2 + H2O → Zn2+ + Mn2O3 +
2OH–
3. Baterai Nikel – Kadmium
Baterai Nikel Kadmium (NiCd) pertama kali ditemukan di Swedia, oleh Waldmar Jungner pada tahun 1899. Namun baru diproduksi secara masal pada tahun 1960an. Baterai jenis ini memiliki tegangan sel sebesar 1,2 Volt dengan kerapatan energi dua kali lipat dari baterai asam timbal. Baterai NiCd termasuk golongan baterai yang dapat diisi ulang (rechargeable battery).
Baterai NiCd menggunakan nikel untuk elektroda positif dan kadmium untuk negative. Baterai nikel kadmium memiliki nilai hambatan intenal yang kecil dan memungkinkan untuk di charge dan discharge dengan rate yang tinggi. Umumnya baterai jenis ini memiliki waktu siklus hingga lebih dari 500 siklus. Selain itu, baterai nikel kadmium juga sangat sensitif terhadap kelebihan
pengisian, sehingga perlu perhatian khusus pada saat pengisian muatan listrik pada baterai. Dengan kata lain, pengisian ulang harus dilakukan pada saat daya baterai benar-benar habis. Karena baterai NiCD memiliki memory effect, semakin lama kapasitasnya akan menurun jika pengisian belum benar-benar kosong.
Cadmium memiliki energi potensial reduksi standar (Eo red)
sebesar -0.40 V, sedangkan Eo
red Nikel sebesar -0.25 V (Daftar
Eo
red beberapa zatterlampir). Oleh karena Eored Nikel lebih besar
(lebih mendekati positif, yang berarti kecenderungan mengalami reduksi lebih besar), maka dalam sistem baterai NiCd, yang menggunakan Nikel dan Cadmium sebagai elektroda, elektroda Nikel akan mengalami reduksi (di sebut sebagai katoda), sedangkan elektroda Cadmium mengalami oksidasi (disebut sebagai anoda), selama reaksi spontan yang menghasilkan listrik (discharge).
Selanjutnya, elektroda Nikel akan disebut sebagai elektroda positif, sementara elektroda Cadmium disebut sebagai elektroda negatif. Reaksi kimia yang berlangsung di dalam baterai NiCd melibatkan air dan zat elektrolit KOH, serta bersifat dapat balik (reversible). Oleh karena itu, baterai dapat ‘diisi ulang’ ataurechargeable, dengan membalik reaksi yang semula mengubah energi kimia menjadi energi listrik, kepada reaksi balikan yakni, mengubah energi listrik menjadi energi kimia. Pada reaksi balikan, elektroda yang semula mengalami reduksi akan mengalami oksidasi, begitupun sebaliknya untuk elektroda yang semua mengalami oksidasi akan mengalami reduksi. Sehingga, katoda dan anoda berubah pada reaksi kebalikan.
Selama penggunaan baterai sebagai sumber energi listrik bagi berbagai alat elektronik, baterai NiCd melakukan reaksi kimia. Adapun prinsip Elektrokimia yang bekerja adalah bahwa pada baterai terjadi reaksi oksidasi dan reduksi yang menyebabkan pergerakan elektron, sehingga dihasilkan arus listrik. Berikut ini adalah reaksi kimia yang terjadi selama penggunaan baterai (discharge) :
Positif (reduksi) : 2NiOOH + 2H2O + 2e- 2Ni(OH)2 +
2OH
-Negatif (oksidasi) : Cd + 2OH- Cd(OH)
2 + 2e
-Reaksi total : 2NiOOH + 2H2O+ Cd 2Ni(OH)2 +
Cd(OH)2
Kapasitas baterai merupakan kemampuan baterai menyimpan daya listrik atau besarnya energi yang dapat disimpan dan dikeluarkan oleh baterai. Besarnya kapasitas, tergantung dari banyaknya bahan aktif pada plat positif maupun plat negatif yang bereaksi, dipengaruhi oleh jumlah plat tiap-tiap sel, ukuran, dan tebal plat, kualitas elektrolit serta umur baterai. Kapasitas energi suatu baterai dinyatakan dalam ampere jam (Ah), misalkan kapasitas baterai 100 Ah 12 volt artinya secara ideal arus yang dapat dikeluarkan sebesar 5 ampere selama 20 jam pemakaian.
Besar kecilnya tegangan baterai ditentukan oleh besar / banyak sedikitnya sel baterai yang ada di dalamnya. Sekalipun demikian, arus hanya akan mengalir bila ada konduktor dan beban yang dihubungkan ke baterai. Kapasitas baterai juga menunjukan kemampuan baterai untuk mengeluarkan arus (discharging) selama waktu tertentu, dinyatakan dalam Ah (Ampere – hour). Berarti sebuah baterai dapat memberikan arus yang kecil untuk waktu yang lama atau arus yang besar untuk waktu yang pendek. Pada saat baterai diisi (charging), terjadilah penimbunan muatan listrik. Jumlah maksimum muatan listrik yang dapat ditampung oleh baterai disebut kapasitas baterai dan dinyatakan dalam ampere jam (Ampere - hour), muatan inilah yang akan dikeluarkan untuk menyuplai beban ke pelanggan. Kapasitas baterai dapat dinyatakan dengan persamaan dibawah ini :
Ah = Kuat Arus (ampere) x waktu (hours) Dimana : Ah = kapasitas baterai aki
I = kuat arus (ampere) t = waktu (jam/sekon)
V. ALAT DAN BAHAN
Alat :
Baterai
Dibongkar
Diidentifikasi isi dan komponen dari baterai Diamati
Komponen baterai Accu
Dibongkar
Diidentifikasi isi dan komponen dari accu Diamati
Komponen accu - Palu 2 buah - Cutter 5 buah Bahan :
- Accu basah 1 buah - Accu kering 1 buah - Baterai lithium 1 buah - Baterai ABC 1 buah - Baterai Hp 1 buah VI. CARA KERJA
Accu
Dibongkar
Diidentifikasi isi dan komponen dari accu Diamati
Komponen accu VII. HASIL PENGAMATAN
No.
Perc. Prosedur Percobaan Hasil Pengamatan Dugaan/Reaksi Kesimpulan
1. Sebelum : - Aki kering Sesudah : Sel Aki Anoda : Pb(s) + SO42-(aq) PbSO4(s) + 2e Katoda :
PbO2(s) + SO42-(aq) + 4H+(aq)
PbSO4(s) + 2H2O
Reaksi Sel :
Pb(s) + PbO2(s) + 2SO42-(aq) + 4H+ (aq) 2PbSO4(s) + 2H2O Sel Baterai Anoda (C) : 2Li+ (aq) + 2e- 2Li(s) Katoda (LiCoO2) : LiCoO2(s) + 2H2O(l) + 2e 2 LiCoO(OH)(s) + 2OH -- Komponen yang terdapat dalam sel accu antara lain : 1. Plat positif dan negatif. 2. Separator dan lapisan serat gelas. 3. Elektrolit yang berupa larutan asam sulfat encer. 4. Penghubung
antara sel dan terminal. 5. Sumbat. 6. Perekat bak
Sel aki kering
- Larutan elektrolit dalam sel aki kering : larutan H2SO4 dan H2O
Sebelum :
- Sel aki basah
Sesudah :
- Sel aki basah
Reaksi Sel :
2Li(s) + LiCoO2(s) + 2H2O(l)
2Li+
(aq) + 2 LiCoO(OH)(s) + 2OH
-Larutan elektrolit dalam baterai litium : campuran LiPF6, EC,
DEM, dan EMC.
- Katoda yang terdapat dalam sel aki adalah PbO2
- Anoda dalam sel aki adalah logam Pb. - Komponen dalam sel baterai adalah : 1. Tutup baja 2. Tabung kertas laminasi atau isolator 3. Pasta 4. Gel pemisah 5. Karbon dan air 6. Elektrolit dari lapisan kanji
7. Bungkus kaleng seng 8. Dasar kertas laminasi atau insolator 9. Logam Zn 10. Batang grafit atau karbon - Katoda dalam sel baterai adalah LiCoO2. - Anoda dalam sel baterai adalah litium.
Plat sel aki basah
- Larutan elektrolit di dalam sel aki basah : accu zuur (H2SO4)
Sebelum :
Baterai
Dibongkar
Diidentifikasi isi dan komponen dari baterai Diamati
Komponen baterai
Analisis
Pada percobaan pertama aki kering yang ada dibongkar dengan cara membuka penutup bagian atas dengan obeng minus secara paksa namun harus hati hati. Kemudian diamati isi dan komponen dari aki kering tersebut. Setelah diamati terdapat beberapa komponen dalam aki kering tersebut diantaranya yaitu plat positif dan negatif, separator dan lapisan serat gelas, elektrolit yang berupa larutan asam sulfat encer, penghubung antara sel dan terminal, sumbat, perekat bak dan tutup, Anodanya terbuat dari logam timbal atau timah hitam(Pb) dan
katodanya terbuat dari logam timbal yang dilapisi PbO2. Dengan persamaan reaksi sebagai
berikut: Sel Aki Anoda :
Pb(s) + SO42-(aq) PbSO4(s) + 2e
Katoda :
PbO2(s) + SO42-(aq) + 4H+(aq) PbSO4(s) + 2H2O
Reaksi Sel :
Pb(s) + PbO2(s) + 2SO42-(aq) + 4H+(aq) 2PbSO4(s) + 2H2O
Voltase yang dihasilkan aki kering yaitu sebesar .... kemudian memiliki voltase efektif sebesar ... kemudian memilki elektroda Pb dan PbO, dalam larutan asam sulfat yang berfungsi sebagai elektrolit.
Plot output negatif Plot output positif Penghubung plat plat Blok baterai Plat timbal Dinding pemisah sel-sel baterai
Pada percobaan kedua aki basah yang ada, dibongkar dengan cara membuka penutup bagian atas dengan obeng minus secara hati hati. Kemudian diamati isi dan komponen dari aki basah tersebut. Setelah diamati terdapat beberapa komponen dalam aki basah hapir sama dengan aki kering namun yang membedakan adalah elektoda pada aki basah berupa cairan sedangkan pada aki kering berupa gel. Sedangkan untuk voltase yang dihasilkan aki kering yaitu sebesar .... kemudian memiliki voltase efektif sebesar ...
Pada percobaan ketiga baterai Lithium yang ada dibuka dengan cara menyileti bagian tubuh baterai secara paksa hingga diperoleh serbuk karbon. Kemudian diamati isi dan komponen dari baterai tersebut. Setelah diamati terdapat beberapa komponen dalam baterai tersebut diantaranya yaitu tutup baja, tabung kertas laminasi atau isolator, pasta, gel pemisah, karbon dan air, elektrolit dari lapisan kanji, bungkus kaleng seng, dasar kertas laminasi atau insolator,
Plat elektroda positif Plat elektroda negatif Kutub positif Kutub negatif Batang penghubun g
logam Zn, dan batang grafit atau karbon. Katoda dalam sel baterai adalah LiCoO2,
sedangkan Anoda dalam sel baterai adalah litium. Dengan persamaan reaksi sebagai berikut: Sel Baterai
Anoda (C) : 2Li+
(aq) + 2e- 2Li(s)
Katoda (LiCoO2) :
LiCoO2(s) + 2H2O(l) + 2e 2 LiCoO(OH)(s) + 2OH
-Voltase yang dihasilkan baterai litium yaitu sebesar .... kemudian memiliki voltase efektif sebesar ... kemudian memiliki elektroda ..., sedangkan larutan elektrolitnya yaitu campuran LiPF6, EC, DEM, dan EMC.
Reaksi Sel :
2Li(s) + LiCoO2(s) + 2H2O(l) 2Li+(aq) + 2 LiCoO(OH)(s) + 2OH
-Serbuk karbon
Lempeng alumunium (foil punch)
Pemisah (separator)
Voltase efektif : besarnya arus efektif telah diketahui maka besarnya tegangan tiap-tiap komponen dapat dicari
Digunakan untuk mengukur besarnya tegangan dan kuat arus listrik bolak balik (AC =Alternating Current) digunakan nilai efektif
Nilai efektif arus dan tegangan bolak balik yaitu nilai arus dan tegangan bolak-balik yang setara dengan arus searah yang dalam waktu yang sama jika mengalir dalam hambatan yang sama akan menghasilkan kalor yang sama.