BAB II
LANDASAN TEORI
2.1 Baterai
Baterai atau akumulator adalah sebuah sel listrik dimana di dalamnya berlangsung proses elektrokimia yang reversible (dapat berbalikan) dengan efisiensinya yang tinggi. Yang dimaksud dengan proses elektrokimia reversibel adalah di dalam baterai dapat berlangsung proses pengubahan energi kimia menjadi energi listrik (proses pengosongan), dan sebaliknya dari energi listrik menjadi energi kimia, pengisian kembali dengan cara regenerasi dari elektroda-elektroda yang dipakai, yaitu dengan melewatkan arus listrik dalam arah (polaritas) yang berlawanan di dalam sel.
Jenis sel baterai ini disebut juga Storage Baterai, adalah suatu baterai yang dapat digunakan berulang kali pada keadaan sumber listrik arus bolak – balik (AC).
2.1.1 Jenis – Jenis Baterai
Jenis-jenis baterai dibedakan berdasarkan bahan elektrolit yang digunakan pada baterai tersebut. Bahan elektrolit yang banyak digunakan pada baterai adalah jenis asam (Lead acid) dan basa (alkali). Untuk itu dibawah ini akan dibahas beberapa jenis baterai :
1. Baterai Asam (Lead Acid Storage Battery)
Baterai asam bahan elektrolitnya adalah larutan asam belerang (Sulfuric Acid = H2SO4). Di dalam baterai asam, elektroda-elektrodanya terdiri dari pelat-pelat timah peroksida PbO2 (Lead Peroxide) sebagai anoda (kutub positif) dan timah murni Pb (Lead Sponge) sebagai katoda (kutub negatif). Ciri-ciri umum (tergantung pabrik pembuat) sebagai berikut.
- Tegangan nominal per sel 2 volt.
- Ukuran baterai per sel lebih besar bila dibandingkan dengan baterai alkali. - Nilai berat jenis elektrolit sebanding dengan kapasitas baterai.
- Suhu elektrolit sangat mempengaruhi terhadap nilai berat jenis elektrolit, semakin tinggi suhu elektrolit semakin rendah berat jenisnya dan sebaliknya. - Nilai standar berat jenis elektrolit tergantung dari pabrik pembuatnya.
- Umur baterai dapat tergantung pada operasi dan pemeliharaan, biasanya dapat mencapai 10-15 tahun, dengan syarat suhu baterai tidak lebih dari 200 C.
- Tegangan pengisian per sel harus sesuai dengan petunjuk operasi dan pemeliharaan dari pabrik pembuat. sebagai contoh adalah:
Pengisian awal (Initial Charge): 2,7 Volt
Pengisian secara Floating: 2,18 Volt
Pengisian secara Equalizing: 2,25 Volt
Pengisian secara Boosting: 2,37 Volt.
- Tegangan pengosongan per sel (Discharge): 2,0 – 1,8 Volt.
2. Baterai Alkaline (Alkaline Storage Battery)
Baterai alkaline bahan elektrolitnya adalah larutan alkaline (Potassium Hydroxide) yang terdiri dari:
- Nickel-Iron Alkaline Battery (Ni-Fe battery) - Nickel-Cadmium Alkaline Battery (Ni-Cd battery)
Pada umumnya yang banyak dipergunakan di instansi unit pembangkit adalah baterai alkali-cadmium (Ni-Cd). Ciri-ciri umum (tergantung pabrik pembuat) sebagai berikut.
- Tegangan nominal per sel 1,2 volt
- Nilai berat jenis elektrolit tidak sebanding dengan kapasitas baterai.
- Umur baterai tergantung pada operasi dan pemeliharaan, biasanya dapat mencapai 15-20 tahun, dengan syarat suhu baterai tidak lebih dari 200 C. - Tegangan pengisian per sel harus sesuai dengan petunjuk operasi dan
Pengisian awal (initial charge) = 1,6-1,9 Volt
Pengisian secara Floating = 1,40-1,42 volt
Pengisian secara Equalizing = 1,45 Volt
Pengisian secara Boosting = 1,50-1,65 Volt Tegangan Pengosongan per sel (Discharge): 1 Volt.
3. Baterai Ni-Cd (Nickel-Cadmium)
Baterai Ni-Cd (Nickel-Cadmium) adalah jenis baterai yang menggunakan Nickel Oxide Hydroxide dan Metallic Cadmium sebagai bahan Elektrolitnya. Baterai Ni-Cd memiliki kemampuan beroperasi dalam jangkauan suhu yang luas dan siklus daya tahan yang lama. Di satu sisi, Baterai Ni-Cd akan melakukan discharge sendiri (self discharge) sekitar 30% per bulan saat tidak digunakan. Baterai Ni-Cd juga mengandung 15% Toksin/racun yaitu bahan Carcinogenic Cadmium yang dapat membahayakan kesehatan manusia dan lingkungan hidup.
4. Baterai Ni-MH (Nickel-Metal Hydride)
Baterai Ni-MH (Nickel-Metal Hydride) memiliki keunggulan yang hampir sama dengan Ni-Cd, tetapi baterai Ni-MH mempunyai kapasitas 30% lebih tinggi dibandingkan dengan Baterai Ni-Cd serta tidak memiliki zat berbahaya Cadmium yang dapat merusak lingkungan dan kesehatan manusia. Baterai Ni-MH dapat diisi ulang hingga ratusan kali sehingga dapat menghemat biaya dalam pembelian baterai. Baterai Ni-MH memiliki Self-discharge sekitar 40% setiap bulan jika tidak
digunakan. Saat ini Baterai Ni-MH banyak digunakan dalam Kamera dan Radio Komunikasi. Meskipun tidak memiliki zat berbahaya Cadmium, Baterai Ni-MH tetap mengandung sedikit zat berbahaya yang dapat merusak kesehatan manusia dan Lingkungan hidup, sehingga perlu dilakukan daur ulang (recycle) dan tidak boleh dibuang di sembarang tempat.
5. Baterai Li-Ion (Lithium-Ion)
Baterai jenis Li-Ion (Lithium-Ion) merupakan jenis baterai yang paling banyak digunakan pada peralatan Elektronika portabel seperti Digital Kamera, Handphone, Video Kamera ataupun Laptop. Baterai Li-Ion memiliki daya tahan siklus yang tinggi dan juga lebih ringan sekitar 30% serta menyediakan kapasitas yang lebih tinggi sekitar 30% jika dibandingkan dengan Baterai Ni-MH. Rasio Self-discharge adalah sekitar 20% per bulan. Baterai Li-Ion lebih ramah lingkungan karena tidak mengandung zat berbahaya Cadmium. Sama seperti Baterai Ni-MH (Nickel- Metal Hydride), Meskipun tidak memiliki zat berbahaya Cadmium, Baterai Li-Ion tetap mengandung sedikit zat berbahaya yang dapat merusak kesehatan manusia dan lingkungan hidup, sehingga perlu dilakukan daur ulang (recycle) dan tidak boleh dibuang di sembarang tempat.
2.1.2 Prinsip Kerja Baterai Ada dua prinsip kerja baterai yaitu: - Proses Discharging (Pengosongan)
Bila sel dihubungkan dengan beban maka elektron mengalir dari anoda melalui beban ke katoda, kemudian ion-ion negatif mengalir ke anoda dan ion-ion positif mengalir ke katoda.
- Proses Charging (Pengisian)
Bila sel dihubungkan dengan power supply maka elektroda positif menjadi anoda dan elektroda negatif menjadi katoda dan proses kimia yang terjadi adalah sebagai berikut:
- Aliran elektron menjadi terbalik, mengalir dari anoda melalui power supply ke katoda.
- Ion-ion negatif mengalir dari katoda ke anoda - Ion-ion positif mengalir dari anoda ke katoda.
2.1.3 Prinsip Kerja Baterai Asam
Bila sel baterai tidak dibebani, maka setiap molekul cairan elektrolit Asam Sulfat (H2SO4) dalam sel tersebut pecah menjadi dua yaitu ion hydrogen yang bermuatan positif (2H+) dan ion sulfat yang bermuatan negatif (SO4)
H2SO4 2H+ + SO4-
Proses Pengosongan
Bila baterai dibebani, maka tiap ion negatif sulfat (SO4) akan bereaksi dengan pelat timah murni (Pb) sebagai katoda menjadi timah sulfat (Pb SO4) sambil melepaskan dua elektron. Sedangkan sepasang ion hydrogen (2H+) akan bereaksi dengan pelat timah peroksida (Pb O2) sebagai anoda menjadi timah sulfat (Pb SO4) sambil mengambil dua elektron dan bersenyawa dengan satu atom oksigen untuk
membentuk air (H2O). Pengambilan dan pemberian elektron dalam proses kimia ini akan menyebabkan timbulnya beda potensial listrik antara kutub-kutub sel baterai.
Proses Pengisian
Proses ini adalah kebalikan dari proses pengosongan di mana arus listrik dialirkan yang arahnya berlawanan dengan arus yang terjadi pada saat pengosongan. Pada proses ini setiap molekul air terurai dan tiap pasang ion hydrogen (2H+) yang dekat pelat negatif bersatu dengan ion negatif sulfat (SO4-) pada pelat negatif untuk membentuk asam sulfat. Sedangkan ion oksigen yang bebas bersatu dengan tiap atom Pb pada pelat positif membentuk timah peroxide (PbO2).
2.2 Alat Pengisi Baterai (Charger)
Alat pengisi baterai atau charger adalah suatu rangkaian peralatan listrik yang digunakan untuk mengubah arus listrik bolak-balik (Alternating Current) menjadi arus listrik searah (Direct Current), yang berfungsi untuk pasokan DC power baik ke peralatan-peralatan yang menggunakan sumber DC maupun untuk mengisi baterai agar kapasitasnya tetap terjaga penuh.
2.2.1 Prinsip Kerja Alat Pengisi Baterai (Charger)
Sumber tegangan AC yang masuk melalui terminal input trafo step-down dari tegangan 220V menjadi tegangan 12VAC kemudian oleh dioda penyearah/thyristor arus bolak-balik (AC) tersebut dirubah menjadi arus searah dengan ripple atau gelombang DC tertentu. Kemudian untuk ripple atau gelombang DC yang terjadi diratakan dengan sebuah kapasistor yang dipasang sebelum terminal output.
2.2.2 Bagian-Bagian Alat Pengisi Baterai (Charger)
Alat pengisi baterai yang digunakan terdiri dari beberapa peralatan antara lain adalah:
1. Trafo utama
Trafo utama yang terpasang di rectifier merupakan trafo Step-Down (penurun tegangan) dari AC 220Volt menjadi AC 12 Volt. Besarnya kapasitas trafo tergantung dari kapasitas baterai dan beban yang terpasang pada baterai yaitu paling tidak kapasitas arus output trafo harus lebih besar 20 % dari arus pengisian baterai. Trafo yang digunakan ada yang 1 fasa ada juga yang 3 fasa.
2. Penyearah (dioda)
Dioda merupakan suatu bahan semikonduktor yang berfungsi merubah arus bolak-balik menjadi arus searah. Mempunyai 2 terminal yaitu terminal positif (anoda) dan terminal negatif (katoda).
3. Thyristor
Suatu bahan semikonduktor seperti dioda yang dilengkapi dengan satu terminal kontrol, Thyristor berfungsi untuk merubah arus bolak-balik menjadi arus searah. Thyristor mempunyai 3 terminal yaitu:
- Terminal positif (anoda) - Terminal negatif (katoda) - Terminal kontrol (gate).
Terminal gate ini terletak diantara katoda dan anoda yang bilamana diberi trigger sinyal positif maka konduksi mulai terjadi antara katoda dan anoda melalui gate, sehingga arus mengalir sebanding dengan besarnya tegangan trigger positif yang masuk pada terminal gate tersebut. Tegangan keluaran penyearah thyristor bervariasi tergantung pada sudut penyalaan dari thyristor.
2.2.3 Metode Pengisian
Ada beberapa metode pengisian baterai antara lain adalah: - Tegangan Konstan (Constant Voltage)
Pada dasarnya adalah berupa DC power supply biasa. Terdiri dari transformator step down dengan rangkaian penyearah untuk memberikan tegangan DC yang digunakan untuk mengisi baterai.
- Arus Konstan (Constant Current)
Metode ini memvariasikan nilai tegangan sehingga didapatkan besarnya arus yang konstan.
- Taper Constant
Metode taper constant mengisi daya baterai dari sumber tegangan konstan. Arus akan berkurang seiring dengan terbentuknya ggl (gaya gerak listrik) pada tegangan sel. - Pulsed Charged
Metode ini bekerja dengan mengirimkan arus listrik berbentuk pulsa pada baterai. Tingkat pengisian (berdasarkan rata-rata arus) dapat dikendalikan dengan memvariasikan lebar pulsa, biasanya sekitar satu detik. Selama proses pengisian, terdapat jeda kosong kira-kira sebesar 20 sampai 30 milidetik. Jeda ini diberikan untuk memungkinkan terjadinya reaksi kimia pada baterai untuk menstabilkan proses pengisian dari efek-efek yang tidak diinginkan seperti timbulnya gelombang gas, timbulnya kristal dan passivasi.
- Burp Charging
Metode ini merupakan kebalikan dari metode pulse charged, pengisian terjadi dengan menggunakan pulsa negatif pada baterai.
- Trickle Charge
Metode ini dirancang untuk mengimbangi debit daripada baterai. Tingkat pengisian disesuaikan dengan frekuensi debit baterai yang akan diisi.
2.3 Mobil Listrik
Mobil listrik adalah mobil yang digerakkan motor listrik, dengan menggunakan energi listrik yang disimpan dalam baterai. Mobil listrik memiliki beberapa kelebihan dibandingkan dengan mobil bermesin pembakaran biasa. Yang paling penting adalah mobil listrik tidak menghasilkan emisi ( ) gas rumah kaca karena tidak
menggunakan bahan bakar fosil. Akan tetapi penggunaan mobil listrik secara meluas memiliki banyak hambatan dan kekurangan, seperti harga, daya tahan baterai dan stasiun pengisian baterai.
Mobil Listrik yang ada di P3TKEBTKE (Pusat Penelitian dan Pengembangan Ketenagalistrikan Energi Baru Terbarukan dan Konversi Energi) adalah Mobil listrik yang mengandalkan baterai sebagai sumber energi untuk menggerakkan kendaraan. Bagian yang sangat penting pada mobil listrik jenis ini ada 4 bagian: 1). Motor listrik. 2). Baterai 3). Charger. 4). Sistem Kontrol seperti yang tampak pada Gambar 2.3.
Gambar 2.3. Mobil Listrik P3TKEBTKE Spesifikasi mobil listrik :
Motor : 3 HP, 48 Volt DC Series Transaction (General
Electric Supplies)
Battery : Deep Cycle 8Volt x 8 series configuration 48 Volt
200 Ah
Wheel (8”) and tire : 18x8, 5-8 wide tire
Steering system : Single-stage rack and pinion steering system
Automatic rocker compensating
Brake system : Mechanical drum brake Accelerator : Steepless speed change
Suspension system : Front and rear plate spring + vibration absorter Driving mode : Rear axie two stage deceleration, motor direct
driving
Rear axie : Rear axie, gear ratio 12,49:1 Max Speed : 10-40 Km/h
Min turnigng radius : 5 Meter
Body : Steel framework + Composite Fiber lass body Seats : Spoonge + artifical Leather
Floor : Steel + Composite fiber glass
Dashboar : Forward/reverse switch, battery capasity indicator, ignition key
Lighting system&horn : 1 Headlights, 2 font turn signals, 2tailights (each combine 1 brake with 1 turn signal)
2.4 Fuel Cell
Fuel cell ialah salah satu pembangkit listrik energi terbarukan dengan cara mengkonversi energi kimia fuel (bahan bakar) secara kontinyu menjadi energi listrik. Fuel cell memiliki persamaan dengan baterai yaitu proses yang terjadi elektrokimia
dan sama-sama mengkasilkan arus listrik searah (DC), tetapi pada pembangkit listrik fuel cell biasanya ditambahkan inverter agar menjadi arus bolak-balik (AC) sehingga dapat disesuaikan dengan sistem listrik yang telah ada. Dari penjelasan singkat di atas, fuel cell memiliki karakteristik konversi energi yang sama dengan baterai. Tetapi fuel cell tetap memiliki perbedaan mendasar dengan baterai.
Pada fuel cell sumber energi diberikan secara kontinyu dari luar sistem, sehingga apabila suplai dari sumber terhenti/habis maka listrik yang dihasilkan pun akan terhenti. Berbeda dengan baterai yang bahan bakarnya sudah berpadu menjadi satu kesatuan, sehingga apabila energi yang dihasilkan sudah habis maka perlu diganti atau di isi kembali (recharged)
2.4.1 Karakteristik Fuel Cell
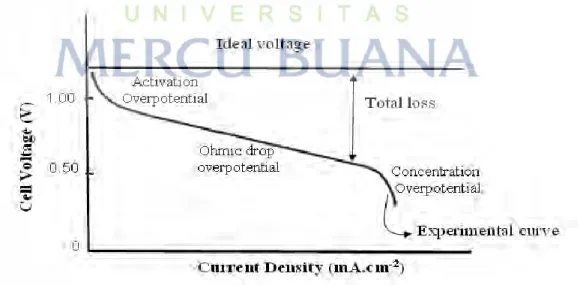
Karakteristik fuel cell dapat dilihat dari dua kondisi yaitu kondsi sisi ideal dan kenyataan. Secara teori pada kondisi ideal (tergantung oleh suhu dan tekanan pada setiap jenis fuel cell) maka setiap hidrogen ( ) atau oksigen ( ) dalam hal ini dimisalkan mampu menghasilkan tegangan sebesar 1,22V dc. Tegangan ideal ini biasa disebut dengan tegangan Nemst (Nernst potensial) yaitu tegangan yang dihasilkan oleh fuel cell saat open circuit (antara 2 elektroda) pada saat kondisi temperatur dan tekanan ideal. Tegangan ini dipengaruhi oleh temperatur yang ada karena proses kimiawi yang ada. Karena jumlah produksi fuel cell yaitu listrik dan air sangat dipengaruhi oleh meningkatnya temperatur yang ada.
Keunggulan fuel cell terbesar dari pembangkit listrik jenis lain adalah ramah lingkungan karena keluaran dari fuel cell itu sendiri, selain itu keunggulan lain seperti
tidak bising dikarenakan tidak adanya komponen yang bergerak pada modul FC sehingga hal ini juga dapat memberikan keuntungan tambahan dari segi umur fuel cell itu sendiri yang mengurangi gesekan secara perlahan yang akan mengikis komponen-komponen yang saling berhubungan. Sementara itu kelemahan dari fuel cell itu sendiri adalah mahalnya alat fuel cell itu sendiri dan bahan bakar yang berupa hidrogen dan segi keamanan yang harus ditingkatkan karena hidrogen mudah terbakar.
Perubahan tegangan keluaran fuel cell yang dominan dipengaruhi oleh arus beban tersebut sebenarnya dapat dijelaskan dengan kurva karakteristik fuel cell, karakteristik tegangan keluaran fuel cell memang dipengaruhi oleh arus keluaran yang berarti tegangan keluaran fuel cell dipengaruhi oleh besarnya beban. Jika perubahan beban berubah-ubah maka arus yang dihasilkan akan ikut berubah-ubah, sehingga tegangan keluaran dari fuel cell juga ikut berubah-ubah.
2.4.2 Prinsip Kerja Fuel Cell
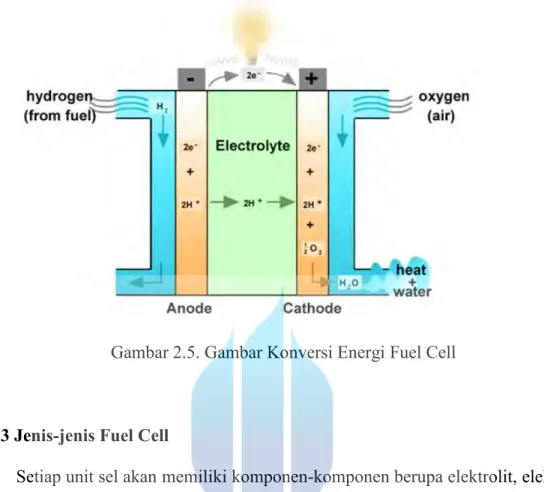
Fuel cell (sel bahan bakar) adalah suatu konverter dari energi kimia menjadi energi listrik dengan memanfaatkan hidrogen dan oksigen untuk bereaksi dimana operasi jangka panjangnya dapat terus menerus terjadi selama bahan bakarnya dapat terus disuplai yaitu hidrogen dan oksigen. Gas hidrogen dan oksigen secara elektrokimia dikonverter menjadi air. Reaksi secara keseluruhannya adalah sebagai berikut:
Anoda: H2 → 2 H+ + 2 e
-Katoda: ½ O2 + 2 H+ + 2 e- → H2O
Reaksi total: H2 + ½ O2 → H2O + energi listrik + kalor
Prinsip kerja fuel cell yaitu hidrogen di dalam sel dialirkan menuju sisi anoda sedangkan oksigen di dalam udara dialirkan menuju sisi katoda. Pada anoda terjadi pemisahan hidrogen menjadi elektron dan proton (ion hidrogen). Ion hidrogen ini kemudian menyebrang dan bertemu dengan oksigen dan elektron di katoda dan menghasilkan air. Elektron-elektron yang mengandung muatan listrik ini akan menuju katoda melalui jaringan eksternal. Aliran elektron-elektron inilah yang akan menghasilkan arus listrik. Skema fuel cell diperlihatkan pada Gambar 2.5
Gambar 2.5. Gambar Konversi Energi Fuel Cell
2.4.3 Jenis-jenis Fuel Cell
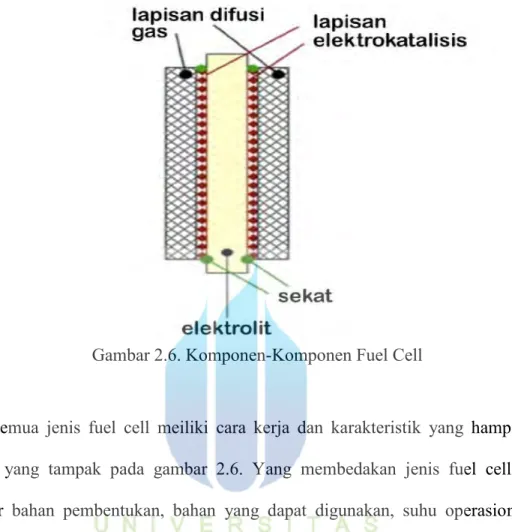
Setiap unit sel akan memiliki komponen-komponen berupa elektrolit, elektroda, lapisan difusi gas dan lapisan katalis. Lapisan katalis merupakan tempat terjadinya reaksi yang menghasilkan ion-ion dengan bantuan katalis. Elektrolit berguna untuk menghantarkan ion-ion yang dihasilkan dari reaksi yang terjasi pada lapisan katalis. Jenis elektrolit ini dapat bermacam-macam dan merupakan salah satu faktor yang membedakan jenis FC yang satu dengan yang lainnya. Lapisan difusi gas merupakan tempat masuknya gas hidrogen yang menjadi bahan bakar utama FC. Desain alur pada lapisan difusi ini berperan besar dalam sebaran aliran gas yang akan bereaksi pada lapisan katalis. Hal ini secara tidak langsung akan mempengaruhi laju reaksi pembentukan ion pada lapisan katalis.
Gambar 2.6. Komponen-Komponen Fuel Cell
Semua jenis fuel cell meiliki cara kerja dan karakteristik yang hampir sama seperti yang tampak pada gambar 2.6. Yang membedakan jenis fuel cell adalah struktur bahan pembentukan, bahan yang dapat digunakan, suhu operasional, dan aplikasi yang dapat digunakan untuk spesifikasi tertentu serta besar daya yang digunakan.
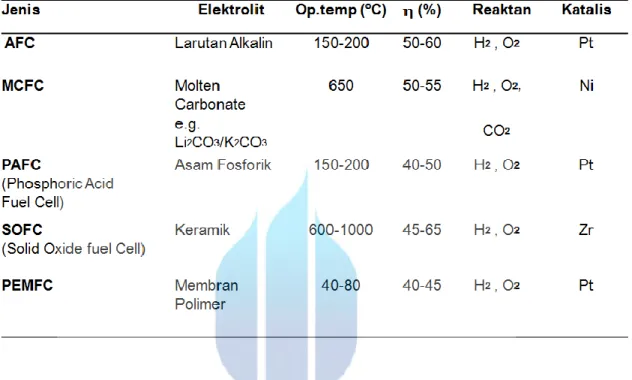
Berikut merupakan perbedaan jenis-jenis fuel cell, yang bisa dilihat di bawah ini:
Tabel 2.1. Jenis-Jenis Fuel Cell
Proton Exchange Membrane Fuel Cell (PEMFC)
Sesuai namanya PEMFC, menggunakan proton sebagai konduktor melewati membrane dari bahan polimer yang berfungsi sebagai elektrolit dari anoda ke katoda. Oleh karena itu juga disebut Polimer Electrolit Fuel Cell (PEFC). Dan platina yang digunakan sebagai katalisator yang melapisi 2 elektroda. Karena menggunakan proton sebagai konduktor untuk melewati membra dari bahan polimer yang berfungsi sebagai elektrolit dari anoda ke katoda, membran ini berupa lapisan tipis padat yang berfungsi sebagai elektrolit pemisah katoda dan anoda. Membran ini secara selektif mengontrol transport proton dari anoda ke katoda dalam fuel cell.
Gambar 2.7. Stack PEMFC
Fuel cell PEM bekerja pada suhu rendah ( ) menggunakan hidrogen murni dalam bentuk gas sebagai bahan bakar yang akan dialirkan ke anoda dalam bentuk konstan. Struktur PEMFC biasa di sebut dengan sel, pada umumnya hanya mampu menghasilkan energi listrik dalam jumlah relatif kecil sehingga diperlukan lebih dari satu sel agar daya yang dihasilkan memadai untuk aplikasi listrik. Sel-sel ini dirangkai secara seri dengan memanfaatkan plat pembatas bipolar antar sel yang disebut Stack, seperti gambar 2.7.
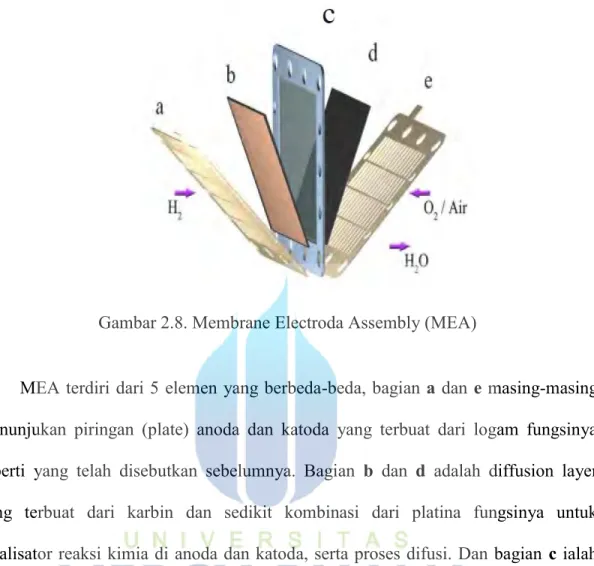
Gambar 2.8. Membrane Electroda Assembly (MEA)
MEA terdiri dari 5 elemen yang berbeda-beda, bagian a dan e masing-masing menunjukan piringan (plate) anoda dan katoda yang terbuat dari logam fungsinya seperti yang telah disebutkan sebelumnya. Bagian b dan d adalah diffusion layer yang terbuat dari karbin dan sedikit kombinasi dari platina fungsinya untuk katalisator reaksi kimia di anoda dan katoda, serta proses difusi. Dan bagian c ialah membran bagian tengah yang dikenal sebagai rubber gasket berfungsi menyaring gas proton saja yang dapat melewatinya.
Alkaline Fuel Cell
AFC merupakan salah satu sejenis fuel cell awal, temperatur yang duhasilkan tergantung oleh konsentrasi elektrolit jika temperatur yang ada mencapai < C maka konsentrasi elektrolitnya yang ada 35%-50%. Reaktan AFC hanya dibatasi dari jenis hidrogenmurni dan oksigen atau karbonmonoksida murni (udara bebas), AFC
juga menghasilkan racun yaitu karbon monoksida (CO). selain itu adanya gas ( ) memberikan reaksi yang buruk karena dapat bereaksi dengan elektrolit yang ada sehingga mengubah kebentuk lain, akibatnya elektrolit yang ada berkurang. AFC tidak memiliki kerugian yang besar untuk aplikasi komersial, karena penggunaan hidrogen murni yang efektif dan penggunaan udara bebas yang sedikit.
Phosphoric Acid Fuel Cell
PAFC menggunakan asam fospor sebagai elektrolit yang bekerja pada suhu sekitar C dan mampu untuk dioperasikan pada udara lembab, serta menggunakan dan uap hidrogen sebagai bahan bakar. Ada kesamaan pada PAFC dan PEMFC yaitu pada penggunaan katalis dari bahan metal (platina) yang harganya mahal pada kedua elektrodanya. Panas yang dihasilkan dari proses yang ada bersuhu cukup tinggi untuk memanaskan air dan meningkatkan tekanan uap pada sistem. PAFC dengan suhu tinggi ini tidak dapat menyokong kinerja reformer (pengkonversian) bahan bakar umum seperti gas alam, oleh karena itu dibutuhkan eksternal reformer yang beroperasi pada suhu tinggi dan mampu mengubah ikatan bahan bakar hidrokarbon menjadi hidrogen murni. Yang artinya mempengaruhi efisiensi sistem secara keseluruhan. Maka dari itu PAFC memiliki keterbatasan yang harus diperbaiki yaitu masalah pada manajemen panas yang terbuang, masih bergantung pada katalisator yang mahal (platina) dan adanya proses efisiensi konversi elektro yang cukup telah merangsang fuel cell dengan suhu yang tinggi.
Solid Oxide Fuel Cell
Pada SOFC menggunakan elektrolit Solid Nonporous Ceramic antara lain: - . Operasinya pada suhu tertinggi dibandingkan dengan fuel cell lainnya yaitu C - C, yang berarti cukup untuk adanya eksternal. Sama dengan CFC gas CO merupakan bahan bakarnya, begitu pula temperatur yang dihasilkan sama-sama tinggi meski dapat mempercepat reaksi kimia tetapi dengan bahan bakar yang ada dapat mempercepat terjadinya korosi. SOFC dapat menghasilkan pembangkit listrik stasioner dengan kapasitas ratusan kilowatt atau lebih tinggi lagi (puluhan mega watt). Karena suhunya yang sangat tinggi, SOFC dapat dikombinasikan dengan generator lain agar dapat dicapai daya yang maksimum seperti PLTGU.
2.5 Kelebihan dan Kekurangan Teknologi Fuel Cell 2.5.1 Kelebihan Fuel Cell
1. Tidak Mengeluarkan Emisi Berbahaya (Zero Emission)
Sebuah sistem fuel cell hanya akan mengeluarkan uap air apabila memakai hidrogen murni. Tetapi ketika memakai hidrogen hasil dari reforming hidrokarbon/fosil (misal: batu bara, gas alam, dll) maka harus dilakukan uji emisi untuk menentukan apakah sistem tersebut masih dapat dikategorikan zero emission. Menurut standar yang dikeluarkan United Technologies Corporation (UTC) pada tahun 2002, maka sebuah sistem fuel cell dapat dikategorikan zero
emission ketika mengeluarkan emisi pencemar udara yang sangat rendah, dengan kriteria sbb: NOx =< 1 ppm, SO2 =< 1 ppm, CO2 =< 2 ppm.
Tabel 2.2. Emisi Pencemar Udara dari Jenis-Jenis Fuel Cell
Catatan: PEM (Polimer Electrolyte Membrane), PAFC (Posporic Acid Fuel Cell), SOFC (Solid Oxide Fuel Cell), MCFC (Molten Carbonate Fuel Cell), 1 lb (pon) = 0,45 kg). Selain itu, sistem ini juga tidak mengeluarkan suara (tidak berisik), kecuali suara dari beberapa peralatan pendukung seperti pompa, kipas, kompresor, dll.
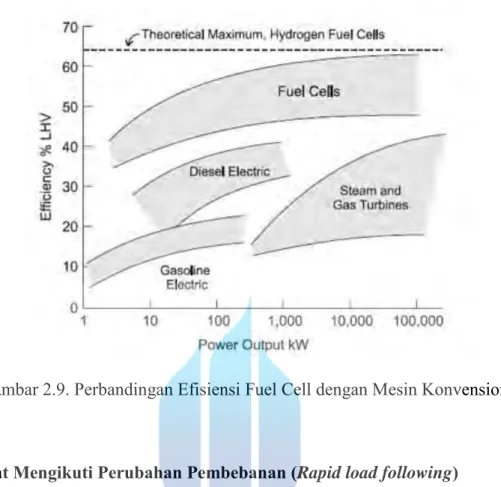
2. Efisiensi Tinggi (High efficiency)
Oleh sebab fuel cell tidak menggunakan proses pembakaran dalam konversi energi, maka efisiensinya tidak dibatasi oleh batas maksimum temperatur operasional (tidak dibatasi oleh efisiensi siklus Carnot). Hasilnya, efisiensi konversi energi pada fuel cell melalui reaksi elektrokimia lebih tinggi dibandingkan efisiensi konversi energi pada mesin kalor (konvensional) yang melalui reaksi pembakaran.
Gambar 2.9. Perbandingan Efisiensi Fuel Cell dengan Mesin Konvensional
3. Cepat Mengikuti Perubahan Pembebanan (Rapid load following)
Fuel cell memperlihatkan karakteristik yang baik dalam mengikuti perubahan beban. Sistem Fuel cell yang menggunakan hidrogen murni dan digunakan pada sebagian besar peralatan mekanik (misal: motor listrik) memiliki kemampuan untuk merespon perubahan pembebanan dengan cepat.
4. Temperatur Operasional Rendah
Sistem fuel cell sangat baik diaplikasikan pada industri otomotif yang beroperasi pada temperatur rendah. Keuntungannya adalah fuel cell hanya memerlukan sedikit waktu pemanasan (warmup time), resiko operasional pada temperatur tinggi dikurangi, dan efisiensi termodinamik dari reaksi elektrokimia lebih baik.
5. Reduksi Transformasi Energi
Ketika fuel cell digunakan untuk menghasilkan energi listrik maka fuel cell hanya membutuhkan sedikit transformasi energi, yaitu dari energi kimia menjadi energi listrik. Bandingkan dengan mesin kalor yang harus mengubah energi kimia menjadi energi panas kemudian menjadi energi mekanik yang akan memutar generator untuk menghasilkan energi listrik. Fuel cell yang diaplikasikan untuk menggerakkan motor listrik memiliki jumlah transformasi energi yang sama dengan mesin kalor, tetapi transformasi energi pada fuel cell memiliki efisiensi yang lebih tinggi.
Gambar 2.10. Transformasi Energi Untuk Keluaran Energi Mekanik
6. Waktu Pengisian Hidrogen Singkat
Sistem fuel cell tidak perlu penyetruman (recharge) layaknya baterai. Tetapi sistem fuel cell harus diisi ulang dengan hidrogen, dimana prosesnya lebih cepat dibandingkan penyetruman baterai. Selain itu, baterai tidak dapat dipasang dalam
jumlah besar pada mesin otomotif untuk meningkatkan performance karena akan semakin menambah beban pada kendaraan tersebut.
Gambar 2.11. Stasiun Pengisian Hidrogen
2.5.2 Kekurangan Fuel Cell 1. Hidrogen
Hidrogen sulit untuk diproduksi dan disimpan. Saat ini proses produksi hidrogen masih sangat mahal dan membutuhkan input energi yang besar (artinya: efisiensi produksi hidrogen masih rendah). Untuk mengatasi kesulitan ini, banyak negara menggunakan teknologi reforming hidrokarbon/fosil untuk memperoleh hidrogen. Tetapi cara ini hanya digunakan dalam masa transisi untuk menuju produksi hidrogen dari air yang efisien.
2. Sensitif pada Kontaminasi Zat-asing
Fuel cell membutuhkan hidrogen murni, bebas dari kontaminasi zat-asing. Zat-asing yang meliputi sulfur, campuran senyawa karbon, dll dapat menonaktifkan katalisator dalam fuel cell dan secara efektif akan menghancurkannya. Pada mesin
kalor pembakaran dalam (internal combustion engine), masuknya zat-asing tersebut tidak menghalangi konversi energi melalui proses pembakaran.
3. Harga Katalisator Platinum Mahal
Fuel cell yang diaplikasikan pada industri otomotif memerlukan katalisator yang berupa Platinum untuk membantu reaksi pembangkitan listrik. Platinum adalah logam yang jarang ditemui dan sangat mahal. Berdasarkan survei geologis ahli USA, total cadangan logam platinum di dunia hanya sekitar 100 juta kg (Bruce Tonn and Das Sujit, 2001). Dan pada saat ini, diperkirakan teknologi fuel cell berkapasitas 50 kW memerlukan 100 gram platinum sebagai katalisator (DEO, 2000). Misalkan penerapan teknologi fuel cell berjalan baik (meliputi: penghematan pemakaian platinum pada fuel cell, pertumbuhan pasar fuel cell rendah, dan permintaan platinum rendah) maka sebelum tahun 2030 diperkirakan sudah tidak ada lagi logam platinum (Anna Monis Shipley and R. Neal Elliott, 2004). Untuk itulah diperlukan penelitian untuk menemukan jenis katalisator alternatif yang memiliki kemampuan mirip katalisator dari platinum.
4. Pembekuan
Selama beroperasi, sistem fuel cell menghasilkan panas yang dapat berguna untuk mencegah pembekuan pada temperatur normal lingkungan. Tetapi jika temperatur lingkungan terlampau sangat dingin (-10 s/d -20 C) maka air murni yang dihasilkan akan membeku di dalamfuel cell dan kondisi ini akan dapat merusak membran fuel cell (David Keenan, 10/01/2004). Untuk itu harus didesain sebuah
sistem yang dapat menjaga fuel cell tetap berada dalam kondisi temperatur normal operasi.
Gambar 2.12. Tes Mobil Bermesin Fuel Cell pada Kondisi Bersalju
5. Teknologi Tinggi & Baru
Perlu dikembangkan beberapa material alternatif dan metode konstruksi yang baru sehingga dapat mereduksi biaya pembuatan sistem fuel cell (harga komersial saat ini untuk pembangkit listrik dengan fuel cell ~$4000/kW) (Javit Drake, 29/03/2005).
2.6 Rangkian Seri
Rangkaian seri terdiri dari dua atau lebih beban listrik yang dihubungkan ke satu daya lewat satu rangkaian .
Rangkaian seri dapat berisi banyak beban dalam satu rangkaian. Contoh yang baik dari beberapa beban rangkaian yang dihubungkan seri adalah dua lampu pohon Natal (kurang lebih 20 lampu dalam rangkaian seri). Dua buah elemen berada dalam
sebuah susunan seri jika mereka hanya memiliki sebuah titik utama yang tidak terhubung menuju elemen pembawa arus pada suatu jaringan. Karena semua elemen disusun seri, maka jaringan tersebut disebut rangkaian seri. Dalam rangkaian seri, arus yang lewat sama besar pada masing-masing elemen yang tersusun seri.
Sifat-sifat Rangkaian Seri adalah beikut ini:
Arus yang mengalir pada masing beban adalah sama.
Tegangan sumber akan dibagi dengan jumlah tahanan seri jika besar tahanan sama. Jumlah penurunan tegangan dalam rangkaian seri masing-masing tahanan seri adalah sama dengan tegangan total sumber tegangan.
Banyak beban listrik yang dihubungkan dalam rangkaian seri, tahanan total rangkaian menyebabkan penurunan arus yang mengalir dalam rangkaian. Arus yang mengalir tergantung pada jumlah besar tahanan beban dalam rangkaian.
Jika salah satu beban atau bagian rangkaian tidak terhubung atau putus, aliran arus terhenti.
Prinsip dalam rangkaian seri adalah sebagai berikut:
Hambatan total merupakan hasil penjumlahan tiap-tiap hambatan serinya.
Kuat arus dalam tiap-tiap hambatannya tetap dan besarkuat arus setiap hambatan sama dengan kuat arus totalnya.
Beda potensial atau teganngan tiap-tiap hambatannya berbeda-beda dan hasil penjumlahan tegangan tiap-tiap hambatannya sama dengan tegangan totalnya.
Rumus tegangan rangkaian seri:
Vtotal = V1 + V2 +….+ Vn………(2.1) Dimana: Vtotal = tegangan total V1 = tegangan 1
V2 = tegangan 2 Vn = tegangan akhir
2.7 Rumus Daya listrik
Daya listrik seperti daya mekanik, dilambangkan oleh huruf P dalam persamaan listrik. Pada rangkaian arus DC, daya listrik sesaat dihitung dengan menggunakan Hukum Joule, sesuai dengan fisikawan Britania James Joule, yang pertama kali menunjukan bahwa energi listrik dapat berubah menjadi energi mekanik. Rumus umum yang digunakan untuk menghitung daya listrik dalam sebuah rangkaian listrik adalah sebagai berikut
P = V x I.………..(2.1) Dimana: P = Daya (meter) I = Arus (ampere) V = Perbedaan potensial (volt)
2.8 Rumus Rata-Rata
Rata-rata merupakan ukuran statistik kecenderungan terpusat yang paling sering digunakan. Rata-rata ada beberapa macam yaitu rata-rata hitung (aritmatik), rata-rata geometrik, rata-rata harmonic dan lain-lain. Tetapi jika hanya disebut dengan kata “rata-rata” saja, maka rata-rata yang dimaksud adalah rata-rata hitung (aritmatik).
Perhintngan rata-rata dilakukan dengan menumlahkan seluruh data satu kelompok sampel, kemudian dibagi dengan jumlah sampel tersebut dengan rumus sebagai berikut:
= ………(2.3)
Dimana: = rata-rata hitung n = jumlah sampel = nilai sampel ke-n
2.9 Rumus Kecepatan Rata-Rata
Perpindahan partikel dari satu posisi ke posisi lain dalam selang waktu tertentu disebut dengan kecepatan rata-rata. Kecepatan rata-rata memiliki arah yang sama dengan arah perpindahan. Kecepatan rata-rata pada bidang dua dimensi dinyatakan sebagai berikut:
Gambar 2.13. Perubahan Posisi Benda
Berdasarkan gambar diatas dapat diketahui bahwa perubahan posisi benda (titik materi) dari A ke B adalah Δr = rB – rA, sedangkan selang waktu yang diperlukan adalah Δt = tB–tA. Hasil bagi antara perpindahan dan selang waktu tersebut adalah kecepatan rata-rata yang dirumuskan:
̅ = = – – ………. (2.4)
Dimana: v = kecepatan rata-rata (m/s) Δt = selang waktu (s) Δr = perpindahan (m)