ENZIM ARABINOSA ISOMERASE DARI GEN BAKTERI
PRODUKSI DAN KARAKTERISASI
ENZIM ARABINOSA ISOMERASE DARI GEN BAKTERI
Geobacillus stearothermophilus
INSTITUT PERTANIAN BOGOR
PRODUKSI DAN KARAKTERISASI
ENZIM ARABINOSA ISOMERASE DARI GEN BAKTERI
Geobacillus stearothermophilus
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRODUKSI DAN KARAKTERISASI
ENZIM ARABINOSA ISOMERASE DARI GEN BAKTERI
Geobacillus stearothermophilus
YONI ATMA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
PRODUKSI DAN KARAKTERISASI
ENZIM ARABINOSA ISOMERASE DARI GEN BAKTERI
Geobacillus stearothermophilus
YONI ATMA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
PRODUKSI DAN KARAKTERISASI
ENZIM ARABINOSA ISOMERASE DARI GEN BAKTERI
LOKAL
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ENZIM ARABINOSA ISOMERASE DARI GEN BAKTERI
ENZIM ARABINOSA ISOMERASE DARI GEN BAKTERI
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Produksi dan Karakterisasi Enzim Arabinosa Isomerase dari Gen Bakteri Geobacillus stearothermophilus Lokal adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Juli 2011
Yoni Atma
ABSTRACT
YONI ATMA. Production and Characterization of an Arabinose Isomerase from Gene of Geobacillus stearothermophilus Local Strain. Under direction of MAGGY T. SUHARTONO and BUDI SAKSONO.
Arabinose isomerase (AI) is an enzyme that catalyzes isomerization of galactose to tagatose. Besides being used as a low-calorie sweeteners, tagatose has been developed as a functional food because it provides many health benefits such as promoting of weight-loss, anti-halitosis, prebiotic, treating of obesity and reducing in symptoms associated with type 2 diabetes, hyperglycemia, anemia, and hemophilia. Thermostable AIs are potential for tagatose production. AI enzymes encoded by araA gene. The araA gene Geobacillus stearothermophilus originated from Tanjung Api, Poso, Indonesia has been successfully cloned and exspressed at previously study in E. coli BL21 (DE3) pLysS. However expression level of AI still low by SDS-PAGE analysis. The E. coli BL21 was incubated in 37°C at 150 rpm. This research was conducted to optimize the araA gene expression. Result from this research showed that the medium tofu liquid waste consisting yeast extract 0.5% (TLW+YE) increased enzyme productivity. Optimation production was obtained by 16 hours induction. The purification was carried out with three steps of freeze-thaw at -70°C, heat treatment (60°C, 30 minutes) and DEAE ion exchange chromatography (elution buffer 0-1000 mM NaCl). The purified enzyme exhibited optimum activity at 60°C and pH 7. The AI activity in the presence of CaCl2 and MnCl2 was increased to 152% and 563% respectively. Heat stability of enzymes in the presence of CaCl2 and MnCl2 was increased. Half-life (t1/2) AI in the presence 1 mM of CaCl2 and MnCl2 was increased becomes 301 and 990 minutes respectively.
Keywords: arabinose isomerase, tagatose, araA gene, G. stearothermophilus,
RINGKASAN
YONI ATMA. Produksi dan Karakterisasi Enzim Arabinosa Isomerase dari Gen Bakteri Geobacillus stearothermophilus Lokal. Dibimbing oleh MAGGY T. SUHARTONO dan BUDI SAKSONO.
Enzim arabinosa isomerase (AI) dapat mengkatalisis secara revesible reaksi isomerisasi D-galaktosa menjadi D-tagatosa. Tagatosa telah digunakan sebagai pemanis rendah kalori (1,5 kkal/g) yang memiliki tingkat kemanisan 92% dibandingkan sukrosa. Tagatosa memberikan berbagai manfaat kesehatan diantaranya seperti menurunkan berat badan, prebiotik, anti-histolisis serta mereduksi sejumlah gejala yang berhubungan dengan diabetes tipe 2, hiperglikemia, obesitas, anemia dan hemophilia. Peran tagatosa sebagai antidiabetes akan bermanfaat sebagai gula alternatif di Indonesia, mengingat Indonesia menempati peringkat ke-4 dengan jumlah penderita diabetes terbesar di dunia.
Produksi tagatosa menggunakan katalis logam memiliki banyak kekurangan. Sedangkan penggunaan beberapa jenis enzim seperti sorbitol dehidrogenase, D-psicosa 3-epimerse, dan D-tagatosa 3-epimerase meskipun lebih ramah lingkungan dibandingkan katalis logam, akan tetapi 3 jenis enzim tersebut membutuhkan substrat yang sangat mahal. Oleh sebab itu, saat ini enzim paling banyak dicari untuk memproduksi tagatosa adalah enzim arabinosa isomerase (AI). Pembentukan tagatosa oleh enzim AI sangat efisien karena substrat yang dibutuhkan dan tahapan produksinya.
Studi produksi dan pencarian enzim AI termostabil lebih difokuskan, sebab konversi D-galaktosa menjadi D-tagatosa meningkat dengan peningkatan suhu (> 50ºC). Selain itu, enzim-enzim pangan yang bersifat termostabil juga menjadi semakin penting dalam dunia industri. Hal ini berkaitan dengan keuntungan yang akan diperoleh bila proses produksi dilakukan pada suhu tinggi. Produksi enzim AI pada bakteri dilakukan dengan menggunakan inang E. coli. Gen araA yang mengkode AI dikloning melalui plasmid ke bakteri E. coli BL21. E. coli kemudian akan mengekspresikan atau menghasilkan AI setelah diberi senyawa penginduksi. Diantara beberapa bakteri temofilik yang telah diteliti, AI yang berasal dari bakteri G. stearothermophilus memiliki kemampuan tertinggi dalam menghasilkan tagatosa dan telah mendekati skala produksi komersial.
Kloning dan ekspresi gen araA dari G. stearothermophilus lokal asal Tanjung Api, Poso, Indonesia menggunakan inang E. coli BL21 pLysS pET21b telah dilakukan pada studi sebelumnya. Namun analisis dengan Sodium Dodecyl
Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE) menunjukkan tingkat
ekspresi gen araA pada media ekspresi (fermentasi) Luria Bertani (LB) masih rendah. Ekspresi gen araA ini perlu ditingkatkan sehingga jumlah enzim AI yang dihasilkan optimal. Selain untuk meningkatkan produksi enzim, penelitian ini juga dilakukan untuk memurnikan enzim yang telah diperoleh dan menganalisis karakteristik enzim AI dari G. stearothermophilus lokal.
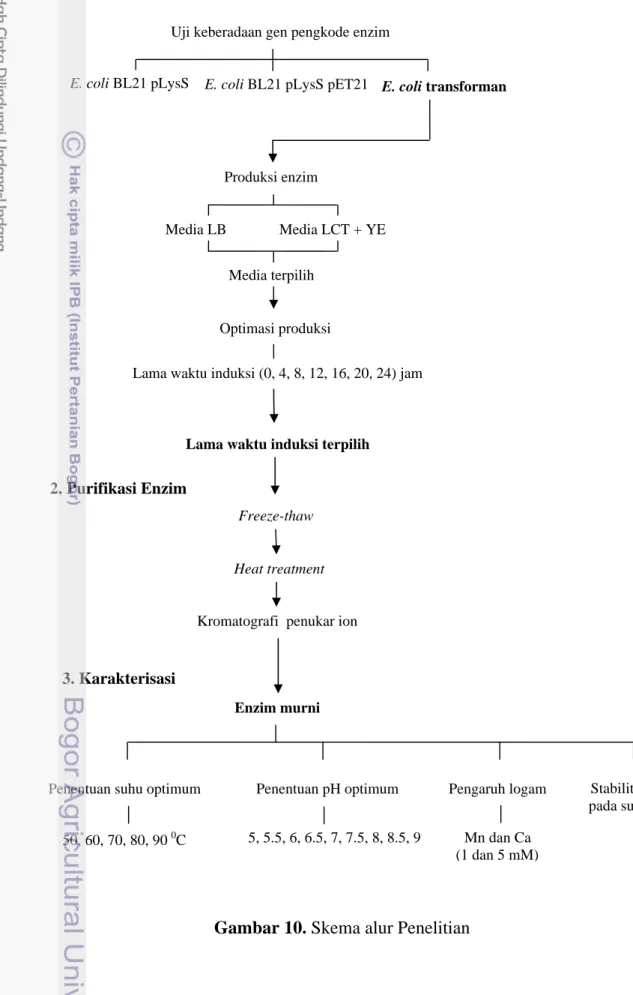
Penelitian dilakukan dengan 3 tahap yaitu produksi, purifikasi dan karakterisasi. Penelitian diawali dengan produksi enzim melalui modifikasi medium ekpresi. Modifikasi medium ekpresi dilakukan dengan menggunakan
limbah cair tahu yang ditambahkan dengan 0.5% ekstrak khamir (m/v) (LCT+YE) dan diatur pH media LCT+YE tersebut sama dengan pH Luria Bertani (LB). Tingkat ekspresi enzim pada media LCT+YE dibandingkan dengan LB. Selanjutnya dilakukan optimasi produksi dengan lama waktu induksi pada medium ekspresi terpilih. Hasil yang optimal dikonfirmasi dengan SDS-PAGE (melalui ketebalan pita) dan aktivitas enzim. Hasil produksi yang paling optimal kemudian dipurifikasi dan dikarakterisasi.
Purifikasi dilakukan melalui 3 langkah secara kontinu, antara lain: 1)
freeze-thaw dengan cara memasukkannya total suspensi sel pada freezer bersuhu -700C sampai membeku selama ± 30 menit dan mencairkannya kembali (freeze-thaw dilakukan dengan 3 kali pengulangan), 2) heat treatment pada suhu 600C selama 30 menit, dan 3) kromatografi penukar ion dengan resin dietil amino etil (DEAE). Larutan NaCl dengan konsentrasi 0, 100, 300, 400, 500 dan 1000 mM digunakan sebagai garam pengelusi ketika purifikasi menggunakan kolom kromatografi dilakukan. Enzim murni yang diperoleh kemudian dikarakterisasi yang meliputi penentuan suhu dan pH optimum, logam aktivator, stabilitas panas serta waktu paruh enzim.
Analisis keberadaan enzim target dilakukan menggunakan SDS-PAGE. Metode Bradford digunakan untuk analisis protein atau enzim secara kuantitatif.
Bovine serum albumin (BSA) digunakan sebagai standar protein saat analisis
dengan larutan Bradford. Enzim yang telah direaksikan dengan larutan Bradford dibiarkan selama 2-5 menit pada suhu 370C, kemudian absorbansinya diukur dengan spektrofotometer pada panjang gelombang 595 nm. Aktivitas enzim diukur dengan metode larutan pewarna sisten karbazol asam sulfat. Substrat galaktosa direaksikan dengan enzim, kemudian diinkubasi pada suhu 600C selama 60 menit. Setelah reaksi enzimatis dihentikan, kemudian diberi larutan pewarna sisten karbazol asam sulfat dan diinkubasi kembali pada suhu 600C selama 30 menit. Absorbansi warna diukur dengan spektrofotometer pada panjang gelombang 560 nm. Pada pengukuran aktivitas enzim, fruktosa digunakan sebagai standar produk yang telah terbentuk.
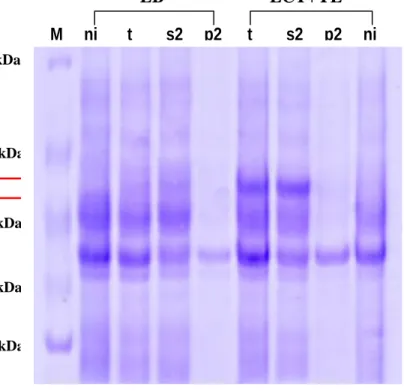
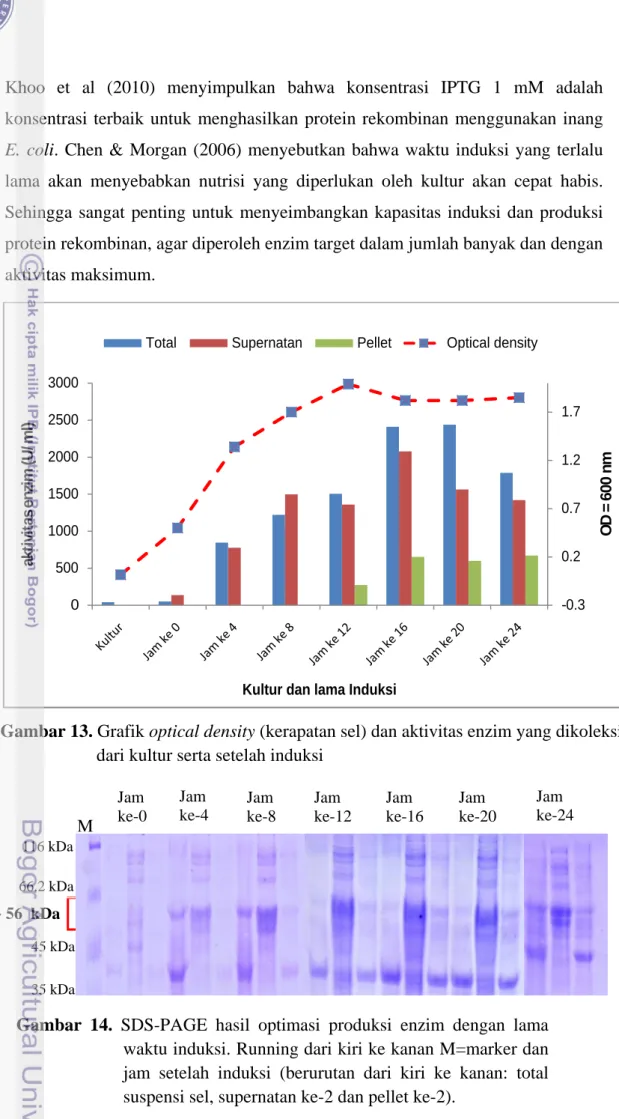
Dari analisis dengan SDS-PAGE disimpulkan bahwa medium ekpresi yang lebih baik untuk produksi enzim AI adalah LCT + YE. Media cair LB juga dapat digunakan sebagai medium ekspesi, akan tetapi pita enzim target yang dihasilkan sangat tipis dibandingkan dengan medium LCT + YE. Optimasi produksi enzim AI dengan mekanisme ekspresi terinduksi yang paling optimum adalah dengan lama waktu induksi 16 jam. Aktivitas total suspensi sel tertinggi terdapat pada lama waktu induksi 16 jam dan 20 jam. Tetapi induksi selama 16 jam memiliki aktivitas enzim pada bagian supernatant ke-2 yang lebih tinggi (±2000 U/ml) dibandingkan induksi jam ke-20 (±1500 U/ml). Bagian supernatan ke-2 merupakan bagian enzim pada sitosol yang larut dan memiliki aktivitas tinggi.
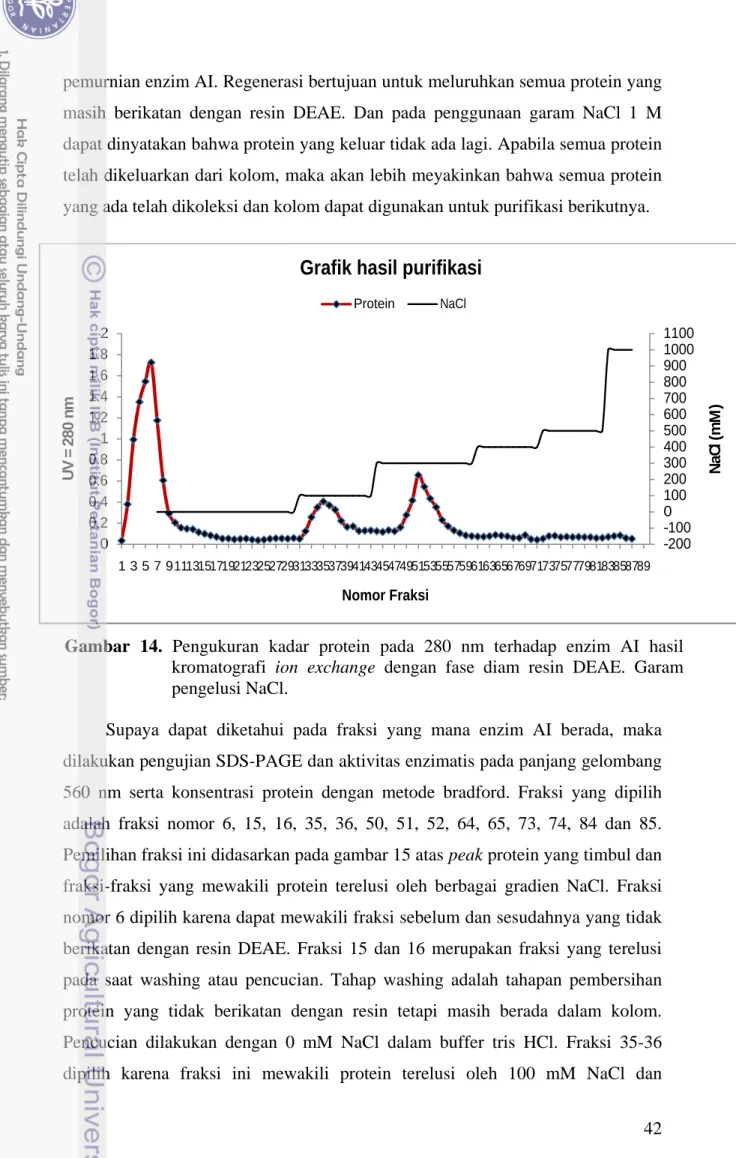
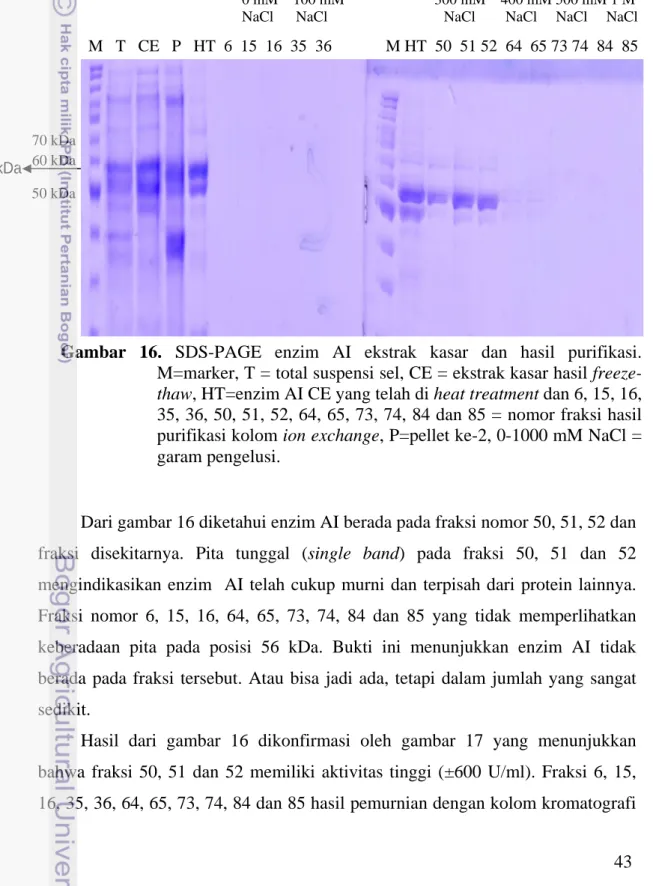
Pada tahapan purifikasi, analisis dengan SDS-PAGE dan uji aktivitas diketahui enzim AI terelusi pada fraksi nomor 49-55. Dari SDS-PAGE diketahui bahwa enzim dengan berat molekul 56 kDa berada pada fraksi 50, 51 dan 52, sedangkan pada fraksi lain tidak menunjukkan keberadaan pita pada posisi 56 kDa. Pita tunggal (single band) pada fraksi 50, 51 dan 52 mengindikasikan enzim AI telah cukup murni dan terpisah dari protein lainnya. Fraksi 50, 51 dan 52 juga memiliki aktivitas yang jauh lebih tinggi dibandingkan fraksi lainnya. Fraksi 49-55 terelusi oleh konsentrasi NaCl 300 mM. Aktivitas spesifik enzim murni pada
fraksi 50, 51 dan 52 antara lain secara berurutan adalah 345, 282 dan 364 U/mg. Kuantifikasi protein dengan metode Bradford juga mengkonfirmasikan bahwa protein hasil elusi kromatografi penukar ion lebih tinggi pada fraksi 50, 51 dan 52 dibandingkan fraksi lainnya.
Enzim AI murni memiliki aktivitas optimal pada suhu 600C dan pH 7. Enzim AI membutuhkan logam kalsium (Ca) dan mangan (Mn) untuk meningkatkan aktivitas dan stabilitas panasnya. Penambahan CaCl2 meningkatkan aktivitas relatif enzim AI dari G. stearothermophilus lokal hingga menjadi 154% pada konsentrasi 1 mM dan 130% pada konsentrasi 5 mM. Dan penambahan MnCl2 meningkatkan aktivitas relatif enzim hingga menjadi 525% pada konsentrasi 1 mM dan 560% pada konsentrasi 5 mM. Inkubasi pada suhu 65 0C selama 150 menit menurunkan aktivitas enzim AI murni tanpa penambahan logam hingga tersisa 43%. Sedangkan dengan penambahan 1 mM logam CaCl2 dan MnCl2, aktivitas enzim AI masih tersisa masing-masing 70% dan 91%. Pendugaan waktu paruh (t1/2) enzim AI hasil pemurnian dilakukan dengan penentuan nilai konstanta deaktivasi enzim (k) terlebih dahulu. t1/2 enzim tanpa logam pada suhu 65 0C adalah 136 menit. Dan dengan penambahan 1 mM CaCl2
dan MnCl2, t1/2 AI meningkat menjadi masing-masing 301 dan 990 menit.
Enzim AI dari beberapa bakteri termofilik yang telah diteliti tidak ada yang menunjukkan karakteristik yang 100% sama, meskipun enzim AI dihasilkan oleh gen yang sama (gen araA), namun genus, spesies, strain ataupun tempat isolasi bakteri yang berbeda dapat memberikan karakteristik yang berbeda pula. Waktu paruh enzim AI lokal pada suhu 65 0C dengan penambahan 1 mM MnCl2 jauh lebih lama dibandingkan beberapa enzim AI termostabil yang telah ada. Salah satu strategi peningkatan produksi tagatosa menggunakan enzim AI adalah mencari enzim dengan waktu paruh yang lama. Dari hasil penelitian ini juga dapat disimpulkan bahwa enzim AI dari G. stearothermophilus lokal dapat langsung diaplikasikan pada industri. Suhu yang direkomendasikan untuk aplikasi industri produksi tagatosa menggunakan enzim AI adalah 60-65ºC, karena pada suhu yang lebih tinggi akan menyebabkan terjadinya reaksi pengcoklatan.
Kata kunci: enzim arabinosa isomerase, tagatosa, gen araA, G. stearothermophilus, E. coli BL21 (DE3) pLysS pET-21b,
© Hak cipta milik IPB, tahun 2011
Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
PRODUKSI DAN KARAKTERISASI
ENZIM ARABINOSA ISOMERASE DARI GEN BAKTERI
Geobacillus stearothermophilus LOKAL
YONI ATMA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
HALAMAN PENGESAHAN
Judul Tesis : Produksi dan Karakterisasi Enzim Arabinosa Isomerase dari Gen Bakteri Geobacillus stearothermophilus Lokal Nama Mahasiswa : Yoni Atma
NRP : F251090131 Program Mayor : Ilmu Pangan
Disetujui, Komisi Pembimbing
Prof. Dr. Ir. Maggy T. Suhartono
Budi Saksono, M.Sc Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pangan
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc Dr. Ir. Dahrul Syah, M.Agr.Sc
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulisan tesis ini dapat diselesaikan. Judul tesis ini adalah ”Produksi dan Karakterisasi Enzim Arabinosa Isomerase dari Gen Bakteri
Geobacillus stearothermophilus Lokal”
Terima kasih penulis ucapkan kepada para Orang Tua dan keluarga penulis atas jasa-jasanya yang tidak akan pernah penulis lupakan. Kepada Prof Dr. Ir. Maggy T. Suhartono selaku ketua komisi pembimbing yang telah memberikan bimbingan, arahan, dukungan, semangat serta pelajaran tentang berbagai macam hal sehingga penulis dapat menyelesaikan tesis ini. Terima kasih juga disampaikan kepada Budi Saksono, M.Sc selaku anggota komisi pembimbing atas saran dan dana penelitiannya. Kepada Dr. Ir. Budiatman Setiawihardja, M.Sc selaku dosen penguji dari Departemen Ilmu dan Teknologi Pangan, atas panduan ilmu dan saran-sarannya.
Selain itu, terima kasih tidak lupa penulis sampaikan kepada staf peneliti laboratorium CBRG dan Puslit Bioteknologi LIPI atas kerjasama dan diskusi yang pernah diberikan. Juga pada rekan-rekan Ilmu Pangan (IPN) dan laboratorium Mikrobiologi Biokimia PAU IPB.
Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan. Oleh karena itu, penulis mengharapkan saran dan kritik demi penyempurnaan pada masa yang akan datang.
Akhirnya, semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jambi pada tanggal 17 Maret 1986 dari ayah Saibunnur (Almarhum) dan ibu Zaimon Lafmi. Penulis merupakan anak ke dua dari tiga bersaudara.
Tahun 2003 penulis lulus dari SMA Negeri 11 Kota Jambi dan pada tahun yang sama penulis diterima di Universitas Jambi melalui jalur PKPM (Pencarian Khusus Pemandu Minat). Penulis memilih program studi Teknologi Hasil Pertanian, Fakultas Pertanian. Pada tahun 2008 penulis memperoleh gelar Sarjana Teknologi Pertanian (S.TP) dari Universitas Jambi.
Tahun 2009 penulis melanjutkan kuliah di Sekolah Pascasarjana IPB. Penulis memilih mayor Ilmu Pangan (IPN). Penulis pernah menjadi Guru Les pada lembaga bimbingan belajar Ganesha Operation cabang Depok tahun 2009 dan Nurul Ilmi cabang Dramaga tahun 2010. Sebagai syarat untuk memperoleh gelar Master of Science (M.Si), penulis menyelesaikan tesisnya dengan judul ”Produksi dan Karakterisasi Enzim Arabinosa Isomerase dari Gen Bakteri
Geobacillus stearothermophilus Lokal” dibawah bimbingan Prof. Dr. Ir. Maggy
DAFTAR ISI
Halaman
DAFTAR ISI……...………...……….... i
DAFTAR TABEL………...………... iii
DAFTAR GAMBAR…….……… iv DAFTAR LAMPIRAN………….………. v PENDAHULUAN Latar Belakang………... 1 Tujuan Penelitian………... 4 Manfaat Penelitian………. 4 TINJAUAN PUSTAKA Enzim Arabinosa Isomerase………... 5
Tagatosa………... 7
Konsep DNA Rekombinan……… 10
Purifikasi dan Karakterisasi Enzim………... 14
Sodium Dedosil Sulfat Poliakrilamid Gel Elektroforesis (SDS-PAGE)….. 18
Pengukuran Konsentrasi Protein………... 19
METODOLOGI PENELITIAN Bahan dan Alat………... 21
Metode Penelitian………... 21
1. Produksi enzim……….………...………... 22
2. Purifikasi enzim………... 23
3. Karakterisasi enzim……….………... 24
Metode Analisis………. 27
1. Pengukuran absorbansi pada 600 nm……… 27
2. Elektroforesis SDS-PAGE………. 27
3. Pengukuran aktivitas enzim………. 28
4. Penentuan kadar protein (Bradford) ………... 29
5. Perhitungan aktivitas spesifik enzim……… 30
6. Penentuan waktu paruh enzim………. 30
HASIL DAN PEMBAHASAN Pengujian Bakteri Transforman……….. 31
Produksi Enzim Arabinosa Isomerase……… 32
Optimasi Produksi Enzim Dengan Lama Waktu Induksi………... 36
Purifikasi………. 40 Karakterisasi……… 46 1. Suhu optimum……….. 47 2. pH optimum………. 48 3. Pengaruh logam……… 50 4. Stabilitas panas………. 53
5. Pendugaan waktu paruh enzim.………... 55 KESIMPULAN DAN SARAN
DAFTAR PUSTAKA LAMPIRAN
DAFTAR TABEL
Halaman
Tabel 1 Karakteristik fisik dan kimia tagatosa... 8 Tabel 2 Manfaat kesehatan dan aplikasi tagatosa pada produk
pangan...
10 Tabel 3 Komposisi separating dan konsentrat (stacking) gel untuk
SDS-PAGE ...
27 Tabel 4 Bahan-bahan untuk uji aktivitas enzim……… 28 Tabel 5 Larutan uji aktivitas………. 28 Tabel 6 Cara perhitungan aktivitas spesifik enzim……… 30 Tabel 7 Perhitungan konsentrasi protein (metode Bradford) dan
aktivitas spesifik yang diberikan………..
46 Tabel 8 Karakteristik suhu dan pH optimum enzim AI dari beberapa
bakteri termofilik………..
50
DAFTAR GAMBAR
Halaman Gambar 1 Ilustrasi produksi tagatosa dari laktosa menggunakan katalis
kalsium...
2
Gambar 2 Reaksi isomerisasi yang dikatalisis oleh enzim AI... 5
Gambar 3 Model molekul AI ketika mengikat galaktosa……… 6
Gambar 4 Perbandingan struktur molekul tagatosa dan fruktosa……… 7
Gambar 5 Salah satu mekanisme tagatosa sebagai produk antidiabetes dan hiperglikemia……….. 8
Gambar 6 Perbandingan respon glikemik tagatosa dengan beberapa pemanis………... 9
Gambar 7 Plasmid sebagai vektor ekspresi………. 11
Gambar 8 Peta plasmid pET-21b(+) secara garis besar……….. 12
Gambar 9 Mekanisme ekspresi gen target pada E. coli BL21 pLysS pET…… ……… 14
Gambar 10 Skema alur penelitian………. 26
Gambar 11 Perbandingan ekpresi enzim AI pada 2 jenis medium ekpresi berbeda……… 32
Gambar 12 Mekanisme ekspresi terinduksi IPTG pada inang E. coli BL21(DE3) dengan sistem pET……… 34
Gambar 13 Grafik optical density (kerapatan sel) dan aktivitas enzim yang dikoleksi dari kultur serta setelah induksi……….. 37
Gambar 14 SDS-PAGE hasil optimasi produksi enzim dengan lama waktu induksi……… 37
Gambar 15 Pengukuran kadar protein pada 280 nm terhadap enzim AI hasil kromatografi ion exchange dengan resin DEAE... 42
Gambar 16 SDS-PAGE enzim AI ekstrak kasar dan hasil purifikasi………... 43
Gambar 17 Pengukuran aktivitas terhadap enzim ekstrak kasar dan fraksi hasil kromatografi………... 44
Gambar 18 Pengukuran konsentrasi protein dengan metode Bradford terhadap enzim ekstrak kasar dan fraksi hasil purifikasi………… 45
Gambar 19 Suhu optimum enzim AI dari G. stearothermophilus lokal……... 47
Gambar 20 pH optimum enzim AI dari G. stearothermophilus lokal………... 49
Gambar 21 Pengaruh penambahan ion logam terhadap aktivitas enzim AI…. 52
Gambar 22 Stabilitas enzim AI pada suhu 65 0C tanpa dan dengan keberadaan logam………... 54
Gambar 23 Hubungan ln aktivitas enzim tanpa logam terhadap waktu inkubasi pada suhu 65 0C……… 55
Gambar 24 Hubungan ln aktivitas enzim dengan penambahan logam Ca terhadap waktu inkubasi pada suhu 65 0C ……… 56
Gambar 25 Hubungan ln aktivitas enzim dengan penambahan logam Mn terhadap waktu inkubasi pada suhu 65 0C ……… 57
DAFTAR LAMPIRAN
Halaman Lampiran 1 Data Optical Density (OD) pada 600 nm dari kultur bakteri
pada saat kultur dilakukan dan induksi dimulai………..
66
Lampiran 2 Data pengukuran aktivitas enzim pada saat optimasi produksi 67
Lampiran 3 Data pengukuran protein terelusi hasil purifikasi dengan kolom penukar ion………. 70
Lampiran 4 Pengukuran aktivitas enzim hasil purifikasi……….. 71
Lampiran 5 Data perhitungan konsentrasi protein dengan metode Bradford 78
Lampiran 6 Data penentuan dan perhitungan suhu optimum ………... 82
Lampiran 7 Data penentuan dan perhitungan pH optimum ……….. 83
Lampiran 8 Data pengaruh penambahan logam………. 88
Lampiran 9 Data stabilitas panas enzim………. 92
PENDAHULUAN
A. LATAR BELAKANG
Enzim arabinosa isomerase (AI) dapat mengkatalisis secara revesible reaksi isomerisasi D-galaktosa menjadi D-tagatosa (Lee et al 2004). Tagatosa telah digunakan sebagai pemanis rendah kalori (1,5 kkal/g) (Levin 2002). Tagatosa memiliki tingkat kemanisan 92% dibandingkan sukrosa (Lee et al 2004). Tagatosa memberikan berbagai manfaat kesehatan diantaranya seperti menurunkan berat badan, prebiotik, anti-histolisis (Oh 2007) serta mereduksi sejumlah gejala yang berhubungan dengan diabetes tipe 2, hiperglikemia, obesitas, anemia dan hemophilia (Levin 2002; Lu et al 2007). Peran tagatosa sebagai antidiabetes akan bermanfaat sebagai gula alternatif di Indonesia, mengingat Indonesia menempati peringkat ke-4 dengan jumlah penderita diabetes terbesar di dunia (Wild et al 2004).
Produksi tagatosa dalam bentuk bulk sweeteners telah dilakukan pada skala industri secara kimiawi menggunakan katalis kalsium (Beadle et al 1991). Tahapan-tahapan dan proses purifikasi yang kompleks, limbah kimia, serta produk akhir lainnya yang dihasilkan yang bukan tagatosa (by-product) menyebabkan penggunaan katalis kimia mulai ditinggalkan. Alternatif yang saat ini banyak digunakan adalah menggunakan katalis biologis seperti enzim. Sorbitol dehidrogenase dari sejumlah mikroorganisme awalnya dipelajari untuk memproduksi D-tagatosa dari galaktitol. D-psicosa 3-epimerse dari
Agrobacterium tumefaciens dan D-tagatosa 3-epimerase dari Pseudomonas cichorii ternyata diketahui dapat membentuk tagatosa dari D-sorbosa. Namun
substrat galaktitol ataupun D-sorbosa yang mahal menyebabkan pengembangan enzim ini tidak efisien (Oh 2007).
Enzim yang saat ini paling banyak dicari untuk memproduksi tagatosa adalah enzim arabinosa isomerase (AI). Pembentukan tagatosa dari galaktosa ini sangat efisien karena substrat yang dibutuhkan dan tahapan produksinya. Studi produksi dan pencarian enzim AI termostabil lebih difokuskan, sebab konversi D-galaktosa menjadi D-tagatosa meningkat dengan peningkatan suhu (> 50ºC) (Kim et al 2002). Selain itu, enzim-enzim pangan yang bersifat termostabil juga
menjadi semakin penting dalam dunia industri. Hal ini berkaitan dengan keuntungan yang akan diperoleh bila proses produksi dilakukan pada suhu tinggi, diantaranya adalah mengurangi kontaminasi, meningkatkan kecepatan reaksi sehingga menghemat waktu, tenaga dan biaya, serta menurunkan viskositas larutan fermentasi sehingga memudahkan proses produksi. Suhu yang direkomendasikan untuk aplikasi industri produksi tagatosa menggunakan enzim AI adalah 60-65ºC, karena pada suhu yang lebih tinggi akan menyebabkan terjadinya reaksi pengcoklatan (Cheng et al 2009).
Sejumlah bakteri termofilik penghasil enzim AI telah dilaporkan. Beberapa diantaranya adalah Thermotoga neapolitana (Kim et al 2002), Thermus sp. (Kim et al 2003b), Thermoanaerobacter mathranii (Jorgensen et al 2004), Thermotoga
maritima (Lee et al 2004), Geobacillus stearothermophilus T6 (Lee et al 2005a), Alicyclobacillus acidocaldarius (Lee et al 2005b), Bacillus stearothermophilus
US100 (Rhimi & Bejar 2006), G. thermodenitrificans (Kim & Oh 2005), dan B.
stearothermophilus IAM11001 (Cheng et al 2009). Produksi enzim AI yang
berasal dari bakteri-bakteri termofilik tersebut diatas dilakukan dengan menggunakan inang E. coli. Gen araA yang mengkode arabinosa isomerase (AI) dikloning melalui plasmid ke bakteri E. coli BL21. E. coli kemudian akan
Gambar 1. Ilustrasi produksi tagatosa dari laktosa menggunakan katalis
mengekspresikan atau menghasilkan enzim AI setelah diberi senyawa penginduksi. E. coli merupakan salah satu mikroorganisme yang banyak digunakan untuk produksi protein rekombinan karena alasan-alasan berikut: 1) E.
coli dapat tumbuh dengan cepat, 2) suhu dan medium pertumbuhan lebih
sederhana untuk mencapai massa sel yang tinggi, 3) karakteristik genetikanya telah diketahui dengan baik, dan 4) E. coli memiliki vektor kloning yang lebih banyak (Baneyx 1999).
Diantara beberapa bakteri termofilik yang diteliti, saat ini enzim AI yang berasal dari G. stearothermophilus (Gali152) memiliki kemampuan tertinggi dalam menghasilkan tagatosa dan produktivitasnya telah mendekati kriteria produksi untuk skala komersial (Oh 2007). Kim et al (2003a) melaporkan bahwa teknik imobilisasi enzim AI dari G. stearothermophilus (Gali152) dapat menghasilkan 230 g/liter tagatosa dari 500 gram/liter galaktosa dengan produktivitas 319 g/liter per hari pada sistem batch. Sedangkan fermentasi dengan sistem kontinu menghasilkan 145 g/liter tagatosa dari 300 g/liter galaktosa dengan produktivitas 1,296 g/liter per hari (Ryu et al 2003).
Fitriani dan Saksono (2010) telah melakukan kloning dan ekspresi gen araA dari strain lokal G. stearothermophilus asal Tanjung Api, Poso, Indonesia. Analisis DNA homologi yang telah dilakukan menunjukkan bahwa AI dari G.
stearothermophilus lokal memiliki nilai kemiripan 98% dengan G. stearothermophilus T6, 97% dengan B. stearothermophilus US100 dan A. acidocaldarius, 96% dengan Thermus sp., 95% dengan B. stearothermophilus IAM11001, dan G. thermodentrificans. Namun analisis dengan Sodium Dodecyl
Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE) menunjukkan level ekspresi enzim AI tersebut pada media ekspresi (fermentasi) Luria Bertani (LB) masih rendah. Ekspresi gen araA ini perlu ditingkatkan sehingga jumlah enzim AI yang dihasilkan optimal.
Meskipun penggunaan E. coli sebagai inang untuk memproduksi arabinosa isomerase memiliki keunggulan, akan tetapi tidak menjamin bahwa protein rekombinan yang ditargetkan terekpresikan dalam jumlah tinggi dan aktif. Apalagi suhu optimum bakteri asal berbeda dengan inang yang akan mengekpresikan, sehingga dapat mempengaruhi pembentukan dan pelipatan
protein ataupun enzim. Kesalahan dalam pelipatan protein dapat menyebabkan peningkatan ekspresi protein rekombinan yang tidak larut (insoluble). Protein rekombinan yang tidak larut biasanya memiliki aktivitas yang rendah. Peningkatan ekspresi protein rekombinan pada E.coli dapat dilakukan dengan modifikasi komponen medium ekspresi dan ini merupakan teknik yang paling efisien (Blommel et al 2007). Lama waktu induksi juga mempengaruhi tingginya ekpresi protein rekombinan pada bakteri E. coli (Donovan et al 1996; Azaman et al 2010). Penelitian yang telah dilakukan Putri (2010) menunjukkan bahwa limbah cair tahu yang ditambahkan ekstrak khamir dapat digunakan sebagai medium pertumbuhan E.coli rekombinan dan ekspresi protein rekombinannya. Penggunaan limbah cari tahu sebagai medium ekspresi mempermudah tahapan pemisahan protein aktif dengan inclusion body (insoluble protein).
Selain untuk meningkatkan produksi enzim, penelitian ini juga dilakukan untuk memurnikan enzim yang telah diperoleh dan mengetahui karakteristik enzim AI dari G. stearothermophilus lokal. Karakteristik AI yang ingin diketahui mencakup suhu dan pH optimum, logam aktivator dan stabilitas panas. Penelitian ini diharapkan dapat memperoleh enzim AI dari isolat lokal atau sumber daya alam Indonesia yang telah terkarakterisasi. Enzim yang dihasilkan dapat digunakan untuk memproduksi tagatosa. Karakteristik enzim AI dari strain lokal ini dapat menjadi acuan untuk dibandingkan dengan enzim AI yang telah ada. Serta apakah enzim bisa langsung diterapkan pada skala industri atau diperlukan teknik lainnya untuk meningkatkan karakteristik enzim.
B. TUJUAN
Tujuan dilakukannya penelitian ini adalah untuk:
1. Optimasi produksi enzim AI yang berasal dari gen araA bakteri G.
stearothermophilus asal Tanjung Api, Poso, Indonesia.
2. Purifikasi dan karakterisasi enzim AI yang telah dihasilkan.
C. MANFAAT
Manfaat jangka panjang yang diharapkan dari penelitian ini adalah industrialisasi enzim AI. Selain itu, juga industrialisasi D-tagatosa sehingga bisa digunakan dalam industri makanan dan obat.
TINJAUAN PUSTAKA
A. ENZIM ARABINOSA ISOMERASEL-Arabinosa isomerase (AI) merupakan enzim intraseluler yang berdasarkan klasifikasi enzim secara internasional atas reaksi yang dikatalisisnya diberi nomor kode EC 5.3.1.4. Enzim AI dapat mengkatalisis secara revesible reaksi isomerisasi L-arabinosa menjadi L-ribulosa dan D-galaktosa menjadi D-tagatosa. Perubahan L-arabinosa menjadi L-ribulosa terjadi secara in vivo, sedangkan perubahan D-galaktosa menjadi D-tagatosa dapat terjadi secara in vitro (Lee et al 2004).
Pada awalnya enzim AI diketahui karena kemampuan beberapa mikroorganisme menggunakan L-arabinosa sebagai sumber karbon. L-arabinosa akan dirubah menjadi D-selulosa-5-posfat yang merupakan reaksi intermediet dalam jalur pentosa fosfat. Reaksi tahap pertama pada jalur tersebut adalah terjadinya perubahan arabinosa menjadi L-ribulosa oleh enzim arabinosa isomerase (AI). Kemampuan AI dalam mengkatalisis reaksi isomerisasi galaktosa menjadi tagatosa dikarenakan kemiripan struktur konfigurasi antara galaktosa dengan L-arabinosa (Yoon et al 2003). Karena dapat mengkatalisis reaksi isomerisasi pada D-galaktosa, enzim AI sering juga disebut sebagai galaktosa isomerase (Zang et al 2010).
Enzim AI dapat dihasilkan oleh mikroorganisme mesofilik dan termofilik.
Aerobacter aerogenes, Lactobacillus plantarum, L. gayonii, L. pentosus,L. sakei, E. coli, Mycobacterium smegmatis, Salmonella typhimurium, Bacillus subtilis dan B. halodurans merupakan mikroorganisme mesofilik penghasil enzim AI yang
telah diteliti. Sedangkan mikroorganisme termofilik penghasil enzim AI yang sampai saat ini telah dipelajari antara lain seperti Thermus sp.
Thermoanaerobacter mathranii, Alicyclobacillus acidocaldarius, Thermotoga neapolitana, Thermotoga maritima,, Geobacillus stearothermophilus, G. thermodenitrificans dan Acidothermus cellulolytics (Zhang et al 2007; Prabhu et
al 2008; Rhimi et al 2010).
Enzim AI dikodekan oleh gen araA yang terletak pada kompleks gen L-arabinosa. Gen araA terdiri dari sekitar 1494 – 1535 pasang basa (bp). Jumlah pasang basa yang dimiliki gen araA tergantung mikroorganisme asalnya. Gen
araA G. stearothermophilus strain lokal memiliki 1512 pasang basa (Fitriani &
Saksono 2010). B. stearothermophilus US 100, G. stearothermophilus, dan G.
thermodenitrificans mengekspresikan enzim AI yang berukuran 56 kDa (Rhimi &
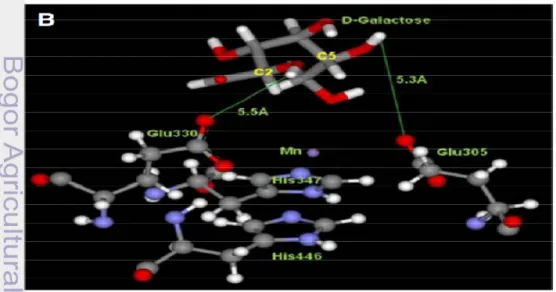
Bejar 2006; Kim & Oh 2005). Sebagian besar AI terdiri dari 4 (tetramer) struktur sekunder yang berbentuk alfa-heliks. Kecuali AI dari E. coli yang berupa hexamer (Wallace et al 1978). Asam amino yang berada pada sisi aktif enzim AI adalah asam glutamat pada posisi 305 dan 330. Sisi aktif AI akan mengikat substrat arabinosa ataupun galaktosa untuk dikatalisis menjadi produk. Struktur AI pada saat mengikat substrat galaktosa dapat dilihat pada gambar 3 dibawah ini.
Enzim AI dari bakteri termofilik memiliki pH optimum 7.0-8.5, dengan pH isoelektrik sekitar 5.0-5.8 dan suhu optimum antara 60-90ºC. Sebagian besar enzim AI membutuhkan ion logam Mn2+
dan Co2+ sebagai kofaktor. Penggunaan Co2+ sebagai kofaktor untuk menghasilkan bahan pangan tidak direkomendasikan
karena bahaya kesehatan yang ditimbulkannya (Jorgensen et al 2004). Aktivitas katalisis dan stabilitas beberapa enzim AI juga ada yang meningkat dengan keberadaan ion Fe2+, Mg2+, dan Ca2+ (Oh 2007; Kim & Oh 2005). Tidak adanya ion logam sebagai kofaktor menyebabkan aktifitas enzim AI lebih rendah (Lee et al 2005a).
B. TAGATOSA
Tagatosa adalah monosakarida dengan rumus empiris C6H12O6 dan berat molekulnya (Mr) 180,6. Tagatosa termasuk hekso-ketosa alami, akan tetapi jarang terdapat di alam. Tagatosa hanya ditemukan dalam jumlah sedikit pada beberapa buah, produk susu dan cokelat. Tagatosa memiliki struktur molekul yang hampir sama dengan fruktosa dan telah dikenal sebagai komponen yang aman digunakan pada bahan pangan dan produk farmasi. Food and Drug Administration Amerika Serikat (U.S. FDA) telah menetapkan tagatosa sebagai GRAS (Generally
Recognized As Safe) komponen (Levin 2002).
Suhu leleh dari tagatosa adalah 134ºC, dan stabil pada pH 2–7. Tagatosa memiliki kelarutan yang tinggi [58% (w/w) pada 21 0C]. Karakter humektan tagatosa sama dengan sorbitol. Sifat higroskopis dari tagatosa lebih rendah jika
dibandingkan fruktosa. Viskositas tagatosa lebih rendah dibandingkan sukrosa pada konsentrasi yang sama, akan tetapi sedikit lebih tinggi dibandingkan fruktosa dan sorbitol. Pada suhu tinggi, reaksi Maillard dan karamelisasi oleh tagatosa akan memberikan warna coklat seperti yang dihasilkan oleh sukrosa (Levin 2002).
Tabel 1. Karakteristik fisik dan kimia tagatosa (Levin 2002; Skytte 2006)
Karakteristik Penjelasan
Nama umum D-Tagatosa, Tagatosa Sinonim D-lyxo-hexulose Melting point 133-137ºC Bulk density (g/ml) 0.7-0.9
Optical rotation aD20= - 5ºC (c =1 dalam H2O) Bentuk fisik Kristal
Nilai kalori < 1,5 kcal/g Odor, cooling effect dan
Karsinogenesitas
Tidak ada
Lu et al (2007) menyatakan bahwa tagatosa digunakan sebagai produk antidiabetes dan pengendali obesitas. Tagatosa bisa meningkatkan high density
lipoprotein (HDL) dan mencegah kanker kolon. Kemampuan tagatosa dalam
mengendalikan gejala hiperglikemia dikarenakan tagatosa dapat menjadi inhibitor bagi enzim maltase dan sukrase. Mekanisme tagatosa sebagai inhibitor enzim maltase dan sukrase dapat dilihat pada gambar 5.
Gambar 5. Salah satu mekanisme tagatosa sebagai produk antidiabetes dan
Konsumsi tagatosa tidak menyebabkan kerusakan gigi dan efek laktasif. Tagatosa lambat diserap oleh saluran intestinal sehingga tidak berakibat pada naiknya indeks glikemik secara cepat (Lu et al 2007). Gambar 6 memperlihatkan perbandingan respon glikemik dari tagatosa dibandingkan pemanis lainnya. Menurut Skytte (2006) hanya sekitar 25% tagatosa yang diserap pada usus halus, sisanya 75% akan difermentasi dalam usus besar oleh mikroflora menjadi asam lemak rantai pendek. Tagatosa dapat meningkatkan pertumbuhan Lactobacillus dan bakteri asam laktat lainnya. Manfaat prebiotik tagatosa telah dipelajari pada manusia dan hewan (Skytte 2006).
Gambar 6. Perbandingan respon glikemik tagatosa dengan beberapa pemanis
(Skytte 2006)
Konsentrasi penggunaan tagatosa pada produk pangan bervariasi. Tagatosa digunakan sebanyak 1% pada minuman diet berkarbonasi, 2% pada produk roti, 3% pada es krim dan 15% produk candies khusus untuk penderita diabetes (Dobbs & Bell 2010). Amerika Serikat, Korea, New Zeland dan Australia telah menerapkan penggunaan tagatosa dalam produk-produk minuman, confectionary, makanan kesehatan dan pemanis rendah kalori.
Tabel 2. Manfaat kesehatan dan aplikasi tagatosa pada produk pangan (Oh 2007)
Manfaat kesehatan Jenis produk pangan
Rendah kalori Makanan rendah karbohidrat, sereal, minuman ringan dan health bars
No glycemic effect Diabetic food (tipe 2)
Anti halistosis Supplemen
Prebiotik Cokelat, candies, chewing gum
Flavor enhancement Yogurt, bakery, minuman susu dan
confectionary
C. KONSEP DNA REKOMBINAN
Prinsip teknologi rekombinasi DNA yaitu menggabungkan molekul fragmen DNA atau gen dari organisme yang berbeda sehingga menghasilkan kombinasi baru yang sebenarnya tidak terdapat secara alami (Glick & Pasternak 2003). DNA dari manusia, hewan, tumbuhan dan mikroorganisme dapat direkombinasi. DNA rekombinan buatan sangat berguna dalam penelitian genetika. Teknologi DNA rekombinan terus mengembangkan metode untuk isolasi dan menyatukan gen menjadi kombinasi baru.
Tahap awal dari rekombinasi adalah isolasi gen target. Isolasi gen dapat dilakukan dengan 2 cara yakni pemotongan secara langsung dan isolasi mRNA untuk persiapan cDNA. Enzim endonuklease restriksi digunakan untuk memotong untai DNA. Sedangkan DNA ligase berguna untuk menggabungkan fragmen-fragmen DNA. Apabila menggunakan metode isolasi mRNA, maka harus berdasarkan prinsip reverse transcription dan memerlukan penyusunan DNA primer. Gen yang telah diperoleh kemudian disisipkan pada vektor pembawa yang akan membawa gen ke dalam sel inang (host). Sel inang yang telah ditransformasi kemudian diseleksi dan digunakan ataupun dikembangkan sebagai organisme penghasil DNA rekombinan (Lehninger 2004).
1. Plasmid
Cara insersi gen asing ke dalam sel inang pada teknik rekombinasi DNA dapat dilakukan dengan plasmid, bakteriophage, cosmid dan kromosom buatan (Prescott 2002). Plasmid dan bakteriophage merupakan vektor yang paling banyak digunakan. Plasmid adalah DNA berbentuk lingkaran yang ditemukan dalam sitoplasma spesies bakteri. Plasmid mengandung gen yang melakukan
replikasi, transkripsi dan translasi secara terpisah, tetapi dalam waktu yang bersamaan dengan kromosom. Plasmid memiliki sifat istimewa, sehingga sangat bermanfaat dalam teknik rekayasa genetika. Plasmid dapat melewati sel, pindah dari sel yang satu ke sel lainnya atau dari satu spesies bakteri ke spesies lainnya. Penggabungan gen asing ke dalam plasmid dapat dilakukan dengan mudah. Selain itu, plasmid dapat disisipi atau terkadang telah memiliki penanda seleksi (Tortora et al 2010).
Plasmid juga bisa digunakan sebagai vektor ekspresi. Ekpresi adalah perubahan fragmen DNA atau gen menjadi protein spesifik melalui tahap transkripsi dan translasi. Untuk ekspresi, plasmid harus memiliki signal pemulai tahapan transkripsi dan translasi yang diperlukan. Tingkat ekspresi gen yang dikloning dikendalikan oleh sekuen promoter dan regulator yang terdapat pada vektor ekpresi tersebut. Promoter dan regulator memberikan isyarat tempat dimana RNA polimerase berikatan dan mulai melakukan proses transkripsi (Lehninger 2004).
Pemakaian teknologi rekombinasi DNA dibidang produksi enzim secara lebih spesifik dapat dilakukan dengan beberapa cara, salah satunya aplikasi gen terpilih melalui plasmid. Pemindahan gen penyandi enzim suatu mikroba atau organisme yang bersifat unggul ke dalam mikroba lain dapat dilakukan dengan cara mengisolasi gen yang diinginkan. Kemudian memindahkan dan mengintegrasikannya ke dalam plasmid tertentu. Selanjutnya dilakukan amplifikasi gen yang diinginkan sehingga dapat meningkatkan produksi protein fungsional yang diturunkan dari gen tersebut (Suhartono 1989).
2. Plasmid pET-21b(+) dan Inang E. coli BL21 (DE3) pLysS
Plasmid pET-21b(+) merupakan salah satu plasmid yang dirancang untuk mengekspresikan gen target yang telah membawa situs pengikatan ribosom dan kodon pemulai (start codon). pET-21b(+) berukuran 5442 bp dimana peta konstruksi sistem ekspresinya terdiri dari sebuah gen lacI yang mengkode protein represor, sebuah promoter T7 yang spesifik untuk hanya T7 RNA polimerase (bukan bakteri RNA polimerase dan juga tidak terdapat dalam genom prokariotik), operator lac (lac O) yang dapat menghalangi transkripsi, multiple
cloning site (MCS), sebuah gen replikasi asli dari plasmid alaminya (pBR322
ORI), dan suatu gen resistensi ampisilin (Blaber 1998). Gambar 8 menampilkan secara garis besar peta plasmid kontruksi pET-21b(+). Sistem pET memberikan hasil ekspesi protein target yang tinggi dan sangat kuat dalam mengendalikan ekpresi basal yang tidak diinginkan. Sistem pET plasmid yang berdasarkan T7 promoter merupakan yang paling tepat untuk kloning dan ekspresi DNA rekombinan di dalam E. coli (Studier & Moffatt 1986; Novagen 1999).
Gambar 8. Peta plasmid pET-21b(+) secara garis besar
Bakteri E. coli BL21 (DE3) pLysS mempunyai stabilitas yang tinggi dalam ekspresi protein. Inang ekspresi ini membawa gen T7 RNA polimerase dibawah kontrol promoter lacUV5. E. coli BL21 memiliki plasmid pLysS, plasmid ini akan mengkode sejumlah kecil lisosim T7 yang mempunyai kontrol yang tinggi terhadap ekspresi protein toksik dan resisten terhadap kloramfenikol.
Plasmid pLysS mempunyai sedikit inhibisi terhadap T7 RNA polimerase sehingga perlu diinduksi oleh isopropyl-ß -D-thiogalactopyranoside (IPTG). IPTG menginduksi T7 RNA polimerase dengan promoter lacUV5 sehingga ekspresi protein rekombinan dapat maksimal (Sambrook & Russell 2001).
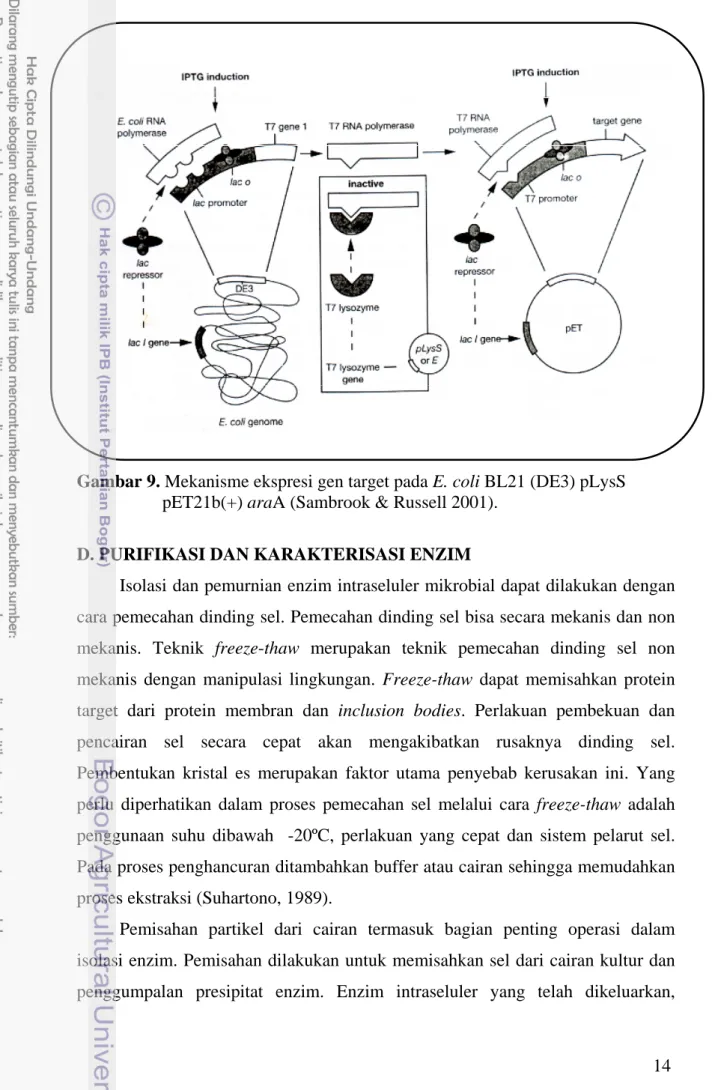
3. Mekanisme Ekspresi Gen Target pada Kombinasi Plasmid pET-21b dan E. coli BL21
Ekpresi protein pada sistem pET21b(+) dan inang E. coli BL21 merupakan sistem operon indusibel yang sangat kompleks. Operon adalah kelompok gen yang diatur secara terkoordinasi dengan fungsi yang saling terkait. Operon terdiri dari promoter, operator, kompleks gen penyandi protein fungsional dan gen pengkode represor yang berada pada bagian terluar dari operon. Promoter berfungsi sebagai tempat RNA polimerase mengawali proses transkripsi. Operator sebagai saklar yang akan menentukan perlu atau tidaknya ekspresi suatu protein atau peptida pada operon. Saklar operator akan aktif apabila represor terlepas dari operator (Campbell et al 2003).
Plasmid pET21b yang telah mengandung gen target pada posisi hilir dari T7 promoter dimasukkan ke dalam inang E. coli BL21. E. coli BL21 telah mengandung gen T7 faga yang akan menghasilkan T7 RNA polimerase. T7 RNA polimerase ini hanya bekerja dan memulai transkripsi pada situs promoter T7 (yang dalam hal ini terdapat pada plasmid pET21b[+]). Pembentukan T7 RNA polimerase diatur melalui operon tersendiri yang telah dikonstruksi pada genom
E. coli BL21 (Sambrook & Russell 2001).
Penambahan senyawa IPTG akan menyebabkan represor tidak dapat menginkatifkan operator yang awalnya memblok proses transkripsi, sehingga T7 RNA polimerase dihasilkan yang selanjutnya memulai tahapan transkripsi pada T7 promoter gen target. Karena T7 merupakan promoter dari virus, maka gen target akan ditranskripsikan secara cepat selama RNA polimerase ada (Sambrook & Russell 2001). Ekspresi gen target akan naik secara cepat sebagaimana jumlah mRNA yang ditranskripsikan juga meningkat. Mekanisme pada plasmid ini serupa dengan mekanisme pemanfaatan laktosa oleh lac operon bakteri.
Gambar 9. Mekanisme ekspresi gen target pada E. coli BL21 (DE3) pLysS
pET21b(+) araA (Sambrook & Russell 2001).
D. PURIFIKASI DAN KARAKTERISASI ENZIM
Isolasi dan pemurnian enzim intraseluler mikrobial dapat dilakukan dengan cara pemecahan dinding sel. Pemecahan dinding sel bisa secara mekanis dan non mekanis. Teknik freeze-thaw merupakan teknik pemecahan dinding sel non mekanis dengan manipulasi lingkungan. Freeze-thaw dapat memisahkan protein target dari protein membran dan inclusion bodies. Perlakuan pembekuan dan pencairan sel secara cepat akan mengakibatkan rusaknya dinding sel. Pembentukan kristal es merupakan faktor utama penyebab kerusakan ini. Yang perlu diperhatikan dalam proses pemecahan sel melalui cara freeze-thaw adalah penggunaan suhu dibawah -20ºC, perlakuan yang cepat dan sistem pelarut sel. Pada proses penghancuran ditambahkan buffer atau cairan sehingga memudahkan proses ekstraksi (Suhartono, 1989).
Pemisahan partikel dari cairan termasuk bagian penting operasi dalam isolasi enzim. Pemisahan dilakukan untuk memisahkan sel dari cairan kultur dan penggumpalan presipitat enzim. Enzim intraseluler yang telah dikeluarkan,
dipisahkan dari bagian sel dan dindingnya dengan proses sentrifugasi. Pemisahan dengan sentrifugasi merupakan sistem pemisahan berdasarkan berat. Partikel dengan berat yang berbeda akan mengendap pada kecepatan yang berbeda. Proses sentrifugasi pada enzim sebagian besar dilakukan pada suhu rendah, sehingga kehilangan aktivitas enzim dapat dijaga seminimal mungkin (Suhartono, 1989).
Pemurnian atau purifikasi enzim adalah memisahkan enzim target dari selainnya. Tujuan pemurnian enzim adalah mendapatkan enzim target dalam keadaan murni. Untuk enzim termofolik, pemurnian dengan perlakuan panas sering kali dilakukan. Dengan perlakuan panas akan memisahkan enzim yang tahan panas dari protein lain yang tidak tahan panas. Hal penting yang harus diperhatikan dalam merencanakan tahapan pemurnian yaitu mempertahankan aktivitas enzim atau mengurangi proteolisis dan denaturasi aktivitas enzim murni serta menentukan jumlah enzim yang dibutuhkan. Enzim yang kasar dan murni dapat digunakan untuk tujuan komersial. Sedangkan untuk keperluan laboratorium diperlukan enzim murni (Harris 1989).
Pemurnian enzim seringkali menggunakan kolom kromatografi. Terdapat 5 teknik kromatografi kolom yang sering digunakan antara lain seperti: kromatografi pertukaran ion, kromatografi gel filtrasi, kromatografi afinitas, kromatografi interaksi hidrofobik dan kromatografi cair kinerja tinggi (HPLC) (Sheehan 2009). Kromatografi penukar ion memanfaatkan perbedaan afinitas antara molekul bermuatan di dalam larutan dengan senyawa yang tidak reaktif yang bermuatan berlawanan sebagai pengisi kolom. Golongan senyawa ini merupakan polimer terhidratasi yang bersifat tidak larut seperti selulosa, dekstran dan agarosa. Gugus penukar ion diimobilisasikan pada matriks. Matriks selulosa biasanya digunakan untuk memisahkan protein (termasuk enzim), polisakarida dan asam nukleat. Beberapa gugus penukar anion yaitu aminoetil (AE-) kuntenari aminoetil (QAE-) dan dietil aminoetil (DEAE-), sedangkan gugus penukar kation yaitu sulfopropil (SP-), metil sulfonat dan karboksimetil (CM-) (Widyastuti 2007).
Kromatografi penukar ion dilakukan dengan mengelusi protein enzim menggunakan buffer awal yang telah diatur. Protein enzim yang diharapkan terikat pada kolom kemudian dilepaskan dengan cara mengubah pH buffer atau
kekuatan ionik pelarut (Phage & Thorpe 2009). Molekul enzim atau protein terdiri atas muatan positif dan negatif tergantung pada rantai samping asam amino asam dan basa. pH pada kondisi jumlah muatan positif dan muatan negatif sama disebut titik isoelektrik (pI). pI sebagian besar protein berkisar antara pH 5 dan 9. Protein yang berada pada kondisi pH diatas pI akan bermuatan negatif, dan apabila pH dibawah pI akan bermuatan positif (Lehninger 2004). Karboksimetil selulosa (CMC) dan dietilaminoetil (DEAE) selulosa merupakan penukar ion yang banyak dipakai untuk keperluan fraksinasi enzim. Apabila kondisi elusi dapat dijaga dengan hati-hati, tingkat kemurnian yang tinggi seringkali dapat dicapai.
Agar enzim dapat bekerja secara optimal, perlu diketahui karakteristik biokimiawi enzim, seperti suhu dan pH optimum, pengaruh ion logam, stabilitas panas dan lainnya. Kondisi lingkungan harus menunjang kondisi yang dibutuhkan enzim untuk dapat berfungsi sebagai katalis suatu reaksi (Buchholz et al 2005).
Enzim adalah suatu protein, maka kenaikan suhu dapat menyebabkan terjadinya denaturasi. Apabila terjadi proses denaturasi, maka bagian aktif enzim akan terganggu dan dengan demikian konsentrasi efektif enzim akan berkurang dan kecepatan reaksinya juga akan menurun. Kenaikan suhu sebelum terjadinya proses denaturasi dapat menaikkan kecepatan reaksi, akan tetapi kenaikan suhu pada saat mulai terjadinya proses denaturasi akan mengurangi kecepatan reaksi. Peningkatan suhu tertentu menyebabkan semakin meningkatnya aktivitas katalitik enzim tetapi juga semakin bertambahnya kerusakan enzim (Illanes 2008).
Struktur protein menentukan aktivitas enzim, jika strukturnya terganggu maka aktivitasnya akan berubah pula. Kenaikan suhu sampai batas tertentu dalam suatu reaksi menyebabkan peningkatan kecepatan reaksi karena bertambahnya energi kinetik yang mempercepat gerak vibrasi, translasi dan rotasi enzim dan substrat sehingga memperbesar peluang keduanya untuk bereaksi. Pada suhu yang lebih besar dari batas reaksi, protein enzim dapat mengalami perubahan konformasi yang bersifat detrimal yaitu berubahnya susunan tiga dimensi yang khas dari rantai polipeptida. Hal yang sama juga dapat terjadi pada substrat yang perubahan konformasinya dapat menyebabkan gugus reaktifnya akan mengalami kesulitan pada saat memasuki sisi aktif enzim (Machielsen et al 2007).
Seperti protein pada umumnya, struktur ion enzim tergantung pada pH lingkungannya. Enzim dapat berbentuk ion positif, ion negatif atau ion bermuatan ganda (zwitter ion). Dengan demikian perubahan pH lingkungan akan berpengaruh terhadap aktivitas bagian aktif enzim dalam bentuk kompleks enzim substrat. Disamping pengaruh struktur ion pada enzim, pH rendah atau pH tinggi dapat pula menyebabkan terjadinya proses denaturasi dan ini akan menyebabkan menurunnya aktivitas enzim (Lehninger 2004)
Enzim memiliki pH optimum yang khas, yaitu pH yang menyebabkan aktivitas maksimal. Profil aktivitas pH enzim menggambarkan pH pada saat gugus pemberi atau penerima proton yang penting pada sisi katalitik enzim berada dalam tingkat ionisasi yang diinginkan. Nilai pH optimum tidak perlu sama dengan pH lingkungan normalnya, dengan pH yang mungkin sedikit berada diatas atau dibawah pH optimum. Aktivitas katalitik enzim dalam sel mungkin diatur sebagian oleh perubahan pada pH medium atau lingkungan (Lehninger 2004).
Banyak enzim yang memerlukan tambahan komponen kimia bagi aktivitasnya. Komponen ini disebut dengan kofaktor. Kofaktor bisa berupa molekul organik seperti ion Fe, Mn dan Zn atau mungkin juga molekul organik kompleks yang disebut koenzim seperti tiamin pirofosfat, FAD serta koenzim A. Beberapa enzim memerlukan satu atau lebih kofaktor dan koenzim bagi aktivitasnya. Pada beberapa enzim, koenzim atau ion logam hanya terikat secara lemah atau dalam waktu sementara. Akan tetapi pada beberapa enzim lainnya senyawa ini terikat kuat dan permanen. Dalam hal ini disebut gugus prostetik. Enzim yang strukturnya sempurna dan aktif mengkatalisis bersama-sama dengan koenzim atau gugus logam lainnya disebut holoenzim. Koenzim dan ion logam bersifat stabil selama pemanasan, sedangkan bagian protein enzim yang disebut apoenzim akan terdenaturasi oleh pemanasan (Illanes 2008).
Ion logam mempunyai peranan penting dalam menjaga kestabilan enzim. Logam biasanya berperan sebagai pengatur aktivitas enzim. Ion logam dapat mengaktifkan enzim melalui berbagai kemungkinan seperti : 1) menjaga bagian internal enzim, 2) menghubungkan enzim dengan substrat 3) merubah konstanta keseimbangan reaksi enzim 4) merubah tegangan permukaan reaksi enzim 5) menghilangkan inhibitor, 6) menggantikan ion logam yang tidak efektif pada sisi
aktif enzim maupun substrat, dan 7) merubah konformasi enzim menjadi konformasi yang lebih aktif (Whitaker et al 2003).
Beberapa jenis enzim mengandung ion logam yang telah terikat ataupun memerlukan ion logam yang sengaja ditambahkan bagi aktivitasnya. Metaloenzim mengandung ion logam fungsional dalam jumlah pasti, yang dipertahankan selama proses pemurnian. Enzim yang diaktifkan oleh logam memperlihatkan ikatan yang lebih lemah dengan logam, dan dengan demikian memerlukan logam tambahan. Oleh karena itu, perbedaan metaloenzim dengan enzim yang diaktifkan oleh logam terletak pada afinitas suatu enzim tertentu terhadap ion logamnya (Bugg 2004).
Seperti halnya katalisator, enzim dapat mempercepat reaksi kimia dengan menurunkan energi aktivasinya. Kemampuan enzim merubah substrat menjadi produk disebut sebagai aktivitas enzim. Dengan persetujuan internasional, 1,0 unit aktivitas enzim didefinisikan sebagai jumlah yang menyebabkan pengubahan 1,0 mikromol (10-6
mol) substrat per menit pada keadaan pengukuran optimal. Aktivitas spesifik adalah jumlah unit substrat yang dirubah per milligram enzim (Lehninger 1982).
E. SODIUM DEDOSIL SULFAT POLIAKRILAMID GEL
ELEKTROFORESIS (SDS-PAGE)
Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE)
merupakan metode analisis protein secara kualitatif yang paling banyak digunakan. Secara umum SDS-PAGE bermanfaat untuk menganalisis kemurnian protein. Dan karena dapat memisahkan protein berdasarkan ukuran, maka metode ini juga dapat digunakan untuk menentukan berat molekul relatif protein (Walker 2009). Elektroforesis adalah peristiwa perpindahan partikel-partikel bermuatan karena pengaruh medan listrik. Pada tahapan SDS-PAGE, protein didenaturasi menggunakan panas, ß-merkaptoetanol, dan SDS. Protein yang terdenaturasi akan bereaksi dengan SDS yang merupakan deterjen anionik membentuk kompleks yang bermuatan negatif. Protein dalam bentuk kompleks yang bermuatan negatif ini akan dapat dipisahkan berdasarkan muatan dan ukurannya secara elektroforesis di dalam matriks gel poliakrilamid. Berat molekul protein dapat diukur dengan
bantuan protein standar (marker) yang telah diketahui berat molekulnya melalui perbandingan nilai mobilitas relatif (Rf) (Lehninger 2004).
Gel poliakrilamid tersusun atas monomer monoakrilamid yang membentuk ikatan silang dengan bantuan ammonium persulfat (APS) dan
N,N,N,N-tetramethylethylenediamine (TEMED). Ukuran pori gel poliakrilamid bergantung
pada konsentrasi akrilamid. SDS-PAGE terdiri dari 2 gel yaitu stacking gels dan
separating gels. Stacking gels memiliki kandungan akrilamid yang lebih rendah
sehingga memiliki pori yang lebih besar. Stacking gels berfungsi sebagai media agar protein terdenaturasi yang telah bermuatan negatif bergabung atau berasosiasi membentuk elips masuk kedalam separating gel. Separating gels yang memiliki pori yang lebih kecil kemudian akan memisahkan protein berdasarkan ukuran. Protein yang berukuran lebih kecil akan lebih cepat melewati pori-pori pada separating gels (Walker 2009).
SDS-PAGE dilakukan dengan posisi berdiri, dimana pada bagian bawah gel diberi buffer anoda (bermuatan positif) dan dibagian atas gel diberi buffer katoda (bermuatan negatif). Kompleks protein-SDS yang telah bermuatan negatif akan bergerak melewati gel poliakrilamid menuju anoda dengan bantuan medan listrik dan buffer elektroforesis. Laju pergerakan protein bergantung pada ukuran pori dan kekuatan medan listrik. Setelah dilakukan elektroforesis, gel divisualisasi dengan pewarnaan. Pewarnaan protein dalam gel dapat dilakukan dengan pewarna
Coomassie Brilliant Blue R-250 atau pewarna perak (silverstain). Dengan
pewarnaan, protein dalam gel poliakrilamid akan terlihat membentuk band atau pita yang terpisah berdasarkan ukurannya masing-masing (Walker 2009).
F. PENGUKURAN KONSENTRASI PROTEIN
Menurut Walker (2009), kuantifikasi protein dapat dilakukan dengan beberapa metode diantaranya adalah dengan: 1) absorbansi dengan sinar ultraviolet (UV absorption), 2) metode Lowry, 3) bicinchoninic acid (BCA) assay
dan 4) metode Bradford. Metode Bradford merupakan salah satu teknik penentuan kadar protein yang berdasarkan pada pengikatan secara langsung zat warna
Coomassine Brilliant Blue G250 (CBBG) oleh protein pada kondisi pH asam.
Grup trifenilmetana mengikat struktur non polar protein dan grup anion sulfonat berinteraksi dengan rantai samping protein kation (protein bermuatan positif).
Jumlah CBBG yang terikat pada protein proporsional dengan muatan positif yang ditemukan pada protein. Reagen CBBG bebas berwarna merah-kecoklatan (panjang gelombang
maks 465 nm), sedangkan dalam suasana asam reagen CBBG akan berada dalam bentuk anion yang akan mengikat protein membentuk warna biru (panjang gelombangmaks 595 nm). (Bradford 1976).
Pada metode Bradford, penentuan protein dapat dilakukan dengan cara mikro untuk kandungan protein yang rendah dan makro untuk kandungan protein yang tinggi. Standar konsentrasi protein yang sesuai adalah 10-100 µg. Konsentrasi protein 0-10 µg biasanya digunakan dalam pengujian mikro dan 10-100 µg digunakan dalam pengujian makro. Karena lebih sederhana dan lebih
sensitif, metode ini adalah yang paling banyak digunakan untuk analisis protein secara kuantitatif (Kruger 2009).
Hubungan absorbansi dan konsentrasi protein ditentukan melalui kurva standar yang telah dibuat sebelumnya. Penetapan kurva standar dilakukan dengan menggunakan protein tertentu seperti bovin serum albumin (BSA), dengan berbagai konsentrasi. Besarnya konsentrasi BSA sebagai protein standar adalah sekitar 150-750 µg/ml (Coligan et al 2004). Hubungan antara konsentrasi larutan standar dan absorbansinya dinyatakan sebagai persamaan regresi linier: Y = a + bx. Dalam analisis dengan metode bardford ini terdapat dua jenis metode yaitu makro assay untuk konsentrasi protein tinggi dan mikro assay untuk konsentrasi protein rendah (Bradford 1976).
METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Inang atau bakteri penghasil enzim yang digunakan dalam penelitian ini adalah E. coli BL21 (DE3) pLysS pET-21b yang telah ditransformasi dengan gen
araA dari bakteri Geobacillus sterothermophilus strain lokal asal Tanjung Api,
Poso, Indonesia di laboratorioum Carbohydrate Bioengeenering Research Grup (CBRG) Pusat Penelitian Bioteknologi LIPI Cibinong.
Bahan kimia yang digunakan untuk produksi, purifikasi dan karakterisasi enzim antara lain yeast extract, tripton, NaCl, limbah cair tahu, ampisilin, kloramfenikol, isopropylthiogalactoside (IPTG), Tris, HCl, gliserol, loading protein, sodium dedosil sulfat (SDS), ammonium persulfate (APS), akrilamid, N,N,N,N-tetramethylethylenediamine (TEMED), buffer elektroforesis, protein marker, coommasie blue, metanol, standar bovin serum albumin (BSA), fruktosa, galaktosa, karbazol, sistein, etanol, asam sulfat, Bradford reagent, resin dietilaminoetil (DEAE) sepharos, NaOH, sodium asetat, sodium fosfat, MnCl2.4H2O, CaCl2.2H2O, akuades dan alkohol 70%.
Peralatan yang digunakan yakni laminar flow, sentrifus dingin, shaker inkubator, lemari pendingin (suhu 4 0C), freezer (suhu -20 dan -70ºC), mikropipet, spektrofotometer, waterbath, vorteks, perangkat elektroforesis SDS-PAGE, hot
plate, pH meter, kolom kromatografi buatan (1.5x8cm), pompa kromatografi, effendof, kuvet, autoklaf, pipet Mohr, timbangan analitik dan alat-alat gelas.
B. METODE PENELITIAN
Penelitian dilakukan dengan 3 tahap yaitu produksi, purifikasi dan karakterisasi. Penelitian diawali dengan produksi enzim menggunakan modifikasi medium ekpresi dan kemudian optimalisasi dengan lama waktu induksi pada medium ekspresi terpilih. Hasil yang optimal dikonfirmasi dengan SDS-PAGE (melalui ketebalan pita) dan aktivitas enzim. Ketebalan pita dan aktivitas yang tinggi pada supernatan dari presipitat diharapkan sehingga menunjukkan bahwa enzim yang diperoleh larut (soluble) pada supernatan. Hasil produksi yang paling optimal kemudian dipurifikasi dan dikarakterisasi.
1. Produksi Enzim
a. Persiapan medium (Shin et al 1997; Putri 2010)
Media Luria Bertani (LB) cair sebanyak 100 mL dibuat dengan komposisi (m/v) 1% bacto-pepton , 1% NaCl, dan 0.5% ekstrak khamir. Limbah cair tahu (LCT) diatur pH-nya menjadi 6.71-6.73 kemudian ditambahkan ekstrak khamir 0.5 g per 100 mL (LCT+YE). Medium LCT dan LB disterilisasi pada temperatur 121ºC selama 15 menit.
b. Persiapan kultur E. coli transfroman
Untuk persiapan dan penyegaran, kultur E. coli transfroman sebanyak 20 µl ditumbuhkan dalam 2 ml media cair Luria Bertani (LB) yang mengandung 50 µg/ml ampisilin dan 50 µg/ml kloramfenikol. Selanjutnya diinkubasi selama 16 jam pada shaker inkubator (37ºC, 150 rpm). Setelah inkubasi, kultur sebanyak 800 µl dimasukkan ke dalam effendof dan ditambahkan 200 µl gliserol, kemudian disimpan pada suhu -20ºC. Setiap satu bulan dilakukan penyegaran terhadap kultur E. coli transforman.
c. Produksi enzim dengan membandingkan medium ekspresi standar dengan medium ekspresi yang dimodifikasi (Modifikasi Cheng et al 2009)
Kultur E. coli dengan umur 16 jam diinokulasikan masing-masing sebanyak 50 µl pada 5 ml medium cair LB dan medium LCT+YE. Kedua medium ekpresi tersebut telah ditambahkan 50 µg/ml ampisilin dan 50 µg/ml kloramfenikol. Selanjutnya kultur pada medium ekpresi diinkubasi pada shaker inkubator (37ºC, 150 rpm). Setelah optical density (OD) kedua medium mencapai 0.5-0.6 (pada panjang gelombang 600 nm) maka kedua medium masing-masing dibagi menjadi 2 bagian. Untuk memisahkan perlakuan induksi dan non induksi. Induksi dilakukan dengan penambahan IPTG pada medium dengan konsentrasi akhir 1 mM, dan diinkubasi kembali selama 4 jam. Inkubasi atau waktu induksi dihentikan dengan meletakkan medium pada cairan es. Setelah itu, sel pada medium dipanen dengan setrifugasi pada kecepatan 11,000 rpm suhu 4ºC selama 15 menit. Supernatan 1 (S1) yang merupakan medium ekspresi dibuang, sedangkan pellet 1 (P1) yang tertinggal ditambahkan dengan 500 µl (25%) buffer Tris HCl pH 7.5 (kemudian divorteks untuk homogenisasi). Sebanyak 50 µl
campuran pellet dan buffer tersebut diambil dan disimpan pada lemari pendingin. Campuran pellet 1 (P1) dan buffer ini disebut juga dengan total suspensi (T). Sisa total suspensi (T) kemudian dipisahkan kembali untuk memperoleh supernatan 2
(S2) dan pellet 2 (P2) seperti yang akan dijelaskan pada tahapan purifikasi. d. Optimasi produksi enzim pada medium ekpresi terpilih
Sebanyak 600 µl kultur E. coli transforman ditumbuhkan pada 60 ml medium ekpresi terpilih yang telah ditambahkan ampisilin dan kloramfenikol. Setelah OD kultur mencapai 0.5-0.6, kemudian diinduksi dengan penambahan IPTG (konsentrasi akhir IPTG pada medium = 1 mM). Sel dipanen setiap interval 0, 4, 8, 12, 16, 20 dan 24 jam setelah induksi. Pengambilan total suspensi sel dilakukan dengan cara yang sama dengan yang telah diterangkan sebelumnya. Setelah itu dilakukan pemisahan kembali dengan teknik freeze-thaw untuk mendapatkan supernatan 2 (S2) dan pellet 2 (P2). Penentuan keberadaan enzim dilakukan dengan perangkat gel elektroforesis SDS-PAGE. Sedangkan aktivitas enzim diukur pada panjang gelombang 560 nm.
2. Purifikasi a. Freeze-thaw
Total suspensi sel (T) atau campuran P1 dan buffer diberi perlakuan
freeze-thaw dengan cara memasukkannya pada freezer bersuhu -70 0
C sampai membeku selama ± 30 menit dan mencairkannya kembali (freeze-thaw dilakukan dengan 3 kali pengulangan). Kemudian disentrifugasi pada kecepatan 11,000 rpm suhu 4 0C selama 15 menit untuk memisahkan pellet 2 (P2) dan supernatan 2 (S2). Pellet 2 (P2) ditambahkan buffer Tris HCl pH 7.5, sedangkan supernatan 2 (S2) dimurnikan lebih lanjut. Penentuan keberadaan enzim AI dilakukan menggunakan SDS-PAGE. Dan penentuan konsentrasi protein pada S2 ditentukan dengan metode Bradford. Sedangkan aktivitasnya diukur pada panjang gelombang=560 nm setelah direaksikan dengan larutan pewarna sistein karbazol asam sulfat.