1
Indonesia merupakan negara kepulauan terbesar di dunia. Luas total laut Indonesia sekitar 5 juta km2 dengan zona ekonomi eksklusif seluas 2,7 juta km2 (Suharsono, 2014). Wilayah yang kaya akan perairan ini menjadikan melimpahnya sumber daya hayati laut dan keanekaragaman hayati laut (megabiodiversity). Kekayaan biodiversity tersebut berbanding lurus dengan adanya kekayaan kandungan kimia dari lingkungan laut. Produk alami laut, terutama senyawa metabolit sekunder dianggap sebagai sumber yang tak ada habisnya untuk penemuan obat baru dan obat yang telah digunakan dalam bidang farmasi (Chasanah, 2008).
Penelitian bahan bioaktif dari biota laut beberapa tahun terakhir sangat gencar dilakukan, baik di dalam maupun di luar negeri. Biota-biota yang tidak bertulang belakang (invertebrata) seperti spons, koral dan tunikat mengandung senyawa bioaktif yang lebih banyak dibanding alga dan tumbuhan darat. Diantara biota laut tak bertulang belakang tersebut, spons menduduki tempat teratas sebagai sumber substansi aktif (Proksch, 1998). Spons merupakan hewan yang sangat sederhana yang merupakan peralihan dari hewan bersel tunggal menuju hewan tingkat tinggi namun belum mempunyai organ dan sistem syaraf (Campbell, 2003). Spons menjadi fokus yang menarik akhir-akhir ini dikarenakan dua faktor yang utama, yaitu spons mampu membentuk asosisasi dengan berbagai
mikroba dan spons merupakan sumber yang kaya bioaktif metabolit sekunder (Taylor dkk., 2007).
Dalam pemanfaatan spons sebagai sumber senyawa baru dan memproduksi senyawa bioaktif tertentu, perlu dilakukan upaya pengendalian pengambilan spons laut dari alam dan mencegah tangkap lebih (overfishing), (Suparno, 2005). Salah satu upaya pengendalian tersebut adalah dengan memanfaatkan mikroorganisme simbionnya. Interaksi antara spons dan bakteri terjadi dalam bentuk simbiosis komensalisme di mana dalam interaksi ini dihasilkan senyawa bioaktif (Proksch, 2002). Penelitian yang dilakukan oleh Narshinha dan Anik (2000) menunjukkan adanya hubungan kerjasama dalam biosintesis metabolit sekunder antara mikroba simbion dengan spons. Dalam penelitian tersebut dijabarkan bahwa senyawa antibakteri yang dihasilkan oleh bakteri simbion spons (α-proteobacterium MBIC 3368, Idiomarina sp dan
Pseudomonas sp.) sangat dipengaruhi oleh protein rekombinasi yang terdapat
pada biota inang Suberitas domuncula.
Mikroba yang potensial sebagai target penghasil senyawa aktif adalah
Cyanobacteria, fungi dan Actinomycetes (Murniasih dan Rasyid, 2010).
Komponen bioaktif seperti antimikroba, antitumor, agen immunosupresan dan enzim telah ditemukan di organisme Actinomycetes laut (Gandhimathi, 2008). Penelitian tentang fungi dari biota laut (marine-derived fungi) yang berasal dari Indonesia jumlahnya masih sedikit, padahal jika dilihat dari keanekaragaman biota laut di negara kita, potensi marine-derived fungi sebagai penghasil metabolit sekunder juga besar. Pada tahun 2002-2004, dari fungi laut telah ditemukan 272
produk alami baru, hal ini membuktikan bahwa fungi laut memiliki potensi farmakologis (Samuel, 2011).
Salah satu senyawa bioaktif unik yang dihasilkan oleh mikroba simbion spons adalah protein aktif (enzim) yang memiliki aktivitas antimikroba. Karena kondisi lingkungan laut yang sangat berbeda dengan daratan, organisme laut mampu menghasilkan berbagai tipe antibiotik. Sebagai contoh, senyawa Cephalosporin C yang dihasilkan oleh fungi laut Cephalosporium acremonium sudah diaplikasikan sebagai antibiotik untuk mengatasi berbagai macam penyakit dari bakteri patogen. Namun sejauh ini belum banyak data penelitian yang mengeksplorasi senyawa metabolit sekunder terutama enzim dari mikroba simbion spons yang berpotensi sebagai bahan baku obat dalam menekan berbagai penyakit pada manusia seperti zat antimikroba (Suriani dkk., 2012; Kim dkk., 2013). Fungi kode Sal 6 merupakan fungi asosiasi spons Stylissa flabelliformis yang diambil dari Perairan Pulau Menjangan, Taman Nasional Bali Barat. Aktivitas antimikroba dari fungi kode Sal 6 belum diketahui karena belum pernah ada penelitian mengenai fungi ini. Oleh karena itu, penelitian ini dilakukan untuk mengetahui aktivitas antimikroba dari fungi kode Sal 6 asosiasi spons Stylissa
flabelliformis.
B. Rumusan Masalah Permasalahan yang diajukan dalam penelitian ini adalah :
1. Apakah fungi kode Sal 6 asosiasi spons Stylissa flabelliformis mampu menghasilkan metabolit yang berkhasiat sebagai senyawa antimikroba?
2. Pada hari ke berapa fermentasi fungi kode Sal 6 asosiasi spons Stylissa
flabelliformis menunjukkan diameter zona hambat terbesar?
3. Termasuk golongan senyawa apakah metabolit sekunder fungi kode Sal 6 asosiasi spons Stylissa flabelliformis yang potensial sebagai antimikroba?
C. Tujuan Penelitian Tujuan dari penelitian ini adalah :
1. Mengisolasi fungi kode Sal 6 asosiasi spons Stylissa flabelliformis dan mengetahui sifat antimikroba dari metabolit yang dihasilkan.
2. Mengetahui pada hari ke berapa fermentasi fungi kode Sal 6 asosiasi spons
Stylissa flabelliformis menunjukkan diameter zona hambat terbesar.
3. Mengetahui golongan senyawa aktif antimikroba dari metabolit fungi kode Sal 6 asosiasi spons Stylissa flabelliformis.
D. Manfaat Penelitian
Manfaat dari penelitian ini adalah untuk memberikan informasi dalam pengembangan senyawa antimikroba pada fungi kode Sal 6 asosiasi spons Stylissa
flabelliformis. Selain itu dapat dijadikan bahan acuan penelitian yang serupa bagi
para peneliti lainnya untuk mengoptimalkan potensi biota laut Indonesia pada bidang farmasi dan biomedis (marine drug).
E. Tinjauan Pustaka 1. Spons
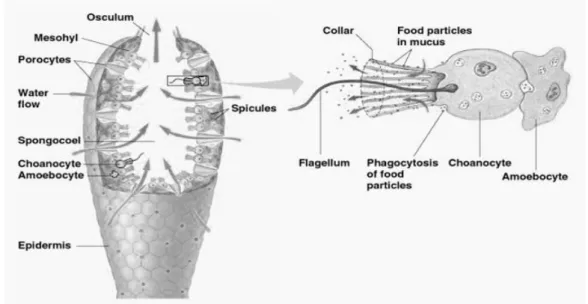
Spons adalah hewan yang hidup sesil (menempel) tanpa organ dan jaringan yang terspesialisasi. Spons menyaring makanan dari air yang dipompakan melalui tubuhnya yang memiliki banyak pori-pori. Spesies spons yang beraneka ragam bervariasi dalam bentuk, warna, dan kerumitan struktural. Sejumlah spesies berpigmen sangat cerah karena hidup bersama ganggang simbiotik (Campbell, 2003).
Gambar 1. Morfologi spons (Campbell, 2003)
Tubuh spons sederhana, mirip dengan suatu kantung yang berpori atau berlubang-lubang (porifera berarti “mengandung pori”). Air akan disedot melalui pori-pori itu ke dalam rongga tengah atau spongosel (spongocoel), yang kemudian akan mengalir keluar spons itu melalui suatu lubang yang lebih besar yang disebut oskulum. Spons yang lebih kompleks memiliki dinding tubuh yang melipat, dan banyak diantaranya mengandung saluran air bercabang dan beberapa
oskula. Pada kondisi tertentu, sel-sel yang berada di sekitar pori dan oskulum berkontraksi, dan menutup pembukaan atau lubang itu (Campbell, 2003).
Hampir semua dari 9000 jenis spons hidup di laut. Spons dapat hidup di wilayah kutub maupun tropis, namun sebagian besar jenis spons hidup di wilayah tropis (Castro dkk., 2003). Habitat spons umumnya adalah menempel pada pasir, batu-batuan dan karang-karang mati. Biota laut ini dikenal dengan filter feeders, yaitu mencari makanan dengan mengisap dan menyaring air melalui sel cambuk dan memompakan air keluar melalui oskulum. Partikel-partikel makanan seperti bakteri, mikroalga dan detritus terbawa oleh aliran air ini (Amir & Budiyanto, 1996). Pola makanan spons yang khas yaitu filter feeder (menghisap dan menyaring) dapat memanfaatkan jasad renik di sekitarnya sebagai sumber nutrien diantaranya bakteri (Suparno, 2005).
Pembentukan senyawa bioaktif pada spons sangat ditentukan oleh prekursor berupa enzim, nutrien serta hasil simbiosis dengan biota lain yang mengandung senyawa bioaktif seperti bakteri, kapang dan beberapa jenis dinoflagellata yang dapat memacu pembentukan senyawa bioaktif pada hewan tersebut (Scheuer, 1978). Beberapa senyawa aktif yang diisolasi dalam spons juga ditemukan dalam bakteri yang bersimbiosis dengannya, oleh sebab itu beberapa peneliti berpendapat bahwa bakteri terlibat sebagian maupun keseluruhan dalam biosintesis senyawa aktif tertentu dalam spons.
Spons Stylissa flabelliformis memiliki kenampakan berwarna merah dengan bentuk tipis dan lunak, permukaan berpori dengan tonjolan tak beraturan pada seluruh tubuh, bagian dalam tubuh berwarna putih kekuningan. Spons ini
mampu menghasilkan senyawa sitotoksik dan fungisid. Dari penelitian Setyowati dkk. (2005) disimpulkan bahwa kandungan senyawa aktif sitotoksik dan fungisid dari spons Stylissa flabelliformis adalah jaspamide.
2. Fungi Asosiasi Spons
Fungi asosiasi spons memainkan peran ekologis seperti transfer nutrisi dan pertahanan kimiawi dalam spons (Bugni & Ireland, 2004). Rot dkk. (2006) menemukan transfer gen horizontal mitokondria dari fungi ke spons yang menunjukkan adanya hubungan simbiosis antara spons dan fungi. Banyak fungi yang berasal dari spons menunjukkan aktivitas antimikroba yang jelas, misalnya Eurotiales, Hypocreales, dan Pleosporales (Baker dkk., 2009). Dalam penelitian Ding (2011) dikemukakan bahwa sebagian besar fungi asosiasi spons (> 45%) memiliki aktivitas enzimatik atau dapat menghasilkan produk alami bioaktif.
Penelitian mengenai diversitas fungi laut asli indonesia masih sangat sedikit, sedangkan potensi fungi tersebut untuk bioteknologi sangat menjanjikan (Gandjar, 2006). Sampai saat ini jumlah spesies fungi yang sudah dideskripsikan di dunia kurang dari 10% dari total 1.5 juta spesies yang diperkirakan ada di dunia (Sjamsuridzal, 2006). Samuel dkk. (2011) mengatakan pada tahun 2002-2004, dari fungi laut telah ditemukan 272 produk alami baru, hal ini membuktikan bahwa fungi laut memiliki potensi farmakologis. Salah satu produsen metabolit sekunder adalah fungi simbion dari spons. Jumlah metabolit sekunder yang diisolasi dari fungi laut yang bersimbiosis dengan alga, spons, avertebrata lainnya dan sedimen sebagai antibakteri, antifungi dan sitotoksik rata-rata 75% memiliki aktivitas biologis (Reddy dkk., 2011).
Fungi yang digunakan dalam penelitian ini merupakan fungi kode Sal 6 simbion dari spons Stylissa flabelliformis yang diambil dari Pulau Menjangan, Taman Nasional Bali Barat. Fungi ini merupakan golongan kapang dengan ciri-ciri berwarna kuning-putih, memiliki spora, tidak berklorofil, bersifat eukariot, bersel banyak berbentuk benang-benang hifa.
3. Jalur Biosintesis Metabolit Sekunder
Metabolit sekunder merupakan senyawa yang dihasilkan atau disintesis pada sel dan grup taksonomi tertentu pada tingkat pertumbuhan atau stress tertentu. Senyawa ini diproduksi hanya dalam jumlah sedikit, tidak terus-menerus, untuk mempertahankan diri dan tidak berperan penting dalam proses metabolisme utama (primer). Senyawa metabolit sekunder memiliki struktur yang lebih kompleks, sulit disintesis, dan masih sedikit (15%) yang telah berhasil diisolasi sehingga memiliki nilai ekonomi yang tinggi (Mariska, 2013). Beberapa manfaat metabolit sekunder yang telah diketahui, misalnya sebagai racun untuk pertahanan diri terhadap predator, sebagai senyawa volatil untuk menarik spesies lain, sebagai agen pewarna untuk menarik atau memperingatkan spesies lain. Sebagian besar produk alam yang menghasilkan metabolit sekunder mampu berkhasiat secara farmakologis (Dewick, 2002).
Jalur pembentukan metabolit sekunder senyawa metabolit sekunder diproduksi melalui jalur di luar biosintesis karbohidrat dan protein. Sejauh ini,
building block yang berperan penting dalam biosintesis metabolit sekunder
berasal dari intermediet asetil koenzim A (asetil-CoA), asam sikimat, asam mevalonat, dan 1-deoxyxylulose-5-phosphate. Jalur yang biasanya dilalui dalam
pembentukan metabolit sekunder ada tiga jalur, yaitu jalur asam asetat, jalur asam sikimat, dan jalur asam mevalonat.
1) Jalur Asam Asetat
Semua senyawa yang termasuk poliketida digolongkan menjadi satu dikarenakan jalur biosintesisnya. Keanekaragaman strukturnya berasal dari rantai poli-β-keto yang dibentuk oleh kopling unit-unit asam asetat (C2) melalui reaksi kondensasi.
Pembentukan rantai poli-β-keto dapat digambarkan sebagai sederet reaksi Claisen, yang melibatkan urutan β-oksidasi dalam metabolisme asam lemak. Jadi, 2 molekul asetil-KoA dapat ikut serta dalam reaksi Claisen membentuk asetoasetil-KoA, kemudian reaksi berlanjut sampai dihasilkan rantai poli-β-keto yang cukup. Termasuk senyawa poliketida adalah asam lemak, polisetilena, prostaglandin, antibiotika, makrolida dan senyawa aromatik seperti antrakinon dan tetrasiklin (Dewick, 2002). Senyawa metabolit sekunder yang dihasilkan melalui jalur asam malonat diantaranya asam lemak (laurat, miristat, palmitat, stearat, oleat, linoleat), gliserida, poliasetilen, fosfolipida, dan glikolipida (Mariska, 2013).
2) Jalur Asam Mevalonat
Terpenoid merupakan bentuk senyawa dengan keragaman struktur yang besar dalam produk alami yang diturunkan dari unit isoprena (C5) yang bergandengan dalam model kepala ke ekor (head-to-tail), sedangkan unit
isoprena diturunkan dari metabolisme asam asetat oleh jalur asam mevalonat (mevalonic acid: MVA) (Dewick, 2002).
Jalur Asam Mevalonat Senyawa metabolit sekunder dari jalur ini diantaranya adalah essential oil, squalent, monoterpenoid, menthol, korosinoid, streoid, terpenoid, sapogenin, geraniol, ABA, dan GA3 (Mariska, 2013).
3) Jalur Asam Sikimat.
Jalur asam sikimat merupakan jalur alternatif menuju senyawa aromatik, utamanya L-fenilalanin, L-tirosina, dan L-triptofan. Jalur ini berlangsung dalam mikroorganisme dan tumbuhan, tetapi tidak berlangsung pada hewan. Zat antara pusat adalah asam sikimat, suatu asam yang ditemukan dalam tanaman Illicium sp., beberapa tahun sebelum perannya dalam metabolisme ditemukan. Asam ini juga terbentuk dalam mutan tertentu dari E. coli (Dewick, 2002). Metabolit sekunder yang disintesis melalui jalur asam sikimat diantaranya adalah asam sinamat, fenol, asam benzoat, lignin, kumarin, tanin, asam amino benzoat dan quinon (Mariska, 2013).
4. Media
Dalam mikrobiologi, media sebagai tempat pertumbuhan mikroorganisme digunakan untuk menumbuhkan dan mempelajari sifat-sifat mikroorganisme. Media pertumbuhan harus memenuhi persyaratan nutrisi yang dibutuhkan oleh suatu mikroorganisme (Atlas, 2004). Nutrisi yang dibutuhkan mikroorganisme untuk pertumbuhan meliputi karbon, nitrogen, unsur non logam seperti sulfur dan fosfor, unsur logam seperti Ca, Zn, Na, K, Cu, Mn, Mg, dan Fe,
vitamin, air, dan energi (Cappucino & Natalie, 2014). Suatu media dapat menumbuhkan mikroorganisme dengan baik diperlukan persyaratan antara lain: media harus mempunyai tekanan osmose, tegangan muka, dan pH yang sesuai, media tidak mengandung zat-zat penghambat, media harus steril, dan media harus mengandung semua nutrisi yang mudah digunakan mikroba (Surawiria, 1985).
Menurut McNeil & Harvey (2008), media yang digunakan dalam kultur mikroba berdasarkan komponen media ada 3 jenis, yaitu media sintesis, semi sintesis dan kompleks. Media sintesis adalah media yang secara keseluruhan terbuat secara kimiawi. Komponen yang terkandung dalam media sintesis merupakan komponen yang sudah diketahui dan konsentrasi tiap komponen spesifik. Media semi sintetik adalah media yang secara keseluruhan terbuat dari bahan kimia tapi beberapa atau sebagian komponen terbuat dari bahan non sintesis tapi tetap terkontrol, seperti yeast. Yeast digunakan jika sel membutuhkan vitamin B dalam jumlah besar. Media kompleks adalah media yang hampir secara keseluruhan komponen berasal dari tumbuhan atau hewan akan tetapi semua komponen tersebut terkontrol. Contoh media yang umum yang digunakan untuk fungi dan kapang seperti Czapedok Dox Agar (CDA), Hay infusion agar (HIA),
Mal Extract Agar (MEA), Malt Yeast Agar (MYA), Oatmeal Agar (OA), Potato
Carrot Agar (PCA) dan Potato Dextrose Agar (PDA).
5. Fermentasi
Kata fermentasi memiliki makna yang berbeda untuk berbagai kelompok individu. Secara tradisional, fermentasi dideskripsikan sebagai proses perendaman sel hewan atau sel tumbuhan atau mikroorganisme dalam kultur cair untuk
membuat produk-produk yang bermanfaat atau mengumpulkan informasi mengenai fisiologi selnya. Sebaliknya, industri fermentasi modern melakukan budidaya aerobik untuk membuat berbagai produk bernilai lebih tinggi daripada etanol sederhana (McNeil & Harvey, 2008). Fermentasi dapat dimanfaatkan dalam proses produksi senyawa antimikroba. Sedikitnya ada 5 produk hasil fermentasi yang saat ini telah banyak diproduksi, yaitu :
a. Biomassa (sel-sel mikroba), misalnya produksi protein sel tunggal; b. Enzim, misalnya amilase dan protease;
c. Metabolit mikroba, berupa metabolit primer seperti polisakarida, protein, asam nukleat dan metabolit sekunder seperti antibiotik;
d. Produk rekombinan, misalnya insulin dan interferon;
e. Biokonversi, misalnya konversi etanol menjadi asam asetat, propanol menjadi aseton, sorbitol menjadi sorbosa, dan lain sebagainya.
(Stanburry dkk., 1995)
Formulasi media merupakan tahap penting dalam proses fermentasi, karena penelitian mikrobiologi sangat bergantung pada kemampuan untuk menumbuhkan dan memelihara mikroorganisme di media yang sesuai (Prescott, 2002). Media fermentasi harus mengandung berbagai unsur yang dibutuhkan untuk membentuk biomassa sel mikroba dan produksi metabolitnya. Perbandingan jumlah nutrisi dalam media fermentasi merupakan hal yang harus diperhatikan agar diperoleh kultur fermentasi yang optimal (Nisak, 2013). Umumnya, nutrisi untuk pertumbuhan mikroorganisme berupa makroelemen (C,
H, O, N, S, P, K, Ca, Mg, Fe) dan mikronutrien atau trace elements (Mn, Zn, Co, Ni, Cu) (Prescott, 2002).
Terdapat 3 macam sistem fermentasi, yaitu : a. Fermentasi sistem curah (Batch)
Sistem batch adalah sistem tertutup, artinya semua nutrisi yang dibutuhkan mikroba untuk tumbuh dan memproduksi metabolit berada dalam berada dalam satu fermentor dan tidak ada penambahan bahan atau pengambilan hasil selama fermentasi (Stanbury dkk., 1995). Pada fermentasi
batch semua bahan dimasukkan sekaligus di awal proses dan dikeluarkan
sekaligus pula setelah proses, kecuali oksigen dan udara dialirkan secara kontinyu (Crueger & Crueger, 1988). Keuntungan metode ini adalah produktivitas tinggi, waktu fermentasi cepat dan efek toksik direduksi pada komponen media (Stanburry dkk., 1995).
b. Fementasi Fed-batch culture
Sistem fed-batch adalah suatu sistem yang menambahkan media baru secara teratur pada kultur tertutup tanpa mengeluarkan cairan kultur yang ada di dalam fermentor sehingga volume kultur makin lama makin bertambah (Rachman, 1989). Sistem ini memungkinkan organisme untuk tumbuh pada tingkat pertumbuhan yang dikehendaki, meminimalkan produksi produk yang tidak diinginkan, dan memungkinkan pencapaian jumlah sel dan kadar produk yang tinggi. Kekurangan sistem ini adalah diperlukan pengetahuan pertumbuhan organisme dan pembentukkan produk (Patrick & Finn, 2008). c. Fermentasi kontinu (Continuous).
Sistem ini merupakan proses fermentasi yang mana media pertumbuhan ditambahkan dengan kecepatan yang sama secara terus-menerus saat setelah penanaman dan saat bersamaan cairan kultur dikeluarkan dari wadah fermentasi. Keuntungan sistem ini adalah mempunyai produktivitas dan kecepatan pertumbuhan dapat dioptimalkan, proses dalam waktu lama dapat dijalankan, dapat digunakan model sel amobil, serta faktor fisis dan lingkungan mudah dianalisis; sedangkan kerugiannya adalah tidak sesuai dengan kaidah Good Manufacturing Practice sehingga dilarang digunakan untuk memproduksi produk farmasi, resiko kontaminasi yang besar, produk yang belum optimal terbentuk, dan mudah timbul perubahan/evolusi pada mikroba.
Menurut McNeil & Harvey (2008) beberapa hal yang perlu diperhatikan dalam proses fementasi adalah :
a. Kecepatan aerasi sering tidak sesuai dengan jumlah oksigen yang dibutuhkan dan oksigen yang terlarut dalam media;
b. Jumlah sumber karbon dan nutrisi lain harus sesuai baik dalam jumlah dan komposisi dengan mikroba dan produk yang diinginkan;
c. Toksin yang terakumulasi dan dapat menghambat pertumbuhan; d. Perubahan pH selama proses fermentasi;
e. Busa yang mungkin ditimbulkan. Busa dapat disebabkan oleh kandungan garam, pH, suhu, komposisi media, aliran udara, agitasi, dan penambahan anti busa yang berlebihan. Anti busa yang ditambahkan dalam media fermentasi dapat mengurangi jumlah oksigen yang terlarut media.
Terdapat 4 fase pertumbuhan bakteri ketika ditumbuhkan pada kultur curah (batch culture), yaitu fase adaptasi (lag phase), fase perbanyakkan (exponential phase), fase statis (stationer phase), dan fase kematian (death phase) (Purwoko, 2007).
1. Fase Adapatasi /Lag phase
Pada fase ini tidak ada pertambahan populasi. Sel mengalami perubahan dalam komposisi kimiawi dan bertambah ukurannya, substansi interaseluler bertambah (Pelczar & Chan, 2005). Pada fase adaptasi tidak di jumpai peningkatan jumlah sel. Akan tetapi terjadi pertambahan volume sel karena pada fase statis biasanya sel melakukan pengecilan ukuran sel. Fase adaptasi dapat dihindari (langsung ke fase perbanyakan), jika sel di media lama dalam kondisi fase perbanyakan dan dipindahkan ke media baru yang sama komposisinya dengan media lama (Purwoko, 2007). Lama fase lag sangat dipengaruhi oleh kondisi dan jumlah awal mikroba (inokulum) dan media pertumbuhan (Pratiwi, 2008).
2. Fase Perbanyakan/ Fase Log/ exponential phase
Setelah memperoleh kondisi ideal dalam pertumbuhannya, sel melakukan pembelahan. Karena pembelahan sel merupakan persamaan ekponensial, maka fase itu disebut juga fase eksponensial. Pada fase perbanyakan jumlah sel meningkat pada batas tertentu (tidak terdapat pertumbuhan bersih jumlah sel), sehingga memasuki fase statis. Pada fase perbanyakan sel melakukan konsumsi nutrien dan proses fisiologis lainnya. Pada fase itu produk senyawa yang di inginkan oleh manusia terbentuk,
karena senyawa terbentuk merupakan senyawa yang diinginkan pada fase perbanyakan adalah etanol, asam laktat dan asam organik lainnya (Purwoko, 2007). Pertumbuhan dan perbanyakan sel tergantung pada genetika mikroba, media, dan kondisi pertumbuhan (Pratiwi, 2008).
3. Fase Statis (stationer phase)
Pada fase ini terjadi penumpukan produk beracun dan atau nutrisi sudah habis. Beberapa sel mati sedangkan yang lain tumbuh dan membelah. Jumlah sel hidup menjadi tetap (Pelczar & Chan, 2005). Pada fase statis biasanya sel melakukan adaptasi terhadap kondisi yang kurang menguntungkan. Adaptasi ini dapat menghasilkan senyawa yang diinginkan manusia misalnya antibiotika dan antioksidan (Purwoko, 2007).
4. Fase Kematian (death phase)
Pada fase ini, jumlah sel mati meningkat karena nutrisi dalam media telah habis dan akumulasi senyawa toksik (Pratiwi, 2008). Penyebab utama kematian adalah autolisis sel dan penurunan energi seluler. Beberapa bakteri hanya mampu bertahan beberapa jam selama fase statis dan akhirnya masuk ke dalam fase kematian, sementara itu beberapa bakteri hanya mampu bertahan sampai harian dan mingguan pada fase statis dan akhirnya masuk ke fase kematian. Beberapa bakteri bahkan mampu bertahan sampai puluhan tahun sebelum mati, yaitu dengan mengubah sel menjadi spora (Purwoko, 2007).
Pertumbuhan mikroorganisme dapat diukur dengan dua cara, yaitu secara langsung dan secara tidak langsung. Pengukuran pertumbuhan mikroorganisme secara langsung dapat dilakukan dengan pengukuran menggunakan bilik hitung (counting chamber), electronic counter, platting
technique, dan tehnik filtrasi membran (membrane filtration technique).
Sedangkan pengukuran pertumbuhan mikroorganisme secara tidak langsung dapat dilakukan dengan pengukuran kekeruhan (turbidity) menggunakan spektrofotometer, pengukuran aktivitas metabolik, dan pengukuran berat sel kering (BSK) (Pratiwi, 2008).
6. Antimikroba
Salah satu contoh golongan antimikroba adalah antibakteri. Antibakteri adalah suatu senyawa yang dalam konsentrasi kecil mampu menghambat bahkan membunuh proses kehidupan suatu mikroorganisme (Jawetz dkk., 2005). Beberapa istilah yang digunakan untuk menjelaskan proses pembasmian bakteri yaitu:
a. Germisid adalah bahan yang dipakai untuk membasmi mikroorganisme dengan mematikan sel-sel vegetatif, tetapi tidak selalu mematikan bentuk sporanya.
b. Bakterisidal adalah bahan yang dipakai untuk mematikan bentuk-bentuk vegetatif bakteri.
c. Bakteriostatik adalah suatu bahan yang mempunyai kemampuan untuk menghambat pertumbuhan bakteri tanpa mematikannya.
d. Antiseptik adalah suatu bahan yang menghambat atau membunuh mikroorganisme dengan mencegah pertumbuhan atau menghambat aktivitas metabolisme, digunakan pada jaringan hidup.
e. Desinfektan adalah bahan yang dipakai untuk membasmi bakteri dan mikroorganisme patogen tapi belum tentu beserta sporanya, digunakan pada benda mati
(Pelczar & Chan, 1986). Obat antimikroba sering disebut sebagai bakteriostatik atau bakteriosidal. Istilah “bakteriostatik” menggambarkan suatu obat yang dapat menghambat pertumbuhan mikroorganisme. Keberhasilan pengobatan ini sering bergantung pada partisipasi mekanisme pertahanan tubuh inang (Jawetz, 2005).
Berdasarkan spektrum aktivitas antimikroba, antibiotik terbagi menjadi dua yaitu antibiotik spektrum luas dan spektrum sempit. Antibiotik spektrum luas dapat mempengaruhi pertumbuhan bakteri Gram positif maupun Gram negatif. Sedangkan antibiotik spektrum sempit hanya dapat mempengaruhi salah satunya (Tortora dkk., 2010). Adapun mekanisme kerja obat antimikroba diantaranya : 1) Penghambatan sintesis dinding sel.
Berbeda dengan sel binatang, sel bakteri mempunyai lapisan luar yang kaku, dinding sel, yang mengelilingi secara lengkap sitoplasma
membran sel. Pada bakteri Gram negatif, bagian luar dinding sel adalah lapisan lipid yang disebut membran luar. Tekanan internal adalah tiga sampai lima kali lebih besar pada besar pada bakteri positif dibandingkan dengan bakteri negatif. Perusakan terhadap dinding sel atau penghambatan pembentukkannya dapat menyebabkan lisis sel ini. Contoh obat antibiotik yang memiliki mekanisme ini adalah golongan penisilin.
2) Perubahan permeabilitas membran atau transpor aktif melalui membran sel. Membran sitoplasma mempertahankan bahan-bahan tertentu di dalam sel serta mengatur aliran keluar-masuknya bahan-bahan lain. Membran memelihara integritas komponen-komponen selular. Kerusakan pada membran inti akan menyebabkan terhambatnya pertumbuhan sel atau matinya sel.
3) Perubahan molekul protein dan asam nukleat
Suatu kondisi atau subtansi yang mengubah keadaan alamiah molekul-molekul protein dan asam nukleat dapat merusak sel tanpa dapat diperbaiki kembali. Suhu tinggi dan konsentrasi pekat beberapa zat kimia dapat mengakibatkan koagulasi ireversibel komponen-komponen yang vital ini.
4) Penghambatan kerja enzim
Banyak zat kimia telah diketahui dapat mengganggu reaksi biokimiawi. Penghambatan ini dapat mengakibatkan terganggunya metabolisme atau matinya sel.
DNA, RNA dan protein memegang peranan amat penting di dalam proses kehidupan normal sel. Hal itu berarti bahwa gangguan apapun yang terjadi pada pembentukan atau pada fungsi zat-zat tersebut dapat mengakibatkan kerusakan total sel. Contoh obat yang menghambat sintesis protein adalah golongan aminoglikosida dan tertrasiklin. Sedangkan yang menghambat sintesis asam nukleat ialah rifampisin.
(Jawetz, 1996; Pelczar & Chan, 1986).
7. Uji Aktivitas Antimikroba
Uji aktivitas antimikroba dilakukan dengan cara mengukur respons pertumbuhan populasi mikroorganisme terhadap agen antimikroba. Tujuan assay antimikroba adalah untuk menentukan potensi dan kontrol kualitas selama proses produksi senyawa antimikroba di pabrik, untuk menentukan farmakokinetik obat pada hewan atau manusia, dan untuk mengontrol dan memonitor kemoterapi obat (Pratiwi, 2008). Penentuan aktivitas antimikroba dapat dilakukan dengan salah satu dari dua metode utama, yaitu metode dilusi atau metode difusi.
Metode difusi dilakukan dengan cara menempatkan cakram kertas saring berisi sejumlah tertentu obat pada permukaan medium padat yang sebelumnya telah diinokulasikan bakteri uji pada permukaannya. Setelah inkubasi, diameter zona hambatan sekitar cakram dipergunakan untuk mengukur kekuatan hambatan obat terhadap organisme uji. Metode ini dipengaruhi oleh beberapa faktor fisik dan kimia, selain faktor antara obat dan organisme (misalnya sifat medium dan kemampuan difusi, ukuran molekular dan stabilitas obat) (Jawetz dkk., 2001). Keuntungan metode ini antara lain adalah uji yang sederhana, tidak memerlukan
peralatan khusus, fleksibilitas pemilihan disc yang akan diuji, dan hasil uji mudah diintrepetasi ( Jorgensen & Ferraro, 2009).
8. KLT- Bioautografi
KLT-Bioautografi merupakan metode yang menggabungkan teknik kromatografi lapis tipis dengan respon dari mikroorganisme yang diuji berdasarkan aktivitas biologi suatu analit yang dapat berupa antibakteri, antikapang, atau antiprotozoa (Kusumaningtyas dkk., 2008).
a. Kromatografi Lapis Tipis
Kromatografi merupakan metode pemisahan senyawa kimia berdasarkan afinitas yang berbeda dari senyawa pada fase diam dan fase gerak. KLT adalah metode pemisahan senyawa kimia secara kimia – fisika berdasarkan perbedaan kecepatan migrasi atau rasio distribusi (Rf) dengan fase gerak cairan dan fase diam absorben padat. KLT umumnya dianggap metode kromatografi yang sederhana, cepat, dan murah untuk pemisahan, dan penilaian visual semi kuantitatif dari fitokomplek (Striegel & Hill, 1996).
Fase diam merupakan penjerap berukuran kecil dengan diameter partikel antara 10-30 µm. Penjerap yang paling sering digunakan adalah silica dan serbuk selulosa, sedangkan mekanisme sorpsi yang utama pada KLT adalah partisi dan adsorbs. Fase gerak yang dikenal sebagai pelarut pengembang akan bergerak sepanjang fase diam karena pengaruh kapiler pada pengembangan secara menaik (ascending), atau karena pengaruh gravitasi pada pengembangan secara menurun (descending) (Gandjar & Rohman, 2007).
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan angka Rf atau hRf. Harga Rf dirumuskan sebagai berikut:
Rf = Jarak antara titik penotolan ke pusat bercak
Jarak antara titik penotolan ke batas elusi
Angka Rf berjangka antara 0,00 dan 1,00 dan hanya dapat ditentukan dua desimal. Bilangan hRf adalah angka Rf dikalikan faktor 100 (h), menghasilkan nilai berjangka 0 sampai 100 (Stahl, 1985).
Bercak yang dihasilkan dari totolan sampel umumnya tidak berwarna dan untuk mengidentifikasinya dapat menggunakan cara fisika, kimia dan biologi. Cara fisika dilakukan dengan melihat bercak yang ada pada plat KLT dibawah sinar ultraviolet maupun dengan pencacahan radioaktif. Fluoresensi sinar ultraviolet terutama untuk senyawa yang dapat berfluoresensi, membuat bercak akan terlihat jelas (Gandjar & Rohman, 2007). Di bawah sinar UV 254 nm, indikator pada plat KLT akan memancarkan warna hijau dan pada UV 366 nm akan memancarkan warna ungu. Komponen yang menyerap cahaya pada 254 atau 366 nm akan tampak sebagai bercak gelap pada plat yang bercahaya (Gibbons, 2006).
Cara kimia dilakukan dengan mereaksikan pita dengan pereaksi yang cocok melalui penyemprotan sehingga pita terlihat jelas. Adapun contoh berbagai pereaksi semprot adalah sebagai berikut :
1. Anisaldehid-asam sulfat digunakan untuk mendeteksi adanya senyawa terpenoid, propilpropanoid, saponin, zat pahit, zat pedas, gula dan steroid (Spangenberg, 2008). Setelah disemprot dengan Anisaldehid, plat dipanaskan
pada suhu 1000C selama 5-10 menit, kemudian dievaluasi di bawah sinar tampak dan UV 366 nm (Wagner & Bladt, 1996). Senyawa turunan terpenoid akan menunjukkan warna ungu, hijau kecoklatan, jingga tergantung dari senyawanya (Stahl, 1985). Senyawa fenol, terpenoid, gula dan steroid akan menunjukkan warna ungu, biru, kelabu tergantung jenis senyawanya (Harborne, 1973).
2. Liebermann Burchard (LB) digunakan untuk mendeteksi sterol dan terpenoid. Pengamatan dilakukan di bawah sinar UV 366 nm akan menunjukkan bercak yang berpendar (Spangenberg, 2008). Warna biru, hijau, pink, cokelat dan kekuning-kuningan di bawah sinar tampak dan juga di bawah UV mengindikasikan adanya senyawa triterpenoid dan steroid (Oleszek, 2008). 3. Besi (III) klorida (FeCl3) untuk mendeteksi adanya senyawa fenol, flavonoid,
tanin, asam hidroksimat, zat pahit dan hiperisin. Warna yang ditimbulkan adalah merah untuk senyawa golongan fenolik (Spangenberg, 2008). Suatu senyawa fenolik apabila disemprot dengan FeCl3 akan memberikan warna hijau, merah ungu, biru, kelabu atau hitam (Harborne, 1987)
4. Dinitrofenilhidrazin (2,4-DNPH), untuk mendeteksi adanya senyawa dengan ikatan rangkap karbonil seperti gugus aldehid dan keton. Warna yang timbul adalah kuning-merah setelah dipanaskan 1000C selama 5-10 menit (Spangenberg, 2008);
5. Dragendorff, untuk mendeteksi senyawa alkaloid dan senyawa yang mengandung komponen nitrogen. Warna yang ditimbulkan adalah oranye
coklat dengan latar belakang kuning untuk senyawa alkaloid (Spangenberg, 2008).
6. Sitroborat, komponen utamanya adalah H3BO3 yang dapat membentuk kompleks khelat dengan gugus orto dihidroksi dan orto hidroksi karbonil seperti pada senyawa kumarin, flavonoid dan kuinon (benzokuinon, naftokuinon, dan antrakuinon). Hasil positif ditandai dengan terbentuknya flouresensi bercak di bawah sinar UV 366 nm (Pramono, 1989). Menurut Markham (1988), warna bercak kuning di bawah sinar UV 366 kemungkinan mempunyai struktur dasar flavonol yang mengandung gugus 3-OH bebas dengan atau tanpa 5-OH bebas serta mengandung gugus ortodihidroksi.
b. Bioautografi
Metode bioautografi bersifat efisien untuk mendeteksi adanya senyawa antimikroba karena letak bercak dapat ditentukan walaupun berada dalam campuran yang kompleks (Pratiwi, 2008). Bioautografi termasuk metode skrining mikrobiologi yang umumnya digunakan untuk deteksi aktivitas antimikroba. Permukaan silika plat KLT yang ditutupi medium menjadi sumber nutrisi dan dapat ditumbuhi mikroba. Namun, bercak yang memiliki aktivitas antimikroba akan membentuk zona hambat pertumbuhan mikroba (Choma, 2010).
Menurut Djide dkk. (2005), bioautografi dapat dilakukan dengan 3 cara, yaitu : 1. Bioautografi langsung
Suspensi mikroba uji dalam medium cair disemprotkan pada permukaan KLT yang telah dihilangkan sisa eluen yang menempel pada
lempeng kromatogram. Setelah itu dilakukan inkubasi pada suhu dan waktu tertentu. Letak senyawa aktif tampak sebagai area jernih dengan latar belakang keruh.
2. Bioautografi pencelupan
Prinsip dari metode ini adalah penuangan medium agar yang telah diinokulasikan dengan suspensi bakteri diatas lempeng KLT yang telah dielusi, media ditunggu hingga padat, kemudian diinkubasi pada suhu dan waktu tertentu. Area hambatan dilihat dengan penyemprotan menggunakan tetrazolium klorida. Senyawa yang aktif sebagai antimikroba akan tampak sebagai area jernih dengan latar belakang ungu.
3. Bioautografi kontak
Metode ini dilakukan dengan cara menyentuhkan plat KLT pada permukaan media agar yang telah diinokulasikan suspensi bakteri. Metode ini didasarkan atas difusi dari senyawa yang telah dipisahkan dengan KLT. Senyawa yang memiliki aktivitas antimikroba akan menghambat pertumbuhan bakteri setelah diinkubasi pada suhu dan waktu tertentu.
9. Mikroba Uji
1. Staphylococcus aureus
S. aureus merupakan bakteri golongan Gram positif yang
berukuran 0.5-1.5 µm. Bentuk Staphylococcus terbagi dalam dua bidang tegak lurus dimana sel anakan baru akan tetap terikat dalam kelompok mirip anggur irreguler. Berbeda dengan Streptococcus yang terbagi dalam satu bidang dan biasanya berbentuk rantai. Staphylococci tidak dapat bergerak,
tidak membentuk spora dan tumbuh tanpa kapsul. S. aureus adalah bakteri komensalisme fisiologis yang ada di kulit manusia, permukaan mukosa dan hidung. S. aureus selalu ditemukan berasosiasi dengan manusia dan menjadi potensi patogenik terbesar. S. aureus merupakan penyebab utama infeksi nosokomial dan infeksi yang ada di masyarakat (Schneewind & Missiakas, 2008).
Menurut Todar (2012a), bakteri S. aureus dapat diklasifikasikan sebagai berikut : Kingdom : Bacteria Filum : Firmicutes Kelas : Bacilli Ordo : Bacillales Famili : Staphylococcaceae Genus : Staphylococcus
Spesies : Staphylococcus aureus
2. Escherichia Coli
E. coli memiliki bentuk bulat, cembung, dan berkoloni halus
dengan tepi yang berbeda-beda. E. coli merupakan anggota bakteri Gram negatif yang dapat bergerak dengan bantuan flagella peritrik atau tidak bergerak. Bakteri ini tumbuh di pepton atau pada media ekstrak daging tanpa penambahan natrium klorida atau suplemen lainnya. E. coli adalah penyebab utama infeksi saluran kencing (Brooks dkk., 2013).
Menurut Todar (2012b), bakteri E. coli dapat diklasifikasikan sebagai berikut :
Kingdom : Bacteria Filum : Proteobacteria
Kelas : Gamma Proteobacteria Ordo : Enterobacteriales Famili : Enterobacteriaceae Genus : Escherichia
Spesies : Escherichia coli
3. Candida albicans
C. albicans merupakan suatu fungi lonjong yang berkembang biak dengan bertunas yang menghasilkan psedomiselium baik dalam biakan maupun dalam jaringan dan eksudat. Candida adalah flora normal selaput lendir saluran pernafasan, saluran pencernaan, dan genitalia wanita. Pada tempat-tempat tersebut fungi ini dapat menjadi dominasi dan dihubungkan dengan keadaan patogen. Kadang-kadang fungi ini menyebabkan penyakit sistemik progresif pada penderita yang lemah atau kekebalan rendah.
Candida dapat menimbulkan invasi dalam aliran darah, tromboflebiti,
endokarditid, atau infeksi pada mata dan organ-organ lain (Jawetz dkk., 1995). Miselia sejati dan chlamydospora mungkin ada (Pelczar & Chan, 2005). C. albicans menghasilkan sekelompok spora reproduktif aseksual
yang disebut blastospora dan spora pertahanan hidup yang berdinding tebal yang disebut clamydospora (Subandi, 2010).
C. albicans dapat tumbuh secara optimum pada pH 4, tetapi juga dapat tumbuh pada pH antara 3-7. Penyakit yang disebabkan oleh Candida
sp dikenal dengan kandidiasis. Kandidiasis adalah suatu penyakit fungi yang
bersifat akut dan sub akut yang disebabkan oleh spesies Candida sp, biasanya oleh C. albicans dan dapat mengenai kulit mulut, vagina, kuku, kulit, bronki atau paru-paru. Penyakit ini ditemukan diseluruh dunia dan dapat menyerang semua umur baik laki-laki maupun perempuan (Belin, 2010).
Dalam proses kultur fungi C. albicans ini membutuhkan waktu hingga 72 jam masa inkubasi dalam suhu 250-300C agar fungi C. albicans dapat tumbuh dengan baik. Untuk kultur fungi jenis C. albicans ini menggunakan media SDA (Getas, 2014).
Menurut Jones dkk. (2004) bakteri C. albicans dapat diklasifikasikan sebagai berikut :
Kingdom : Fungi Filum : Ascomycota Kelas : Saccharomycetes Ordo : Saccharomycetales Famili : Saccharomycetaceae Genus : Candida
F. Keterangan Empiris
Dari penelitian ini ingin diketahui aktivitas antimikroba dari fungi kode Sal 6 asosiasi spons Stylissa flabelliformis yang diambil dari Taman Nasional Menjangan Bali Barat terhadap bakteri Escherichia coli ATCC 25922,
Staphylococcus aureus ATCC 25923 dan Candida albicans ATCC 10231. Selain
itu, ingin diketahui pula waktu panen metabolit aktif yang optimal beserta golongan senyawa aktif antimikroba.