BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan selama kurang lebih 6 bulan yang dimulai dari bulan September sampai Desember 2006. Pengamatan dan pengambilan sampel spons dilakukan di sekitar perairan terumbu karang Pulau Pari, yaitu pada bagian Barat (1060 35’ 712” BT dan 050 52’ 055” LS) dan Selatan (1060 36’ 761” BT dan 050 52’ 244” LS) Pulau Pari, Kepulauan Seribu, DKI Jakarta. Sementara sampel spons hasil transplantasi diambil dari kegiatan transplantasi spons Hibah Pasca di perairan yang sama (bagian Barat Pulau Pari).
Selama pengamatan, juga dilakukan pengukuran beberapa parameter lingkungan, yaitu suhu, salinitas, pasang surut dan parameter kualitas air lingkungan.
Sampel spons yang diambil, selanjutnya dianalisis di Laboratorium Mikrobiologi, Pusat Penelitian Lingkungan Hidup (PPLH)-IPB.
Bahan dan Alat
Ekstraksi, Fraksinasi dan Uji Bioaktivitas (Skrining Senyawa Bioaktif)
Ektraksi adalah suatu teknik untuk memisahkan dan mengisolasi suatu senyawa dari suatu larutan campuran atau padatan. Ekstraksi padatan dilakukan untuk mengambil produk natural dari jaringan makhluk hidup, dengan perendaman jaringan pada suatu pelarut yang memiliki kesamaan tingkat polaritas dengan senyawa yang diinginkan. Alat dan bahan yang digunakan untuk ekstraksi adalah jaringan spons Aaptos aaptos dan Petrosia sp. yang dipreservasi dalam metanol teknis, pelarut MeOH (metanol) p.a (Richelle-Maurer & Braekman 2001; Kelly et al. 2003), erlenmeyer, tabung Buchner, vaccum
pump, rotary evaporator, alat freeze drying, kertas saring Whattman 9 mm
ukuran 40, dan tabung sampel.
Fraksinasi adalah suatu teknik untuk memisahkan komponen organik dan ionik (larut dalam air) dalam suatu senyawa campuran menjadi dua fraksi berbeda. Metode ini dapat dilakukan dengan mencampur dua jenis pelarut yang berbeda, dengan komponen senyawa yang ingin dipisahkan. Alat dan bahan yang digunakan adalah hasil ekstrak kasar sampel spons Aaptos aaptos dan
Petrosia sp. yang telah dikristalisasi, pelarut EtOAc (etil asetat), pelarut air,
Uji bioaktivitas dilakukan untuk melihat potensi ekstrak kasar senyawa organik sampel spons Aaptos aaptos dan Petrosia sp. dari lingkungan yang berbeda. Alat dan bahan yang digunakan adalah: senyawa organik hasil ekstrak kasar spons Aaptos aaptos dan Petrosia sp., dengan konsentrasi 25 mg/ml MeOH (Richelle-Maurer & Braekman 2001); bakteri target (Staphylococcus aureus, Aeromonas sp., dan Escherichia coli) dan antibiotik pembanding Amphisilin trihidrat untuk uji anti bakteria senyawa, Artemia
salina (untuk uji toksisitas), cawan petri, pipet mikro, pipet tetes, kertas
cakram (diameter 6 mm), media Tryptic Soy Broth (TSB) dan Tryptic Soy Agar (TSA), DMSO (dimetil sulfooksida), jarum ose, shaker, inkubator, batang sebar, air laut.
Isolasi Senyawa Bioaktif
Isolasi senyawa bioaktif dilakukan terlebih dahulu dengan mengekstrak sampel spons menggunakan metanol. Senyawa bioaktif yang didapatkan lalu di fraksinasi menggunakan metanol (MeOH) dan etil asetat (EtOAc). Analisa kandungan senyawa bioaktif dilakukan menggunakan DCM (diklorometana) dan MeOH (10:1, v/v) pada gel silika kromatografi lapis tipis (TLC) 25 TLC
Aluminium Sheets Silica Gel 60F254 Merck, yang lalu diikuti oleh deteksi spektrofotometri pada gelombang 254 dan 365 nm (Zheng et al. 2005).
Uji bioaktivitas senyawa bioaktif (bioautografi) menggunakan bioindikator bakteri uji A hydrophilla, media TSA (triptic Soy Agar Difco). Gel silica TLC yang sudah mengandung senyawa terpisah kemudian diuji dengan melapisi media yang mengandung bakteri, untuk melihat aktivitas antimikrob senyawa hasil fraksinasi.
Metode Kerja
Konsentrasi dan Bioaktivitas Antibakteri Ekstrak Kasar dan Fraksi
Pengambilan Sampel. Semua sampel yang akan digunakan dalam
analisis pada penelitian ini diambil dari dua lokasi, yaitu bagian Barat (1060 35’ 712” BT dan 050 52’ 055” LS) dan Selatan (1060 36’ 761” BT dan 050 52’ 244” LS) P.Pari. Pengambilan sampel dilakukan pada kedalaman 7 m dengan menggunakan peralatan SCUBA DIVING SET. Sementara sampel hasil transplantasi diambil dari rak transplantasi di bagian Barat P. Pari, juga pada kedalaman yang sama (7 m). Transplantasi dilakukan dengan mengikat fragmen spons (ukuran 3 x 3 x 3cm) pada rak. Sampel spons transplantasi
yang telah berusia 3 bulan, kemudian diambil untuk dianalisis. Beberapa individu spons diambil pada setiap habitat di kedua lokasi (untuk sampel alam) dan pada rak transplantasi untuk diekstraksi, yang ekstraksinya terpisah setiap sampel, untuk kemudian dilakukan penapisan senyawa bioaktif ekstrak kasarnya. Sampel untuk setiap habitat diperlakukan sebanyak tiga kali ulangan. Sampel masing-masing spons dengan bobot yang memadai juga diambil untuk analisis fraksinasi. Setelah preparasi dengan menyemprotkan metanol (MeOH) teknis, sampel-sampel tersebut disimpan pada suhu -20°C. Selain itu, masing-masing spons juga diambil dalam jumlah kecil dalam keadaan segar dan preparasi formalin 4%, dengan tujuan mengisolasi bakteri simbion dan analisa biomassa sel spons.
Ekstraksi. Ekstraksi dilakukan dengan metode maserasi menurut petunjuk
Richelle-Maurer dan Braekman (2001) dan Kelly et al. (2003). Metode tersebut adalah sebagai berikut: spons laut ditimbang sebanyak 25 gr, setelah ditimbang, dipotong kecil-kecil, lalu dipindahkan ke dalam beaker glass 100 ml dan ditambahkan 25 ml metanol p.a., kemudian diaduk-aduk hingga metanol meresap ke dalam sampel. Beaker glass ditutup plastik dan disimpan selama 24 jam dalam suhu kamar. Kegiatan ini dilakukan sebanyak dua kali, sehingga volume pelarut mencapai 50 ml. Setelah 24 jam, suspensi pekat disaring dengan kertas saring untuk memisahkan cairan dengan endapannya. Cairan ditampung di dalam labu takar 50 ml (ekstrak). Setelah dilakukan pengeringan ekstrak larutan menggunakan evaporator rotavapor, lalu dilanjutkan dengan kristalisasi menggunakan metode freeze drying, ekstrak kasar dipindahkan ke dalam botol-botol kecil dan ditutup rapat, kemudian ditimbang untuk mengetahui konsentrasinya. Ekstrak disimpan di dalam lemari pendingin untuk dilakukan pengujian bioaktivitasnya.
Fraksinasi. Fraksinasi didasarkan pada prosedur fraksinasi menurut
Parenrengi (1999). Prosedur fraksinasinya adalah sbb: (1) ekstraksi dengan metanol (500 g spons segar dihaluskan dengan blender dan diekstraksi secara maserasi dengan menggunakan pelarut metanol 500 ml selama 3 x 24 jam, kemudian ekstrak kasar yang dihasilkan dihilangkan kadar airnya dengan menggunakan vaccum rotary evaporator; (2) ekstraksi dengan etil asetat (ekstrak senyawa dalam 500 ml fraksi air dengan pH yang sama dengan larutan EtOAc
secara pelan-pelan, kemudian diekstraksi menggunakan pelarut etil asetat sehingga didapatkan dua fraksi, yakni larutan organik dan lapisan air).
Metode ini dilakukan dalam sebuah tabung separasi. Pelarut organik (EtOAc) dan air dicampur sedemikan rupa dengan komponen campuran yang ingin dipisahkan, lalu didiamkan beberapa waktu sampai membentuk dua lapisan larutan fraksi yang berbeda. Kemudian lapisan paling bawah, yaitu fraksi air (karena pelarut organik yang digunakan memiliki berat jenis yang lebih rendah daripada air), dikeluarkan dari tabung, dan dipisahkan dari fraksi organik. Jenis komponen organik dan ionik akan terpisah pada masing-masing fraksi.
Isolasi Bakteri simbion Spons. Sampel spons hidup dicuci dengan air
laut steril untuk membuang bakteri non-simbion. Kemudian sekitar 0,5 g sampel dikocok dengan air laut steril dan diinokulasi ke media padat (Sea Water
Complete agar + air laut steril). Setelah inkubasi selama ± 10 hari pada suhu
250C (Zheng et al. 2005), semua koloni dengan pigmentasi dan morfologi yang berbeda, dipisahkan dan dibuat isolat murninya.
Uji bioaktivitas senyawa. Uji bioaktivitas terhadap senyawa hasil isolasi
dilakukan dengan metode difusi agar menggunakan media TSA. Organisme target (bakteri patogen) dikulturkan pada media tersebut dalam masing-masing petri. Media yang telah disebar organisme target didiamkan selama 1 jam dalam suhu kamar (280C). Kemudian ditengah-tengah media diletakan "paper disc" dan diteteskan senyawa ekstrak kasar spons, yang telah dilarutkan sebanyak 25 mg/ml MeOH p.a (Richelle-Maurer & Braekman 2001), kurang lebih 20 µl (0,04mg). Media yang telah diinokulasi dan ditotol dengan kertas cakram diinkubasi pada 4 jam pada suhu 100C, untuk optimalisasi proses difusi, kemudian diinkubasi selama 18 jam kemudian dihitung diameter hambatnya terhadap organisme target. Sementara kista Artemia salina, dikultur pada air laut steril selama 24 jam dengan suhu 280C dalam erlenmeyer, lalu diteteskan ekstrak senyawa yang telah dilarutkan sebanyak 5 mg/ 20 µl DMSO (Effendi 2004), pada tabung reaksi yang berisi 2 ml air laut dan 10 individu Artemia salina untuk melihat tingkat toksisitas senyawa (Richelle-Maurer & Braekman 2001).
Isolasi/identifikasi senyawa bioaktif sampel hasil fraksinasi
Isolasi dan identifikasi senyawa bioaktif sampel dilakukan dengan melakukan kromatografi lapis tipis (Thin Layer Chromatography/TLC)
terhadap senyawa organik dan semi organik dari hasil fraksinasi ekstrak kasar spons Aaptos aaptos dan Petrosia sp. TLC dilakukan pada plat 25 TLC
Aluminium sheets Silica Gel 60F254 produksi Merck. Sampel senyawa
organik diteteskan pada plat yang telah diberi tanda sebagai titik awal. Kemudian plat direndam dalam eluen DCM:MeOH (10:1,v/v, yang telah dioptimasi selama 2 jam) selama beberapa saat pada kotak kromatografi (chamber). Setelah senyawa bergerak sampai garis batas, plat dikeluarkan dan dikeringkan. Komponen senyawa organik yang terpisah akan berbentuk spot-spot di sepanjang plat, kemudian dilihat dan ditandai di bawah sinar uv dengan panjang gelombang 256 dan 365 nm (Zheng et al. 2005).
Analisa Aktivitas Antimikrob Senyawa Hasil Fraksinasi (Bioautografi)
Bahan yang digunakan adalah lapisan gel silica TLC yang mengandung senyawa yang sudah difraksinasi. Lapisan gel tersebut disterilisasi menggunakan sinar uv selama 30 menit, lalu diletakkan di atas agar nurien pada cawan petri. Kemudian lapisan tersebut di lapisi oleh media agar nutrien cair yang mengandung bakteri bioindikator A.hydrophylla dengan metode agar tuang, kemudian diinkubasi pada suhu ruang selama 24 jam. Setelah masa inkubasi, zona bening yang terbentuk diamati, untuk melihat spot komponen senyawa organik yang dapat menghambat pertumbuhan bakteri (Zheng et al.2005).
Observasi Biomassa Sel Spons
Preparat histologi sampel spons yang telah dipreparasi dalam formalin 4% dilakukan untuk melihat susunan struktur jaringan spons. Selain itu, sampel spons dipreparasi dalam formalin 3,5 - 4 % yang diencerkan dengan air laut yang telah disaring dengan filter 0,2µm. Sampel spons kemudian dihancurkan dengan menggunakan blender, kemudian suspensi sel diamati dibawah mikroskop fase kontras untuk melihat tipe sel dan menghitung jumlah sel dengan memakai haemasitometer.
Suspensi sel disentrifugasi untuk memisahkan biomassa sel spons dengan bakteri simbion, serta fraksi bakteri, dengan dua kali proses sentrifugasi.(1) Sentrifugasi pertama pada 1000 g selama 5 menit, untuk mendapatkan supernatannya, (2) kemudian sentrifugasi pada 4000 g selama 10 menit untuk mendapatkan pellet bakteri. Setelah masing hasil sentrifugasi disimpan dalam air laut buatan yang dingin (cold artificial sea water) pengamatan jenis dan jumlah sel bakteri dilakukan dibawah mikroskop (Richelle-Maurer & Braekman 2001).
Analisa Data
Analisa data pada penelitian ini sesuai dengan tahapan-tahapan yang dilakukan, yaitu:
a. Penapisan senyawa bioaktif dianalisa dengan melihat besar zona bening (zona hambat) terhadap bakteri indikator dan toksisitas terhadap Artemia
salina.
b. Kekuatan aktivitas (tingkat bioaktivitas) senyawa ekstrak berdasarkan lingkungan hidup spons dianalisa secara deskriptif (kualitatif).
c. Hubungan bioaktivitas antibakteri dan toksisitas senyawa ekstrak spons dianalisa dengan analisa korelatif, menggunakan program Minitab 1.3. d. Analisa kandungan senyawa hasil fraksinasi, serta kaitan bakteri simbion
dan biomassa sel spons dengan bioaktivitas spons dilakukan secara deskriptif (kualitatif)
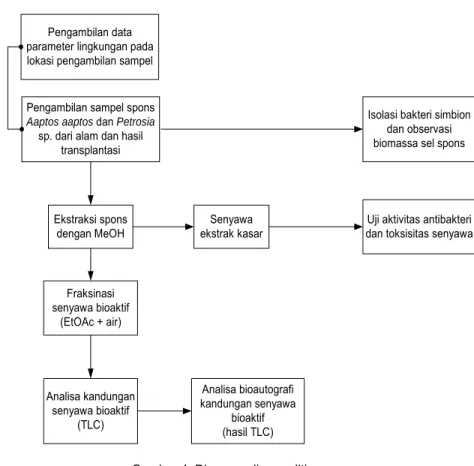
DIAGRAM ALIR PENELITIAN
Pengambilan sampel spons Aaptos aaptos dan Petrosia sp. dari alam dan hasil
transplantasi Ekstraksi spons dengan MeOH Senyawa ekstrak kasar Fraksinasi senyawa bioaktif (EtOAc + air) Analisa kandungan senyawa bioaktif (TLC)
Uji aktivitas antibakteri dan toksisitas senyawa
Analisa bioautografi kandungan senyawa
bioaktif (hasil TLC)
Isolasi bakteri simbion dan observasi biomassa sel spons Pengambilan data
parameter lingkungan pada lokasi pengambilan sampel
Gambar 4 Diagram alir penelitian