BAB II
LANDASAN TEORI
2.1. Tinjauan Pustaka 2.1.1. Sepsis
Sepsis atau suatu kondisi yang mirip telah diketahui sejak jaman dahulu. Hippocrates menganggap sepsis sebagai proses pembusukan dari daging atau proses yang menyebabkan rawa berbau busuk. “Germ theory” atau teori kuman pada abad ke 19 mengungkapkan bahwa beberapa penyakit diakibatkan oleh adanya infeksi mikroorganisme, hal ini mendorong beberapa ahli seperti Louis Pasteur dan Semmelwise, untuk menyatakan bahwa sepsis adalah keracunan darah (blood poisoning) akibat infeksi mikroorganisme (Angus DC dan van der Poll T, 2013). Namun, dengan penemuan antibiotik, teori tersebut menjadi tidak tepat dikarenakan sepsis masih dapat terjadi walaupun eradikasi bakteri telah berhasil dilakukan. Hal tersebutlah yang mendorong para ahli untuk menganggap bahwa sepsis diakibatkan terutama oleh peran tuan rumah, atau pasien di mana sepsis terjadi akibat suatu proses hiper-inflamasi yang dipicu oleh infeksi. Akan tetapi, pengobatan sepsis menggunakan obat-obatan antiinflamasi telah gagal menunjukkan perbaikan yang signifikan, bahkan prevalensi sepsis semakin meningkat.
Sepsis didefinisikan sebagai suatu kondisi tubuh yang mengancam nyawa akibat respon tubuh terhadap infeksi melukai jaringan sendiri dan organ-organ tubuh. Dari perspektif yang lebih klinis, baru-baru ini diusulkan untuk menyertakan bukti disfungsi organ dalam kriteria untuk sepsis-yaitu, seps
is harus didefinisikan sebagai respon sistemik terhadap suatu infeksi dengan adanya disfungsi organ (Vincent JL et.al., 2013).
“Surviving Sepsis Campaign” mendifinisikan sepsis sebagai adanya suatu kondisi infeksi (kemungkinan atau terbukti) bersama dengan manifestasi sistemik dari infeksi, dan sepsis berat didefinisikan sebagai sepsis ditambah gangguan organ akibat sepsis atau hipoperfusi jaringan (Dellinger RP et.al., 2012).
Sepsis ditegakkan menggunakan kriteria-kriteria klinis dan laboratorium yang menggambarkan adanya suatu proses inflamasi atau yang disebut sebagai Systemic Inflammatory Response Syndrome dengan adanya suatu infeksi baik yang dapat dibuktikan maupun diduga. Dalam perkembangannya, kriteria sepsis telah ditambah dengan kriteria-kriteria yang lebih spesifik namun masih cukup sensitif untuk menghindari adanya keterlambatan diagnosa.
Tabel 1. Kriteria diagnosis sepsis (SSC, 2012)
Dengan perkembangan ilmu kedokteran yang progresif, sepsis masih merupakan suatu masalah medis yang serius, mengenai seluruh dunia tanpa melihat umur, jenis kelamin ataupun strata sosial. Prevalensi sepsis juga semakin meningkat dari tahun ke tahun. Hal ini membuat konsep patogenesis sepsis yang saat ini diterima, kembali dipertanyakan.
Beberapa penelitian Clinical Trial menggunakan obat-obatan anti inflamasi seperti anti-TNFα, walaupun menunjukkan hasil yang cukup baik, namun efek manfaatnya tidak sebesar yang diperkirakan dan tidak terlalu signifikan (Opal SM, 2003). Pengobatan dengan steroid juga
menunjukkan hasil yang kurang baik, bahkan pada pemberian steroid dosis tinggi menunjukkan outcome yang lebih buruk dibandingkan tanpa penggunaan steroid. Yang menunjukkan hasil yang relatif baik (namun masih kontroversial) adalah penggunaan steroid dosis rendah, itupun terbatas pada kasus-kasus sepsis berat (ref). Steroid dosis ini mempunyai efek imunomodulasi dan bukan efek imunosupresi. Steroid dosis rendah juga menjadi suplementasi pada gangguan kadar kortisol yang jamak terjadi pada sepsis berat (Lefering R dan Neugebauer EA, 2005).
Penemuan-penemuan terbaru juga menunjukkan bahwa proses pro-inflamasi dan proses anti-inflamasi terjadi pada saat bersamaan. Hal ini bertentangan dengan konsep yang dipercaya bahwa proses anti-inflamasi akan datang setelah proses inflamasi. Paradigma yang dipercayai saat ini adalah proses inflamasi yang berlebihan akan menyebabkan SIRS dan apabila proses pro-inflamasi menjadi tidak terkendali, akan merusak jaringan. Sebaliknya, apabila respon anti-inflamasi yang lebih dominan, maka akan terjadi Compensatory Anti-inflamatory Response Syndrome (CARS). Kedua proses akan mengakibatkan outcome penyakit yang buruk. Kondisi yang ideal adalah terjadinya keseimbangan antara pro-inflamasi dan anti-inflamasi yang disebut sebagai Mixed Antagonist Response Syndrome. Teori patogensis tersebut menempatkan respon pro-inflamasi dan anti-inflamasi sebagai dua proses yang berjalan sendiri-sendiri atau berurutan (Guntur A, 2008; Guntur A, 2011).
Namun, akhir-akhir ini diketahui bahwa penghambatan dari kedua sitokin utama tersebut tidak memperbaiki kondisi klinis kebanyakan pasien. Hal ini menujukkan bahwa paradigma lama yang menyatakan bahwa inflamasi yang berlebihan sebagai patogenesis utama dari sepsis perlu untuk ditinjau ulang. Respon dari tuan rumah terhadap sepsis melibatkan banyak proses baik yang sifatnya berurutan maupun bersamaan yang berakibat pada inflamasi berlebihan dan penekanan daya tahan tubuh (Cavaillon JM dan Adib-Conquy M, 2002).
Pasien dengan sepsis yang mampu bertahan hidup setelah fase awal sepsis, menunjukkan ciri-ciri imunosupresi. Waktu tepatnya kapan terjadinya penekanan sistem kekebalan tubuh pada sepsis masih diperdebatkan. Menurut hipotesis yang telah diterima saat ini, SIRS akan diikuti oleh CARS di mana akan terjadi pengeluaran sitokin-sitokin anti-inflamasi. Namun beberapa penemuan terakhir, mengungkapkan bahwa pada pasien dalam kondisi sakit kritis, kedua proses ditemukan bersamaan. Hal ini menunjukkan bahwa kedua proses tersebut mungkin bukan merupakan dua proses terpisah dua proses yang terjadi berurutan (Cavaillon JM dan Adib-Conquy M, 2002; Kumpf O dan Schumann RR, 2010).
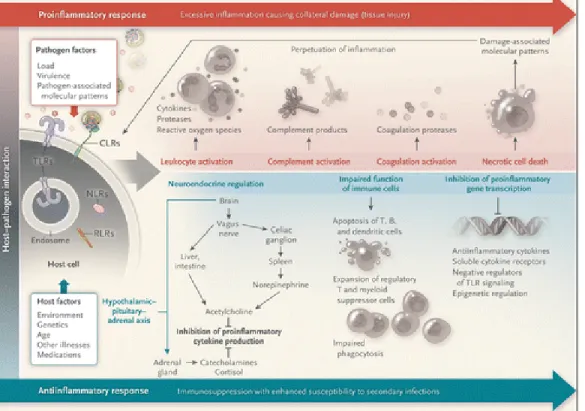
Gambar 1. Respon Host pada sepsis berat dikarakterisasai dengan respon pro- dan anti-inflamsi dan respon imunosupresi anti-inflamsi. Arah, tingakat keparahan, dan durasi dari reaksi ini ditentukanoleh faktor host dan faktor patogen. Respon inflamasi dihasilkan dari interaksi antar PAMP dan DAMp dengan TLR dan CLR di permukaan sel, TLR di endosome atau NLR dan RLR di sitoplasma. Inflamasi yang berlebihan akan menyebabkan kerusakan jaringan dan kematian sel, yang mana kan meningkatakan pengeluaran DAMP dan reaksi inflamasi (Angus DC, van der Poll T, 2013).
Saat ini patogenesis sepsis dipercaya merupakan berbagai proses yang bekerja sinergis, kadang berlawanan, melibatkan inflamasi berlebihan dan supresi sistem kekebalan tubuh yang mana akan menyebabkan ketidak seimbangan antara pro-inflamasi dan anti-inflamasi. Faktor virulensi dan beban kuman, tempat infeksi, genetika inang, dan penyakit penyerta diduga kuat juga turut berperan. Interaksi antar patogen dan sistem kekebalan tubuh dari inang selama infeksi proses akut diduga memainkan peranan penting pada perjalanan dan prognosis penyakit. Hal ini membuka peluang penelitian-penelitian baru untuk mengungkap lebih jauh misteri dari sepsis. Dengan ditemukannya jalur-jalur pathogenesis baru, diharapkan dapat menciptakan potensi-potensi terapi baru.
2.1.2. Nod-like Receptors (NLRs)
Mikroorganisme yang menginvasi sitosol dapat dikenali oleh PRR sitoplasmatik, seperti NLR dan RLR. NLR akhir-akhir ini menjadi suatu topik yang gencar diteliti dikarenakan kemampuannya dalam mengenali berbagai rangsangan PAMP dan DAMP.
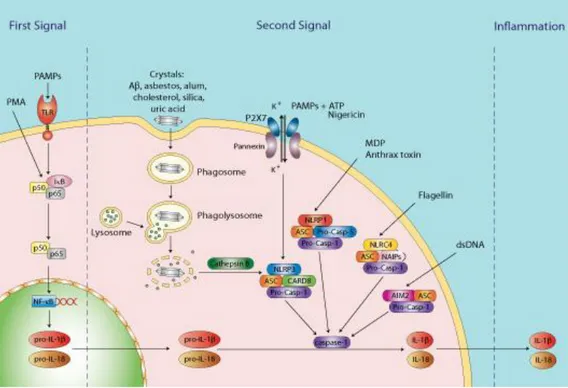
Setelah stimulasi, NLR akan membentuk suatu struktur yang disebut sebagai Inflammasome dengan bantuan protein adaptor yang bernama ASC (apoptosis-associated speck like-like protein containing a caspase activation and recruiting domain) yang kemudian menyusun suatu kompleks multimolekuler, melalui proses oligomerasi, yang disebut sebagai inflammasome. Inflammasome akan mengaktifkan pro Caspase-1 menjadi Caspase-1 yang bertugas mengaktivasi sitokin inflamasi pro IL-1β dan pro IL-18 menjadi bentuk aktif IL-1β dan IL-18 (Wen et.al., 2013; Bournefield F, dan Hornung V, 2013).
Sitokin pro-inflamasi IL-1β dan IL-18 diekspresikan sebagai pro IL-1β dan pro IL-18 oleh nucleus dari jalur aktivasi NF-κB akibat stimulasi Toll Like Receptor di membran sel.
Dalam bentuk pro, sitokin-siktokin tersebut tidak di Aktif dan tidak dapat keluar dari sel. Hanya setelah diaktivasi oleh protein Caspase-1, sitokin-sitokin tersebut menjadi aktif dan dapat dikeluarkan oleh sel yang kemudian memicu kaskade inflamasi.
Gambar 2. Ilustrasi yang menggambarkan aktivasi sistem NLR-Inflammasome oleh berbagai faktor stimuls yang akan mengaktifkan capase-1 dan memproses siltokin IL-1β dan IL-18 menjadi bentuk aktif (Bournefield F, Hornung V, 2013).
NLR berdasarkan letaknya yang berada di sitoplasma sel, bertugas untuk mengenali materi-materi PAMP atau DAMP yang masuk ke dalam sel. Ini termasuk DNA dan RNA virus, LPS yang berhasil masuk ke dalam sel, produksi sitokin pro-inflamasi endogen sel, komponen bakteri gram negatif yang masuk dalam sel via jalur sekretori bakteri tipe 3 dan tipe 4, dan sebagainya. PRR sitosilik ini dibagi menjadi dua golongan besar berdasarkan susunan N-terminalnya. Kelompok NLR terbesar mempunyai sebuah domain pyrin N-terminal (PYD) yang
disebut NLRP dan NLRC yang mengandung domain CARD. Dari kedua golongan besar tersebut, telah diidentifikasi beberapa NLR, akan tetapi yang sampai saat ini yang paling banyak dipelajari adalah NLRP-1, NLRP-3, NLRP-6, NLRP-12 dan NLRC-4 (Wen et.al., 2013; Bournefield F, dan Hornung V, 2013). Masing-masing NLR tersebut berbeda dalam hal jenis komponen DAMP dan PAMP yang dapat diidentifikasi dan jenis protein adaptornya. Akan tetapi semua NLR tersebut pada dasarnya akan mengaktifkan protein pro-Caspase 1 yang bertugas merubah bentuk inaktiv pro IL-1β dan pro IL-18 menjadi bentuk aktif IL-1β dan IL-18 yang dapat disekresikan keluar sel untuk mengamplifikasi reaksi inflamasi. NLR juga dapat menginduksi Pyroptosis di mana akan menyebabkan kematian sel dan terlepasnya berbagai mediator inflamasi (Wen et.al., 2013; Fink SL et.al., 2005; Cookson BT, 2005). Dari beberapa NLR tersebut di atas, yang paling banyak dipelajari adalah NLRP3 dikarenakan keunikannya karena dapat distimulasi oleh berbagai macam DAMP dan PAMP atau bahkan disregulasi dari lingkungan intrasel seperti influks calsium dan efluks kalium.
Baik DAMP seperti DNA rantai ganda maupun asam urat, dan PAMP seperti RNA virus atau peptidoglikan bakteri dapat mengaktifasi inflamosom. Ditambah lagi, inflamosom NLRP3 dapat terbentuk akibat dari berbagai macam stimulasi, seperti efluks kalium, ATP ekstraseluler, atau ROS.
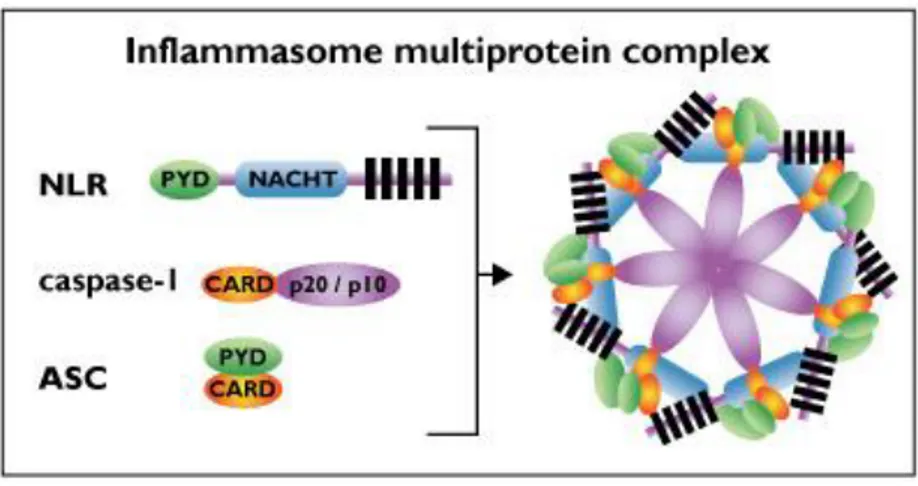
Gambar 3. Kompleks Inflammassome yang terdiri dari NLR dengan domain Pyrin yang bergambung degan protein adaptor ASC. Sebuah kompleks Inflammasome biasanya terdiri dari 7 buah NLR. (Bournefield F, Hornung V, 2013).
Inflammasome dapat secara langsung mengenali patogen atau teraktifasi akibat dari perubahan intraeluler yang diakibatkan oleh patogen atau PRR lain. Aktifasi Inflammasome saat sepsis dapat mengamplifikasi respon inflamasi. Peran inflammasome pada infeksi telah dibuktikan melalui beberapa penelitian.
Tikus yang defisien NLRP3 dan NLRC4 lebih rentan terhadap infeksi Samonella typhimurium, dan tikus yang tidak mempunyai NLRP3 atau ASC akan lebih mudah terinfeksi S. Pneumoniae (Fang R et.al., 2011; Bournefield F, dan Hornung V, 2013). Pada pasien dengan syok sepsis, mempunyai tingkat ekspresi inflamosom dari ASC, caspase-1 dan NLRP1/NALP1, yang rendah apabila dibandingkan dengan pasien sakit kritis kontrol, yang mana mungkin disebabkan oleh kondisi immunocompromised yang diderita oleh pasien-pasien sepsis tersebut. Dipihak lain, aktivasi inflammasome yang berujung pada aktifasi caspase-1 dan dikeluarkannya IL-1β, akan menyebabkan kerusakan organ selama sepsis (Broz P et al 2010).
Selain mengaktivasi IL-1β dan IL-18, inflammasome juga diketahui mempunyai peran dalam peningkatan produksi High Mobility Group Box-1 (HMGB1) yang merupakan sitokin inflamasi pada fase lambat sepsis. HMGB-1 biasanya dilepaskan oleh sel yang mengalami
kematian. Inflammasome yang mengaktivasi Caspase-1 juga turut berperan dalam kematian sel. Proses kematian sel yang diinduksi oleh inflammasome disebut Pyroptosis (Lamkanfi et.al., 2010; Lu B et.al., 2012)
Tidak seperti apoptosis, yang tidak mengeluarkan sitokin-sitokin inflamasi, Pyroptosis adalah proses kematian sel yang diaktivasi juga oleh Caspase-1 yang prosesnya tergantung atau melibatkan sitokin pro-inflamasi.
Pada Pyroptosis, ketika sel lisis, maka terlepas pula sitokin-sitokin pro-inflamasi dari dalam sel seperti IL-1β, IL-18, IL-6, TNF-α, dan HMGB-1. Sitokin-sitokin ini kemudian berperan menjadi DAMP yang kemudian akan mengkativasi sel-sel lain. Sampai saat ini, telah diketahui empat macam NLR telah diketahui dapat mengkativasi Caspase-1 yaitu; NLRP1/NALP1b, NLRC4/IPAF, NLRP3/NALP3, dan AIM2 (absent in melanoma 2) (Bournefield F, Hornung V, 2013).
2.1.3. NLR-Inflammasome yang berperan pada sepsis
NLR dan inflammasomes-nya mempunyai peran penting dalam innate immunity. Sistem tersebut mengenali dan merespon komponen-komponen DAMP dan PAMP.
Penelusuran lebih lanjut akan aktivasi dari sistem inflammasome akan memberi pengetahuan tambahan akan mekanisme sistem kekebalan tubuh dan patogenesis penyakit autoimun.
2.1.3.1. NLRP1 Inflammasome
NLRP1 membentuk kompleks inflammasome multimolekular dengan Caspase-1, Caspase-5, ASC, dan triphosphate ribonucleotida.
NLRP1 berikatan secara langsung dengan ASC melalui domain pyrin (PYD) dan berikatan dengan caspase-1 melalui domain CARD yang dimilikinya. Aktifitas NLRP1 inflammasome
diinduksi oleh Muramyl Dipeptide (MDP) dan Anthrax Lethal Toxin (mouse NLRP1b). Penelitian-penelitian in vitro telah mengungkap bahwa NOD2 diperlukan untuk pengenalan baik MDP dan anthrax lethal toxin.
Beberapa variasi gen NLRP1 telah dihubungkan dengan peningkatan resiko penyakit autoimun, vitiligo, dan kondisi autoimun yang akan berujung pada kelaian pigmentasi kulit. Akan tetapi, peran spesifik NLRP1 inflammasome pada respon imun tetap belum sepenuh nya diketahui (Broz P et.al., 2010; Bournefield F, dan Hornung V, 2013).
2.1.3.2. NLRC4 Inflammasome
NLRC4 (juga dikenal sebagai IPAF) adalah satu-satunya anggota dari keluarga NLRC yang diketahui yang membentuk inflammasome.
NLRC4 berhubungan dengan pro–caspase-1 melalui domain CARD tanpa memerlukan protein adaptor, dan interaksi dengan ASC diperlukan untuk sekresi IL-1β.
Oligomerasi dari NLRC4 dipicu oleh cytosolic flagellin dari berbagai macam jenis bakteri seperti Salmonella typhimurium, Legionella pneumophila, Shigella flexneri, dan Pseudomonas aeruginosa atau stimulus lain yang diperantarai oleh sistem sekrei bakteri tipe III atau tipe IV.
Flagellin adalah ligand yang dapat memicu baik TLR5 maupun NLRC4 inflammasome . Flagellin mampu secara mandiri memberi sinyal untuk produksi sitokin dan memfasilitasi pematangan sitokin lewat jalur caspase-1 (Fang R et.al., 2011; Bournefield F dan Hornung V, 2013).
2.1.3.3. NLRP3 Inflammasome
Diantara keluarga inflammasomes, NLRP3 inflammasome adalah yang paling banyak dipelajari dikarenakan kemampuan aktivasinya di makrofag dapat dipicu oleh berbagai macam
stimulus seperti; berbagai macam PAMP, seperti lipopolisakarida, peptidoglikan, dan asam nukleat bakteri, dengan catatan sel terpapar ATP. Tidak adanya ATP, makrofag yang distimulus oleh LPS akan memproduksi sejumlah besar pro-IL-1β, namun hanya melepaskan sitokin aktif pada medium. ATP dan beberapa toksin bakteri seperti nigericin dan maitotoxin, akan mengakibatkan perubahan pada komposisi ion intrasel yang akan menginduksi pembentukan NLRP3 inflammasome.
Kristal monosodium urate (MSU) dan calcium phosphate dihydrate (CPPD) diketahui mengaktivasi Caspase-1 melalui jalur NLRP3. Deposisi dari MSU dan kristal CPPD di persendian bertanggung-jawab atas kondisi peradangan pada gout dan pseudogout, yang mana melibatkan NLRP3. Asam urat juga dilepaskan ke ekstraseluler akibat nekrosis dari sel, yang mana mengindikasikan adanya peran dari NLRP3 pada deteksi DAMP endogenous. Kristal silica dan asbestos dapat mengaktifkan NLRP3 inflammasome, menunjukkan perannya pada patogenesis silicosis dan asbestosis.
Kristal garam Aluminium dapat mengaktivasi NLRP3 inflammasome, bila terdapat juga PAMP seperti LPS. Fagositosis dari kristal akan mengakibatkan pembengkakan dan perusakan lisosomal. Hal tersebut, bersamaan dengan pelepasan cathepsin B, sebuah protease lysosomal cysteine, akan berujung pada aktivasi NLRP3 inflammasome (Wen et.a.l, 2013; Bournefield F dan Hornung V, 2013).
2.1.3.4. AIM2 Inflammasome
AIM2 (absent in melanoma 2), adalh sebuh reseptor untuk DNA sitoplasmik, akan membentuk inflammasome dengan ligand-nya dan ASC yang kemudian mengktivasi caspase-1. AIM2 adalah sebuah anggota dari keluarga interferon-inducible HIN-200 yang mempunyai
sebuah domain amino-terminal pyrin dan sebuah domain carboxy-terminal oligonucleotide/ oligosaccharide-binding.
AIM2 mengenali double-stranded DNA sitoplasmik melalui domain oligonucleotide/ oligosaccharide-binding dan berinteraksi dengan ASC lewat domain pyrin miliknya untuk aktivasi caspase-1.
Interaksi antar AIM2 dengan ASC juga akan menyebabkan terbentuknya formasi ASC pyroptosome, yang akan menginduksi kematian sel melalui proses pyroptosis, pada sel yang mempunyai caspase-1 (Lamkanfi et.al., 2010).
Peran AIM2 penting dalam aktivasi inflammasome sebagai respon dari DNA sitoplasmik (Wen et.a.l, 2013; Bournefield F dan Hornung V, 2013).
2.2. Interleukin 1 Beta
IL-1β dan IL-18 adalah satu keluarga sitokin yang mempunyai efek pada berbagai proses biologis yang berperan pada infeksi, inflamasi, dan proses autoimun.
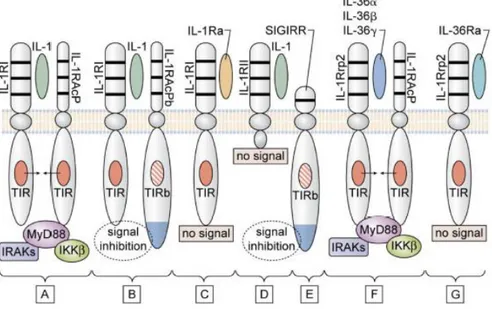
IL-1β berperan pada respon lokal maupun sistemik dengan memicu kenaikan suhu tubuh, aktivasi limfosit, dan memicu infiltrasi lekosit pada lokasi infeksi maupun cedera (Dinarello CA, 2011). TLR merupakan reseptor yang terletak pada permukaan sel yang mengenali sinyal-sinyal bahaya dan kemudian akan memulai kaskade inflamasi. TLR mempunyai bagian yang memanjang hingga ke dalam sitoplasma. Bagian sitoplasma TLR ini adalah domain fungsional yang terdiri dari TIR (Toll IL-1 Receptor). Hal tersebut membuat TLR-TLR yang mempunyai TIR dapat diaktivasi oleh keluarga IL-1, termasuk IL-1β. Hal ini membuat pelepasan IL-1β dari sel-sel sistem imun tetap yang teraktivasi dapat lebih lanjut merangsang aktivasi sel-sel imun yang lain.
Gambar 4. Toll-like receptors (TLR) dengan domain ekstra seluler dan ekor intraseluler yang terdiri dari domain Toll IL-1 Receptor (Dinarello, 2011) IL-18 menginduksi produksi IFN-γ dari sel T-helper 1 (Th1) dan membantu dalam polarisasi sel Th1 (Swain SL , 2001).
Maturasi dari IL-1β dan IL-18 oleh caspase-1 merupakan proses penting dari respon kekebalan tubuh. Caspase-1 sendiri diproduksi dalam bentuk inaktif sebagai 45 kDa zymogen (pro-caspase-1) yang akan mengalami proses autokatalitik setelah stimulus yang sesuai. Aktivasi Caspase-1 di dalam kompleks multiprotein inflammasome melalui interaksi NLR dengan ASC, sebuah adaptor yang menjembatani antar NLR dengan caspase-1.
Saat ini telah diketaui bahwa aktivasi dan pelepasan IL-1β memerlukan 2 macam sinyal/stimulus. Proses dan sifat dari stiumulus tersebut pada in-vivo belum sepenuhnya diketahui. Akan teapi, pada percobaan in vitro memperlihatkan bahwa sinyal pertama dapat dipicu oleh PAMP melalui jalur TLR yang kemudian akan memulai inti sel memproduksi pro-IL1β. Sinyal kedua adalah aktivasi dari inflammasome dan caspase-1 yang bertugas dalam proses aktivasi IL-1β (Wen et. Al., 2013; Bournefield F dan Hornung V, 2013).
Kebutuhan akan sinyal kedua untuk aktivasi dari maturasi IL-1β mungki diperlukan sebagai sistem pengaman untuk memastikan bahwa respon inflamasi yang poten hanya terjadi pada stimulus yang sesuai seperti infeksi patogen maupun cedera jaringan.
2.3. Aktivasi Caspase-1
Cysteine-dependent aspartate-directed proteases-1 (Caspase-1) atau yang sebelumnya disebut sebagai IL-1 converting enzyme diproduksi sebagai zymogen yang terbelah menjadi dua sub unit heterodimer, yaitu 20 kDa (p20) dan 10 kDa (p10) yang akan menjadi bagian dari enzyme aktif. Kedua heterodimer tersebut akan berinteraksi dengan ASC dan kemudian terlibat pada aktivasi proses inflamasi. Seperti namanya, maka tugas utama dari Caspase-1 adalah merubah pro IL-1β menjadi bentuk aktif IL-1β.
Caspase-1 juga memicu proses kematian sel yang disebut Pyroptosis di makrofag sebagai respon dari bakteri/komponen bakteri intraseluler.
Pada penelitian ini, pengukuran Caspase-1 dilakukan dengan cara Flow cytomery pada sel-sel netrofil darah tikus percobaan. Caspase-1 terutama terdapat pada sel imun seperti monosit, makrofag, dan sel dendrit yang kemudian akan memberi sinyal ke sel imun lain. Target organ IL-1β yang telah diteliti meliputi jantung, hati, ginjal, paru-paru dan sistem gastrointestinal (Palmer et.a.l, 1995; Falk R, et.a.l, 2005) .
2.4. Choloroquine
Chloroquine (CHQ) adalah sebuah obat anti-malaria yang populer hingga kurang lebih 2 dekade lalu sebelum terjadinya resistensi yang meluas terhadap obat tersebut. Popularitasnya terutama dikarenakan harganya murah, tersedia di mana saja, relatif minim efek samping, dan mempunyai onset kerja yang cepat. CHQ dapat dibeli over the counter terutama di negara-negara dunia ketiga di mana malaria endemis. Sekarang Chloroquine dikenal sebagai obat anti-inflamasi
yang digunakan sebagai DMARD untuk Rheumatoid Arthritis, Lupus Eritematosus Sistemik diskoid, dan bisa juga untuk amebiasis hati. CHQ menghambat pelepasan sitokin pro-inflamasi ke peredaran darah sehingga dapat digunakan sebagai terapi penyakit inflamasi kronik, namun karena kemampuan ini juga CHQ mempunyai potensi dalam terapi inflamasi akut yang disebabkan oleh infeksi (Cooper RG, 2008; Magwere T, 2008).
CHQ segera diserap oleh sistem gastrointestinal bila diberikan peroral. Bioavailabilitasnya mencapai 75-80%. Konsentrasi maksimum CHQ dicapai dalam waktu 1-2 jam dan bertahan di puncak hingga 3,6 jam. Volume distribusi CHQ sangat luas (160-800 mg/kg).
Waktu paruhnya sangat panjang, mencapai 2-3 hari pada tikus dan 3-6 hari pada manusia. 70% CHQ disekresikan tanpa perubahan lewat urine, dan masih dapat dideteksi hingga 120 jam pada manusia setelah pemberian dosis tunggal 300 mg (Moore BR, 2011).
Chloroquine mempunyai efek lisosomotropik, yaitu CHQ dapat mempengaruhi lisosom dari sel. Efek ini yang dianggap berperan pada efek anti-inflamasi dari CHQ. Obat ini telah diketahui dapat menurukan produksi dari sitokin pro-inflamasi seperti IFN-g, TNF-a, dan IL-6, IL-1 a dan IL-1b di sel-sel monosit dan mikroglia. Namun CHQ juga dapat meningkatkan produksi sitokin-sitokin inflamasi tersebut pada sel astroglia manusia (Cooper RG, 2008; Magwere T, 2008). Hal ini menunjukkan bahwa efek CHQ bervariasi antar jenis sel dan mempunyai efek imunomodulator. Namun penelitian lain yang menggunakan kultur sel monosit manusia, CHQ diketahui menghambat produksi dari TNFα dengan penghambatan NFkβ dan menurunkan kadar IL-6 dan IL-1β dengan cara mengganggu stabilitas mRNA kedua sitokin tersebut (Jang CH et al, 2006).
Efek CHQ pada inflmammasome diperlihatkan pada penelitian yang melihat produksi 1 pada sel kultur makrofag dan tikus percobaan. CHQ dapat menurunkan kadar HMGB-1 yang diduga dengan cara menghambat proses autofagositosis. Proses autofagositosis ini adalah proses dimana fagosom mendegradasi organel dan bagian sel yang mati. Proses autofagositosis akan menghasilkan nigericin yang mana merupakan aktivator dari NLRP3. HMGB-1 merupakan mediator sepsis fase akhir yang dikeluarkan dengan kematian sel. Dari penelitian diketahui bahwa pengeluaran HMGB-1 memerlukan NLRP3, diketahui ketika sel yang dihilangkan gen NLRP3 yang diinduksi oleh LPS, produksi HMGB-1 terhambat. Caspase-1 diketahui juga dapat memicu proses Pyroptosis. Caspase-1 diaktifkan dari bentuk tidak aktifnya, pro Caspase-1 oleh inflammasome. Pyroptosis akan menyebabkan kematian sel dan melepaskan sitokin-sitokin pro-inflamasi termasuk HMGB-1. Hal ini sejalan dengan penelitian-penelitian sebelumnya yang menunjukkan bahwa CHQ mempunyai efek lisosomotropik, di mana Lisosom mempunyai peran penting dalam proses autofagositosis (Lu B et.al., 2012).
Penelitian dengan tikus yang diinduksi oleh e-coli dan LPS dan diberikan CHQ menunjukkan bahwa pemberian CHQ dapat melindungi tikus dari kematian akibat sepsis berat. Pada penelitian tersebut CHQ diberikan pada kelompok pra induksi LPS dan post induksi LPS. Hasilnya CHQ dapat memberikan perlindungan terhadap kematian dari sepsis di kedua kelompok.
Hal ini menunjukkan bahwa CHQ dengan waktu paruhnya yang panjang dapat melindungi tikus kematian baik di fase awal maupun akhir sepsis (Yang M, 2013).