Pemilahan Isolat Penghasil Kolagenase Tertinggi
Fermentasi
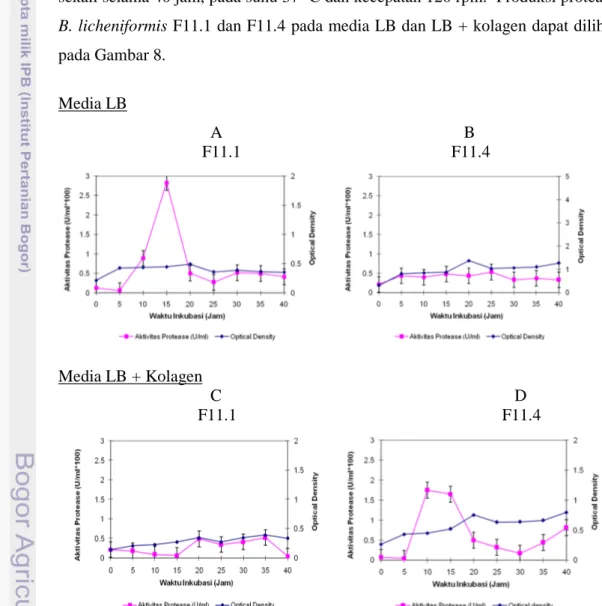
Fermentasi untuk produksi protease dilakukan pada media Luria Bertani broth (LB) dan media LB + kolagen 5%. Pengamatan dilakukan setiap 5 jam sekali selama 40 jam, pada suhu 370C dan kecepatan 120 rpm. Produksi protease B. licheniformis F11.1 dan F11.4 pada media LB dan LB + kolagen dapat dilihat pada Gambar 8. Media LB A B F11.1 F11.4 Media LB + Kolagen C D F11.1 F11.4
Gambar 8. Aktivitas protease (U/ml) Bacillus licheniformis F11.1 (A dan C) dan Bacillus licheniformis F11.4 (B dan D) pada media LB (A dan B) dan LB + kolagen (C dan D)
Pengukuran aktivitas spesifik juga dilakukan. Untuk menentukan aktivitas spesifik protease, dilakukan pengukuran konsentrasi protein enzim. Konsentrasi protein ditentukan dengan metode Bradford (1976) dengan bovine serum albumin sebagai standar (Lampiran 3). Konsentrasi protein dianalisis bersamaan pada saat pengukuran aktivitas protease. Aktivitas spesifik protease bakteri Bacillus licheniformis F11.1 dan Bacillus licheniformis F11.4 pada media LB dan LB + kolagen dapat dilihat pada Gambar 9.
Media LB A B F11.1 F11.4 Media LB + Kolagen C D F11.1 F11.4
Gambar 9. Aktivitas spesifik protease selama fermentasi Bacillus licheniformis F11.1 (A dan C) dan Bacillus licheniformis F11.4 (B dan D) pada media LB (A dan B) dan LB + kolagen (C dan D).
Tabel 6. Ringkasan produksi protease pada media LB dan LB + kolagen Aktivitas maksimum Waktu produksi optimum
F11.1 F11.4
LB LB + kolagen LB (Jam) LB + kolagen
(Jam)
U/ml U/mg U/ml U/mg
0.028 0.909 0.005 0.172 15 20-35
0.005 0.157 0.017 0.456 5-40 10-15
Gambar 8 dan 9 serta Tabel 6 memperlihatkan pada media LB, Bacillus licheniformis F11.1 menghasilkan aktivitas protease yang lebih tinggi dibandingkan dengan B. licheniformis F11.4. Waktu produksi optimum untuk B.licheniformis F11.1 adalah pada jam ke-15 dengan aktivitas 0,028 U/ml atau 0,909 U/mg protein dan B.licheniformis F11.4 adalah pada jam ke-20 sampai dengan jam ke-35 dengan aktivitas protease adalah 0,005 U/ml atau 0,157 U/mg protein. Aktivitas protease B. licheniformis F11.1 setelah jam ke-15 mengalami penurunan secara cepat. Aktivitas enzim yang tinggi mungkin menyebabkan terjadinya autohydrolisis pada enzim. Hal ini berbeda dengan aktivitas yang rendah dari B.licheniformis F11.4 yang stabil dengan interval waktu yang panjang. Hubungan antara pola pertumbuhan sel bakteri dan aktivitas protease menunjukkan akivitas optimum protease B. licheniformis F11.4 dicapai pada saat pertumbuhan bakteri pada fase stasioner sedangkan pada protease B. licheniformis F11.1 enzim diproduksi pada fase logaritmik dan aktivitas optimum dan stabil terjadi pada fase stasioner. Hasil penelitian yang dilaporkan menunjukkan bahwa fase pertumbuhan eksponensial adalah fase dimana terjadi sintesis dan sekresi awal protease, secara substansial meningkat pada fase akhir pertumbuhan dan mengalami produksi protease maksimum pada fase stasioner (Kumar & Hiroshi 1999).
Produksi pada media LB + kolagen (Gambar 8 dan 9 serta Tabel 6) menghasilkan pola ekspresi protease yang berbeda. Pada penelitian ini, dilakukan pengurangan kandungan nutrisi (sumber nitrogen dan karbon) dari LB (triptone dari 1% menjadi 0,5% dan yeast extract dari 0,5% menjadi 0,25%), dengan demikian bakteri terdorong untuk memanfaatkan substrat kolagen yang ditambah ke media. Aktivitas protease B. licheniformis F11.1 mengalami penurunan dari 0,028 U/ml atau 0,909 U/mg protein menjadi 0,005 U/ml atau 0,172 U/mg protein sedangkan aktivitas protease B. licheniformis F11.4 meningkat dari 0,005 U/ml
atau 0,157 U/mg protein menjadi 0,017 U/ml atau 0,456 U/mg protein pada waktu yang lebih pendek dengan waktu produksi optimum adalah 10 - 15 jam inkubasi yang berbarengan dengan fase logaritmik. Protease B. licheniformis F11.1 dengan dengan aktivitas yang rendah memiliki produksi optimum pada inkubasi jam ke-5 dan stabil sampai pada inkubasi jam ke-35. Protease B.licheniformis F11.4 yang aktivitasnya tinggi mengalami penurunan pada inkubasi jam ke-20.
Hasil penelitian Hoffmann et al. (2010) yang menggunakan B. lichniformis F11.1 dan F11.4 pada media Luria Bertani (LB) dengan azocasein sebagai substrat memiliki pola yang hampir sama dengan penelitian ini yaitu B. licheniformis F11.1 memiliki waktu produksi optimal pada inkubasi yang singkat yaitu pada jam ke-20 dan B. licheniformis F11.4 memiliki waktu produksi optimum pada inkubasi yang lama yaitu pada jam ke-40 dengan aktivitas B. licheniformis F11.1 yang lebih tinggi dibandingkan dengan B. licheniformis F11.4. Hasil penelitian Junianto (2008) yang menggunakan B. licheniformis F11.1 dalam berbagai media sistem fermentasi untuk proses deproteinasi kulit udang hasil demineralisasi menunjukkan waktu produksi optimum aktivitas protease yang lebih lama dibandingkan dengan penelitian ini dan Hoffmann et al. (2010). Pada fermentasi batch dengan penambahan inokulum sebanyak 2 kali pada awal fermentasi dan jam ke-24 dan fermentasi batch dengan penambahan inokulum sebanyak 2 kali pada awal fermentasi dan pada jam ke-12 serta fermentasi batch berturut-turut (subsequent batch) dengan penggantian 100% media pada jam ke-24 didapatkan waktu produksi optimum yang sama yaitu pada inkubasi jam ke-72, sedangkan waktu produksi optimum pada fermentasi batch didapatkan waktu produksi optimumnya adalah pada inkubasi jam ke-48 (Junianto 2008).
Bakteri yang berbeda dapat memperlihatkan waktu produksi enzim yang serupa. Akan tetapi, bakteri yang serupa dapat memperlihatkan waktu produksi optimum enzim yang berbeda tergantung pada kondisi lingkungannya. Pada penelitian ini dan Bacillus subtilis CN2 memiliki waktu produksi optimal pada inkubasi jam ke-14 - 15 (Tran & Nagano 2004). Waktu yang lebih singkat bagi produksi protease optimumnya yaitu inkubasi selama 9 jam diperlihatkan pada
protease Bacillus SMIA-2 yang ditumbuhkan pada media trisodium sitrat 1% (Nascimento & Martins 2004). Bacillus licheniformis Lbbl-11 dan Bacillus subtilis PE-11 pada media nutrien broth memproduksi protease secara optimal pada waktu yang lebih panjang yaitu pada inkubasi jam ke-48 (Olajuyigbe dan Ajele 2008; Adinarayana et al. 2003).
Spesifitas Substrat
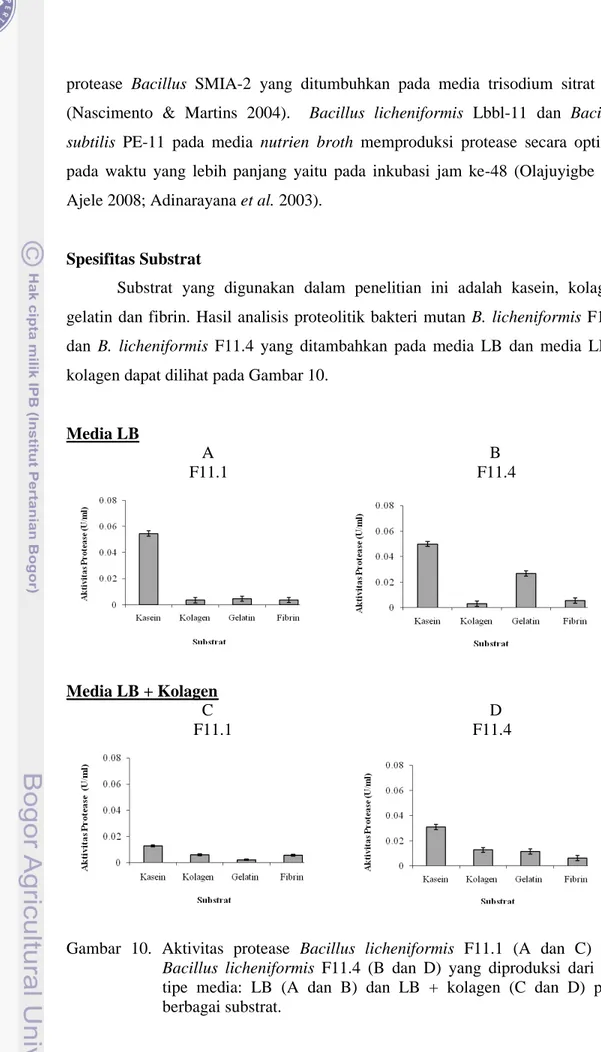
Substrat yang digunakan dalam penelitian ini adalah kasein, kolagen, gelatin dan fibrin. Hasil analisis proteolitik bakteri mutan B. licheniformis F11.1 dan B. licheniformis F11.4 yang ditambahkan pada media LB dan media LB + kolagen dapat dilihat pada Gambar 10.
Media LB A B F11.1 F11.4 Media LB + Kolagen C D F11.1 F11.4
Gambar 10. Aktivitas protease Bacillus licheniformis F11.1 (A dan C) dan Bacillus licheniformis F11.4 (B dan D) yang diproduksi dari dua tipe media: LB (A dan B) dan LB + kolagen (C dan D) pada berbagai substrat.
Gambar 10 menunjukkan aktivitas protease B. licheniformis F11.1 dan B. licheniformis F11.4 pada substrat yang berbeda. Ketika diproduksi pada media LB, kedua protease lebih aktif pada substrat kasein dibandingkan dengan tiga protein lain (kolagen, gelatin dan fibrin). Terdapat perbedaan preferensi substrat dari protease baik dari B. licheniformis F11.1 maupun B. licheniformis F11.4. Pada media LB, protease B.licheniformis F11.4 memiliki aktivitas yang lebih tinggi dalam mendegradasi gelatin, kira-kira 3 kali lebih tinggi dibandingkan dengan B.licheniformis F11.1.
Penambahan kolagen pada media (LB + kolagen) dapat menginduksi fraksi pemecah kolagen menjadi lebih banyak. Hal ini didukung dengan hasil zimogram (Gambar 12) pada media LB + kolagen terdapat pita yang lebih banyak dan intensitas pita yang lebih nyata dibandingkan dengan media LB dengan substrat kolagen. Kedua protease tetap menjadi lebih aktif terhadap kolagen dan gelatin walaupun kasein masih merupakan substrat yang terbaik. Hal ini dimungkinkan protease dengan jenis yang berbeda disintesis oleh kedua isolat sebagai respon perubahan sumber protein yang ada atau tersedia pada media yang dapat mengubah sintesis fraksi protease dan spesifisitasnya. Fraksi protease kedua isolat tetap memiliki aktivitas yang lebih aktif pada substrat kasein, ikatan peptida kasein lebih accessible hal ini berhubungan dengan struktur protein kasein yang globular dibandingkan dengan kolagen, gelatin dan fibrin yang merupakan protein fibrilar. Kolagen dan gelatin memiliki konformasi triple helix yang menyebabkan kolagen dan gelatin resisten terhadap sebagian besar proteinase (Chung et al. 2004). Kolagenase B. licheniformis F11.1 dan F11.4 mampu menghidrolisis berbagai substrat (kasein, kolagen, gelatin dan fibrin) yang menunjukkan kolagenase B. licheniformis F11 memiliki spesifitas substrat yang luas. Kolagenase dari bakteri umumnya memiliki spesifitas substrat yang luas (Peterkofsky 1982) dibandingkan dengan kolagenase dari vertebrata. Hasil penelitian lain yang mencakup hidrolisis protease terhadap berbagai substrat protein menunjukkan pola yang hampir sama dengan penelitian protease dari B. licheniformis F 11.1 dan F 11.4 yaitu protease dari Bacillus subtilis PE-11 yang memiliki aktivitas yang tinggi terhadap kasein, rendah sampai sedang aktivitas
hidrolisisnya pada BSA dan putih telur dan aktivitas hidrolitik yang sangat sulit pada gelatin (Adinarayana et al. 2003).
Media LB A B F11.1 F11.4 Media LB + Kolagen C D F11.1 F11.4
Gambar 11. Rasio hidrolisis kolagen dengan substrat lain (kasein, gelatin dan fibrin). oleh protease Bacillus licheniformis F11.1 (A dan C) dan Bacillus licheniformis F11.4 (B dan D) yang diproduksi dari dua tipe media: LB (A dan B) dan LB + kolagen (C dan D).
Gambar 11 menunjukkan rasio hidrolisis kolagen dengan protein lain (kasein, gelatin dan fibrin). Rasio hidrolisis kolagen dengan substrat lain bertujuan untuk membandingkan aktivitas enzim pada substrat kolagen dengan aktivitas enzim pada substrat protein lain. Rasio hidrolisis kolagen terhadap protein lain pada media LB + kolagen lebih besar dibandingkan pada media LB. Rasio hidrolisis kolagen pada substrat kasein oleh protease B.licheniformis F11.1 dan F11.4 hampir sama dan kedua isolat memiliki rasio hidrolisis lebih besar 7 kali pada media LB + kolagen dibandingkan dengan pada media LB. Rasio hidrolisis kolagen terhadap gelatin pada protease B.licheniformis F11.1 lebih besar 3,7 kali pada media LB + kolagen dibandingkan dengan media LB sedangkan pada protease B.licheniformis F 11.4 pada media LB + kolagen lebih besar 9,5 kali dibandingkan dengan media LB. Rasio hidrolisis kolagen terhadap fibrin pada protease B.licheniformis F11.1 lebih besar 1,1 kali pada media LB + kolagen dibandingkan dengan media LB sedangkan pada protease B.licheniformis F 11.4 pada media LB + kolagen lebih besar 3,7 kali dibandingkan dengan media LB. Rasio hidrolisis kolagen terhadap substrat protein lain pada media LB + kolagen yang lebih besar dibandingkan pada media LB menunjukkan penambahan kolagen pada media dapat meningkatkan aktivitas enzim sehingga media LB + kolagen dipilih untuk memproduksi enzim yang menghidrolisis kolagen.
Finger Print Substrate Protease B.licheniformis F11.1 dan F11.4
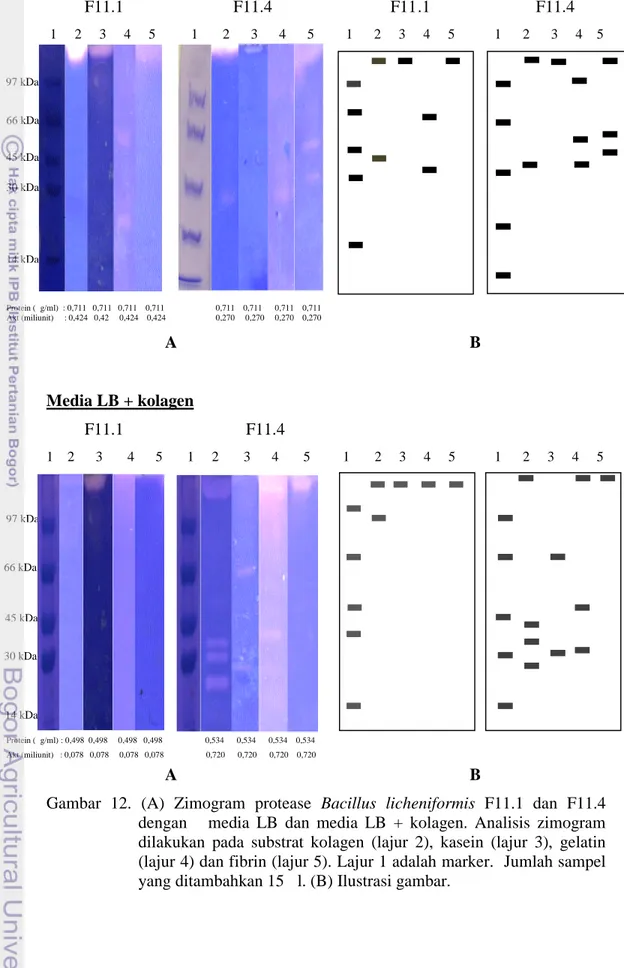
Gambar 12 dan Tabel 7 mengkonfirmasikan bahwa fraksi-fraksi protease yang berbeda dihasilkan oleh kedua B. licheniformis mutan yang ditumbuhkan pada media yang berbeda. Keragaman fraksi protease dengan berat molekul yang berbeda terdeteksi pada penelitian ini yang diperlihatkan pada Tabel 7. B. licheniformis F 11.4 mensintesis protease dengan keragaman ukuran yang lebih tinggi pada 4 substrat (kasein, kolagen, gelatin dan fibrin) baik pada media LB maupun media LB + kolagen. Analisis zimogram memperlihatkan bahwa protease B.licheniformis F 11.1 pada media LB + kolagen mampu menghidrolisis ke empat substrat dengan perkiraan di atas 97 kDa.
Media LB F11.1 F11.4 F11.1 F11.4 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 Protein (μg/ml) : 0,711 0,711 0,711 0,711 0,711 0,711 0,711 0,711 Akt (miliunit) : 0,424 0,42 0,424 0,424 0,270 0,270 0,270 0,270 A B Media LB + kolagen F11.1 F11.4 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 Protein (μg/ml) : 0,498 0,498 0,498 0,498 0,534 0,534 0,534 0,534 Akt (miliunit) : 0,078 0,078 0,078 0,078 0,720 0,720 0,720 0,720 A B
Gambar 12. (A) Zimogram protease Bacillus licheniformis F11.1 dan F11.4 dengan media LB dan media LB + kolagen. Analisis zimogram dilakukan pada substrat kolagen (lajur 2), kasein (lajur 3), gelatin (lajur 4) dan fibrin (lajur 5). Lajur 1 adalah marker. Jumlah sampel yang ditambahkan 15 μl. (B) Ilustrasi gambar.
97 kDa 66 kDa 45 kDa 30 kDa 14 kDa 97 kDa 66 kDa 45 kDa 30 kDa 14 kDa
Tabel 7. Ringkasan fraksi protease yang diproduksi oleh Bacillus licheniformis F11.1 dan Bacillus licheniformis F11.4 yang terdeteksi pada zimogram Berat Molekul (kDa) F11.1 F11.4 KS LB KS LB+ K KL LB KL LB + K GL LB GL LB + K F R LB F R LB + K KS LB KS LB+ K KL LB KL LB + K GL LB GL LB + K FR LB FR LB + K 10 20 √ √ √ √ √ √ 30 √ √ √ √ √ 40 √ √ √ √ √ 50 √ √ 60 √ √ 70 √ 80 √ 90 100 √ √ √ √ √ √ √ √ √ √
Keterangan : KS = Kasein, KL= Kolagen, GL= Gelatin, FR = Fibrin
LB = Media Luria Bertani Broth, LB + K = LB modifikasi + Kolagen
Pada Tabel 7, ditunjukkan bahwa fraksi-fraksi protease dari Bacillus licheniformis F11.4 lebih aktif dalam menghidolisis substrat yang digunakan kecuali fibrin jika diproduksi pada media LB + kolagen dibandingkan dengan B.licheniformis F11.1. Adanya kolagen pada media produksi menginduksi fraksi-fraksi protease sehingga lebih aktif terhadap kolagen. Keragaman fraksi-fraksi-fraksi-fraksi protease dengan berat molekul yang berbeda dapat ditemukan B.lichneiformis F11.4 dengan media LB + Kolagen. Perbedaan karakteristik dari kedua isolat menghasilkan aktivitas metabolik yang berbeda sehingga pola sintesis fraksi protease berbeda.
Berdasarkan hasil dari produksi protease ekstraselularnya, spesifitas terhadap substrat dan finger print substrate, B.licheniformis F11.4 dipilih sebagai isolat untuk dimanfaatkan lebih jauh untuk penelitian tahap selanjutnya. Protease B. licheniformis F11.4 pada media LB + kolagen dengan waktu produksi optimum 15 jam memiliki aktivitas yang tinggi (Gambar 8 dan 9), spesifitas terhadap substrat kolagen juga meningkat (Gambar 10) dan analisis zimogram menunjukkan kemampuan menghidrolisis kolagen dengan intensitas pita yang lebih nyata (Gambar 12). Enzim dari Bacillus liceniformis F11.4 karena memiliki
kemampuan menghidrolisis substrat kolagen selanjutnya istilah yang digunakan adalah kolagenase. Produksi kolagenase menggunakan B. licheniformis F11.4 dengan media LB + kolagen dengan waktu produksi selama 15 jam digunakan untuk dilakukan pemurnian dan diaplikasikan pada hidrolisis kolagen menjadi peptida kolagen.
Pemurnian Enzim
Pengendapan Amonium Sulfat
Pemurnian bertujuan untuk memisahkan enzim yang diinginkan dari berbagai senyawa protein lain. Sebelum dilakukan pemurnian enzim, filtrat kolagenase dipekatkan dengan pengendapan garam amonium sulfat dengan tingkat kejenuhan 20 - 90%. Proses mengendapkan protein enzim menggunakan garam adalah proses umum pada tahap awal isolasi protein, proses ini bertujuan untuk memisahkan protein dari komponen non protein. Konsentrasi garam terbaik dalam mengendapkan protein kolagenase adalah 50% tingkat kejenuhan dengan aktivitas kolagenase mencapai nilai tertinggi yaitu 0,056 U/ml pada endapannya dan pada supernatan memiliki aktivitas yang paling rendah yaitu 0,0002 U/ml (Gambar 13). Dengan demikian pada saat konsentrasi garam 50% tingkat kejenuhan sebagian besar protein ekstraseluler Bacillus licheniformis F11.4 diperkirakan sudah mengendap (salting out).
Gambar 13. Aktivitas kolagenase B. licheniformis F11.4 hasil pengendapan dengan berbagai macam konsentrasi garam amonium sulfat.
Berbagai jenis kolagenase bakteri berhasil dimurnikan dengan perlakuan awal pengendapan amonium sulfat. Kolagenase Bacillus pumilus COI-J diendapkan menggunakan amonium sulfat 30 dan 70% (Wu et al. 2010), kolagenase Clostridium perfringens pada amonium sulfat 60% (Matsushita et al. 1994).
Pemurnian dengan Kromatografi Pertukaran Ion
Kromatografi pertukaran ion memisahkan protein berdasarkan muatan protein dan interaksinya dengan muatan gel serta pada kekuatan relatif dari muatan protein tersebut. Kromatografi pertukaran ion memerlukan fase diam yang biasanya merupakan polimer terhidratasi yang bersifat tidak larut seperti selulosa, dekstran dan agarosa. Gugus penukar ion diimobilisasi pada matriks. Beberapa gugus penukar anion yaitu aminoetil (AE-), kuanternari aminoetil (QAE-) dan dietilaminoetil (DEAE-) sedangkan gugus penukar kation yaitu sulfopropil (SP-), metal sulfonat dan karboksimetil (CM-).
Sebelum dilakukan pemurnian dengan DEAE Sephadex A-50, pengaruh garam mineral dan kelebihan amonium sulfat yang terdapat pada larutan enzim dihilangkan dengan dialisis semalam dalam kantong dialisis D0655 Sigma berukuran cut off 12 kDa. Dialisis dilakukan dengan menggunakan bufer fosfat 0,01 M pH 8.
Profil elusi kolagenase B. licheniformis F11.4 dengan kolom DEAE Sephadex A-50 dapat dilihat pada Gambar 14. Hasil tahapan pemurnian kolagenase dapat dilihat pada Tabel 8.
Gambar 14. Profil elusi kolagenase B. licheniformis F11.4 dengan kolom DEAE Sephadex A-50. volume tiap fraksi 5 ml/tabung dan elusi bufer fosfat 0,02 M pH 8.
Pada tahap pemurnian kolagenase diawali dengan pengendapan amonium sulfat selanjutnya dengan kromatografi kolom DEAE Sephadex A-50. Tahap pengendapan amonium sulfat didapatkan tingkat kemurnian sebesar 5 kali ekstrak kasar dengan yield sebesar 10,1% (Tabel 8). Hasil pemurnian tahap awal dengan amonium sulfat menghasilkan tingkat kemurnian yang cukup tinggi. Kolagenase Bacillus pumilus COI-J dilakukan pengendapan amonium sulfat menghasilkan tingkat kemurnian sebesar 3,39 kali dengan perolehan (yield) 66,4% (Wu et al. 2010), kolagenase Streptomyces exfoliates menghasilkan tingkat kemurnian sebesar 3,29 kali dibandingkan dengan ekstrak kasar dengan perolehan 67,21% (Jain dan Jain 2009). Untuk memudahkan penulisan, kolagenase fraksi amonium sulfat selanjutnya digunakan istilah crude. Pemurnian dengan kolom DEAE Sephadex A-50 memberikan tingkat kemurnian sampai 26,3 kali dengan yield
sebesar 2,6% dibandingkan dengan enzim ekstrak kasar. Penggunaan
kromatografi kolom dengan penukar ion banyak digunakan untuk memurnikan enzim kolagenase. Petrova et al. (2006a) menggunakan kolom DEAE Sephadex
0,25 M 0,5 M 1 M 0,75 M 0,125 M 0 M NaCl 1 M
A-25 dalam memurnikan kolagenaseStreptomyces sp Strain 3B, diperoleh tingkat kemurnian 18,9 kali dengan perolehan 38%.
Tabel 8. Tahapan pemurnian kolagenase dari B. licheniformis F11.4
Tahapan Pemurnian Aktivitas (U/ml) Protein (mg/ml) Volume (ml) Total Aktivitas (Unit) Total Protein (mg) Aktivitas spesifik (U/mg) Tingkat kemurni-an (X) Yield (%) Ekstrak kasar 0,003 0,082 1000 3,10 82 0,038 1 100 (NH4)2SO4 50% 0,032 0,162 10 0,315 1,617 0,195 5 10,1 DEAE Sephadex A-50 (Fraksi 44) 0,016 0,015 5 0,08 0,08 1 26,3 2,6
Berat molekul enzim ditentukan menggunakan SDS-PAGE dan zimogram yang dapat dilihat pada Gambar 15. Dengan menggunakan SDS-PAGE dan zimogram menunjukkan kolagenase crude memiliki empat pita dengan berat molekul 124, 35, 31 dan 24 kDa, sedangkan kolagenase hasil pemurnian dengan DEAE Sephadex A-50 adalah 124 dan 26 kDa.
A B
1 2 3 1 2 3
Gambar 15. Berat molekul kolagenase B. licheniformis F11.4. (A) SDS-PAGE dan (B) zimogram. Lajur 1, marker: phosphorylase b (97 kDa), bovine serum albumin (66 kDa), ovalbumin (45 kDa), carbonic anhydrase (30 kDa), and lysozyme (14,4 kDa); lajur 2, ekstrak kasar; dan lajur 3, enzim murni DEAE Sephadex A-50 fraksi 44.
14 ,4 kDa 30 kDa 45 kDa 66 kDa 97 kDa 97 kDa 66 kDa 45 kDa 30 kDa 14 ,4 kDa 45 kDa 30 kDa
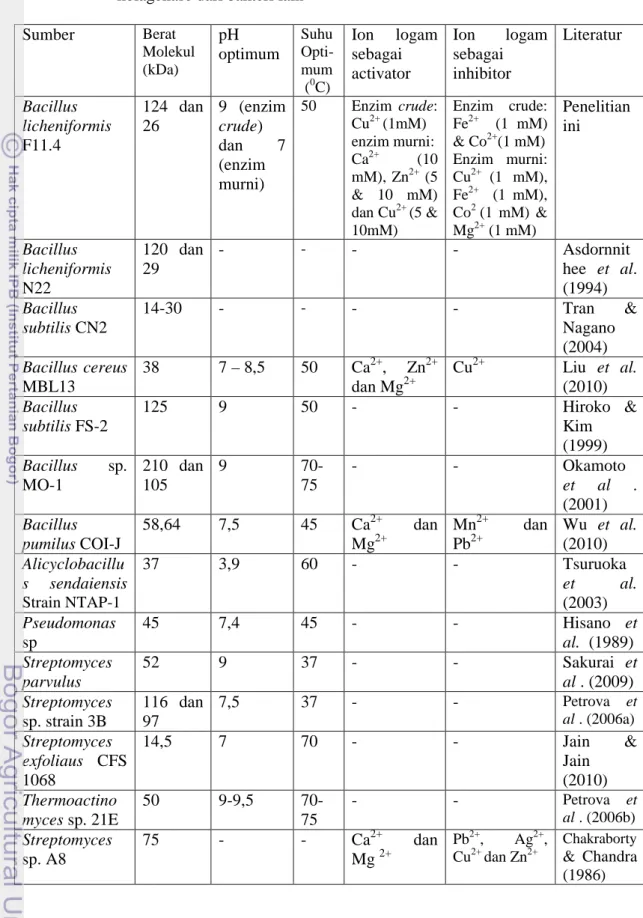
Berat molekul yang berbeda dari sumber kolagenase yang berbeda telah diteliti yaitu:125 kDa dari kolagenase B. subtilis FS-2 (Hiroko & Kim 1999); 120 and 29 kDa dari B. licheniformis N22 (Asdornnithee et al. 1994); 42,8 kD dari B. cereus (Sela et al. 1998); 58,64 kDa dari B. pumilus CoI-J (Wu et al. 2010); 50 kDa dari Thermoactinomyces sp. 21E (Petrova et al. 2006b); dan 33 and 19,8 kDa dari Pseudomonas sp. (Hisano et al. 1989). Beberapa berat molekul kolagenase yang telah dipurifikasi oleh peneliti lain disajikan pada Tabel 9.
Karakterisasi Kolagenase
Pengaruh Suhu terhadap Aktivitas Enzim
Penentuan pengaruh suhu terhadap aktivitas kolagenase dilakukan dengan cara mereaksikan kolagenase crude dan murni dengan substrat pada berbagai tingkatan suhu. Pada umumnya setiap enzim memiliki aktivitas maksimum pada suhu tertentu, aktivitas enzim akan semakin meningkat dengan bertambahnya suhu sampai suhu optimum tercapai. Setelah itu kenaikan lebih lanjut akan menyebabkan aktivitas enzim menurun. Gambar 16 menunjukkan pengaruh suhu terhadap aktivitas kolagenase murni B. licheniformis F11.4.
A B
Gambar 16. Pengaruh suhu terhadap aktivitas kolagenase Bacillus licheniformis F11.4. (A) enzim crude dan (B) murnidengan 10 mM Ca2+(
□
) dan tanpa 10 mM Ca2+ (Δ
). Aktivitas kolagenase dilakukan pada bufer fosfat 0,05 M pH 7,0.Tabel 9. Karakteristik kolagenase B. licheniformis F11.4 dibandingkan dengan kolagenase dari bakteri lain
Sumber Berat Molekul (kDa) pH optimum Suhu Opti-mum (0C) Ion logam sebagai activator Ion logam sebagai inhibitor Literatur Bacillus licheniformis F11.4 124 dan 26 9 (enzim crude) dan 7 (enzim murni) 50 Enzim crude: Cu2+(1mM) enzim murni: Ca2+ (10 mM), Zn2+(5 & 10 mM) dan Cu2+(5 & 10mM) Enzim crude: Fe2+ (1 mM) & Co2+(1 mM) Enzim murni: Cu2+ (1 mM), Fe2+ (1 mM), Co2(1 mM) & Mg2+(1 mM) Penelitian ini Bacillus licheniformis N22 120 dan 29 - - - - Asdornnit hee et al. (1994) Bacillus subtilis CN2 14-30 - - - - Tran & Nagano (2004) Bacillus cereus MBL13 38 7 – 8,5 50 Ca2+, Zn2+ dan Mg2+ Cu2+ Liu et al. (2010) Bacillus subtilis FS-2 125 9 50 - - Hiroko & Kim (1999) Bacillus sp. MO-1 210 dan 105 9 70-75 - - Okamoto et al . (2001) Bacillus pumilus COI-J 58,64 7,5 45 Ca2+ dan Mg2+ Mn2+ dan Pb2+ Wu et al. (2010) Alicyclobacillu s sendaiensis Strain NTAP-1 37 3,9 60 - - Tsuruoka et al. (2003) Pseudomonas sp 45 7,4 45 - - Hisano et al. (1989) Streptomyces parvulus 52 9 37 - - Sakurai et al . (2009) Streptomyces sp. strain 3B 116 dan 97 7,5 37 - - Petrova et al . (2006a) Streptomyces exfoliaus CFS 1068 14,5 7 70 - - Jain & Jain (2010) Thermoactino myces sp. 21E 50 9-9,5 70-75 - - Petrova et al . (2006b) Streptomyces sp. A8 75 - - Ca2+ dan Mg2+ Pb2+, Ag2+, Cu2+dan Zn2+ Chakraborty & Chandra (1986)
Pada kolagenase murni dilakukan penambahan ion Ca2+ 10 mM, karena hasil penelitian sebelumnya (Tabel 9) menunjukkan ion Ca2+ mampu meningkatkan aktivitas kolagenase Bacillus cereus MBL13 (Liu et al 2010), kolagenase Bacillus pumilus COI-J (Wu et al 2010) dan kolagenase Streptomyces sp. A8 (Chakraborty & Chandra 1986). Pada enzim crude dan enzim murni dengan adanya ion Ca2+ dan tanpa Ca2+memiliki suhu optimum yang sama yaitu 500C. Pada enzim dengan adanya ion Ca2+, lebih dari 80% aktivitas optimal masih ada pada kisaran suhu 30 - 500C, setelah suhu di atas 500C aktivitas menurun secara drastis. Sedangkan pada keadaan tanpa ion Ca2+, sekitar 80% aktivitas enzim masih ada pada kisaran yang pendek yaitu 50 - 600C (Gambar 16). Adanya ion Ca2+ yang dapat menstabilkan aktivitas pada kisaran suhu 30 - 500C berkaitan dengan kondisi suhu pada kisaran tersebut enzim belum mengalami denaturasi. Pada suhu 30 - 500C domain pengikatan Ca2+ belum rusak sehingga pengaruh Ca2+dalam meningkatkan aktivitas enzim terlihat jelas. Setelah suhu di atas 500C, suhunya semakin tinggi menyebabkan rusaknya interaksi-interaksi non kovalen (ikatan hidrogen, ikatan van der walls, ikatan hidrofobik dan interaksi elektrostatik) yang menjaga struktur 3 dimensi enzim secara bersama-sama sehingga enzim mengalami denaturasi yang menyebabkan domain pengikatan Ca2+ berubah.
Pada Gambar 16, enzim crude dan enzim murni (dengan dan tanpa Ca2+) menunjukkan aktivitas kolagenase semakin meningkat dengan bertambahnya suhu sampai suhu optimum tercapai, setelah itu kenaikan lebih lanjut akan menyebabkan aktivitas kolagenase menurun. Pada suhu yang lebih rendah dari suhu optimum, aktivitas enzim juga rendah, hal ini kemungkinan berkaitan dengan rendahnya energi aktivasi yang tersedia. Energi tersebut dibutuhkan untuk menciptakan kondisi tingkat kompleks aktif, baik dari molekul enzim maupun dari molekul substrat. Peningkatan suhu juga berpengaruh terhadap perubahan konformasi substrat sehingga substrat mengalami hambatan untuk memasuki sisi aktif enzim dan menyebabkan turunnya aktivitas enzim. Kedua, peningkatan energi termal molekul yang membentuk struktur protein enzim itu sendiri menyebabkan rusaknya interaksi-interaksi non kovalen (ikatan hidrogen, ikatan van der walls, ikatan hidrofobik dan interaksi elektrostatik) yang menjaga
struktur 3 dimensi enzim secara bersama-sama sehingga enzim mengalami denaturasi. Denaturasi menyebabkan struktur lipatan enzim membuka pada bagian permukaannya sehingga terjadi perubahan konformasi dan mengakibatkan terjadi penurunan aktivitas enzim (Hames & Hooper 2000).
Kolagenase B. licheniformis F11.4 yang memiliki suhu optimum pada suhu 500C termasuk termostabil yang moderat. Suhu optimum kolagenase B.licheniformis F11.4 dibandingkan dengan kolagenase dari bakteri lainnya dapat dilihat pada Tabel 9. Kolagenase B. licheniformis F11.4 memiliki suhu optimum yang sama dengan kolagenase B. subtilis FS-2 (Hiroko & Kim 1999). Suhu optimum B. licheniformis F11.4 dibandingkan dengan kolagenase Cytophaga sp L43-1 (Sasagawa et al. 1993) dan C. perfringens (Matsuhita et al. 1994) memiliki suhu optimum lebih tinggi, kedua enzim tersebut memilki suhu optimum 30– 420C, kolagenase lainnya yang memilki suhu optimum yang lebih rendah dibandingkan kolagenase B.licheniformis F11.4 yaituBacillus pumilus C01-J (Wu et al. 2010) dan Pseudomonas sp (Hisano et al. 1989) kedua enzim memiliki suhu optimum 450C. Suhu optimum B. licheniformis F1.14 dibandingkan dengan kolagenase Bacillus sp. MO-1 (Okamoto et al. 2001) dan Thermoactinomyces sp. 21E (Petrova et al. 2006b) memiliki suhu optimum yang lebih rendah, suhu optimum Bacillus sp. MO-1 dan Thermoactinomyces sp. 21E adalah 70–750C.
Kestabilan terhadap Suhu
Pengujian kestabilan suhu enzim crude dan enzim murni (tanpa dan dengan 10 mM Ca2+) dipanaskan tanpa substrat pada suhu 500C dan 700C dapat dilihat pada Gambar 17. Enzim dipanaskan terpisah sesuai waktu yang telah ditentukan. Pengukuran stabilitas enzim terhadap panas dinyatakan dalam nilai k, dan t1/2dari enzim kolagenase crude dan kolagenase murni B. licheniformis F11.4.
Dengan pemanasan, kolagenase pada penelitian ini relatif stabil dengan adanya Ca2+ dibandingkan dengan tanpa adanya Ca2+dan aktivitas sisa lebih dari 50% dengan perlakuan suhu 500C selama 20 menit. Enzim dengan adanya Ca2+ lebih termostabil dibandingkan dengan tanpa Ca2+ karena kation (Ca2+) meningkatkan stabilitas termal dengan memproteksi enzim terhadap denaturasi
panas dan memelihara konformasi aktifitas enzim pada suhu tinggi (Donaghy & Mckay 1993).
A B
Gambar 17. Pengaruh suhu terhadap stabilitas kolagenase B. licheniiformis F11.4. (A) kolagenase crude dan (B) kolagenase murni (tanpa dan dengan Ca2+). Enzim dalam bufer fosfat 0,05 M (pH 7,0) pada 500C dan 700C. Aktivitas relatif enzim diukur pada kondisi standar.
Sebelum menentukan waktu paruh (t1/2), perlu ditentukan dulu konstanta
laju deaktivasi (k). Konstanta laju deaktivasi enzim (k) dapat ditentukan dari hubungan ln aktivitas enzim terhadap waktu inkubasi (pemanasan) pada suhu tertentu. Slope persamaan linier hubungan ln aktivitas enzim terhadap waktu dinyatakan sebagai nilai k. Nilai k kolagenase crude pada suhu 500C adalah 0,026/menit dan pada suhu 700C adalah 0,033/menit (Gambar 18). Semakin tinggi suhu maka konstanta deaktivasi enzim biasanya semakin tinggi.
Gambar 18. Hubungan ln [aktivasi] kolagenase B. licheniformis F11.4 enzim
crude terhadap waktu pemanasan.
Waktu paruh enzim pada suhu 50 dan 700C diperoleh dari penurunan rumus kinetika deaktivasi enzim (Lampiran 8, persamaan 3). Dari persamaan tersebut diperoleh nilai t1/2 kolagenase crude pada suhu 500C dan 700C adalah
masing-masing 26,66 menit dan 21,01 menit.Waktu paruh kolagenase crude pada suhu 500C adalah 26,66 menit, artinya pemanasan pada suhu 500C dengan lama waktu inkubasi 26,66 menit, aktivitas kolagenase crude tinggal setengahnya.
Konstanta laju deaktivasi kolagenase murni tanpa Ca2+ dapat ditentukan dari hubungan ln aktivitas enzim terhadap waktu inkubasi (pemanasan) pada suhu 500C dan 700C yang dapat dilhat pada Gambar 19.
Gambar 19. Hubungan ln [aktivasi] kolagenase B. licheniformis F11.4 murni tanpa Ca2+ terhadap waktu pemanasan.
Pada Gambar 19 dapat ditentukan konstanta laju deaktivasi enzim (k) kolagenase murni tanpa Ca2+. Nilai k kolagenase murni tanpa Ca2+ pada suhu 500C adalah 0,05/menit dan pada suhu 700C adalah 0,078/menit. Dari penurunan rumus kinetika deaktivasi enzim dapat diperoleh nilai t1/2 kolagenase murni tanpa
Ca2+pada suhu 500Cdan 700C adalah masing-masing 13,86 menit dan 8,89 menit. Keberadaan logam Ca2+menurunkan nilai k dari enzim kolagenase murni. Nilai k enzim dengan keberadaan ion logam Ca2+ pada suhu 500C menjadi 0,043/menit dan pada suhu 700C menjadi 0,031/menit. Nilai t1/2kolagenase murni
dengan keberadaan ion logam Ca2+ menjadi 16,12 menit pada suhu 500C dan 22,36 menit pada suhu 700C. Hubungan ln aktivitas kolagenase B. licheniformis F11.4 murni dengan keberadaan ion Ca2+ terhadap waktu pemanasan dengan keberadaan ion logam Ca2+dapat dilihat pada Gambar 20.
Gambar 20. Hubungan ln [aktivasi] kolagenase B. licheniformis F11.4 murni dengan 10 mM Ca2+terhadap waktu pemanasan.
Dengan adanya ion logam Ca2+, nilai k enzim kolagenase murni semakin kecil dihubungkan dengan kolagenase murni tanpa logam, hal ini menunjukkan bahwa kinetika deaktivasi enzim semakin lambat. Nilai k dan waktu paruh kolagenase crude dan kolagenase murni dapat dirangkum pada Tabel 10.
Tabel 10. Nilai k dan Waktu paruh kolagenase crude dan murni (tanpa dan dengan Ca2+).
Kolagenase
Konstanta Laju Deaktivasi Enzim (k) (per menit)
Waktu Paruh (menit)
500C 700C 500C 700C Crude 0,026 0,033 26,69 21,01 Murni (Tanpa Ca2+) 0,05 0,078 13,86 8,89 Murni (dengan Ca2+) 0,043 0,031 16,12 22,36
Perhitungan waktu paruh (t1/2) sangat berguna dalam perhitungan stabilitas
enzim terhadap panas (lebih sensitif). Namun sebagian besar publikasi enzim dari berbagai mikroba tidak menghitung waktu paruh untuk kestabilan enzim terhadap panas. Sebagian besar publikasi menghitung stabilitas kolagenase menggunakan perhitungan aktivitas relatif (%).
Waktu paruh kolagenase crude lebih tinggi dibandingkan dengan kolagenase murni (tanpa dan dengan Ca2+) pada suhu inkubasi 50 dan 700C, kecuali pada kolagenase murni dengan Ca2+pada suhu inkubasi 700C yang sedikit meningkat. Waktu paruh yang lebih tinggi pada enzim crude dapat dihubungkan dengan aktivitas relatif (Gambar 18) yang pada inkubasi 20 menit masih memilki aktivitas relatif di atas 50%. Kolagenase murni tanpa Ca2+memiliki waktu paruh yang lebih rendah dibandingkan dengan kolagenase murni dengan penambahan ion Ca2+ (10 mM). Kehilangan ion logam selama pemurnian ternyata mengakibatkan perubahan stabilitas konformasi sehingga enzim tidak tahan panas, penambahan kembali ion logam Ca2+ pada enzim murni dapat meningkatkan waktu paruh, hal ini membuktikan adanya peranan ion Ca2+ dalam mempertahankan stabilitas enzim terhadap suhu.
Pengaruh pH terhadap Aktivitas Enzim
Enzim yang mempunyai pH optimum akan menyebabkan aktivitas enzim yang maksimal. Aktivitas enzim bergantung pada tingkat ionisasi rantai samping asam amino tertentu. Profil aktivitas pH dari suatu enzim menggambarkan pH
pada saat gugus pemberi atau penerima proton yang penting pada sisi katalitik enzim berada dalam tingkat ionisasi yang diinginkan. Pengaruh pH dilakuan dengan kisaran pH dari 2 sampai 12 menggunakan bufer universal. Gambar 21 memperlihatkan pengaruh pH terhadap aktivitas kolagenase.
A B
Gambar 21. Pengaruh pH terhadap aktivitas kolagenase B. licheniformis F11.4. (A) enzim crude dan (B) murni dengan 10 mM Ca2+ (
□
) dan tanpa 10 mM Ca2+ (Δ
). Aktivitas kolagenase dilakukan pada suhu 500C dengan bufer universal.Enzim crude memiliki aktivitas yang tinggi pada kisaran pH 7,0 - 12,0 dengan pH optimum pada pH 9. Enzim murni tanpa Ca2+ kolagenase B. licheniformis F11.4 memiliki aktivitas yang tinggi pada kisaran pH 6,0 - 8,0 dengan pH optimum adalah 7,0 (Gambar 21), sedangkan dengan adanya Ca2+, aktivitas yang tinggi pada kisaran 5,0 – 7,0 dengan pH optimum juga pada pH 7,0. Kolagenase murni dengan adanya Ca2+ pada kisaran pH 3-7 memiliki aktivitas tinggi dibandingkan dengan tanpa Ca2+hal ini disebabkan terjadinya interaksi optimum antara Ca2+dan protein enzim sehingga respon substrat lebih baik.
Pola grafik pengaruh pH terhadap aktivitas optimum kolagenase crude yang berbeda dengan aktivitas optimum kolagenase murni hal ini disebabkan pada kolagenase murni telah kehilangan kofaktor dan garam-garam yang sebelumnya
ada pada kolagenase crude. Kolagenase crude (fraksi amonium sulfat) memberi kisaran yang lebih lebar dari pada enzim murni, hal ini menunjukkan bahwa garam amonium sulfat berperan dalam mempertahankan stabilitas enzim dengan cara meningkatkan kekuatan ion larutan (Scopes 1987).
Hasil penelitian kolagenase dari bakteri lain menunjukkan banyaknya variasi pH optimum (Tabel 9). Kolagenase crude dan murni dari B. licheniformis F11.4 memiliki pH optimum yang lebih tinggi dibandingkan dengan kolagenase Alicyclobacillus sendaiensis Strain NTAP-1 (Tsuruoka et al. 2003) yang memiliki pH optimum 3,9. Kolagenase murni B.licheniformis memiliki pH optimum yang sama dengan kolagenase Streptomyces exfoliaus CFS 1068 (Jain & Jain 2010) sedangkan kolagenase crude memiliki pH optimum yang sama dengan kolagenase Bacillus subtilis FS-2 (Hiroko & Kim 1999) dan Bacillus sp. MO-1 (Okatomo et al. 2001) yang memiliki pH optimum 9.
Kestabilan pada pH Optimum
Pengujian kestabilan enzim crude dan enzim murni (tanpa dan dengan 10 mM Ca2+) pada pH optimum dapat dilihat pada Gambar 22. Kolagenase murni dari B. licheniformis F11.4 merupakan enzim yang lebih labil selama inkubasi dibandingkan dengan kolagenase crude. Inkubasi selama 20, 40 dan 60 menit pada suhu 500C aktivitas kolagenase murni secara gradual menurun hingga kurang dari 20% aktivitas relatifnya sedangkan kolagenase crude dengan inkubasi selama 20 menit aktivitas relatif masih di atas 80% dan sampai inkubasi selama 60 menit aktivitas relatif masih di atas 40%. Pengaruh adanya ion Ca2+ pada kolagenase murni tidak mempengaruhi stabilitas enzim terhadap pH (Gambar 22).
A B
Gambar 22. Stabilitas pada pH optimum kolagenase B. licheniformis F11.4. (A) kolagenase crude dan (B) kolagenase murni. Enzim dengan 10 mM Ca2+ (
□
) dan tanpa 10 mM Ca2+(Δ
) dalam bufer fosfat 0,05 M (pH 9.0 untuk kolagenase crude dan pH 7,0 untuk kolagenase murni). Aktivitas kolagenase diukur suhu 500C.Pola grafik stabilitas enzim pada pH optimum kolagenase crude (fraksi amonium sulfat) yang lebih stabil dibandingkan dengan kolagenase murni menunjukkan adanya peranan garam amonium sulfat dalam mempertahankan stabilitas enzim dengan cara meningkatkan kekuatan ion larutan (Scopes 1987). Selain itu pemurnian dengan kolom menyebabkan hilangnya garam, protein lain dan kondisi lingkungan yang berubah sehingga menyebabkan perubahan ikatan-ikatan di dalam enzim dan akibatnya pH dapat mempengaruhi aktiviasnya.
Pengaruh Ion Logam terhadap Aktivitas Enzim
Beberapa enzim memerlukan ion logam untuk aktivitasnya. Senyawa kation yang diujikan meliputi CaCl2, ZnCl2, CuCl2, CoCl2, FeCl2 dan MgCl2. Pada pengujian pengaruh ion logam (Gambar 23), ditemukan aktivitas kolagenase
crude dihambat FeCl2 (1mM) and CoCl2(1 mM) dengan persentase penurunan masing-masing sebesar 28% dan 39%, sedangkan CuCl2meningkatkan aktivitas kolagenase sebesar 60%. Aktivitas kolagenase murni dihambat oleh CuCl2 (1 mM), FeCl2 (1 mM), CoCl2 (1 mM) dan MgCl2 (1 mM) dengan persentase penurunan masing-masing sebesar 44%, 60%, 94% dan 86% sedangkan CaCl2(10
mM) meningkatkan aktivitas sebesar 109%, ZnCl2 (5 mM) meningkatkan aktivitas sebesar 66% dan ZnCl2(10 mM) meningkatkan aktivitas sebesar 72%. Ion logam CuCl2 (5 mM) dapat meningkatkan aktivitas sebesar 30% dan CuCl2 (10 mM) meningkatkan aktivitas kolagenase murni sebesar 55%.
A B
Gambar 23. Pengaruh ion logam terhadap aktivitas kolagenase Bacillus
licheniformis F11.4. (A) kolagenase crude dan (B) kolagenase
murni. Enzim dalam bufer fosfat 0,05 M (pH 7,0) pada 500C. Aktivitas relatif enzim diukur pada kondisi standar.
Pada Gambar 23 menunjukkan ion logam CaCl2 (1, 5 dan 10 mM) yang
ditambahkan pada kolagenase crude tidak terlalu berpengaruh terhadap
aktivitasnya, akan tetapi terhadap kolagenase murni pada konsentrasi 10 mM dapat meningkatkan lebih dari 2 kali lipat dibandingkan dengan tanpa ion logam CaCl2. Pada kolagenase crude penambahan ionCaCl2tidak berpengaruh terhadap aktivitasnya disebabkan pada kolagenase crude masih terdapat ion CaCl2tetapi pada kolagenase murni ion CaCl2 hilang selama pemurnian sehingga dengan penambahan CaCl2 aktivitasnya kembali meningkat. Menurut Park et al. (2002) kolagenase dari bakteri termasuk matriks metalloproteinase (MMP) yang membutuhkan ion logam dalam katalitiknya. Kolagenase membutuhkan ionCa2+ dalam stabilitas katalitiknya(Stricklin et al. 1977).
Ion CaCl2 pada konsentrasi 10 mM sebagai aktivator pada kolagenase murni mendukung hasil penelitian pada pengaruh suhu, pH dan stabilitas suhu.
Adanya ion CaCl2 dapat meningkatkan aktivitas enzim pada kisaran suhu 30 -500C dan pada kisaran pH 3 - 7 serta meningkatkan stabilitas panas pada suhu 500C selama 20 menit. Ion CaCl2 sebagai aktivator kolagenase Bacillus
licheniformis F11.4 ini sama dengan yang didapatkan pada penelitian kolagenase
dari Bacillus cereus MBL13 (Liu et al. 2010) dan kolagenase Bacillus pumilis COI-J (Wu et al. 2010).
Ion logam ZnCl2 tidak memberikan pengaruh terhadap kolagenase crude, akan tetapi pada kolagenase murni seiring meningkatnya konsentrasi ion logam ZnCl2 menyebabkan aktivitas kolagenase juga meningkat. Ion logam CuCl2dapat meningkatkan aktivitas kolagenase crude pada konsentrasi 1 mM sedangkan pada kolagenase murni dapat meningkatkan aktivitas pada konsentrasi 5 dan 10 mM. Ion ZnCl2 sebagai aktivator sama dengan yang didapatkan pada penelitian kolagenase Bacillus cereus MBL13 (Liu et al. 2010).
Pengaruh ion logam FeCl2 dan CoCl2menyebabkan terjadinya penurunan aktivitas pada kolagenase crude dan kolagenase murni. Pada kolagenase murni menyebabkan penurunan aktivitas yang tajam, hal ini disebabkan pada kolagenase murni sudah kehilangan ion-ion logam selama pemurnian yang dapat menjaga stabilitas enzim sehingga adanya penambahan ion logam FeCl2 dan CoCl2 pengaruhnya sebagai inhibitor terlihat jelas.
Adanya ion logam MgCl2 tidak memberikan pengaruh terhadap
kolagenase crude tetapi pada kolagenase murni menyebabkan aktivitasnya menurun. Keberadaan ion logam pada kolagenase crude dimungkinkan sebagai inhibitor akan tetapi pada kolagenase crude karena masih adanya ion-ion logam lain di sekitar sisi aktif enzim menyebabkan pengaruh ion logam MgCl2 tidak signifikan.
Kation logam dapat meningkatkan stabilitas termal dengan cara
memproteksi enzim terhadap denaturasi panas dan memelihara konformasi aktivitas enzim pada suhu tinggi (Donaghy & Mckay 1993). Adanya peningkatan keaktivan karena penambahan logam tertentu menunjukkkan bahwa ion logam diperlukan sebagai komponen dalam sisi aktif enzim. Mekanisme ion logam dapat memperbesar aktivitas enzim yaitu a) menjadi bagian integral dari sisi aktif, b) merubah konstanta kesetimbangan dari reaksi enzimatis, c) merubah muatan
listrik, d) mengusir ion inhibitor, e) menukar ion yang kurang efektif pada sisi aktif enzim atau substrat. Pada konsentrasi tertentu ion logam tertentu dapat bertindak sebagai inhibitor, tetapi dapat juga bertindak sebagai aktivator pada konsentrasi lain (Richardson & Hyslop 1985). Adanya penghambatan ion logam terhadap aktivitas kolagenase pada konsentrasi tertentu berkaitan dengan kekuatan ion, dimana kekuatan ion itu sendiri mempengaruhi konformasi atau struktur tiga dimensi dari protein enzim atau protein substrat (Suhartono 1989).
Spesifitas Substrat Kolagenase Murni
Kolagenase biasanya aktif pada berbagai protein lain. Kolagenase murni menunjukkan memiliki aktivitas yang tinggi terhadap kasein. Disamping itu kolagenase B. licheniformis F11.4 dapat juga menghidrolisis kolagen, gelatin dan fibrin (Gambar 24).
Gambar 24. Spesifitas substrat kolagenase murni B. licheniformis F11.4 (Insert: Spesifitas substrat kolagenase B.licheniformis F11.4 ekstrak kasar)
Spesifitas kolagenase murni dibandingkan dengan kolagenase ekstrak kasar memiliki pola yang hampir sama kecuali substrat fibrin yang aktivitasnya lebih tinggi dibandingkan gelatin. Pada Gambar 24 terlihat aktivitas tertinggi yaitu
substrat kasein, kemudian kolagen, fibrin dan gelatin. Rasio hidrolisis kolagen terhadap kasein, gelatin dan fibrin terdapat pada Gambar 25.
Gambar 25. Rasio hidrolisis kolagen dengan substrat lain (kasein, gelatin dan fibrin) oleh kolagenase Bacillus licheniformis F11.4 fraksi murni (Insert: rasio substrat kolagenase B. licheniformis F11.4 ekstrak kasar)
Rasio hidrolisis kolagen terhadap gelatin memiliki rasio yang tertinggi dibandingkan dengan substrat lain sedangkan yang terrendah pada rasio hidrolisis kolagen terhadap kasein. Rasio hidrolisis kolagen terhadap gelatin yang tinggi menunjukkan aktivitas hidrolisis yang lebih tinggi pada kolagen dibandingkan dengan gelatin. Rasio hidrolisis kolagen terhadap kasein memiliki rasio yang rendah (0,56) menunjukkan hidrolisis kasein lebih tinggi dibandingkan dengan kolagen. Rasio hidrolisis kolagen terhadap substrat lain menggunakan kolagenase murni hampir sama dengan rasio hidrolisis menggunakan kolagenase ekstrak kasar, kecuali rasio hidrolisis kolagen terhadap fibrin menggunakan kolagenase murni lebih tinggi dibandingkan dengan kolagenase ekstrak kasar.
Penentuan Vmaxdan KmKolagenase Murni
Penentuan Vmax dan Km kolagenase murni dilakukan pada pH 7 dan suhu
500C. Parameter Vmax adalah kecepatan maksimum enzim dan Km adalah
maksimumnya, nilai Kmbersifat khas bagi enzim tertentu dengan substrat spesifik
pada kondisi pH dan suhu tertentu (Lehninger 1994a). Km enzim kolagenase B. lichneiformis F11.4 adalah 0,26 mg/ml sedangkan Vmax nya adalah 0.27 U
(Gambar 26). Kolagenase Bacillus pumilus COI-J menggunakan substrat kolagen dari kulit sapi memiliki Kmsebesar 0,792 mg/ml dan Vmaxsebesar 129,5 U (Wu et al. 2010). Kolagenase B. licheniformis F11.4 memiliki nilai Km dan Vmax yang
lebih rendah dibandingkan dengan kolagenase Bacillus pumilus COI-J. Nilai Km
yang rendah menunjukkan kolagenase B. licheniformis F11.4 memerlukan konsentrasi substrat yang relatif rendah untuk memperoleh setengah kecepatan maksimum katalisisnya atau lebih aktif dalam menghidrolisis substrat.
y = 1,04x + 3,8 R2 = 0,9898 0 1 2 3 4 5 6 7 8 9 10 2,1 2,22 2,3 2,35 2,4 1/[S ] 1 /V
Gambar 26. Penentuan parameter kinetika enzim koalgenase murni dari Bacillus
licheniformis F11.4 dengan Lineweaver-Burk plot.
Pembuatan Peptida Kolagen
Derajat Hidrolisis
Derajat hidrolisis kolagen (konsentrasi 0,54 mg/ml) dengan kolagenase crude (aktivtas 0,032 U/ml) dan kolagenase murni (aktivitas 0,016 U/ml) dapat dilihat pada Gambar 27. Hidrolisis kolagen menggunakan kolagenase crude memiliki derajat hidrolisis tertinggi 79,41% sedangkan hidrolisis kolagen
menggunakan kolagenase murni memiliki derajat hidrolisis tertinggi sebesar 52,94% dengan waktu hidrolisis masing-masing selama 90 menit.
A B
Gambar 27. Derajat hidrolisis kolagenase B.licheniformis F11.4 pada substrat kolagen. (A) kolagenase crude (0,056 U/mg) dan (B) kolagenase murni (0,028 U/mg).
Derajat hidrolisis kolagen menggunakan kolagenase crude lebih besar dibandingkan dengan kolagenase murni. Hal ini disebabkan pada kolagenase crude terdapat fraksi kolagenase lain dan kofaktor yang berperan dalam proses hidrolisis. Adanya fraksi kolagenase lain dibuktikan dengan analisis zimogam yang menunjukkan pada kolagenase crude memiliki 4 fraksi kolagenase setelah dimurnikan memiliki 2 fraksi kolagenase (Gambar 15) dan adanya kofaktor yang berperan dalam katalitik dibuktikan dengan aktivitas yang meningkat pada kolagenase murni setelah ditambahkan ion logam Ca2+ dan Zn2+ (Gambar 23). Stabilitas kolagenase crude (fraksi amonium sulfat) juga stabil dengan adanya garam karena garam dapat meningkatkan kekuatan ion pada enzim (Scopes 1987) sedangkan pada kolagenase murni terjadi kehilangan garam, protein lain dan kondisi lingkungan yang berubah sehingga menyebabkan perubahan ikatan-ikatan di dalam enzim dan akibatnya dapat mempengaruhi aktiviasnya. Hal ini didukung pada penelitian karakterisasi kolagenase terutama pengaruh ion logam yang menunjukkan kolagenase murni yang sudah kehilangan kofaktor anorganik (ion logam) dengan penambahan ion logam Ca2+ dan Zn2+ dapat meningkatkan
aktivitas enzim (Gambar 23). Kolagenase merupakan enzim yang pada sisi katalitiknya terdapat Zn2+ dan membutuhkan ion Ca2+ dalam stabilitas enzimnya (Stricklin et al. 1977).
Pola hubungan antara waktu hidrolisis dengan derajat hidrolisis berkolerasi positif, semakin lama waktu hidrolisis maka semakin tinggi derajat hidrolisisnya (Gambar 27). Penelitian lain yang membahas derajat hidrolisis dengan sumber enzim yang berbeda umumnya menghasilkan derajat hidrolisis yang bervariasi. Kolagen dari kulit ikan salmon dan kulit ikan tuna bluefin menggunakan enzim tripsin memiliki derajat hidrolisis masing-masing sebesar 53,1% dan 96,2% (Han et al. 2011). Hasil hidrolisis protein frame tuna
menggunakan α-chymotripsin memiliki derajat hidrolisis 74,3%, hidrolisis
menggunakan enzim neutrase memiliki derajat hidrolisis sebesar 74,8% dan hidrolisis menggunakan pepsin memiliki derajat hidrolisis sebesar 74,5% (Lee et al. 2010). Penggunaan enzim yang menghasilkan hidrolisis rendah adalah penggunaan enzim papain pada hidrolisis kolagen porcin menghasilkan derajat hidrolisis 20,43%, penggunaan enzim bovine pancrease juga menghasilkan derajat hidrolisis yaitu 21,55% (Li et al. 2007). Enzim papain dan protease XXIII untuk menghidrolisis daging merah ikan tuna menghasilkan derajat hidrolisis masing-masing 20,4% dan 30,2% (Hsu et al. 2011).
Pola Peptida Hasil Hidrolisis
Pola peptida hasil hidrolisis menggunakan kolagenase crude dapat dilihat pada Gambar 28 A. Sedangkan pola peptida hasil hidrolisis menggunakan kolagenase murni dapat dilihat pada Gambar 28 B. Pola peptida hasil hidrolisis dengan menggunakan SDS-PAGE menunjukkan semakin lama waktu hidrolisis maka semakin tebal pita peptida yang dihasilkan. Gambar 28 menunjukkan hasil hidrolisis menggunakan kolagenase crude lebih aktif dalam memecah kolagen dibandingkan dengan kolagenase murni yang ditunjukkan dengan berat molekul hasil hidrolisis kolagenase crude lebih kecil (lebih dari 4,6 kD) dibandingkan dengan hasil hidrolisis kolagenase murni (lebih dari 10 kD). Kolagenase crude yang aktif dalam memecah kolagen dihubungkan dengan terdapatnya fraksi
kolagenase lain dan kofaktor yang berperan dalam proses katalitik. Mekanisme hidrolisis substrat kolagen oleh enzim kolagenase dijelaskan oleh Chung et al. (2004), kolagenase berikatan dengan substrat kolagen kemudian kolagenase menggerakkan substrat kolagen triple helix yang kaku. Ikatan antar residu asam amino Gly775-Ile776 pada α1(I) dan Gly775-Leu776 pada α2(I) terhidrolisa dan terputus. Ikatan yang terputus pertama kali adalah pada salah satu rantai α1(I).
Kolagenase crude A B M K M 15’ 30’ 60’ 90’ 15’ 30’ 60’ 90’ Kolagenase murni C D M K M 15’ 30’ 60’ 90’ 15’ 30’ 60’ 90’
Gambar 28. Pola hidrolisis kolagen oleh enzim kolagenase B. licheniformis F11.4. kolagenase crude (A dan B) dan kolagenase murni (C dan D), dengan aktivitas kolagenase A= 0,056 U/mg; B= 0,028 U/mg; C= 0,028 U/mg dan D= 0,014 U/mg (M= marker, K= kolagen tanpa hidrolisis). 14 kDa 45 kDa 66 kDa 97 kDa 4,6 kDa 10 kDa 15 kDa 14 kDa 97 kDa 66 kDa 45 kDa 4,6 kDa 10 kDa 15 kDa