1
TINJAUAN PUSTAKA
1. Stereokimia
Stereokimia merupakan ilmu yang mempelajari tentang struktur 3 dimensi dari molekul. Perlu diketahui bahwa stereokimia ini sangatlah penting. bahkan karena seterokimia ini, sebuah struktur yang memiliki rumus molekul sama hanya karena susunannya berbeda akan mengakibatkan fungsi yang berbeda pula, hal ini sering terjadi di dunia kesehatan. pada produk hasil sintesis. produk berupa rasemat, yaitu dua produk isomer yang berlawanan strukturnya.
Stereokimia adalah studi mengenai molekul – molekul dalam ruang tiga dimensi, yakni bagaimana atom – atom dalam sebuah molekul ditata dalam ruangan satu relatif terhadap yang lain.
1.1 Isomer Geometri dalam Alkena
Isomer geometri dalam Alkena (Cis dan Trans). Diakibatkan oleh ketegaran dalam molekul. Dijumpai dalam dua kelas senyawa: alkena dan senyawa siklik. Senyawa yang mempunyai ikatan rangkap tak dapat berputar dengan ikatan rangkap sebagai sumbunya, tanpa mematahkan ikatan pi nya. Karena kekakuan ikatan pi, gugus-gugus yang terikat pada ikatan pi terletak tetap dalam ruang relatif satu sama lain.
Syarat isomer geometri dalam alkena, yaitu tiap atom karbon yang terlibat dalam ikatan pi mengikat dua gugus yang berlainan, misalnya H dan Cl. Jika salah satu atom karbon berikatan rangkap itu mempunyai dua gugus identik, misalnya dua atom H atau dua gugus CH3, maka tak mungkin terjadi isomeri geometri.
2 1.1.1 Sistem Tata Nama (E) dan (Z)
Aturan Penandaan E dan Z untuk membedakan isomer alkena dengan dua substituen dapat kita gunakan istilah cis-trans, tetapi bagaimana jika alkena yang kita temukan memiliki tiga substituen atau empat substituen? Untuk kasus ini kita menggunakan penamaan menggunakan sistem E dan Z. Urutan prioritas kita butuhkan untuk mengurutkan penomoran pada substituen. Jika substituen dengan prioritas yang sama berposisi sama maka diberi tanda Z (Zussamen) sedangkan jika posisinya berlawanan diberi tanda E (Entgegen).
Aturan yang digunakan untuk memberikan urutan prioritas disebut aturan Cahn-Ingold-Prelog (diambil dari nama ilmuwan yang menemukannya). Aturan-aturan tersebut adalah sebagai berikut: Aturan 1 : Lihat pada atom yang terikat langsung pada karbon ikatan rangkap lalu urutkan substituen tersebut berdasarkan nomor atomnya.
3
Klorin memiliki nomor atom lebih besar dibandingkan karbon, sehingga substituen Cl menerima prioritas lebih tinggi dibandingkan metil.
Aturan 2 : Jika pengurutan prioritas tidak dapat dilakukan menggunakan atom pertama yang terikat langsung pada karbon ikatan rangkap maka gunakan prioritas atom berikutnya. Substituen -CH2CH3 dan –CH3 memiliki prioritas yang sama jika
digunakan aturan 1 karena kedua atom yang terikat langsung pada karbon ikatan rangkap adalah atom karbon juga. Dengan aturan 2, gugus etil menerima prioritas lebih tinggi dari pada metil karena etil memiliki prioritas lebih tinggi pada atom kedua. Atom karbon yang terikat pada karbon ikatan rangkap, masih mengikat satu karbon lain, sedangkan atom kedua pada gugus metil adalah hidrogen.
Aturan 3 : Ikatan rangkap diangkap sama dengan sebagai ikatan tunggal tetapi dengan jumlah sesuai dengan ikatan rangkapnya. Contohnya, substituen aldehid (-CH=O), memiliki ikatan rangkap antara karbon dengan oksigen, hal ini dianggap sama dengan satu karbon mengikat dua buah oksigen.
4 1.1.2 Aturan Deret
Aturan deret untuk prioritas :
1) Jika atom-atom yang dipermasalahkan berbeda-beda, maka urutan deret ditentukan oleh nomor atom. Atom dengan nomor atom tinggi memperoleh prioritas.
F < Cl < Br < I
Semakin tinggi nomor atom, maka prioritas semakin naik.
2) Jika atom-atom itu adalah isotop satu sama lain, maka isotop dengan nomor massa tinggi memperoleh prioritas.
H D
Nomor massa 1 < 2
3) Jika kedua atom tersebut identik, maka nomor atom dari atom-atom berikutnya digunakan untuk memberikan prioritas. Jika atom-atom tersebut juga mengikat atom-atom identik, maka prioritas ditentukan pada titik pertama kali dijumpai perbedaan dalam menyusuri rantai. Atom yang mengikat suatu atom dengan prioritas tinggi akan diprioritaskan (jangan menjumlakan nomor-nomor atom, melainkan mencari atom tunggal yang berprioritas tinggi).
4) Atom-atom yang terikat oleh ikatan rangkap atau ikatan ganda tiga diberi kesetaraan (equivalenceis) ikatan tunggal, sehingga atom-atom ini dapat diperlakukan sebagai gugus-gugus berikatan tunggal, dalam menentukan prioritas. Tiap atom berikatan rangkap diduakalikan (atau ditigakalikan untuk ikatan ganda tiga).
5 1.2 Isomer Geometri dalam Senyawa siklik
Dalam beberapa hal, sifat kimia sikloalkana mirip dengan alkana asikloik (rantai terbuka). Keduanya sama-sama non polar dan cenderung inert. Akan tetapi terdapat perbedaan mendasar. Pertama, sikloalkana kurang fleksibel dibandingkan dengan alkana rantai terbuka. Ikatan tunggal (ikatan sigma) pada alkana asliklik dapat berputar.
Pada sikloalkana, ikatan yang terbentuk kurang bebas untuk berputar. Misalnya siklopentana, bentuknya adalah segitiga rigid dan planar. Putaran pada ikatan karbon-karbon tidak mungkin terjadi tanpa merusak cincin.
6
Oleh karena strukturnya yang siklik, sikloalkana memiliki dua sisi yaitu sisi atas dan bawah. Hal ini memungkinakn sikloheksana memiliki kemungkinan isomerisme berdasarkan letak substituennya. Contohnya, ada dua bentuk isomer dari 1,2-dimetilsiklopropana. Pertama dengan dua gugus metil pada sisi yang sama, kedua dengan gugus metil pada posisi yang berlawanan. Kedua bentuk isomer merupakan molekul yang stabil, dan dapat dikonfersi dari bentuk satu ke bentuk lainnya tanpa memecah cincin atau tanpa membentuk ikatan baru.
Tidak seperti isomer konstitusional seperti pada butana dan isobutana dimana terdapat perbedaan urutan penempatan atom- atomnya. Kedua isomer 1,2-dimetilsiklopropana memiliki tempat ikatan yang sama, tetapi berbeda pada posisi atom-atomnya. Semua senyawa yang memiliki posisi ikatan atom yang sama tetapi berbeda pada orientasi tiga dimensinya disebut stereoisomer.
1.3 Konformasi Senyawa Rantai Terbuka
Dalam suatu molekul rantai terbuka, atom-atomnya memiliki peluang tak terhingga jumlah penataan/posisinya di dalam suatu ruang. Gugus-gugus fungsi yang terikat pada ikatan karbon-karbon dalam senyawa alkana dapat berotasi dengan bebas mengelilingi ikatan tersebut. Oleh karena itu atom-atom dalam suatu senyawa rantai
7
terbuka dapat memiliki posisi yang tak terhingga banyaknya di dalam ruang relatif satu terhadap yang lain. Pengaturan posisi atom yang bervariasi/berbeda-beda yang diakibatkan oleh rotasi ini disebut konformasi.
Untuk menggambarkan konformasi, digunakan tiga jenis rumus yaitu : 1. Rumus dimensional
2. Rumus bola-dan-pasak 3. Proyeksi Newman
Proyeksi Newman adalah pandangan ujung ke ujung dari dua atom karbon saja dalam molekul itu, sementara ikatan antar karbon tidak terlihat. Ketiga ikatan dari karbon depan tampak menuju pusat proyeksi sementara ketiga ikatan dari karbon belakang hanya tampak sebagian.
Contoh molekul yang digambarkan dengan 3 jenis rumus ini adalah 3-kloro-1-propanol
8
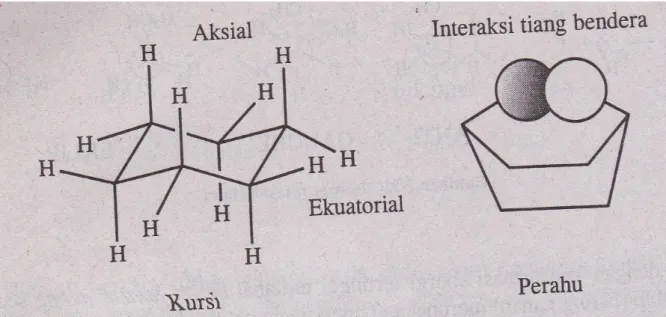
Rotasi gugus mengelilingi ikatan sigma menghasilkan konformasi yang berlainan, seperti eklips, gauche, goyang dan anti. Konformer dengan energi rendah lebih disukai. Pada temperatur kamar konformer dapat diubah menjadi satu sama lain dan karena itu mereka bukanlah isomer yang dapat diisolasi. Untuk cincin sikloheksana, disukai konformer bentuk kursi.
1.4 Bentuk Senyawa Siklik
a. Terikan Cincin (Ring Strain)
600 900 1080 1200
Sudut Ikatan menurut Bayer
Dalam tahun 1885 Adolf Von Baeyer, seorang ahli kimia Jerman, melontarkan teori bahwa senyawa siklik membentuk cincin-cincin datar. Semua senyawa siklik (kecuali siklopentana) menderita terikan (tegang karena tidak leluasa), karena sudut ikatan (bond angle) mereka menyimpang dari sudut tetrahedral 109,50.
b. Melipatnya Cincin dan Tolakan Hidrogen-hidrogen
Seandainya cincin sikloheksana datar, maka semua atom hidrogen akan tereklipskan. Tetapi dalam konformer lipatan, semua hidrogen bersifat goyang. Siklopentana akan mempunyai sudut ikatan hampir optimal (1080) seandainya datar. Tetapi siklopentana juga sedikit terlipat, sehingga atom-atom hidrogen yang terikat pada karbon cincin bersifat goyang. Siklobutana (sudut ikatan datar 900) juga terlipat, meskipun pelipatan ini menyebabkan sudut ikatan lebih tegang. Siklopropana harus datar; secara geometris, tiga titik (atau tiga atom karbon menentukan sebuah bidang. Atom-atom hidrogen mau tidak mau bersifat eklips.
9 1.5 Konformer Sikloheksana
Isomersime konformasi adalah sebuah bentuk stereoisomerisme dari
molekul-molekul dengan rumus struktural yang sama namun konformasi yang berbeda oleh karena rotasiatom pada ikatan kimia. Konformer yang berbeda dapat saling berubah dengan melakukan rotasi pada ikatan tunggal tanpa memutuskan
ikatan kimia. Keberadaan lebih dari satu konformasi, biasanya dengan energi yang berbeda, dikarenakan oleh rotasi hibridisasi orbital sp3 atom karbon yang terhalang. Isomerisme konformasi hanya terjadi pada ikatan tunggal karena ikatan rangkap dua dan rangkap tiga mempunyai ikatan pi yang menghalangi rotasi ikatan. Perbandingan stabilitas konformer-konformer yang berbeda biasanya dijelaskan dengan perbedaan dari kombinasi tolakan sterik dan efek elektronik.
Gambar konformasi sikloheksana
1.5.1 Substituen Ekuatorial dan Aksial
- Konformasi yang paling stabil dari atom-atom karbon sikloheksana adalah bentuk kursi.
- Tiap karbon cincin dari sikloheksana mengikat dua atom hidrogen. Ikatan pada salah satu hidrogen terletak dalam bidang cincin secara kasar.
- Hidrogen ini disebut hidrogen ekuatorial, sedangkan hidrogen yang tegak lurus dengan bidang disebut hidrogen aksial.
- Tiap atom karbon sikloheksana mempunyai satu atom hidrogen ekuatorial satu hidrogen aksial.
10 1.5.2 Sikloheksana Terdisubstitusi
Molekul sikloheksana dapat bersifat cis ataupun trans, bila terdisubstitusi oleh dua gugus molekul atau atom. Bentuk cis dan trans pada sikloheksana adalah isomer geometris dan pada suhu kamar tak dapat saling-diubah satu menjadi lainnya, dan masing-masing isomer dapat memiliki aneka ragam konformasi. Sebagai contoh senyawa cis-1,2-dimetilsikloheksana dan trans-1,2-cis-1,2-dimetilsikloheksana, seperti yang terlihat pada gambar berikut:
1.6 Kiralitas
1.6.1 Kiralitas Obyek dan Molekul Kiral
Molekul kiral adalah molekul yang mempunyai bayangan cermin tidak superimposabel (tidak dapat bertumpukan). Yang menyebabkan adanya kiralitas adalah adanya senyawa karbon yang tidak simetris. Atom C kiral adalah atom karbon yang mempunyai empat substituen yang berbeda.
Istilah kiral berasal dari kata Yunani χειρ (kheir) yang berarti tangan. Istilah kiral secara umum digunakan untuk menggambarkan suatu objek yang tidak dapat bertumpukan secara pas pada bayangannya. Akiral (tidak kiral) adalah benda yang identik dengan bayangan cermin. Untuk mempelajari kiralitas, dapat menggunakan tangan manusia sebagai perumpaaan. Perhatikan contoh kiralitas asam amino berikut ini.
H H
H
aksial ekuatorial
ujung ini bergerak ke atas ujung ini bergerak ke bawah
aksial, aksial(atau a,a) ekuatorial, ekuatorial(atau e,e)
CH3 H H CH3 CH3 H H CH3
11
Molekul kiral yang saling mempunyai bayangan cermin satu sama lain disebut dengan enantiomer atau isomer optik.
1.6.2 Atom Karbon Kiral
Atom karbon kiral adalah suatu atom karbon yang mengikat empat gugus yang berbeda.
1.6.3 Proyeksi Fischer
Molekul di alam sebenarnya berbentuk 3 dimensi, namun untuk kemudahan mempelajari , kebanyakan molekul digambarkan dalam bentuk 2 dimensinya. Nah struktur 2 dimensi yang merupakan proyeksi dari bentuk 3 dimensinya disebut proyeksi fischer yang ditemukan oleh seorang ilmuwan bernama Emil Fischer.
Dalam menggambarkan struktur proyeksi fischer harus memperhatikan beberapa aturan, antara lain:
1. Gugus – gugus yang diletakkan horizontal adalah gugus- gugus yang
12
2. Gugus – gugus yang diletakan vetikal adalah gugus – gugus yang menjauhi
pengamat.
3. Hetero atom ( atom selain C dan H) diletakkan pada garis horizontal.
Sedangkan carbon diletakkan pada garis vertikal.
4. Carbon dengan dengan bilangan oksidasi lebih tinggi diletakkan diatas.
Dibawah akan saya contohkan proyeksi fischer untuk molekul metaha (CH4 ).Saat
di kelas, biasanya kita menggambar rumus molekul dalam bentuk 2 dimensinya . namun molekul dialam berbentuk 3dimensi.
Bentuk molekul metana yang sebenarnya adalah
namun biasanya kita menggambarkannya dalam bentuk
1.7 Rotasi (perputaran) Cahaya Terpolarisasi Bidang
Rotasi spesifik zat aktif optis ditetapkan dengan sebuah polarimeter. Jika cahaya terpolarisasi dilewatkan salah satu isomer, bidang polarisasi akan berputar ke kiri atau ke kanan. Pemutaran bidang terpolarisasi ke kanan yaitu searah dengan putaran jarum jam, disebut putaran dekstro yang disingkat d atau (+).
13
Sebaliknya, pemutaran bidang cahaya terpolarisasi ke kiri yaitu berlawanan arah dengan putaran jarum jam, disebut dengan putaran levo yang disingkat l atau (-).
Senyawa yang memutar bidang cahaya terpolarisasi ke kanan disebut dekstrorotatori, sedangkan senyawa yang memutar bidang cahaya terpolarisasi ke kiri disebut levorotatori. Asam laktat yang bersifat putar kanan mempunyai rotasi spesifik +3,820, sedangkan metil ester yang bersifat putar kiri mempunyai rotasi spesifik -8,250.
1
.8 Penetapan Konfigurasi R dan SSistem R / S adalah sistem tata nama yang paling penting untuk menjelaskan enantiomer. R dan S berasal dari bahasa Latin yaitu Rectus (kanan) dan Sinister (kiri). Pusat kiral diberi label R atau S menurut sebuah sistem dimana substituen yang menempel pada pusat kiral diberi prioritas berdasarkan nomor atom. Hal itu sesuai dengan aturan prioritas Cahn - Ingold - Prelog (CIP). Nomor 1 adalah yang mempunyai nomor atom paling tinggi, sedangkan nomor 4 adalah mempunyai nomor atom paling rendah. Atom pusat berorientasi pada sibstituen dengan prioritas paling rendah (nomor 4). Perhatikan model berikut :
14
Pada gambar di atas, yang diurutkan hanya nomor 1, 2, dan 3. Sedangkan nomor 4 adalah sebagai pusat orientasi pusat kiral. Bila arah urutan searah dengan jarum jam, maka diberi simbol R. Jika arah urutan berlawanan dengan arah jarum jam, maka dberi simbol S.
Sifat-sifat kimia dari molekul kiral berbeda dari sifat bayangan cerminnya. Di sinilah letak pentingnya kiralitas dalam kaitannya dengan kimia organik modern.
1.9 Lebih dari Satu Atom Karbon Kiral
1.9.1 Molekul yang memiliki lebih dari dua Pusat Kiral
Ternyata sebuah pusat kiral dalam satu molekul memberikan 2 stereoisomer (sepasang enantiomer) dan 2 pusat kiral dalam satu molekul memberikan maksimum 4 stereoisomer atau 2 pasang enantiomer. Secara umum, sebuah molekul dengan n pusat kiral mempunyai maksimum 2n stereoisomer atau 2n-1 pasang enantiomer, walaupun mungkin bisa kurang karena mungkin beberapa stereoisomer adalah senyawa meso. Contohnya kolesterol mengandung 8 pusat kiral, memungkinkan 28 = 256 stereoisomer, walaupun beberapa diantaranya terlalu rumit untuk eksis, hanya ada 1 yang terdapat di alam.
15 1.9.2 Diastereomer
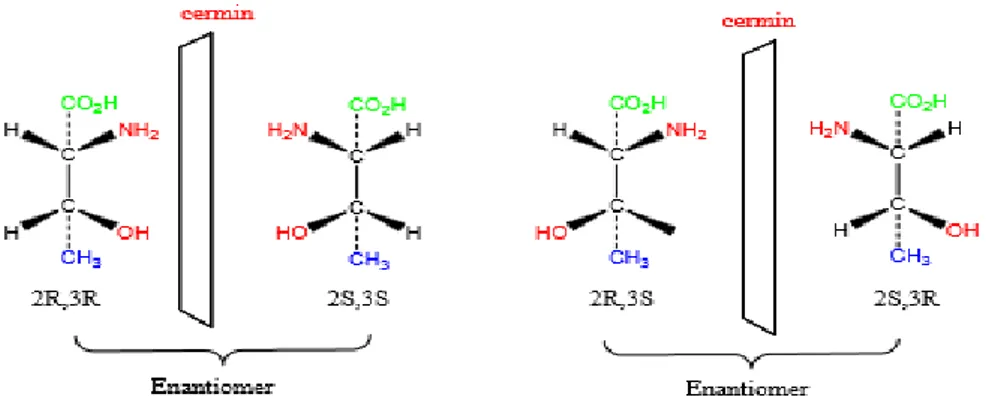
Mari kita lihat pasangan enantiomer dari asam 2-amino-3- hidroksibutanoat.
Akan nampak enantiomer 2R,3R yang bayangan cerminnya merupakan enantiomer 2S,3S dan enantiomer 2R,3S yang bayangan cerminnya merupakan enantiomer 2S,3R. Kemudian muncul pertanyaan bagaimana hubungan antar 2 molekul yang bukan merupakan bayangan cerminnya? Misalkan antara 2R,3R dan 2R,3S? Memang kedua molekul tersebut stereoisomer, namun bukan merupakan enantiomer. Untuk menjelaskan hubungan yang istimewa ini diperlukan terminologi baru yaitu diastereomer.
Diastereomer adalah stereoisomer yang bukan bayangan cerminnya. Diastereomer kiral mempunyai konfigurasi yang berlawanan pada beberapa pusat kiral namun mempunyai konfigurasi yang sama dengan yang lainnya. Sebagai pembandingnya, enantiomer yang mempunyai konfigurasi berlawanan pada semua pusat kiral.
16 1.9.3 Senyawa Meso
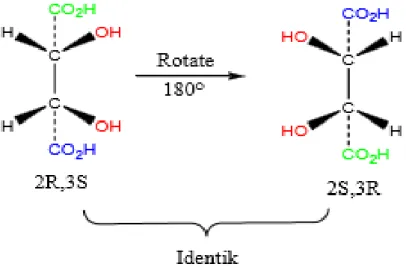
Struktur bayangan cermin 2R,3R dan 2S,3S adalah tidak identik namun merupakan pasangan enantiomer. Jika diperhatikan benar-benar, struktur 2R,3R dan 2S,3S adalah identik jika salah satu strukturnya diputar 180o.
Gambar Contoh senyawa meso
Struktur 2R,3S dan 2S,3R adalah identik karena molekul tersebut mempunyai bidang simetri sehingga akiral. Bidang simetri memotong pada ikatan C2-C3 sehingga setengahnya merupakan bayangan cermin dari setengah berikutnya.
Gambar Pencerminan dalam senyawa meso
Senyawa diatas merupakan akiral, namun mengandung 2 pusat kiral yang disebut senyawa meso.
17 1.9.4. Senyawa Kiral Siklik
Beberapa sikloalkana tersubtitusi adalah kiral. Contohnya cis- atau trans dimetilsiklopropana yang mengandung dua karbon kiral.
1.10 Pemisahan Suatu Campuran Rasemik
Produk dari suatu reaksi kimia yang terjadi berkaitan erat dengan stereokimia isomer. Kebanyakan para akhli kimia di laboratorium menggunakan bahan baku yang bersifat stereo yaitu akiral maupun rasemik , sehingga diperoleh produk yang akiral maupun rasemik.
Namun reaksi yang terjadi di dalam biologi, berlainan dengan reaksi kimia di laboratorium. Reaksi yang terjadi dalam biologi, selalu dihasilkan produk yang kiral walaupun bahan bakunya berasal dari senyawa kiral atau akiral. Reaksi biologis ini dimungkinkan karena adanya katalis biologi yaitu enzim. Karena enzim bersifat kiral, maka enzim tersebut berjalan sangat selektif dalam kegiatan katalitiknya. Misalnya, bila suatu organisme mencernakan suatu campuran alanina rasemik, maka hanya (S) – alanina yang tergabung ke dalam protein, sedangkan (R) – alanina tak digunakan dalam protein.
C C C H H H H H H CH2 CH2 CH2 Cyclopropane C C C C H H H H H H H H CH2 CH2 CH2 CH2 Cyclobutane C C C C C H H H H H H H H H H CH2 CH2 CH2 CH2 CH2 Cyclopentane C C C C C C H H H H H H H H H H H H CH2 CH2 CH2 CH2 CH2 CH2 Cyclohexane
18
Resolusi campuran rasemik yaitu pemisahan fisis suatu campuran rasemik enantiomer –enantiomer murni yang dilakukan di laboratorium. Untuk memisahkan sepasang enantiomer digunakan teknik yang sangat umum yaitu mereaksikannya dengan suatu reagensia kiral sehingga diperoleh sepasang produk diasteromer. Diastereomer ialah pasangan sterereoisomer tetapi bukan enantiomer. Jadi diastereoisomer adalah senyawa yang berlainan sifat fisiknya, sehingga dapat dipisahkan dengan cara fisik biasa, seperti kristalisasi, destilasi, kromatografi.
Suatu contoh campuran rasemik karboksilat (R)(S)–RCOOH, dapat dipisahkan secara laboratorium. (R)–RCOOH dan (S)–RCOOH ialah enantiomer dan kedua senyawa ini dapat bereaksi dengan suatu amina , membentuk suatu garam. Asam (R) (S) karboksilat bila direaksikan dengan suatu amina yang berupa enantiomer murni, akan menghasilkan sepasang diastereomer yaitu garam asam (R) amina dan garam asam amina (S).
H2N C CO2H H CH3 H3 H CO2H H2N C C (S)-alanina (R)-alanina
19
20
DAFTAR PUSTAKA
Allinger, N. L. et. al, 1976., Organic Chemistry, 2nd edition, Worth Printing, Inc., New York
Eliel, E. I., 1981., Stereochemistry of Carbon Compounds, Tata Mc Graw-Hill Publishing Company Ltd., New Delhi
H. Hart/Suminar Achmad; (1987), Kimia Organik, Suatu Kuliah Singkat. Jakatra: Penerbit Erlangga
Tim dosen kimia, 2013. Kimia organic. MKU unhas, Makassar.
R.J.Fessenden, J. S. Fessenden/A. Hadyana Pudjaatmaka (1986). Kimia Organik, (terjemahan dari Organic Chemistry, 3rd Edition), Erlangga, Jakarta
Solomons, T.W., 1982., Fundamentals of Organic Chemistry., John Willey & Sons. Inc., Canada.