BAB II
LANDASAN TEORI
A. Tinjauan Pustaka 1. Logam Kadmium (Cd)
Kadmium merupakan logam transisi yang berwarna putih-perak dengan nomor atom 48, struktur kristalnya heksagonal, dan masuk dalam golongan IIB pada tabel periodik. Logam kadmium dapat larut dalam HCl dan H2SO4 panas, dan sangat cepat larut dalam HNO3. Konfigurasi elektron kadmium pada keadaan dasar adalah 1s2 2s2 2p6 3s2 3p6 3d10 4s2 5p6 4d10 5s2. Jari-jari logam 1,489 Ǻ, jari- jari ionik Cd2+ 0,99 Ǻ (Nostrand, 1992). Hanya ada satu jenis mineral kadmium di alam yaitu greennockite (CdS) yang selalu ditemukan bersamaan dengan mineral spalerite (ZnS). Mineral greenockite ini sangat jarang ditemukan di alam, sehingga dalam eksploitasi logam kadmium, biasanya merupakan produk samping dari proses peleburan dan refining bijih-bijih Zn (Darmono, 1995).
Berdasarkan pada sifat fisikanya, kadmium merupakan logam yang lunak, ductile, akan kehilangan kilapnya bila berada dalam udara yang basah atau lembab serta akan cepat mengalami kerusakan bila dikenai oleh uap amonia (NH3) dan sulfur dioksida (SO2). Sedang berdasarkan pada sifat kimianya, logam kadmium didalam persenyawaan yang dibentuknya pada umumnya mempunyai bilangan oksidasi +2 (Darmono, 1995), selain itu Cd juga mempunyai bilangan oksidasi +1.
Kadmium digunakan dalam industri elektroplating dan logam aliasi, kabel tenaga transmisi, pigmen pada industri keramik dan enamel, logam aliasi (alloys), fotografi dan litografi, elektrode untuk lampu uap-kadmium, dan sel fotoelektrik (Irving Sax, 1987). Sulfida dan selenida dari kadmium telah digunakan sebagai fosfor dalam tabung televisi berwarna. Kadmium juga digunakan sebagai baterai NiCd yang rechargeable (Lagowski, 1997). Kadmium merupakan logam pengotor (impurity) pada industri besi dan baja, pupuk fosfat, bahan bakar (Cook dan Morrow, 1995 dalam www.cadmium.org) dan sebagai deposit dalam bijih seng karbonat (Irving sax, 1987). Kadmium dalam air berasal dari pembuangan
industri dan limbah pertambangan (Munaf, 1994). Adanya logam berat diperairan seperti kadmium, berbahaya baik secara langsung terhadap kehidupan organisme, maupun efeknya secara tidak langsung terhadap kesehatan manusia.
Kadmium dan garamnya sangat beracun (toxic). Kadmium, seperti merkuri adalah racun yang berakumulasi pada hati dan ginjal. Toksisitasnya diakibatkan dari ikatan ion divalennya dengan residu gugus sulfihidril (-SH), dan dari penggantian seng pada enzim seng (Zink-enzyme), mereduksi aktifitas enzim ini (Lagowski, 1997). Keracunan kadmium dapat bersifat akut dan kronis. Efek keracunan yang ditimbulkannya berupa penyakit paru-paru, hati, tekanan darah tinggi, gangguan pada sistem ginjal dan kelenjar pencernaan serta mengakibatkan kerapuhan pada tulang (Clarkson, 1988; Saeni, 1997 dalam Munaf, 1994).
2. Ligan
Salah satu jenis ligan adalah ionofor. Ionofor merupakan reseptor yang membentuk kompleks lipofilik dengan spesies hidrofilik yang bermuatan seperti Li+, Na+, Cd2+, Ca2+, Cr3+, atau Pb2+ dan mempunyai kemampuan menangkap ion- ion serta menstransfernya melewati medium lipofilik. Ionofor dapat membedakan ion-ion berdasarkan ukurannya dan sifat selektivitasnya (Siswanta, 1993). Ligan biasanya bersifat selektiv terhadap suatu jenis logam dan tidak selektif untuk logam yang lain (Sriyanto, 2002).
Kompleks antara ion logam dengan ionofor dapat dilihat sebagai model host-guest yang mana guest (ion) berupa bola yang terperangkap dalam struktur semacam lobang (cavity) dari molekul host (ionofor/ligan) yang memiliki rantai siklik atau terbuka. Sisi cavity mengandung gugus polar dari atom-atom elektronegatif seperti oksigen, nitrogen dan sulfur yang dipergunakan untuk berinteraksi dengan ion logam. Interaksi tersebut ada dua kemungkinan, yang pertama tanpa adanya konformasi dari ligan dan yang kedua mengadopsi bentuk akhir dari kompleks yang terbentuk dengan kation setelah terjadinya penataan ulang. (Siswanta, 1993).
Sisi aktif dari ligan mengandung gugus-gugus polar yang biasanya adalah atom-atom elektronegatif seperti oksigen, nitrogen dan belerang yang
dipergunakan untuk berinteraksi dengan ion logam. Gugus ini ada yang bersifat asam yang akan melepaskan proton sebelum pembentukan kompleks atau bersifat netral dimana kompleks dapat terbentuk tanpa melalui dissosiasi dari ligan.
Beberapa macam gugus yang bersifat asam antara lain: -COOH, -OH, -SH, - PO3H2, -C=NOH (Oksin) dan R3NH+. Gugus yang bersifat netral antara lain : - R3N, -C=O, -COR, -CONR2, -C=S dan –CN. Sedangkan gugus anorganik biasanya adalah halida (F-, Cl-, Br-, dan I-). Atom-atom dengan elektronegatifitas rendah memiliki kecenderungan membentuk ikatan yang kuat dengan ion logam.
Jadi atom N dan S lebih kuat dalam membentuk ikatan dibandingkan dengan atom O.
Sisi luar ligan harus mempunyai karakteristik lipofilik untuk menyediakan permukaan yang sesuai dengan medium nonpolar tempat berlangsungnya transfer ion logam (Siswanta, 1993). Pemisahan logam akan lebih menguntungkan bila dilakukan dengan ligan yang bersifat proton terionisasi (proton-ionizable) dibandingkan ligan bersifat netral, karena transfer ion logam ke dalam fase organik tidak memerlukan transfer secara bersamaan dari anion fase air (Hayashita, Yamasaki, Kunogi, Hiratani, Huang, Jang, Mc Gowen, dan Bartsch, 1994). Menurut Uehara, Honzawa, dan Shimizu, (2001), jenis ligan pengkhelat merupakan jenis ligan yang paling banyak dikembangkan karena menghasilkan selektifitas dan sensitifitas yang tinggi. Karena ligan pengkhelat spesifik untuk logam-logam transisi (Khopkar, 1990), maka dari itu ligan jenis ini sangat cocok digunakan dalam metode pemisahan selektif ion-ion logam transisi.
3. Ligan Kopoli(eugenol-asam eugenoksi asetat)
Handayani, dkk (2004) telah mensintesis ligan kopoli(eugenol-asam eugenoksi asetat) dari bahan awal asam eugenoksi asetat dan eugenol. Eugenol yang digunakan sebagai bahan utama dalam sintesis ini memiliki tiga gugus fungsional yaitu gugus alil, eter dan fenol (Anwar, 1994 dalam Sriyanto, 2002).
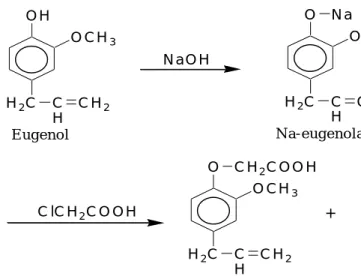
Asam eugenoksi asetat diperoleh dengan metode sintesis eter Williamson. Sintesis eter Williamson adalah reaksi SN2 antara natrium alkoksida dengan alkil halida.
Natrium alkoksida dalam reaksi ini adalah garam natrium eugenolat yang
kemudian bereaksi dengan asam kloroasetat yang merupakan alkil halida pada proses refluks suhu 50 – 70 0C. Dimana natrium eugenolat merupakan hasil reaksi antara eugenol dan natrium hidroksida. Reaksinya dapat dilihat pada Gambar 1. Hasil karakterisasi asam eugenoksi asetat dengan spektra FTIR (Fourier Transform Infra Red) dan kromatogram GC-MS (Gas Chromatography- Mass Spectrum) disajikan pada Lampiran 20 dan 22.
Gambar 1. Sintesis Asam Eugenoksi Asetat
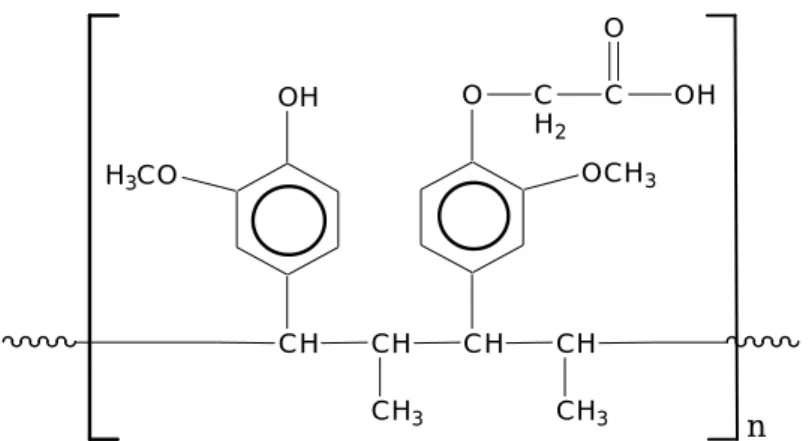
Sedangkan kopoli(eugenol-asam eugenoksi asetat) dihasilkan dari polimerisasi asam eugenoksi asetat dan eugenol dengan menggunakan katalis kationik BF3O(C2H5)2 dengan perbandingan mol eugenol dan asam eugenoksi asetat adalah 1:3. Reaksi yang terjadi ditunjukan pada Gambar 2. Karakterisasi kopoli(eugenol-asam eugenoksi asetat) dengan FTIR dan DTA (Diferensial Thermal Analysis) disajikan pada Lampiran 21 dan 23.
BF3O(C2H5)2
OH
OCH3
H2C C H
CH2
O
OCH3
H2C C H
CH2 CH2
Eugenol
+
Asam eugenoksi asetat C OH O O H
O C H3
H2C C H
C H2
N a O H
O
O C H3
H2C C H
C H2 N a
C lC H2C O O H
O
O C H3
H2C C H
C H2 C H2C O O H
N a C l
E u g e n o l N a-e u g e n o la t
A s am e u g e n o k si a seta t +
Kopoli(eugenol-asam eugenoksi asetat)
Gambar 2. Sintesis Kopoli(eugenol-asam eugenoksi asetat)
Ligan kopoli(eugenol-asam eugenoksi asetat) memiliki gugus aktif karboksilat yang berasal dari monomer asam eugenoksi asetat dan gugus fenol dari monomer eugenol. Gugus ini bersifat proton terionisasi (proton-ionizable), yang akan melepaskan proton sebelum terbentuknya kompleks dan akan membentuk kompleks dengan logam transisi menurut mekanisme asam-basa Lewis, sehingga memungkinkan untuk mengadakan ikatan kompleks selektif dengan ion logam Cd2+. Selain itu ligan ini merupakan suatu polimer (makromolekular) yang memiliki lipofilisitas besar sehingga kelarutannya dalam fase air sangat rendah, dengan demikian hilangnya ligan selama proses ekstraksi dapat dicegah atau diperkecil. Hayashita, et al., (1994) menyatakan bahwa untuk mencegah hilangnya ligan ke dalam fase air selama ekstraksi pelarut dan untuk meningkatkan efisiensi ekstraksi pelarut dilakukan dengan cara meningkatkan lipofilisitas dari ligan tersebut. Untuk itu sintesis dapat diarahkan pada pembuatan suatu ligan polimer.
Dilihat dari strukturnya ligan kopoli(eugenol-asam eugenoksi asetat) merupakan suatu ligan polieter asiklik. Menurut Hiratani, et al., (1990) carrier asiklik lebih menguntungkan daripada carrier makrosiklik dalam hal pelepasan dan penangkapan ion logam. Hal ini disebabkan oleh : a). Ligan asiklik lebih mudah dibuat dari pada ligan makrosiklik sejenis dan variasi strukturnya dapat
CH CH
CH3
CH CH
CH3
OH O
OCH3 H3CO
C H2
C OH O
n
dengan mudah diubah ke bentuk ligan yang potensial; b). Ligan asiklik dapat mengalami penataan pseudosiklik sampai terbentuk kompleks dengan kation.
4. Ekstraksi Pelarut Sistem Khelat
Dalam sistem ekstraksi pelarut selalu melibatkan senyawa yang bersifat aktif yang dapat berinteraksi dengan ion logam yang biasa dikenal ekstraktan. Ektraksi khelat merupakan pengembangan dari ekstraksi pelarut berdasarkan interaksinya dengan ion logam dengan menggunakan ekstraktan pengkhelat (Sriyanto, 2002).
Pada prinsipnya proses ekstraksi pelarut berlangsung melalui tiga tahap, yaitu:
pembentukan kompleks tidak bermuatan, distribusi dari kompleks yang terekstraksi dan interaksinya yang mungkin dalam fase organik (Khopkar, 1990).
Pembentukan kompleks tidak bermuatan merupakan tahapan yang terpenting dalam ekstraksi, karena suatu kompleks dapat tertransfer ke dalam fase organik bila kompleks tersebut tidak bermuatan. Kompleks tidak bermuatan dapat terbentuk melalui proses pembentukan khelat netral, solvasi atau pembentukan pasangan ion.
Menurut Nernst, apabila suatu zat ada dalam campuran dua pelarut yang tidak saling bercampur, maka zat tersebut akan terdistribusi sedemikian rupa diantara kedua pelarut tersebut dan akan berada dalam suatu kesetimbangan pada temperatur dan tekanan tertentu dalam larutan tersebut.
X1 X2
Dalam kesetimbangan tersebut berlaku :
[ ] [ ]
1 2X
Kd = X ………(1)
Dimana,
Kd = koefisien distribusi
[X1] = Konsentrasi zat X pada fasa 1.
[X2] = Konsentrasi zat X pada fasa 2.
Umumnya pelarut 1 adalah air dan pelarut 2 adalah pelarut organik.
Kelarutan suatu senyawa tergantung polaritasnya, sehingga senyawa nonpolar
akan cenderung larut pada fase organik dan senyawa polar akan cenderung larut pada fase air.
Pada penerapan praktis ekstraksi pelarut, yang menjadi perhatian utama adalah fraksi zat terlarut total dalam fase yang satu atau yang lainnya, tanpa mempedulikan bagaimana cara-cara dissosiasi, assosiasi atau interaksinya dengan spesi-spesi lain yang terlarut. Besaran yang digunakan untuk menyatakan konsentrasi solut yang ada pada tiap fase adalah perbandingan distribusi (D) :
air fase pada zat total i konsentras
organik fase
pada zat total i Konsentras
D= ...(2)
Kd, koefisien partisi tidak bergantung pada konsentrasi total zat terlarut pada kedua fase tersebut. Jika tidak terjadi assosiasi, dissosiasi atau polimerisasi pada fase-fase tersebut dan pada keadaan ideal, maka harga Kd sama dengan D (Khopkar, 1990).
Sebagai contoh pada ekstraksi asam lemah HA dari fase air ke fase organik.
HA akan terdistribusi di antara fasa air dan fase organik menurut reaksi : HA(a) HA(o)
atau ...(3)
Dissosiasi asam tersebut dalam air memberikan persamaan : HA(a) + H2O H3O+ + A-(a)
Atau ...(4)
Sehingga perbandingan distribusi D dapat dituliskan :
………...…...…...…………(5) Subsitusi persamaan (2), (3) dalam (4) diperoleh ;
[ ] [ ]
a od HA
K = HA
[ ]
HA o = Kd.[ ]
HA a[ ][ ]
[ ]
a aa HA
A O K H
−
= 3 +
[ ] [ [ ] ]
aa a
O H
HA A− = K +
3
[ ] [ ]
a[ ]
a OA HA
D HA −
= +
………...………(6)
Untuk tujuan praktis biasanya harga D dinyatakan dalam istilah persen ekstraksi (E). Persen ekstraksi (E) merupakan perbandingan antara banyaknya zat hasil ekstraksi dengan zat hasil mula-mula dikalikan seratus persen.
………...…..…... (7)
Jika volume fase air dan fase organik yang digunakan sama maka :
...(8) Dimana: E = persen ekstraksi
SO = konsentrasi solut didalam fase organik VO = volume fase organik
Sa = konsentrasi solut di dalam fase air
Va = volume fase air (Christian, 1986).
Dalam ekstraksi sistem khelat akan terbentuk khelat yang merupakan senyawa kompleks hasil interaksi antara ion logam dan ligan polifungsional, yaitu ligan yang mampu menempati dua atau lebih posisi pada lingkaran koordinasi dari ion logam untuk membentuk senyawa siklik (Huheey, 1972). Faktor-faktor yang mempengaruhi kestabilan kompleks seperti keasaman ion logam, kebasaan ligan serta konfigurasi kompleks yang terbentuk dengan sendirinya juga merupakan faktor yang mempengaruhi kestabilan khelat. Selain itu kestabilan khelat juga dipengaruhi ukuran dan jumlah cincin khelat yang terbentuk. Sebagai contoh, cincin lingkar 5 dan 6 biasanya relatif stabil karena mempunyai rintangan sterik yang minimal dan tidak ada tegangan yang berarti (Khopkar, 1990). Kestabilan khelat sebanding dengan jumlah cincin yang ada. Hal ini disebabkan jumlah cincin yang ada dalam suatu khelat logam berarti semakin banyak pula jumlah molekul air yang digantikan dari posisi lingkaran koordinasi logam itu (Sriyanto, 2002).
[ ] [ ] [ ]
[
+]
+[
+]
= +
=
O H
K K O
H HA HA K
HA D K
a d a
a d
3 3
1
% 100
% ×
= +
a a O O
O O
V S V S
V E S
1
% 100
= + D E D
[ ] [ ] [ ] [ ]
nOn
n a O
eks M HR
O H K MRn +
= 3 +
[ ] [ ]
a OdHR HR
K = HR
[ ] [ ]
[ ] [
a]
a a aa HR H O
R O K H
2 _ 3
= +
[ ]
[ ] [ ]
n a a af M R
K = MRn+ −
Ditinjau dari muatannya, khelat dapat bersifat netral, bermuatan positif atau bermuatan negatif. Pada proses ekstraksi logam melalui mekanisme pembentukan kompleks khelat netral, ligan biasanya merupakan senyawa organik yang bersifat asam lemah berbasa satu. Dalam sistem ekstraksi khelat, reaksi terjadi apabila pada fase air yang mengandung ion logam mengadakan kontak dengan fase organik yang mengandung ligan khelat. Bila M adalah ion logam dengan valensi n dan HR adalah ligan khelat, maka persamaan reaksi ditulis sebagai berikut:
H2O(a) + Mn+(a) + nHR(O) MRn (O) + nH3O+ Pada kesetimbangan berlaku:
………....………(9) Ligan khelat akan terdistribusi diantara dua fase tersebut
HR(O) HR(a) ……...….(10)
Dissosiasi ligan khelat tersebut memberikan persamaan;
HR(a) + H2O H3O+(a) + R-(a)
………...……...(11)
Anion khelat akan bereaksi dengan ion logam M membentuk suatu khelat netral yang dapat diekstraksi dan khelat tersebut akan terdistribusi diantara dua fase:
Mn+(a) + nR(a) MRn(a)
………...……(13)
MRn(a) MRn(O)
………...………...……….(14)
[ ] [ ]
aO
dMRn MRn
K = MRn
2 1
D
= D α
Angka banding distribusi (D) dapat dinyatakan bila khelat MRn dianggap semuanya pada fase organik dan Mn+ pada fase air
...………...………...………..(15)
Selektifitas pemisahan logam dapat ditinjau dari besaran faktor pemisahan α, yang dinyatakan dengan persamaan:
...………...…...…..….(16) Pemisahan akan berlangsung semakin baik apabila harga α semakin besar.
Dalam ekstraksi pelarut sistem khelat, pemisahan logam tergantung pada kestabilan khelat yang terbentuk dan kelarutan relatif khelat pada fase organik.
5. Membran Cair
Definisi membran adalah tipis, semi-permeable, dan merupakan pembatas padat (solid barrier). Membran cair merupakan fase cair, biasanya organik, dan terletak antara dua larutan yang tidak saling larut (Kralj dan Brecevic, 1992).
Membran cair adalah fase cair yang memisahkan dua fase cair lainnya yang tidak saling larut. Dimana terjadi transport kation (M+) dari fase air (fase sumber) ke fase air lainnya (fase penerima) melalui “membran cair”. Pergerakan spesies bermuatan melalui membran hidrofobik terjadi dengan adanya ligan yang berperan sebagai kation carrier (Lamb, Christensen, Bedke, Astin, dan Izzat, 1979).
Ada beberapa tipe membran cair:
a. Membran Cair Ruah (Bulk Liquid Membrane, BLM)
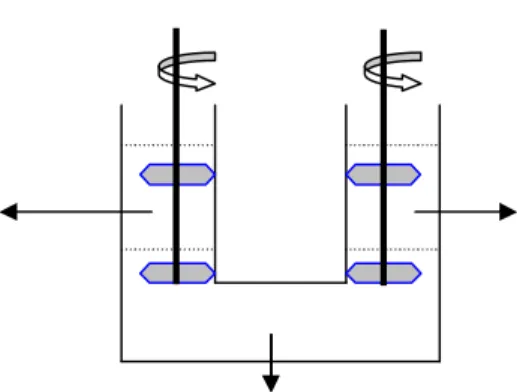
Membran cair ruah merupakan tipe membran cair yang paling sederhana dan biasanya digunakan untuk mempelajari aspek-aspek yang mempengaruhi proses transport seperti pH larutan, konsentrasi ligan, waktu transport dan jenis stripping agent (Rumhayati, 2000). Membran transport yang digunakan sebagai pemisah ion menggunakan ligan yang dikerjakan dalam sisten membran cair dengan menggunakan pipa U (Gambar 3) atau pipa H (Hiratani,
[ ]
[ ]
MRnMn aOD= +
et al., 1990). Ligan dilarutkan dalam fasa membran sehingga ligan tersebut mobile.
Fase Sumber Fase Penerima
Fase Membran Kloroform
Gambar 3. Membran Cair Ruah (pipa U)
(Hiratani, et al., 1997) b. Membran Cair berpendukung (Supported Liquid Membrane, SLM)
Membran cair berpendukung terdiri dari tiga komponen utama yaitu membran pendukung, pelarut organik, dan senyawa pengemban. Membran cair berpendukung dapat dibuat dengan cara merendam suatu membran polimer yang berpori, solid dan inert (Kralj dan Brecevic, 1992) dengan suatu senyawa pengemban yang dilarutkan dalam pelarut yang sesuai. Skema membran cair berpendukung dapat dilihat pada Gambar 4. Membran yang telah direndam berperan sebagai penghalang (barrier) antara fase sumber dan fase penerima yang diletakkan dalam kompartemen pada masing-masing sisi membran. Permeasi yang terjadi dapat dijelaskan sebagai suatu ekstraksi dan stripping dalam suatu proses dalam kondisi non kesetimbangan (Rumhayati, 2000).
Fase Sumber Fase Penerima
Fase Membran
Gambar 4. Membran Cair Berpendukung
(Kralj dan Brecevic, 1992)
c. Membran Cair Emulsi (Emulsion Liquid Membrane, ELM)
Membran cair emulsi sebenarnya adalah dua sistem emulsi, yaitu air dalam minyak dalam air (w/o/w). Dalam sistem membran cair emulsi w/o/w, fase minyak yang memisahkan fase sumber dan larutan penerima merupakan membran cairnya (Djunaidi, 2000 dalam Pudiastuti, 2004). Air dalam minyak didispersikan dengan pengadukan secara perlahan-lahan di fase sumber untuk membentuk emulsi ganda. Area antar-muka yang luas antara fase sumber dan globula emulsi, dan juga area permukaan fase stripping yang luas mempercepat proses transfer massa dalam sistem (Kralj dan Brecevic, 1992).
Skema membran cair emulsi dapat dilihat pada Gambar 5.
Fase Stripping Fase Membran
Fase membran Fase Penerima
Gambar 5. Membran Cair Emulsi
(Kralj dan Brecevic, 1992)
6. Transport Logam Melalui Membran Cair
Transport membran cair merupakan gabungan antara ekstraksi dan striping yang dilakukan dalam satu proses (Akhond, et al., 2002). Secara tradisional ekstraksi pelarut telah digunakan untuk pemisahan logam platina. Namun demikian ekstraksi cair-cair ini membutuhkan kuantitas pelarut dan ekstraktan dalam jumlah yang besar. Dalam beberapa kasus, pelarut bersifat toksik dan terkadang karsinogenik (Abbassapour dan Fariba, 1999). Dibandingkan dengan ekstraksi pelarut, sistem transport membran cair memiliki keuntungan bahwa jumlah pelarut, agen pengompleks (ligan) dan ion logam jauh lebih sedikit (Hiratani, et al., 1997). Menurut Gaikwad, (2003), keuntungan dari teknik
membran cair adalah: penggunaan pelarut yang sedikit, operasinya mudah dan bersifat kontinu, serta tahapannya sederhana.
Mekanisme transport ion logam terjadi sebagai berikut:
a) Ligan dan ion logam saling berada diantar muka fase sumber-fase membran setelah ligan melepaskan proton, kemudian diikuti pembentukan kompleks antara ligan dan ion logam di antar muka fase sumber-fase membran.
b) Didalam fase membran terjadi pelarutan dan mobilisasi dari kompleks ligan- logam yang berdifusi melalui membran menuju ke antar muka fase membran- fase penerima (Abbassapour dan Fariba, 1999).
c) Kompleks ligan-logam yang berada di antar muka fase membran-fase penerima menangkap proton dari fase penerima menjadi ligan bebas dan ion logam ke fase penerima berasosiasi dengan anion di fase penerima.
d) Ligan bebas terdifusi ke antar muka fase sumber-fase membran untuk memulai transport lagi (Umi, 2002).
Transport kation melalui membran cair yang mengandung ionofor (yang selektif terhadap ion logam) adalah salah satu metode yang paling efektif untuk pemisahan ion logam tertentu (Akhond, et al., 2002). Transport dalam membran cair dapat terjadi dengan cara :
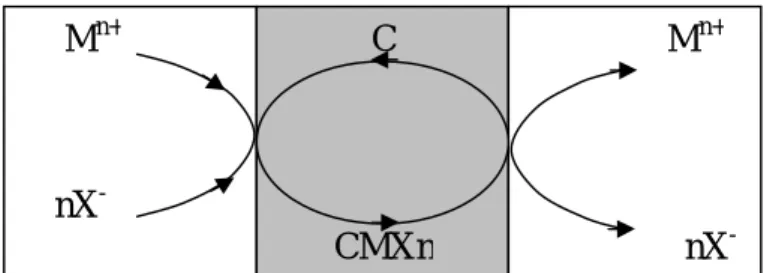
a) Transport serta (co-transport), dimana ion logam dan ion tanding tertransport dari fase sumber melalui membran cair menuju ke fase penerima. Jika senyawa carrier C adalah senyawa yang netral maka gaya dorong adalah gradien konsentrasi ion tanding, X-, misalnya NO3-
, Cl-, antara fase sumber dan fase penerima. Ion logam (Mn+) dan ion tanding akan membentuk kompleks dengan senyawa carrier.
Reaksi yang terjadi:
Mn+ + nX- + C(membran) CMXn(membran)
CMXn(membran) C(membran) + Mn+ nX-
Fase Sumber Fase Membran Fase Penerima
Gambar 6. Mekanisme Transport Serta.
(Kralj dan Brecevic, 1992)
Molekul senyawa carrier yang bebas berdifusi kembali ke antar muka fase sumber-membran, mengambil ion logam dan ion tanding lainnya dan proses terus berlanjut. Secara sederhana mekanisme transport serta diilustrasikan pada Gambar 6.
b) Transport tanding (Counter-transport), terjadi dengan adanya perbedaan konsentrasi counter-ion dimana suatu senyawa carrier asam, HC, melepaskan proton dan terbentuk kompleks MC dengan ion logam, M diantar muka fase sumber-membran dengan reaksi:
Mn+ + nHC(membran) MCn(membran) + nH+ MCn(membran) + nH+ nHC(membran) + Mn+
Fase Sumber Fase Membran Fase Penerima
Gambar 7. Mekanisme Transport Tanding
(Kralj dan Brecevic, 1992) Kompleks MCn berdifusi ke antar muka membran-fase penerima dan ion logam dilepas kembali ke fase penerima dan secara simultan mengambil proton dari fase penerima. Mekanisme transport tanding dapat dilihat pada
Mn+
nH+
nHC
MCn
Mn+
nH+ Mn+
nX-
-
C
CMXn
Mn+
nX-
Gambar 7. Gaya dorong dalam proses ini adalah perbedaan pH (gradien konsentrasi proton) antar fase sumber dan fase penerima (Bartsch, 1996 dalam Pudiastuti, 2004).
Dalam sistem transport membran-kation, tidak diperlukan counter anion untuk menyeimbangkan muatan positif, karena ionofor terdisosiasi (melepaskan proton) bertindak sebagai anion pada kompleksasi kation. Oleh karena itu kemampuan transport kation independen terhadap jumlah hidrogen dari counter anion. Transport melawan konsentrasi kation juga memungkinkan karena kation tertransfer oleh counter transport (transport tanding) dari proton (Akhond, et al, 2002).
7. Spektroskopi Serapan Atom (SSA) a). Prinsip Spektrofotometri
Spektroskopi serapan atom adalah suatu metode analisis yang cuplikannya diuapkan dalam nyala menjadi atom yang akan tereksitasi sambil menyerap radiasi elektromagnetik pada panjang gelombang tertentu. Metode ini sangat tepat untuk analisis analit pada konsentrasi rendah (Khopkar, 1990).
Unsur-unsur yang dapat ditentukan dengan SSA lebih dari 70 unsur (Shugar, 1996).
Prinsip spektrofotometri serapan atom adalah absorbsi cahaya oleh atom pada keadaan dasar. Atom-atom tersebut menyerap cahaya dan pada panjang gelombang yang spesifik, sesuai dengan jenis dan sifat unsurnya. Cahaya pada panjang gelombang ini mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom. Dengan absorpsi energi, satu atom pada keadaan dasar akan tereksitasi ke tingkat yang lebih tinggi. Atom tereksitasi ini akan mengemisikan radiasi resonansi kesemua arah pada panjang gelombang yang sesuai. Monokromator akan melewatkan radiasi ini. Kemonokromatisan cahaya dalam spektrofotometri serapan atom merupakan syarat utama.
Disamping itu kemudahan pelarutan atau peruraian sampel juga sangat menentukan keberhasilan analisis.
b). Komponen Utama Spektrofotometer Serapan Atom
Spektrofotometer serapan atom, terdiri atas 3 komponen utama (Khopkar, 1990), yaitu :
(i). Sumber Radiasi
Sumber radiasi dalam spektrofotometer serapan atom harus bersifat kontinu. Disamping itu sistem dengan penguraian optis yang sempurna juga sangat diperlukan agar diperoleh sumber sinar dengan garis absorbsi yang semonokromatis mungkin. Seperangkat sumber yang dapat memberikan ionisasi yang tajam dari suatu unsur dikenal dengan Hollow Cathode Lamp. Lampu ini memiliki dua elektroda, satu diantaranya berbentuk silinder dan terbuat dari unsur yang sama dengan yang dianalisis.
(ii). Unit Atomisasi
Atomisasi dilakukan baik dengan nyala atau tanpa nyala. Untuk mengubah unsur metalik menjadi uap atom diperlukan energi panas.
Temperatur harus benar-benar terkendali agar atomisasi sempurna dan unsur tidak mengalami ionisasi.
(iii). Sistem Pengukur Fotometrik.
Sistem pengukur fotometrik dalam spektrofotometer serapan atom terdiri atas 3 komponen (Khopkar, 1990) yaitu, monokromator, pemroses sinar, dan sistem pembacaan.
c). Hukum Lambert Beer
Untuk mengetahui kuantitas analit yang dianalisa, digunakan hukum Lambert-Beer :
A = Є.b.C………...………....(17) Dimana :
A = Aborbansi Analit
Є = Konstanta absorbansi molar b = Tebal cuvet
C = Konsentrasi
B. Kerangka Pemikiran
Metode transport membran cair memungkinkan terjadinya transport ion logam dari fase sumber ke fase penerima. Transport terjadi melalui difusi antar muka fase dengan mekanisme asam-basa Lewis. Ligan kopoli(eugenol-asam eugenoksi asetat) memiliki gugus aktif karboksilat dan hidroksi. Gugus ini bersifat proton terionisasi (proton-ionizable), yang akan melepaskan proton setelah terbentuknya kompleks. Atom O pada kedua gugus tersebut merupakan donor pasangan elektron yang baik dalam pembentukan kompleks khelat netral dengan logam melalui reaksi asam-basa lewis.
Karena transport terjadi terus-menerus secara kontinu maka pengadukan yang semakin lama dapat memberikan kesempatan bagi ion logam untuk lebih banyak berdifusi melalui fase membran dan berakhir dengan pelepasan ion logam di fase penerima. Dengan demikian jumlah ion logam yang tertransport juga semakin meningkat
Pelepasan ion logam dari dari fase membran ke fase penerima dipengaruhi oleh konsentrasi H+ serta jenis anion di fase penerima. Agar ion logam dalam fase penerima tidak dapat berdifusi kembali ke fase membran, konsentrasi H+ di fase penerima harus tinggi dengan demikian akan diperoleh ligan yang terprotonasi.
Ligan yang terprotonasi tidak dapat bereaksi dengan ion logam karena kemampunnya sebagai estraktan berkurang (Pudiastuti, 2004). Anion berfungsi sebagai basa lewis yang akan berkompetisi dengan ligan untuk menarik ion logam. Anion yang berbeda memiliki tingkat kebasaan yang berbeda pula, oleh karena itu kemampuannya untuk berinteraksi dengan ion logam (yang berlaku sebagai asam lewis) juga berbeda. Semakin tingggi tingkat kekuatan anion maka akan semakin kuat untuk menarik ion logam, hal ini berkaitan dengan gaya elektrostatik antara kation dan anion. Semakin kuat gaya elektrostatik antara kation dan anion, semakin dekat jarak kation dengan anion maka akan semakin stabil (Supriyanto, 2000 dalam Pudiastuti, 2004). Menurut Eckenfelder, Jr (2000), urutan kekuatan anion adalah: ClO4-
> SO42-
> NO3-
> Br- > HPO42-
> CO32-
> CN-
> NO2-
> Cl- > HCO3-
> OH-. Dengan demikian asam sebagai media penerima
disamping sebagai sumber ion hidrogen yang menggantikan ion logam juga dapat menarik ion-ion logam yang berdifusi ke fase penerima.
Ligan kopoli(eugenol-asam eugenoksi asetat) mempunyai kemampuan yang berbeda dalam hal selektivitas terhadap berbagai ion logam. Oleh karena itu perlu dilakukan uji selektivitas dari ligan kopoli(eugenol-asam eugenoksi asetat) terhadap berbagai ion logam lain.
C. Hipotesis
Berdasarkan kerangka pemikiran dapat diajukan hipotesis sebagai berikut:
1. Semakin lama waktu transport maka semakin banyak ion Cd(II) yang terekstraksi dari fase sumber ke fase penerima.
2. Jenis asam yang paling baik di fasa penerima pada transport logam Cd(II) adalah asam yang memiliki tingkat kekuatan anion yang tinggi.
3. Ligan kopoli(eugenol-asam eugenoksi asetat) memiliki selektivitas terhadap ion logam tertentu dalam transport membran cair.