UJI KINERJA PENGGUNAAN KITOSAN CuO ZEOLIT SEBAGAI ADSORBEN UNTUK MENURUNKAN
KADAR LOGAM BESI (Fe) DAN TIMBAL (Pb)
SKRIPSI
YUNI ISMAYANTI 140802033
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2019
UJI KINERJA PENGGUNAAN KITOSAN CuO ZEOLIT SEBAGAI ADSORBEN UNTUK MENURUNKAN
KADAR LOGAM BESI (Fe) DAN TIMBAL (Pb)
SKRIPSI
DIAJUKAN UNTUK MELENGKAPI TUGAS DAN MEMENUHI SYARAT MENCAPAI GELAR SARJANA SAINS
YUNI ISMAYANTI 140802033
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2019
i
PENGESAHAN SKRIPSI
Judul : Uji Kinerja Penggunaan Kitosan CuO Zeolit Sebagai Adsorben Untuk Menurunkan Kadar Logam Besi (Fe) Dan Timbal (Pb)
Kategori : Skripsi
Nama : Yuni Ismayanti
NIM : 140802033
Program Studi : Sarjana (S1) Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam (MIPA) Universitas Sumatera Utara
Disetujui di
Medan, September 2019
Ketua Program Studi, Pembimbing,
Dr. Cut Fatimah Zuhra, M.Si Prof. Dr. Harry Agusnar, M. Sc.
NIP. 197404051999032001 NIP.195308171983031002
PERNYATAAN ORISINALITAS
UJI KINERJA PENGGUNAAN KITOSAN CuO ZEOLIT SEBAGAI ADSORBEN UNTUK MENURUNKAN
KADAR LOGAM BESI (Fe) DAN TIMBAL (Pb)
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, September 2019
YUNI ISMAYANTI 140802033
iii
PENGHARGAAN
Bismillahirrahmanirrahim,
Puji dan syukur senantiasa penulis ucapkan kepada Allah SWT karena berkat rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi ini dengan baik. Dalam kesempatan ini penulis ingin menyampaikan terimakasih yang tak terhingga kepada kedua orang tua tercinta Bapak Bedjo Nurhasim dan Alm. Ibu Sutariyah, dan ketiga kakak penulis Yayuk Kurniawati, Mei Larasati, Amd dan Yuyun Irmawati, S.Pd yang dengan tulus mendoakan, menyayangi, menyemangati dan memberikan dukungan baik moril maupun materil terhadap penulis.
Terima kasih penulis sampaikan kepada Bapak Prof.Dr. Harry Agusnar, M.Sc selaku dosen Pembimbing yang telah memberi topik skripsi dan memotivasi penulis, terima kasih juga kepada Ibu Dr. Cut Fatimah Zuhra, M.Si dan Ibu Dr. Sovia Lenny, M.Si selaku ketua dan sekretaris Departemen Kimia FMIPA USU. Terima kasih juga kepada Bapak dan Ibu dosen yang telah memberikan ilmu yang sangat bermanfaat selama masa perkuliahan. Terima kasih teruntuk Yollanda Simbolon, yang selalu menyemangati, menyayangi, sabar dan memberikan motivasi serta memberi dukungan moril ataupun materil kepada penulis hingga terselesaikannya skripsi ini.
Untuk Yanita Utami Nasution dan teman teman Kimia stambuk 2014, serta adik-adik stambuk 2015, stambuk 2016, stambuk 2017 penulis terima kasih atas motivasi, semangat arahan, bantuan dan telah menjadi keluarga penulis selama ini.
Semoga Allah melindungi dan mengabulkan doa kita dan membalas kebaikan kalian kepada penulis, Aaamiin Ya Rabbal ‘Alamin.
Medan, September 2019
Yuni Ismayanti
UJI KINERJA PENGGUNAAN KITOSAN CuO ZEOLIT SEBAGAI ADSORBEN UNTUK MENURUNKAN
KADAR LOGAM BESI (Fe) DAN TIMBAL (Pb)
ABSTRAK
Telah dilakukan penelitian tentang penggunaaan kitosan dan zeolit komersial yang dimodifikasi menjadi kitosan CuO Zeolit sebagai adsorben untuk menurunkan kadar logam besi (Fe) dan logam timbal (Pb). Pada penelitian ini, didahului dengan pembuatan kitosan CuO dengan melarutkan kitosan komersial dan asam asetat 1%
serta dicampurkan dengan larutan Cu(NO3)2 0,5 M dengan rasio 2:1 lalu diteteskan kedalam larutan NaOH 2 M yang kemudian membentuk gel (bead) berwarna hitam.
Kitosan CuO yang telah dikeringkan dimasukkan ke dalam beaker glass kemudian ditambahkan dengan zeolit lalu ditambahkan 100 mL akuades dan 50 mL asam asetat 1%, kemudian diaduk hingga tercampur merata lalu dikeringkan. Setelah itu kitosan CuO yang dihasilkan dilakukan analisa gugus fungsi dengan menggunakan spektofotometer FTIR, kemudian dilakukan uji kuantitatif untuk penentuan kandungan logam Fe dan Pb sebelum dan sesudah diaktivasi dengan menggunakan metode spektrofotometri serapan atom dengan ƛ spesifik masing-masing 248,3 nm untuk logam besi (Fe) dan 217 nm untuk logam timbal (Pb). Hasil penelitian menunjukkan bahwa proses adsorpsi diperoleh persentase penyerapan logam Fe 73,98% dan Pb 58,05% pada waktu perendaman optimum selama 30 menit.
Kata kunci : adsorben, logam Fe, logam Pb, kitosan CuO, zeolit
v
PERFORMANCE TEST USING CHITOSAN CuO ZEOLIT AS AN ADSORBEN TO REDUCING IRON (Fe)
AND LEAD (Pb) METAL
ABSTRACT
A research chitosan and commercial zeolites modified into chitosan CuO Zeolite as an adsorbent to reduce levels of iron (Fe) and lead (Pb) metals. In this study, preceded by making chitosan CuO by dissolving commercial chitosan and 1% acetic acid and mixed with a solution of Cu (NO3)2 0.5 M at a ratio of 2: 1 then dripped into 2 M NaOH solution which then forms a colored gel (bead) black. The dried chitosan CuO was put into the beaker glass then added with zeolite then added 100 mL of distilled water and 50 mL of 1% acetic acid, then stirred until evenly mixed and then dried. After that, the chitosan CuO produced was analyzed by functional groups using FTIR spectrophotometer, then quantitative tests were carried out to determine Fe and Pb metal content before and after activation using atomic absorption spectrophotometri methods with specifics of 248.3 nm for ferrous metals (Fe) ) and 217 nm for lead metal (Pb). The results showed that the adsorption process obtained the percentage of Fe metal absorption of 73.98% and 58.05% Pb at the optimum immersion time for 30 minutes.
Keywords: adsorbent, Fe metal, Pb metal, chitosan CuO, zeolite.
DAFTAR ISI
Halaman
PENGESAHAN SKRIPSI i
PERNYATAAN ORISINALITAS ii
PENGHARGAAN iii
ABSTRAK iv
ABSTRACT v
DAFTAR ISI vi
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
DAFTAR SINGKATAN xii
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Pembatasan Masalah 3
1.4 Tujuan Penelitian 3
1.5 Manfaat Penelitian 4
1.6 Metodologi Penelitian
4 BAB 2 TINJAUAN PUSTAKA
2.1 Kitosan 5
2.1.2 Sumber dan Karakteristik Kitosan 6
2.1.3 Kegunaan Kitosan 6
2.1.3.1 Kitosan Sebagai Penyerap Logam Berat 7
2.2. Kitosan CuO 7
2.3. Zeolit 8
2.3.1 Sumber dan Aktivasi Zeolit 9
2.3.2 Sifat-Sifat Zeolit 10
2.3.3 Kegunaan Zeolit 11
2.4 Logam 12
2.4.1 Logam Timbal (Pb) 13
2.4.2 Logam Besi (Fe) 13
2.5 Adsorpsi 14
2.6 Instrumentasi Spektrofotometri Serapan Atom
15 BAB 3 METODE PENELITIAN
3.1 Waktu dan Tempat 18
vii
3.2.1 Alat Penelitian 18
3.2.2 Bahan Penelitian 19
3.3 Pembuatan Larutan Pereaksi 19
3.4 Pembuatan Kitosan CuO 20
3.5 Aktivasi Zeolit Alam 20
3.6 Pembuatan Kitosan CuO Zeolit Tidak Teraktivasi 21 3.7 Pembuatan Kitosan CuO Zeolit Teraktivasi 21 3.8. Penentuan Kadar Logam Besi (Fe) dengan
Spektrofotometri Serapan Atom (SSA) 21
3.8.1 Pembuatan Larutan Standar Besi (Fe) 100
ppm 21
3.8.2 Pembuatan Larutan Standar Besi (Fe) 10
ppm 21
3.8.3 Pembuatan Larutan Seri Standar Besi (Fe)
0,2; 0,4 ; 0,6 ; 0,8 ; dan 1 ppm 22 3.8.4 Pembuatan Kurva Standar Besi (Fe) 22 3.9 Penentuan Kadar Logam Timbal (Pb) dengan
Spektrofotometri Serapan Atom (SSA 22
3.9.1 Pembuatan Larutan Standar Timbal (Pb) 100 ppm
22 3.9.2 Pembuatan Larutan Standar Timbal (Pb)
10 ppm 22
3.9.3 Pembuatan Larutan Seri Standar Timbal
(Pb) 0,2 ; 0,4 ; 0,6 ; 0,8 ; dan 1 ppm 22 3.9.4 Pembuatan Kurva Standar Timbal (Pb) 23 3.10 Penentuan Waktu Kontak Optimum pada Kitosan
CuO Zeolit Teraktivasi dan Kitosan Zeolit Tidak
Teraktivasi 23
3.11 Bagan Penelitian 24
3.11.1. Pembuatan Pereaksi 24
3.11.1.1. Larutan asam asetat glasial 24
3.11.1.2 Larutan NaOH 2 M 24
3.11.1.3 Larutan CU(NO3)2.3H2O 25 3.11.1.4 Pembuatan Larutan Kitosan 25
3.12 Pembuatan Kitosan CuO 26
3.13 Aktivasi Zeolit Alam 26
3.14 Pembuatan Kitosan CuO Zeolit Tidak Teraktivasi 27 3.15 Pembuatan Kitosan CuO Zeolit Teraktivasi 28 3.16 Penentuan Wakti Kontak Optimum Pada Kitosan
CuO Zeolit Tidak Teraktivasi 29
BAB 4 HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian 31
4.1.1 Data Spektrum FT-IR 31
4.1.2 Logam Besi (Fe) 32
4.1.3 Pengolahan Data Logam Besi (Fe) 34
4.1.3.1 Penurunan Persamaan Garis Regresi
dengan Metode Least Square 34
4.1.3.2 Penentuan Koefisien Korelasi 35
4.1.4 Logam Timbal (Pb) 35
4.1.5 Pengolahan Data Logam Timbal (Pb) 37 4.1.5.1 Penurunan Persamaan Garis Regresi
dengan Metode Least Square 37
4.1.5.2 Penentuan Koefisien Korelasi 38 4.1.6 Data Persentase Penyerapan Konsentrasi Logam
pada Kitosan CuO Zeolit Tidak Teraktivasi dan Kitosan CuO Zeolit Teraktivasi dengan
menggunakan SSA (Penentuan Persen Adsorpsi)
39
4.2. Pembahasan 40
4.2.1. Analisa FTIR 40
4.2.2. Penentuan Adsorpsi Ion Logam Fe dan Pb dengan variasi Waktu Kontak Pada Kitosan CuO Zeolit Tidak Teraktivasi
Dan Kitosan CuO Zeolit Teraktivasi 41 BAB 5 KESIMPILAN DAN SARAN
5.1 Kesimpulan 43
5.2 Saran 43
DAFTAR PUSTAKA LAMPIRAN
ix DAFTAR TABEL
Nomor Tabel
Judul Halaman
2.1 Spesifikasi Mutu Kitosan 6
4.1 Data Spektrum FT-IR Kitosan CuO Zeolit TidakTeraktivasi
31 4.2 Data Spektrum FT-IR Kitosan CuO Zeolit Teraktivasi 32 4.3 Kondisi Alat Spektrofotmeter Serapan Atom (SSA)
Shimadzu AA-7000 Pada Absorbansi Larutan Seri Standar Logam Fe
33
4.4 Data Absorbansi Larutan Seri Standar Logam Fe 33 4.5 Penurunan Persamaan Garis Regresi Untuk Penentuan
Konsentrasi Logam Fe Berdasarkan Pengukuran Absorbansi Larutan Seri Standar Logam Fe
34
4.6 Kondisi Alat Spektrofotmeter Serapan Atom (SSA) Shimadzu AA-7000 Pada Absorbansi Larutan Seri Standar Logam Pb
36
4.7 Data Absorbansi Larutan Seri Standar Logam Pb 36 4.8 Penurunan Persamaan Garis Regresi Untuk Penentuan
Konsentrasi Logam Fe Berdasarkan Pengukuran Absorbansi Larutan Seri Standar Logam Pb
37
4.9 Data Persentase Peningkatan Konsentrasi Penyerapan Logam Pada Kitosan CuO Zeolit Sebelum dan Sesudah Diadsorpsi Pada Waktu 15 Menit
39
4.10 Data Persentase Peningkatan Konsentrasi Penyerapan Logam Pada Kitosan CuO Zeolit Sebelum dan Sesudah Diadsorpsi Pada Waktu 30 Menit
40
4.11 Data Persentase Peningkatan Konsentrasi Penyerapan Logam Pada Kitosan CuO Zeolit Sebelum dan Sesudah Diadsorpsi Pada Waktu 45 Menit
40
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Rangkaian Komponen Spektrofotometer Serapan Atom 16 4.1 Spektrum FT-IR kitosan CuO Zeolit Tidak Teraktivasi 31
4.2 Spektrum FT-IR kitosan CuO Zeolit Teraktivasi 32
4.3 Kurva Kalibrasi Larutan Seri Standar Logam Besi (Fe) 34 4.4 Kurva Kalibrasi Larutan Seri Standar Logam Timbal (Pb) 37
xi DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1 Zeolit dan Kitosan 49
2 Alat Spektrofotometer Serapan Atom Merk Shimadzu Tipe AA-7000
50
3 Spektrum FT-IR Kitosan CuO Zeolit Tidak Teraktivasi 51
4 Spektrum FT-IR Kitosan CuO Zeolit Teraktivasi 52
DAFTAR SINGKATAN
FT-IR = Fourier Transform – Infra Red SSA = Spektrofotometer Serapan Atom CuO = Tembaga (II) Oksida
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Kitosan merupakan suatu polimer yang bersifat polikationik. Keberadaan gugus hidroksil dan amino sepanjang rantai polimer mengakibatkan kitosan sangat efektif mengadsorpsi kation ion logam berat maupun kation dari zat-zat organik (protein dan lemak) (Sanjaya, 2007).
Kitosan dapat dibuat komposit dengan material anorganik untuk meningkatkan ketahanan fisiknya yang mudah larut atau membentuk gel pada suasana asam. Komposit kitosan dengan material anorganik diharapkan dapat bekerja dengan baik pada suasana asam dan mempunyai stabilitas yang tinggi. Komposit kitosan dengan bahan anorganik berpori berpotensi memberikan keuntungan dalam mekanisme adsorpsi.
Proses adsorpsi dapat terjadi dengan melibatkan gugus fungsi atau melibatkan pori atau keduanya menjadi sama-sama berperan dalam mekanisme adsorpsi.
Berbagai modifikasi kimia telah dilakukan untuk menghasilkan turunan kitosan ataupun komposit kitosan yang diharapkan dapat memperbaiki ketahanan, stabilitas dan kemampuan kitosan sebagai adsorben (Muhardi, 2018).
Selain kitosan, Zeolit pun telah banyak dimanfaatkan sebagai adsorben.
Zeolit merupakan salah satu bahan kekayaan alam yang sangat bermanfaat bagi industri kimia di Indonesia.
Zeolit ada dua macam, yaitu zeolit alam dan zeolit sintetik. Zeolit alam sudah banyak dimanfaatkan sehingga jumlahnya semakin berkurang. Umumnya zeolit alam digunakan untuk pupuk, penjernihan air, dan untuk dimanfaatkan sebagain adsorben.
Zeolit mempunyai beragam kegunaan, seperti pemantap tanah dibidang pertanian, penjernih air, penjernih limbah, dan pakan ternak (Kusnaedi, 2010).
Kitosan merupakan poli-aminosakarida yang memiliki gugus aktif amina bebas, gugus hidroksi primer dan gugus hidroksi sekunder yang berturut-turut berada pada atom C2, C6, dan C3. Kitosan dapat berinteraksi dengan zeolit melalui ikatan
hidrogen antara gugus amina dan hidroksi kitosan dengan gugus hidroksi aluminol dan silanol permukaan zeolit (Yuan et al., 2007).
Dalam komposit kitosan-zeolit, penutupan zeolit oleh rantai polimer kitosan bergantung pada rasio masa zeolit dan kitosan yang digunakan. Bertambahnya rasio massa zeolit yang digunakan menjadikan permukaan komposit kasar, terjadi agregasi zeolit dan terbentuk celah atau rongga kosong. Agregasi zeolit mengindikasikan bahwa masa kitosan tidak dapat mendispersi dan menutup zeolit secara efektif.
Sementara itu, bertambahnya rasio massa kitosan menjadikan morfologi komposit halus dan berkurangnya agregasi zeolit di permukaan komposit. Hal tersebut membuktikan bahwa rantai polimer kitosan mampu mendispersi dan melapisi zeolit lebih efektif (Sun et al., 2008).
Berdasarkan penelitian sebelumnya telah banyak diteliti tentang kitosan yang digunakan sebagai absorben (Sanjaya, 2007) melakukan penelitian tentang penyerapan logam Arsen (V) menggunakan komposit kitosan Cu(OH)2 dan CuO dengan daya serap 95% dan telah dilakukan preparasi karakterisasi kompleks kitosan hydrogel-tembaga(II) bahwa antara kitosan hydrogel dan tembaga(II) dapat terbentuk suatu senyawa kompleks (Muhadi, 2011).
(Silvia, 2017) telah melakukan penelitian menggunakan kitosan CuO sebagai adsorben untuk menurunkan kadar logam besi (Fe) dan zink (Zn) pada air danau toba, kecematan haranggaol, kabupaten simalungun, Sumatera Utara. Dimana kesimpulan yang didapat konsentrasi kadar logam berat tersebut turun menjadi 70,44% dan 96,98%.
(Anis, 2018) melakukan penelitian mengenai stabilitas kitosan yang akan dikompositkan dengan zeolit dalam bentuk beads dan pelet, dimana komposit dalam bentuk pelet dan pelet yang terikat silang mwmiliki stabilitas termal yang lebih baik dibanding dengan bentuk beads dan beads yang terikat silang.
Dengan melihat berbagai penelitian yang telah dilakukan sebelumnya bahwa kitosan dapat dibuat dalam bentuk bead, pelet dan juga gel yang dapat mengadsorpsi terhadap ion logam. Maka pada penelitian ini akan dilakukan modifikasi kitosan menjadi kitosan tembaga (II) oksida zeolit sebagai adsorben untuk menurunkan kadar logam besi (Fe) dan timbal (Pb).
3
1.2 Permasalahan
Berdasarkan uraian latar belakang masalah sebelumnya, adapun beberapa hal yang menjadi masalah dalam penelitian ini adalah :
1. Bagaimana perbandingan daya serap kitosan CuO zeolit teraktivasi dengan kitosan CuO zeolit tidak teraktivasi terhadap logam Fe (besi) dan Pb (timbal)?
2. Bagaimana waktu kontak optimum penyerapan logam Fe dan Pb pada kitosan CuO zeolit teraktivasi dan kitosan CuO zeolit tidak teraktivasi?
1.3 Pembatasan Masalah
Dalam penelitian ini masalah dibatasi pada :
1. Kitosan dan zeolit yang digunakan merupakan kitosan dan zeolit laboratorium penelitian FMIPA USU
2. Penelitian ini merupakan penelitian skala laboratorium
3. Modifikasi kitosan dibuat menjadi kitosan CuO dengan melakukan perendaman kitosan pada larutan Cu(NO3)2
4. Penelitian dilakukan hanya dengan melarutkan kitosan CuO dengan penambahan asam asetat 1% dan aquabides yang kemudian dicampurkan dengan zeolit teraktivasi dan zeolit tidak teraktivasi
5. Uji analisa gugus fungsi dengan menggunakan Spektrofotometer FTIR
6. Logam-logam yang diteliti dibatasi pada penentuan logam Besi (Fe) dan Timbal (Pb)
7. Penyerapan logam Fe dan Pb dilakukan berdasarkan perbandingan variasi waktu kontak dengan menggunakan alat Spektrofotometri Serapan Atom (SSA)
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah :
1. Untuk menentukan perbandingan daya serap kitosan CuO zeolit teraktivasi dengan kitosan CuO zeolit tidak teraktivasi terhadap logam Fe (besi) dan Pb (timbal)?
2. Untuk menentukan waktu kontak optimum penyerapan logam Fe dan Pb pada kitosan CuO zeolit teraktivasi dan kitosan CuO zeolit tidak teraktivasi?
1.5 Manfaat Penelitian
Hasil yang diperoleh dari penelitian ini diharapkan dapat menjadi salah satu informasi ilmiah bahwa kitosan CuO zeolit mampu menyerap logam berat berdasarkan waktu kontak optimum.
1.7 Metodologi Penelitian
Penelitian ini dilakukan secara eksperimen laboratorium. Dengan cara pembuatan kitosan CuO zeolit yang dilakukan dengan cara melarutkan asam asetat 1% lalu dicampurkan dengan larutan Cu(NO3)2 0,5M dengan rasio 2:1 dan selanjutnya diteteskan dalam larutan NaOH 2M hingga terbentuk butiran. Kemudian dicuci dengan aquades dan dikeringkan. Kitosan CuO diencerkan dengan asam asetat 1% dan akuabides lalu ditambahkan zeolit teraktivasi dan zeolit tidak teraktivasi.
Kemudian dilakukan uji analisa gugus fungsi dengan menggunakan spektrofotometer FTIR. Dan uji kuantitatif untuk menentuan kandungan logam Fe sebelum dan sesudah penyerapan dilakukan dengan metode SSA dengan λspesifik = 248,3 nm. Dan uji kuantitatif untuk penentuan kandungan logam Pb sebelum dan sesudah penyerapan dilakukan dengan metode SSA dengan λspesifik = 217 nm
BAB 2
TINJAUAN PUSTAKA
2.1 Kitosan
Kitosan merupakan biopolimer polikationik yang mempunyai kemampuan mengikat beberapa logam dan merupakan polimer poliamina berbentuk linier (Cahyaningrum., 2008). Kitosan mengandung gugus amina bebas yang memberikan karakteristik sebagai penukar ion dan pembentukan ion kompleks. Keberadaan gugus amina tersebut menyebabkan kitosan mudah larut dalam media asam. Kitosan dapat dibuat komposit dengan material anorganik untuk meningkatkan ketahanan fisiknya yang mudah larut atau membentuk gel pada suasana asam. Komposit kitosan dengan material anorganik diharapkan dapat bekerja dengan baik pada suasana asam dan mempunyai stabilitas yang tinggi. Komposit kitosan dengan bahan anorganik berpori berpotensi memberikan keuntungan dalam mekanisme adsorpsi
Pada proses pembuatan kitosan dilakukan tahap demineralisasi terlebih dahulu dikarenakan mineral membentuk pelindung yang keras pada kulit udang.
Umumnya mineral lebih keras dibandingkan protein, sehingga dengan menghilangkan mineral terlebih dahulu, tahap deproteinasi dapat lebih optimal menghilangkan protein karena pelindung yang terbuat dari mineral telah hilang (Puspawati, 2010).
Proses demineralisasi dilakukan dengan menambahkan HCl 1,25 N untuk mengurangi kadar mineral (CaCO3) yang terkandung dalam kulit udang sehingga diperoleh kitin. Terjadinya proses pemisahan mineral ditunjukkan dengan terbentuknya gas CO2 berupa gelembung udara pada saat larutan HCl ditambahkan ke dalam sampel. Reaksi yang terjadi adalah:
CaCO3(s) + 2HCl(l) CaCl2(s) + H2O(l) + CO2(g)
Kitin yang telah diperoleh selanjutnya dilakukan proses deproteinasi untuk menghilangkan protein dan deasetilasi untuk menghilangkan gugus asetil pada kitin dengan menggunakan larutan NaOH dan diikuti dengan pemanasan. Proses deasetilasi dengan menggunakan alkali pada suhu tinggi akan menyebabkan terlepasnya gugus asetil dari molekul kitin. Gugus amida pada kitin akan berikatan
dengan gugus hidrogen yang bermuatan positif sehingga membentuk gugus amina bebas –NH2 (Puspawati, 2010).
2.1.2 Sumber dan Karakteristik Kitosan
Kitosan merupakan deasetilasi kitin pada hewan avertebrata laut, darat, dan jamur dari genus Mucor, Phycomyces, dan Saccaromyces (Kumar, 2004).
Karakteristik dari kitosan diantaranya struktur yang tidak teratur, bentuknya kristalin atau semi kristalin. Selain itu dapat juga berbentuk padatan amorf berwarna putih dengan stuktur kristal tetap dari bentuk awal kitin murni. Kitosan mempunyai rantai yang lebih pendek daripada rantai kitin. Kelarutan kitosan dalam larutan asam serta viskositas larutannya tergantung dari derajat deastelasi dan derajat degradasi polimer. Karakteristik kitosan berdasarkan standar mutu yang ditetapkan Protan Laboratories dapat dilihat pada tabel 2. 1.
Tabel 2.1 Spesifikasi mutu kitosan
Jenis Organisme Kandungan Kitosan
Ukuran partikel Serbuk sampai bubuk
Kadar air ≤ 10%
Kadar abu ≤ 2%
Warna larutan Jernih
Derajat deasetilasi ≥ 70%
Viskositas (cPs) < 200
Rendah < 200
Medium 200 - 799
Tinggi 800 - 2000
Sangat tinggi > 2000
Sumber: Protan Laboratories, 1992.
2.1.3 Kegunaan Kitosan
Kitosan telah dimanfaatkan dalam berbagai bidang biokimia, obat-obatan, farmakologi, pertanian, pangan dan gizi, mikrobioligi, penanganan air limbah serta keperluan industri, seperti industri kertas dan tekstil sebagai zat aditif, industri pembungkus makanan berupa film khusu, industri cat sebagai koagulan, pensuspensi,
7
dan flokulasi, serta industri makanan sebagai aditif dan penghasil protein tunggal (Suptijah, 1992).
Kitosan juga merupakan bahan polimer yang mudah dibakar tanpa meninggalkan sisa-sisa. Jika logam berat mudah diserap oleh kitosan yang kemudian mengeluarkan logam yang terserap dengan cara membakar ini adalah cara yang paling ekonomis tanpa memerlukan elusi lagi. Oleh karena itu kitosan sangat baik untuk menurunkan kandungan ion logam pada air limbah industri. (Oguntimian et al.
2002).
2.1.3.1 Kitosan Sebagai Penyerap Logam Berat
Dengan aplikasi terbaru tersebut kitosan telah membawa keuntungan yang sangat signifikan. Salah satu pemanfaatan kitosan dalam bidang lingkungan tersebut adalah sebagai adsorben atau atom penyerap logam berat, seperti timbal (Pb), krom (Cr), dan raksa (Hg) yang terdapat pada air yang tercemar (Sry et al, 2013).
Kitosan telah digunakan secara meluas sebagai penukar kation dengan cara pengompleksan pada perawatan air limbah. Kitosan dikenal juga sebagai penghelat logam-logam beracun. Serbuk atau larutan kitosan dapat menghilangkan atau mengurangi logam atau ion logam yang terdapat dalam air sungai, air laut dan air limbah (Muzarelli, 1985).
2.2. Kitosan CuO
Nanopartikel CuO dengan berbagai morfologi telah dikembangkan dengan banyak metode seperti dengan oksidasi tembaga pada suhu yang tinggi, sebaliknya misel, template surfaktan, reaksi keadaan padat, mhidrotermal dan metode dekomposisi`resi termal. Proses imobilisai CuO terhadap kitosan menyelesaikan ingatan dan digunakan ulang pembatasan CuO untuk menghilangkan kontamin yang diserap oleh kitosan insitu tanpa penggunaan asam atau basa dan menghasilkan polutan sekunder. Dalam studi ini, dilakukan sintesis sebuah material kitosan-CuO multifungsi untuk memenuhi keutuhan adsorpsi yang tinggi, mudah dipisahkan, dan juga hemat biaya. Kitosan-CuO disintesis dengan metode presipitasi yang dapat dikarakterisasi dengan FTIR, XRD, potensial zeta, dan TEM, (Haldorai, 2013).
2.3. Zeolit
Zeolit merupakan kristal alumina silikat terhidrasi yang mengandung kation alkali atau alkali tanah berbentuk kerangka tiga dimensi, bersifat asam dan mempunyai pori yang berukuran molekul. Rumus molekul empiris zeolit adalah :
M2n(Al2O3.ySiO2)wH2O
Dimana M = kation alkali tanah atau alkali, n = valensi logam alkali dan x, y adalah bilangan tertentu. (Saviano, 2013).
Zeolit terdiri dari 3 komponen yaitu kation yang dapat dipertukarkan, kerangka alumina silikat dan kandungan air. Kandungan air berubah-ubah tergantung dari sifat kation-kation yang ditukar dan kondisi kristalisasi. Air dan kation yang ada di dalam rongga zeolit dapat disubstitusikan dengan molekul lain. Zeolit merupakan mineral berpori dan memiliki sifat yang sama dengan mineral silika lainnya. Jika terdapat beberapa interaksi molekul dengan zeolit. Mekanisme interaksi molekul yang terjadi bisa secara penyerapan fisika (gaya Van der Waals), penyerapan kimia (gaya elektrostatik), ikatan hidrogen dan pembentukan kompleks koordinasi.
Efektivitas penyerapan bergantung pada sifat spesies yang diserap, kemampuan pertukaran ion, keasaman padatan zeolit dan kelembaban sistem. Zeolit dengan rongga-rongga molekulnya mempunyai gugus aktif di dalam saluran antar kristal sehingga dapat berlaku sebagai pengemban katalis.
Zeolit mempunyai kegunaan yang luas dalam bidang agrikultura, holtikultura, rumah tangga, industri, pengolahan air dan pengolahan air limbah. Zeolit memiliki luas area yang tinggi, ukuran pori tertentu, kemampuan sebagai penyaring molekuler, dan bersifat asam. Luas permukaan aktif zeolit mencapai 200 m2/gram zeolit (Vyas, 2004).
Zeolit merupakan suatu mineral berupa kristal silika alumina yang terdiri dari tiga komponen yaitu kation yang dapat dipertukarkan, kerangka alumina silikat dan air. Air yang terkandung dalam pori tersebut dapat dilepas dengan pemanasan pada temperatur 300 hingga 400 oC. Pemanasan pada temperatur tersebut air dapat keluar dari pori-pori zeolit, sehingga zeolit dapat berfungsi sebagai penyerap gas atau cairan. (Halimantun, 1992)
Jumlah air yang terkandung dalam zeolit sesuai dengan banyaknya pori atau volume pori. Zeolit banyak ditemukan dalam batuan kerangka dasar struktur zeolit
9
terdiri dari unit-unit tetrahedral AlO42-
dan SiO4-
yang saling berhubungan melalui atom O dan di dalam struktur, Si4+ dapat diganti dengan Al3+ . Ikatan Al-O-Si membentuk struktur kristal sedangkan logam alkaliatau alkali tanah merupakan sumber kation yang dapat dipertukarkan (Sutarti,1994).
2.3.1 Sumber dan Aktivasi Zeolit
Zeolit terdapat secara alami di permukaan tanah. Saat ini banyak jenis zeolit alam yang telah ditemukan dan dikelompokkan berdasarkan kesamaan strukturnya.
Meskipun zeolit sintetis juga telah banyak diproduksi, namun zeolit alam tetap mempunyai peranan penting karena ketersediaannya yang melimpah di alam, khususnya di Indonesia (Senda., 2006).
Zeolit dialam banyak ditemukan di India, Siprus, Jerman, dan Amerika Serikat, serta banyak pula di Indonesia yang daerahnya memiliki gunung berapi.
Mineral zeolit telah dikenal sejak tahun 1756 oleh Cronstedt ketika menemukan Stilbit yang bila dipanaskan seperti batuan mendidih (boiling stone) karena dehidrasi molekul air yang dikandungnya. Pada tahun 1954, zeolit diklasifikasikan sebagai golongan mineral tersendiri, yang saat itu dikenal sebagai molecular sieve materials.
(kusnaedi., 2010)
Berbeda dengan zeolit sintetis yang strukturnya dapat diprediksi dari senyawa penyusunnya, zeolit alam mempunyai struktur yang tidak selalu sama, tergantung pada kondisi pembentukannya di alam. Oleh karena itu, pada penggunaan zeolit alam sebagai adsorben dibutuhkan proses aktivasi. Proses aktivasi ini diperlukan untuk meningkatkan sifat khusus zeolit dan menghilangkan unsur pengotor (Rosita dkk., 2004). Proses aktivasi juga dapat merubah jenis kation, perbandingan Si/Al serta karakteristik zeolit agar sesuai dengan bahan yang akan diserap.
Zeolit alam adalah zeolit yang ditambang langsung dari alam. Dengan demikian harganya jauh lebih murah daripada zeolit sintetis. Zeolit alam merupakan mineral yang jumlahnya banyak tetapi distribusinya tidak merata, seperti klinoptilolit, mordenit, phillipsit, chabazit dan laumontit. Namun zeolit alam memiliki beberapa kelemahan, di antaranya mengandung banyak pengotor seperti Na, K, Ca, Mg dan Fe serta kristalinitasnya kurang baik. Keberadaan pengotor- pengotor tersebut dapat mengurangi aktivitas dari zeolit Untuk memperbaiki karakter
zeolit alam sehingga dapat digunakan sebagai katalis, absorben, atau aplikasi lainnya, biasanya dilakukan aktivasi dan modifikasi terlebih dahulu.
Selain untuk menghilangkan pengotor-pengotor yang terdapat pada zeolit alam, proses aktivasi zeolit juga ditujukan untuk memodifikasi sifat-sifat dari zeolit, seperti luas permukaan dan keasaman. Luas permukaan dan keasaman yang meningkat akan menyebabkan aktivitas katalitik dari zeolit meningkat. Salah satu kelebihan dari zeolit adalah memiliki luas permukaan dan keasaman yang mudah dimodifikasi (Yuanita, 2009).
Secara umum, ada tiga proses aktivasi yang bisa dilakukan terhadap zeolit alam, yaitu aktivasi secara fisis dengan pemanasan, aktivasi secara kimia dengan asam dan aktivasi secara kimia dengan basa. Proses aktivasi dengan panas dapat dilakukan pada suhu antara 200-4000C selama beberapa jam. Sementara aktivasi dengan basa dapat dilakukan dengan larutan NaOH, dimana penurunan rasio Si/Al akan terjadi pada aktivasi dengan pH tinggi (Jozefaciuk, 2002).
Aktivasi zeolit alam Turki dengan menggunakan larutan HCl pada berbagai konsentrasi dan suhu memberikan hasil bahwa aktivasi dengan HCl menyebabkan terjadinya proses dealuminasi zeolit (Ozkan, 2005). Dari proses aktivasi zeolit baik secara asam maupun basa, diperoleh hasil bahwa zeolit yang diaktivasi dengan basa akan menjadi lebih polar bila dibandingkan dengan zeolit yang diaktivasi dengan asam (Jozefaciuk, 2002).
Perlakuan dengan asam terhadap zeolit juga terbukti akan menyebabkan zeolit menjadi lebih hidrofob sehingga daya adsorpsinya terhadap air akan berkurang (Sumin dkk., 2009). Semakin tinggi konsentrasi asam yang digunakan maka daya adsorpsi zeolit terhadap uap air menjadi semakin kecil ( Ozkan, 2005)
2.3.2 Sifat-Sifat Zeolit
Zeolit mempunyai beberapa sifat, diantaranya :
1. Dehidrasi : Sifat dehidrasi dari zeolit berpengaruh terhadap sifat adsorbsi. Jumlah molekul air sesuai dengan pori-pori kristal zeolit bila dipanaskan.
2. Adsorbsi : Dalam keadaan normal ruang hampa dalam kristal zeolit terisi oleh molekul air yang bila dipanaskan pada suhu 300 - 4000C maka air
11
tersebut akan keluar sehingga zeolit dapat berfungsi sebagai penyerap gas atau cairan.
3. Penukar Ion : Ion-ion pada rongga atau kerangka elektrolit berguna untuk menjaga penetralan zeolit.
4. Katalis : Zeolit merupakan pengemban katalis yang baik karena mempunyai pori- pori yang banyak dengan luas permukaan maksimum.
5. Penyaring atau Pemisah : Zeolit dapat memisahkan molekul gas atau zat lain dari suatu campuran tertentu karena mempunyai ruang hampa yang cukup besar. Volume dan ukuran garis tengah ruang hampa dan kisi-kisi kristal ini menjadi dasar kemampuan untuk bertindak sebagai penyaring molekul. (Anggoro,. 2017)
2.3.3 Kegunaan Zeolit
Zeolit telah banyak digunakan secara luas, yaitu : a. Peternakan
Penggemukan, kesehatan kandang, penambah ketahanan terhadap penyakit, penyerap kontaminan.
b. Pertanian
Pupuk, peningkatan produksi, penyerap logam berat dalam tanah, perantara herbisida,fungisida.
c. Kedokteran/kesehatan
Kedokteran gigi : tapal gigi, resin gigi, semen gigi, mahkota gigi.
Kesehatan : penghilang bau nafas, penanganan luka bakar.
d. Bahan bangunan
Semen, agregat ringan, penyerap air/zat pengotor.
e. Lingkungan
Pengolahan air/penyerap kotoran, penyerap limbah radioaktif, penyerap polutan udara, pengkayaan O2 untuk udara di ruangan.
f. Industri
1) Industri kertas : bahan pengisi, bahan penyerap tinta, meningkatkan ketahanan
terhadap panas, sinar dan asam.
2) Industri ban : meningkatkan modulus elastisitas, mencegah polimerisasi pada proses vulkanisasi
3) Industri sabun : penyusun detergen, penurun kesadahan air.Industri minyak bumi/ gas alam : penyerap CO2, H2O, H2S dalam gas alam, katalisator (alkilasi, isomerisasi, cracking, aromatisasi dll), pemisah/pengering, alkilasi (McKetta, J.1981).
2.4 Logam
Logam berat merupakan zat pencemar yang memiliki efek berbahaya karena sifatnya yang tidak dapat diuraikan secara biologis dan stabil. Ada dua hal yang menyatakan logam berat termasuk sebagai pencemar berbahaya, yaitu tidak dihancurkan oleh mikroorganisme yang hidup di lingkungan dan terakumulasi dalam komponen-komponen lingkungan terutama air dengan membentuk komplek bersama bahan anorganik secara adsorpsi dan kombinasi (Ridhowati, 2013).
Logam berat yang ditemukan di alam, diketahui merupakan penyebab sakitnya seseorang, jika terdapat dalam kadar yang cukup tinggi. Unsur logam di alam terdapat dalam kadar tinggi atau telah melebihi ambang batas dalam siklusnya, unsur tersebut menjadi polutan yang potensial (Khan et al., 2009).
Diantara logam tersebut adalah : Ag, As, Au, B, Bi, Cd, Co, Cr, Cu, Fe, Hg, Mn, Mo, Pb, Sb dan Zn. Dari sejumlah logam tersebut di atas, beberapa unsur telah banyak dipelajari secara insentif, antara lain Cu, Hg dan Pb. Hal ini mengingat bahaya yang ditimbulkan akibat toksisitasnya(Arisandi et al., 2012).
Kontaminasi logam berat di lingkungan merupakan salah satu masalah besar dunia saat ini. Ion-ion logam berat yang mencemari lingkungan, sebagian besar terbawa melalui makanan. Proses ini akan lebih cepat bila memasuki tubuh manusia melalui rantai makanan. Apabila suatu logam terakumulasi pada jaringan hewan dan tumbuhan yang kemudian di konsumsi oleh manusia, tentunya manusia sebagai rantai makanan tertinggi pada piramida makanan maka dalam tubuhnya akan terakumulasi logam berat tersebut. Logam berat yang terakumulasi dalam tubuh manusia dapat menghambat pertumbuhan dan perkembangan tubuh, menimbulkan cacat fisik, menurunkan kecerdasan, melemahkan syaraf, dan berpengaruh ketulang (Rafly., 2016).
13
Logam berat masih termasuk golongan logam dengan kriteria yang sama dengan logam-logam lain. Perbedaannya terletak dari pengaruh yang dihasilkan bila logam berat ini berikatan atau masuk kedalam tubuh organisme hidup. Sebagai contoh, bila unsur logam Fe (besi) masuk kedalam tubuh, meski dalam jumlah agak berlebihan, biasanya tidaklah menimbulkan pengaruh yang buruk terhadap tubuh.
Karena unsur Fe (besi) dibutuhkan dalam darah untuk mengikat oksigen. Sedangkan unsur logam berat baik itu logam berat beracun yang dipentingkan seperti, Pb (timbal) dan Cu (tembaga), bila masuk kedalam tubuh dalam jumlah berlebihan akan menimbulkan pengaruh-pengaruh buruk terhadap fungsi fisiologis tubuh. Jika yang masuk kedalam tubuh organisme hidup adalah unsur logam berat beracun seperti Hg atau disebut juga air raksa, maka dapat dipastikan bahwa organisme tersebut akan langsung keracunan. (Khusnul, 2016).
2.4.1 Logam Timbal (Pb)
Timbal (Pb) merupakan logam berat yang bersifat toksik yang berasal dari gas hasil pembuangan kendaraan bermotor dan industri. Pb terdapat dalam udara, air dan tanah. Pb dapat menyebabkan berbagai penyakit jika kadarnya dalam tubuh melebihi ambang batas. Penggunaan senyawa Pb secara luas untuk bahan penolong dalam proses produksi bahan bakar bensin karena dapat meningkatkan nilai oktan bahan bakar sekaligus berfungsi mencegah terjadinya ledakan saat berlangsungnya pembakaran dalam mesin (Arisandi et al., 2012). Bagi manusia, termakannya senyawa timbale dalam konsentrasi tinggi, dapat mengakibatkan gejala keracunan timbale seperti iritasi gastrointestinal akut, rasa logam pada mulut, muntah, sakit perut dan diare (Panjaitan, 2009).
Timbal merupakan salah satu logam berat paling berbaya dari unsur-unsur zat pencemar. Daya racun timbal yang akut pada perairan alami menyebabkan kerusakan hebat pada ginjal, sistem reproduksi, hati dan otak, serta sistem syaraf sentral, dan bisa menyebabkan kematian (Rukaesih, 2004).
2.4.2 Logam Besi (Fe)
Besi atau ferrum (Fe) adalah salah satu logam yang paling banyak dijumpai di kerak bumi, metal berwarna putih keperakan, liat dan dapat dibentuk. Di alam
didapat sebagai hematite. Secara kimia besi merupakan logam yang cukup aktif, hal ini karena besi dapat bersenyawa dengan unsur-unsur lain. Salah satu kegunaan besi adalah sebagai campuran untuk membuat paduan logam, misalnya untuk membuat baja, besi tempa, besi tuang dan lain-lain yang banyak digunakansebagai bahan bangunan, peralatan-peralatan logam, rangka kenderaan dan lainnya (Apriani, 2011)
Besi merupakan logam dalam kelompok makro mineral di dalam kerak bumi, tetapi termasuk kelompok mikro dalam sistem biologi. Logam ini mungkin logam yang pertama ditemukan dan digunakan oleh manusia sebagai alat pertanian. Pada sistem biologi seperti hewan, manusia, dan tanaman, logam ini bersifat esensial, kurang stabil dan secara perlahan berubah menjadi fero (Fe 2+) atau feri (Fe3+) (Darmono, 2001).
2.5 Adsorpsi
Adsorpsi merupakan proses pelekatan molekul pada permukaan adsorben.
Suatu molekul atau partikel yang melekat pada adsorben disebut dengan adsorbat.
Adsorpsi bisa digunakan dalam proses penghilangan zat warna, pigmen, virus, bakteri, partikel koloid dan juga untuk mengontrol nilai BOD. Mekanisme adsorpsi terbagi menjadi dua, yaitu proses fisika dan kimia. Adsorpsi secara fisika terjadi ketika molekul cairan atau gas mencapai permukaan suatu adsorben, diikuti dengan terjadinya reaksi kimia pada waktu yang sama. Adsorpsi secara kimia terjadi ketika komponen kimia diproduksi dari reaksi antara molekul adsorbat dan adsorben. Proses ini membutuhkan energi dari komponen kimia yang baru pada permukaan adsorben.
Adsorpsi bisa terjadi secara pasif pada air.Beberapa faktor yang mempengaruhi daya serap adsorpsi yaitu:
1. Sifat adsorben
Adsorpsi secara umum terjadi pada semua permukaan, namun besarnya ditentukan oleh luas permukaan adsorben yang kontak dengan adsorbat. Luas permukaan adsorben sangat berpengaruh terhadap proses adsorpsi. Adsorpsi merupakan suatu kejadian permukaan sehingga besarnya adsorpsi sebanding dengan luas permukaan.
Semakin banyak permukaan yang kontak dengan adsorbat maka akan semakin besar pula adsorpsi yang terjadi.
15
2. Sifat serapan
Adsorpsi akan bertambah besar sesuai dengan bertambahnya ukuran molekul serapan dari struktur yang sama. Adsorpsi juga dipengaruhi oleh gugus fungsi, posisi gugus fungsi, ikatan rangkap, struktur rantai dari senyawa serapan
3. Temperatur
Faktor yang mempengaruhi temperatur proses adsorpsi adalah viskositas dan stabilitas termal senyawa serapan. Jika pemanasan tidak mempengaruhi sifat-sifat senyawa serapan, seperti terjadi perubahan warna maupun dekompisisi, maka perlakuan dilakukan pada titik didihnya. Untuk senyawa volatil, adsorpsi dilakukan pada temperatur kamar atau bila memungkinkan pada temperatur lebih kecil.
4. pH (derajat keasaman)
Untuk asam-asam organik adsorpsi akan meningkat bila pH diturunkan, yaitu dengan penambahan asam-asam mineral. Hal ini disebabkan karena kemampuan asam mineral untuk mengurangi ionisasi asam organik tersebut. Sebaliknya bila pH asam organik dinaikkan, yaitu dengan menambahkan alkali, adsorpsi akan berkurang sebagai akibat terbentuknya garam.
5. Waktu Kontak
Suatu adsorben yang ditambahkan ke dalam suatu cairan membutuhkan waktu untuk mencapai kesetimbangan. Waktu yang dibutuhkan berbanding terbalik dengan jumlah adsorben yang digunakan. Selain ditentukan oleh dosis adsorben, pengadukan juga mempengaruhi waktu singgung. Pengadukan dimaksudkan untuk memberi kesempatan pada partikel adsorben untuk bersinggungan dengan senyawa serapan.
Untuk larutan yang mempunyai viskositas tinggi, dibutuhkan waktu singgung yang lebih lama (Aryanti, 2011)
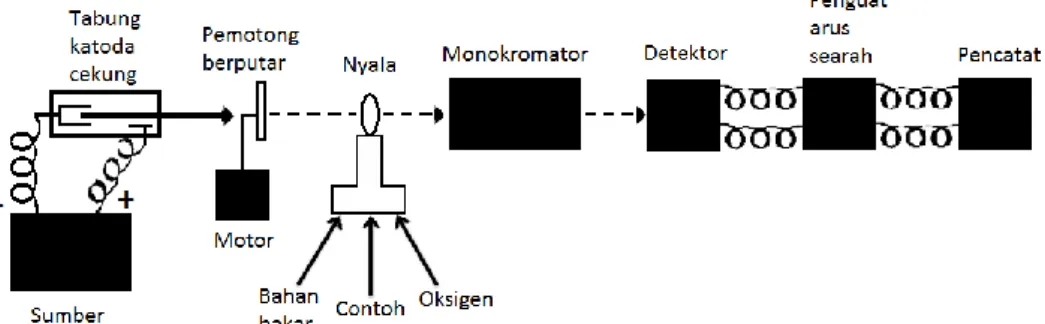
2.6 Instrumentasi Spektrofotometri Serapan Atom
Spektrofotometri Serapan Atom (SSA) adalah suatu metode atau cara analisis secara kuantitatif menggunakan instrumen spektrofotometer serapan atom. Alat spektrofotometer serapan atom berprinsip pada penyerapan cahaya oleh atom. Atom- atom menyerap cahaya pada panjang gelombang tertentu tergantung pada sifat-sifat unsurnya. Penyerapan tersebut menyebabkan tereksitasinya atom ke tingkat energi yang lebih tinggi. Prinsip kerja metode ini mirip dengan metode fotometri nyala
tetapi sumber energinya berupa lampu katode berlubang (hollow cathode lamp) sedang nyala pembakar berguna untuk mengaktifkan atom-atom logam sebelum menyerap energi. Karena itu, dengan metode ini hampir semua atom logam yang terdaftar dalam sistem periodik dapat ditentukan konsentrasinya.
Gambar 2.1 Rangkaian Komponen Spektrofotometer Serapan Atom
Cuplikan yang diukur dalam SSA adalah berupa larutan, biasanya air sebagai pelarutnya. Larutan cuplikan tersebut mengalir ke dalam ruang pengkabutan, karena terisap oleh aliran gas bahan bakar dan oksigen yang cepat. Berbeda dengan spektroskopi sinar tampak, metode ini tidak mempedulikan warna larutan, sedangkan larutan cuplikan diatomisasi dahulu.
1. Sumber Radiasi
Suatu sumber radiasi yang digunakan harus memancarkan spektrum atom dari unsur yang ditentukan. Spektrum yang dipancarkan harus terdiri dari garis tajam yang mempunyai setengah lebar yang sama dengan garis serapan yang dibutuhkan oleh atom – atom dalam contoh. Untuk penetapan apa saja yang diminta, lampu katoda berongga yang digunakan mempunyai sebuah katoda pemancar yang terbuat dari unsur yang sama yang akan dipelajari dalam nyala ini
2. Tempat sampel
Sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu dengan nyala (flame) dan dengan tanpa nyala (flameless) (Rohman, 2007).
17
3. Monokromator
Monokromator berfungsi untuk memisahkan garis-garis spektrum lainnya yang mungkin mengganggu sebelum pengukuran. Sistem monokromator terdiri dari celah masuk (entrance slit), pemilih panjang gelombang berupa prisma atau kisi-kisi difraksi. Dalam monokromator juga terdapat suatu alat yang digunakan untuk memisahkan radiasi resonansi dan kontinu yang disebut dengan chopper (Rohman,2007).
4. Detektor
Detektor digunakan untuk mengukur intensitas cahaya melalui tempat pengatoman. Detektor pada spektrofotometer serapan atom berfungsi mengubah intensitas radiasi yang datang menjadi arus listrik (Mulja, 1995).
5. Rekorder
Rekorder berfungsi untuk menerima dan merekam sinyal yang disampaikan oleh detektor dan menyampaikannya ke sistem read out.
6. Sistem Pencatat (Sistem Read-Out)
Read-out merupakan suatu alat penunjuk atau dapat juga diartikan sebagai sistem pencatat hasil. Pencatatan hasil dilakukan dengan suatu alat yang telah terkalibrasi untuk pembacaan suatu transmisi atau absorbsi. Hasil pembacaan dapat berupa angka atau berupa kurva dari suatu rekorder yang menggambarkan absorbansi atau intensitas emisi (Rohman, 2007)
Ada beberapa faktor gangguan dalam menggunakan SSA ;
1. Suhu yang sesuai, suhu gas pembakar harus sesuai dengan suhu unsur yang akan dianalisis.
2. Konsentrasi sampel tidak boleh melebihi kesensitifan dari alat detektor SSA. Ini akan menyebabkan gangguan terhadap garis spektrum dan mengakibatkan kerusakan pada alat detektor SSA.
3. Pengaruh penguapan pelarut dan bahan larutan jangan sampai menurunkan suhu nyala gas pembakar, ini akan menyebabkan bacaan nilai serapan atom menjadi rendah .
Memang selain dengan metode spetrofotometer serapan atom, unsur-unsur dengan energi eksitasi rendah dapat juga dianalisis dengan fotometri nyala, tetapi untuk unsur-unsur dengan eksitasi tinggi hanya dapat dilakukan dengan fotometri
nyala. Untuk analisis dengan garis spektrum resonansi antara 400-800 nm, fotometri nyala sangat berguna, sedangkan antara 200-300 nm metode SSA lebih baik dari fotometri nyala (Khopkar, 1990).
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian dilakukan pada bulan November 2018 sampai bulan Januari 2019.
Penelitian ini dilakukan di Laboratorium Kimia Analitik, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Dan uji spektrofotometer Fourier Transform Infra Red (FTIR) dilakukan di Laboratorium Kimia Organik UGM Yogyakarta. Analisa logam Fe dan Pb dilakukan dengan Spektrofotometer Serapan Atom (SSA) di Balai Riset dan Standarisasi Industri (BARISTAND) Medan.
3.2 Alat dan Bahan Penelitian 3.2.1 Alat
- Beaker Glass Pyrex
- Corong kaca Pyrex
- Spatula
- Gelas Ukur Pyrex
-Neraca analitik (presisi ± 0,0001 g) Mettler - Cawan Petri
- Labu Takar Pyrex
- Pipet Tetes
- Kertas Saring Whatmann no. 01
- Botol Aquades
- Magnetic bar - Pompa Injeksi - Hot Plate
- Indikator Universal
- Spektrofotometer Serapan Atom (SSA) Shimadzu AA-7000
3.2.2 Bahan Penelitian - Kitosan
- Zeolit
- NaOH p.a (E. Merck)
- Asam Asetat p.a (E. Merck)
- Cu(NO3)2.3H2O p.a (Merck) - Akuades
- Akuabides
3.3. Pembuatan Larutan Pereaksi a. Pembuatan Larutan Asetat 1% (v/v)
Sebanyak 1 mL asam asetat glasial dimasukkan kedalam labu ukur 100mL, kemudian diencerkan dengan akuades sampai garis tanda dan dihomogenkan.
b. Pembuatan Larutan NaOH 2M (b/v)
Sebanyak 40 gram NaOH pellet dimasukkan kedalam Beaker Glass. Ditambahkan 500mL akuades. Lalu diaduk samapai homogen sehingga diperoleh larutan NaOH 2 M.
21
c. Pembuatan Larutan CU(NO3)2.3H2O
Sebanyak 30,18 g Kristal CU(NO3)2.3H2O dimasukkan kedalam Beaker Glass.
Dilarutkan dengan 400mL akuades, dimasukkan kedalam labu takar 500mL, kemudian ditambahkan akuades hingga garis tanda sehingga diperoleh larutan Cu(NO3)2 0,5 M.
d. Pembuatan Larutan kitosan 1%
Sebanyak 1 gram kitosan dilarutkan dengan 100mL larutan asam asetat 1%
3.4 Pembuatan Kitosan CuO
Larutan kitosan kedalam Beaker Glass. Kemudian ditambahkan dengan larutan Cu(NO3)2 0,5 M dengan rasio 2:1 hingga diperoleh larutan kental berwarna biru.
Larutan kental kemudian dimasukkan ke dalam pompa injeksi dan diteteskan kedalam larutan NaOH 2 M sebanyak 1L hingga terbentuk butiran hitam.
Selanjutnya didiamkan selama 1 malam. Lalu disaring dan dicuci dengan akuades dan dipanaskan sampai kering hingga temperatur 800C. Disimpan pada suhu ruang.
3.5 Aktivasi Zeolit Alam
Sebanyak 30 gram zeolit alam dihaluskan, kemudian dimasukkan kedalam Beaker Glass, ditambahkan akuades dan dicuci sampai tiga kali. Kemudian dipanaskan pada suhu 3000C selama 4 jam. Kemudian disimpan kedalam vakum.
3.6 Pembuatan Kitosan CuO Zeolit Tidak Teraktivasi
Sebanyak 15 g Kitosan CuO dan sebanyak 15 g Zeolit tidak teraktivasi dimasukkan kedalam Beaker Glass, kemudian ditambahkan 100mL akuabides dan ditambahkan 50 mL larutan asam asetat 1%, Kemudian distirerr dengan kecepatan 100 rpm.
Kemudian disaring dengan menggunakan kertas saring Whatmann no. 1, kemudian
dikeringkan pada suhu 1500C, lalu dihaluskan Kitosan CuO Zeolit yang sudah dikeringkan. Kemudian disimpan didalam vakum.
3.7 Pembuatan Kitosan CuO Zeolit Teraktivasi
Sebanyak 15 g Kitosan CuO dan sebanyak 15 g Zeolit teraktivasi dimasukkan kedalam Beaker Glass, kemudian ditambahkan 100mL akuabides dan ditambahkan 50mL larutan asam asetat 1%, Kemudian distirerr dengan kecepatan 100 rpm.
Kemudian disaring dengan menggunakan kertas saring Whatmann no. 1, kemudian dikeringkan pada suhu 1500C, lalu dihaluskan Kitosan CuO Zeolit yang sudah dikeringkan. Kemudian disimpan didalam vakum.
3.8 Penentuan Kadar Logam Besi (Fe) dengan Spektrofotometri Serapan Atom (SSA)
3.8.1 Pembuatan Larutan Standar Besi (Fe) 100 ppm
Sebanyak 10 mL larutan standar Besi (Fe) 1000 ppm dimasukkan kedalam labu takar 100 mL, kemudian diencerkan dengan aquadest sampai garis batas dan dihomogenkan.
3.8.2 Pembuatan Larutan Standar Besi (Fe) 10 ppm
Sebanyak 10 mL larutan standar Besi (Fe) 100 ppm dimasukkan kedalam labu takar 100 mL kemudian diencerkan dengan aquadest sampai garis batas dan dihomogenkan.
3.8.3 Pembuatan Larutan Seri Standar Besi (Fe) 0,2 ; 0,4 ; 0,6 ; 0,8 ; dan 1 ppm Larutan standar Besi (Fe) 10 ppm berturut-turut dipipet 2, 4, 6, 8, dan 10 mL, kemudian masing-masing dimasukkan kedalam labu takar 100 mL, lalu diencerkan dengan aquadest sampai garis batas dan dihomogenkan.
23
3.8.4 Pembuatan Kurva Standar Besi (Fe)
Larutan blanko (0,0) mg/L diukur absorbansinya dengan menggunakan spektrofotometri serapan atom (SSA) pada λspesifik 248,3 nm. Perlakuan dilakukan sebanyak 3 kali.
3.9 Penentuan Kadar Logam Timbal (Pb) dengan Spektrofotometri Serapan Atom (SSA)
3.9.1 Pembuatan Larutan Standar Timbal (Pb) 100 ppm
Sebanyak 10 mL larutan standar Timbal (Pb) 1000 ppm dimasukkan kedalam labu takar 100 mL, kemudian diencerkan dengan aquadest sampai garis batas dan dihomogenkan.
3.9.2 Pembuatan Larutan Standar Timbal (Pb) 10 ppm
Sebanyak 10 mL larutan standar Timbal (Pb) 100 ppm dimasukkan kedalam labu takar 100 mL kemudian diencerkan dengan aquadest sampai garis batas dan dihomogenkan.
3.9.3 Pembuatan Larutan Seri Standar Timbal (Pb) 0,0 ; 0,2 ; 0,4 ; 0,6 ; dan 8 ppm
Larutan standar Timbal (Pb) 10 ppm berturut-turut dipipet 0, 2, 4, 6, dan 8 mL, kemudian masing-masing dimasukkan kedalam labu takar 100 mL, lalu diencerkan dengan aquadest sampai garis batas dan dihomogenkan.
3.9.4 Pembuatan Kurva Standar Timbal (Pb)
Larutan blanko (0,0) mg/L diukur absorbansinya dengan menggunakan spektrofotometri serapan atom (SSA) pada λspesifik 217 nm. Perlakuan dilakukan sebanyak 3 kali.
3.10 Penentuan Waktu Kontak Optimum pada Kitosan CuO Zeolit Teraktivasi dan Kitosan Zeolit Tidak Teraktivasi
Sebanyak 50 mL larutan standar 100 ppm dimasukkan kedalam kolom yang telah berisi 15 g kitosan CuO zeolit teraktivasi, didiamkan selama 15, 30, dan 45 menit, kemudian dibuka tutup kolom dan ditampung dengan botol vial, Selanjutnya dianalisa logam Fe, dan Pb dengan menggunakan spektrofotometri serapan atom (SSA)
25
3.11 Bagan Penelitian 3.11.1 Pembuatan Pereaksi
3.11.1.1 Larutan asam asetat glasial
1 ml asam asetat glasial
Dimasukkan kedalam labu takar 100ml
Larutan asam asetat 1%
Diencerkan dengan akuades sampai garis tanda Dihomogenkan
3.11.1.2 Larutan NaOH 2 M
40 gram NaOH pellet
Dimasukkan kedalam beaker glass Ditambahkan 500ml akuades
Dimasukkan kedalam labu takar 500ml sampai garis tanda Dihomogenkan
Larutan NaOH 2M
3.11.1.3 Larutan CU(NO3)2.3H2O
30,18 gram kristal Cu(NO3)2.3H2O
Dimasukkan kedalam beaker glass Ditambahkan 400ml akuades
Dimasukkan kedalam labu takar 500ml sampai garis tanda Dihomogenkan
LarutanCu(NO3)2.3H2O 0,5M
3.11.1.4 Pembuatan Larutan Kitosan
1 gram kitosan
Dilarutkan kedalam larutan asam asetat 1%
sebanyak 100ml
Distirrer selama 24 jam hingga homogen
kitosan 1%
27
3.12 Pembuatan Kitosan CuO
Larutan Kitosan 1%
Dimasukkan kedalam beaker glass
Ditambahkan dengan larutan Cu(NO3)2 0,5M dengan rasio 2:1
Larutan Kental
Dimasukkan kedalam pompa injeksi Diteteskan kedalam larutan NaOH 2M hingga terbentuk butiran hitam
Didiamkan selama 1 malam Disaring
Filtrat Residu
Dicuci dengan akuades Dikeringkan
Hasil
3.13 Aktivasi Zeolit Alam
30 gram zeolit
Dihaluskan dan diayak dengan menggunakan ayakan 100 mesh
Dimasukkan kedalam beaker glass
Ditambahkan akuades dan dicuci sampai 3 kali Dikeringkan pada suhu 3000C selama 4 jam Disimpan didalam vakum
Zeolit teraktivasi
3.14 Pembuatan Kitosan CuO Zeolit Tidak Teraktivasi
15 gram kitosan CuO 15 gram zeolit tidak teraktivasi
Dimasukkan kedalam beaker glass Ditambahkan 100 ml akuabides
Ditambahkan 50 ml larutan asam asetat 1%
Distirrer dengan kecepatan 100 rpm
Disaring dengan menggunakan kertas saring whattman no. 1
Filtrat Residu
Dikeringkan pada suhu 1100C dengan menggunakan oven Dihaluskan kitosan CuO zeolit yang sudah dikeringkan Disimpan didalam vakum Hasil
Dikarakterisasi Uji FTIR
29
3.15 Pembuatan Kitosan CuO Zeolit Teraktivasi
15 gram kitosan CuO 15 gram zeolit teraktivasi
Dimasukkan kedalam beaker glass Ditambahkan 100 ml akuabides
Ditambahkan 50 ml larutan asam asetat 1%
Distirrer dengan kecepatan 100 rpm
Disaring dengan menggunakan kertas saring whattman no. 1
Filtrat Residu
Dikeringkan pada suhu 1100C dengan menggunakan oven Dihaluskan kitosan CuO zeolit yang sudah dikeringkan Disimpan didalam vakum Hasil
Dikarakterisasi Uji FTIR
3.16Penentuan Waktu Kontak Kitosan CuO Zeolit
Kitosan CuO Zeolit Tidak Teraktivasi
Dirangkai alat kolom dengan statif dan klem
Dimasukkan 50 ml larutan standar
Didiamkan selama variasi waktu 15, 30. dan 45 menit
Hasil Rendaman
Dibuka bagian tutup bawah kolom
Ditampung berdasarkan variasi waktu 15, 30, dan 45 menit dengan menggunakan botol vial
Dimasukkan 15 g kitosan CuO zeolit tidak teraktivasi
Diukur absorbansinya pada = 248,3 nm dengan menggunakan SSA
Hasil
Catatan : Perlakuan yang sama dilakukan pada kitosan Cuo zeolit teraktivasi dan tidak teraktivasi pada Logam Pb dengan λ = 217 nm
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Hasil Analisa Spektrofotometer FT-IR
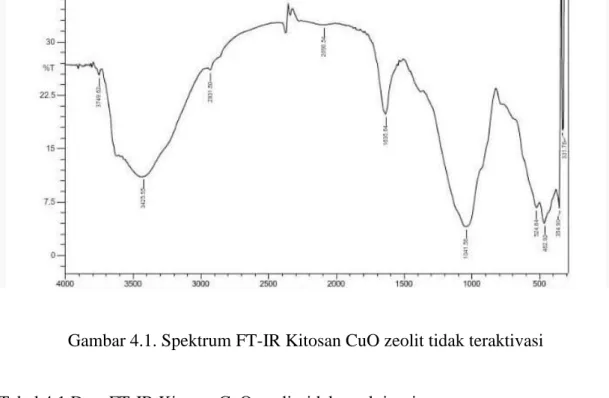
Spektrum dan data FT-IR pada kitosan CuO zeolit tidak teraktivasi dapat dilihat pada tabel 4.1 dan gambar 4.1 berikut :
Gambar 4.1. Spektrum FT-IR Kitosan CuO zeolit tidak teraktivasi
Tabel 4.1 Data FT-IR Kitosan CuO zeolit tidak teraktivasi
Bilangan Gelombang ( cm⁻ ¹) Gugus Fungsi
3425,58 O-H tumpang tindih dengan N-H
1635,64 C=O
1041,56 Si-O dan Al-O tarik ulur
462,92 Vibrasi tekuk Si-O-Si /Al-O-Al
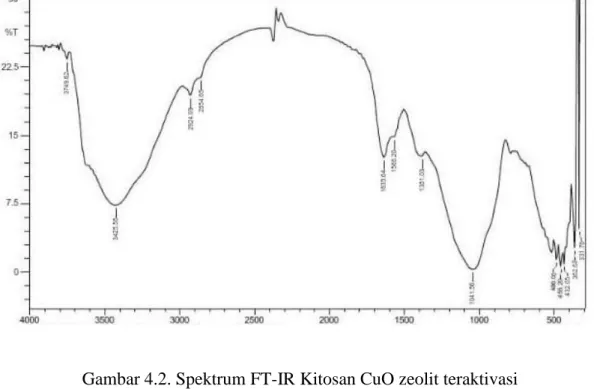
Spektrum dan data FT-IR pada kitosan CuO zeolit teraktivasi dapat dilihat pada tabel 4.2 dan gambar 4.2 berikut :
Gambar 4.2. Spektrum FT-IR Kitosan CuO zeolit teraktivasi
Tabel 4.2 Data FT-IR Kitosan CuO zeolit teraktivasi
Bilangan Gelombang ( cm⁻ ¹) Gugus Fungsi
3425,58 O-H tumpang tindih dengan N-H
1635,64 C=O
1566,2 N-H
1041,56 Si-O dan Al-O tarik ulur
486,06 - 432,05 Vibrasi tekuk Si-O-Si/Al-O-Al
4.1.2 Logam Besi (Fe)
Pembuatan kurva larutan standar logam Besi (Fe) dilakukan dengan menyiapkan larutan seri standar dengan berbagai konsentrasi yaitu pada pengukuran 0,2; 0,4; 0,6; 0,8; dan 1,0 mg/L, kemudian diukur absorbansinya dengan menggunakan Spektrofotometer Serapan Atom (SSA). Untuk kondisi alat Spektrofotometer Serapan Atom (SSA) pada pengukuran konsentrasi logam Besi (Fe) dapat dilihat pada tabel 4.2 dan untuk data absorbansi larutan seri standar logam
33
Besi (Fe) dapat dilihat pada tabel 4.3 sehingga diperoleh kurva kalibrasi larutan seri standar logam Besi (Fe) pada gambar 4.3.
Tabel 4.3 Kondisi Alat Spektrofotometer Serapan Atom (SSA Shimadzu AA-7000) pada Pengukuran Konsentrasi Logam Besi (Fe)
No Parameter Logam Fe
1 Panjang Gelombang (nm) 248,3
2 Tipe Nyala Udara –C2H2
3 Kecepatan Aliran Gas Pembakar (L/min) 2,2
4 Kecepatan Aliran Udara (L/min) 15
5 Burner Angle (degree) 0
6 Ketinggian Tungku (nm) 9
Tabel 4.4 Data Absorbansi Larutan Seri Standar Logam Besi (Fe)
No Konsentrasi (mg/L) Absorbansi Rata-Rata (Ā)
1 0,2 0,0071
2 0,4 0,0160
3 0,6 0,0244
4 0,8 0,0333
5 1,0 0,0417
Gambar 4.3 Kurva kalibrasi Larutan Seri Standar Logam Besi (Fe)
4.1.3 Pengolahan Data Logam Besi (Fe)
4.1.3.1 Penurunan Persamaan Garis Regresi dengan Metode Least Square Hasil pengukuran absorbansi larutan seri standar logam Besi (Fe) pada tabel 4.2 diplotkan terhadap konsentrasi sehingga diperoleh kurva berupa garis linear.
Persamaan garis regresi untuk kurva ini dapat diturunkan dengan metode least square dengan data pada tabel 4.5.
Tabel 4.5 Penurunan Persamaan Garis Regresi Untuk Penentuan Konsentrasi Logam Besi (Fe) Berdasarkan Pengukuran Absorbansi Larutan Seri Standar Logam Besi (Fe)
NO Xi Yi (xi-x) (Yi-Y) (Xi-X)(Yi-Y) (Xi-X)2 (Yi-Y)2 1 0,2 0,0071 -0,4 -0,017400 0,006960 0,200000 0,000355 2 0,4 0,0160 -0,2 -0,008500 0,001700 0,060000 0,000113 3 0,6 0,0244 0,0 -0,000100 0,000000 0,000000 0,000000 4 0,8 0,0333 0,2 0,008800 0,001760 0,020000 0,000035 5 1,0 0,0417 0,4 0,017200 0,006880 0,120000 0,000222
∑ 3,0 0,1225 0,0 0,000000 0,017300 0,400000 0,000726
y = 0.0433x - 0.0015 R² = 0.9999
0 0.005 0.01 0.015 0.02 0.025 0.03 0.035 0.04 0.045
0 0.2 0.4 0.6 0.8 1 1.2
Absorbansi Logam Fe (Ā)
Konsentrasi Logam Fe (mg/L)
35
=
Penurunan persamaan garis regresi : Y= aX + b
Dimana a = Slope b = Intersept
Maka persamaan garis regresi adalah : Y = 0,04325 + 0,0015
4.1.4.2 Penentuan Koefisien Korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut:
4.1.4 Logam Timbal (Pb)
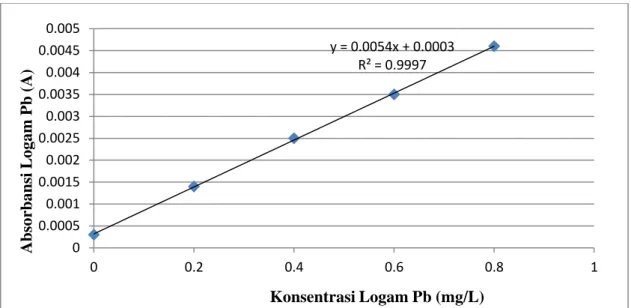
Pembuatan kurva larutan standar logam Timbal (Pb) dilakukan dengan menyiapkan larutan seri standar dengan berbagai konsentrasi yaitu pada pengukuran 0,0; 0,2; 0,4;
0,6; dan 0,8 mg/L, kemudian diukur absorbansinya dengan menggunakan Spektrofotometer Serapan Atom (SSA). Untuk kondisi alat Spektrofotometer Serapan Atom (SSA) pada pengukuran konsentrasi logam Timbal (Pb) dapat dilihat pada tabel 4.6 dan untuk data absorbansi larutan seri standar logam Timbal (Pb)
dapat dilihat pada tabel 4.7 sehingga diperoleh kurva kalibrasi larutan seri standar logam Timbal (Pb) pada gambar 4.4.
Tabel 4.6 Kondisi Alat Spektrofotometer Serapan Atom (SSA) Shimadzu AA-7000 pada Pengukuran Konsentrasi Logam Timbal (Pb)
No Parameter Logam Pb
1 Panjang Gelombang (nm) 217
2 Kuat Arus Lampu Katoda (µA) 10
3 Kecepatan Aliran Gas Pembakar (L/min) 2
4 Kecepatan Aliran Udara (L/min) 10
5 Tinggi Burner (mm) 2
6 Lebar Celah (nm) 1
Tabel 4.7 Data Absorbansi Larutan Seri Standar Logam Timbal (Pb)
No Konsentrasi (mg/L) Absorbansi Rata-Rata (Ā)
1 0 0,0003
2 0,2 0,0014
3 0,4 0,0025
4 0,6 0,0035
5 0,8 0,0046
37
Gambar 4.4 Kurva kalibrasi Larutan Seri Standar Logam Timbal (Pb)
4.1.5 Pengolahan Data Logam Timbal (Pb)
4.1.5.1 Penurunan Persamaan Garis Regresi dengan Metode Least Square Hasil pengukuran absorbansi larutan seri standar logam Timbal (Pb)pada tabel 4.2 diplotkan terhadap konsentrasi sehingga diperoleh kurva berupa garis linear.
Persamaan garis regresi untuk kurva ini dapat diturunkan dengan metode least square dengan data pada tabel 4.8.
Tabel 4.8 Penurunan Persamaan Garis Regresi Untuk Penentuan Konsentrasi Logam Timbal (Pb) Berdasarkan Pengukuran Absorbansi Larutan Seri Standar Logam Timbal (Pb)
NO Xi Yi (xi-x) (Yi-Y) (Xi-X)(Yi-Y) (Xi-X)2 (Yi-Y)2 1 0 0,0003 -0,4 -0,002160 0,000864 0,200000 0,000044 2 0,2 0,0014 -0,2 -0,001060 0,000212 0,060000 0,000014 3 0,4 0,0025 0,0 0,000040 0,000000 0,000000 0,000000 4 0,6 0,0035 0,2 0,001040 0,000208 0,020000 0,000004 5 0,8 0,0046 0,4 0,002140 0,000856 0,120000 0,000028
∑ 2,0 0,0123 0,0 0,000000 0,002140 0,400000 0,000090
y = 0.0054x + 0.0003 R² = 0.9997
0 0.0005 0.001 0.0015 0.002 0.0025 0.003 0.0035 0.004 0.0045 0.005
0 0.2 0.4 0.6 0.8 1
Absorbansi Logam Pb (A)
Konsentrasi Logam Pb (mg/L)
=
Penurunan persamaan garis regresi : Y= aX + b
Dimana a = Slope b = Intersept
Maka persamaan garis regresi adalah : Y = 0,0054+ 0,0003
4.1.5.2 Penentuan Koefisien Korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut: