UJI DAYA HAMBAT EKSTRAK DAUN KEMANGI (OCIMUM CITRIODORUM VIS) TERHADAP PERTUMBUHAN BAKTERI
ESCHERICHIA COLI
SKRIPSI
Oleh :
MUFIDAH KHALISHAH MOEZA 160100103
PROGRAM STUDI PENDIDIKAN DOKTER FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA MEDAN
2019
UJI DAYA HAMBAT EKSTRAK DAUN KEMANGI (OCIMUM CITRIODORUM VIS) TERHADAP PERTUMBUHAN
BAKTERI ESCHERICHIA COLI
SKRIPSI
Diajukan Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Kedokteran
Oleh :
MUFIDAH KHALISHAH MOEZA 160100103
PROGRAM STUDI PENDIDIKAN DOKTER FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA MEDAN
2019
KATA PENGANTAR
Segala Puji dan syukur kehadirat Allah SWT atas rahmat dan berkat-Nya penulis mampu menyelesaikan skripsi ini tepat pada waktunya. Skripsi ini berjudul
“Uji Daya Hambat Ekstrak Daun Kemangi (Ocimum citriodorum Vis.) Terhadap Pertumbuhan Bakteri Escherichia coli” yang merupakan salah satu syarat untuk memperoleh kelulusan sarjana kedokteran program studi Pendidikan Dokter Fakultas Kedokteran Universitas Sumatera Utara.
Dalam penyusunan dan penyelesaian skripsi ini, penulis mendapat banyak dukungan dan bantuan baik secara moril maupun materil dari berbagai pihak. Oleh karena itu, penulis ingin menyampaikan ucapan terima kasih sebesar-besarnya kepada:
1. Dekan Fakultas Kedokteran Universitas Sumatera Utara, Dr. dr. Aldy Safruddin Rambe, Sp.S(K), yang banyak memberikan dukungan selama proses penyusunan skripsi.
2. Dosen Pembimbing, dr. Cut Adeya Adella, Sp.OG(K) yang banyak memberikan arahan, masukan, ilmu, dan motivasi kepada penulis sehingga skripsi ini dapat terselesaikan sedemikian rupa.
3. Ketua Penguji, dr. Lokot Donna Lubis, M.Ked (PA), Sp.PA dan Anggota Penguji, dr. M. Rizki Yaznil, M. Ked (OG), Sp. OG, untuk setiap kritik dan saran yang membangun selama proses pembuatan skripsi ini.
4. Dosen Pembimbing Akademik, dr. Sake Juli Martina, Sp.FK yang senantiasa membimbing dan memberikan motivasi selama masa perkuliahan 7 semester.
5. Seluruh staf pengajar dan civitas akademika Fakultas Kedokteran Universitas Sumatera Utara atas bimbingan dan ilmu yang diberikan dari mulai awal perkuliahan hingga penulis menyelesaikan skripsi ini
6. Seluruh asisten Laboratorium Biologi Farmasi Fakultas Farmasi Universitas Sumatera Utara yang telah mendukung dan berbagi pengalaman kepada penulis dalam menyelesaikan penelitian ini.
7. Seluruh Laboran Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Sumatera Utara atas bantuan dan dukungan serta pengarahan dalam penelitian ini.
8. Kedua orang tua beserta adik yang selalu mendukung, memberikan semangat, kasih sayang, bantuan dan rasa kebersamaan yang tidak pernah berhenti sampai penulis menyelesaikan skripsi ini.
9. Sahabat-sahabat penulis, Annisa Pulungan, Berlian Febia, Diajeng Putri, Ghinia Zati, Michelle Aurell, Savira Laniari, Tassa Nasirah, Zafira Kirey, dan sahabat terbaik lainnya yang tak bisa disebut satu per satu saling bahu membahu menolong satu sama lain dari awal perkuliahan sampai selesainya skripsi ini.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna, baik dari segi konten maupun cara penulisannya. Oleh sebab itu, dengan segala kerendahan hati, penulis mengharapkan kritik dan saran agar penulis dapat menyempurnakan skripsi ini.
Akhir kata penulis berharap skirpsi ini dapat bermanfaat dan mampu memberikan sumbangsih bagi bangsa dan Negara terutama dalam bidang pendidikan terkhususnya ilmu kedokteran.
Medan, 27 November 2019 Penulis,
Mufidah Khalishah Moeza 160100103
DAFTAR ISI
Halaman
Halaman Pengesahan ... i
Kata Pengantar ... ii
Daftar Isi ... iv
Daftar Gambar ... vi
Daftar Tabel ... vii
Daftar Lampiran ... viii
Daftar Singkatan ... ix
Abstrak ... x
Abstract ... xi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 3
1.3 Tujuan Penelitian ... 3
1.3.1 Tujuan Umum ... 3
1.3.2 Tujuan Khusus... 3
1.4 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Tanaman Kemangi ... 5
2.1.1 Klasifikasi Tanaman Kemangi... 5
2.1.2 Morfologi Tanaman Kemangi ... 5
2.1.3 Penyebaran Tanaman Kemangi ... 6
2.1.4 Nama Daerah Tanaman Kemangi ... 6
2.1.5 Manfaat Tanaman Kemangi... 7
2.1.6 Kandungan Kimia Tanaman Kemangi ... 7
2.2 Escherichia coli ... 7
2.2.1 Taksonomi Escherichia coli ... 8
2.2.2 Morfologi Bakteri Escherichia coli ... 8
2.2.3 Patogenesis ... 9
2.3 Efek Senyawa Kimia Tanaman Kemangi ... 11
2.4 Ekstraksi ... 13
2.4.1 Prinsip Ekstraksi ... 13
2.4.2 Metode Ekstraksi ... 14
2.4.2.1 Metode Ekstraksi Cara Dingin ... 14
2.4.2.2 Metode Ekstraksi Cara Panas ... 15
2.5 Pengukuran Aktivitas Antimikroba ... 16
2.5.1 Metode Difusi ... 16
2.5.2 Metode Dilusi ... 17
2.6 Kerangka Teori... 18
2.7 Kerangka Konsep ... 19
2.8 Hipotesis ... 19
2.8.1 Hipotesis Mayor ... 19
2.8.2 Hipotesis Minor ... 19
BAB III. METODE PENELITIAN ... 20
3.1 Jenis Penelitian ... 20
3.2 Waktu dan Tempat Penelitian ... 20
3.2.1 Waktu Penelitian ... 20
3.2.2 Tempat Penelitian ... 20
3.3 Populasi dan Sampel Penelitian ... 20
3.3.1 Populasi ... 20
3.3.2 Sampel ……. ... 21
3.3.3 Kriteria Inklusi dan Kriteria Eksklusi ... 22
3.3.3.1 Kriteria Inklusi ... 22
3.3.3.2 Kriteria Eksklusi ... 22
3.4 Metode Pengumpulan Data ... 22
3.4.1 Alat dan Bahan Penelitian... 22
3.4.1.1 Alat Penelitian... 22
3.4.1.2 Bahan Penelitian ... 23
3.4.2 Determinan Tanaman ... 23
3.4.3 Pembuatan Ekstrak ... 23
3.4.4 Pembuatan Seri Konsentrasi Ekstrak ... 24
3.4.5 Pembuatan Suspensi Bakteri ... 25
3.4.6 Identifikasi Bakteri ... 25
3.4.6.1 Pewarnaan Gram ... 25
3.4.6.2 Uji Biokimia ... 25
3.4.7 Pembuatan Media Mueller Hinton Agar ... 26
3.4.8 Uji Aktivitas Antibakteri ... 26
3.5 Metode Analisa Data ... 27
3.6 Variabel Penelitian ... 27
3.6.1 Variabel Independen ... 27
3.6.2 Variabel Dependen ... 27
3.7 Definisi Operasional ... 28
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ... 29
4.1 Hasil Penelitian ... 29
4.1.1 Lokasi Penelitian... 29
4.1.2 Karakteristik Sampel... 29
4.1.3 Zona Hambat... 30
4.2 Pembahasan… ….. ... 32
BAB V. KESIMPULAN DAN SARAN ... 36
5.1 Kesimpulan….. ... 36
5.2 Saran………… ... 36
DAFTAR PUSTAKA ... 37
LAMPIRAN... ... 40
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar 2.1 Tanaman
Kemangi ... 6
... Gambar 2.2 Daun Kemangi ... 6
Gambar 2.3 Bunga Kemangi ... 6
Gambar 2.4 (a) Morfologi Escherichia coli ... 9
Gambar 2.4 (b) Koloni Escherichia coli di media EMD ... 9
Gambar 2.4 (c) Escherichia coli dengan pewarnaan Gram ... 9
Gambar 2.5 Kerangka Teori ... 18 ... Gambar 2.6 Kerangka Konsep ... 19
Gambar 4.1 Zona Hambat Ekstrak Daun Kemangi Terhadap Pertumbuhan Bakteri Escherichia coli ... 30
Gambar 4.2 Zona Hambat Kontrol Positif gentamisin dan Kontrol Negatif DMSO Terhadap Pertumbuhan Bakteri Escherichia coli ... 31
DAFTAR TABEL
Nomor Judul Halaman
Tabel 3.1 Defenisi
Operasional ... 28 ...
Tabel 4.1 Hasil Pengukuran diameter zona hambat konsentrasi ekstrak daun kemangi terhadap pertumbuhan
Bakteri
E.coli ... 31 ...
DAFTAR LAMPIRAN
Halaman
Lampiran A. Biodata Penulis ... 40
Lampiran B. Alur Kerja Penelitian ... 41
Lampiran C. Halaman Pernyataan Orisinalitas ... 43
Lampiran D. Ethical clearance ... 44
Lampiran E. Surat Izin Penelitian ... 45
Lampiran F. Surat Izin Pemakaian Fasilitias Laboratorium ... 48
... Lampiran G. Surat Keterangan Selesai Penelitian ... 49
Lampiran H. Hasil Determinasi Tanaman Daun Kemangi ... 50
Lampiran I. Persiapan Daun Kemangi ... 51
Lampiran J. Proses Ekstraksi Daun Kemangi ... 52
Lampiran K. Ekstrak Daun Kemangi ... 54
Lampiran L. Identifikasi Bakteri Escherichia coli ... 55
Lampiran M. Bakteri Escherichia coli ... 56
Lampiran N. Uji Antibakteri ... 57
Lampiran O. Uji Normalitas Shapiro-Wilk, Uji Homogenitas Levene dan Statistik Deskriptif ... 58
DAFTAR SINGKATAN
ADP : Adenosin Difosfat
AMP : Adenosin Monofosfat
ATP : Adenosine triphosphate
CFU : Colony Forming Unit
Cl : Klorida
DNA : Deoxyribonucleic Acid
Depkes : Departemen Kesehatan
E.coli : Escherichia coli
EAEC : Enteroaggregative Escherichia coli EHEC : Enterohaemorrhagic Escherichia coli EIEC : Enteroinvasive Escherichia coli EPEC : Enteropathogenic Escherichia coli ETEC : Enterotoxigenic Escherichia coli GTPase : Glutamyl Transpeptidase
Na : Natrium
Permenkes : Peraturan Mentri Kesehatan
RNA : Ribonucleic acid
WHO : World Health Organization
ABSTRAK
Latar Belakang. Penyakit infeksi merupakan salah satu masalah dalam bidang kesehatan yang dari waktu ke waktu terus berkembang. Penyakit infeksi dapat disebabkan oleh mikroorganisme patogen seperti bakteri, virus, parasit, dan jamur. Salah satu bakteri yang dapat menyebabkan penyakit infeksi adalah Escherichia coli. Escherichia coli merupakan bakteri gram negatif yang normalnya hidup sebagai flora normal di sistem pencernaan manusia namun juga dapat menjadi patogen yang menyebabkan infeksi. Di Indonesia tanaman obat tradisional mampu membuktikan pentingnya bahan alam untuk berbagai proses pengobatan manusia karena memiliki efek samping yang sedikit serta tidak terjadi resistensi seperti obat sintesis. Daun kemangi (Ocimum citriodorum Vis.) yang mengandung flavonoid, saponin, tannin, dan minyak atsiri dapat digunakan untuk menghambat pertumbuhan bakteri. Tujuan. Penelitian ini dilakukan untuk mengetahui uji daya hambat ekstrak daun kemangi (Ocimum citriodorum Vis.) terhadap pertumbuhan bakteri Escherichia coli. Metode.
Uji antibakteri menggunakan metode difusi cara sumuran. Daun kemangi (Ocimum citriodorum Vis.) dikumpulkan dari kebun yang berada di daerah Medan Labuhan. Daun kemangi (Ocimum citriodorum Vis.) diekstrak dengan metode maserasi menggunakan pelarut etanol 96%. Dilakukan 6 perlakuan, yaitu dengan konsentrasi 6,25%, 12,5%, 25%, dan 50%, kontrol positif gentamisin dan kontrol negatif DMSO. Setiap perlakuan dilakukan pengulangan sebanyak empat kali. Hasil. Data diameter zona hambat dianalisis menggunakan uji statistik one way Anova. Hasil penelitian menunjukkan terdapat perbedaan yang signifikan pada semua perlakuan (p<0,05). Kesimpulan.
Ekstrak daun kemangi (Ocimum citriodorum Vis.) memiliki daya antibakteri terhadap pertumbuhan bakteri Escherichia coli.
Kata kunci : Escherichia coli, ekstrak daun kemangi, Ocimum citriodorum, metode difusi sumuran.
ABSTRACT
Background. Infectious diseases are one of the problems in the field of health that over time continues to evolve. Infectious diseases can be caused by pathogenic microorganisms such as bacteria, viruses, parasites, and fungi. One of the bacteria that can cause infectious diseases is Escherichia coli. Escherichia coli is a Gram-negative bacteria that normally live as a normal flora in the human digestive system but can also be an pathogenic cause of infection. In Indonesia, traditional medicinal plants are able to prove the importance of natural materials for the various processes of human treatment because they have little side effects as well as no resistance to synthetic medicine. Basil leaves (Ocimum citriodorum Vis.) containing flavonoids, saponin, tannins, and essential oils can be used to inhibit bacterial growth. Objective. This study was conducted to know the power test of basil leaf extract (Ocimum citriodorum Vis.) against the growth of bacteria Escherichia coli. Method. Antibacterial test using the way to diffuse method. Basil leaves (Ocimum citriodorum Vis.) are gathered from a garden located in the area of Labuhan Medan. Basil leaves (Ocimum citriodorum Vis.) are extracted by the Maceration method using the 96% ethanol solvent.
Performed 6 treatments, namely with concentrations of 6.25%, 12.5%, 25%, and 50%, positive control gentamicin and negative control DMSO. Each treatment is repeated four times. Results.
Data on the diameter of the barrier zone analyzed using statistical Test one way Anova. The results showed significant differences in all treatments (P < 0.05). Conclusion. Basil leaf extract (Ocimum citriodorum Vis.) has antibacterial power against the growth of Escherichia coli bacteria.
Keywords. Escherichia coli, basil leaf extract, Ocimum citriodorum, the Sumuran diffusion method.
BAB I PENDAHULUAN 1.1 LATAR BELAKANG
Penyakit infeksi merupakan salah satu masalah dalam bidang kesehatan yang dari waktu ke waktu terus berkembang. Penyakit infeksi dapat disebabkan oleh mikroorganisme patogen seperti bakteri, virus, parasit, dan jamur (WHO, 2014).
Penyakit infeksi merupakan penyakit yang banyak diderita masyarakat Indonesia sejak dulu seperti, infeksi usus yang disebabkan oleh bakteri Escherichia coli, Staphylococcus aureus, Salmonella typhi, Vibrio cholerae, dan infeksi kulit yang disebabkan oleh bakteri Staphylococcus aureus, Pseudomonas aeruginosa dan sebagainya (Oktalia, 2009).
Salah satu bakteri yang dapat menyebabkan penyakit infeksi pada manusia adalah Escherichia coli (Roslizawaty et al., 2013). E.coli merupakan bakteri gram negatif yang normalnya hidup sebagai flora normal di sistem pencernaan manusia, namun juga dapat menjadi patogen yang menyebabkan infeksi (Eriksson et al., 2012). E.coli dapat menyebabkan diare, infeksi saluran kemih, pneumonia, meningitis pada bayi yang baru lahir, dan infeksi luka. Penyakit diare merupakan penyebab kedua kematian pada anak di bawah lima tahun dan menjadi penyebab kematian sekitar 760.000 anak setiap tahun. Selain itu terdapat 1,7 miliar kasus diare tiap tahunnya (WHO, 2014). Sedangkan meningitis menyebabkan kematian pada 20-40 % pada bayi yang terinfeksi (Jafari et al., 2012).
Berdasarkan data pola kuman dan resistensi dari isolat urin pada tiga tempat berbeda di Indonesia yaitu Jakarta (Bagian Mikrobiologi dan Bagian Patologi Klinik FKUI-RSCM), Bandung (Bagian Patologi Klinik Sub Bagian Mikrobiologi RS Hasan Sadikin) dan Surabaya (Bagian Mikrobiologi RS Soetomo), jumlah kuman yang didapat dari periode 2002-2004, infeksi E.coli merupakan yang terbanyak ditemukan yaitu sebanyak 38.85% diikuti dengan Klebsiella spp 16.63%
dan Pseudomonas spp 14.95% (Firizki, 2013).
Penyakit infeksi dapat disembuhkan dengan mengkonsumsi antibiotik. Lebih dari separuh pasien di rumah sakit menerima antibiotik sebagai pengobatan atau profilaksis. Sekitar 80% konsumsi antibiotik dipakai untuk kepentingan manusia dan sedikitnya 40% berdasar indikasi yang kurang tepat, misalnya infeksi virus seperti influenza, hepatitis, ataupun demam berdarah dengue (Permenkes, 2011).
Penggunaan antibiotik yang relatif tinggi merupakan permasalahan dan suatu ancaman besar terhadap lingkungan secara global. Permasalahan ini terutama terkait dengan resistensi bakteri terhadap antibiotik. Resistensi dapat terjadi di rumah sakit ataupun pada masyarakat secara luas. Beberapa bakteri yang telah banyak ditemukan resisten yakni Streptococcus pneumoniae, Staphylococcus aureus, dan Escherichia coli (Permenkes, 2011).
Di Indonesia tanaman obat tradisional mampu membuktikan pentingnya bahan alam untuk berbagai proses pengobatan manusia. Penggunaan obat tradisional menjadi salah satu pilihan masyarakat dalam penyembuhan penyakit karena memiliki efek samping yang sedikit serta tidak terjadi resistensi seperti obat sintesis.
Keuntungan penggunaan obat tradisional yaitu biaya yang murah dan mudah didapat. Salah satu tanaman yang sering digunakan sebagai obat yaitu tanaman kemangi (Ocimum citriodorum Vis.)
Tanaman kemangi (Ocimum citriodorum Vis.) merupakan tanaman yang tersebar hampir diseluruh Indonesia karena dapat tumbuh liar maupun dibudidayakan (Sudarsono et al., 2002). Tanaman kemangi (Ocimum citriodorum Vis.) memiliki banyak sekali manfaat, terutama bagian daunnya yang biasa digunakan sebagai lalapan dan penyedap masakan maupun sebagai obat-obatan seperti perut kembung, demam, sariawan, dan juga sebagai antibakteri.
Daun kemangi (Ocimum citriodorum Vis..) yang mengandung flavonoid, saponin, tannin, dan minyak atsiri dapat digunakan untuk menghambat pertumbuhan bakteri. Sifat dari penghambatan ini disebut sebagai bakteriosida (Hadipoentyanti dan Wahyuni, 2008).
Hasil penelitian sebelumnya, dapat disimpulkan bahwa ekstrak daun kemangi (Ocimum citriodorum Vis.) dapat menghambat pertumbuhan jamur Candida albicans serta ada kecendrungan semakin tinggi konsentrasi ekstrak daun kemangi
(Ocimum citriodorum Vis.) maka zona hambat terbentuk semakin besar. Hal ini karena perbedaan variasi konsentrasi yang diberikan serta aktivitas antijamur dapat dipengaruhi oleh konsentrasi ekstrak, kandungan senyawa antijamur, daya difusi ekstrak dan jenis jamur (Komang et al., 2017).
Berdasarkan uraian diatas, maka peneliti tertarik untuk melakukan penelitian tentang uji daya hambat ekstrak daun kemangi (Ocimum citriodorum Vis.) terhadap pertumbuhan bakteri Escherichia coli.
1.2 RUMUSAN MASALAH
Uraian dalam latar belakang di atas memberikan dasar bagi peneliti untuk merumuskan pertanyaan penelitian ini yaitu: “Bagaimana aktivitas ekstrak daun kemangi (Ocimum citriodorum Vis.) sebagai antibakteri terhadap biakan Escherichia coli?”
1.3 TUJUAN PENELITIAN 1.3.1 TUJUAN UMUM
Tujuan umum dalam penelitian ini adalah untuk mengetahui uji daya hambat ekstrak daun kemangi (Ocimum citriodorum Vis.) terhadap pertumbuhan bakteri Escherichia coli.
1.3.2 TUJUAN KHUSUS
Tujuan khusus dari penelitian ini adalah sebagai berikut:
1. Untuk mengetahui potensi daya hambat ekstrak daun kemangi terhadap pertumbuhan Escherichia coli secara invitro.
2. Untuk mengetahui konsentrasi ekstrak daun kemangi (Ocimum citriodorum Vis.) yang efektif dapat menghambat pertumbuhan bakteri Escherichia coli secara invitro.
3. Untuk mengetahui kadar hambat minimum (KHM) dan kadar bunuh maksimum (KBM) dari hasil uji mikroba daun kemangi (Ocimum citriodorum Vis.) terhadap bakteri Escherichia coli secara invitro.
4. Untuk mengetahui profil fitokimia dari ekstrak daun kemangi (Ocimum citriodorum Vis.)
1.4 MANFAAT PENELITIAN Hasil penelitian ini diharapkan:
1. Memberikan informasi ilmiah tentang efek pemberian ekstrak daun kemangi (Ocimum citriodorum Vis.) terhadap pertumbuhan bakteri Escherichia coli.
2. Digunakan sebagai pertimbangan bagi klinis untuk menggunakan daun kemangi (Ocimum citriodorum Vis.) sebagai alternatif pengobatan.
3. Menjadi acuan untuk penelitian selanjutnya dan perkembangan ilmu pengetahuan medis.
BAB II
TINJAUAN PUSTAKA
2.1 TANAMAN KEMANGI
2.1.1 Klasifikasi Tanaman kemangi
Klasifikasi tanaman kemangi (Ocimum citriodorum Vis.) adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae
Ordo : Lamiales
Famili : Lamiaceae
Genus : Ocimum
Spesies : Ocimum citriodorum Vis. (Bilal et al., 2012)
2.1.2 Morfologi Tanaman Kemangi
Tanaman kemangi (Ocimum citriodorum Vis.) memiliki morfologi tajuk membulat, herba tegak atau semak, sangat harum, bercabang banyak dengan tinggi 0,3-1,5 cm, batang pokoknya tidak jelas, daun berwarna hijau keunguan, daun berhadapan tunggal, tersusun dari bawah keatas. Memiliki panjang tangkai daun 0,25-3 cm dan setiap helaian daun berbentuk elips hingga bulat, memanjang, ujung tumpul atau meruncing. Pangkal daun pasak hingga membulat, kedua permukaan berambut halus, bergelombang, dan tepi bergerigi (Kusuma, 2010).
Bunga tersusun pada tangkai berbentuk tegak, jenis bunga hemafrodit, berwarna putih dan berbau wangi. Kelopak bunga berwarna hijau atau ungu (Kusuma, 2010).
Gambar 2.1 Tanaman kemangi Gambar 2.2 Daun kemangi
Gambar 2.3 Bunga kemangi
2.1.3 Penyebaran Tanaman Kemangi
Tanaman kemangi (Ocimum citriodorum Vis.) berasal dari Asia Barat dan tersebar secara alami ke Amerika, Afrika, dan Asia. Tanaman ini sudah dibudidayakan si Mesir sejak 3000 tahun yang lalu serta cara penanamannya dikenal dari Timur Tengah sampai Yunani, Italia, Eropa, dan Asia (Sutarno dan Atmowidjojo, 2001).
2.1.4 Nama Daerah Tanaman Kemangi
Nama daerah dari tanaman kemangi (Ocimum citriodorum Vis.) adalah sebagai berikut: Saraung (Sunda), Lampes (Jawa Tengah), Kemangek (Madura), Uku-uku (Bali), Lufe-lufe ( Ternate), Hairy Basil (Inggris) (Voight, 1995).
2.1.5 Manfaat Tanaman Kemangi
Tanaman kemangi (Ocimum citriodorum Vis.) memiliki banyak sekali manfaat, seperti bumbu penyedap makanan dan memberikan keharuman baik daun yang di keringkan atau daun segar. Beberapa manfaat lain bagi kesehatan tubuh seperti mengatasi demam, mencegah gangguan jantung, anti inflamasi, menurunkan efek nikotin, menurunkan stress, mencegah penyakit diabetes serta mengatasi batu ginjal.
2.1.6 Kandungan Kimia Tanaman Kemangi
Tanaman kemangi (Ocimum citriodorum Vis.) memiliki kandungan kimia pada bunga, daun, ataupun batangnya. Kandungan kimia tertinggi dari tanaman kemangi (Ocimum citriodorum Vis.) terdapat pada daunnya (Kicel, 2005). Daun kemangi (Ocimum citriodorum Vis.) mengandung flavonoid, saponin, tannin, dan minyak atsiri yang mengandung eugenol sebagai komponen utama (Peter, 2002).
Flavonoid merupakan senyawa yang mudah larut dalam pelarut polar, seperti etanol, butanol, serta aseton. Flavonoid merupakan senyawa fenol yang berfungsi sebagai antibakteri. Flavonoid bekerja dengan merusak membran sel sehingga terjadi perubahan permeabilitas sel yang dapat mengakibatkan terhambatnya pertumbuhan sel (Anggraini dan Saputra, 2016).
Saponin bekerja sebagai antibakteri dengan mengganggu stabilitas membran sel bakteri sehingga menyebabkan sel bakteri lisis (Ganiswarna, 1995).
Sementara itu, tannin dapat menyebabkan kerusakan dinding sel dengan cara mengerutkan dinding sel, sehingga mengganggu permeabilitas dinding sel itu sendiri, akibatnya pertumbuhannya menjadi terhambat (Ajizah, 2004).
Minyak atsiri berperan sebagai antibakteri dengan cara menggangu proses terbentuknya membran atau dinding sel sehingga tidak terbentuk atau terbentuk tidak sempurna (Ajizah, 2004).
2.2 ESCHERICHIA COLI
Escherichia coli adalah salah satu jenis bakteri gram negatif yang secara normal hidup dalam saluran pencernaan baik manusia maupun hewan yang sehat. Nama bakteri ini diambil dari nama Theodor Escherich, dokter anak German-Austria yang pada tahun 1885 mengisolasi bakteri ini dari sampel tinja bayi. Escherich awalnya bernama “Bacterium coli commune”. Castellani dan Chalmers mengusulkan nama Escherichia coli pada tahun 1919, tetapi tidak secara resmi diakui sampai tahun 1958 (Henry, 2015).
2.2.1 Taksonomi Escherichia coli
Klasifikasi Escherichia coli adalah berikut:
Kingdom : Bacteria Filum : Proteobacteria
Class : Gamma Proteobacteria Ordo : Enterobacteriales Famili : Enterobacteriaceae Genus : Escherichia
Spesies : Escherichia coli (Hardjoeno, 2007)
2.2.2 Morfologi bakteri Escherichia coli
E.coli merupakan bakteri gram negatif berbentuk batang pendek (cocobasil) dengan ukuran 0,4-0,7 μm x 1,4 μm, bersifat motil (dapat bergerak), tidak memiliki nukleus, tidak membentuk spora, dan memiliki organel eksternal yakni vili yang merupakan filamen tipis dan lebih panjang, E.coli merupakan bakteri anaerobik fakultatif yang dapat tumbuh pada keadaan aerob maupun anaerob, bakteri yang tergolong dalam anaerob fakultatif merupakan bakteri patogen yang sering dijumpai (Jawetz, 2009).
Bakteri E.coli dapat tumbuh di beberapa media seperti Endo agar, MacConkay agar, dan Eosin Methylen Blue, bakteri ini mempunyai strain yang bersifat mikroaerofilik yaitu sangat membutuhkan oksigen untuk hidup tetapi dengan tanpa oksigen E.coli masih dapat hidup.
(a) (b)
(c)
Gambar 2.4 Koloni Escherichia coli
(a) Morfologi; (b) Di media Eosin Methylen Blue; (c) Pewarnaan Gram
2.2.3 Patogenesis
Bakteri E.coli merupakan bakteri Coliform dan hidup dalam saluran
pencernaan manusia sehingga bakteri E.coli termasuk dalam flora normal usus.
Tetapi jika bakteri E.coli ditemukan pada makanan dan minuman dapat dikatakan bahwa pengolahan makanan tersebut sudah tercemar atau berkontak dengan feses manusia dikarenakan kondisi tersebut dapat menyebabkan gangguan saluran pencernaan. Pada kondisi yang telah menimbulkan gejala seperti diare dapat dipengaruhi oleh jumlah koloni pada saluran pencernaan dan karakteristik
virulensinya (Rakhmawati, 2012). Berdasarkan sifat virulensinya bakteri E.coli digolongkan menjadi beberapa golongan, yaitu:
1. Enterotoxigenic Escherichia coli (ETEC)
Golongan ETEC merupakan penyebab diare yang sering pada bayi di negara berkembang, hal tersebut diakibatkan virulensi yang dihasilkan oleh ETEC yaitu enterotoksin dan antigen vili (fimbrae), enterotoksin ETEC berupa toksin tidak tahan panas (heat labile toxins) dan toksin tahan panas (heat stabile toxins).
Mekanisme infeksi ETEC di dalam tubuh yaitu ETEC menempel pada sel enterosit dengan vili kemudian berproliferasi dan berkolonisasi di mukosa usus sehingga menyebabkan peningkatan jumlah ETEC di dalam saluran pencernaan. Toksin yang dihasilkan oleh ETEC baik heat labile toxins atau heat stabile toxins akan berikatan dengan reseptor dan masuk ke dalam sel, toksin mengaktivasi guanilat siklase sehingga menyebabkan akumulasi cairan dan elektrolit di dalam lumen usus serta menghambat absorbsi. Toksin labil akan mengikat ribose adenosin difosfat (ADP) sehingga menghambat kegiatan GTPase (pemecah proteinG). Akibatnya, protein G ini meningkat dan merangsang adenilil siklase epitel yang berkepanjangan sehingga menyebabkan peningkatan jumlah adenosin monofosfat (AMP). Peningkatan AMP akan menyebabkan peningkatan sekresi pada sel-sel kelenjar di dalam usus yaitu dengan merangsang seksresi Cl-(hipersekresi) dengan membuka saluran klorida pada sel kripta dan menghambat absorbsi Na+ dari lumen ke dalam sel epitel usus.
Peningkatan kadar elektrolit dan air di dalam lumen usus dapat menyebabkan diare (Jawetz, 2009).
2. Enteropathogenic Escherichia coli (EPEC)
EPEC merupakan strain pertama diantara strain E.coli yang berhasil diidentifikasi sebagai penyebab diare pada pasien bayi dan anak-anak di Eropa. Oleh karena itu, EPEC merupakan penyebab diare cair yang sering terjadi pada bayi di negara berkembang tetapi dapat sembuh sendiri. EPEC akan menempel pada sel mukosa usus halus atau masuk kedalam mukosa yang dapat menyebabkan hilangnya mikrovili sehingga proses penyerapan terganggu dan terjadi diare (Jawetz, 2009).
3. Enteroinvasive Escherichia coli (EIEC)
EIEC mempunyai beberapa persamaan dengan Shigella yaitu dalam hal reaksi biokimia, serologi, dan sifat patogenitasnya. EIEC melakukan penetrasi di mukosa usus dan akan multiplikasi pada sel-sel epitel colon (usus besar). Kerusakan yang terjadi pada mukosa usus dapat menyebabkan diare berdarah. Gejala yang ditimbulkan mirip dengan disentri yang disebabkan oleh Shigella (Mahon et al., 2015).
4. Enterohaemorrhagic Escherichia coli (EHEC)
EHEC merupakan penyebab diare ringan dan hemorrhage colitis (radang usus besar). Transmisi EHEC dapat melalui makanan yang dihidangkan tidak higienis dan penularan secara spontan atau secara kontak langsung (person to person), EHEC memproduksi sitotoksin yang dapat menyebabkan terjadinya peradangan dan perdarahan yang meluas di usus besar yang dapat menyebabkan haemolytic uraemic syndrome terutama pada anak-anak. Gejala yang timbul ditandai dengan diare akut, kejang, demam, dan perlahan-lahan diare menjadi berdarah (Jawetz, 2009).
5. Enteroaggregative Escherichia coli (EAEC)
EAEC merupakan penyebab diare akut dan kronik dalam jangka waktu lebih dari 14 hari pada orang-orang di negara berkembang, EAEC memproduksi hemolisin dan Heat stabil toxin, enterotoksin seperti yang dikeluarkan oleh ETEC. Toksin yang dihasilkan oleh EAEC dapat melekat pada bagian mukosa lumen usus yang dapat menyebabkan diare pada anak-anak (Mahon et al., 2015).
2.3 EFEK SENYAWA KIMIA DAUN KEMANGI
Pengujian fitokimia pada ekstrak etanol daun kemangi (Ocimum citriodorum Vis.) menunjukkan hasil yang positif untuk golongan senyawa flavonoid, tannin, dan minyak atsiri. Sedangkan metabolit sekunder hasil negatif adalah saponin, alkaloid, dan steroid/terpenoid.
Kandungan metabolit sekunder yang terdapat dalam tumbuhan berbeda-beda karena dipengaruhi oleh faktor lingkungan. Metabolit sekunder berfungsi untuk
mempertahankan diri dari kondisi lingkungan yang kurang menguntungkan, misalnya untuk mengatasi hama dan penyakit (Verpoorte dan Alfermann, 2000).
Faktor penggunaan pelarut juga dapat berpengaruh terhadap hasil metabolit sekunder yang didapat. Golongan steroid/terpenoid merupakan senyawa yang larut dalam pelarut non polar seperti n-heksan, sedangkan senyawa flavonoid dan tannin dapat larut dalam pelarut polar seperti etanol, metanol, etilasetat atau pelarut polar lainnya, dan golongan alkaloid termasuk senyawa yang tidak larut dalam air (Harborne, 1987).
Mekansime kerja flavonoid dengan merusak membran sel bakteri pada bagian fosfolipid sehingga mengurangi permeabilitas mengakibatkan bakteri mengalami kerusakan yang dapat mengakibatkan terhambatnya pertumbuhan sel. Flavonoid bersifat antibakteri melalui 3 mekanisme, yaitu : menghambat sintesis asam nukleat, menghambat fungsi membran sel, dan menghambat metabolisme energi. Mekanisme kerja flavonoid dalam menghambat sintesis asam nukleat dilakukan melalui cincin B pada flavonoid yang mempunyai peranan penting dalam proses interkalasi atau ikatan hidrogen dengam menumpuk basa asam nukleat yang mengambat sintesis DNA dan RNA. Flavonoid menghambat fungsi membran sel bakteri melalui ikatan komplek dengan protein ekstraseluler yang berifat larut sehingga dapat mengganggu integritas membran sel bakteri. Adanya gangguan dalam permeabilitas membran sel ini akan mempengaruhi gradien elektrokimia proton yang melewati membran. Gradien elektrokimia proton melintasi membran sangat penting bagi bakteri dalam mensistesis ATP, transport membran, dan pergerakan bakteri, sehingga dengan adanya senyawa flavonoid akan menyebabkan terganggunya proton motive force yang berakibat terganggunya sintesis ATP, transport membran, dan pergerakan bakteri. Selain itu, penghambatan metabolisme energi bakteri oleh flavonoid dilakukan dengan cara menghambat proses respirasi bakteri sehingga adanya energi yang dihambat akan berpengaruh terhadap aktivitas penyerapan metabolit dan biosintesis makromomolekul bakteri. Terhentinya aktivitas metabolisme mengakibatkan kematian pada sel bakteri.
Senyawa tannin berperan sebagai antibakteri karena memiliki kemampuan membentuk senyawa kompleks dengan protein melalui ikatan hidrogen, jika terbentuk ikatan
hidrogen antara tannin dengan protein maka protein akan terdenaturasi sehingga metabolisme bakteri menjadi terganggu (Makkar et al., 1993).
Minyak atsiri merupakan minyak yang mudah menguap, minyak atsiri umumnya dibagi menjadi dua komponen yaitu golongan hidrokarbon dan golongan hidrokarbon teroksigenasi (Robinson, 1995). Senyawa-senyawa turunan hidrokarbon teroksigenasi (fenol) memiliki daya antibakteri yang kuat. Minyak atsiri menggangu proses terbentuknya membran atau dinding sel sehingga tidak terbentuk atau terbentuk tidak sempurna.
2.4 EKSTRAKSI
Ekstrak merupakan sediaan sari pekat tumbuh-tumbuhan atau hewan yang diperoleh dengan cara melepaskan zat aktif dari masing-masing bahan obat, menggunakan menstrum yang cocok, uapkan semua atau hampir semua dari pelarutnya dan sisa endapan atau serbuk diatur untuk ditetapkan standarnya (Ansel, 1989).
Menurut Farmakope Indonesia Edisi IV, ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua pelarut yang diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian sehingga memenuhi baku yang telah ditentukan (Depkes RI,1995).
Ekstraksi merupakan proses pemisahan bahan dari campurannya dengan menggunakan pelarut yang sesuai. Proses ekstraksi dihentikan ketika tercapai kesetimbangan antara konsentrasi senyawa dalam pelarut dengan konsentrasi dalam sel tanaman. Setelah proses ekstraksi, pelarut dipisahkan dari sampel dengan penyaringan.
2.4.1 Prinsip Ekstraksi
Prinsip ekstraksi adalah melarutkan dan menarik senyawa dengan menggunakan pelarut yang tepat. Ada 3 tahap proses pada waktu ekstraksi, yaitu:
a. Penetrasi pelarut ke dalam sel tanaman dan pengembangan sel
b. Disolusi pelarut ke dalam sel tanaman dan pengembangan sel c. Difusi bahan yang terekstraksi ke luar sel
Dari proses diatas, diharapkan terjadi kesetimbangan antara larutan dan pelarut.
Kecepatan untuk mencapai kesetimbangan umumnya tergantung pada suhu, pH, ukuran partikel dan gerakan partikel. Prinsip utama adalah berkaitan dengan kelarutan, yaitu senyawa polar lebih mudah larut dalam pelarut polar dan senyawa nonpolar akan mudah larut dalam pelarut nonpolar (Emilan et al., 2011).
2.4.2 Metode Ekstraksi
Metode ekstraksi dapat dibagi menjadi dua macam, yaitu ekstraksi cara dingin dan ekstraksi cara panas. Ekstraksi cara dingin antara lain maserasi dan perkolasi, sedangkan ekstraksi cara panas antara lain refluks, soklet, destilasi, infus dan dekoksi (Emilan et al., 2011).
2.4.2.1 Metode ekstraksi cara dingin
Pada metode ini tidak dilakukan pemanasan selama proses ekstraksi berlangsung, agar senyawa yang diinginkan tidak menjadi rusak (Chandra dan Novalia, 2014).
a.Maserasi
Istilah maserasi berasal dari bahasa Latin macerace, yang artinya mengairi, melunakkan. Maserasi merupakan cara ekstraksi yang paling sederhana dan paling banyak digunakan (Agoes, 2007). Maserasi merupakan metode ekstraksi dengan menggunakan pelarut diam atau dengan adanya pengadukan beberapa kali pada suhu ruangan. Metode ini dapat dilakukan dengan cara merendam bahan dengan sesekali dilakukan pengadukan. Pada umumnya perendaman dilakukan selama 24 jam, kemudian pelarut diganti dengan pelarut baru. Maserasi juga dapat dilakukan dengan pengadukan secara sinambung (maserasi kinetik). Kelebihan dari metode ini, yaitu efektif untuk senyawa yang tidak tahan panas (terdegradasi karena panas), peralatan yang digunakan relatif sederhana, murah, dan mudah didapat. Namun, metode ini juga memiliki beberapa kelemahan, yaitu waktu ekstraksi yang lama dan membutuhkan pelarut dalam jumlah yang banyak (Chandra dan Novalia, 2014).
b.Perkolasi
Istilah perkolasi berasal dari bahasa latin per yang artinya melalui dan colare yang artinya merembes. Jadi, perkolasi adalah penyarian dengan mengalirkan cairan penyari melalui serbuk simplisia yang telah dibasahi. Alat yang digunakan untuk mengekstraksi disebut perkolator, dengan ekstrak yang telah dikumpulkan disebut perkolat (Ansel, 1989). Prosedur metode ini, yaitu bahan direndam dengan pelarut, kemudian pelarut baru dialirkan secara terus-menerus sampai warna pelarut tidak lagi berwarna atau tetap bening yang artinya sudah tidak ada lagi senyawa yang terlarut. Kelebihan dari metode ini adalah tidak diperlukan proses tambahan untuk memisahkan padatan dengan ekstrak, sedangkan kelemahan metode ini adalah jumlah pelarut yang dibutuhkan cukup banyak dan proses juga memerlukan waktu yang cukup lama, serta tidak meratanya kontak antara padatan dengan pelarut (Chandra dan Novalia, 2014).
2.4.2.2 Metode ekstraksi cara panas
Metode ini melibatkan pemanasan selama proses ekstraksi berlangsung.
Adanya panas secara otomatis akan mempercepat proses ekstraksi dibandingkan dengan cara dingin. Beberapa jenis metode ekstraksi cara panas, yaitu:
a.Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna (Depkes RI, 2000). Kelebihan metode refluks adalah padatan yang memiliki tekstur kasar dan tahapan terhadap pemanasan langsung dapat diekstrak dengan metode ini.
Kelemahan metode ini adalah membutuhkan jumlah pelarut yang banyak (Chandra dan Novalia, 2014).
b.Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilarutkan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut yang relatif konstan dengan adanya pendingin balik. Kelebihan metode soxhlet adalah proses ekstraksi berlangsung secara kontinu, memerlukan waktu ekstraksi yang lebih singkat dan jumlah pelarut yang lebih sedikit bila dibandingkan dengan metode maserasi atau perkolasi. Kelemahan dari metodi ini adalah dapat menyebabkan rusaknya solute atau komponen lainnya yang tidak tahan panas karena pemanasan ekstrak yang dilakukan secara terus-menerus.
c.Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada suhu ruang (kamar). Secara umum, proses digesti dilakukan pada suhu 40-50 ͦ C.
d.Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-98ºC selama waktu tertentu (15-20 menit).
e.Dekok
Dekok adalah infus pada waktu yang lebih lama (suhu lebih dari 30ºC) dan temperatur sampai titik didih air (Chandra dan Novalia, 2014).
2.5 PENGUKURAN AKTIVITAS MIKROBA
Penentuan kepekaan bakteri patogen terhadap antimikroba dapat dilakukan dengan salah satu dari dua metode dasar, yaitu difusi dan dilusi. Metode standar sangat penting digunakan untuk mengendalikan semua faktor yang mempengaruhi aktivitas mikroba (Brooks et al., 2013).
2.5.1 Metode difusi
Prinsip dari metode difusi cakram adalah menempatkan kertas cakram yang sudah mengandung bahan antimikoba tertentu pada medium lempeng padat yang telah dicampur dengan bakteri yang akan diuji. Medium ini kemudian diinkubasi pada suhu 37ºC selama 18-24 jam, selanjutnya diamati adanya zona jernih di sekitar
kertas cakram. Daerah jernih yang tampak di sekeliling kertas cakram menunjukkan tidak adanya pertumbuhan mikroba. Bakteri yang sensitif terhadap bahan antimikroba akan ditandai dengan adanya daerah hambatan disekitar cakram, sedangkan jamur yang resisten terlihat tetap tumbuh pada tepi kertas cakram (Tortora et al., 2001).
2.5.2 Metode dilusi
Cara ini digunakan untuk menentukan kadar hambat minimum dan kadar bunuh minimum dari bahan antimikroba. Prinsip dari metode dilusi menggunakan satu seri tabung reaksi yang diisi medium cair dan sejumlah tertentu sel mikroba yang diuji.
Selanjutnya masing-masing tabung diisi dengan bahan antimikroba yang telah diencerkan secara serial, kemudian seri tabung diinkubasi pada suhu 37ºC selama 18-24 jam dan diamati terjadinya kekeruhan konsentrasi terendah bahan antimikroba pada tabung yang ditunjukkan dengan hasil yang mulai tampak jernih (tidak ada pertumbuhan bakteri merupakan konsentrasi hambat minimum). Biakan dari semua tabung yang jernih ditumbuhkan pada medium agar padat, diinkubasi selama 24 jam, dan diamati ada tidaknya koloni bakteri yang tumbuh. Konsentrasi terendah obat pada biakan pada medium padat yang ditunjukan dengan tidak adanya pertumbuhan bakteri adalah merupakan konsentrasi bunuh minimum bahan antimikroba terhadap bakteri uji (Tortora et al., 2001).
2.6 KERANGKA TEORI
Gambar 2.5 Kerangka Teori
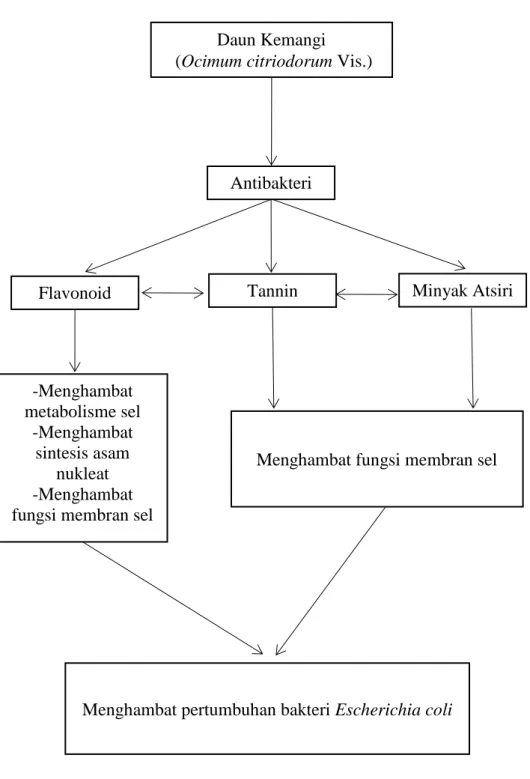
Daun Kemangi (Ocimum citriodorum Vis.)
Antibakteri
Minyak Atsiri
Flavonoid Tannin
-Menghambat metabolisme sel
-Menghambat sintesis asam
nukleat -Menghambat fungsi membran sel
Menghambat fungsi membran sel
Menghambat pertumbuhan bakteri Escherichia coli
2.7 KERANGKA KONSEP
Variabel Independen Variabel dependen
Gambar 2.6 Kerangka Konsep
2.8 HIPOTESIS 2.8.1 Hipotesis Mayor
Ekstrak daun kemangi (Ocimum citriodorum Vis.) memiliki pengaruh dalam menghambat pertumbuhan bakteri Escherichia coli.
2.8.2 Hipotesis Minor
a. Ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 50%
memiliki pengaruh dalam menghambat pertumbuhan bakteri Escherichia coli.
b. Ekstrak daun kemamgi (Ocimum citriodorum Vis.) dengan konsentrasi 25%
memiliki pengaruh dalam menghambat pertumbuhan bakteri Escherichia coli.
c. Ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 12,5%
memiliki pengaruh dalam menghambat pertumbuhan bakteri Escherichia coli.
d. Ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 6,25%
1. Ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 6,25%.
2. Ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 12,5%.
3. Ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 25%.
4. Ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 50%.
Diameter zona hambat pertumbuhan bakteri Escherichia coli
memiliki pengaruh dalam menghambat pertumbuhan bakteri Escherichia coli.
BAB III
METODE PENELITIAN
3.1 JENIS PENELITIAN
Jenis penelitian yang dilakukan adalah eksperimental laboratorik (Experimental Research Laboratory). Rancangan penelitian yang digunakan adalah Posttest only control group design.
3.2 WAKTU DAN TEMPAT PENELITIAN 3.2.1 WAKTU PENELITIAN
Penelitian ini dilakukan pada bulan Juli sampai dengan Oktober 2019.
3.2.2 TEMPAT PENELITIAN
Penelitian ini dimulai dengan pembuatan ekstrak daun kemangi (Ocimum citriodorum Vis.) di Laboratorium Biologi Farmasi Fakultas Farmasi Universitas Sumatera Utara dan dilanjutkan dengan melakukan uji daya hambat ekstrak daun kemangi (Ocimum citriodorum Vis.) terhadap pertumbuhan bakteri Escherichia coli di Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Sumatera Utara.
3.3 POPULASI DAN SAMPEL PENELITIAN 3.3.1 Populasi
a) Kelompok I : Kontrol positif (terapi standard) dengan gentamisin.
b) Kelompok II : Kontrol negatif menggunakan DMSO (Dimethyl sufoxide).
c) Kelompok III : Eksperimen ekstrak etanol 96% daun kemangi (Ocimum citriodorum Vis.) 50%.
d) Kelompok IV : Eksperimen ekstrak etanol 96% daun kemangi (Ocimum citriodorum Vis.) 25%.
e) Kelompok V : Eksperimen ekstrak etanol 96% daun kemangi (Ocimum citriodorum Vis.) 12,5%.
f) Kelompok VI : Eksperimen ekstrak etanol 96% daun kemangi (Ocimum citriodorum Vis.) 6,25%.
3.3.2 Sampel
Sampel yang digunakan untuk penelitian ini adalah bakteri Escherichia coli yang diberikan ekstrak daun kemangi (Ocimum citriodorum Vis.) Bakteri Escherichia coli diperoleh dari Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Sumatera Utara, sedangkan daun kemangi (Ocimum citriodorum Vis.) diperoleh dari kebun yang berada di daerah Medan Labuhan.
Besar sampel dihitung dengan dengan rumus Federer, dengan perhitungan sampel sebagai berikut:
(t-1)(n-1) ≥ 15
Keterangan:
t = banyak kelompok diperlakukan
n = jumlah sampel tiap kelompok diperlakukan
(t-1)(n-1) ≥ 15 (6-1)(n-1) ≥ 15 5(n-1) ≥ 15 5n-5 ≥ 15 5n ≥ 20 n ≥ 4
Dalam penelitian ini dilakukan sebanyak enam perlakuan, yaitu pemberian ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 6,25%, 12,5%, 25%, 50%, kontrol positif gentamisin dan kontrol negatif
Dimethyl Sulfoxide (DMSO). Keenam perlakuan ini diulang sebanyak empat kali sehingga jumlah sampel seluruhnya adalah 24 biakan.
3.3.3 Kriteria Inklusi dan Kriteria Eksklusi
3.3.3.1 Kriteria Inklusi
1. Biakan bakteri Escherichia coli dengan jumlah koloni standar terdiri dari 1x106 CFU/mL tanpa kontaminan.
2. Tanaman Kemangi (Ocimum citriodorum Vis.) diambil dari perkebunan yang bebas pestisida.
3.3.3.2 Kriteria Eksklusi
Kriteria eksklusi sampel penelitian adalah:
1. Cawan petri rusak.
2. Media yang tidak ditumbuhi biakan bakteri Escherichia coli.
3.4 METODE PENGUMPULAN DATA
Jenis data yang dikumpul dari penelitian ini berupa data primer, dimana peneliti mengukur diameter zona hambat yang timbul pada pertumbuhan koloni bakteri Escherichia coli setelah diberi intervensi dengan ekstrak daun kemangi (Ocimum citriodorum Vis..) dengan konsentrasi yang berbeda.
3.4.1 Alat dan Bahan Penelitian 3.4.1.1 Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah blender (National), vacuum rotary evaporator, kain lap, kertas saring, cawan penguap, erlenmeyer (Pyrex), gelas ukur (Pyrex), tabung reaksi (Pyrex), rak tabung reaksi, spatula, batang pengaduk, corong, cawan petri, ose, pembakar bunsen, gelas objek, deck glass, mikroskop (Olympus), pipet tetes, mikropipet, inkubator, laminar air flow,
timbangan digital, autoklaf, microwave, freezedryer, pelubang gabus, vortex, dan jangka sorong.
3.4.1.2 Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah daun kemangi (Ocimum citriodorum Vis.), Eosin Methylen Blue (EMB) Agar, Mueller Hinton Agar (Oxoid), Nutrient Broth (Oxoid), gentamisin, air, Dimethyl Sulfoxide (DMSO), etanol 96%, reagen pewarnaan Gram, standar McFarland, dan suspensi bakteri Escherichia coli.
3.4.2 Determinasi Tanaman
Tahap pertama penelitian adalah melakukan determinasi tanaman kemangi (Ocimum citriodorum Vis.). Determinasi tanaman dilakukan dengan menunjukkan tanaman kemangi (Ocimum citriodorum Vis.) dan menetapkan kebenarannya sesuai ciri-ciri morfologi. Determinasi tanaman dilakukan di Laboratorium Herbarium Medanense (MEDA) Universitas Sumatera Utara.
3.4.3 Pembuatan Ekstrak
Ekstrak tanaman kemangi (Ocimum citriodorum Vis.) dibuat dengan metode maserasi menggunakan pelarut etanol 96%. Metode maserasi dipilih karena metode ini mudah dilakukan dan murah. Sebanyak 2kg daun kemangi (Ocimum citriodorum Vis.) dibersihkan dari kotoran, dicuci dengan air mengalir sampai bersih dan dikeringkan dalam lemari pengering dengan lampu 25 watt selama 48 jam. Kemudian, daun kemangi (Ocimum citriodorum Vis.) dihaluskan menggunakan blender. Setelah itu, daun kemangi (Ocimum citriodorum Vis.) yang telah halus dimaserasi dengan 15 L etanol 96% di dalam bejana kemudian ditutup rata dan direndam selama 5 hari sambil sesekali diaduk. Setelah 5 hari, larutan ekstrak daun kemangi (Ocimum citriodorum Vis.) disaring sehingga diperoleh fitrat dan ampas. Selanjutnya, dilakukan perendaman kembali terhadap ampas tersebut dengan menggunakan etanol 96% sebanyak 5 L selama 2 hari sambil sesekali diaduk kemudian disaring menggunakan corong dan kertas saring dan ditampung.
Setelah itu, semua filtrat dikumpulkan dan dimasukkan ke dalam vacuum rotary evaporator, selanjutnya filtrat yang tersisa diuapkan menggunakan cawan penguap didalam waterbath sehingga diperoleh ekstrak kental.
3.4.4 Pembuatan Seri Konsentrasi Ekstrak
Ekstrak daun kemangi (Ocimum citriodorum Vis.) yang terbentuk (kadar konsentrasi 100%) akan diencerkan dengan menggunakan DMSO dengan tingkat konsentrasi 6,25%, 12,5%, 25%, dan 50% menggunakan rumus pengenceran :
N1 x V1 = N2 x V2
Keterangan :
N1 = Konsentrasi 100% (%)
V1 = Volume larutan dengan konsentrasi 100% yang diperlukan (mL) N2 = Konsentrasi yang diinginkan (%)
V2 = Volume konsentrasi yang diinginkan (mL)
3.4.5 Pembuatan Suspensi Bakteri
Bakteri E. coli diambil sebanyak satu ose dari kultur, kemudian diinkubasikan ke dalam media Nutrient Broth, selanjutnya diinkubasi pada suhu 37°C selama 2-4 jam. Setelah 2-4 jam, suspensi bakteri yang telah diinkubasi disesuaikan dengan standar kekeruhan larutan McFarland 0,5 sehingga jumlah bakteri yang didapatkan setara dengan 1x108 CFU/mL. Standar McFarland digunakan untuk memperkirakan secara visual konsentrasi sel yang ada di dalam suspensi. Standar McFarland 0,5 dibuat dengan cara mencampurkan larutan BaCl2 1% sebanyak 0,05 mL dan larutan H2SO4 sebanyak 9,95 mL. Pada uji efektivitas animikroba terhadap bakteri, jumlah inokulum yang digunakan sebanyak 1x106 CFU/mL (Sutton, 2011).
Jumlah bakteri tersebut dadapatkan dengan cara mengambil sebanyak 1 mL dari suspensi bakteri yang telah disesuaikan dengan standar McFarland 0,5, kemudian masukkan ke dalam tabung reaksi yang sudah diberi media Nutrient Broth sebanyak 9 mL. Selanjutnya, suspensi dihomogenkan menggunakan vortex. Hasil akhir suspensi tersebut menentukan jumlah bakteri sebanyak 1x107 CFU/mL. Lakukan
pengulangan yang sama tanpa melakukan proses inkubasi dengan mengambil 1 mL dari suspensi dengan jumlah bakteri 1x107 CFU/mL, mengambil tabung reaksi yang baru yang telah diisi dengan media Nutrient Broth sebanyak 9 mL dan dihomogenkan kembali menggunakan vortex. Hasil akhir suspensi ini menunjukkan jumlah bakteri sebanyak 1x106 CFU/mL.
3.4.6 Idetifikasi Bakteri 3.4.6.1 Pewarnaan Gram
Bersihkan gelas objek dengan kain bersih agar tidak berlemak dan dilayangkan diatas nyala api. Teteskan satu tetes akuades pada gelas objek dan suspensi bakteri E.coli diambil sebanyak 1 ujung mata ose. Suspensikan jamur pada tetesan akuades lalu sebarkan dengan gerakan memutar agar rata. Luas sediaan 1-2 cm². Spesimen dibiarkan mengering diudara, kemudian lewatkan diatas nyala api bunsen sebanyak 3 kali agar sediaan melekat sempurna di atas permukaan gelas objek dan spesimen siap untuk diwarnai.
Spesimen yang telah siap untuk diwarnai digenangi dengan zat warna crystal violet selama 1 menit. Setelah itu, spesimen dibilas dengan air kran sampai zat warna luntur selama 5-10 detik. Kemudian, spesimen digenangi dengan larutan lugol selama 1 menit. Selanjutnya, spesimen dibilas kembali dengan air. Spesimen kembali digenangi dalam alkohol 96% selama 30 detik dan dibilas dengan air.
Spesimen digenangi lagi dengan safranin selama 1-2 menit dan spesimen kembali dibilas dengan air. Setelah itu spesimen dikeringkan diudara dan spesimen siap diamati dibawah mikroskop.
3.4.6.2 Uji Biokimia
Bakteri E. coli diambil menggunakan ose dan diinokulasikan ke dalam media selektif Eosin Methylen Blue. Setelah itu, media diinkubasikan selama 18-24 jam pada suhu 37°C. Kemudian amati perubahan warna pada media dan koloni yang tumbuh.
3.4.7 Pembuatan Media Mueller Hinton Agar
Serbuk Mueller Hinton Agar sebanyak 60 gram dimasukkan ke dalam tabung erlenmeyer dan dilarutkan dengan 1000 mL akuades. Suspensi yang dihasilkan dipanaskan hingga mendidih. Selanjutnya, tabung dimasukkan ke dalam autoklaf dengan suhu 121°C selama 15 menit. Kemudian, tabung erlenmeyer dimasukkan ke dalam inkubator dengan suhu 37°C selama 24 jam.
3.4.8 Uji Aktivitas Antibakteri
Metode yang digunakan untuk uji aktivitas antibakteri ini adalah metode difusi dengan cara sumuran. Suspensi bakteri E. coli diambil sebanyak 0,1 mL lalu dihomogenkan ke dalam cawan petri. Kemudian, media Mueller Hinton Agar diambil dari tabung erlenmeyer sebanyak 15 mL dan dihomogenkan ke dalam cawan petri yang terisi suspensi bakteri E. coli. Selanjutnya, media dibiarkan memadat.
Metode uji aktivitas antibakteri ini menggunakan metode sumuran. Metode ini menggunakan sumur sebagai tempat meletakkan zat antibakteri yang akan diuji.
Media Mueller Hinton Agar yang telah padat dilubangi menggunakan alat pelubang gabus dengan diameter 6 mm (Balouiri et al., 2016). Kemudian ekstrak etanol daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 6,25%, 12,5%, 25%, dan 50% masing-masing sebanyak 25μL dimasukkan ke dalam lubang tersebut. Media Mueller Hinton Agar yang telah mengalami perlakuan tersebut diinkubasikan selama 18-24 jam pada suhu 37°C tanpa dibalik.
Pada penelitian ini, kontrol positif digunakan gentamisin, sedangkan sebagai kontrol negatif digunakan DMSO.
Hasil aktivitas antibakteri ekstrak etanol daun kemangi (Ocimum citriodorum Vis.) diamati secara visual dengan mengukur diameter zona hambat di sekitar sumuran menggunakan jangka sorong.
3.5 METODE ANALISA DATA
Data yang dikumpulkan akan diolah dan dianalisis dengan menggunakan program Statistical Product Service Solution for Windows (SPSS). Data yang telah didapat dilakukan uji normalitas Shapiro-Wilk. Uji ini digunakan untuk melihat normalitas distribusi data, mengetahui apakah data yang diperoleh berdistribusi normal atau tidak. Data yang berdistribusi normal memiliki nilai p>0,05, sedangkan data yang tidak berdistribusi normal memiliki nilai p<0,05.
Selanjutnya, data dilakukan uji homogenitas Levene untuk mengetahui varian data, apakah varian homogen atau tidak. Apabila data homogen, dapat dilakukan analisis varian satu arah (One way Anova). Uji ini dilakukan untuk mengetahui apakah ada hubungan antara variabel-variabel yang diuji.
3.6 VARIABEL PENELITIAN 3.6.1 Variabel Independen
Variabel independen (bebas) dalam penelitian ini adalah ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan berbagai konsentrasi. Konsentrasi tersebut diuji secara bertahap dengan konsentrasi 6,25%, 12,5%, 25%, dan 50%.
3.6.2 Variabel Dependen
Variabel dependen (terikat) dalam penelitian ini adalah diameter zona hambat pertumbuhan bakteri Escherichia coli pada media Mueller Hinton Agar di sekitar sumuran.
3.7 DEFENISI OPERASIONAL
Tabel 3.1 Definisi operasional.
No Variabel Definisi Operasional Cara
Ukur Alat Ukur Hasil Ukur Skala Ukur 1. Ekstrak daun
kemangi
Ekstrak daun kemangi dipersiapkan dengan diencerkan dengan DMSO dalam beberapa konsentrasi.
Observasi Mikropipet dan tabung reaksi
Konsentrasi 6,25%, 12,5%, 25%, 50%
Rasio
2. Kadar Hambat Minimum
Kadar hambat minimum dinilai dengan mengukur diameter zona terang (clear zone) di sekeliling sumuran.
Observasi Jangka sorong
Milimeter (mm)
Rasio
3. Kadar Bunuh Minimum
Kadar bunuh minimum dinilai dengan mengukur diameter zona terang (clear zone) di sekeliling sumuran.
Observasi Jangka sorong
Milimeter (mm)
Rasio
4. Media Tumbuh
Media yang digunakan untuk menumbuhkan dan membiakkan bakteri E.coli
Observasi - Layak jika pantri tidak pecah dan biakan tumbuh.
Tidak layak jika pantri pecah dan biakan tidak tumbuh
Nominal
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
4.1 HASIL PENELITAN
Proses pengambilan data ini dilakukan dengan observasi yang dilakukan dengan mengamati uji daya hambat ekstrak daun kemangi (Ocimum citriodorum Vis.) Dilakukan enam perlakuan, yaitu dengan konsentrasi 6,25%, 12,5%, 25%, dan 50%, kontrol positif gentamisin dan kontrol negatif DMSO. Setiap perlakuan dilakukan pengulangan sebanyak empat kali. Hasil penelitian yang telah telah dikumpulkan kemudian dianalisa, sehingga dapat disimpulkan hasil penelitain seperti dipaparkan di bawah ini.
4.1.1 Lokasi Penelitian
Penelitian ini dilakukan di tiga tempat, di Laboratorium Herbarium Medanense (MEDA) Universitas Sumatera Utara dinyatakan bahwa tanaman yang digunakan dalam penelitian ini adalah daun kemangi (Ocimum citriodorum Vis.), di Laboratorium Biologi Farmasi Fakultas Farmasi Universitas Sumatera Utara dilakukan pembuatan ekstrak daun kemangi (Ocimum citriodorum Vis.), dan di Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Sumatera Utara dilakukan uji daya hambat ekstrak daun kemangi (Ocimum citriodorum Vis.) terhadap pertumbuhan bakteri E.coli.
4.1.2 Karakteristik Sampel
Data yang digunakan adalah jenis data primer karena data diambil secara langsung oleh peneliti. Sampel yang digunakan untuk penelitian ini adalah bakteri E.coli yang diberikan ekstrak daun kemangi (Ocimum citriodorum Vis.) Dilakukan sebanyak enam perlakuan, yaitu pemberian ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 6,25%, 12,5%, 25%, 50%, kontrol
positif gentamisin dan kontrol negatif Dimethyl Sulfoxide (DMSO). Keenam perlakuan ini diulang sebanyak empat kali sehingga jumlah sampel seluruhnya adalah 24 biakan. Bakteri E.coli yang digunakan merupakan bakteri bakteri E.coli ATCC 25922 dari Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Sumatera Utara. Sebelum bakteri E.coli digunakan, dilakukan identifikasi &
pewarnaan Gram untuk memastikan bakteri tidak terkontaminasi.
4.1.3 Zona Hambat
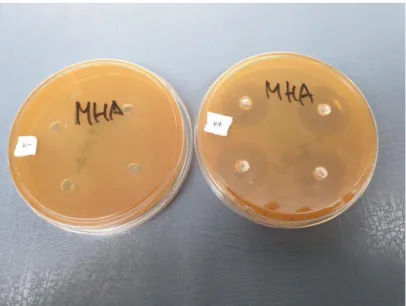
Hasil penelitian daya antibakteri ekstrak daun kemangi (Ocimum citriodorum Vis.) terhadap pertumbuhan bakteri E.coli di media Mueller Hinton Agar dengan metode difusi sumuran dibuktikan dengan adanya zona bening atau zona hambat di sekitar area sumuran.
Gambar 4.1 Zona hambat ekstrak daun kemangi terhadap pertumbuhan bakteri E.coli
Gambar 4.2 Zona hambat kontrol positif gentamisin dan kontrol negatif DMSO terhadap pertumbuhan bakteri E.coli
Tabel 4.1 Hasil pengukuran diameter zona hambat konsentrasi ekstrak daun kemangi (Ocimum citriodorum Vis.) terhadap pertumbuhan bakteri E.coli
Diameter Zona Hambat (mm) Pengulangan DMSO Ekstrak
6,25%
Ekstrak 12,5%
Ekstrak 25%
Ekstrak
50% Gentamisin
I 0 4,5 5,5 6,6 7,5 19,6
II 0 5,9 5,9 7,0 7,5 17,8
III 0 6,3 7,9 8,0 7,9 16,4
IV 0 5,7 6,9 7,5 8,2 18
Mean ±SD 0 5,600±
0,774
6,550 ± 1,075
7,275±
0,607
7,775±
0,340
17,950±
1,310
Tabel 4.1 menunjukkan bahwa ekstrak daun kemangi (Ocimum citriodorum Vis.) dengan konsentrasi 6,25%, 12,5%, 25%, dan 50% memiliki diameter zona hambat yang lebih kecil daripada kontrol positif gentamisin. Hal ini menunjukkan bahwa ekstrak daun kemangi (Ocimum citriodorum Vis.) memiliki aktivitas antibakteri terhadap bakteri E.coli, tetapi efek antibakterinya tidak sekuat kontrol positif dan kontrol negatif DMSO tidak memiliki zona hambat.
Berdasarkan hasil uji varian satu arah (One Way ANOVA), didapat nilai signifikansi 0,000 (p<0,05). Hal ini menunjukkan bahwa terdapat perbedaan
bermakna pada variasi konsentrasi ekstrak daun daun kemangi (Ocimum citriodorum Vis.) dalam menghambat pertumbuhan bakteri E.coli.
4.2 PEMBAHASAN
Pembuatan ekstrak dapat dibagi menjadi dua motode, yaitu ekstraksi cara dingin dan cara panas. Menurut penelitian Sanjaya dan Angga (2012) pembuatan ekstrak dengan motode cara panas, yaitu soxhlet menghasilkan intensitas warna yang lebih tinggi dibandingkan dengan metode cara dingin, yaitu maserasi. Pada metode soxhlet tidak memerlukan banyak pelarut dan sampel yang dibutuhkan sedikit. Namun, tumbuhan mudah rusak dan pelarut mudah menguap. Dalam penelitian ini, ekstrak daun kemangi (Ocimum citriodorum Vis.) didapatkan dengan metode maserasi. Metode ini efektik untuk senyawa yang tidak tahan panas dan tidak merusak komponen kimia serta pengerjaan dan peralatan yang digunakan sederhana dan mudah didapatkan. Namun, metode ini membutuhkan waktu yang cukup lama dan membutuhkan pelarut dalam jumlah yang banyak.
Pada penelitian ini, maserasi sampel menggunakan pelarut etanol 96% karena larutan tersebut bersifat polar, sehingga dapat melarutkan senyawa metabolit sekunder pada tanaman. Menurut Helmi et al. (2004) pelarut etanol mampu melarutkan hampir semua zat, baik yang bersifat polar, semi polar, dan non polar serta kemampuannya untuk mengendapkan protein dan menghambat kerja enzim sehingga dapat terhindar proses hidrolisis dan oksidasi.
Setelah pembuatan ekstrak daun kemangi (Ocimum citriodorum Vis.), selanjutnya adalah pembuatan konsentrasi ekstrak daun kemangi (Ocimum citriodorum Vis.) Penelitian yang dilakukan oleh Maria et al. (2015) konsentrasi ekstrak daun kemangi (Ocimum citriodorum Vis.) yang digunakan yaitu 20%, 40%, 60%, 80%, 100%, kontrol positif Thiamfenicol, dan kontrol negatif DMSO. Hasil penelitian tersebut menunjukkan bahwa diameter zona hambat yang terbentuk saat konsentrasi 20%, 40%, 60%, 80%, 100%, kontrol positif Thiamfenicol, dan kontrol negatif DMSO adalah 6,28 mm, 6,74 mm, 7,55 mm, 8,89 mm, 9,54 mm, 13,57, dan 0. Pada penelitian ini konsentrasi ekstrak daun kemangi (Ocimum citriodorum Vis.) yang digunakan yaitu 6,25%, 12,5%, 25%, dan 50%, kontrol positif gentamisin,
dan kontrol negatif DMSO dengan zona hambat yang terbentuk dengan rata-rata 5,600 mm, 6,550 mm, 7,275 mm, 7,775 mm, 17,950 mm, dan 0. Penelitian ini menunjukkan adanya aktivitas antibakteri terhadap pertumbuhan E.coli yang ditandai dengan terbentuknya zona hambat. Semakin tinggi konsentrasi ekstrak menandakan semakin banyak senyawa metabolit sekunder yang terkandung didalamnya dan dengan tidak adanya pengaruh DMSO terhadap pertumbuhan bakteri, terbukti bahwa aktivitas antibakteri hanya berasal dari esktrak daun kemangi (Ocimum citriodorum Vis.)
E.coli merupakan bakteri gram negatif yang memiliki tiga lapisan peptidoglikan yang terdiri dari fosfolipid, protein, dan lipopolisakarida dengan kandungan lipid sebesar 11%-22%. Apabila dibandingkan dengan Stayphylococcus aureus yang merupakan gram positif maka respon hambatnya lebih kuat. S.aureus terdiri dari dua lapisan yaitu lipopolisakarida dan protein dengan kandungan lipid sebesar 1%-4% (Maria et al., 2015). Hasil penelitian yang dilakukan Mari et al.
(2015) menunjukkan diameter zona hambat terhadap pertumbuhan S.aureus yang terbentuk saat konsentrasi 20%, 40%, 60%, 80%, 100%, kontrol positif Thiamfenicol, dan kontrol negatif DMSO adalah 12,10 mm, 12,77 mm, 13,34 mm, 18,31 mm, 18,90 mm, 24,29 mm, dan 0. Pada penelitian ini, diameter zona hambat terhadap pertumbuhan E.coli dengan konsentrasi 6,25%, 12,5%, 25%, dan 50%, kontrol positif gentamisin, dan kontrol negatif DMSO adalah dengan rata-rata 5,600 mm, 6,550 mm, 7,275 mm, 7,775 mm, 17,950 mm, dan 0.
Uji aktivitas antibakteri pada penelitian ini dilakukan dengan metode difusi, yaitu metode sumuran. Pada metode sumuran, osmolalitas terjadi lebih menyeluruh dan lebih homogen untuk menghambat pertumbuhan bakteri. Menurut penelitian yang dilakukan Eko (2013) metode difusi dapat dilakukan dengan dua metode, yaitu metode disk dan sumuran. Namun diantara kedua metode tersebut, metode sumuran lebih efektif karena menghasilkan diameter zona hambat pada pertumbuhan bakteri yang lebih besar daripada metode disk.
Aktivitas penghambatan E.coli oleh ekstrak daun kemangi (Ocimum citriodorum Vis.) disebabkan oleh adanya pengaruh senyawa metabolit sekunder yang terdapat dalam ekstrak tersebut. Sifat dari penghambatan ini disebut sebagai