IDENTIFIKASI HASIL ISOLASI PIGMEN KLOROFIL DARI DAUN SIBO (Leea indica F.) MENGGUNAKAN
SPEKTROFOTOMETER ULTRAVIOLET VISIBLE (UV-VIS)
SKRIPSI
OLEH:
ANNISA URRAHMAH NASUTION NIM 151501137
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
IDENTIFIKASI HASIL ISOLASI PIGMEN KLOROFIL DARI DAUN SIBO (Leea indica F.) MENGGUNAKAN
SPEKTROFOTOMETER ULTRAVIOLET VISIBLE (UV-VIS)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH:
ANNISA URRAHMAH NASUTION NIM 151501137
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
KATA PENGANTAR
Bismillahirrahmanirrahim,
Puji dan syukur kehadirat Allah subhanahu wa ta’ala yang Maha Pengasih dan Maha Penyayang yang telah melimpahkan banyak nikmat dan pertolongan, sehingga penulis dapat menyelesaikan penulisan skripsi yang berjudul
“Identifikasi Hasil Isolasi Pigmen Klorofil dari Daun Sibo (Leea indica F.) menggunakan Spektrofotometer Ultraviolet Visible (UV-Vis)”. Tidak lupa ucapan sholawat kepada baginda Rasulullah shollallahu ‘alaihi wa sallam sebagai suri tauladan seluruh umat manusia, semoga kita bisa dipertemukan dengan Rasulullah dan mendapatkan syafaat dari beliau di hari akhir kelak.
Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara. Penulis mengucapkan terimakasih yang tidak terhingga kepada Ayah Rasyid Ridho Nasution dan Bunda Mimi Ariani Siregar yang memberikan banyak pengorbanan dan kasih sayang yang tidak bisa diucapkan satu persatu, serta adik-adik tersayang Fadhlan Habib Nasution dan Sulthan Fauzan Nasution yang selalu memberi semangat dan motivasi.
Penulis berterimakasih atas bantuan dan bimbingan berbagai pihak serta teman-teman yang member dukungan dari masa perkuliahan, penelitian sampai pada penyusunan skripsi. Pada kesempatan ini penulis menyampaikan rasa hormat dan terimakasih yang sebesar-besarnya kepada Bapak Drs. Nahitma Ginting, M.Si., Apt dan Ibu Dr. Marline Nainggolan, M.S., Apt sebagai dosen pembimbing I dan II yang memberikan perhatian, mengajar dan membimbing penulis selama
perkuliahan maupun penelitian hingga akhir. Bapak Prof. Dr. Ginda Haro, M.Sc., Apt dan Ibu Dra. Masria Lasma Tambunan, M.Si., Apt selaku dosen penguji yang telah bersedia menguji dan memberi saran untuk menyempurnakan skripsi ini serta Bapak dan Ibu Dosen Farmasi Universitas Sumatera Utara yang telah memberikan ilmu-ilmu yang berharga selama masa perkuliahan.
Penulis juga mengucapkan terimakasih kepada teman-teman sejuk Raesa Ema Sari Barus, S.Farm, Danty Rizky Amalia dan Annisa, Keluarga Besar UKMI Ath-Thibb, dan teman-teman angkatan 2015 Fakultas Farmasi Universitas Sumatera Utara yang telah menyemangati penulis.
Penulis menyadari masih banyak kekurangan dalam penulisan skripsi ini, maka dari itu penulis mengharapkan kritik dan saran yang bersifat membangun dari semua pihak. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi pembaca dan menjadi sumber ilmu pengetahuan khususnya bidang ilmu farmasi.
Medan, 27 Januari 2020 Penulis,
Annisa Urrahmah Nasution NIM 151501137
IDENTIFIKASI HASIL ISOLASI PIGMEN KLOROFIL DARI DAUN SIBO (Leea indica F.) MENGGUNAKAN SPEKTROFOTOMETER
ULTRAVIOLET VISIBLE (UV-VIS) ABSTRAK
Latar Belakang: Di daerah Karo terdapat tumbuhan obat yang memiliki banyak kandungan senyawa berkhasiat salah satunya daun sibo (Leea indica F.), mengandung klorofil sebagai pigmen warna yang diketahui memiliki khasiat sebagai antioksidan, antiinflamasi, antikarsinogenik, antikanker dan antibiotik.
Tujuan: Tujuan dari penelitian ini untuk mengidentifikasi hasil isolasi pigmen klorofil dari daun sibo (Leea indica F.) menggunakan spektrofotometer ultraviolet visible (uv-vis).
Metode: Penelitian ini dilakukan dengan metode eksperimental meliputi ekstraksi serbuk simplisia menggunakan 3 pelarut yaitu n-heksan, aseton dan metanol masing-masing dengan perbandingan 1:10. Serbuk simplisia diekstraksi dengan masing-masing pelarut, selanjutnya dilakukan penguapan menggunakan rotary evaporator. Hasil ekstrak dianalisis dengan kromatografi lapis tipis (KLT) menggunakan variasi fase gerak yaitu n-heksan, aseton, metanol, n-heksan:aseton (7:3) dan metanol:aseton (8:2), dilakukan KLT preparatif dengan fase gerak terbaik. Dianalisis panjang gelombang ekstrak masing-masing pelarut dan hasil isolat dengan pelarut metanol secara spektrofotometer ultraviolet visible (UV- Vis).
Hasil: Hasil kromatografi lapis tipis (KLT) didapatkan warna bercak hijau biru (klorofil a), hijau kuning (klorofil b) dan kuning (ksantofil), didapatkan pelarut aseton paling efektif menarik klorofil dengan fase gerak n-heksan:aseton (7:3) untuk diuji secara KLT preparatif, dikerok 3 noda yang menghasilkan warna paling baik yaitu noda 3,4 dan 5 dari 11 noda. Hasil analisis ekstrak daun sibo menggunakan spektrofotometer UV-Vis diperoleh panjang gelombang 411,5 nm;
453,5 nm; 534,5 nm; 612,5 nm; 663 nm pada pelarut aseton dan 409,5 nm; 448,5;
535 nm; 610,5 nm; 662,5 nm pada pelarut metanol terdapat klorofil a dan klorofil b, sedangkan pada pelarut n-heksan tidak terdapat klorofil. Selanjutnya pengujian isolat secara spektrofotometer UV-Vis dengan pelarut metanol, noda 3 dengan Rf sebesar 0,2000 dan panjang gelombang 408 nm; 531,5 nm; 570 nm; 659,50 nm menunjukkan klorofil a, noda 4 dengan Rf sebesar 0,2971 dan panjang gelombang 407,5 nm; 531 nm; 571 nm; 659,5 nm menunjukkan klorofil a dan noda 5 dengan Rf 0,4571 dan panjang gelombang 465,5 nm; 603 nm dan 652,5 nm menunjukkan klorofil b.
Kesimpulan : Hasil penelitian disimpulkan bahwa daun sibo mengandung jenis klorofil a dan klorofil b, didapatkan pelarut terbaik yaitu aseton dan fase gerak terbaik n-heksan:aseton (7:3) untuk menarik klorofil secara kromatografi lapis tipis (KLT) dan spektrofotometer ultraviolet visible (UV-Vis).
Kata kunci : Sibo, Klorofil, KLT, Spektrofotometer UV-Vis
IDENTIFICATION OF CHLOROPHYLL PIGMEN ISOLATION RESULTS FROM SIBO LEAF (Leea indica F.) USING VISIBLE
ULTRAVIOLET SPECTROPHOTOMETERS (UV-VIS) ABSTRACT
Background: In the Karo region there are medicinal plants that have many nutritious compounds, one of which is sibo leaf (Leea indica F), containing chlorophyll as a color pigment that is known to have antioxidant, anti- inflammatory, anti-carcinogenic, anticancer and antibiotic properties.
Objective: The purpose of this study was to identify the results of the isolation of chlorophyll pigments from sibo (Leea indica F.) leaves using an ultraviolet visible (uv-vis) spectrophotometer.
Method: This research was conducted with an experimental method including extraction of simplicia powder using 3 solvents namely n-hexane, acetone and methanol each with a ratio of 1:10. Simplisia powder was extracted with each solvent, then evaporation was carried out using a rotary evaporator. The extracts were analyzed by thin layer chromatography (TLC) using a mobile phase variation namely n-hexane, acetone, methanol, n-hexane: acetone (7: 3) and methanol: acetone (8: 2), preparative TLC was done with the best mobile phase . Analyzed the extract wavelength of each solvent and the results of the isolate with a methanol solvent by ultraviolet visible (UV-Vis) spectrophotometer.
Results: The result of thin layer chromatography (TLC) obtained blue green (chlorophyll a), yellow green (chlorophyll b) and yellow (xanthophyll) patches, the most effective acetone solvent was attracted to chlorophyll by the mobile phase of n-hexane: acetone (7: 3) To be tested by preparative TLC, scraped off 3 stains which produced the best color, 3,4 and 5 out of 11 stains. The results of sibo leaf extract analysis using UV-Vis spectrophotometer obtained wavelength of 411.5 nm; 453.5 nm; 534.5 nm; 612.5 nm; 663 nm in acetone and 409.5 nm;
448,5; 535 nm; 610.5 nm; 662.5 nm in the methanol solvent contained chlorophyll a and chlorophyll b, while in the n-hexane solvent there was no chlorophyll.
Furthermore, the isolate was tested using a UV-Vis spectrophotometer with methanol, stain 3 with Rf of 0.2000 and a wavelength of 408 nm; 531.5 nm; 570 nm; 659.50 nm shows chlorophyll a, stain 4 with Rf of 0.2971 and wavelength of 407.5 nm; 531 nm; 571 nm; 659.5 nm shows chlorophyll a and stain 5 with Rf 0.4571 and wavelength 465.5 nm; 603 nm and 652.5 nm indicate chlorophyll b.
Conclusion: The results of the study concluded that sibo leaves contained chlorophyll a and chlorophyll b types, the best solvents were acetone and the best n-hexane: acetone (7: 3) mobile phase to attract chlorophyll by thin layer chromatography (TLC) and ultraviolet visible spectrophotometer (UV- Vis).
Keywords: Sibo, Chlorophyll, TLC, UV-Vis spectrophotometer
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERNYATAAN ORISINALITAS ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian tumbuhan ... 5
2.1.1 Morfologi tumbuhan ... 5
2.1.2 Habitat ... 5
2.1.3 Sistematika tumbuhan ... 5
2.1.4 Nama asing ... 6
2.1.5 Sinonim tumbuhan ... 6
2.1.6 Nama daerah ... 7
2.1.7 Manfaat sibo ... 7
2.1.8 Kandungan kimia ... 7
2.2 Uraian kandungan Kimia ... 7
2.2.1 Glikosida ... 7
2.2.2 Flavonoid ... 8
2.2.3 Steroid/Triterpenoid ... 8
2.2.4 Saponin ... 9
2.2.5 Tanin ... 9
2.2.6 Alkaloid ... 9
2.3 Ekstraksi ... 10
2.4 Klorofil ... 12
2.5 Kromatografi... 14
2.5.1 Kromatografi lapis tipis ... 15
2.5.2 Penjerap/fase diam ... 16
2.5.3 Fase gerak pada KLT ... 16
2.5.4 Aplikasi penotolan sampel... 17
2.6 Spektrofotometri ... 18
2.6.1 Spektrofotometer Ultraviolet (UV) ... 18
2.6.2 Spektrofotometer Ultraviolet Visible (UV-Vis) ... 18
BAB III METODE PENELITIAN ... 20
3.1 Tempat Penelitian ... 20
3.2 Alat-Alat ... 20
3.3 Bahan-Bahan... 19
3.4 Pengambilan dan Pengolahan Sampel ... 21
3.4.1 Pengambilan sampel ... 21
3.4.2 Identifikasi tumbuhan ... 21
3.4.3 Pengolahan sampel ... 21
3.4.4 Ektraksi simplisia daun sibo ... 21
3.5 Pembuatan silika gel ... 21
3.6 Isolasi pigmen klorofil secara KLT ... 22
3.7 Isolasi pigmen klorofil secara KLT preparatif... 22
3.8 Identifikasi ekstrak secara spektrofotometer UV-Vis ... 22
3.9 Identifikasi hasil isolasi secara spektrofotometer UV-vis ... 22
BAB IV HASIL DAN PEMBAHASAN ... 24
4.1 Identifikasi Tumbuhan ... 24
4.2 Hasil Ekstraksi ... 24
4.3 Analisis pigmen klorofil secara KLT ... 24
4.4 Analisis pigmen klorofil secara KLT preparatif ... 26
4.5 Identifikasi ekstrak secara spektrofotometer UV-Vis ... 26
4.6 Identifikasi hasil isolasi secara spektrofotometer UV-Vis ... 29
BAB V KESIMPULAN DAN SARAN ... 32
5.1 Kesimpulan ... 32
5.2 Saran ... 33
DAFTAR PUSTAKA ... 34
LAMPIRAN ... 36
DAFTAR GAMBAR
`
2.1 Struktur Kimia Klorofil ... 13
4.1 Spektrum Ultraviolet Visible (UV-Vis) Ekstrak n-heksan... 27
4.2 Spektrum Ultraviolet Visible (UV-Vis) Ekstrak aseton ... 28
4.3 Spektrum Ultraviolet Visible (UV-Vis) Ekstrak metanol. ... 29
4.4 Spektrum klorofil b dalam MeOH ... 30
4.5 Spektrum klorofil a dalam MeOH ... 31
4.6 Spektrum klorofil a dalam MeOH ... 31
DAFTAR LAMPIRAN
`
1. Hasil identifikasi tumbuhan ... 36
2. Gambar tumbuhan dan daun sibo ... 37
3. Gambar simplisia dan serbuk simplisia daun sibo ... 38
4. Bagan kerja penelitian ... 39
5. Bagan Isolasi Ekstrak Cair Daun Sibo ... 40
6. Kromatogram hasil KLT ekstrak daun sibo ... 43
7. Harga Rf hasil KLT ekstrak daun sibo ... 46
8. Hasil KLT dari fase gerak terbaik ... 47
9. Harga rentang Rf berdasarkan pelarut dan fase gerak ... 48
10. Kromatogram hasil KLT preparatif ... 49
11. Harga Rf hasil KLT preparatif ... 50
12. Proses Pengerokan noda dari KLT preparatif... 51
13. Hasil KLT Preparatif ... 54
14. Hasil Identifikasi Panjang Gelombang Sampel ... 55
15. Hasil Identifikasi Isolat ... 58
16. Alat Spektrofotometer UV ... 60
BAB I PENDAHULUAN
1.1 Latar Belakang
Kata klorofil berasal dari bahasa Yunani, chloros yang artinya hijau dan phyllon yang artinya daun (Sumbono, 2019). Klorofil merupakan pigmen yang bertindak sebagai pemberi warna hijau pada tumbuhan, terdapat pada kloroplas dan banyak menyerap sinar pada panjang gelombang antara 400-700 nm. Jenis klorofil yang sering dijumpai adalah klorofil a dan klorofil b yang merupakan pigmen utama dalam proses fotosintesis dan diketahui memiliki manfaat sebagai antioksidan, antiinflamasi, antikarsinogenik, antikanker dan antibiotik (Gibson dkk, 2017).
Menurut Mishra dkk (2011), klorofil dan turunannya memiliki sejarah panjang dalam pengobatan tradisional diantaranya digunakan untuk membantu proses penyembuhan luka. Penelitian terbaru menunjukkan bahwa peran klorofil sebagai antimutagenik dan antikarsinogenik sangat kuat, bahkan dalam dunia farmasi berfungsi sebagai fotosensitizer untuk terapi kanker.
Di Sumatera Utara khususnya didaerah karo, banyak tumbuhan yang mengandung klorofil digunakan sebagai sumber obat tradisional, salah satunya adalah sibo yang umumnya dikenal dengan nama girang di Indonesia dan biasanya digunakan sebagai ramuan obat untuk infeksi luka (Syaifuddin dkk, 2015).
Bangar (2019), telah melakukan penelitian uji aktivitas antibakteri fraksi n-heksan dan fraksi etil asetat daun sibo (Leea indica F.) terhadap Staphylococcus aureus dan Escherichia coli didapatkan pemeriksaan karakteristik serbuk simplisia daun sibo (Leea indica F.) yaitu kadar air sebesar 9,33%; kadar sari larut
air sebesar 11,32%; kadar sari larut etanol sebesar 6,92%; kadar abu total sebesar 8,1% dan kadar abu tidak larut asam sebesar 0,88%.
Penelitian mengenai isolasi klorofil dari daun sibo (Leea indica F.) belum pernah dilakukan sebelumnya dan mengingat banyaknya manfaat klorofil dalam dunia pengobatan, maka peneliti tertarik untuk melakukan isolasi klorofil dari daun sibo meliputi ekstraksi serbuk simplisia menggunakan beberapa pelarut, pengujian ekstrak daun sibo secara kromatografi lapis tipis (KLT) menggunakan variasi fase gerak, kemudian hasil KLT dengan pelarut dan fase gerak terbaik dilakukan pengujian menggunakan KLT preparatif, dianalisis panjang gelombang ekstrak daun sibo menggunakan spektrofotometer UV-Vis dan diuji hasil isolasi secara spektrofotometer UV-Vis.
Pengujian dilakukan dengan menggunakan metode kromatografi lapis tipis (KLT) yang diketahui merupakan suatu metode analisis untuk memisahkan suatu campuran senyawa secara cepat dan sederhana (Leba, 2017). Sedangkan pemilihan uji dengan menggunakan spektrofotometer UV-Vis merupakan pengukuran panjang gelombang dan intensitas sinar ultraviolet serta cahaya tampak yang diabsorbsi oleh sampel pada panjang gelombang 400-800 nm hal ini sesuai dengan panjang gelombang yang biasanya diserap oleh pigmen klorofil (Dachriyanus, 2004).
1.2 Perumusan Masalah
Berdasarkan uraian pada latar belakang tersebut, maka perumusan masalah penelitian adalah:
a. Apakah klorofil terdapat pada daun sibo (Leea indica F.) yang disari dengan pelarut n-heksan, aseton dan metanol?
b. Apakah klorofil dapat diisolasi dari ekstrak n-heksan, aseton dan metanol menggunakan KLT dengan fase gerak berbeda?
c. Apakah senyawa klorofil hasil isolasi dapat dianalisis pada spektrofotometer UV-Vis?
1.3 Hipotesis
Berdasarkan perumusan masalah tersebut, maka hipotesis penelitian ini adalah sebagai berikut :
a. Klorofil terdapat pada daun sibo (Leea indica F.) yang disari dengan pelarut n-heksan, aseton dan metanol.
b. Klorofil dapat diisolasi dari ekstrak n-heksan, aseton dan metanol menggunakan KLT dengan fase gerak berbeda.
c. Senyawa klorofil hasil isolasi dapat dianalisis pada spektrofotometer UV- Vis.
1.4 Tujuan Penelitian
Adapun tujuan dilakukannya penelitian ini adalah:
a. Untuk mengetahui adanya klorofil dari daun sibo (Leea indica F.) yang disari dengan pelarut n-heksan, aseton, dan metanol.
b. Untuk mengetahui adanya klorofil yang diisolasi dari ekstrak n-heksan, aseton dan metanol menggunakan KLT dengan fase gerak berbeda.
c. Untuk mengetahui adanya klorofil dari hasil isolasi yang dianalisis menggunakan spektrofotometer UV-Vis.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai jenis klorofil yang terdapat pada daun sibo (Leea indica F.) serta pelarut dan fase gerak terbaik untuk menarik klorofil sehingga dapat dimanfaatkan dan dikembangkan oleh peneliti-peneliti selanjutnya.
1.6 Kerangka Pikir Penelitian
Variabel bebas Variabel terikat Parameter
ekstrak aseton, ekstrak metanol dan ekstrak n- heksan daun sibo
Isolasi klorofil
Uji Kromatografi Lapis Tipis (KLT) dan spektrofotometer UV- vis
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Morfologi Tumbuhan
Sibo (Leea indica F.) adalah tumbuhan perdu yang tingginya kurang lebih 5 meter. Batang tumbuhan tegak, berkayu, bulat, bekas melekatnya daun nampak jelas dan batangnya berwarna hijau. Daun tumbuhan majemuk, bentuk daunnya berseling lonjong, pertulangan daunnya menyirip, panjang daun 8-16 cm, lebar daun 3-7 cm, tangkai bulat dan daun berwarna hijau. Bunga dari tumbuhan ini majemuk, berkelamin dua, bunganya berbentuk payung terdapat diketiak daun, kelopak bunga berbentuk bintang, mahkota bunga berbentuk torong, kepala sari berwarna putih. Buah berbentuk bulat dan berwarna hitam, bijinya berbentuk bulat dan berwarna putih, akarnya tunggang dan berwarna coklat (Depkes RI,1994).
2.1.2 Habitat
Sibo (Leea indica F.) adalah tumbuhan yang terdapat di India, Bangladesh, Asia tenggara, Australia dan Fiji. Di Indonesia tanaman ini banyak terdapat di Sumatera, Jawa dan Borneo. Tumbuhan ini umumnya terdapat di hutan-hutan primer maupun sekunder dan banyak tumbuh dihutan pedesaan, disepanjang sungai, bukit dan lereng-lereng pada ketinggian 1700 -2500 mdpl (Steenis, 1976).
2.1.3 Sistematika Tumbuhan Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae
Bangsa : Rhamnales Suku : Leeacea Marga : Leea
Jenis : Leea indica F. (Aulia, 2019).
2.1.4 Nama Asing
Sibo (Leea indica F.) memiliki nama lain seperti bandicoot berry yang berasal dari Inggris, hastipalash/kurkurjiwah yang berasal dari Hindi, karkani yang berasal dari Marathi, Ottannalam yang berasal dari Tamil, Manipiranta yang berasal dari Malayalam dan huo tong shu yang berasal dari Cina (Khare, 2007).
2.1.5 Sinonim Tumbuhan
Sinonim dari daun sibo cukup banyak, diantaranya : Aquilicia otillis Gaertn., Aquilicia sambucina L., Leea biserrata Miq., Leea celebica Clarke., Leea divaricata., Leea expansa Craib, Leea fuliginosa Miq, .Leea gigantea Griff., Leea gracilis Laut., Leea longifolia Merr., Leea longifoliola Merr., Leea ramosi Merr., Leea robusta Blume., Leea roehrsiana Sanders ex Masters., Leea sambucifolia Salisb., Leea sambucina (L.) Willd., Leea sambucina var., biserrata (Miq.), Leea sambucina var., heterophylla Miq., Leea sambucina var., occidentalis Clarke, Leea sambucina var., robusta Miq., roehrsiana (Sanders) Chittenden, Leea sambucina var. simplex Miq., Leea sambucina var. sumatrana Miq., Leea staphylea Roxb., Leea sumatrana Miq., Leea sundaica Miq., Leea sundaica var.
fuliginosa (Miq.) Miq., Leea sundaica var. pilosiuscula Miq., Leea sundaica var.
subsessilis Miq., Leea umbraculifera Clarke., Leea viridiflora Planch., Otillis zeylanica Gaertn.S, taphylea indica Burm.f (Steenis, 1976).
2.1.6 Nama Daerah
Di Indonesia, tumbuhan sibo (Leea indica F.) memiliki berbagai macam nama daerah seperti malimali (melayu, borneo), kituwa (sunda), kayutuwa (jawa), ghirang (Madura), kolatada (Ternate), ngeteda (Halmahera) dan malimali hantu (palembang) (Depkes RI,1994).
2.1.7 Manfaat Tumbuhan Sibo
Sibo (Leea indica F.) termasuk tumbuhan liar yang telah digunakan sebagai obat tradisional yaitu antidiare, antidisentri, antispasmodik dan mengobati vertigo (Khare, 2007). Daun sibo (Leea indica F.) diketahui berkhasiat sebagai obat pusing, dengan cara kurang lebih 7 gram daun segar dari tumbuhan sibo dicuci dan dihancurkan sampai lumat, kemudian ditempelkan pada pelipis kiri dan kanan (Depkes RI, 1994).
2.1.8 Kandungan Kimia
Sibo (Leea indica F.) mengandung beberapa senyawa diantaranya alkaloid, flavonoid, saponin, tanin dan triterpenoid steroid (Emran, dkk., 2012).
Pada daun sibo (Leea indica F.) teridentifikasi setidaknya dua puluh tiga senyawa fitokimia termasuk sebelas hidrokarbon, asam ftalat, asam palmitat, eikosanol, solanesol, farnesol, tiga ester asam ftalat, asam galat, lupeol, sitosterol, dan asam ursolat (Srinivasan dkk, 2008).
2.2 Uraian Kandungan Kimia 2.2.1 Glikosida
Glikosida merupakan suatu senyawa yang bila dihidrolisis akan terurai menjadi gula (glikon) dan senyawa lain (aglikon atau genin). Glikosida dibagi atas 4 tipe berdasarkan atom penghubung glikon dan aglikon, yaitu:
a. Tipe O-heterosida atau O-glikosida, jika glikon dan aglikonnya dihubungkan oleh atom O, contohnya : salisin.
b. Tipe S-heterosida atau S-glikosida, jika glikon dan aglikonnya dihubungkan oleh atom S, contohnya : sinigrin.
c. Tipe N-heterosida atau N-glikosida, jika glikon dan aglikonnya dihubungkan oleh atom N, contohnya nikleosidin dan kronotosidin.
d. Tipe C-heterosida atau C-glikosida, jika glikon dan aglikonnya dihubungkan oleh atom C, contohnya aloin dan viteksin (Fransworth, 1996).
2.2.2 Flavonoid
Flavonoid merupakan salah satu golongan fenol alam yang terbesar mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6-C3-C6, yaitu dua cincin aromatis yang dihubungkan oleh satuan tiga karbon yang dapat atau tidak dapat membentuk cincin ketiga (Markham, 1998). Flavonoida sering terdapat sebagai glikosida dan merupakan kandungan khas tumbuhan hijau yang terdapat pada bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, nektar, bunga, buah buni dan biji. Flavonoida bersifat polar karena mengandung sejumlah hidroksil yang tersulih atau suatu gula (Markham, 1998).
2.2.3 Steroid/triterpenoid
Steroid adalah triterpena yang kerangka dasarnya tersusun dari sistem cincin siklo pentana perhidrofenantren. Triterpenoid adalah senyawa yang kerangka karbonya berasal dari enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik yaitu skualena. Uji yang biasa digunakan adalah reaksi Liebermann-Burchard yang dengan kebanyakan triterpen dan steroida akan memberikan warna hijau-biru. Senyawa triterpenoid dan steroid berstruktur siklik dengan berbagai gugus fungsi yang melekat padanya, seperti gugus alkohol, aldehid atau asam karboksilat yang merupakan senyawa tidak
berwarna berbentuk kristal, sering kali memiliki titik leleh yang tinggi dan bersifat aktif optik. Triterpenoid dapat dipilah menjadi sekurang-kurangnya empat golongan senyawa yaitu triterpena sebenarnya, steroid, saponin dan glikosida jantung. Triterpena tertentu menjadi terkenal karena rasanya, terutama kepahitannya (Harborne, 1987).
2.2.4 Saponin
Saponin merupakan senyawa glikosida triterpenoida ataupun glikosida steroida yang merupakan senyawa aktif pada permukaan dan bersifat seperti sabun serta dapat dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisa sel darah merah (Harborne, 1987).
2.2.5 Tanin
Tanin adalah senyawa yang berasal dari tumbuhan, yang mampu mengubah kulit hewan yang mentah menjadi kulit yang siap pakai karena kemampuannya menyambung silang proteina. Tanin pada tumbuhan dibagi menjadi dua golongan, yaitu tanin terkondensasi dan tanin terhidrolisis. Kadar tanin yang tinggi mempunyai arti penting bagi tumbuhan yakni sebagai sistem pertahanan bagi tumbuhan dan membantu mengusir hewan pemakan atau pengganggu tumbuhan tersebut. Tanin terkondensasi terdapat pada paku-pakuan, gimnospermae dan angiospermae. Sedangkan tanin terhidrolisis penyebarannya sangat terbatas pada tumbuhan berkeping dua saja. Beberapa tanin terbukti mengandung antioksidan dan berfungsi sebagai penghambat pertumbuhan tumor (Harborne, 1987).
2.2.6 Alkaloid
Alkaloid adalah sebuah golongan senyawa basa nitrogen yang kebanyakan heterosiklik dan terdapat pada tumbuh-tumbuhan tetapi tidak terkecuali terdapat pada hewan. Asam amino, peptida, protein, nukleotid, asam nukleik, gula amino
dan antibiotik biasanya tidak digolongkan sebagai alkaloid. Pada prinsip yang sama, senyawa netral yang secara biogenetik berhubungan dengan alkaloid termasuk digolongan ini (Robinson, 1991).
Alkaloid dibagi menjadi 3 tipe yaitu alkaloid sejati, protoalkaloid dan pseudoalkaloid. Alkaloid sejati dibentuk dari asam amino yang mempunyai unsur N dalam sistem heterosiklik, memiliki aktivitas biologis, rasa pahit dan berbentuk padatan berwarna putih. Protoalkaloid memiliki unsur N bukan dalam sistem heterosiklik, strukturnya sederhana dan biasanya merupakan alkaloid minor.
Pseudoalkaloid memiliki unsur N dalam kerangka karbon yang tidak atau bukan berasal dari asam amino, tetapi pada kenyataannya berkaitan dengan pembentuk asam amino atau sebagai hasil reaksi aminasi dan tansaminasi (Harborne, 1987).
2.3 Ekstraksi
Ekstraksi merupakan proses penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia yang diekstraksi mengandung senyawa aktif yang dapat larut dan senyawa yang tidak larut seperti serat, karbohidrat, protein dan lain-lain. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloida, flavonoida, glikosida, tanin, saponin, steroid/triterpenoid dan lain-lain. Diketahui bahwa senyawa aktif yang terkandung pada simplisia akan mempermudah pemilihan pelarut dengan cara ekstraksi yang tepat dengan fase gerak yang tepat (Ditjen POM, 1995). Ekstrak adalah sediaan kering, kental atau cair yang dibuat dengan cara menyari simplisia nabati atau hewani menurut cara dan pelarut yang cocok (Ditjen POM, 1979).
Menurut Ditjen POM (2000), beberapa metode ekstraksi dengan menggunakan pelarut yaitu:
a. Cara dingin
1. Maserasi adalah proses penyarian simplisia dengan cara perendaman menggunakan pelarut dengan sesekali pengadukan pada suhu kamar.
Penambahan pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi.
2. Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap maserasi antara dan tahap perkolasi sebenarnya (penetesan/
penampungan ekstrak).
b. Cara panas
1. Refluks adalah proses penyarian simplisia dengan menggunakan alat pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2. Digesti adalah proses penyarian dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50oC.
3. Sokletasi adalah proses penyarian dengan menggunakan pelarut yang selalu baru, dilakukan menggunakan alat soklet sehingga terjadi ekstraksi kontinu dengan pelarut relatif konstan dengan adanya pendingin balik.
4. Infudansi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 15 menit.
5. Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 30 menit.
2.4 Klorofil
Klorofil adalah pigmen hijau yang ditemukan pada daun, alga, dan sianobakteria. Kata klorofil berasal dari bahasa Yunani, yairu chloros artinya hijau dan phyllon artinya daun. Klorofil menyerap cahaya paling kuat pada gelombang warna biru dan merah, namun tidak menyerap pada gelombang warna hijau spektrum elektromagnetik. Awalnya diasumsikan bahwa klorofil adalah senyawa tunggal tetapi pada tahun 1864 Stokes menunjukkan dengan spektroskopi bahwa klorofil adalah campuran (Sumbono, 2019).
Klorofil memiliki peranan penting pada tubuh manusia yang dikenal sebagai “darah hijau”. Pengertian “darah hijau” merupakan fungsi klorofil yang mirip seperti hemoglobin di dalam darah dan memiliki peranan penting pada proses penyediaan oksigen ke seluruh sel dan jaringan tubuh (Astawan dan Andreas, 2008). Hal tersebut terjadi karena klorofil memiliki kesamaan struktur dengan hemoglobin (pigmen pada darah manusia), dimana atom sentral Fe2+ pada darah diganti dengan Mg2+ pada klorofil (Ernaini dkk, 2012).
Klorofil memiliki hampir semua zat gizi yang diperlukan tubuh manusia dalam komposisi yang seimbang, kaya zat anti radang, zat antibakteri, zat anti parasit dan zat-zat berkhasiat lainnya. Sejak lama klorofil telah dipercaya memiliki khasiat untuk memanjangkan umur. Berbagai penelitian saat ini sudah dapat membuktikan bahwa dengan mengonsumsi makanan tinggi klorofil akan memiliki kualitas kesehatan yang lebih baik (Astawan dan Andreas, 2008).
Diketahui bahwa klorofil dapat melindungi tubuh dari senyawa-senyawa karsinogenik (penyebab kanker) pada kondisi ketika makanan dan obat lainnya sudah tidak berfungsi lagi. Klorofil bertindak menguatkan sel-sel, melepaskan zat racun dari hati dan aliran darah serta secara kimiawi menetralisasi polutan (Astawan dan Andreas, 2008).
Molekul klorofil memiliki ekor hidrofobik yang masuk ke dalam hidrokarbon dinding-dinding sel tubuh dan menariknya keluar dari dinding sel tersebut, seperti halnya sabun yang mengikat kotoran. Golongan hidrokarbon diantaranya adalah pestisida, narkotika, flavor makanan, dan lain-lain. Hati berfungsi untuk menghancurkan senyawa kimia sintesis tersebut kemudian mengeluarkannya dari dalam aliran darah. Oleh karena itu, klorofil bertugas membantu kerja hati sehingga tidak bekerja terlalu berat (Astawan dan Andreas, 2008).
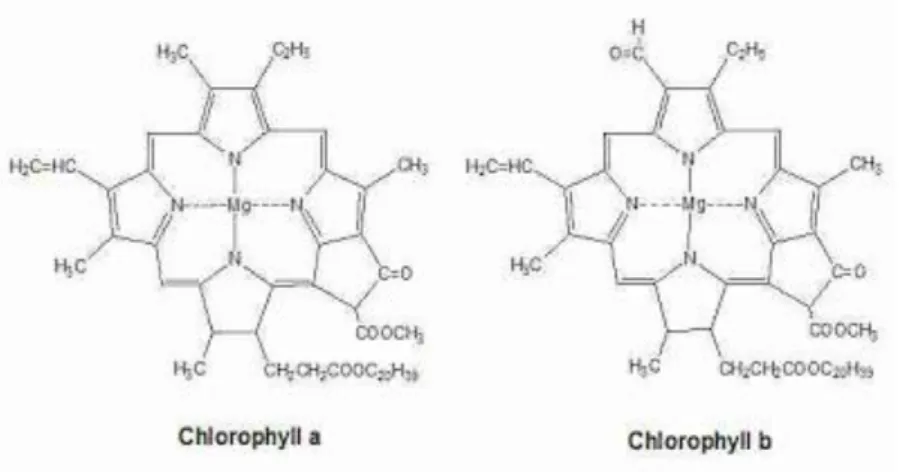
Gambar 2.1 Struktur Kimia Klorofil
Struktur kimia Klorofil adalah pigmen klorin dan diproduksi melalui jalur metabolisme yang sama seperti pigmen porfirin lainnya contohnya heme.
Pada pusat cincin klorin terdapat ion magnesium, cincin klorin dapat memiliki beberapa rantai samping yang berbeda dan biasanya termasuk rantai phytol yang panjang. Ada beberapa bentuk yang berbeda terjadi secara alami, tetapi bentuk yang paling banyak didistribusikan di tanaman terestrial adalah klorofil a. Struktur umum klorofil a dijelaskan oleh Hans Fischer pada tahun 1940 dan 1960, ketika sebagian besar stereokimia klorofil a diketahui, Robert Burns Woodward mempublikasikan sintesis total molekul seperti yang diketahui dan pada tahun 1967, penjelasan mengenai stereokimia terakhir diselesaikan oleh Ian Fleming,
dan akhirnya pada tahun 1990 Woodward dan rekannya menerbitkan sintesis yang telah diperbarui (Sumbono, 2019).
Diketahui beberapa jenis klorofil yaitu klorofil a, b, c dan d. Klorofil a memiliki warna hijau kekuningan jika berada di dalam larutan dan merupakan pigmen utama pada proses fotosintesis yang biasanya terdapat pada tumbuhan tinggi dan sebagian ganggang merah. Klorofil b merupakan pigmen pembantu pada proses fotosintesis yang bertugas mengirim energi cahaya ke klorofil a, diketahui memiliki warna hijau kebiruan jika berada di dalam larutan dan banyak terdapat pada tumbuhan tinggi dan ganggang hijau. Klorofil c hanya terdapat pada ganggang coklat dan klorofil d terdapat di beberapa alga merah (Inanc, 2011).
Namun, saat ini telah ditemukan jenis klorofil baru yang terdapat dalam stromatolite (struktur batuan yang dibuat oleh cyanobacteria) di Australia barat yang diberi nama klorofil f, sehingga saat ini klorofil dibagi menjadi lima kelas, yaitu klorofil a, b, c, d dan f (Pareek dkk, 2018).
Menurut Miller (1931), Klorofil a sangat mudah larut dalam eter, aseton, kloroform, karbon disulfida, benzol dan metanol, cukup larut dalam metanol dingin dan agak mudah larut dalam metanol hangat. Sedangkan kelarutan klorofil b secara umum hampir sama dengan klorofil a, hanya saja klorofib b sepenuhnya tidak larut dalam petroleum eter.
2.5 Kromatografi
Kromatografi adalah suatu nama yang diberikan untuk teknik pemisahan tertentu. Cara yang asli telah diketengahkan pada tahun 1903 oleh Tswett, ia telah menggunakannya untuk pemisahan senyawa-senyawa yang berwarna dan nama kromatografi diambilkan dari senyawa yang berwarna. Elusi pertama-tama telah digunakan oleh Tswett untuk pemisahan pigmen-pigmen daun, karena warna
tersebut maka cepat terlihat lokasinya dalam kolom. Kolom yang digunakan diisi padatan kalsium karbonat dan dielusi dengan pelarut organik sehingga terjadi pemisahan yang berupa pita-pita yang berwarna pada kolom. Pembatasan untuk senyawa-senyawa yang berwarna tak lama dan hampir kebanyakan pemisahan secara kromatografi sekarang diperuntukkan pada senyawa- senyawa yang tak berwarna. Senyawa-senyawa tak berwarna dapat juga dilihat lokasinya, karena flouresensi senyawa dalam sinar ultraviolet (Sastrohamidjojo, 1985).
2.5.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis, KLT (thin layer chromatography, TLC) adalah suatu metode analisis yang digunakan untuk memisahkan suatu campuran senyawa secara cepat dan sederhana. Metode ini termasuk dalam kromatografi cair-padat (Leba, 2017).
Pada prinsipnya pemisahan pala KLT didasarkan atas adsorpsi senyawa- senyawa oleh fasa diam dan fasa gerak. Pemisahan dapat terjadi akibat perbedaan kepolaran antara senyawa-senyawa dalam campuran dengan fasa diam dan fasa gerak.perbedaan kepolaran inilah yang menyebabkan terjadinya pemisahan yang diamati melalui tampaknya bercak atau noda dengan nilai Rf yang berbeda berdasarkan kecepatan migrasi tiap senyawa (Leba, 2017).
Dibandingkan dengan kromatografi cair kinerja tinggi (KCKT) dan kromatografi gas (KG), KLT mempunyai beberapa keuntungan, yaitu :
1. KLT memberikan fleksibilitas yang lebih besar, dalam hal memilih fase gerak.
2. Berbagai macam teknik untuk optimasi pemisahan seperti pengembangan 2 dimensi, pengembangan bertingkat, dan pembaceman penjerap dapat dilakukan pada KLT.
3. Proses kromatografi dapat diikuti dengan mudah dan dapat dihentikan kapan saja.
4. Semua komponen dalam sampel dapat dideteksi (Rohman, 2009).
2.5.2 Penjerap/Fase diam
Penjerap yang paling sering digunakan pada KLT adalah silika dan serbuk selulosa, sementara mekanisme sorpsi-desorpsi (suatu mekanisme perpindahan solute dari fase diam ke fase gerak atau perpindahan dari fase gerak ke fase diam) yang utama pada KLT adalah partisi dan adsorpsi. Lapisan tipis yang digunakan sebagai penjerap juga dapat dibuat dari silika yang telah dimodifikasi, resin penukar ion, gel ekslusi, dan siklodestrin yang digunakan untuk pemisahan senyawa kiral. Beberapa penjerap KLT serupa dengan penjerap yang digunakan pada KCKT. Kebanyakan penjerap dikontrol keajegan ukuran partikel dan luas permukaannya. Beberapa prosedur kromatografi terutama pemisahan yang menggunakan larutan pengembang anhidrat, mensyaratkan adanya control kandungan air dalam silika. Kandungan air yang ideal adalah antara 11-12 % b/b (Rohman, 2009).
Lempeng silika gel dapat dimodifikasi untuk membentuk penjerap fase terbalik dengan cara membacemnya menggunakan paraffin cair, minyak silikon, atau dengan lemak. Lempeng fase terbalik jenis ini digunakan untuk identifikasi hormon-hormon steroid (Rohman, 2009).
2.5.3 Fase Gerak pada KLT
Fase gerak pada KLT dapat dipilih dari pustaka, tetapi lebih sering dengan mencoba-coba karena waktu yang diperlukan hanya sebentar. Sistem yang paling sederhana ialah dengan menggunakan campuran 2 pelarut organik, karena daya elusi campuran kedua pelarut ini dapat mudah diatur sedemikian rupa sehingga
pemisahan dapat terjadi secara optimal. Berikut ini adalah beberapa petunjuk dalam memilih dan mengoptimasi fase gerak pada KLT:
Fase gerak harus mempunyai kemurnian yang sangat tinggi karena KLT merupakan teknik yang sensitif
Daya elusi fase gerak harus diatur sedekimian rupa sehingga harga Rf
solute terletak antara 0,2-0,8 untuk memaksimalkan pemisahan.
Untuk pemisahan dengan menggunakan fase diam polar seperti silika gel,
polaritas fase gerak akan menentukan kecepatan migrasi solute yang berarti juga menentukan Rf. Penambahan pelarut yang bersifat sedikit polar seperti dietil eter ke dalam pelarut non polar seperti metal benzene akan meningkatkan harga Rf secara signifikan.
Solut-solut ionik dan solut-solut polar lebih baik digunakan campuran
pelarut sebagai fase geraknya seperti campuran air dan metanol dengan perbandingan tertentu. Penambahan sedikit asam etanoat atau ammonia masing-masing akan meningkatkan elusi solut-solut yang bersifat basa dan asam (Rohman, 2009).
2.5.4 Aplikasi Penotolan Sampel
Pemisahan pada kromatografi lapis tipis yang optimal akan diperoleh hanya jika menotolkan sampel dengan ukuran bercak sekecil dan sesempit mungkin. Sebagaimana dalam prosedur kromatografi yang lain, jika sampel yang digunakan terlalu banyak maka akan menurunkan resolusi (Rohman, 2009).
2.6 Spektrofotometri
Spektrofotometri sesuai dengan namanya adalah alat yang terdiri dari spektrometer dan fotometer. Spektrofotometer menghasilkan sinar dari spektrum
dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau diabsorbsi. Jadi, spektrofotometer digunakan untuk mengukur energi relatif jika energi tersebut ditransmisikan, direfleksikan atau diemisikan sebagai fungsi panjang gelombang. Kelebihan spektrofotometer dengan fotometer adalah panjang gelombang dari sinar putih dapat lebih dideteksi dan cara ini diperoleh dengan alat pengurai seperti prisma, grating atau celah optis. Pada fotometer, filter dari berbagai warna yang mempunyai spesifikasi melewatkan trayek pada panjang gelombang tertentu (Watson, 2005).
2.6.1 Spektrofotometer Ultraviolet (UV)
Prinsip kerja spektrofotometer UV adalah interaksi yang terjadi antara energi yang berupa sinar monokromatis dari sumber sinar dengan materi berupa molekul. Besar energi yang diserap menyebabkan elektron tereksitasi dari keadaan dasar ke keadaan tereksitasi yang memiliki energi lebih tinggi. Prinsip kerja spektrofotometer berdasarkan hukum Lambert Beer, yaitu bila cahaya monokromatik (Io) melalui media (larutan), maka sebagian cahaya tersebut diserap (Ia), sebagian dipantulkan (Ir), dan sebagian lagi dipancarkan (It).
Penyerapan sejumlah energi, menghasilkan percepatan dari elektron dalam orbital tingkat dasar ke orbital yang berenergi lebih tinggi. Serapan yang kuat akan timbul apabila transisi disertai dengan perubahan besar di dalam keadaan transisi (Silverstein dkk, 2005).
2.6.2 Spektrofotometer Ultraviolet Visible (UV-Vis)
Spektrofotometer UV-Vis merupakan pengukuran panjang gelombang dan intensitas sinar ultraviolet serta cahaya tampak yang diabsorbsi oleh sampel yang akan diuji. Sinar ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi.
Spektroskopi UV-Vis biasanya digunakan untuk molekul dan ion anorganik atau
kompleks di dalam larutan. Spektrum UV-Vis mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang bisa didapatkan dari spektrum ini.
Tetapi spektrum ini sangat berguna untuk pengukuran secara kuantitatif.
Konsentrasi dari analit di dalam larutan bisa ditentukan dengan mengukur absorban pada panjang gelombang tertentu dengan menggunakan hokum Lambert-Beer. Sinar ultraviolet berada pada panjang gelombang 200-400 nm, sedangkan sinar tampak berada pada panjang gelombang 400-800 nm (Dachriyanus, 2004).
Prinsip dari spektrofotometri Ultraviolet Sinar Tampak (UV-Vis) adalah melewatkan cahaya dalam rentang daerah ultraviolet dan sinar tampak ke sampel yang akan diuji. Kemudian menyerap cahaya pada panjang gelombang tertentu dan menerusakan cahaya tersebut, sampel yang mampu menyerap cahaya dalam daerah tampak atau atau senyawa yang berwarna, memiliki elektron yang pada keadaan normal atau berada pada kulit atom dengan energi terendah disebut keadaan dasar (ground state) (Rialita, 2013).
BAB III
METODOLOGI PENELITIAN
3.1 Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Fitokimia dan Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara.
3.2 Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi alat-alat gelas laboratorium (Pyrex dan Oberoi), blender (Sharp), chamber, gunting, kertas perkamen, lemari pengering, maat pipet, mikro pipet, neraca analitik (Mark-M5- ion), oven (Memmert), penangas air, penotol, pipet volume (Herma), plat kaca, spatula, spektrofotometer Uv-Vis (Shimadzu).
3.3 Bahan-bahan
Bahan tumbuhan yang digunakan dalam penelitian ini adalah tumbuhan daun sibo (Leea indica F.) dan bahan-bahan kimia yang digunakan adalah aseton p.a, metanol p.a, n-heksan p.a, plat silika gel 60 F254 dan serbuk silika gel.
3.4 Pengambilan dan Pengolahan Sampel 3.4.1 Pengambilan Sampel
Pengambilan bahan tumbuhan dilakukan secara purposif, tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Sampel yang digunakan pada penelitian ini adalah daun sibo yang masih segar berwarna hijau (tidak terlalu tua dan tidak terlalu muda) diambil dari rumah Bapak Drs. Nahitma
Ginting, M.Si., Apt. yang berada di perumahan taman bunga ester, Kecamatan Medan Selayang, Provinsi Sumatera Utara.
3.4.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Medanense, Laboratorium Herbarium Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara.
3.4.3 Pengolahan Sampel
Daun sibo (Leea indica F.) dicuci bersih dengan air mengalir, ditiriskan dan ditimbang sebagai berat bersih kemudian dikeringkan didalam lemari pengering suhu 400-500C selama ±7 hari, simplisia dianggap sudah kering jika rapuh bila diremas. Timbang simplisia kering sebagai berat kering, kemudian blender hingga menjadi serbuk dan disimpan dalam wadah plastik yang terlindung dari sinar matahari.
3.4.4 Ekstraksi Simplisia Daun Sibo
Serbuk simplisia 100 g dimaserasi dalam masing-masing pelarut 1 L n- heksan, 1 L aseton dan 1 L metanol selama 2 hari sambil sesekali diaduk.
Pisahkan maserat, ampas (sisa) dimaserasi kembali dengan masing-masing pelarut dengan cara yang sama diatas, maserat dipisahkan. Semua maserat yang diperoleh digabung sesuai pelarutnya, kemudian diuapkan dengan alat rotary evaporator dengan suhu ±400C, hasilnya diperoleh ekstrak kental (Mabry, 1970).
3.5 Pembuatan Silika Gel
Serbuk silika gel 60 F254 sebanyak 7 gram dilarutkan menggunakan akuades 21 ml dengan perbandingan (1:3), kemudian dituang dan diratakan pada lempeng kaca yang telah dibersihkan dengan tisu yang dibasahi oleh etanol.
Setelah kering, lempeng kaca silika gel 60 F254 tersebut diaktifkan dengan cara
memasukkan lempeng kaca silika gel 60 F254 kedalam oven dan ditunggu selama
±1 jam dengan suhu 1000C.
3.6 Isolasi Pigmen Klorofil Secara KLT
Pemisahan senyawa klorofil dari ekstrak daun sibo digunakan pelarut n- heksan, aseton dan metanol secara KLT, dengan fase diam plat silika gel 60 F254
yang sebelumnya telah diaktifkan pada oven selama ±1 jam dengan suhu 1000C.
Selanjutnya ekstrak n-heksan, aseton dan metanol dari daun sibo ditotol pada masing-masing plat KLT silika gel hingga jenuh, kemudian masing-masing dimasukkan ke dalam chamber yang telah jenuh dengan masing-masing uap fase gerak n-heksan, aseton, metanol, n-heksan:aseton (7:3) dan aseton:metanol (8:2), kemudian dielusi sampai batas tanda, dikeringkan lalu diamati secara visual (Widyawati, 2017).
3.7 Isolasi Pigmen Klorofil Secara KLT Preparatif
Pemisahan senyawa klorofil dari ekstrak daun sibo digunakan pelarut dan fase gerak yang terbaik dengan cara KLT Preparatif menggunakan fase diam silika gel 60 F254 berukuran 20×20 cm. Pada plat silika yang telah aktif, ditotol ekstrak yang memberikan pemisahan terbaik hingga jenuh dan dimasukkan ke dalam chamber yang telah jenuh dengan uap fase gerak terbaik yang telah didapatkan (Widyawati, 2017).
3.8 Identifikasi Ekstrak Secara Spektrofotometri UV-Vis
Sampel secara bergantian dimasukkan ke dalam kuvet yang telah dibilas dengan larutan sampel dan diuji dengan spektrofotometer UV-Vis. Absorbansi larutan sampel diukur pada panjang gelombang 400-800 nm dengan konsentrasi larutan
sebesar 2,5 mg/ml kemudian dianalisis panjang gelombang yang dihasilkan (Rosang, 2016).
3.9 Identifikasi Hasil Isolasi Secara Spektrofotometri UV-Vis
Dipilih 3 noda yang menghasilkan warna terbaik dari hasil KLT Preparatif, dikerok dan dimasukkan ke dalam vial yang berbeda. Dilarutkan masing-masing noda dengan metanol, disaring menggunakan corong yang telah dilapisi kertas saring dan kapas kemudian dibasahi dengan metanol. Hasil dilakukan pengukuran pada panjang gelombang 400-800 nm secara spektrofotometer UV-Vis, dimasukkan larutan uji kedalam kuvet yang telah dibilas dengan larutan uji dan dianalisis panjang gelombang yang dihasilkan (Rosang, 2016).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tumbuhan
Identifikasi tumbuhan yang digunakan dilakukan di Herbarium Medanenese, Universitas Sumatera Utara Medan, menunjukan bahwa tanaman yang diteliti adalah tanaman sibo (Leea indica F.), famili Leeaceae.
4.2 Hasil Ekstraksi
Hasil ekstrak masing-masing 100 g serbuk simplisia daun sibo diekstraksi dengan cara maserasi menggunakan pelarut n-heksan, aseton dan metanol, diperoleh ekstrak kental n-heksan sebanyak 1,2 gram, ekstrak kental aseton sebanyak 1,3 gram dan ekstrak metanol sebanyak 1,2 gram .
4.3 Analisis Pigmen Klorofil Secara KLT
Hasil analisis KLT ekstrak n-heksan, aseton dan metanol dari daun sibo menggunakan fase diam plat silika gel 60 F254 dengan 5 fase gerak yaitu n-heksan, aseton, metanol, n-heksan:aseton (7:3) dan aseton:metanol (8:2). Didapatkan hasil terbaik yaitu ektrak aseton dengan fase gerak n-heksan:aseton (7:3) yang menarik klorofil dengan baik dilihat dari warna noda yang dihasilkan dan pemisahan noda.
Hasil penelitian menunjukkan bahwa perbandingan fase gerak n- heksan:aseton (7:3) lebih efektif dalam menarik klorofil dari pelarut metanol dan aseton dilihat dari noda yang dihasilkan hal ini sesuai dengan hasil penelitian Gross (1991) dalam Prangdimurti (2007) bahwa prinsip perhitungan klorofil larut air adalah separasi antara pelarut (aseton dan petroleum eter), yaitu turunan klorofil yang bersifat polar (larut air) akan tetap berada pada lapisan aseton,
setelah dilakukan penambahan petroleum eter pada ekstrak aseton, sedangkan klorofil yang bersifat non polar akan berpindah ke dalam lapisan petroleum eter.
Cara ini yang biasa diterapkan untuk melihat aktivitas klorofilase yaitu dengan mengukur intensitas klorofilid yang terbentuk. Enzim klorofilase dapat menghidrolisis gugus fitol dari klorofil sehingga terlepas membentuk klorofilid.
Penghilangan gugus fitol dari klorofil akan menghasilkan molekul klorofilid yang bersifat polar dan larut dalam air (Ernaini dkk, 2012).
Warna yang ditunjukkan dalam pemisahan pigmen pada KLT dapat digunakan sebagai dasar identifikasi pigmen. Bercak berwarna hijau biru merupakan klorofil a, bercak berwarna hijau kuning merupakan klorofil b dan bercak berwarna kuning merupakan ksantofil. Data ini sesuai dengan deskripsi Gross (1991) yang menyatakan bahwa klorofil a berwarna hijau biru, klorofil b hijau kuning dan karotenoid berwarna kuning, orange atau merah. Menurut Gross (1991), karotenoid dibedakan menjadi dua golongan utama yaitu karotenoid polar (ksantofil) dan karotenoid non polar (karoten) (Heriyanto dan Limantara, 2006).
Salah satu sifat kimia klorofil yang penting adalah ketidakstabilan yang ekstrim, seperti sensitif terhadap cahaya, panas, oksigen, dan degradasi kimia dan reaksi oksidasi (Gross, 1991).
Hasil penelitian menunjukkan bahwa rentang Rf klorofil a (hijau biru) yaitu 0,2625-0,8875, klorofil b (hijau kuning) yaitu 0,225-0,85 dan ksantofil (kuning) yaitu 0,1125-0,9375 memiliki kecenderungan yang sama dengan hasil penelitian Madalena (2004) dimana nilai Rf klorofil a yaitu 0,40-0,63; klorofil b yaitu 0,30- 0,57 dan dari hasil penelitian Heriyanto dan Limantara (2006) dimana nilai Rf klorofil a yaitu 0,57-0,64; klorofil b yaitu 0,48-0,56 dan ksantofil yaitu 0,26-0,34.
Hasil analisis dapat dilihat pada lampiran 8 halaman 44.
4.4 Analisis Pigmen Klorofil Secara KLT Preparatif
Hasil analisis KLT preparatif ekstrak aseton dari daun sibo menggunakan fase diam lempeng kaca silika gel 60 F254 berukuran 20x20 cm dan fase gerak yaitu n-heksan:aseton (7:3) dalam 20 ml. Diperoleh 11 noda pita yaitu Rf1 sebesar 0,0285 (coklat muda); Rf2 sebesar 0,0571 (coklat muda); Rf3 sebesar 0,2000 (coklat muda); Rf4 sebesar 0,2971 (hijau kuning); Rf5 sebesar 0,4571 (hijau kuning); Rf6 sebesar 0,6000 (hijau biru); Rf7 sebesar 0,7142 (hijau biru); Rf8
sebesar 0,7885 (kuning); Rf9 sebesar 0,8000 (coklat muda); Rf10 sebesar 0,8114 (coklat tua); Rf11= 0,8571 (kuning).
Hasil KLT preparatif yang memberikan noda yang paling jelas atau dominan untuk dilakukan pengerokan dan dilakukan maserasi dengan pelarut metanol, kemudian disaring dengan kertas saring telah dilapisi kapas yang telah dibasahi dengan metanol. Hasil kemudian dilakukan pengujian kromatografi lapis tipis kembali menggunakan fase gerak n-heksan:aseton (7:3), untuk selanjutnya dilakukan analisis secara spektrofotometer UV-Vis.
4.5 Identifikasi Ekstrak Secara Spektrofotometri UV-Vis
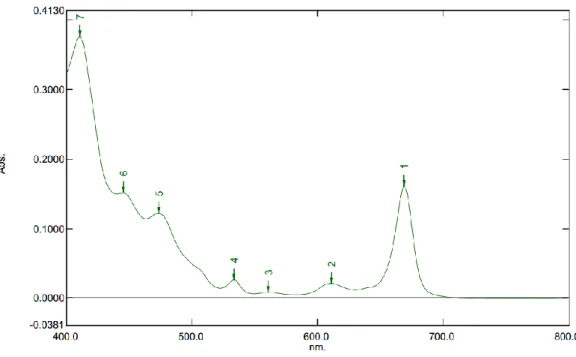
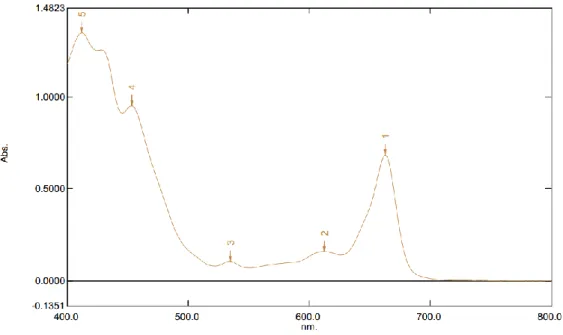
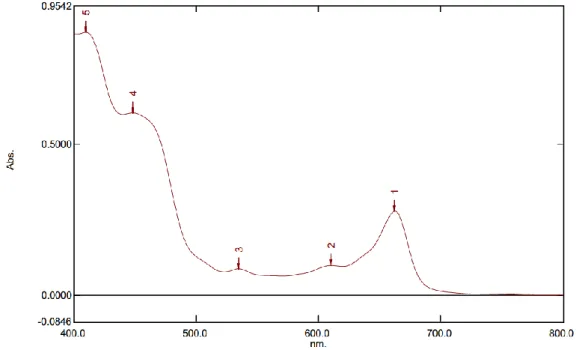
Spektrum Ultraviolet Visible dari ekstrak n-heksan, ekstrak aseton dan ektrak metanol dapat dilihat pada Gambar 4.1; Gambar 4.2 dan Gambar 4.3.
1. Hasil analisis ekstrak n-heksan terlihat pada Gambar 4.3. Diasumsikan bahwa masih terjadi pencampuran pigmen. Diantaranya pigmen karotenoid yang berada pada kisaran 380-550 nm. Didapatkan hasil dengan panjang gelombang 669 nm, menurut Sandiningtyas dan Suendo (puncak tertinggi 669 nm merupakan feofitin a dan diduga pada sampel ekstrak n-heksan tidak terdapat pigmen klorofil dari hasil analisis panjang gelombang yang dihasilkan.
Gambar 4.1 Spektrum Ultraviolet Visible (UV-Vis) Ekstrak n-heksan
2. Hasil analisis sampel ekstrak aseton terlihat pada Gambar 4.1 yang membentuk puncak 411,5 nm dan 663 nm. Menurut Goodwin (1988) pada penelitian Rosang dan Billy (2016) menghasilkan puncak 428 nm dan 660 nm yang merupakan pigmen klorofil a. Dari hasil tersebut juga menunjukkan bahwa masih terjadi pencampuran pigmen dan diasumsikan bahwa pigmen jenis karotenoid juga masih tercampur dengan pigmen klorofil. Pigmen karotenoid berada pada kisaran 380-550 nm. Sedangkan menurut penelitian Kamagi dkk (2017) pada klorofil a puncak tertinggi berada pada panjang gelombang 665 nm, sedangkan untuk klorofil b puncak tertinggi berada panjang gelombang 652 nm. Hal ini membuktikan bahwa sampel ekstrak aseton mengandung klorofil a dan klorofil b.
Gambar 4.2 Spektrum Ultraviolet Visible (UV-Vis) Ekstrak Aseton
3. Hasil analisis ekstrak metanol terlihat pada Gambar 4.2 yang membentuk puncak 409,5 nm dan 662,5 nm. Dari hasil tersebut juga menunjukkan bahwa masih terjadi pencampuran pigmen dan diasumsikan pigmen jenis karotenoid tercampur diantara pigmen klorofil. Pigmen karotenoid berada pada kisaran 380-550 nm. Sedangkan menurut penelitian Kamagi dkk (2017) pada klorofil a, puncak tertinggi berada pada panjang gelombang 665 nm, sedangkan untuk klorofil b, puncak tertinggi berada panjang gelombang 652 nm. Hal ini membuktikan bahwa sampel dengan pelarut metanol mengandung klorofil a dan klorofil b.
Gambar 4.3 Spektrum Ultraviolet Visible (UV-Vis) Ekstrak metanol
4.6 Identifikasi Hasil Isolasi Secara Spektrofotometri UV-Vis
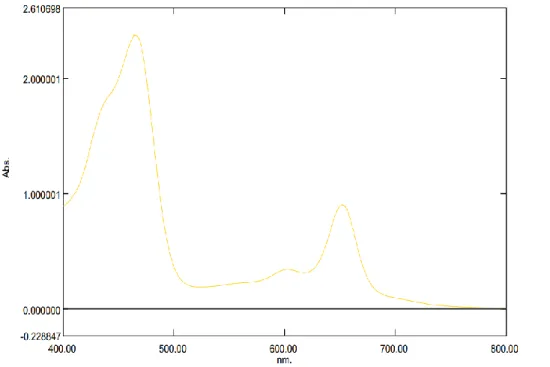
1. Hasil KLT preparatif noda 3 yang telah dikerok dan dimaserasi dengan metanol kemudian dilakukan pengukuran panjang gelombang dengan menggunakan spektrofotometer UV-Vis. Noda 3 menghasilkan panjang gelombang yaitu 465,5 nm; 603 nm dan 652,5 nm. Hasil tersebut menunjukkan bahwa noda 3 termasuk klorofil b. Hal ini sesuai dengan hasil penelitian Riyono (2007) bahwa panjang gelombang klorofil b yaitu 430 nm;
455 nm; 549 nm; 595 nm dan 644 nm.
Gambar 4.4. Spektrum klorofil b dalam MeOH
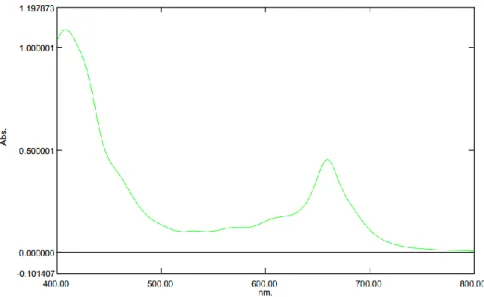
2. Hasil KLT preparatif noda 4 yang telah dikerok dan dimaserasi dengan metanol kemudian dilakukan pengukuran panjang gelombang dengan menggunakan spektrofotometer UV-Vis. Noda 4 menghasilkan panjang gelombang yaitu 408 nm; 531,5 nm; 570 nm dan 659,50 nm. Hasil tersebut menunjukkan bahwa 4 noda termasuk klorofil a. Hal ini sesuai dengan hasil penelitian Riyono (2007) bahwa panjang gelombang klorofil a yaitu 410 nm;
430 nm; 533,5 nm; 578 nm; 615 nm dan 662 nm.
Gambar 4.5. Spektrum klorofil a dalam MeOH
3. Hasil KLT preparatif noda 5 yang telah dikerok dan dimaserasi dengan metanol kemudian dilakukan pengukuran panjang gelombang dengan menggunakan spektrofotometer UV-Vis. Noda 5 menghasilkan panjang gelombang yaitu 407,5 nm; 531 nm; 571 nm dan 659,5 nm. Hasil tersebut menunjukkan bahwa noda 5 termasuk klorofil a. Hal ini sesuai dengan hasil penelitian Riyono (2007) bahwa panjang gelombang klorofil a yaitu 410 nm;
430 nm; 533,5 nm; 578 nm; 615 nm dan 662 nm.
Gambar 4.5. Spektrum klorofil a dalam MeOH
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian, dapat disimpulkan bahwa:
a. Hasil analisis pigmen klorofil secara KLT pada pelarut n-heksan tidak mengandung klorofil, pelarut aseton didapatkan klorofil a dengan rentang Rf yaitu 0,5875-0,8875 dan klorofil b rentang Rf yaitu 0,2875-0,8500 serta pelarut metanol didapatkan klorofil a dengan rentang Rf yaitu 0,2625-0,525 dan klorofil b rentang Rf yaitu 0,2250-0,6500.
b. Hasil KLT dengan variasi pelarut yaitu n-Heksan tidak menarik klorofil pada semua fase gerak, aseton menarik klorofil pada fase gerak metanol, aseton, n-heksan:aseton (7:3) dan metanol:aseton (8:2), metanol menarik klorofil pada fase gerak metanol, aseton, n-heksan:aseton (7:3) dan metanol:aseton (8:2).
c. Hasil analisis isolat secara spektrofotometri UV-Vis dengan pelarut metanol, noda 3 dengan Rf sebesar 0,2000 dan panjang gelombang 408 nm; 531,5 nm; 570 nm; 659,50 nm menunjukkan klorofil a, noda 4 dengan Rf sebesar 0,2971 dan panjang gelombang 407,5 nm; 531 nm; 571 nm;
659,5 nm menunjukkan klorofil a dan noda 5 dengan Rf 0,4571 dan panjang gelombang 465,5 nm; 603 nm dan 652,5 nm menunjukkan klorofil b.
5.2 Saran
Disarankan untuk peneliti selanjutnya dilakukan dengan menggunakan pelarut dan fase gerak yang berbeda serta pengujian kadar klorofil dari daun sibo (Leea indica F).
DAFTAR PUSTAKA
Astawan. M dan Andreas. L.M. (2008). Khasiat Warna-Warni Makanan. Penerbit Pustaka Utama. Jakarta. Halaman 128-130.
Bangar, R.I. (2019). Uji Aktivitas Antibakteri Fraksi n-Heksana dan Fraksi Etil Asetat daun Sibo (Leea indica F) terhadap Staphylococcus aureus dan Escherichia coli. Skripsi. Medan. Universitas Sumatera Utara. Halaman 32-33.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi.
Penerbit Lembaga Pengembangan Teknologi Informasi dan Komunikasi (LPTIK). Universitas Andalas. Padang. Halaman 1.
Depkes RI (1994). Pedoman Pencatatan Rekam Medis Rumah Sakit di Indonesia. Jakarta: Depkes RI. Halaman 570-571.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Halaman 203-204.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. 300-304.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat.
Cetakan Pertama. Jakarta: Departemen Kesehatan RI. Halaman 401-404.
Emran, T . B., Rahman, Md. A., Hosen, S.M.Z., Khanam, U.H., dan Saha, D.
2012. Antioxidant, cytoxic and phytochemical proporties of ethanol extract of Leea Indica leaf. Journal of Pharmacy Research. Vol 5(5).Halaman 2938-2941.
Ernaini, Y., Agus, S., Rinto (2012). Pengaruh Jenis Pelarut Terhadap Klorofil dan Senyawa Fitokimia Daun Kiambang (Salvinia molesta Mitchell) dan Peranan Rawa. Jurnal. Program Studi Teknologi dan Hasil Perikanan, Universitas Sriwijaya.
Fransworth, N.R. (1996). Biological and Phytochemical Screening of Plants.
Journal of Pharmaceutical Science: Halaman 255-276.
Gibson, M., Kasman., dan Iqbal. (2017). Analisa Kualitas Klorofil Daun Jarak Kepyar (Ricinus comunis L) Sebagai Bahan Pewarna Pada Dye Sensitized Solar Cell (DSSC). Jurnal. Fakultas MIPA. Universitas Tadulako.
Halaman 33.
Gross, J. (1991). Pigmen in Vegetables Chlorophylls and Carotenoids. Springer Sciences Bussines Media New York. New York. Halaman 3-4.
Harborne, J.B. (1987). Metode Fitokimia: Penuntun Cara Modern menganalisa Tumbuhan. Penerjemah: Kosasih Padmawinata dan Iwang Soediro.
Terbitan Kedua. Bandung: ITB. Halaman 71, 130-147.
Heriyanto dan Leenawaty, L. (2006). Komposisi dan Kandungan Pigmen Utama Tumbuhan Taliputri Cuscuta australis R.Br. dan Cassytha filiformis L.
Jurnal. Satya Wacana Cristian University. Salatiga. Halaman 71-72.
Inanc, A.L. (2011). Clorophyll Structural Properties, Healt Benefits and Its Occurrence in Virgin Olive Oil. Departemen of Food Enginering.
Kahramanmaras. Turkey. Halaman 26-27.
Kamagi, L., Julius, P., dan Lidya, I.M. (2017). Analisis Kandungan Klorofil Pada Beberapa Posisi Anak Daun Aren (Arenga pinnata) dengan Spektrofotometer UV-Vis. Fakultas MIPA. Jurnal. Unsrat. Manado.
Halaman 51.
Khare, C.P. (2007). Indian Medicinal Plants. New Delhi: Springer Science and Business Media, LLC. Halaman 366.
Leba. M.A.U. (2017). Buku Ajar Ekstraksi dan Real Kromatografi. Yogyakarta.
Deepublish. Halaman 46-50.
Mabry, T.J., Markham, K.R., Thomas, M.B. (1970). The Sistematic and Identification of Flavonoids . Springer Verlag. New York. Halaman 47.
Markham, K. R. (1998). Cara Mengidentifikasi Flavonoida. Terjemahan Kosasih Padmawinata. Bandung: ITB Press. Halaman 41-43. 47.
Miller, E.C. (1931). Plant Physiology. Edisi Pertama. Mcgraw hill book company.
London. Halaman 422.
Mishra, V.K., Bacheti., dan Azamal, H. (2011). Medical Uses of Chlorophyll: A Cricital Overview. Journal. Faculty of Natural and Computational Sciences. India. Halaman 2.
Pareek, S., Narashans, A.S., Sunil, S., Vinay,K., Tripti,A., Gustavo, A.G.A., dan Elhadi, M.Y. (2018). Chlorophylls Chemistry and Biological Function.
Journal. National Institute of Food Technology Entrepreneurship and Management (NIFTEM). Halaman 269-270.
Rialita, K.M., Gayatri, C., Frenly, W. (2013). Analisis Kafein dalam Kopi Bubuk di Kota Manado Menggunakan Spektrofotometri UV-VIS. Jurnal Farmasi. Program Studi Farmasi FMIPA. UNSRAT. Manado. Halaman 123.
Riyono, S.H. (2007). Beberapa Sifat Umum dari Klorofil Fitoplankton. Jurnal Pusat Penelitian Oseanografi. LIPI. Jakarta. Halaman 24-26.
Robinson, T. (1991). Kandungan organik Tumbuhan Tinggi. ITB, Bandung, Indonesia. Halaman 191-193.
Rohman, A. (2009). Kromatografi Untuk Analisis. Cetakan I. Yogyakarta:
Pustaka Pelajar. Halaman 217.
Rosang, C.I., Billy, T.W (2016). Penentuan Kandungan Pigmen Klorofil pada Lamun Jenis Halophile ovalis di Perairan Malalayang. Jurnal Penelitian.
Manado. Halaman 15-18.
Sastrohamidjojo. (1985). Kromatografi. Edisi I. Cetakan I. Yogyakarta. Liberty Press. Halaman 16-18.
Silverstein, R. M., Francis X. Webster dan David J Kiemle. (2005). Spectrometric Identification Of Organics Compounds. New Jersey: John Wiley dan Sons.Inc. Halaman 79-80.
Srinivasan, G.V. (2008). Identification of chemical compunds from the leaves of Leea indica.Acta Pharm. 58(2008). 207-214.
Steenis, C. G. J.V. (1976). Flora Malesiana. Volume 7 part 4. Leyden:
Noordhoff international Publishing. Halaman 779-781.
Sumbono. A. (2019). Biomolekul. Penerbit Budi Utama. Yogyakarta. Halaman 254-255.
Syaifuddin., Edi,S., Nur, M.A.K., Siska, F. (2015). Etnobiologi Tumbuhan Hutan Berkhasiat Obat di Desa Mandiangin Barat Kecamatan Karang Intan Kabupaten Banjar Provinsi Kalimantan Selatan. Balai Penelitian Kehutanan Banjar Baru. Jurnal Penelitian. Kalimantan Selatan. Halaman 3.
Watson, D.G. (2005). Analisis Farmasi. Edisi Kedua. Jakarta: EGC Penerbit Buku Kedokteran. Halaman: 56-59.
Widyawati, S.A. (2017). Isolasi Pigmen Tanaman Dengan Kromatografi Kolom.
Skripsi. Universitas Darussalam Gontor. Halaman 6-11.
Lampiran 1. Hasil identifikasi tumbuhan
Lampiran 2. Gambar tumbuhan dan daun sibo
Tumbuhan Sibo
Daun Sibo
Lampiran 3. Simplisia dan serbuk daun sibo
Simplisia daun sibo
Serbuk simplisia daun sibo
Lampiran 5. Bagan kerja penelitian
dicuci dari pengotor sampai bersih ditiriskan
ditimbang berat basahnya (2,1 kg) dikeringkan pada lemari pengering dengan suhu 40-50°
ditimbang berat keringnya
dihaluskan dengan blender
disimpan dalam wadah yang tertutup rapat sebelum digunakan
Daun Sibo (2 kg)
Simplisia daun sibo (1,3) kg)
Serbuk simplisia daun sibo (1,1) kg)
Ekstrak n- heksan 1,2 gram
Ekstrak aseton 1,3 gram
Ekstrak metanol 1,2 gram 100 g serbuk simplisia
dimaserasi dengan 1 L pelarut n-heksan
100 g serbuk simplisia dimaserasi dengan 1 L pelarut aseton
100 g serbuk simplisia dimaserasi dengan 1 L pelarut metanol
Disaring menggunakan kertas saring dan diuapkan dengan rotary evaporator
Di KLT dengan :
-FD = Plat silika gel 60 F254 -FG= 5 fase gerak yaitu :
n-heksan 10 ml, aseton 10 ml, metanol 10 ml, n- heksan:aseton (7:3) 10 ml dan aseton:metanol (8:2) 10 ml.
Lampiran 6. Bagan Isolasi Ekstrak Cair Daun Sibo Ekstrak Aseton Daun
Sibo
Fase gerak n-
heksan
Fase gerak aseton
Fase gerak metanol
Fase gerak heksan:aseton
(7:3)
Fase gerak aseton:metanol
(8:2)
Hasil
Kromatogram
1 noda 3 noda 2 noda 11 noda 1 noda 1 noda
Di KLT dengan :
-FD = Plat silika gel 60 F254 -FG= 5 fase gerak yaitu :
n-heksan 10 ml, aseton 10 ml, metanol 10 ml, n- heksan:aseton (7:3) 10 ml dan aseton:metanol (8:2) 10 ml.
Lampiran 6. Lanjutan
Ekstrak Metanol Daun Sibo
Fase gerak n-
heksan
Fase gerak aseton
Fase gerak metanol
Fase gerak heksan:aseton
(7:3)
Fase gerak aseton:metanol
(8:2)
Hasil
Kromatogram
1 noda 1 noda 2 noda 7 noda 1 noda
Di KLT dengan :
-FD = Plat silika gel 60 F254 -FG= 5 fase gerak yaitu :
n-heksan 10 ml, aseton 10 ml, metanol 10 ml, n- heksan:aseton (7:3) 10 ml dan aseton:metanol (8:2) 10 ml.
Lampiran 6. Lanjutan
Ekstrak n-Heksan Daun Sibo
Fase gerak n-
heksan
Fase gerak aseton
Fase gerak metanol
Fase gerak heksan:aseton
(7:3)
Fase gerak aseton:metan
ol (8:2)
Hasil
Kromatogram
1 noda - - 5 noda -