HIDROGENASI ELEKTROKIMIA MINYAK NABATI
Maureen Astriani (2009620037)
Jurusan Teknik Kimia, Fakultas Teknologi Industri, Universitas Katolik Parahyangan Jalan Ciumbuleuit 94, Bandung 40141
Telp/Fax : (022)-2032700
Pembimbing : Dr. Tatang Soerawidjaja ; Dr. Tedi Hudaya, ST., M.Eng.Sc
Abstrak
Di Indonesia terdapat berbagai sumber daya potensial yang dapat dijadikan biodiesel, salah satunya adalah minyak kemiri sunan. Secara kimiawi, senyawa yang terkandung di dalam minyak kemiri sunan memiliki karakteristik yang hampir sesuai untuk dijadikan bahan baku biodiesel. Namun, kandungan asam eleostearat (alias asam 9,11,13-oktadekatrienoat) yang cukup tinggi (sekitar 50%) membuat minyak ini memilikiangka iodium amat tinggi. Melalui penelitian yang dilakukan, jumlah ikatan rangkap ganda yang ada direduksi melalui reaksi hidrogenasi elektrokimia secara elektrokatalitik.
Percobaan-percobaan pada penelitian ini dilakukan pada rangkaian alat hidrogenasi elektrokatalitik yang telah disempurnakan dari yang digunakan ada penelitian sebelumnya (Oktivani, 2011). Kemudian digunakan kupro amonium format sebagai larutan elektrolit dan Cu sebagai katoda. Kupro amonium format dipilih karena ion kupro diketahui dapat membentuk kompleks dengan senyawa berikatan rangkap sehingga trigliserida-trigliserida berikatan tak jenuh ganda dapat terekstrak ke fasa akuatik yang mengandung kupro.
Melalui penelitian yang dilakukan diketahui bahwa terdapat kekurangan dan kelebihan dari penggunan kupro ammonium format sebagai larutan elektrolit. Kelemahannya, harus dilakukan pemurnian terhadap minyak hasil hidrogenasi. Namun keuntungannya adalah pada waktu hidrogenasi yang sama, 6 jam, dapat dicapai angka iodium ±85 dengan daya listrik yang jauh lebih efisien, yakni 33.178 Watt (sebelumnya 21967.2 Watt).
Kata kunci: angka iodium, hidrogenasi, kemiri sunan, kupro ammonium format. Abstract
Indonesia has many potential resources for providing biodiesel feedtocks, one of them is bagilumbang (or kemiri sunan) oil. Chemically, the compounds contained in this fatty oil have suitable characteristics to be used as raw material for making biodiesel. However, the content of eleostearic acid (namely 9,11,13-octadecatrienoic acid) is quite high (about 50%) and thus making this oil has a very high iodine number.
The oil’s very high iodine number causes it to have bad thermal stability and oxidative stability. The oil or its methyl ester would easily polymerize and cause blockages of diesel engine injectors. The present research attepts to reduce the number of double bonds in the oil through electrocatalytic hydrogenation.
The experiments in the present work were performed with an improved version of the electrocatalytic hydrogenation apparatus used previously (Oktivani, 2011). Cuprous ammonium formate solution was used as the electrolyte solution and Cu as the cathode. Cuprous ammonium formates known to form complexes with poly unsaturated alkyl chains, so that poly unsaturated triglycerides could be extracted into the aqueous phase containing cuprous ions.
The results of the present research showed theadvantages and disadvantages of the use of cuprous ammonium formate as an electrolyte solution. The most notable disadvantage is that the hydrogenated oil must be freed from colored contaminants through extraction with Na-EDTA. However, this is more than compensated by the advantage that reduction of oil’s iodine down from 112 to ± 85 could be achieved within the same reaction time as was done previousy (Oktivani, 2011) and but with much lower electrical power, that is 33.178Watt (previously 21967.2Watt).
PENDAHULUAN
Biodiesel merupakan bahan bakar mesin diesel berupa ester metil asam – asam lemak (EMAL) dan dibuat dari minyak-lemak nabati/hewani dengan proses metanolisis atau transesterifikasi dengan metanol. Karena bahan mentahnya berasal dari sumber daya terbarukan, emisi gas karbon dioksida yang dihasilkan pembakaran biodiesel diklasifikasikan sebagai CO2 netral alias
bukan gas rumah kaca. Oleh karena ini, biodiesel kini merupakan bahan bakar ramah lingkungan pensubstitusi petrodiesel (solar) di dalam sektor transportasi maupun industri.
Dua sifat bahan bakar yang merupakan tolok ukur penting mutu suatu biodiesel EMAL adalah angka setan (yaitu ukuran kesegeraan terbakar setelah diinjeksikan ke ruang bakar) dan kestabilan oksidatif (yaitu ketahanan terhadap degaradasi oleh oksigen udara). Ester metil dari asam-asam lemak jenuh umumnya memiliki angka setan maupun kestabilan oksidatif tinggi. Makin banyak ikatan rangkap pada suatu ester metil asam lemak, makin rendah pula angka setan dan kestabilan oksidatifnya. Karena ini, biodiesel EMAL yang berangka iodium lebih besar dari 115 – 120 umumnya dinilai tak memenuhi syarat mutu, karena angka setan maupun kestabilan oksidatifnya rendah.
Di Indonesia terdapat berbagai minyak-lemak nabati non-pangan yang berpotensi untuk dapat diproduksi dalam jumlah/volume besar tetapi tak memenuhi syarat mutu untuk dijadikan bahan mentah pembuatan biodiesel EMAL, karena angka iodiumnya > 120. Contoh utama dari minyak-minyak ini adalah minyak-minyak kemiri sunan (Reutealis/Aleurites trisperma), minyak-minyak biji karet (Hevea brasiliensis) dan minyak kemiri (Aleutites mollucana). Agar membuka peluang peningkatan nilai tambah dalam bentuk termanfaatkannya minyak-minyak ini dalam produksi biodiesel, maka mutu minyak ini perlu ditingkatkan melalui penurunan angka iodiumnya hingga menjadi di bawah 115 atau, lebih baik lagi, di sekitar 85 (angka iodium ester metil asam oleat). Cara terbaik untuk melaksanakan hal ini adalah dengan penjenuhan parsial ikatan-ikatan tak jenuh ganda menjadi ikatan tak jenuh tunggal melalui proses hidrogenasi.
PERALATAN DAN METODE PENELITIAN
Penelitian dilakukan dengan metode hidrogenasi elektrokimia (secara elektrokatalitik) yang dilakukan pada sel elektrokimia. Pada awal proses penelitian, dilakukan percobaan pendahuluan. Percobaan tersebut bertujuan untuk menentukan tegangan optimum. Penentuan tegangan optimum dilakukan dengan mereaksikan larutan elektrolit berupa campuran minyak kemiri sunan dan larutan elektrolit ke dalam sel elektrokimia dengan perbandingan volume 3:4. Pereaksian tersebut dilakukan pada tegangan dan waktu tertentu. Dalam prosesnya tegangan dinaikkan sedikit demi sedikit hingga diperoleh nilai arus yang tetap. Diperhatikan pula kapan mulai terbentuk gelembung di sekitar katoda. Tegangan optimum
dipilih pada saat arus konstan dan belum terbentuk gelembung. Tegangan tersebut yang digunakan untuk percobaan hidrogenasi elektrokimia (secara elektrokatalitik) seterusnya. Percobaan dilanjutkan dengan materi serupa dengan menggunakan tegangan optimum yang telah ditentukan tadi. Dilakukan penelitian apakah reaksi hidrogenasi dapat berlangsung dengan baik melalui uji Wijs. Apabila proses hidrogenasi tersebut berhasil, dilakukan variasi yang sesuai agar angka iodium minyak menjadi di sekitar angka iodium metil oleat (85).
Peralatan
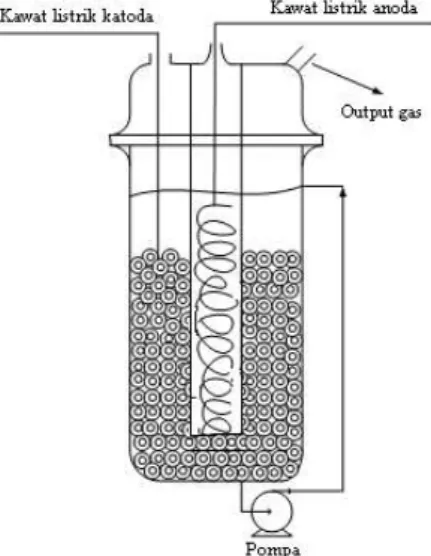
Gambar 1 menyajikan sketsa peralatan yang digunakan pada percobaan hidrogenasi elektrokimia (elektrokatalitik). Pada sel elektrokimia terdapat anoda berupa per stainless steel dan katoda berupa Cu yang diperoleh dari potongan pipa tembaga /
kabel tembaga. Diperlukan pula serangkaian kabel listrik yang dihubungkan dengan sumber arus searah yang didapat dari power supply. Pada rangkaian ini diperlukan voltmeter dan amperemeter untuk mengukur tegangan dan arus yang mengalir dalam sel elektrokimia. Pompa kecil yang ada digunakan untuk mensirkulasi campuran dalam sel yang dilakukan agar perpindahan massa yang terjadi menjadi lebih optimum. Antara anoda dan katoda diberi sekat berupa selongsong kaca agar tidak terjadi kontak. Celah tersebut juga membuat gas oksigen yang terbentuk tidak bermigrasi ke ruang katoda.
Variasi yang digunakan merupakan variasi waktu reaksi dan konsentrasi larutan elektrolit. Merujuk pada penelitian sebelumnya (Oktivani, 2011) dipilih waktu reaksi 1-6 jam dan konsentrasi Cu dalam larutan elektrolit sebesar 0,1-0,6 M. Setelah dilakukan hidrogenasi, angka iodium sampel diukur dengan uji Wijs. Berikut merupakan skema langkah – langkah penelitian yang dilakukan.
METODOLOGI PENELITIAN
Gambar 2. Skema Penelitian
Tahap Persiapan
Katoda yang digunakan dalam percobaan berupa pipa tembaga yang dipotong kecil – kecil dengan diameter 3mm. Katoda yang digunakan dalam percobaan perlu direndam terlebih dahulu dalam larutan asam nitrat 0.6 M untuk menghilangkan senyawa oksida. Proses perendaman ini dilakukan kurang lebih selama 2-3 menit. Kemudian dilanjutkan dengan pembilasan menggunakan akuades untuk menetralisir asam.
Selanjutnya dibuat kupro oksida [Cu2O] yang merupakan bahan baku pembuatan larutan
elektrolit. Dalam pembuatannya dilarutkan 143 gram NOH ke dalam 215 mL akuades. Larutan tersebut kemudian ditambahkan ke dalam 250 gram CuSO4 dan 250 gram dekstrosa (glukosa
urni) yang telah dilarutkan dalam 1250 mL akuades. Campuran kemudian dipanaskan selama 30 menit pada suhu 85o dengan hotplate berpengaduk. Setelah itu campuran di diamkan hingga
Persiapan sel elektrokimia
Minyak Nabati
Analisis awal Uji Wijs
Pembuatan katoda
Percobaan pendahuluan hidrogenasi elektrokimia (secara elektrokatalitik)
Percobaan hidrogenasi elektrokimia (secara elektrokatalitik) dengan variasi tertentu
Analisis hasil dengan Uji Wijs
Pengolahan data pengamatan Pembuatan Bahan dan
mencapai suhu kamar lalu di saring endapannya. Endapan yang diperoleh dicuci dengan akuades hingga air bilasan bening, lalu di keringkan. Padatan Cu2O yang dihasilkan akan berwarna merah
kecoklatan.
Selanjutnya dibuat larutan elektrolit kupro ammonium format. 184 gram asam format murni dicampurkan perlahan ke dalam 748 gram larutan 25 %-b NH3 kemudian tambahkan metanol
hingga larutan bervolume 1 liter. 250 mL larutan format ammoniakal tersebut kemudian direaksikan dengan 71.57 gram Cu2O yang telah dibuat sebelumnya. Pereaksian dilangsungkan
pada suhu 50oC selama kurang lebih 12jam.
Tahap Penelitian
Proses hidrogenasi dilakukan pada kondisi temperatur dan tekanan atmosferik. Larutan campuran minyak kemiri sunan dan kupro ammonium format dimasukkan ke dalam sel elektrokimia dan dilakukan hidrogenasi pada tegangan dan kuat arus optimum yang telah ditentukan. Proses berlangsung selama waktu variasi yang ditentukan, dilanjutkan dengan pemisahan minyak dan larutan elektrolit. Minyak yang telah di hidrogenasi kemudian di cek angka iodiumnya melalui uji Wijs.
Pengujian dilakukan dengan menambahkan larutan iodium monoklorida dalam campuran asetat dan karbon tetraklorida ke dalam sampel.Setelah melewati waktu tertentu dilakukan penetapan halogen yang dibebaskan dengan penambahan kalium iodide (KI).Banyaknya iod yang dibebaskan dititrasi dengan larutan standar natrium tiosulfat dan indikator kanji. Reaksi yang terjadi adalah sebagai berikut:
H H Cl Cl
-C = C - + 2 ICl ( - C – C - ) + I2 ... (1)
(Ikatan rangkap dari lemak) H H
I2 + Na2S2O3 2 NaI + Na2S4O6 ... (2)
Waktu pereaksian dan bobot sampel yang digunakan bergantung pada kondisi minyak yang digunakan.
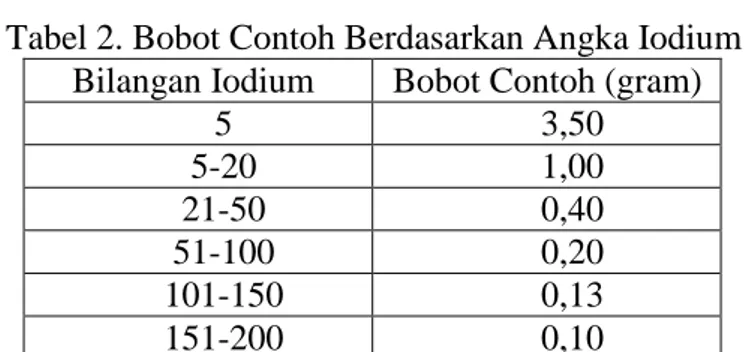
Tabel 2. Bobot Contoh Berdasarkan Angka Iodium Bilangan Iodium Bobot Contoh (gram)
5 3,50 5-20 1,00 21-50 0,40 51-100 0,20 101-150 0,13 151-200 0,10
Untuk minyak kemiri sunan, dengan kisaran angka iodium awal lebih dari 100, maka digunakan bobot sampel 0.13 gram. Sampel tersebut dilarutkan dalam 15mL kloroform dan direaksikan dengan 25 mL reagen Wijs selama 2-3 jam. Setelah itu ditambahkan 10mL KI 20% dan 100 mL akuades. Sampel tersebut kemudian dititrasi dengan natrium tiosulfat 0.1 N yang telah distandarkan sampai warna coklat iodium hampir hilang. Setelah ini tercapai, tambahkan 2 mL larutan indikator pati dan teruskan titrasi sampai warna biru kompleks iodium-pati persis sirna. Bersamaan dengan analisis tersebut, dibuat analisa blanko (tanpa contoh minyak). Setelah itu angka iodium minyak dihitung dengan rumus berikut.
Angka Iodium, AI % − b = 12,96 B−C NW ... (3) Keterangan:
N adalah normalitas larutan standar natrium tiosulfat
B adalah volume larutan natrium tiosulfat yang diperlukan untuk penitaran blanko (mL) C adalah volume larutan natrium tiosulfat yang diperlukan untuk penitaran contoh (mL) W adalah bobot contoh (gram)
HASIL DAN PEMBAHASAN Tahap Persiapan
Dalam proses pembuatan Cu2O ion Cu+ yang tidak stabil sangat mudah teroksidasi menjadi
Cu2+. Hal tersebut diakibatkan oleh proses pemanasan yang terlalu lama (lebih dari 12 jam) dan terlalu tinggi (lebih dari 100oC).. Hal tersebut dapat dilihat dari warna padatan yang dihasilkan. Apabila padatan yang dihasilkan berwarna sangat gelap, maka dapat dipastikan bahwa terdapat pengotor dan Cu2+ di dalamnya. Cu2+ tersebut akan membentuk CuO yang berwarna hitam. Sebaliknya apabila proses berlangsung dengan baik maka padatan Cu2O yang dihasilkan akan
berwarna merah kecokelatan.
Padatan Cu2O ini kemudian direaksikan bersama ammoniak, asam format, dan metanol dalam
gelas kimia yang dipanaskan hingga 50˚C dengan kecepatan pengadukan sebesar 5 rpm. Proses pereaksian membutuhkan waktu kurang lebih 12 jam agar Cu2O dapat bereaksi dengan baik.
Metode ini dipilih karena dianggap lebih aman dan ekonomis dibandingkan dengan pemanasan menggunakan metode refluks. Setelah diamati, apabila dilakukan dengan proses refluks, maka akan terbentuk garam ammoniak pada kondensor. Hal tersebut mengakibatkan tekanan dalam sistem menjadi sangat tinggi dan berbahaya. Selain itu bau ammoniak yang sangat menyengat juga sulit dikendalikan dan berbahaya bagi kesehatan orang – orang di sekitarnya.
Secara teori, apabila larutan tersebut hanya mengandung ion Cu+ maka larutan yang dihasilkan tidak berwarna atau bening. Cu+ yang memiliki konfigurasi bilangan elektron [Ar]3d10 yang memiliki orbital yang penuh. Hal tersebut menyebabkan elektron – elektron dalam konfigurasi memiliki kestabilan yang baik dan tidak mudah tereksitasi.Haltersebut mengakibatkanakan langsung diteruskannya seluruh gelombang cahaya yang diterima, dengan kata lain tidak ada gelombang cahaya yang terserap sehingga tidak menimbulkan suatu warna tertentu. Lain halnya dengan ion Cu2+ yang memiliki konfigurasi elektron [Ar]3d9. Dengan kondisi setengah penuh (orbital terakhir) maka elektron lebih mudah tereksitasi dan menyebabkan gelombang cahaya yang diterima tidak akan diteruskan sepenuhnya, melainkan ada yang terserap sebagian. Dengan demikian akan terlihat suatu warna tertentu, seperti yang dihasilkan dalam penelitian ini, yakni warna biru.
Tahap Hidrogenasi
Perbandingan volume minyak dan larutan elektrolit pada setiap run penelitian dibuat konstan, yakni 3:4. Perbandingan ini dipilih berdasarkan percobaan yang telah dilakukan. Apabila konsentrasi Cu dalam larutan elektrolit lebih dari 1M, ketika larutan di tambahkan perlahan ke dalam minyak, maka akan terbentuk suatu campuran yang sangat kental dengan sangat cepat. Dengan kata lain dengan sedikit penambahan larutan saja, campuran akan menjadi sangat kental. Oleh karena itu dilakukan berbagai variasi perbandingan volume minyak dan larutan elektrolit dalam rentang konsentrasi larutan elektrolit 0.1 – 0.8 M. Dari hasil percobaan diketahui 3:4 merupakan perbandingan antara minyak dan larutan elektrolit yang paling optimum. Perbandingan tersebut dianggap optimum karena volume larutan elektrolit yang dapat digunakan sudah maksimal dalam range konsentrasi tersebut tanpa membuat campuran mengental. Kemudian dilanjutkan dengan proses hidrogenasi yang didahului oleh proses penentuan tegangan optimum sistem pada setiap run-nya. Ketika arus listrik tidak mengalami peningkatan selama penambahan tegangan saat itulah dapat ditetapkan sebagai tegangan optimum. Arus listrik mejadi konstan akibat terhalangi gelembung yang terbentuk.
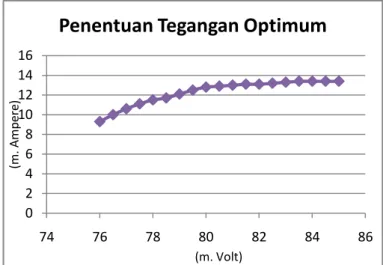
Gambar 3. Grafik Penentuan Tegangan Optimum
Dari grafik tersebut diketahui bahwa tegangan optimum berada pada ±80 mV dengan kuat arus sebesar ±13mA.
Proses hidrogenasi dilakukan dalam variasi waktu dan konsentrasi Cu dalam larutan elektrolit. Melalui perhitungan diketahui bahwa angka iodium minyak awal sebesar 115.992, setelah dihidrogenasi angka iodium turun seperti yang tertera pada tabel di bawah ini.
Tabel 3. Angka Iodium Minyak Hasil Hidrogenasi
Konsentrasi Larutan Elektrolit (M)
Waktu (jam) 0.6 0.3 0.1 gr. minyak ml. tio AI gr. minyak ml. tio AI gr. minyak ml. tio AI 3 0.13 34.5 108.415 0.13 33.5 110.499 0.13 33.1 115.699 3 0.13 34.5 108.415 0.13 33.5 110.499 0.13 33.1 115.699 6 0.13 36 86.7323 0.13 34.3 100.099 0.13 33.3 113.099 6 0.13 36 86.7323 0.13 34.5 97.4991 0.13 33.3 113.099 9 0.13 36.8 67.5994 0.13 35.5 84.4992 0.13 33.5 110.499 9 0.13 36.8 67.5994 0.13 35.5 84.4992 0.13 33.5 110.499 Dari data tersebut dapat diketahui bahwa penggunaan konsentrasi larutan elektrolit sebesar 0.6 M paling efektif dibandingkan dengan yang lainnya. Dalam waktu ±6jam dapat dicapai angka iodium mendekati biodiesel. Sedangkan dengan waktu 9 jam, seluruhnya telah menjadi oleat dengan angka iodium ± 68.
Proses pemurnian minyak dari larutan elektrolit dilakukan dengan menggunakan centrifuge selama beberapa jam. Minyak yang diperoleh berwarna hijau tua. Hal ini menandakan bahwa minyak masih mengandung pengotor (tembaga). Untuk menghilangkan pengotor tersebut dilakukan penambahan heksan dan larutan Na-EDTA yang dapat membentuk kompleks dengan besi. Dalam hal ini heksan berfungsi sebagai pelarut yang membuat minyak cenderung lebih cair sehingga Na-EDTA yang ditambahkan setelahnya lebih mudah mengikat besi dan membentuk kompleks.
Konsentrasi Na-EDTA yang digunakan berkisar ±5% (5 gram dalam 100 mL). Konsentrasi ini dinilai cukup optimum karena apabila lebih dari itu, maka akan terbentuk endapan Na-EDTA sehingga penggunaannya tidak efisien. Larutan Na-EDTA yang semula bening setelah mengikat tembaga akan berwarna biru. Minyak yang diperoleh berwarna kecokelatan diperoleh dari minyak hasil hidrogenasi yang telah didiamkan beberapa hari, tidak langsung dipisahkan dari larutan elektrolitnya. Berbeda dengan minyak yang langsung dipisahkan setelah proses hidrogenasi. Proses pemisahan akan menghasilkan minyak yang berwarna kuning bening, sama seperti sebelum dihidrogenasi. Peristiwa ini diduga terjadi akibat terjadinya kesetimbangan antara minyak dengan senyawa di dalam larutan elektrolit, sehingga sulit terpisahkan dan menimbulkan warna kecokelatan.
0 2 4 6 8 10 12 14 16 74 76 78 80 82 84 86 (m. A mp ere ) (m. Volt)
Perbandingan Hasil Penelitian
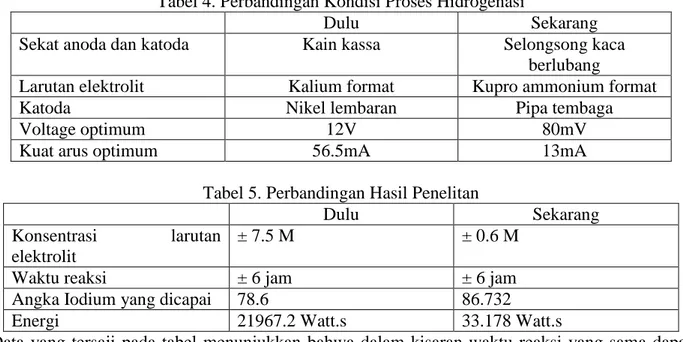
Dibandingkan dengan peneltian yang dilakukan oleh Oktivani (2011), terdapat beberapa perbedaan perlakuan dalam hidrogenasi elektrokimia minyak nabati. Berikut akan dipaparkan perbedaan – perbedaan tersebut.
Tabel 4. Perbandingan Kondisi Proses Hidrogenasi
Dulu Sekarang
Sekat anoda dan katoda Kain kassa Selongsong kaca berlubang
Larutan elektrolit Kalium format Kupro ammonium format
Katoda Nikel lembaran Pipa tembaga
Voltage optimum 12V 80mV
Kuat arus optimum 56.5mA 13mA
Tabel 5. Perbandingan Hasil Penelitan
Dulu Sekarang
Konsentrasi larutan elektrolit
± 7.5 M ± 0.6 M
Waktu reaksi ± 6 jam ± 6 jam
Angka Iodium yang dicapai 78.6 86.732
Energi 21967.2 Watt.s 33.178 Watt.s
Data yang tersaji pada tabel menunjukkan bahwa dalam kisaran waktu reaksi yang sama dapat dicapai target angka iodium biodiesel, yakni 85. Namun, melalui penggunaan larutan kupro ammonium format, dibutuhkan daya yang lebih kecil daripada kalium format. Sehingga boleh dikatakan bahwa dengan penggunaan kupro ammonium format, proses dapat berlangsung dengan lebih ekonomis.
KESIMPULAN
Dari penelitian yang dilakukan, dapat disimpulkan bahwa penentuan tegangan optimum sebaiknya dipilih sebelum mencapai arus konstan. Konsentrasi larutan kupro ammonium format yang ideal untuk menghidrogenasi minyak kemiri sunan adalah 0.6 M karena dalam 6jam dapat menurunkan angka iodium hingga ±86 (kira-kira sama dengan angka iodium minyak yang hanya mengandung iikatan rangkap tunggal, seperti triolein atau metil oleat). Selain itu apabila dibandingkan dengan kalium format, kupro ammonium format dinilai lebih ekonomis karena energi yang dibutuhkan lebih rendah.
UCAPAN TERIMA KASIH
1. Dr.Tatang Hernas S., Ir., selaku dosen pembimbing utama yang telah memberikan bimbingan dan perhatian selama proses penelitian ini.
2. Dr. Tedi Hudaya, ST., M.Eng.Sc., selaku dosen pembimbing yang telah dengan sabar membimbing dengan sabar serta meluangkan waktu sepanjang proses penelitian ini.
DAFTAR PUSTAKA
Bird, Alfred J., Timothy M. Priestley, and John M. Winterbottom (1979). "Process for the Hydrogenation of a Fegetable Oil." Johnson, Matthey & Co., limited, London, England. F.Beck (1979). "Electrochemical and catalytic hydrogenation : common features and
differences." International Chemical Engineering 19(1).
Garmier, William W, and Adam W Rotondo (2002). "Biodegradable Vegetable Oil Compositions." 2: Renewable Lubricants, Inc., Hartville, OH (US).
"Info Tek Perkebunan" (2009). Kemiri Sunan (Aleurites trisperma BLANCO) Tanaman Harapan
Sumber Bahan Bakar Nabati,no. Kemiri Sunan (Aleurites trisperma BLANCO) Tanaman
Harapan Sumber Bahan Bakar Nabati
Knothe, Gerhard, Jon Van Gerpen, and Jurgen Krahl (2005). "The Biodiesel Handbook." ed Jon Van Gerpen Gerhard Knothe, Jurgen Krahl. Illinois: AOCS Press.
Mondal, Kanchan, and Shashi B. Lalvani. "Electrochemical Hydrogenation of Canola Oil Using Hydrogen Transfer Agent." Southern Illinois University, Carbondale (2003): 3.
O'Brien, Richard D (2004). "Fats and Oils (Formulating and Processing for Application)." Boca Barton: CRC Press LLC.
Perry, Robert H (1997). "Perry's Chemical Engineers' Handbook." ed Don W. Green and James O. Maloney. San Fransisco: McGraw Hill.
Pintauro, Peter N (1993). "Electrocatalytic Process for the Hydrogenation of Edible and Non-Edible Oils and Fatty Acids." 3. New Orleans.
Rutz, Dominik, and Rainer Janssen (2007). "Biofuel Technology Handbook." WIP Renewable Energies.
Rylander, Paul N (2005). "Hydrogenation and Dehydrogenation." In Encyclopedia of Industrial
Chemistry, edited by Ullmann. New jersey: Wiley-VCH Verlag GmbH & Co.
Soerawidjaja, T. H., T. P. Brojdonegoro, et al. (2006). Tanaman Sumber Bahan Mentah Biodiesel.
Thober, Herbert C., and Rolland G. Bowers (1947). "Separation of Diolefins from Hydrocarbon Mixtures with Cuprous Ammonium Formate Solutions." In United States Patent Office, 2. Toledo, Ohio.
Yusem, G. J. and P. N. Pintauro (1992). "The Electrocatalytic hydrogenation of soybean oil."