1
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Kanker payudara dikenal sebagai salah satu kanker yang paling mematikan. Kebiasaan pola hidup yang salah, kondisi lingkungan yang buruk, serta adanya faktor genetik menjadi penyebab utama semakin tingginya prevalensi kanker di dunia. Faktor-faktor tersebut berperan dalam proses kanker payudara baik pada tahap promosi, progresi, maupun metastasis (Tyagi, et al., 2004). Insidensi kanker payudara di United State mengalami peningkatan dari 25.000 menjadi 44.000 kasus tiap tahun pada lebih dari 20 tahun (Dowsett, 2008). Di antara kanker yang menyerang wanita Indonesia, kanker payudara menduduki peringkat kedua setelah kanker leher rahim (Dalimartha, 2008).
Pengobatan kanker yang telah dilakukan yaitu pembedahan, kemoterapi, radioterapi, terapi dengan hormon atau dengan terapi antibodi monoklonal (Mihajlovic, 2008 dan Dolinsky, 2002). Pengobatan kanker payudara yang utamanya dipilih adalah dengan menggunakan agen kemoterapi. Agen kemoterapi yang telah dikenal efektif dalam terapi kanker terutama kanker payudara diantaranya adalah Doxorubicin (Dox). Akan tetapi, agen kemoterapi ini dalam dosis yang tinggi beresiko menimbulkan kardiotoksisitas yang dapat menyebabkan kematian (Shan, et al., 1996 cit Kilickap, et al., 2005). Sehingga penemuan obat baru dengan menggunakan bahan alam sebagai alternatif agen
antikanker yang selektif sangat berpotensi untuk dikembangkan (Walaszek, et al., 2004).
Indonesia adalah negara dengan biodiversitas nomor dua di dunia yang memiliki potensi untuk mengembangkan pengobatan dengan bahan dasar alam. Banyak kandungan senyawa yang telah berhasil diisolasi dari bahan alam untuk dikembangkan dan digunakan sebagai obat dalam terapi berbagai penyakit. Daun kenikir (Cosmos caudatus Kunth.) merupakan salah satu bahan alam yang berpotensi berkhasiat sebagai alternatif agen antikanker. Pada uji in vitro, ekstrak metanol daun kenikir mempunyai aktivitas dalam memacu kematian sel T47D melalui mekanisme apoptosis, sehingga berpotensi untuk dikembangkan sebagai obat antikanker dengan target aksi yang spesifik. Kandungan flavonoid dan glikosida kuersetin dalam ekstrak metanol daun kenikir dilaporkan memiliki efek sitotoksik terhadap sel kanker payudara T47D dengan nilai IC50 344,91 μg/mL
(Pebriana, et al., 2008).
Flavonoid dan glikosida kuersetin merupakan komponen aktif dalam daun kenikir (Abas, et al., 2003). Senyawa flavonoid diketahui mampu menginduksi terjadinya apoptosis melalui penghambatan aktivitas DNA topoisomerase I/II, modulasi signalling pathways, penurunan ekspresi gen Bcl-2 dan Bcl-XL, peningkatan ekspresi gen Bax dan Bak, serta aktivasi endonuclease (Ren, et al., 2003) dengan cara menstimulasi pelepasan sitokrom c dari mitokondria. Kuersetin memiliki kemampuan menginduksi apoptosis sel kanker kolon Caco-2 dan HT-29 serta sel kanker leukemia HL-60 dengan cara menstimulasi pelepasan sitokrom c dari mitokondria (Taraphdar, 2001). Kromatrogram ekstrak kenikir hasil analisis
dengan HPLC (dengan ekstrak standard) menunjukkan sampel kenikir memiliki kandungan kuersetin yang paling banyak diantara 10 tanaman sayuran indigenous (Batari, 2007). Kuersetin pada 28 jenis sayuran yang diteliti oleh Hertog, et a.,l (1992) jumlahnya tidak jauh berbeda dari tanaman yang diteliti oleh Mien dan Mohamed (2001). Berdasarkan perbandingan dari data-data tersebut, kenikir memiliki kandungan kuersetin hampir tiga kali lipat dari kandungan kuersetin pada daun bawang.
Seiring dengan perkembangan jaman, pengembangan obat-obatan tidak hanya dilakukan secara eksperimental, tetapi dilakukan secara kimia komputasi. Kimia komputasi memiliki banyak keunggulan seperti mengurangi biaya dan menghemat waktu penelitian. Adanya kimia komputasi banyak dilakukan penemuan dan pengembangan obat untuk memprediksi penempatan gugus fungsi aktif (gugus farmakofor) suatu molekul secara tiga dimensi (Richon, 1994). Metode yang digunakan untuk menganalisis afinitas suatu molekul obat salah satunya yaitu secara in silico.
Metode in silico banyak digunakan untuk memberikan gambaran tentang ikatan, interaksi, afinitas suatu obat (ligan) dengan reseptornya, maupun enzim dengan substrat atau inhibitornya dan juga dapat berguna dalam pengembangan senyawa dengan aktivitas yang lebih baik serta dapat digunakan memprediksi apakah suatu senyawa memiliki aktivitas atau tidak. Meskipun pengembangan senyawa aktif kuersetin dari daun kenikir (Cosmos caudatus kunth.) dalam memacu apoptosis dengan metode in vitro sudah pernah dilakukan, namun belum ada penelitian mengenai senyawa aktif kuersetin dari daun kenikir sebagai
pemacu apoptosis yang dilakukan secara kimia komputasi (metode in silico) caranya yaitu mendesain senyawa dan interaksi senyawa tersebut dengan enzim atau reseptor. Melalui uji in silico, senyawa aktif kuersetin dari daun kenikir (Cosmos caudatus Kunth.) perlu diuji interaksinya dengan reseptor Bcl-2. Protein Bcl-2 merupakan protein yang memainkan peranan penting pada regulasi apoptosis, atau kematian sel terprogram (Petros, et al., 2005). Bax dan Bak merupakan protein proapoptosis sedangkan Bcl-2 dan Bcl-XL merupakan protein anti apoptosis (King, 2000). Pada sel kanker, mutasi dapat menyebabkan peningkatan ekspresi Bcl-2 yang dapat menekan fungsi normal dari protein proapoptosis. Hal ini akan menyebabkan sel kehilangan kemampuan untuk regulasi apoptosis yang dapat memicu terjadinya sel yang tidak terkontrol (kanker) (Lumongga, 2008). Apabila hasil uji menunjukkan interaksi yang baik antara senyawa aktif dari daun kenikir dengan reseptor Bcl-2 maka dapat dilanjutkan dengan melakukan uji in vivo untuk mengetahui tingkat keamanannya agar dapat dikembangkan lebih lanjut sebagai sediaan pemacu apoptosis yang poten.
B. Perumusan Masalah
1. Apakah kuersetin, senyawa aktif dari daun kenikir mempunyai afinitas yang baik dengan reseptor Bcl-2 (PDB ID : 4LVT, 4MAN, 4XLD, 2W3L) sebagai pemacu apoptosis sel kanker payudara T47D secara in silico?
2. Bagaimana mekanisme aksi kuersetin, senyawa aktif dari daun kenikir dengan reseptor Bcl-2 (PDB ID : 4LVT, 4MAN, 4XLD, 2W3L) sebagai pemacu apoptosis sel kanker payudara T47D secara in silico?
C. Tujuan Penelitian
1. Membuktikan adanya afinitas kuersetin, senyawa aktif dari daun kenikir dengan reseptor Bcl-2 (PDB ID : 4LVT, 4MAN, 4XLD, 2W3L) sebagai pemacu apoptosis sel kanker payudara T47D secara in silico.
2. Mengetahui bagaimana mekanisme aksi kuersetin, senyawa aktif dari daun kenikir dengan reseptor Bcl-2 (PDB ID : 4LVT, 4MAN, 4XLD, 2W3L) sebagai pemacu apoptosis sel kanker payudara T47D secara in silico.
D. Manfaat Penelitian
Penelitian ini diharapkan dapat menjelaskan salah satu mekanisme aksi kuersetin dalam memacu apoptosis sel kanker payudara T47D secara in silico.
E. Tinjauan Pustaka 1. Kanker Payudara
Kanker payudara adalah kanker yang terjadi pada jaringan payudara yaitu pada lobulus (kelenjar susu) dan ductus (saluran yang menyalurkan susu ke puting). Kanker payudara merupakan proses perubahan genetik yang disebabkan karena sel inang normal berinteraksi dengan tumor (sel imun, vaskuler dan sel stromal) (Cavalieri, et al., 2006). Penyebab kanker payudara sangat beragam, antara lain:
a. Kerusakan pada DNA yang menyebabkan mutasi genetik. Kerusakan ini dapat disebabkan oleh radiasi yang berlebihan
b. Kegagalan immune surveillance dalam pencegahan proses malignan pada fase awal
d. Malfungsi DNA repairs seperti : BRCA1, BRCA2, dan p53. (Cavalieri, et al., 2006)
Insidensi kanker payudara di Indonesia cukup tinggi diperkirakan sebanyak 21 penderita baru per seratus ribu orang (Siswono, 2006). Kanker payudara dapat terjadi pada pria dan wanita, tetapi mempunyai prevalensi pada wanita yang jauh lebih tinggi. Kasus kanker yang menyerang wanita Indonesia, kanker payudara menduduki peringkat kedua setelah kanker leher rahim (Dalimartha, 2008).
Kanker payudara pada umumnya berupa ductal breast cancer yang invasif dengan pertumbuhan tidak terlalu cepat. Sel ini dapat tumbuh benjolan sebesar 1 cm2 dalam waktu 8-12 tahun (Tambunan, 1995). Banyak kasus kanker termasuk kanker payudara ditemukan ekspresi Bcl-2 yang berlebihan (King, 2000; Davis, et al., 2003).
Protein Bcl-2 merupakan protein yang memainkan peranan penting pada regulasi apoptosis, atau kematian sel terprogram (Petros, et al., 2005). Bax dan Bak merupakan protein proapoptosis sedangkan Bcl-2 dan Bcl-XL merupakan protein anti apoptosis (King, 2000). Pada sel kanker, mutasi dapat menyebabkan peningkatan ekspresi Bcl-2 yang dapat menekan fungsi normal dari protein proapoptosis. Hal ini akan menyebabkan sel kehilangan kemampuan untuk regulasi apoptosis yang dapat memicu terjadinya kanker (Lumongga, 2008).
Peningkatan insidensi kanker payudara disebabkan oleh kegagalan terapi terhadap kanker itu sendiri yang diakibatkan oleh adanya multidrug resistance
(MDR) dan terjadi hingga 71% dibandingkan dengan faktor penyebab lainnya (Mechetner, et al., 1998). Multidrug resistance diakibatkan oleh adanya breast cancer resistance protein (BCRP) yang salah satunya adalah P-glycoprotein (Pgp) (Imai, et al., 2005). Aktivasi Pgp dan peningkatan ekspresinya dapat menurunkan efikasi dari beberapa agen kemoterapi seperti Taxol dan Doxorubicin (Mechetner, et al., 1998). Penekanan aktivitas Pgp dan ekspresinya mampu meningkatkan efektivitas agen kemoterapi (Zhou, et al., 2006).
BRCA1 adalah breast cancer susceptibility gene. Sebagian kasus kanker payudara terjadi karena adanya mutasi genetik BRCA1 dan BRCA2 (Garcia, et al., 2009). Mutasi pada BRCA1 adalah delesi ekson 11 sedangkan pada BRCA2 adalah delesi ekson 12 dan 3 (Pusztai, et al., 1996). Adanya mutasi pada BRCA1 dan BRCA2 akan meningkatkan resiko terjadinya kanker ovarian dan kanker payudara (King, 2000).
2. Apoptosis
Apoptosis merupakan suatu proses normal yang terlibat dalam berbagai keperluan seperti perbaikan jaringan dan pelepasan sel yang rusak yang mungkin membahayakan tubuh (King, 2000). Apoptosis adalah mekanisme fisiologis dari kematian sel yang telah menunjukkan peranan dalam onset dengan atau perkembangan kanker. Apoptosis berfungsi mengeliminasi sel yang tidak diinginkan atau tidak berguna selama proses pertumbuhan sel dan proses biologis normal lainnya seperti pada embriogenesis, hormone-dependent involution pada siklus menstruasi dan atresia folikel pada menopause, delesi
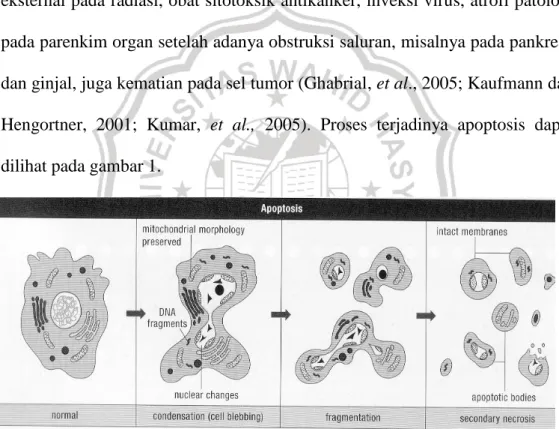
sel pada poliferasi sel epitel, eliminasi sel reaktif limfosit yang berlebihan, kematian sel yang diinduksi oleh sel T sitotoksik pada infeksi virus dan perkembangan tumor (Wyllie, et al., 2000). Sel yang mengalami apoptosis, morfologinya berupa sitoplasma mengkerut, membran berbentuk gelembung kondensasi kromatin ( DNA dan protein) dan fragmentasi pada membran yang menggelembung. Apoptosis juga terjadi pada kondisi patologi, dimana apoptosis bertanggung jawab pada kematian sel seperti stimulasi kerusakan eksternal pada radiasi, obat sitotoksik antikanker, inveksi virus, atrofi patologi pada parenkim organ setelah adanya obstruksi saluran, misalnya pada pankreas dan ginjal, juga kematian pada sel tumor (Ghabrial, et al., 2005; Kaufmann dan Hengortner, 2001; Kumar, et al., 2005). Proses terjadinya apoptosis dapat dilihat pada gambar 1.
Gambar 1. Proses terjadinya apoptosis (Bobe, 2002)
Apoptosis berperan penting dalam membatasi proliferasi sel yang tidak diperlukan yang dapat menginduksi kanker. Sel kanker memiliki kemampuan untuk mensintesis faktor pertumbuhan sehingga merusak mekanisme homeostatis penting yang secara normal berfungsi menjamin keberaturan dari
bermacam-macam sel dalam jaringan. Apoptosis dapat terjadi melalui jalur ekstrinsik dan instrinsik. Jalur ekstrinsik (jalur sitoplasma) yang dipacu melalui Fas death receptor, bagian dari tumor necrosis factor (TNF) receptor superfamily. Jalur intrinsik (jalur mitokondria) dinduksi sebagai respon terhadap kerusakan DNA, glukokortikoid, ceramide, dan penurunan faktor pertumbuhan yang menyebabkan perubahan pada membran mitokondria. Permeabilitas membran mitokondria diatur oleh aksi berlawanan dari pro dan anti apoptosis famili Bcl-2. Protein yang termasuk dalam kelompok pro apoptosis adalah Bax (Bcl-2 associated x protein), Bak (Bcl-2 homologus antagonist killer), dan Bok sedangkan yang termasuk protein anti apoptosis adalah Bcl-2 dan Bcl-XL (Ricci dan Zong, 2006). Adanya suatu sinyal kematian sel, protein pro-apoptosis melakukan modifikasi post translation termasuk defosforilasi dan pemecahan yang mengakibatkan aktivasinya dan translokasi mitokondria untuk memacu apoptosis. Respon dari stimulus apoptosis, menyebabkan membran luar mitokondria menjadi permeable, yang akan memacu pelepasan sitokrom C dan pemacu caspase. Sitokrom C akan melepaskan sitosol, yang berinteraksi dengan Apaf-1 dan memacu aktivitas pro-enzim caspase-9. Aktivasi caspase-9 kemudian mengaktifkan caspase-3, selanjutnya menginduksi aktivasi sisa cascade, caspase dan terjadilah apoptosis. Aktivasi caspase menyebabkan lamin nucleus dan terurainya nucleus oleh caspase-3. Jalur instrinsik dan ekstrinsik ini saling berhubungan, dimana pemaparan secara berlebihan dari Bcl-2 pada jalur instrinsik dapat memacu hambatan dari jalur ekstrinsik, sebaliknya TNF-α dapat meningkatkan
ekspresi NF-kB dan menstimulasi anggota anti-apoptosis dari protein Bcl-2 family (Tamm, et al., 2001).
Gambar 2. Jalur instrinsik dan ekstrinsik apoptosis. (Ricci, M.S., and Zong, W.,
2006). Jalur instrinsik diinduksi oleh stress seluler (kerusakan DNA) yang mengatur keberadaan protein pro apoptosis (Bak/Bax) melebihi protein antiapoptosis (Bcl-2) sehingga sitokrom terlepas menuju keluar membran mitokondria, membentuk apoptosom bersama APAF 1, dATP, procaspase-9 mengaktivasi jalur caspase. Jalur ekstrinsik diinduksi melalui aktivasi reseptor kematian (TNFR, FAS) oleh ligan (TNF, Fas ligan) yang mengaktifkan caspase-8 yang memotong Bid menjadi tBid yang mengaktifkan jalur caspase sehingga terjadi apoptosis.
3. Kuersetin
Gambar 3. Struktur kimia kuersetin (Herowati, 2008)
Flavonoid merupakan salah satu kelompok senyawa metabolit sekunder yang paling banyak ditemukan didalam jaringan tanaman (Rajalakshmi dan
Narasimhan, 1985). Flavonoid adalah komponen yang mempunyai berat molekul rendah, dan pada dasarnya merupakan phenylbenzopyrones dengan berbagai variasi pada struktur dasarnya, yaitu tiga cincin utama yang saling melekat. Flavonoid termasuk dalam golongan senyawa fenolik dengan struktur kimia C6-C3-C6 (White dan Xing, 1951; Madhavi, et al., 1985; Maslarova,
2001). Flavonoid memiliki ikatan difenilpropana C6-C3-C6 yang diketahui
sebagai antimutagenik dan antikarsinogenik. Kerangka flavonoid terdiri dari satu cincin aromatik A, satu cincin aromatik B, dan cincin tengah berupa heterosiklik yang mengandung oksigen dan bentuk teroksidasi cincin ini dijadikan dasar pembagian flavonoid kedalam sub-sub kelompoknya. Sistem penomoran digunakan untuk membedakan posisi karbon disekitar molekulnya (Cook dan Samman, 1996). Jenis utama flavonoid adalah antosianidin, flavonol, flavone, flavonol, flavonone, dan isoflavon (Spencer, et al., 2003). Telah banyak hasil penelitian yang menunjukkan bahwa flavonoid mempunyai kontribusi dalam aktivitas anti-proliferatif pada sel kanker manusia. Diketahui bahwa dari hasil penelitian, tangeretin, suatu senyawa flavonoid yang terdapat pada citrus, dapat menghambat sel tumor manusia (Bracke, et al., 1994).
Kuersetin adalah senyawa kelompok flavonol terbesar, kuersetin dan glikosidanya berada dalam jumlah sekitar 60-75% dari flavonoid. Kuersetin dipercaya dapat melindungi dari tubuh dari beberapa jenis penyakit degeneratif dengan cara mencegah terjadinya proses peroksidasi lemak. Kuersetin banyak memiliki aktivitas biologis diantaranya bersifat antitumor dan antipoliferatif pada berbagai sel kanker manusia, serta memiliki kemampuan untuk
menghambat glikolisis, sintesis makromolekul, dan aktivitas enzimatik (Bonavida, 2008).
4. Doxorubicin (Dox)
Doxorubicin merupakan agen kemoterapi jenis sitostatika yang termasuk golongan antrasiklin (Rahardja dan Tjay, 2002). Namun, doxorubicin tidak digunakan sebagai antimikroba walaupun termasuk dalam golongan antibiotik. Doxorubicin telah digunakan secara luas untuk mengobati kanker payudara (Thurston dan Lobo, 1998). Senyawa ini menunjukkan kemampuan yang kuat dalam melawan kanker dan telah digunakan sebagai obat kemoterapi kanker sejak akhir tahun 1960-an (Singal, et al., 1998; Rock dan DeMichele, 2003). Tetapi, penggunaan doxorubicin secara terus menerus meningkatkan resiko kardiotoksisitas yang dapat menyebabkan kematian (Shan, et al., 1996 cit Kilickap, et al., 2005). Mekanisme kerja doxorubicin melalui tiga mekanisme utama, yaitu (Katzung, 2003):
1. Memiliki afinitas tinggi sehingga mampu mengikat DNA secara interkalasi dengan menghambat topoisomerase II dan mencegah sintesis DNA dan RNA.
2. Berikatan pada membran sel kanker sehingga menyebabkan perubahan kondisi cairan sel dan transport ion.
3. Membentuk radikal bebas semikuinon dan radikal oksigen sehingga meningkatkan proses apoptosis.
Doxorubicin memiliki aktivitas antineoplastik dan spesifik untuk fase S dalam siklus sel. Mekanisme aktivitas antineoplastiknya belum diketahui
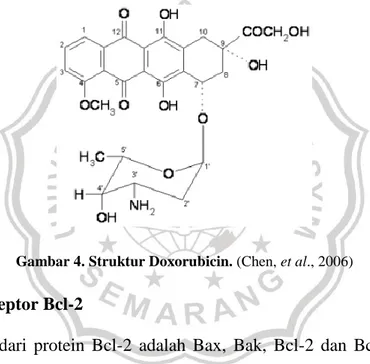
dengan pasti. Mekanisme aksi doxorubicin kemungkinan melibatkan ikatan dengan DNA melalui interkalasi di antara pasangan basa serta menghambat sintesis DNA dan RNA melalui pengkacauan template dan halangan sterik (Rock dan DeMichele, 2003). Kemungkinan mekanisme yang lain adalah melibatkan ikatan dengan lipid membran sel yang akan mengubah berbagai fungsi selular dan berinteraksi dengan topoisomerase II membentuk kompleks pemotong DNA. Struktur doxorubicin dapat dilihat pada Gambar 4.
Gambar 4. Struktur Doxorubicin. (Chen, et al., 2006) 5. Protein Reseptor Bcl-2
Family dari protein Bcl-2 adalah Bax, Bak, Bcl-2 dan Bcl-XL. Bax dan Bak merupakan protein proapoptosis sedangkan Bcl-2 dan Bcl-XL merupakan protein anti apoptosis (King, 2000). Anggota anti-apoptosis Bcl-2 dan Bcl-XL menekan apoptosis melalui blokade pelepasan sitokrom-c, dimana anggota pro-apoptosis bekerja sebagai promotor. Efek ini lebih tergantung pada keseimbangan antara Bcl-2 dan Bax dibandingkan pada Bcl-2 sendiri (ghobrial, et al., 2005; Reed, 1994). Apabila ekspresi Bax atau Bak dinaikkan dan Bcl-2
atau Bcl-XL diturunkan, maka akan terjadi regulasi sel kearah kematian melalui apoptosis.
Bcl-2 menempel pada membran luar mitokondria sehingga menghalangi pelepasan sitokrom c sedangkan Bcl-XL berikatan dengan Apaf-1 (Nunez, et al., 1998). Sitokrom c dan Apaf-1 diperlukan dalam apoptosis jalur intrinsik dengan cara mengaktivasi caspase-9 (Saleh, et al., 1999). Bax dan Bak memperantai fungsi bertahan hidup dan diimbangi oleh fungsi kematian sel. Bax dapat berikatan dengan membran luar mitokondria sehingga menginduksi pengeluaran sitokrom c dari mitokondria sedangkan Bak dapat berikatan dengan Bcl-XL sehingga membebaskan Apaf-1 (Nunez, et al., 1998).
Bcl-2 family merupakan regulator yang paling penting untuk pengaturan utama pada proses apoptosis dalam keseimbangan regulasi pertumbuhan siklik endometrium (Loffe, et al., 1998). Peningkatan ekspresi Bcl-2 dapat menyebabkan resistensi terhadap obat kemoterapi dan terapi radiasi, meskipun penurunan ekspresi Bcl-2 dapat memacu respon apoptosis pada obat antikanker (Ghobrial, et al., 2005).
6. Daun Kenikir (Cosmos caudatus Kunth.)
Daun kenikir merupakan tumbuhan tropis yang berasal dari Amerika Latin, Amerika Tengah, tetapi tumbuh liar dan mudah didapat di Florida Amerika Serikat serta di Indonesia dan Negara-negara Asia Tenggara lainnya. Daun kenikir dibawa ke Asia Tenggara melalui Filipina oleh Spanyol. Kenikir merupakan anggota dari asteraceae. Bunga kenikir yang berwarna kuning jarang digunakan sebagai ulam, tetapi yang berwarna ungu merupakan sayuran
yang sangat popular dimakan mentah bersama nasi atau dengan budu, sambal terasi, tempoyak, serta cicalok. Spesies ini disebut ulam raja di Malaysia yang artinya salad raja (Luqman, 2011). Tanaman daun kenikir dapat dilihat pada Gambar 5.
Gambar 5. Daun Kenikir (Cosmos caudatus Kunth.) a. Morfologi
Daun kenikir mempunyai tinggi 75-100 cm dan berbau khas. Batang tegak, segi empat, beralur membujur, bercabang banyak, beruas berwarna hijau keunguan. Daunnya majemuk, bersilang berhadapan, berbagi menyirip, ujung runcing, tepi rata, panjang 15-25 cm, berwarna hijau. Bunga majemuk, bentuk bongkol, di ujung batang, tangkai panjang ± 25 cm, mahkota terdiri dari 8 daun mahkota, panjang ± 1 cm, merah, benang sari bentuk tabung, kepala sari coklat kehitaman, putik berambut, hijau kekuningan, merah. Buahnya keras, bentuk jarum, ujung berambut, masih muda berwarna hijau setelah tua coklat. Biji keras, kecil, bentuk jarum, panjang ± 1 cm, berwarna hitam. Akar tunggang dan berwarna putih. (Luqman, 2011).
b. Klasifikasi
Klasifikasi daun kenikir (Judd, et al., 1999; Simpson, 2006) adalah sebagai berikut : Kingdom : Plantae Divisi : Spermatophyta Kelas : Dicotyledonae Ordo : Asterales Famili : Asteraceae Marga : Cosmos
Spesies : Cosmos caudatus Kunth.
c. Kandungan Kimia
Kandungan kimia yang terdapat dalam daun kenikir yaitu flavonoid dan polifenol. Tes fitokimia melalui screening juga menyebutkan bahwa pada daun kenikir mengandung terpenoid yaitu minyak atsiri, alkaloid, dan saponin (harbone, 1998; Liliwirianis, 2011).
Kandungan flavonoid dan fenol pada 100 mg daun kenikir berturut-turut sebesar 52,18 mg dan 152,01 (Batari, 2007) sedangkan pada daun kadar saponinnya sebesar 2,2%. Minyak atsiri dalam daun kenikir menurut Lee dan Vairappan (2011) diketahui berjumlah 0,08% dalam bentuk segar (Siagian, 2012).
d. Khasiat
Kenikir mempunyai khasiat sebagai antimikroba (Ragasa, et al, 1997), memiliki aktivitas antioksidan yang sangat tinggi (Shui, et al, 2005), zat
antioksidan tersebut berfungsi untuk menangkal radikal bebas. Radikal bebas dipercaya memicu banyak penyakit karena faktor lingkungan, seperti kanker dan jantung. Karena hal ini, daun kenikir disebut sebagai agen kemopreventif.
7. Kimia Komputasi dan Metode In Silico
Kimia komputasi merupakan ilmu baru yang merupakan pengembangan dunia komputasi dan ilmu kimia. Kimia komputasi menggunakan piranti lunak (software) untuk menjelaskan suatu proses dan reaksi senyawa kimia. Peran ilmu ini antara lain mencakup modelling dan simulasi komputer untuk keperluan biomolekuler, obat, molekul organik, dan molekul anorganik (Cramer, 2004). Kelebihan kimia komputasi adalah dapat memprediksi karakteristik dan stabilitas suatu sistem kimia dan estimasi energi berbagai mekanisme kimia.
Kimia komputasi biasanya digunakan oleh para peneliti untuk mencapai target dan memperoleh jawaban yang benar agar lebih efisien (Cramer, 2004). Model merupakan salah satu cara untuk mendeskripsikan serta memprediksi hasil penelitian, yang dapat berupa penjelasan matematika yang sederhana atau tidak berhubungan dengan matematika sama sekali. Model juga dapat menjelaskan fenomena tanpa manipulasi matematika kompleks dengan teori rumit (Young, 2001).
Metode in silico adalah bagian dari kimia komputasi. Menurut Richon (1994) metode in silico merupakan proses komputasional yang digunakan dalam pencarian agar sebuah ligan dapat cocok, baik secara geometris dan
energi dalam sisi aktif. Proses komputasional membantu menemukan kemungkinan fungsi biologis dari suatu protein dengan membandingkan sekuen asam amino dengan protein dari pangkalan data yang fungsinya diketahui, memahami mekanisme molekuler dari protein, membantu menganalisis interaksi antara active site protein dengan ligan dan mendesain molekul baru yang lebih optimum (Ramachandran, et al, 2008). Apabila struktur proteinnya diketahui maka kita dapat mendesain obat untuk memprediksi kekuatan dan spesifitas molekul terhadap reseptornya, evaluasi dengan kimia komputasi dapat mengetahui energi interaksinya dengan senyawa target (Cramer, 2004).
Metode yang terdapat dalam pengembangan obat baru dengan kimia komputasi yaitu ada dua yaitu metode Ligan Based Drug Design (LBDD) dan Structure Based Drug Design (SBDD) (Istiyastono, 2003; Yuliana, 2004). Metode in silico merupakan proses komputasional yang digunakan dalam pencarian agar sebuah ligan dapat cocok. Asumsi dalam metode ini yaitu struktur protein berwujud rigid (kaku) dan hanya ligan yang berubah struktur 3D-nya selama proses pembentukan ikatan seperti model gembok kunci Emil Fischer tahun 1890. Autodock, Dock, dan FlexX adalah perangkat lunak yang mengguanakan metode tersebut.
Menurut Kitchen (2004) perhitungan interaksi ligan-reseptor dengan scoring merupakan salah satu aspek yang penting dalam uji in silico, apabila tidak dilakukan fungsi scoring dengan baik, maka sulit untuk memperoleh pose ligan yang tepat sehingga tidak selektif dan efisien. Selektif yaitu kemampuan
fungsi scoring dalam membedakan struktur yang benar dan salah sedangkan efisien adalah waktu yang dibutuhkan untuk menyelesaikan perhitungan oleh fungsi tersebut.
RMSD (Root Mean Square Deviation) adalah pengukuran geometri dua pose dengan membandingkan posisi atom antara struktur yang diprediksi. (Hawkins, et al., 2008). PLANTS (Protein-Ligand ANT-System) merupakan salah satu program in silico tak berbayar (gratis) yang mempunyai kualitas seperti GOLD (Aplikasi in silico yang berbayar) yang banyak digunakan di Eropa dan Amerika. PLANTS didasarkan pada kelas algoritma optimasi skokastik yang disebut optimasi koloni semut (ACO : Ant Colony Optimization). ACO terinspirasi oleh perilaku semut nyata menemukan jalan terpendek antara sarang dan sumber makanan. PLANTS, tersedia dua scoring function, yaitu PLP (Piecewise Linear Potential) dan CHEMPLP yang merupakan pengembangan dari PLP (Korb, et al, 2007; Korb, et al., 2009). Kelebihan aplikasi ini yaitu gratis, sederhana dan mudah diaplikasikan (Purnomo, 2011).
F. Landasan Teori
Daun kenikir (Cosmos caudatus Kunth.) merupakan salah satu bahan alam yang berpotensi berkhasiat sebagai alternatif agen antikanker. Flavonoid dan glikosida kuersetin merupakan komponen aktif dalam daun kenikir (Abas, et al., 2003). Pada uji in vitro, ekstrak metanol daun kenikir menunjukkan aktivitas dalam memacu kematian sel T47D melalui mekanisme apoptosis, sehingga berpotensi untuk dikembangkan sebagai obat antikanker dengan target aksi yang
spesifik. Kandungan flavonoid dan glikosida kuersetin dalam ekstrak metanol daun kenikir dilaporkan memiliki efek sitotoksik terhadap sel kanker payudara T47D dengan nilai IC50 344,91 μg/mL (Pebriana, et al., 2008). Senyawa flavonoid
diketahui mampu menginduksi terjadinya apoptosis melalui penghambatan aktivitas DNA topoisomerase I/II, modulasi signalling pathways, penurunan ekspresi gen Bcl-2 dan Bcl-XL, peningkatan ekspresi gen Bax dan Bak, serta aktivasi endonuclease (Ren, et al., 2003). Kromatrogram ekstrak kenikir hasil analisis dengan HPLC (dengan ekstrak standard) menunjukkan sampel kenikir memiliki kandungan kuersetin yang paling banyak diantara 10 tanaman sayuran indigenous (Batari, 2007). Kuersetin pada 28 jenis sayuran yang diteliti oleh Hertog, et al (1992) jumlahnya tidak jauh berbeda dari tanaman yang diteliti oleh Mien dan Mohamed (2001). Berdasarkan perbandingan dari data-data tersebut, kenikir memiliki kandungan kuersetin hampir tiga kali lipat dari kandungan kuersetin pada daun bawang.
Aktivitas senyawa aktif dari daun kenikir (Cosmos caudatus Kunth.) sebagai pemacu apoptosis sel kanker payudara T47D dapat dievaluasi secara kimia komputasi dengan metode in silico menggunakan software PLANTS. Uji in silico dapat digunakan untuk mengetahui apakah suatu senyawa mempunyai aktivitas atau tidak dan dapat berguna dalam pengembangan senyawa untuk aktivitas yang lebih baik. Selain itu, metode ini juga dapat menggambarkan interaksi, ikatan, maupun afinitas suatu ligan (obat) dengan reseptornya. Metode in silico, analisis data dilakukan dengan membandingkan skor tiap senyawa dan skor ligan asli sehingga hasil yang diperoleh berupa skor yang menunjukkan
kekuatan interaksi ligan dengan reseptor. Semakin rendah skor, maka ikatan antara ligand dan reseptor akan mudah terjadi dan senyawa mempunyai aktivitas yang tinggi (Purnomo, 2011).
G. Hipotesis
Kuersetin, senyawa aktif dari daun kenikir memiliki afinitas dan mekanisme yang baik dengan reseptor Bcl-2 (PDB ID : 4LVT, 4MAN, 4XLD, 2W3L) sebagai pemacu apoptosis sel kanker payudara T47D secara in silico.