PENGUJIAN FORMULASI KONSORSIUM BAKTERI SECARA IN
VITRO UNTUK MENGENDALIKAN PENYAKIT HAWAR DAUN
BAKTERI
DELLY TRIANGGANA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
ABSTRAK
DELLY TRIANGGANA. Pengujian Formulasi Konsorsium Bakteri secara In Vitro untuk Mengendalikan Penyakit Hawar Daun Bakteri. Dibimbing oleh NISA RACHMANIA MUBARIK dan YADI SURYADI.
Pengembangan agens biokontrol (agens hayati) sebagai komponen pengendalian penyakit padi perlu dilakukan. Penelitian ini bertujuan untuk mengetahui keefektifan formula konsorsium bakteri sebagai pengendali penyakit hawar daun bakteri (HDB). Perlakuan isolat yang digunakan masing-masing ialah A5 (B. firmus E65+ P. aeruginosa C32b), A6 (B. firmus E65+ P. aeruginosa C32b + B. cereus II. 14), A8 (B. firmus E65+ P. aeruginosa C32b + B. cereus II. 14+ S. marcescens E 31) serta penambahan bahan pembawa agensia yang diberikan pada masing-masing perlakuan. Hasil uji konsorsium A5, A6, dan A8 secara in vitro dapat menghambat pertumbuhan Xanthomonas oryzae pv. oryzae masing-masing 84,29%, 75,71%, dan 78,57%. Hasil uji viabilitas menunjukkan konsorsium A8 memiliki jumlah sel yang tinggi yaitu setelah satu bulan penyimpanan pada suhu ruang dibandingkan konsorsium A5 dan A6.
Kata kunci : Hawar Daun Bakteri, Xanthomonas oryzae pv. oryzae (Xoo), konsorsium bakteri, pengendali hayati.
ABSTRACT
DELLY TRIANGGANA. Test of Bacterial Consortium Formulation to Control of Bacterial Blight Diseases on Rice. Supervised by NISA RACHMANIA MUBARIK and YADI SURYADI.
Development of biocontrol agents were used as component of rice diseases control needs to be carry out. This study was aimed to determine the effectivity of bacterial consortium to control bacterial blight diseases on rice plants. Formulation tested were A5 (B. firmus E65+ P. aeruginosa C32b), A6 (B. firmus E65+ P. aeruginosa C32b + B. cereus II. 14), A8 (B. firmus E65+ P. aeruginosa C32b + B. cereus II. 14+ S. marcescens E 31) by using carrier agents. The results of in vitro test that formulations of A5, A6, and A8 showed percentage of inhibition to Xanthomonas oryzae pv. oryzae i.e. 84,29%, 75,71%, 78,57% respectively. Viability test results showed that the A8 consortium had the highest total cell than A5 and A6 consortia at 1 month storage, room temperature.
Key Word: Bacterial Blight, Xanthomonas oryzae pv. oryzae (Xoo), bacterial consortium, biological control.
PENGUJIAN FORMULASI KONSORSIUM BAKTERI SECARA IN
VITRO UNTUK MENGENDALIKAN PENYAKIT HAWAR DAUN
BAKTERI
DELLY TRIANGGANA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Judul : Pengujian Formulasi Konsorsium Bakteri secara In Vitro untuk Mengendalikan PenyakitHawar Daun Bakteri pada Tanaman Padi
Nama : Delly Trianggana NIM : G34061454
Menyetujui,
Pembimbing I Pembimbing II
Dr. Nisa Rachmania Mubarik, M.Si. Ir. Yadi Suryadi, M.Sc. NIP 19671127 199302 2 001 NIP 19580925 198503 1 002
Mengetahui,
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. Ir. Ence Darmo Jaya Supena, M.S. NIP 19641002 198903 1 002
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas limpahan rahmat, nikmat, izin dan karunia-Nya penulis dapat menyelesaikan karya ilmiah dengan judul Pengujian Formulasi Konsorsium Bakteri untuk Mengendalikan Penyakit Hawar Daun Bakteri pada Tanaman Padi. Penelitian ini dilaksanakan pada bulan januari 2012 sampai juli 2012. Penelitian ini didanai dari dana KKP3T Departemen Pertanian, Republik Indonesia, tahun 2012.
Terima kasih kepada penulis ucapkan kepada Dr. Nisa Rachmania Mubarik, M. Si dan Ir. Yadi Suryadi, M. Sc atas bimbingan dan pengarahan yang diberikan dalam penelitian ini. Ucapan terima kasih disampaikan pula kepada Dr. Nunik Sri Ariyanti, M. Si atas arahan dan diskusi yang diberikan. Penulis mengucapkan terima kasih kepada keluarga tercinta yang senantiasa memberi doa dan dukungan. Penulis juga mengucapkan terima kasih kepada Ibu Aminah, Pak Jajang, Pak Eep, Ibu Endang, Mas Alam, dan Ibu Yuli di Laboratorium Konservasi Mikrob BB Biogen atas segala bantuan dan saran selama berlangsungnya penelitian yang dilakukan.
Semoga penelitian ini bermanfaat.
Bogor, Febuari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Provinsi Jawa Barat, pada tanggal 3 Agustus 1988 dari pasangan Dedi Sukardi dan Muslimah. Penulis merupakan anak ketiga dari lima bersaudara. Penulis menyelesaikan pendidikan dasar dan menengah di SDN Pengadilan 3 Tasikmalaya pada tahun 2000, SMPN 5 Bogor pada tahun 2003, dan SMAN 3 Bogor pada tahun 2006. setelah itu, penulis melanjutkan pendidikan tinggi pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB (USMI).
Penulis mempunyai pengalaman sebagai asisten praktikum pada mata kuliah Perkembangan Hewan pada tahun 2010/2011. Penulis juga pernah aktif dalam Paduan Suara Mahasiswa IPB (PSM IPB) Agria Swara sebagai anggota kesekretariatan pada tahun 2007-2009, Himpunan Mahasiswa Biologi (HIMABIO) sebagai anggota informasi tahun 2007-2008, Koordinator Acara Lomba cepat Tepat Biologi (LCTB) tahun 2008, Ketua Divisi Kepelatihan tim PSM IPB Agria Swara Rimini International Choir Competition di Italia tahun 2009, anggota Divisi Kepelatihan tim PSM IPB Agria Swara VI Harald Andersen Choir Competition di Finlandia tahun 2012 serta berpartisipasi dalam berbagai aktivitas keorganisasian di FMIPA, IPB. Selama menempuh studi di Departemen Biologi, penulis juga pernah melakukan studi lapang berjudul Eksplorasi dan Identifikasi Potensi Tumbuhan Survival di Kawasan Taman Wisata Alam Situ Gunung, Sukabumi pada tahun 2008 dan praktik lapangan di BB Biogen dengan judul Pengujian patogenitas Serratia marcescens terhadap Wereng Coklat (Nilaparvata lugens) dan Ulat Hongkong (Tenebrio molitor) pada tahun 2011.
DAFTAR ISI
Halaman
DAFTAR TABEL ……….. viii
DAFTAR GAMBAR……….. viii
DAFTAR LAMPIRAN………... viii
PENDAHULUAN Latar Belakang ………. 1
Tujuan Penelitian……….. 1
BAHAN DAN METODE Waktu dan Tempat………... 1
Bahan ………... 1
Peremajaan Isolat Bakteri ……… 2
Peremajaan Isolat Bakteri Patogen Xanthomonas oryzae pv oryza...……… 2
Uji Antagonisme Bakteri terhadap Bakteri Xoo….………. 2
Formulasi Bahan Pembawa Agensia Biokontrol... 2
Uji Viabilitas Isolat Bakteri... 3
HASIL Peremajaan Isolat Bakteri ……… 3
Uji Antagonisme Bakteri terhadap Bakteri Xoo... 3
Uji Viabilitas Isolat Bakteri... 4
PEMBAHASAN ... 4
SIMPULAN ... 5
DAFTAR PUSTAKA ... 6
DAFTAR GAMBAR
Halaman
1 Bahan pembawa formula……….…..………... 3
2 Hasil uji antagonisme isolat dan konsorsium bakteri terhadap pertumbuhan Xoo setelah inkubasi 24-48 jam ...………. 3
DAFTAR TABEL Halaman 1 Daftar isolat bakteri yang digunakan pada penelitian ini…..………... 2
2 Perlakuan uji antagonis secara in vitro untuk isolat dan konsorsium bakteri biokontrol...………. 2
3 Isolat konsorsium bakteri dan bahan pembawa …..…….………... 3
4 Aktivitas penghambatan isolat dan konsorsium bakteri terhadap pertumbuhan bakteri secara in vitro... 4
5 Viabilitas isolat bakteri bulan ke-0………... 4
6 Viabilitas isolat bakteri pada formulasi bulan ke-1... 4
DAFTAR LAMPIRAN Halaman 1 Ciri-ciri bakteri uji yang digunakan dalam penelitian………... 8
2 Komposisi media pertumbuhan bakteri... 9
3 Hasil uji antagonisme formula bakteri terhadap Xoo... 10
PENDAHULUAN Latar Belakang
Penyakit hawar daun bakteri (HBD) merupakan salah satu penyakit padi terbesar di berbagai ekosistem padi di negara-negara penghasil padi, termasuk Indonesia. Penyakit yang disebabkan oleh bakteri Xanthomonas oryzae pv. oryzae (Xoo) ini merupakan penyakit yang paling merugikan karena dapat mengurangi hasil panen dengan tingkat yang bervariasi (Niňo-Liu 2006). Penurunan produksi yang diakibatkan oleh penyakit ini bisa mencapai 50% (Vikal et al. 2007). Penyakit ini mempunyai beberapa ras dari jenis bakteri dan masing-masing mempunyai perbedaan kemampuan untuk menginfeksi tanaman padi (Sudarmo & Subiyakto 1991). Pada tahun 2006, seluas 519.200 ha sawah diserang organisme penganggu tanaman, dan penyakit HDB menyerang 74.243 hektar pertanaman padi dan merupakan serangan terluas yang disebabkan oleh penyakit (Deptan 2007).
Penyakit HDB dapat menginfeksi tanaman padi pada semua fase tanaman dari mulai persemaian sampai menjelang panen. Namun yang paling umum ialah terjadi pada saat tanaman mulai mencapai anakan maksimum sampai fase berbunga. Bakteri Xoo menginfeksi tanaman padi pada bagian daun melalui luka daun atau lubang alami berupa stomata dan merusak klorofil daun. Hal tersebut menyebabkan menurunnya kemampuan untuk melakukan fotosintesis dan pertumbuhan tanaman terhambat. Sedangkan infeksi yang terjadi pada fase berbunga, proses pengisian gabah menjadi tidak sempurna menyebabkan gabah tidak terisi penuh atau bahkan hampa.
Pengendalian penyakit HDB dengan varietas tahan sangat efektif dan mudah diterapkan. Namun teknologi ini terhambat oleh pembentukan berbagai patotipe (galur) patogen Xoo baru yang lebih virulen menyebabkan ketahanan varietas tidak bertahan lama. Selain itu, pengendalian menggunakan pestisida pun marak dilakukan, namun akibat efek samping yang ditimbulkan dari residu yang ditinggalkan dapat bersifat racun dan karsinogenik. Oleh karena itu pengembangan agens biokontrol (agens hayati) sebagai komponen pengendalian penyakit HDB secara terpadu yang ramah lingkungan tetap dikembangkan dan diharapkan menjadi alternatif pengendalian yang penting dalam era pertanian yang berkelanjutan. Keuntungan biokontrol antara
lain: lebih aman, tidak terakumulasi dalam rantai makanan, adanya proses reproduksi sehingga dapat mengurangi pemakaian yang berulang-ulang dan dapat digunakan secara bersama-sama dengan pengendalian yang telah ada (Suwanto 1994).
Sejumlah bakteri telah dilaporkan efektif sebagai agens hayati pengendali hama dan penyakit tanaman di antaranya ialah dari genus-genus Bacillus, Bdellovibrio, Dactylella, Gliocladium, Penicillium, Pseudomonas, dan Trichoderma (Fravel 1988). Zuraidah (2012) melaporkan bahwa bakteri P. aeruginosa dan B. cereus memiliki potensi yang baik dalam menghambat pertumbuhan bakteri patogen tanaman padi Xoo. Bacillus spp. dapat digunakan sebagai agen hayati pengendali penyakit tanaman yang aman dan lebih efektif daripada penggunaan bahan kimia (Kim et al. 2009). Bacillus merupakan bakteri Gram positif penghasil endospora sehingga tahan pada kondisi kering dan panas. Bacillus cocok untuk aplikasi di lapangan sebagai pengendali hayati tanaman (Mubarik et al. 2010). Pseudomonas dan Serratia termasuk bakteri Gram negatif yang dapat tumbuh pada kondisi nutrisi sederhana dan mudah berkolonisasi di rhizosfer (Pseudomonas) dan filosfer (Serratia) tanaman padi. Bahan pembawa formulasi yang banyak digunakan dalam pengendali hayati antara lain bentuk padat (granul), tepung, dan suspensi (Ardakani et al. 2009; Riana 2011; Syachroni 2011).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui keefektifan formula konsorsium bakteri secara in vitro sebagai pengendali penyakit hawar daun bakteri.
BAHAN DAN METODE Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari 2012 sampai Juli 2012 di Laboratorium Konservasi Mikrob Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetika Pertanian (BB Biogen), Bogor.
Bahan
Bakteri yang digunakan dalam penelitian ini antara lain ialah: Pseudomonas aeruginosa C32b, Serratia marcescens E31, Bacillus firmus E65, dan isolat patogen Xoo koleksi Laboratorium Konservasi Mikrobiologi Balai Besar Penelitian dan Pengembangan
2
Bioteknologi dan Sumber Daya Genetik Pertanian Bogor (Lampiran 1). Selain itu juga terdapat isolat bakteri Bacillus cereus II.14 koleksi IPBCC, Departemen Biologi, FMIPA-IPB, Bogor (Tabel 1).
Tabel 1 Daftar isolat bakteri yang digunakan pada penelitian ini
Kode isolat
Spesies bakteri
Asal isolat Tahun koleksi C32b Pseudomonas aeruginosa Lumpur, Sidoarjo, Jawa Timur 2007 E31 Seratia marcescens Padi, Sukabumi, Jawa Barat 2004 E65 Bacillus firmus Padi, Sukabumi, Jawa Barat 2004 II.14 Bacillus cereus Cabai, Bogor, Jawa Barat 2007
Peremajaan Isolat Bakteri
Semua isolat bakteri diperbanyak dengan memindahkan kultur pada medium nutrient agar (NA) dan diinkubasi pada suhu ruang selama 24-48 jam. Isolat tersebut diremajakan dan diperiksa kemurniannya dengan menggunakan metode kuadran. Biakan yang telah murni ditumbuhkan pada media agar-agar miring dan disimpan dalam lemari pendingin pada suhu -200C. Seluruh biakan bakteri yang telah diinkubasi selama 24 jam pada media agar-agar miring NA dilakukan pengenceran serial menggunakan garam fisologis 0,85% dan dihitung jumlahnya.
Peremajaan Isolat Bakteri Patogen
Xanthomonas oryzae pv oryzae
Bakteri Xoo ditumbuhkan pada medium Wakimoto Agar (WA) (Lampiran 3) dan diinkubasi pada suhu ruang selama 24-48 jam. Peremajaan dilakukan pada media WA dilakukan setiap satu bulan sekali.
Uji Antagonisme Bakteri terhadap Bakteri Xoo
Uji antagonisme secara in vitro dilakukan dengan. Sebanyak 800µL (107cfu/ml) kultur cair bakteri patogen diinokulasi ke dalam 80 ml WA semipadat lalu dituang pada permukaan cawan WA padat masing-masing sebanyak 10 ml. Setelah permukaan media memadat, potongan kertas saring Whatman No.2 (diameter 0,7 cm) yang telah direndam dalam larutan yang mengandung bakteri yang
berumur 24 jam dikeringanginkan, kemudian diletakkan di tengah cawan petri yang berisi biakan bakteri Xoo. Biakan diinkubasi selama 24-48 jam kemudian diamati zona hambat di sekeliling cakram. Perlakuan kontrol terdiri atas, kontrol negatif menggunakan akuades dan kontrol positif menggunakan pembanding kimia (streptomisin sulfat). Konsorsium isolat yang digunakan untuk diseleksi yaitu: B. firmus E65 + P. aeruginosa C32b, B. cereus II.14 + B. firmus E65 + P. aeruginosa C32b, B. cereus II.14 + P. aeruginosa C32b + S. marcescens E31, dan B. cereus II.14 + B. firmus E65 + P. aeruginosa C32b + S. marcescens E31 (Tabel 2). Setiap perlakuan dilakukan tiga ulangan. Isolat yang dapat menghambat pertumbuhan Xoo ditunjukkan dengan luasnya zona bening di sekitar koloni yang kemudian dihitung indeks penghambatannya. Indeks Penghambatan (IP) dihitung dengan menggunaan persamaan sebagai berikut (Findy 2009):
IP (%) = Φ zona bening – Φ koloni x 100% Φ koloni
Keterangan : Φ = Diameter (cm)
Tabel 2 Perlakuan uji antagonis secara in vitro untuk isolat dan konsorsium bakteri biokontrol
Pelakuan Isolat
A1 Bacillus cereus II.14 A2 Bacillus firmus E65
A3 Pseudomonas aeruginosa C32b A4 Serratia marcescens E31
A5 B. firmus E65 + P. aeruginosa C32b
A6 B. cereus II.14 + B. firmus E65 + P. aeruginosa C32b
A7 B. cereus II.14 + P. aeruginosa C32b + S. marcescens E31 A8 B. cereus II.14 + B. firmus E65
+ P. aeruginosa C32b + S. marcescens E31
A9 Streptomisin sulfat A10 Akuades
Formulasi Bahan Pembawa Agensia Biokontrol
Bahan pembawa utama yang digunakan yaitu kaolin, bentonit, minyak, dan suspensi yang kemudian dibuat formulasi (Tabel 3). Komposisi dari formula yaitu: (a) formulasi kaolin 300 ml suspensi isolat bakteri, 1 kg
3
kaolin, 10 g CMC, 15 g CaCO3 , (b) formulasi
bentonit: 300 ml suspensi isolat bakteri, 1 kg bentonit, 10 g CMC, 15 g CaCO3 , (c)
formulasi minyak: 300 ml suspensi isolat bakteri, 6 ml minyak sawit, 0,15 ml Triton X-100, dan (d) formulasi suspensi: 300 ml suspensi isolat bakteri dengan jumlah sel 109 cfu/ml.
(a) (b) (c) Gambar 1 Bahan pembawa formula (a) kaolin,
(b) bentonit, dan (c) minyak sawit Proses pencampuran bahan-bahan yang digunakan untuk formulasi kaolin dan bentonit dilakukan dalam wadah kantung plastik, sedangkan minyak dan suspensi dalam labu erlenmeyer (Gambar 1).
Tabel 3 Isolat konsorsium bakteri dan bahan pembawa
Formula Bahan Pembawa A5 Kaolin Bentonit Minyak Suspensi A6 Kaolin Bentonit Minyak Suspensi A8 Kaolin Bentonit Minyak Suspensi
Uji Viabilitas Isolat Bakteri
Uji viabilitas isolat bakteri pada bahan pembawa agensia dengan mengencerkan 1 gram formulasi (kaolin dan bentonit) dengan 9 ml garam fisiologis steril, kemudian dilakukan pengenceran serial. Perhitungan populasi sel dilakukan dengan metode cawan sebar atau total plate count. Uji viabilitas dilakukan pada bulan bulan ke-0 (sebelum formulasi) dan 1 bulan setelah formulasi. Formulasi disimpan pada suhu ruang (± 250C).
HASIL Peremajaan Isolat Bakteri
Isolat bakteri dapat tumbuh dengan baik dan didapat biakan murni yang segar setelah
48 jam pada media NA, sedangkan untuk bakteri Xoo diperlukan waktu 7 hari untuk tumbuh maksimal pada media WA. Koloni tunggal bakteri Xoo berbentuk bulat, berwarna kuning pucat hingga kuning, berlendir, permukaan timbul, dengan tepian rata.
Uji Antagonisme Bakteri terhadap Bakteri Xoo
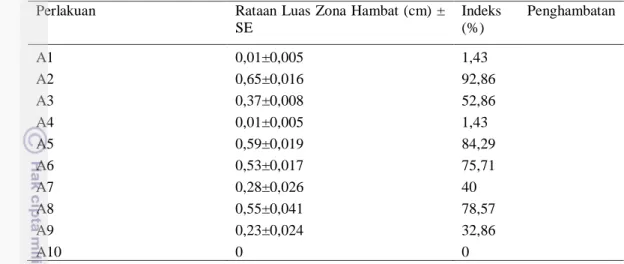
Hasil uji antagonisme menunjukkan adanya aktivitas penghambatan oleh isolat dan konsorsium terhadap bakteri Xoo. Hal ini terlihat dengan terbentuknya zona hambat. Hasil perhitungan luas penghambatan bakteri terhadap Xoo menunjukkan bahwa isolat dan konsorsium A2, A5, A6, dan A8 sebagai isolat terbaik dengan luas daerah penghambatan yang paling besar. Isolat perlakuan A2, A5, A6, dan A8 memiliki persentase penghambatan masing-masing sebesar 92,86%, 84,29%, 75,71%, 78,57% (Tabel 4). Perlakuan A10 (kontrol negatif) merupakan kontrol yang tidak diberikan formulasi menunjukkan tidak ada aktivitas penghambatan terhadap bakteri Xoo (Gambar 2, Lampiran 3). (a) (b) (c) (d) (e)
Gambar 2 Hasil uji antagonisme isolat dan konsorsium bakteri terhadap pertumbuhan Xoo setelah inkubasi 24-48 jam (a) isolat A2, (b) konsorsium A5, (c) konsorsium A6, (d) konsorsium A8, dan (e) kontrol negatif (A10).
4
Tabel 4 Aktivitas penghambatan isolat dan konsorsium bakteri terhadap pertumbuhan bakteri secara in vitro
keterangan: SE = standard error (nilai rataan ± SE, n = 3)
Uji Viabilitas Isolat Bakteri
Pengamatan viabilitas isolat bakteri dilakukan pada saat sebelum pembuatan dan satu bulan setelah formulasi. Formulasi padat dan cair disimpan di suhu ruang. Jumlah isolat bakteri rata-rata sebelum pembuatan formulasi yaitu sebesar 4,0x109 cfu/ml. Isolat bakteri S. marcescens memiliki jumlah terbanyak yaitu 6,0 x 109 cfu/ml (Tabel 5).
Setelah isolat dibuat formulasi jumlah sel bakteri yang terkandung menjadi 2,28x108 cfu/ml pada konsorsium A5, 1,39x108 cfu/ml pada konsorsium A6, dan 7,75x109 cfu/ml pada konsorsium A8. Jumlah sel terbanyak ditemukan pada formula konsorsium A8 dengan bahan pembawa bentonit yaitu 9,8 x 109 cfu/ml. Sedangkan jumlah sel paling sedikit ditemukan pada formula konsorsium A5 dengan bahan pembawa suspensi yaitu 1,6 x 108 cfu/ml (Tabel 6).
Berdasarkan jumlah sel yang terkandung maka formula yang efektif dalam penyimpanan dalam jangka waktu satu bulan yaitu penggunaan formula A8 dengan bahan pembawa bentonit.
Tabel 5 Viabilitas isolat bakteri bulan ke-0
Isolat Jumlah sel (cfu/ml)
II.14 2,5 x 109 E65 2,6 x 109 E31 6,0 x 109 C32b 5,1 x 109 Rata-rata 4,0 x 109
Tabel 6 Viabilitas isolat bakteri pada formulasi bulan ke-1
Formula Bahan Pembawa Jumlah sel (cfu/ml) A5 Kaolin 1,28 x 108 Bentonit 2,98 x 108 Minyak 4,57 x 108 Suspensi 2,8 x 107 A6 Kaolin 4,4 x 107 Bentonit 1,6 x 108 Minyak 1,6 x 108 Suspensi 1,9 x 108 A8 Kaolin 9,4 x 109 Bentonit 9,8 x 109 Minyak 3,2 x 108 Suspensi 8,6 x 109 PEMBAHASAN
Bakteri penyebab HDB termasuk bakteri aerobik Gram negatif, berbentuk batang tunggal dan jarang berpasangan, bergerak dengan flagel (Ou 1985), serta koloninya berwarna kuning (Abadi 2003). Koloni dengan warna kuning ini dijumpai pada hasil pengamatan peremajaan bakteri Xoo pada media WA. Suhu optimum untuk pertumbuhan Xanthomonas antara 25-300C dan suhu minimum berkisar antara 5-100C. Suhu yang cocok untuk pertumbuhan awal ialah 200C pada suspensi yang agak encer. Derajat keasaman (pH) untuk menumbuhkan bakteri ini berkisar antara 6,2-6,4 atau yang Perlakuan Rataan Luas Zona Hambat (cm) ±
SE Indeks Penghambatan (%) A1 0,01±0,005 1,43 A2 0,65±0,016 92,86 A3 0,37±0,008 52,86 A4 0,01±0,005 1,43 A5 0,59±0,019 84,29 A6 0,53±0,017 75,71 A7 0,28±0,026 40 A8 0,55±0,041 78,57 A9 0,23±0,024 32,86 A10 0 0
5
berbeda tergantung strain bakteri dan medium yang dipakai (Ou 1985).
Perlakuan bakteri tunggal dan konsorsium pada penelitian ini menunjukkan variasi aktivitas pada keduanya. Campuran dari dua bakteri B. firmus dan P. aeruginosa lebih efektif menekan pertumbuhan Xoo dibandingkan dengan pencampuran dengan campuran menggunakan B. cereus dan S. marcescens.
Formulasi suspensi hanya berisi media nutrient broth (NB) dan isolat bakteri. Pembuatan formulasi dengan menggunakan bahan pembawa bentonit dan minyak menggunakan penambahan Carboxymethyl cellulose (CMC) yang berfungsi sebagai zat aditif agar formulasi dapat menempel pada permukaan organ tumbuhan serta penambahan CaCO3 sebagai sumber nutrisi kalsium untuk
pertumbuhan bakteri dan menetralkan pH pada media bahan pembawa (Ardakani et al. 2010).
Uji antagonisme dilakukan untuk menyeleksi isolat dan konsorsium yang memiliki aktivitas penghambatan terhadap pertumbuhan Xoo. Hasil pengujian in vitro menunjukkan penghambatan pertumbuhan Xoo terbesar oleh isolat A2 dan konsorsium A5, A6, dan A8 dibandingkan dengan yang lainnya. Perlakuan A2 yang hanya mengandung Bacillus firmus (E65) merupakan isolat endofit (Zuraidah 2012) yang dalam penelitian ini digunakan sebagai pembanding untuk perlakuan konsorsium. Zona hambat terbentuk disebabkan oleh zat antimikrob yang dihasilkan bakteri. Pembentukan senyawa antimikrob disebabkan berkurangnya nutrisi yang dibutuhkan untuk pertumbuhan sel (Zou et al. 2006). Pada pengujian in vitro isolat A1 dan A4 menghasilkan zona hambat terkecil, hal ini diduga bahwa antimikrob kedua isolat ini kurang efektif dalam menghambat pertumbuhan Xoo. Sedangkan zona hambat terbesar dihasilkan oleh konsorsium A5, A6, dan A8. Hasil uji ini dapat dijadikan acuan untuk menjadikan ketiga konsorsium tersebut sebagai agen pengendali hayati penyakit HDB yang akan dikembangkan dalam bentuk formulasi kaolin, bentonit, minyak dan suspensi.
Mekanisme kerja dari agen pengendali hayati pada umumnya digolongkan sebagai aktivitas kompetisi zat makanan, parasitisme, dan antibiosis (Fravel 1988; Weller 1988). Kemampuan agens hayati mengendalikan patogen berhubungan dengan kemampuan bakteri dalam memproduksi siderofor, HCN,
senyawa antibiotik, dan enzim yang menginduksi ketahanan sistemik pada tanaman (Siddiqui 2005; van Loon 2007). Berdasarkan hal tersebut, dalam penelitian ini mekanisme penghambatan isolat bakteri terhadap Xoo diduga akibat aktivitas senyawa antibiotik yang dihasilkan bakteri. Bacillus memproduksi berbagai macam antibiotik untuk bakteri dan cendawan (He et al. 1994). Menurut Arwiyanto et al. (2007) biakan P. aeruginosa mampu memproduksi endotoksin dan produk ekstraseluler yang mendukung invasi lokal dan penyebaran mikroorganisme.
Aktivitas yang terjadi pada formulasi konsorsium bakteri diduga merupakan proses quorum sensing (QS). QS menghasilkan dan melepaskan senyawa kimia sebagai bentuk komunikasi mereka yang disebut dengan autoinduser (AI). AI yang digunakan oleh Gram negatif yaitu Acylade homoserin lactones dan Gram positif menggunakan proses oligopeptida (Bassler & Miller 2001). Gram positif dan Gram negatif suatu bakteri menggunakan QS pada berbagai sifat regulasi. Aktivitas ini diduga terjadi dalam konsorsium A8 yang terdiri atas bakteri Gram positif dan Gram negatif.
Hasil uji viabilitas menunjukkan bahwa formulasi A8 dengan bahan pembawa bentonit memiliki jumlah sel yang lebih tinggi dibandingkan dengan suspensi, hal ini diduga karena adanya kandungan zat yang tidak dimiliki dalam suspensi. Formulasi suspensi merupakan formula yang hanya berisi media nutrient broth (NB) dan konsorsium bakteri. Pemberian bubur Bordeaux (campuran CaCO3
dan CuSO4), beberapa jenis antibiotik
streptomisin, kandungan Cu dan Hg terbukti efektif mencegah bakteri hawar daun, tetapi mengakibatkan kerusakan pada gabah ketika disemprotan pada fase pembungaan di lapang (Liu et al. 2006).
SIMPULAN
Konsorsium bakteri A5 (B. firmus E65 + P. aeruginosa C32b), A6 (B. cereus II.14 + B. firmus E65 + P. aeruginosa C32b) dan A8 (B. cereus II.14 + B. firmus E65 + P. aeruginosa C32b + S. marcescens E31) memiliki kemampuan untuk menghambat X. oryzae pv. oryzae secara in vitro. Konsorsium A8 kecenderungan memiliki viabilitas sel lebih tinggi dibandingkan konsorsium A5 dan A6 setelah satu bulan penyimpanan.
6
DAFTAR PUSTAKA
Abadi LA. 2003. Pertahanan Tumbuhan dalam Ilmu Penyakit Tumbuhan. Malang: Bayumedia Publishing dan Fakultas Pertanian Univesitas Brawijaya.
Ardakani SS, Heydari A, Khorasani N, Arjmandi R. 2010. Development of new bioformulation of Pseudomonas fluorescens and evaluation of these products againts damping-off of cotton seedlings. J Plant Pathol 92: 83-88. Arwiyanto T, Maryudani YMS, Azizah NN.
2007. Sifat-sifat fenotik Pseudomonas fluorescens, agensia pengendali hayati penyakit lincat pada Tembakau Temanggung. J Biodiversitas 8:147-151. Bassler BL, Miller MB. 2001 Quorum sensing
in bacteria. Ann Rev Microbiol 55:165-199.
[Deptan] Departemen Pertanian, Direktorat Perlindungan Tanaman Pangan. 2007. OPT Padi di Indonesia. Jakarta: Departemen Pertanian RI.
Findy K. 2009. Aktivitas penghambatan Bacillus sp. terhadap Xanthomonas oryzae pv. oryzae, Pseudomonas syringae pv. glycines, dan Pseudomonas fluorescens [skripsi]. Bogor: FMIPA, IPB Fravel DR. 1988. Role of antibiosis in the biocontrol of plant disease. Ann Rev Phytopathol 26:75-91.
He HLA, Laura ASS, Handelsman J, Clardy J. 1994. Zwittermicin A: and antifungal and plat protection agent from Bacillus cereus. Tetrahedon Lett 35:2499.
Kim GH, Lim MT, Hur JS, Yum KJ, Koh YJ. 2009. Biological control of tea anthracnose using an antagonistic bacterium of Bacillus subtilis isolated from tea leaves. J Plant Pathol 25:99-102.
Liu DO, Ronald PC, and Bogdanovie AJ. 2006. Xanthomonas oryzae pathovars: model patogen of a model crop. Mol Plant Pathol 7 : 303-324.
Mubarik NR, Mahagiani I, Putri AA, Santoso S, Rusmana I. 2010. Chitinolytic bacteria isolated from chili rhizosphere: chitinase characterization and application as biocontrol for whitefly (Bemisia tabaci Genn.). Am J Agric Biol Sci 5:430-535.
Niňo-Liu DO, Ronald PC, Bogdanove AJ. 2006. Xanthomonas oryzae pathovars: model pathogens of model crop. Mol Plant Pathol 7:303-324.
Ou SH. 1985. Rice Disease. Ed. Ke-2. Kew Surrey: Commonwealth Mycological Institute.
Riana E. 2011. Seleksi dan Formulasi Konsorsium Bakteri untuk Mengendalikan Penyakit Blas (Pyricularia oryzae) pada Tanaman Padi [skripsi]. Bogor: FMIPA, IPB.
Siddiqui ZA. 2005. PGPR: Prospective Biocontrol Agents of Plant Pathogens. Amsterdam: Springer.
Sudarmo, Subiyakto. 1991. Pengendalian Serangan Hama Penyakit dan Gulma Padi. Yogyakarta: Kanisius.
Suwanto A. 1994. Mikroorganisme untuk biokontrol, strategi penelitian & penerapannya dalam bioteknologi pertanian. Agrotek 2:4.
Syachroni FA. 2011. Efektivitas formulasi konsorsium bakteri sebagai pengendali penyakit hawar pelepah daun tanaman padi [skripsi]. Bogor: FMIPA, IPB. Tay L, Goh KT, Tan SE. 2008. An outbreak
of Bacillus cereus food pisoning. Singapore J Medic 23:214-217.
van Loon LC. 2007. Plant response to plant growth-promoting rhizobacteria. Eur J Plant Pathol 119:243-254.
Vikal Y, Das A, Patra B, Goel LK, Sindhu JS, Singh K. 2007. Identifiction of news sources of bacterial blight (Xanthomonas oryzae pv. oryzae) resitence in wild oryza species and O. glaberrima. Plant Genet Res 5: 108-112.
Weller DM. 1988. Biological control of soilborne pathogens in rhizosphere with bacteria. Ann Rev Phytopathol 26:379-407.
Zou LF, Wang XP, Xiang Y, Zhang B, Chen OY. 2006. Elucidation of the hrp gene clusters of Xanthomonas oryzae pv. oryzicola that control the hypersensitive response in a nonhost tobacco and pathogenicity in susceptible host rice. Appl Environ Microbiol 72: 6212-6224. Zuraidah. 2012. Potensi beberapa bakteri
penghambat pertumbuhan Xanthomonas oryzae pv. oryzae penyebab penyakit hawar daun bakteri pada tanaman padi [tesis]. Bogor: Sekolah Pascasarjana IPB.
8
Lampiran 1 Ciri-ciri bakteri uji yang digunakan dalam penelitian ini
Bakteri Ciri-ciri
Bacillus cereus (Tay et al. 2008)
- Bakteri Gram positif yang berbentuk batang besar - Sering bersusun sepasang atau rantai dan melingkar - Ukuran 0,5-2,5 x 1,2-10 μm
- Membentuk endospora - Beberapa motil
- Bersifat fakultatif aerobic
Bacillus firmus - Bakteri Gram positif yang berbentuk batang panjang - Ukuran 0,6-1,0 x 1,2-3,8 μm
- Membentuk endospora dengan diameter <0,9 μm - Bersifat aerobik
Pseudomonas aeruginosa - Bakteri Gram negatif yang berbentuk batang
- Bersusun tunggal, berpasangan, dan terkadang membentuk rantai pendek
- Ukuran panjang sekitar 0,6 x 2 μm - Tidak membentuk spora
- Tumbuh pada suhu optimum 420C - Bersifat aerobik
Serratia marcescens - Bakteri Gram negatif yang berbentuk batang - Beberapa galur membentuk kapsul
- Berdiameter 0,5-0,8 μm dan panjang 0,9-2 μm - Bersifat fakultatif anaerobik
9
Lampiran 2 Komposisi media pertumbuhan bakteri Media nutrient agar (NA)
Komposisi Jumlah
Nutrient broth 8 g
Agar-agar 20 g
Akuades 1000 ml
Media nutrient broth (NB)
Komposisi Jumlah
Nutrient broth 8 g
Akuades 1000 ml
Media wakimoto agar (WA)
Komposisi Jumlah Ca(NO3)2 . 4H2O 0,5 g Na2HPO4 . 12H2O 2 g Pepton 5 g Sukrosa 15 g FeSO4 . 7H2O 0,5 g Agar-agar 15 g Akuades 1000 ml
10
Lampiran 3 Hasil uji antagonisme formula bakteri terhadap Xoo
(a)
(b)
(c)
(d)
(e)
(f)
(g)
(h)
(i)
(j)
Keterangan:
a A1 Bacillus cereus II.14 b A2 Bacillus firmus E65
c A3 Pseudomonas aeruginosa C32b d A4 Serratia marcescens E31
e A5 B. firmus E65 + P. aeruginosa C32b
f A6 B. cereus II.14 + B. firmus E65 + P. aeruginosa C32b g A7 B. cereus II.14 + P. aeruginosa C32b + S. marcescens E31
h A8 B. cereus II.14 + B. firmus E65 + P. aeruginosa C32b + S. marcescens E31 i A9 Streptomisin sulfat
j A10 Akuades
Lampiran 4 Data hasil uji antagonisme formula bakteri terhadap Xoo secara in vitro
Formula Isolat ulangan Rataan±standar 1 2 3 deviasi A1 II.14 0,01 0,02 0,01 0,01±0,005 A2 E65 0,67 0,63 0,65 0,65±0,016 A3 C32b 0,38 0,36 0,37 0,37±0,008 A4 E31 0,01 0 0,01 0,01±0,005 A5 E65 + C32b 0,56 0,60 0,60 0,59±0,019 A6 II.14 + E65 + C32b 0,52 0,51 0,55 0,53±0,017 A7 II.14 + C32b + E31 0,24 0,29 0,30 0,28±0,026 A8 II.14 + E65 + C32b + E31 0,50 0,60 0,55 0,55±0,041 A9 Streptomisin sulfat 0,20 0,23 0,26 0,23±0,024