LAPORAN PRAKTIKUM UOB 1
MODUL 1: BIOREAKTOR KULTUS SEL
Disusun Oleh: KELOMPOK 8 Clarissa (1206238974) Jason G. Jonathan (1206238904) Shella (1206238721) Vifky Leondo (1206238665)
TEKNOLOGI BIOPROSES
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK UNIVERSITAS INDONESIA
DEPOK
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 2
KATA PENGANTAR
Puji syukur kami panjatkan kepada Tuhan Yang Maha Esa atas rahmatNya sehingga kami dapat menyelesaikan makalah dalam mata kuliah Industri Oleokimia. Makalah Industri Oleokimia ini berisikan informasi-informasi yang berkaitan dengan Fatty Alkohol dengan mengupas secara lebih mendalam mengenai turunan dari fatty ioreac, metode yang digunakan untuk menghasilkan fatty ioreac maupun senyawa turunannya, katalis yang biasa digunakan dengan efek penggunaan katalis tersebut, serta mengenai salah satu contoh turunan fatty ioreac seperti surfaktan dan FAME.
Akhir kata, kami ucapkan terima kasih kepada dosen kami, Dr. Dianursanti S.T., M.T. dan Ir. Rita Arbianti M. Si. Yang telah membimbing kami selama pembelajaran dalam mata kuliah Industri Oleokimia dan pembuatan makalah ini, juga kepada pihak-pihak yang telah membantu dalam proses pembuatan makalah ini, serta pihak-pihak yang telah kami jadikan referensi untuk dapat lebih mengembangkan makalah ini. Semoga makalah ini dapat bermanfaat bagi para pembaca, sekian ,dan selamat membaca.
Depok, 8 November 2014
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 3
DAFTAR ISI
KATA PENGANTAR ... 2 DAFTAR ISI ... 3 BAB I: PENDAHULUAN Latar Belakang ... 4 Tujuan Penulisan ... 5BAB II: TINJAUAN PUSTAKA 2.1. E.Coli (Escherichia coli) ... 6
2.2. Medium LB (Luria Bertani) ... 7
2.3. Kurva Pertumbuhan Bakteri Escherichia coli... 8
2.4. Kultur Sel Bakteri ... 9
2.5. Faktor – Faktor yang Mempengaruhi Pertumbuhan Sel Bakteri ... 11
2.6. Mengukur Massa Sel ... 12
BAB III: METODOLOGI PERCOBAAN 3.1. Waktu dan Tempat Percobaan ... 14
3.2. Material Percobaan... 14
3.3. Metodologi Percobaan ... 15
BAB IV: HASIL DAN PEMBAHASAN 4.1. Data Pengamatan ... 17
4.2. Pengolahan Data... 18
4.3. Analisis Percobaan ... 23
4.4. Analisis Hasil ... 28
4.5. Analisis Kesalahan ... 32
4.6. Analisis Alat dan Bahan ... 33
BAB V: PENUTUP 5.1. Kesimpulan ... 39
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 4 BAB 1
PENDAHULUAN
1.1. Latar Belakang
Bakteri sebagai salah satu mikroorganisme memiliki beberapa manfaat penting bagi manusia, diantaranya adalah pada bidang pangan, pengobatan, industry dan lain-lain. Pertumbuhan sel (bakteri) merupakan pertambahan volume dan ukuran sel dan juga sebagai pertambahan jumlah sel. Pertumbuhan bakteri biasanya mengikuti pola pada kurva pertumbuhan sigmoid, dimana terdapat lima fase yang dilalui, yaitu fase lag, fase eksponensial, fase stasioner dan fase kematian. Nutrisi sebagai sumber makanan bakteri juga memiliki kaitan erat pada pertumbuhan bakteri, hal ini dikarenakan, bakteri memiliki kondisi yang spesifik, dimana kebutuhan nutrisinya berbeda-beda.
Kultur sel merupakan suatu teknik yang digunakan untuk mengembang-biakan sel di luar tubuh (in-vitro). Contohnya medium yang dipakai, telah diatur nutrisi apa saja yang akan diberikan untuk mikroorganisme, selain itu apakah proses yang beelangsung aerob ataupun anaerob dan yang lainnya. Kultur sel dilakukan secara aseptik. Kultur sel banyak digunakan untuk berbagai aplikasi, maka dari itu penting untuk diketahui cara – cara mngkultur yang efisien. Kultur sel diterapkan juga untuk mengembangbiakan bakteri, karena pada kultur sel, lingkungan tempat hidupnya dapat dikontrol dan diatur sehingga kondisi fisiologis dari kultur relatif konstan. Untuk mendapatkan kultur yang baik, maka diperlukan beberapa faktor-faktor yang mempengaruhi pertumbuhan.
Kultur sel dapat dilakukan menggunakan bioreaktor. Bioreaktor merupakan sebuah sistem yang dapat menyediakan lingkungan biologis yang menunjang suatu reaksi biokimia. Alat ini digunakan untuk mengolah proses dengan adanya mikroorganisme di dalamnya. Baik untuk mengolah suatu bahan mentah menjadi bahan jadi menggunakan mikroorganisme ataupun untuk mengkultur mikroorganisme itu sendiri.
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 5
Berdasarkan hal diataslah maka praktikan melakukan percobaan bioreaktor.
1.2. Tujuan
Adapun tujuan dilakukannya percobaan Bioreaktor adalah sebagai berikut:
1. Memahami metode yang digunakan untuk mengkultur sel 2. Mengetahui faktor-faktor yang mempengaruhi kultur sel 3. Mengetahui pola pertumbuhan bakteri
4. Menghitung kinetika pertumbuhan dari Escherichia coli pada kondisi aerobik
5. Mengetahui hubungan antara nutrisi dan pertumbuhan Escherichia
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 6 BAB 2
TINJAUAN PUSTAKA
2.1. E.Coli (Escherichia coli)
Escherichia coli biasanya disebut E.coli, adalah bakteri gram
negatif, anaerobik fakultatif dan berbentuk tangkai. Bakteri ini umumnya ditemukan pada organ pencernaan organisme berdarah panas. Kebanyakan jenis E.coli tidak berbahaya tetapi beberapa di antaranya dapat menyebabkan keracunan makanan pada manusia.
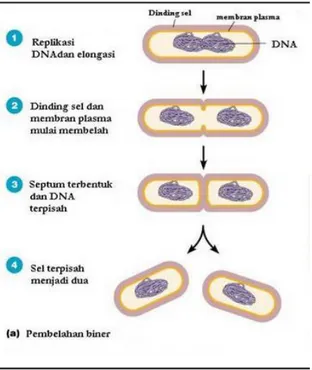
Pertumbuhan dan perkembangbiakan Escherichia coli adalah dengan pembelahan biner, di mana sel akan membelah secara simetris membenuk dua sel anakan, atau secara asimetrik memproduksi endospora tunggal yang dapat bertahan selama berdekade dan dapat tahan pada kondisi lingkungan yang tidak sesuai seperti kondisi terlalu banyak garam, Ph ekstrim, radiasi, dan keberdaan bahan – bahan pelarut.
Gambar 1. Pembelahan Biner
(Sumber: id.slideshare.net)
Beberapa keuntungan dari bakteri E. Coli yaitu menghasilkan kolisin, yang dapat melindungi saluran pencernaan dari bakteri usus yang patogenik, dipakai sebagai indikator untuk menguji adanya pencemaran
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 7
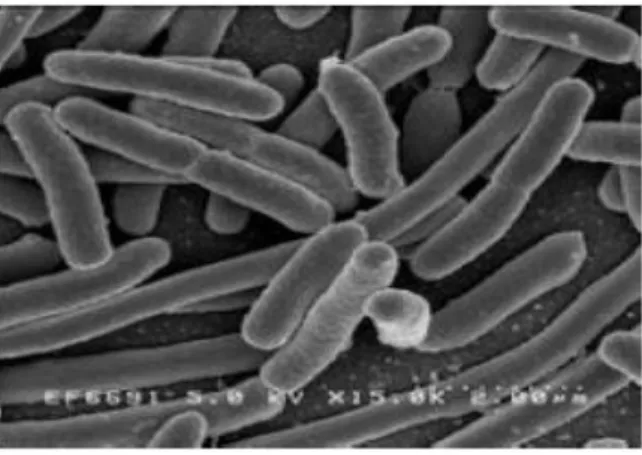
air oleh tinja. Di dalam lingkungan dan kehidupan kita, bakteri E. Coli banyak dimanfaatkan diberbagai bidang, baik pertanian, peternakan, kedokteran maupun dikalangan industri. Dengan berkembangnya ilmu pengetahuan, E. Coli telah banyak diketahui baik sifat morfologi, fisiologi maupun pemetaan DNA nya, sehingga bakteri ini dipakai untuk menyimpan untaian DNA yang dianggap potensial, baik dari tanaman, hewan maupun mikroorganisma dan sekaligus untuk perbanyakannya, sehingga hal ini membuka kesempatan untuk mempelajari sifat dan karakter dari mikroba lain yang tentunya memberikan dampak yang positif untuk kemajuan di bidang kedokteran, pertanian maupun industri. Pada bidang bioteknologi, E.Coli juga dapat digunakan sebagai host untuk rekayasa genetika.
Gambar 2. Morfologi Escherichia coli
(Sumber: www.biotek.lipi.go.id)
2.2. Medium LB (Luria Bertani)
Medium LB (Luria Bertani) adalah media terdehidrasi yang digunakan untuk memelihara dan menumbuhkan strain rekombinan
Escherichia coli dalam prosedur biologi molekuler. Medium LB (Luria
Bertani) menyediakan semua kebutuhan nutrisi dari strain rekombinan Escherichia coli. Pepton menyediakan nitrogen dan karbon. Vitamin (termasuk vitamin B) dan elemen tertentu diberikan oleh ekstrak ragi. Sodium ion untuk transportasi dan keseimbangan osmotik disediakan oleh natrium klorida. Ph pada medium adalah sekitar 7.0 ± 0.2. Komposisi dari LB adalah Tryptone 10.0 g/L, Sodium Klorida 5.0 g/L, dan Yeast extract 5.0 g/L
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 8 2.3. Kurva Pertumbuhan Bakteri Escherichia coli
Sama seperti bakteri umumnya, Escherichia coli berkembang dengan pembelahan biner. Sehingga kehidupannya bisa diamati dan digambarkan di dalam kurva pertumbuhan bakteri. Berikut ini adalah kurva pertumbuhan bakteri Escherichia coli.
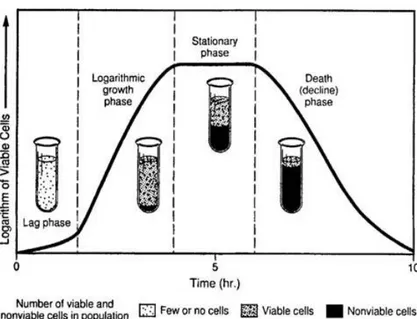
Pertumbuhan dapat didefinisikan sebagai pertambahan jumlah atau volume serta ukuran sel. Pada organisme prokariot seperti bakteri, pertumbuhan merupakan pertambahan volume dan ukuran sel dan juga sebagai pertambahan jumlah sel. Pertumbuhan sel bakteri biasanya mengikuti suatu pola pertumbuhan tertentu berupa kurva pertumbuhan sigmoid. Perubahan kemiringan pada kurva tersebut menunjukkan transisi dari satu fase perkembangan ke fase lainnya. Seperti yang ditunjukkan pada gambar kurva, terdapat empat fase pertumbuhan yaitu fase lag, fase log (eksponensial), fase stasioner, dan fase kematian (death phase).
Gambar 3. Kurva Pertumbuhan Bakteri.
(Sumber: id.slideshare.net)
Pertumbuhan dapat didefinisikan sebagai pertambahan jumlah atau volume serta ukuran sel. Pada organisme prokariot seperti bakteri, pertumbuhan merupakan pertambahan volume dan ukuran sel dan juga sebagai pertambahan jumlah sel. Pertumbuhan sel bakteri biasanya mengikuti suatu pola pertumbuhan tertentu berupa kurva pertumbuhan
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 9
sigmoid. Perubahan kemiringan pada kurva tersebut menunjukkan transisi dari satu fase perkembangan ke fase lainnya. Seperti yang ditunjukkan pada gambar kurva, terdapat empat fase pertumbuhan yaitu fase lag, fase log (eksponensial), fase stasioner, dan fase kematian (death phase).
Fase lag merupakan fase dimana pertumbuhan bakteri masih lambat karena bakteri masih menyesuaikan diri atau adaptasi dengan lingkungan medianya. Fase ini, ditandai dengan peningkatan komponen makromolekul, aktivitas metabolik, dan kerentanan terhadap zat kimia dan faktor fisik. Fase lag merupakan fase yang penting karena pada fase ini bakteri akan menyesuaikan diri dan mulai bertumbuh ke fase selanjutnya.
Fase log (eksponensial) merupakan fase dimana pertumbuhan bakteri berkembang dengan cepat mengikuti kurva logaritmik. Pada fase ini pertumbuhan bakteri sangat dipengaruhi oleh sifat intrinsik dan kondisi lingkungan dari media. Kondisi lingkungan yang paling mempengaruhi pertumbuhan bakteri adalah jumlah nutrisi pada media yang digunakan untuk menumbuhkan bakteri. Setelah melewati fase ini, pertumbuhan bakteri akan mulai menurun.
Fase stasioner merupakan fase dimana bakteri mulai kekurangan nutrisi karena pada fase ini jumlah bakeri yang hidup sama dengan jumlah bakteri yang mati karena nutrisi pada media telah dikonsumsi semua. Fase ini ditandai dengan garis lurus pada kurva pertumbuhan bakteri. Hal ini disebabkan karena bakteri masih tetap membelah walaupun jumlah nutrisi telah habis.
Fase kematian (Death phase) merupakan fase dimana bakteri sudah kekurangan nutrisi dan kematian semakin besar karena nutrisi da energi cadangan pada bakteri sudah benar-benar habis.
2.4. Kultur Sel Bakteri
Kultur sel bakteri adalah suatu proses penumbuhan bakteri pada media secara in vitro untuk digunakan lebih lanjut. Media yang digunakan pada umumnya berisi nutrisi (makanan) untuk pertumbuhan sel. Nutrisi
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 10
dapat berupa unsur hara, mineral, vitamin, dan hormon. Jumlah nutrisi yang diberikan akan disesuaikan dengan jenis kultur sel yang dilakukan. Pada percobaan ini praktikan menggunakan media Luria Bertani. Pada kultur sel ada beberapa tahapan yaitu:
1. Tahapan Inisiasi Sel
Tahap ini merupakan tahapan awal untuk menginduksi sel-sel meristematis dari eksplan yang akan dijadikan bahan dalam kultur sel. Pada tahap ini, bakteri yang akan dikultur disiapkan dari sumbernya. 2. Tahapan Kultur Sel Primer
Sel-sel bakteri dari hasil tahapan inisiasi sel akan ditumbuhkan pada media kultur sel. Tahapan ini bertujuan untuk mendapatkan kondisi pertumbuhan sel yang optimal dan sesuai. Pada tahap ini pertumbuhan sangat dipengaruhi oleh jenis dan komposisi dari medium yang digunakan serta kondisi lingkungan dari media kultur sel.
3. Tahap Sub Kultur Sel
Tahapan sub kultur sel bertujuan untuk meremajakan dan memperbanyak sel – sel dalam kultur. Tahapan ini dilakukan pada saat sel-sel sudah pada fase stasioner (pertumbuhan tetap) dan dilakukan dengan cara mengambil sebagian sel kultur, lalu dipindahkan ke dalam medium baru dengan komposisi yang sama. Proses sub kultur dapat dilakukan beberapa kali sesuai dengan jumlah sel yang diinginkan.
4. Tahap Kultur Lini Sel (Cell Lines)
Tahapan ini merupakan tahapan untuk menumbuhkan lini (galur) sel secara mandiri (independent). Lini sel dapat disimpan dalam waktu lama (tahunan) dengan teknik kriopreservasi (beku dingin) dan dapat ditumbuhkan atau diaktifkan lagi sesuai dengan kebutuhan.
5. Kultur Sel Strain (Strain Cell)
Sel strain dapat berupa sel hasil seleksi in vitro mutasi gen ataupun rekayasa genetk. Sel strain ini akan menjadi materi atau
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 11
bahan untuk proses scale up untuk produksi tertentu. Untuk proses ini dapat digunakan alat bioreactor.
6. Tahap Pemanenan Sel
Pemanenan sel dilakukan saat fase pertumbuhan optimal (eksponensial)
2.5. Faktor – Faktor yang Mempengaruhi Pertumbuhan Sel Bakteri 1. Suhu
Pertumbuhan mikroba memerlukan kisaran suhu tertentu. Kisaran suhu pertumbuhan dibagi menjadi suhu minimum, suhu optimum, dan suhu maksimum. Suhu minimum adalah suhu terendah tetapi mikroba masih dapat hidup. Suhu optimum adalah suhu paling baik untuk pertumbuhan mikroba. Suhu maksimum adalah suhu tertinggi untuk kehidupan mikroba. Pada E.Coli, suhu optimumnya adalah 370C, suhu minimum 70C-80C, dan suhu maksimumnya adalah 460C. Kematian thermal (TDT) pada E.Coli adalah 20-30 menit pada suhu 570C.
2. Ph
Setiap mikroorganisme memiliki karakteristik Ph paling ideal untuk pertumbuhannya. Kebanyakan organisme tumbuh pada Ph sekitar 7 dan sedikit yang dapat tumbuh pada Ph dibawah 4 atau tingkat keasaman yang tinggi. Pada E.Coli, Ph optimum adalah 6-7. 3. Kandungan Air
Setiap mikroba memerlukan kandungan air bebas tertentu untuk hidupnya, biasanya diukur dengan parameter aw (water activity) atau kelembaban relatif. Mikroba umumnya dapat tumbuh pada aw 0,998-0,6. Bakteri umumnya memerlukan aw sebesar 0,90-0,999. 4. Nutrisi
Jika sel kekurangan nutrisi atau substrat yang dibutuhkan untuk pertumbuhannya, maka laju pertumbuhan sel akan terhambat. Beberapa senyawa seperti fenol dan etanol dapat menghambat laju pertumbuhan bakteri. Fenol dan etanol bersifat racun bagi bakteri.
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 12
5. Dissolve Oxygene (DO)
Dissolve oxygene merupakan nilai oksigen terlarut di dalam
medium cair yang dipengaruhi oleh karakteristik dari oksigen itu sendiri. Nilai DO akan menurun seiring dengan naiknya suhu dan banyaknya mineral yang terlarut dalam medium cair.
2.6. Mengukur Massa Sel
Parameter pertumbuhan dapat dihitung dengan mengamati pertumbuhan massa sel. Untuk mengukur massa sel dapat dilakukan 2 macam metode: Metode kering dan metode basah.
2.6.1. Metode basah
Pada metode basah, volume sampel kultur dari fermentor diambil dan disentrifugasi. Setelah disentrifugasi, pellet tersebut ditimbang dan akan di dapatkan berat basah.
2.6.2. Metode Kering
Metode kering adalah metode yang lebih akurat untuk mengukur berat sel karena tidak dipengaruhi oleh berat medium. Metode ini setelah melakukan sentrifugasi pada sampel, supernatan yang terbentuk dipisahkan. Kemudian supernatan dipanaskan dalam oven sehingga seluruh liquid yang terkandung menguap dan tinggal berat kering yang tersisa.
Untuk menghitung berat basah dan berat kering dapat digunakan persamaan:
Berat Basah = Berat microtube dengan massa basah bakteri – Berat
kosong microtube (1)
Berat Kering = Berat microtube dengan massa kering bakteri –
Berat kosong microtube (2)
Perhitungan untuk mendapatkan massa basah bakteri dalam keseluruhan kultur dalam ioreactor:
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 13
Perhitungan untuk mendapatkan massa kering bakteri dalam keseluruhan kultur dalam ioreactor:
(4) Perhitungan yang dapat dilakukan untuk mendapatkan nilai presentase massa kering terhadap massa keseluruhan kultur:
. (5) Nilai OD600 dapat dikonversi menjadi jumlah sel bakteri
Escherichia coli pada sampel. Perhitungan untuk mendapatkan
jumlah sel bakteri dalam sampel dapat memanfaatkan pesamaan garis berikut ini:
Y = 8X x 108 (6)
,dimana Y adalah jumlah sel bakteri dan X adalah nilai OD600 dari sampel yang digunakan. Pada persamaan garis ini, dinyatakan bahwa terdapat 8 x 108 sel/ml, jika nilai OD600 pada spektrofotometer bernilai 1 (Biochrom Ltd,).
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 14 BAB 3
METODOLOGI PERCOBAAN
3.1. Waktu Dan Tempat Percobaan
Praktikum ini dilaksanakan pada hari dan tanggal Jumat, 7 November 2014 pukul 08.00 WIB di Laboratorium Bioproses Departemen Teknik Kimia Universitas Indonesia.
3.2. Material Percobaan
Alat yang digunakan dalam percobaan ini adalah: 1. Bioreaktor
2. Autoklaf
3. Beaker glass 250 ml 4. Static incubator
5. Cawan petri untuk kultur bakteri (plate) 6. Tusuk gigi steril
7. Stirred fermentor 8. Spektrofotometer 9. Kuvet
10. Sentrifuge
11. Tabung sentrifugasi Falcon 12. Pipet mikro
13. Microtube
14. Spektrofotometer
Sedangkan bahan yang digunakan dalam percobaan ini adalah: 1. Escherichia coli
2. Medium LB agar 3. Medium LB cair 4. Aquadest
5. Glukosa
6. Kapsul enzim PGO
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 15 3.3. Metodologi Percobaan
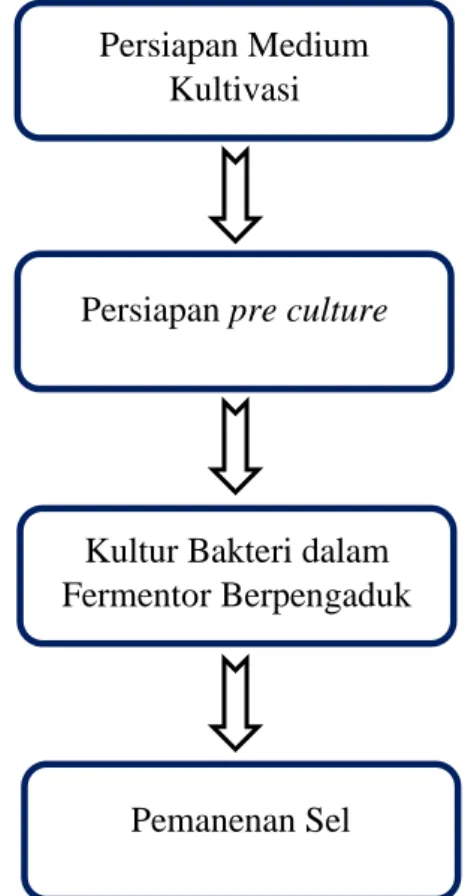
Diagram Alir Percobaan:
Gambar 4. Diagram Alir Percobaan
Prosedur percobaan yang dilakukan adalah sebagai berikut. 1. Persiapan Medium kultivasi
500 mL dan 1.5 mL medium Luria Bertani (LB) cair yang sudah jadi dengan komposisi per liternya adalah 10g pepton. 5g ekstrak yeast dan 5g NaCl. Kemudian mensterilisasi medium tersebut menggunakan autoklaf dengan suhu 1210C dan tekanan 2 atm selama 15 menit.
2. Persiapan pre culture
Melakukan peremajaan bakteri yang telah diinokulasi di medium agar, dengan cara mengambil bakteri dengan tusuk gigi steril dan menyebarkan di medium LB cair 1.5 mL dan menginkubasi pada suhu 370C selama 18 jam. 3. Kultur Bakteri dalam Fermentor Berpengaduk
Menambahkan medium cair dengan tetrasikin sebelum memasukan pre
culture kedalam 250 mL medium cair, sampai konsentrasi tetrasiklin menjadi
5µg/mL. Kultivasi dimulai dengan memasukkan 1.5 mL pre culture ke dalam Persiapan Medium
Kultivasi
Persiapan pre culture
Kultur Bakteri dalam Fermentor Berpengaduk
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 16
medium LB cair yang telah disterilisasi dan mengandung tetrasiklin. Kultur sel dilakukan pada suhu 370C. Laju aerasi divariasikan antara 0.5-2 v/v/m dan kecepatan agitasi 200 rpm sampai nilai OD600 mencapai 0.4 kemudian ditambahkan lagi tetrasiklin sehingga konsentrasi tetrasiklin menjadi 5 µg/mL. Kultur sel dilanjutkan kembali pada suhu 370C dengan kecepatan shaker 200 rpm selama 1.5 jam. Setelah itu kultur sel diberhentikan.
4. Pemanenan sel
Memanen sel dengan melakukan sentrifugasi 5000 x g selama 20 menit. Hasil panen sel disimpan di dalam pendingin -200C. Selanjutnya mentukan berat basah dan berat kering sel yang dihasilkan.
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 17 BAB 4
HASIL DAN PEMBAHASAN
4.1. Data Pengamatan
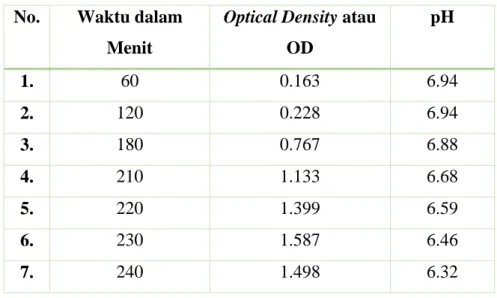
Data pengamatan yang didapatkan pada percobaan modul Bioreaktor ini dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 600 nm. Berikut ini adalah data pengamatan nilai
Optical Density pada panjang gelombang 600 nm atau OD600 terhadap waktu pertumbuhan bakteri Escherichia coli:
Tabel 1. Data Pengamatan Hubungan Waktu dengan OD600 No. Waktu dalam
Menit
Optical Density atau OD pH 1. 60 0.163 6.94 2. 120 0.228 6.94 3. 180 0.767 6.88 4. 210 1.133 6.68 5. 220 1.399 6.59 6. 230 1.587 6.46 7. 240 1.498 6.32
Selanjutnya dilakukan penimbangan massa kosong microtube, massa microtube dengan massa basah bakteri, dan massa microtube dengan massa kering bakteri. Berikut adalah data pengamatan yang didapatkan:
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 18 Tabel 2. Data Pengamatan Berat Kosong Microtube, Berat Microtube dengan
Massa Basah Bakteri dan Berat Microtube dengan Massa Kering Bakteri
Nomor Microtube Berat Kosong Microtube Berat Microtube dengan Massa Basah Berat Microtube dengan Massa Kering 1. 0.9981 1.0117 0.9988 2. 1.0002 1.0174 1.0062 3. 1.0054 1.0364 1.0062 4. 0.9997 1.0253 1.0003 5. 0.997 1.0483 0.9992 6. 0.9984 1.0324 0.9988 7. 1.0121 1.0372 1.0137 8. 0.995 1.0108 0.9957 9. 0.9967 1.0301 0.998 10. 1.002 1.0381 1.0044 11. 1.0176 1.0254 1.0197 12. 1 1.0161 1.0028 4.2. Pengolahan Data
4.2.1. Grafik Pertumbuhan Escherichia coli
Data yang telah didapat pada percobaan yang mengandung hubungan antara waktu dengan besarnya Optical Density pada panjang gelombang 600 nm atau OD600, diplot di dalam suatu grafik yang akan menggambarkan hubungan antara 2 buah variable tersebut. Kurva yang didapat merupakan kurva pertumbuhan bakteri Escherichia coli, dimana sumbu y pada kurva merupakan nilai OD600, sedangkan sumbu x pada kurva merupakan waktu dalam satuan menit. Berikut adalah grafik yang didapat berdasarkan data pengamatan:
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 19 Gambar 5. Kurva Pertumbuhan Escherichia coli
4.2.2. Perhitungan Massa Basah dan Massa Kering dalam Gram
Data pengamatan yang didapatkan praktikan merupakan data berat kosong microtube (dinotasikan dengan A), berat microtube dengan massa basah bakteri (dinotasikan dengan B), dan berat microtube dengan massa kering bakteri (dinotasikan dengan C). Dari ketiga buah variabel data yang didapatkan, praktikan dapat menghitung berat basah dan berat kering bakteri hasil kultur yang dilakukan pada percobaan modul ini dengan menggunakan persamaan berikut:
Berat Basah = B - A (1)
Berat Kering = C - A (2)
, dimana berat basah dan berat kering dalam satuan gram. Berikut ini adalah hasil perhitungan yang menggunakan persamaan 1 dan 2:
Nomor Microtube Berat Kosong Microtube Berat Microtube dengan Massa Basah Berat Microtube dengan Massa Kering Berat atau Massa Basah Bakteri Berat atau Massa Kering Bakteri 1 0.9981 1.0117 0.9988 0.0136 0.0007 2 1.0002 1.0174 1.0062 0.0172 0.006 3 1.0054 1.0364 1.0062 0.031 0.0008 4 0.9997 1.0253 1.0003 0.0256 0.0006 5 0.997 1.0483 0.9992 0.0513 0.0022 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 0 50 100 150 200 250 300 O D 600
Waktu dalam Menit
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 20 6 0.9984 1.0324 0.9988 0.034 0.0004 7 1.0121 1.0372 1.0137 0.0251 0.0016 8 0.995 1.0108 0.9957 0.0158 0.0007 9 0.9967 1.0301 0.998 0.0334 0.0013 10 1.002 1.0381 1.0044 0.0361 0.0024 11 1.0176 1.0254 1.0197 0.0078 0.0021 12 1 1.0161 1.0028 0.0161 0.0028 Rata-Rata 1.00185 0.02558 0.0018
Dari pengolahan data yang dilakukan untuk mendapatkan massa basah dan massa kering bakteri dari 12 microtube yang digunakan, didapatkan bahwa rata-rata massa basah dari bakteri hasil kultur yang dilakukan adalah 0.02558 gram, sedangkan rata-rata massa kering dari bakteri adalah 0,0018 gram.
4.2.3. Perhitungan Massa Basah dan Massa Kering dalam Sampel
Untuk mendapatkan massa basah secara keseluruhan dalam sampel hasil kultur yang dilakukan, dapat ditentukan dengan menggunakan perbandingan massa basah pada microtube dengan massa basah dalam keseluruhan sampel kultur, dimana volume kultur dalam microtube diasumsikan sebesar 1.5 mililiter dan volume kultur keseluruhan dalam bioreaktor adalah sebesar 250 mililiter. Metode perhitungan dengan menggunakan perbandingan ini dapat dilakukan, jika diasumsikan bakteri tersebar secara merata di dalam media cair Luria Bertani. Asumsi ini didukung oleh adanya proses agitasi atau pengadukan, sehingga jumlah massa basah dalam 1.5 mililiter kultur pada microtube dapat mewakili jumlah massa basah dalam 250 mililiter kultur dalam bioreaktor. Berikut adalah perhitungan untuk mendapatkan massa basah bakteri dalam keseluruhan kultur dalam bioreaktor:
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 21
Perhitungan serupa juga dapat dilakukan untuk mendapatkan massa kering bakteri hasil kultur secara keseluruhan dalam 250 mililiter media cair Luria Bertani. Berikut ini adalah perhitungan untuk mendapatkan massa kering bakteri dalam keseluruhan kultur dalam bioreaktor:
4.2.4. Perhitungan Presentase Massa Kering dalam Sampel
Berikut ini adalah perhitungan yang dapat dilakukan untuk mendapatkan nilai presentase massa kering terhadap massa keseluruhan kultur:
.
(3) Pada perhitungan sebelumnya didapatkan bahwa massa basah bakteri dalam keseluruhan kultur adalah 4.263 gram, sedangkan massa kering bakteri adalah sebesar gram, sehingga perhitungan yang dilakukan dengan menggunakan persamaan 3 adalah sebagai berikut ini:
Nilai presentase massa kering bakteri hasil kultur adalah sebesar 7.0373 %.
4.2.5. Perhitungan Jumlah Bakteri berdasarkan Nilai OD600
Nilai OD600 yang didapatkan dengan menggunakan instrumen spektrofotometer dapat dikonversi menjadi jumlah sel bakteri Escherichia
coli dalam sampel. Perhitungan untuk mendapatkan jumlah sel bakteri
dalam sampel dapat memanfaatkan pesamaan garis berikut ini:
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 22
,dimana Y menyatakan jumlah sel bakteri dan X merupakan nilai OD600 sampel yang digunakan. Persamaan garis ini juga menyatakan bahwa terdapat 8 x 108 sel/ml, jika nilai OD600 yang terbaca bernilai 1 (Biochrom Ltd,). Berikut ini adalah data hasil pengolahan dengan menggunakan persamaan 4:
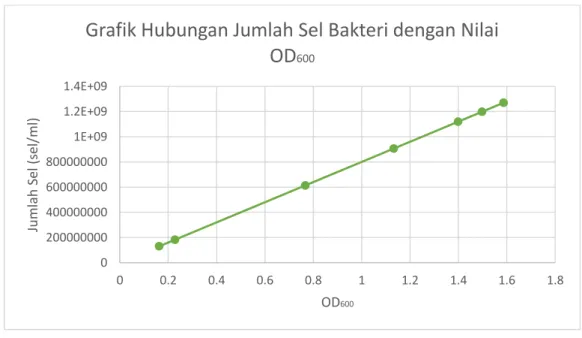
Tabel 3. Penentuan Jumlah Sel Bakteri dengan Menggunakan Nilai OD600
No. Waktu dalam Menit Optical Density atau OD Jumlah Sel 1 60 0.163 1.304 x 108 2 120 0.228 1.824 x 108 3 180 0.767 6.136 x 108 4 210 1.133 9.064 x 108 5 220 1.399 1.119 x 109 6 230 1.587 1.27 x 109 7 240 1.498 1.198 x 109
Berikut ini adalah grafik yang menyatakan hubungan OD600 dengan jumlah sel, dimana sumbu y merupakan jumlah sel dan sumbu x merupakan nilai OD600:
Gambar 6. Grafik Hubungan Jumlah Sel Bakteri Escherichia coli terhadap Nilai OD600 0 200000000 400000000 600000000 800000000 1E+09 1.2E+09 1.4E+09 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 Ju m lah Se l (s el/m l) OD600
Grafik Hubungan Jumlah Sel Bakteri dengan Nilai
OD
600Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 23 4.3. Analisis Percobaan
Percobaan bioreactor kultur sel secara umum bertujuan untuk mengetahui pola pertumbuhan dari bakteri serta memahami faktor-faktor yang mempengaruhi kultur sel. Berdasarkan prosedur yang disediakan pada modul praktikum, langkah pertama yang praktikan lakukan adalah mempersiapkan medium kultivasi, dengan medium kultivasi yang digunakan adalah Luria Bertani (LB). Namun, prosedur pertama ini tidak dilakukan oleh praktikan, tetapi medium telah terlebih dahulu disiapkan oleh asisten laboratorium sebelum praktikum dimulai. Hal ini dilakukan agar bakteri Escherichia coli dapat beradaptasi terlebih dahulu dengan medium bakteri yang digunakan.
Medium LB yang digunakan berada di dalam fasa cair, dimana media kultur dalam fasa cair memberikan beberapa keuntungan dan kelebihan. Keuntungan dari media kultur dalam fasa cair adalah sel/ bakteri yang dikultur akan lebih mudah menyerap nutrisi yang terdapat dalam media dengan nutrisi pada media akan terdistribusi secara merata, serta memiliki aerasi sel yang lebih baik dibandingkan dengan media-media kultur pada fasa lain. Sedangkan kelemahan dari media-media kultur dengan fasa cair adalah memiliki tingkat kontaminasi yang lebih tinggi dibandingkan dengan media kultur pada fasa lain. Oleh karena itu, media kutur LB pada tahap preparasi disterilisasi terlebih dahulu dengan menggunakan autoklaf pada suhu 121oC dan tekanan 2 atm selama 15 menit untuk mensterilisasi media dan menghindari adanya kontaminan pada media yang dapat menggangu laju pertumbuhan bakteri. Medium kultivasi yang telah disiapkan sebelumnya ketika praktikan akan memulai praktikum bewarna kuning keruh, yang mengindikasikan adanya kontaminan pada medium tersebut, walaupun pada kadar yang relatif rendah.
Prosedur berikutnya adalah melakukan kalibrasi alat biofermentor. Kalibrasi yang dilakukan praktikan adalah mengatur beberapa faktor yang dapat mempengaruhi pertumbuhan bakteri Escherichia coli yang diantaranya adalah suhu 37o C, pH 7, laju agitasi 200 rpm, dan kecepatan
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 24
aerasi sebesar 0,5 liter/menit. Pengaturan kalibrasi dilakukan dengan cara menekan tombol-tombol yang sudah tersedia pada biofermentor. Nilai-nilai suhu, pH, laju agitasi, dan laju aerasi di atas merupakan kondisi optimum untuk pertumbuhan bakteri. Penentuan kecepatan aerasi dan laju agitasi yang tepat akan berpengaruh terhadap pertumbuhan optimum dari bakteri. Kecepatan aerasi sendiri memberikan pengaruh nyata terhadap jumlah pertumbuhan bakteri nantinya, tetapi tidak berpengaruh nyata terhadap perubahan nilai pH medium. Hal itu disebabkan karena kecepatan aerasi yang sesuai sangat diperlukan untuk memaksimalkan proses pertumbuhan bakteri, karena konsentrasi oksigen terlarut mempengaruhi pertumbuhan sel mikroba. Jika konsentrasi oksigen terlarut terlalu tinggi atau terlalu rendah, maka akan oksigen yang terlarut akan mungkin dapat meracuni bakteri, sehingga pertumbuhan bakteri menjadi tidak normal (Andry Prasetyo Putro, 2002).
Proses aerasi tidak terlepas dari proses pengadukan (agitasi). Hembusan udara dari suatu kompresor ke dalam suatu larutan medium selain memberikan aerasi juga pengadukan. Pengadukan ini kadang-kadang ditambah dengan pengadukan mekanik untuk meningkatkan kecepatan pemindahan oksigen dari fase gas ke sel bakteri, sehingga diketahui bahwa proses aerasi dan agitasi tersebut selain untuk memenuhi kebutuhan oksigen juga untuk menjaga mikroorganisme tetap tersuspensi dan larutan medium tetap homogen. Tingkat agitasi mempunyai pengaruh yang nyata terhadap efisiensi transfer oksigen di dalam fermentasi dengan pengadukan mekanik. Agitasi sangat membantu proses transfer oksigen di dalam fermentor dengan cara sebagai berikut.
Agitasi menyebabkan ukuran gelembung udara menjadi lebih kecil sehingga luas permukaan untuk terjadinya transfer oksigen menjadi lebih besar.
Agitasi menyebabkan waktu tinggal gelembung udara di medium menjadi lebih lama.
Agitasi mencegah bergabungnya kembali gelembung-gelembung udara yang sudah ada.
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 25
Agitasi memperkecil tebal lapisan film pada permukaan antar fase gas dan cairan karena sifat alir fluida yang menjadi tubulen.
pH dikalibrasi dan ditentukan pada pH 7 dikarenakan bakteri Escherichia
coli dapat tumbuh pada kisaran pH 2,71 hingga pH 8,45, dengan
pertumbuhan maksimum diperoleh pada kisaran pH 6,0 hingga pH 7 (K. A. Presser, 1997).
Setelah biofermentor selesai dikalibrasikan, medium Luria Bertani (LB) kemudian dimasukkan ke dalam bioreaktor berpengaduk (Continuous Strirred Tank Bioreactor), dimana di antara tabung elrenmenyer tempat media Luria Bertani (LB) dan tabung bioreaktor tersebut, terhubung suatu perangkat yang berfungsi untuk mengalirkan media tumbuh ke dalam tabung bioreaktor. Penggunaan CSTBR dalam praktikum kali ini bertujuan untuk mengoptimalkan sistem bioproses yang ada sehingga dapat memaksimalkan pertumbuhan dari bakteri (Gargouri B. et al, 2011). Perangkat penghubung yang ada tersebut telah diatur oleh asisten sehingga waktu yang dibutuhkan untuk memindahkan 250 mL media Luria Bertani (LB) ke dalam tabung bioreaktor adalah 60 menit (1 jam). Praktikan kemudian menyiapkan sepuluh microtube untuk disterilisasi dengan oven dengan suhu 105o C selama 1 jam 30 menit, seiring dengan menunggu pemindahan selesai. Microtube ini nantinya akan digunakan untuk memperoleh berat basah dan berat kering dengan menggunkan metode sentrifugasi pada prosedur terakhir. Oleh karena itu, setelah steriliasi dilakukan, masing-masing microtube diukur massanya dengan menggunakan neraca digital.
Setelah waktu 1 jam terlah berlalu dan media Luria Bertani telah selesai dipindahkan, praktikan kemudian memasukkan kultur bakteri
Escherichia coli ke dalam tabung bioreaktor dalam alat biofermentor.
Kultur bakteri yang dimasukkan adalah medium kultivasi 1,5 mL yang telah disiapkan asisten sehari sebelumnya. Injeksi bakteri Escherichia coli dilakukan dengan menggunakan mikropipet. Setelah dimasukkan, sistem agitasi otomatis biofermentor dinyalakan kembali, dimana hal ini bertujuan agar bakteri dan nutrisi dalam medium dapat tersebar merata.
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 26
Laju agitasi yang digunakan harus diperhatikan serta diatur terlebih dahulu dengan nilai 200 rpm sehingga sel-sel bakteri tidak rusak dan mati. Laju agitasi yang terlalu tinggi dapat menghancurkan sel-sel bakteri. Selama pengadukan ini, perlu diketahui pula bahwa pengaliran udara ke dalam biofermentor juga tetap berjalan. Hal ini dilakukan karena bakteri
Escherichia coli merupakan bakteri anaerob fakultatif, dimana bakteri
anaerob merupakan bakteri yang dapat tumbuh meskipun berada dalam lingkungan tanpa oksigenn, namun akan lebih memilih untuk hidup pada lingkungan yang memiliki oksigen (Yanti Kristy, 2014). Oleh karena itu, bakteri ini membutuhkan oksigen untuk proses respirasi. Oksigen juga dapat digunakan dan dibutuhkan oleh bakteri anaerob untuk pertumbuhan, kelangsungan hidup, dan bereproduksi (Anonim, 2014). Pengadukan atau agitasi kemudian dilakukan selama 1 jam.
Praktikan kemudian mengambil sampel untuk melakukan pengukuran terhadap optical density (OD) setiap selesai pengadukan oleh biofermentor selama 1 jam dengan menggunakan spektrofotometer pada panjang gelombang 600 nm. Spektrofotometer terlebih dahulu dikalibrasi dengan menggunakan larutan media Luria Bertani yang masih murni sebagai larutan awal. Kalibrasi sendiri bertujuan agar alat spektrofotometer dapat digunakan dengan baik (menghasilkan data yang valid) dan awet Pengukuran OD600 akan dilakukan dalam rentang satu jam sekali dengan pengambilan data minimal 6 data selama nilai OD600 yang diperoleh masih lebih kecil dari 0,8. Pengambilan data sebanyak enam kali dimaksudkan agar data yang diambil diperkirakan telah mencapai tahap pertumbuhan bakteri yang stasioner (stationary phase) Apabila nilai OD600 telah mencapai titik 0,8, praktikan akan menambahkan senyawa Xylose sebanyak 5 mL ke dalam tabung bioreaktor besama dengan bakteri
Escherichia coli dan media luria bertani. Penambahan xylose bermaksud
untuk sebagai sumber nutrisi, karena pada saat nilai OD600 0,8 menunjukkan bahwa kuantitas bakteri sudah cukup banyak sehingga membutuhkan nutrisi tambahan untuk tetap dapat tumbuh dengan baik. Setelah mencapai titik nilai OD600 lebih dari 0,8, pengukuran OD600
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 27
berikutnya dilakukan dalam rentang 10 menit seperti yang terlihat pada tabel hasil pengamatan. Perlu diketahui, bahwa pada prosedur seharusnya dilakukan penambaha IPTG (Isopropil Thiogalaktosida) pada larutan/ sampel bakteri Eschericia coli, yang bertujuan untuk menginduksi produksi enzim dari bakteri. Penambahan IPTG seharusnya dilakukan untuk melihat karakterisasi pertumbuhan bakteri (jumlah koloni) pada sampel.
Pada pengambilan data ketujuh atau pada menit ke 240, pengambilan data dihentikan karena nilai OD600 yang ada menunjukkan penurunan. Penurunan nilai nilai OD600 menunjukkan bahwa pertumbuhan bakteri telah mencapai tahapan kematian bakteri (death phase). Tahapan
death phase dalam pengamatan sendiri dapat terjadi dikarenakan beberapa
hal, yakni sebagai berikut:
Kurangnya nutrisi yang terdapat di dalam bioreactor karena tingkat populasi bakteri yang terlalu tinggi (jumlah bakteri melebihi jumlah nutrisi yang ada)
Terdapat bakteri asing/kontaminan yang menyebabkan laju pertumbuhan bakteri terganggu.
Adanya kompetisi dalam memperebutkan nutrisi, sehingga bakteri yang kurang baik pertumbuhannya akan kalah dalam berkompetisi dan akhirnya mati.
Pada tahap yang lebih lanjut, microtube yang telah sterilisasi pada suhu 105o C selama 60 menit disiapkan kembali untuk melakukan sentrifugasi sampel (campuran xylose + Luria Bertani + bakteri
Escherichia coli). Sentrifugasi dilakukan dengan menggunakan alat
sentrifugator. Sentrifugasi dilakukan selama 20 menit dengan kecepatan 5000x g. Durasi dan kecepatan tersebut diperlukan karena dalam percobaan ini yang ingin diperoleh endapannya adalah bakteri Escherichia
coli. Supernatan pada masing-masing microtube hasil sentrifugasi
dikeluarkan (dibuang) dengan menggunakan mikropipet sehingga substansi yang tersisa pada dasar microtube hanya tertinggal bakteri
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 28
dengan menggunakan neraca digital. Berat basah merupakan selisih berat microtube kosong (telah ditimbang pada langkah sebelumya) dengan microtube yang berisi endapan bakteri Escherichia coli. Untuk berat kering, pertama-tama seluruh microtube dimasukkan kedalam oven, sehingga kandungan media cair luria bertani yang masih tersisa bersama endapan dapat benar-benar hilang (menguap). Pengovenan dilakukan selama 40 menit dengan suhu 70 oC. Setelah itu kembali menimbang masing-masing microtube dan selisih berat dengan microtube saat kosong adalah berat keringnya. Perlu diketahui pula bahwa pada saat penimbangan berat kering, bakteri Escherichia coli telah mati oleh karena oleh suhu yang dikenakan pada saat pengovenan. Di sisi lain, sisa campuran bakteri tidak langsung dibuang begitu saja melainkan harus dikenakan proses autoklaf terlebih dahulu untuk mematikan bakteri yang ada. Hal ini harus dilakukan untuk mencegah terjadinya pencemaran yang dapat disebabkan oleh baktei Escherichia coli.
4.4. Analisis Hasil
Nilai OD600 yang diperoleh dalam percobaan menunjukkan jumlah bakteri. Hasil nilai OD600 yang telah di plot ke dalam grafik juga dapat memberikan informasi kepada praktikan mengenai fasa-fasa pertumbuhan bakteri, seperti yang dapat terlihat pada grafik 1. Ketika pengukuran OD600 pertama dan kedua, spektrofotometer menunjukkan angka 0,163 dan 0,228. Hal ini menunjukkan bahwa kondisi pertumbuhan bakteri masih pada fase lag. Pada pengukuran OD600 ketiga, spektrofotometer menunjukkan angka 0,767. Perubahan yang cukup drastis ini menunjukkan bahwa kondisi bakteri mulai berada pada fase eksponensial. Pada pengukuran OD600 keempat, spektrofotometer menunjukkan angka 1,133. Hal ini menunjukkan bahwa kondisi bakteri mulai memasuki fase stasioner (dilihat dari peningkatan nilai OD600 yang tidak drastis seperti sebelumnya). Pada pengukuran OD600 yang kelima dan keenam, spektrofotometer menunjukkan angka masing-masing 1,399 dan 1,587. Peningkatan yang tidak drastis ini menunjukkan bahwa bakteri berada pada fase stasioner. Sementara itu, pada pengukuran OD600 yang ketujuh/
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 29
terakhir, spektrofotometer menunjukkan angka 1,498, yang mengindikasikan bahwa fasa pertumbuhan bakteri telah memasuki fase kematian (death phase).
Dari hasil percobaan, dapat terlihat bahwa nilai pH, memiliki trend menurun dari awal percobaan hingga menit ke-240. Penuruan pH yang drastis terjadi pada OD600 0,767 menuju nilai 1,133. Hal ini menunjukkan bahwa aktivitas metabolit dari bakteri yang menghasilkan produk metabolit sekunder dapat memungkinkan terjadinya penurunan pH pada lingkungan sekitar, dimana dalam hal ini adalah medium cair Luria Bertani (LB). Meskipun begitu, perubahan pH tidak menunjukkan perubahan yang drastis dikarenakan penurunan pH sebesae 0,62 terjadi selama 240 menit (4 jam).
Pada akhir percobaan menit ke-240, praktikan kemudian mengambil sampel 10 microtube untuk mengetahui massa kering dari sampel medium yang diambil dan menghasilkan nilai rata-rata massa kering sebesar 0,0018 gram. Dari nilai massa kering ini, seharusnya dapat diketahui perkiraan jumlah sel dengan melihat pada literatur massa bakteri Escheria coli. Massa kering diketahui dari pengurangan massa kering dalam microtube dengan massa microtube kosong. Sementara itu, massa basah dari bakteri Escheria coli diketahui memiliki nilai rata-rata massa sebesar 0,02558 gram.
Pola pertumbuhan sel dapat diketahui secara tidak langsung dengan melihat pola OD600 (Optical Density pada gelombang 600 nm). Pengukuran Optical Density ini dapat mengukur seberapa banyak sel yang terkandung dalam suatu larutan. Materi yang terkandung dalam larutan tentu tidak hanya sel bakteri, namun juga berupa zat-zat yang terdapat dalam medium. Namun dengan fakta bahwa ukuran sel bakteri yang jauh lebih besar daripada zat-zat lain yang hanya seukuran molekul, maka nilai OD600 ini jelas paling dipengaruhi oleh jumlah sel bakteri yang terdapat dalam larutan yang diukur. Lagipula nilai OD600 yang juga dipengaruhi oleh materi-materi lain dalam larutan yang sama tidak akan mengganggu tujuan dari percobaan ini, yaitu mengetahui pola
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 30
pertumbuhan sel bakteri. Dengan asumsi larutan medium benar-benar homogen, maka tanpa ataupun dengan adanya materi lain selain sel, pola pertumbuhan sel akan tetaplah menunjukkan hasil yang sama, hanya nilai mutlak OD600 yang akan berubah.
Grafik menunjukkan laju pertumbuhan bakteri berdasarkan nilai pengukuran dengan OD600 dan korelasinya dengan waktu. Dari grafik hasil pengukuran dengan OD600, dapat dilihat bahwa bakteri Escheria coli berkembang sesuai dengan grafik literatur. Dari grafik yang terbentuk, terdapat tiga tahap pertumbuhan bakteri yang terlihat, yaitu:
1. Fase Lag (adaptasi)
Pada fase ini, sesuai dengan teori pertumbuhan sel, bakteri akan melakukan adaptasi dengan medium yang baru. Fase lag pada hasil percobaan ini, berlangsung ketika bakteri mulai dimasukkan ke dalam medium hingga menit ke-120. Hasil percobaan menunjukkan bakteri telah melakukan pembelahan pada fase ini, hanya pada kecepatan yang lebih rendah daripada fase selanjutnya.
2. Fase Log/Eksponensial
Fase log dari hasil percobaan terlihat pada menit 120 hingga 210. Pertumbuhan sel pada fase ini terlihat paling cepat ketimbang fase lain hasil percobaan. Pada fase ini, bakteri telah berhasil beradaptasi dengan medium dan lingkungan yang baru, sehingga dapat melakukan pertumbuhan selanjutnya dengan kecepatan yang lebih. Terjadinya fase ini juga menunjukkan bahwa medium dan lingkungan yang dipersiapkan ternyata sesuai untuk pertumbuhan bakteri Escheria coli. 3. Fase Stasioner
Dapat dilihat dari menit ke-210 hingga menit ke-230 bahwa grafik cenderung membentuk garis stabil atau fase stasioner. Sebenarnya fase ini belum mutlak tahap stasioner, tetapi bukan juga fase log. Fase stasioner seharusnya ditunjukkan dengan laju pertumbuhan sel yang benar-benar mendatar, namun sebagaimana yang terlihat pada grafik, masih terjadi pertumbuhan sel. Namun fase ini juga bukan fase log, karena fase log seharusnya ditunjukkan oleh pertumbuhan yang
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 31
meningkat secara eksponensial, sedangkan perlambatan pertumbuhan telah terjadi pada tahapan ini. Fase ini lebih tepat dikatakan peralihan antara fase log dan stasioner, kultur bakteri pada fase ini sedang menuju pada tahapan fase stasioner.
4. Death Phase
Fase ini dapat terlihat pada grafik pertumbuhan dari menit ke-230 hingga menit ke-240 dan seterusnya. Fase ini dapat terlihat dari mulai menunjukkannya penurunan kurva. Tahapan death phase sendiri seperti yang telah dibahas pada analisis percobaan dapat terjadi dikarenakan beberapa hal, yakni sebagai berikut:
Kurangnya nutrisi yang terdapat di dalam bioreactor karena tingkat populasi bakteri yang terlalu tinggi (jumlah bakteri melebihi jumlah nutrisi yang ada)
Terdapat bakteri asing/kontaminan yang menyebabkan laju pertumbuhan bakteri terganggu.
Adanya kompetisi dalam memperebutkan nutrisi, sehingga bakteri yang kurang baik pertumbuhannya akan kalah dalam berkompetisi dan akhirnya mati.
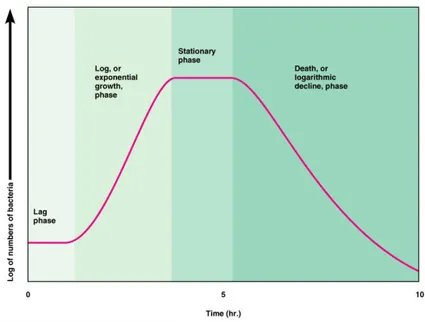
Gambar 7. Grafik literature pertumbuhan sel
(sumber:
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 32
Jika dibandingkan antara grafik hasil percobaan dengan grafik literatur di atas, maka dapat dilihat bahwa grafik hasil percobaan sudah cenderung mirip dengan grafik literatur.
4.5. Analisis Kesalahan
Dalam percobaan modul Bioreaktor yang dilakukan oleh praktikan, terdapat kesalahan secara metodelogi yang terjadi, yaitu memegang mikropipet, bioreaktor, selang keluaran sampel pada bioreaktor dan peralatan lainnya dalam proses kultur tanpa menggunakan sarung tangan. Kesalahan yang dilakukan ini dapat meningkatkan risiko kontaminasi kultur sehingga dapat mempengaruhi pertumbuhan bakteri dan nilai OD600 hasil pembacaan oleh instrumen spektrofotometer. Walaupun demikian, hal tersebut tidak memberikan pengaruh yang signifikan dimana hal ini terlihat dari gambaran grafik yang didapatkan pada bagian Pengolahan Data yang sesuai dengan teori yang ada. Faktor yang menyebabkan konsistensi dalam hasil penggambaran grafik yang didapatkan, dipengaruhi oleh sistem tertutup pada bioreaktor, sehingga selama masa kultur dalam bioreaktor, media dan sel tidak mengalami kontaminasi. Kontaminasi pada media kultur dan sel terjadi pada waktu yang sangat singkat dibandingkan dengan waktu kultur dalam bioreaktor, sehingga kontaminasi yang terjadi tidak mempengaruhi hasil secara signifikan.
Selain kesalahan dalam prosedur, terdapat juga potensi kesalahan terhadap alat yang digunakan. Kuvet atau wadah yang digunakan untuk pembacaan nilai OD dengan menggunakan instrumen spektrofotometer terbuat dari kaca, jika kuvet kaca yang digunakan tidak bersih dalam arti terdapat baretan halus maupun terdapat sidik jari praktikan, maka nilai OD yang terbaca pada spektrofotometer akan menyimpang dari nilai yang sebenarnya. Hal lainnya yang dapat menimbulkan terjadinya kesalahan pembacaan adalah terlalu tingginya nilai OD dari sampel, karena semakin tinggi nilai OD pada sampel maka pengukuran OD akan menjadi semakin kurang sensitif dan menghasilkan pembacaan yang keliru. Permasalahan
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 33
ini dapat diatasi dengan cara menggencerkan sampel kultur sampai pada nilai tertentu sebelum dilakukan penggukuran nilai OD menggunakan spektrofotometer, dimana nilai OD yang sebenarnya dapat dicari dengan mengalikan nilai OD yang didapat dengan faktor pengenceran (sesuai dengan volume yang ditambahkan untuk mengencerkan sampel kultur).
4.6. Analisis Alat dan Bahan 4.6.1. Alat
Peralatan yang digunakan dalam praktikum kali ini dapat dilihat pada tabel berikut.
No. Alat Gambar Keterangan
1. Autoklaf
Gambar 8. Autoklaf
(sumber: www.fairdealtraders.com, diakses pada tanggal 12 November
2014 pk 9.38 PM)
Autoklaf digunakan untuk mematikan sel bakteri. Namun karena autoklaf tidak tersedia di dalam laboratorium, praktikan melakukan cara
manual dengan
menggunakan wadah panci biasa yang diisi air.
2. Erlenmeyer
Gambar 9. Autoklaf
(sumber: www.aliexpress.com, diakses pada tanggal 12 November 2014 pk
9.40 PM)
Erlenmeyer dalam percobaan ini digunakan sebagai wadah sementara untuk memindahkan sampel dari biofermentor ke kuvet dan microtube.
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 34
3. Timbangan digital
Gambar 10. Timbangan Digital (sumber:voer.edu.vn, diakses pada
tanggal 12 November 2014 pk 9.41 PM)
Timbangan digital digunakan untuk mengukur massa microtube, sel basah dan sel kering yang diperoleh dari hasil percobaan.
4. Microtube
Gambar 11. Microtube (sumber: www.avena-medica.com,
diakses pada tanggal 12 November 2014 pk 9.38 PM)
Microtube digunakan sebagai wadah sampel untuk sentrifugasi.
5. Pipet mikro
Gambar 12. Pipet Mikro (sumberwww.labor.com.tr, diakses
pada tanggal 12 November 2014 pk 9.45 PM)
Pipet mikro digunakan untuk memindahkan sampel dari erlenmeyer ke kuvet dan microtube, serta untuk mengambil supernatant dari hasil sentrifuge.
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 35
6. Sentrifuge
Gambar 13. Sentrifuge (sumber: newton.no, diakses pada tanggal 12 November 2014 pk 9.45
PM)
Sentrifuge digunakan untuk memisahkan sel dan larutan supernatant.
7. Kuvet
Gambar 14. Kuvet
(sumber: udorganik.indonetwork.net, diakses pada tanggal 12 November
2014 pk 9.44 PM)
Kuvet digunakan sebagai wadah bagi sampel untuk spektrofotometri.
8. Spektrofotometer
Gambar 15. Spektrofotometer (sumber: http://www.prezi.com, diakses pada tanggal 12 November
2014 pk 9.38 PM)
Spektrofotometer
digunakan untuk mengukur nilai OD sampel.
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 36
9. Biofermentor
Gambar 16. Biofermentor (sumber:http://sites.tech.uh.edu, diakses pada tanggal 12 November
2014 pk 9.45 PM)
Biofermentor digunakan sebagai wadah untuk mengalirkan medium LB, mencampurkan xylose dan mengaduk bakteri. Alat ini diatur pada pH 7, suhu 370C dan laju aerasi 0,5 v/v/m.
10. Oven
Gambar 17. Oven
(sumber: www.aliexpress.com, diakses pada tanggal 12 November 2014 pk
9.46 PM)
Oven digunakan untuk mengeringkan microtube pada awal percobaan, serta untuk mengeringkan sel basah yang diperoleh dari hasil sentrifugasi.
11. Desikator
Gambar 18. Desikator (sumber: www.coleparmer.com, diakses pada tanggal 12 November
2014 pk 9.57 PM)
Desikator digunakan untuk mengabsorpsi uap air yang terbentuk di dinding microtube setelah di oven.
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 37
4.6.2. Bahan
Bahan-bahan yang digunakan dalam praktikum kali ini dapat dilihat pada tabel berikut.
No. Alat Gambar Keterangan
1. Luria Bertani Gambar 19. Luria Bertani
(sumber:
http://upload.wikimedia.org/wikipedia/ commons/b/b8/Laboratoorne_s%C3% B6%C3%B6de_%22LB%22_ehk_%22 lysogeny_broth%22_on_sobiv_bakterit e_kasvatamiseks..JPG, diakses pada
tanggal 12 November 2014 pk 10.01 PM)
Luria Bertani (LB) merupakan media cair yang kaya akan nutrisi yang digunakan sebagai medium pertumbuhan bakteri. Secara umum kandungan yang terdapat dalam LB adalah sebagai berikut. Peptida Vitamins Trace elements (misalkan: nitrogen, sulfur, magnesium) Mineral
2. Bakteri Eschericiaa coli
Gambar 20. Bakteri Eschericia coli (sumber:
http://upload.wikimedia.org/wikipedia/ commons/3/32/EscherichiaColi_NIAI
D.jpg, diakses pada tanggal 12
November 2014 pk 10.03 PM)
Bakteri Escheria coli merupakan bakteri yang dikultur dalam percobaan ini, dan digunakan untuk mengamati kurva
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 38
3. Xylose
Gambar 21. Xylose
(sumber:
http://extractpowder.biz/wp-content/uploads/2011/01/D_Xylose.jpg , diakses pada tanggal 12 November
2014 pk 10.04 PM)
Xylose merupakan pemanis/ gula yang berfungsi sebagai nutrisi
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 39 BAB 5
PENUTUP
5.1. Kesimpulan
Kultur sel merupakan teknik perbanyakan sel pada kondisi dan lingkungan tertentu, pada umumnya bersifat aseptis atau ditumbuhkan secara steril.
Dinamika pertumbuhan sel dapat dipetakan dalam kurva pertumbuhan bakteri, yang dibuat dengan memplotkan peningkatan jumlah sel terhadap waktu. Kurva pertumbuhan mikroorganisme dapat digunakan untuk menggambarkan tahap-tahap dari siklus pertumbuhannya.
Pertumbuhan sel tidak terjadi secara linier, tetapi terdapat beberapa fase yaitu fase lag, fase log, fase stasioner dan fase kematian.
Faktor – faktor yang mempengaruhi proses kultur sel adalah : jenis media yang digunakan, suhu, pH, kandungan air, nutrisi, dan DO (Dissolve
Oxygen)
Percobaan ini dilakukan dalam 4 tahapan yaitu : a. Persiapan media kultur
b. Persiapan pre kultur
c. Kultur bakteri dalam fermentor berpengaduk d. Pemanenan sel
Pada percobaan kali in pola pertumbuhan sel dapat diketahui secara tidak langsung dengan melihat pola OD600 (Optical Density pada gelombang 600 nm) menggunakan alat spektrofotometer
Pada menit ke 60-120 bakteri E.Coli mengalami fase lag dimana bakteri tersebut masih menyesuaikan diri atau beradaptasi terhadap media.
Pada menit ke 120 bakteri E.Coli mulai mengalami fase eksponensial.
Pada menit ke 240 bakteri mulai mengalami death phase yang ditandai dengan berkurangnya nilai OD600.
Massa basah bakteri keseluruhan adalah sebesar 4.263 gram
Laporan Akhir Praktikum UOB 1 Modul Bioreaktor Kultur Sel 40 DAFTAR PUSTAKA
Anonim, 2014. Modul Praktikum Unit Operasi Bioproses I. Depok: Departemen Teknik Kimia Universitas Indonesia.
Freshney, R. Ian. 2006. Basic Principles of Cell Culture. New Jesery: John Wiley & Sons, Inc.
Kusnadi, 2010. Pertumbuhan Bakteri. [pdf]
http://file.upi.edu/Direktori/FPMIPA/JUR._PEND._BIOLOGI/196805091 94031KUSNADI/BUKU_COMMON_TEXT_MIKROBIOLOGI,_Kusnad i,dkk/BAB_IV_PERTUMB.BAKTERI.pdf, diakses pada tanggal 13 November 2014 pukul 9.34 AM.
Melliawati, 2009. Escherichia coli dalam Kehidupan Manusia.[pdf]
http://www.biotek.lipi.go.id/images/stories/biotrends/vol4no1/EcoliR.Mell iawati1014.pdf, diakses pada tanggal 13 November 2014 pukul 8.93 AM. Presser, K. A, T. Ross, and D. A. Ratkowsky. 1998. Modelling the Growth Limits
(Growth/No Growth Interface) of Escherichia coli as a Function of Temperature, pH, Lactic Acid Concentration, and Water Activity. [pdf]
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC106229/, diakses pada tanggal 13 November 2014 pukul 10.10 AM.
Sumarsih, 2007. Lingkungan Pertumbuhan Mikroba. [pdf]
http://sumarsih07.files.wordpress.com/2008/11/ii-lingkungan-pertumbuhan-mikroba.pdf, diakses pada tanggal 13 November 2014 pukul 10.10 AM.