BAB III
METODE PENELITIAN
Metode penelitian menggunakan metode eksperimental untuk mengetahui pengaruh penyimpanan terhadap viabilitas dan aktivitas antibakteri bakteriosin dari bakteri asam laktat (BAL) pada sediaan probiotik.
2.11 Desain Penelitian
Penelitian in vitro dilakukan dengan 2 faktor, yaitu: (1) suhu simpan (Ts):
pada suhu 4oC (dalam refrigerator = Ts1) dan suhu 28oC (dalam inkubator = Ts2), (2) waktu simpan (Ws): pada hari ke-0, 7, 14, 21, 28 (Ws1, Ws2, Ws3, Ws4, dan
Ws5). Semua sampel di simpan dalam kemasan asli untuk uji viabilitas dari BAL. Uji aktivitas antibakteri bakteriosin dari BAL dilakukan terhadap bakteri patogen S. aureus dan E. coli (Carollina, 2015; Abdelsamei, et al., 2015).
2.12 Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Mikrobiologi Fakultas Farmasi dan Laboratorium Mikrobiologi FMIPA Biologi Universitas Sumatera Utara, Medan. Penelitian dilakukan pada bulan Agustus-Oktober Tahun 2016.
2.13 Alat dan Bahan 3.3.1 Alat
Alat yang digunakan dalam penelitian ini adalah autoklaf, batang pengaduk, bunsen, tabung sentrifugasi, cool box, colony counter, hot plate, inkubator,
jangka sorong, jarum ose, Laminar Air Flow Cabinet, mikro pipet, neraca analitik, penangas air, penyaring mikro 0,22 µm, petridisk, refrigerator, sentrifugasi, spatula, spuit, spektrofotometer UV-Vis, dan alat-alat gelas sesuai kebutuhan. Beberapa gambar alat dapat dilihat pada Lampiran 22 halaman 102-104.
Seluruh alat gelas disterilkan menggunakan oven pada suhu 180oC selama 120 menit dengan membungkus menggunakan kertas roti. Jarum ose disterilkan dengan cara dibakar menggunakan lampu spiritus (Ditjen POM, 1995).
3.3.2 Bahan
Bahan uji adalah sediaan probiotik mengandung BAL. Biakan bakteri
patogen yang digunakan yaitu Staphylococcus aureus (S. aureus ATCC 6538) dan Escherichia coli (E. coli ATCC 8939) koleksi Laboratorium Mikrobiologi
Fakultas Farmasi USU. Bahan kimia yang digunakan jika tidak dinyatakan lain berkualitas pro analis yaitu akuades, alkohol 70%, alkohol 96%, NaOH 1 N, NaCl 0,9%, H2O2 3%, gentian violet, lugol, safranin, minyak imersi dan
larutan McFarland No. 0,5. Media yang digunakan yaitu MRSA, MRSB, NA, dan MHA. Gambar bahan dapat dilihat pada Lampiran 23 halaman 105.
Kontrol positif yang digunakan adalah Tetrasiklin HCl 30 µg (Oxoid) dan akuades sebagai kontrol negatif. Pencadang kertas yang digunakan adalah pencadang kertas kosong diameter 6 mm (Oxoid). Pencadang kertas kosong disterilkan dalam autoklaf suhu 121oC selama 15 menit (Adebayo, et al., 2014). 3.3.2.1 Pengumpulan Sampel
Pengumpulan sampel dilakukan dengan metode purposif sampling. Sampel merupakan 4 jenis sediaan probiotik mengandung BAL yang di beli dari apotek-apotek yang ada di wilayah kota Medan, Sumatera Utara yaitu:
A. Lacto B diproduksi oleh Novell Farma dengan berat 1 g/sachet mengandung viable cell 6,0 x 107 CFU/sachet (setara 7,78 log CFU/sachet), terdiri dari: L. acidophilus, S. thermophilus dan B. longum. Kadaluarsa Februari 2018.
B. Rillus diproduksi oleh Kalbe Farma dengan berat 1,5 g/tablet dengan
viable cell 1,0 x 109 CFU/tablet (9 log CFU/tablet) terdiri dari: L. plantarum, B. bifidum dan S. thermophilus. Kadaluarsa Februari 2018.
C. Interlac diproduksi oleh Kalbe Farma dengan berat 0,5 g/tablet mengandung L. reuteri 1 x 108 CFU/tablet (8 log CFU/tablet). Kadaluarsa November 2017.
D. Lacbon diproduksi oleh Kimia Farma dengan berat 0,25 g/tablet mengandung L. sporogenes 5 x 107 CFU/tablet (7,70 log CFU/tablet). Kadaluarsa
Agustus 2018. Komposisi dan banyaknya sampel yang digunakan dapat dilihat pada Lampiran 1 dan Lampiran 2 halaman 76-77.
3.3.2.2 Pembuatan media deMann Rogosa Sharpe Agar (MRSA)
Komposisi : Peptone 10 g
Lab-Lemco’powder 8 g
Yeast extract 4 g
Glucose 20 g
Sorbiton Mono-oleate 1 mL
Dipotasium hydrogen phosphate 2 g
Sodium acetate 3H2O 5 g
Triammonium citrate 2 g
Magnesium Sulphate 7H2O 0,2 g
Manganese Sulphate 4H2O 0,05 g
Sebanyak 62 gram media MRSA dilarutkan dalam 1000 mL akuades steril, dihomogenkan dengan hot plate sampai larut dan disterilkan dalam autoklaf pada suhu 121oC, selama 15 menit (Oxoid, The Manual Laboratories, 2006).
3.3.2.3 Pembuatan media deMann Rogosa Sharpe Broth (MRSB)
Komposisi : Peptone 10 g
Lab-Lemco’powder 8 g
Yeast extract 4 g
Glucose 20 g
Sorbiton Mono-oleate 1 mL
Dipotasium hydrogen phosphate 2 g
Sodium acetate 3H2O 5 g
Triammonium citrate 2 g
Magnesium Sulphate 7H2O 0,2 g
Manganese Sulphate 4H2O 0,05 g
Sebanyak 52 gram media MRSB dilarutkan dalam 1000 mL akuades steril, dihomogenkan dengan hot plate sampai larut dan disterilkan dalam autoklaf pada suhu 121oC selama 15 menit (Oxoid, The Manual Laboratories, 2006).
3.3.2.4 Pembuatan media Nutrient Agar (NA)
Komposisi : Lab-Lemco’ Powder 1 g
Yeast Extract 2 g
Peptone 5 g
Sodium Chloride 5 g
Sebanyak 28 gram media NA dilarutkan dalam 1000 mL akuades steril, dihomogenkan dengan hot plate sampai larut dan disterilkan dalam autoklaf pada suhu 121oC, selama 15 menit (Oxoid, The Manual Laboratories, 2006).
3.3.2.5 Pembuatan media Muller Hinton Agar (MHA)
Komposisi : Beef Dehydrated Infusion from 300 g
Casein Hydrolysate 17,5 g
Starch 1,5 g
Agar 17,0 g
Sebanyak 38 gram media MHA dilarutkan dalam 1000 mL akuades steril,
dihomogenkan dengan hot plate sampai larut dan disterilkan dalam autoklaf pada suhu 121oC, selama 15 menit (Oxoid, The Manual Laboratories, 2006).
3.3.2.6 Pembuatan media agar miring
Sebanyak 3 ml media NA steril dimasukkan ke dalam tabung reaksi steril, didiamkan pada temperatur kamar sampai memadat pada posisi miring kira-kira 45o. Hal yang sama dilakukan terhadap media MRSA (Sihombing, 2014).
3.3.2.7 Pembuatan larutan NaCl 0,9%
Sebanyak 9 g NaCl ditimbang dan dilarutkan sempurna dengan akuades steril dalam labu tentukur 1000 mL, kemudian dicukupkan dengan akuades steril sampai garis tanda dalam erlenmeyer steril kemudian disterilkan dalam autoklaf pada suhu 121oC selama 15 menit (Ditjen POM, 1995).
3.3.2.8 Pembuatan larutan McFarland No. 0,5
Sebanyak 0,05 mL larutan BaCl2 1% dicampur dengan 9,95 mL larutan H2SO4
1% dan dikocok homogen. Larutan McFarland No. 0,5 ini setara dengan suspensi sel bakteri konsentrasi 1,5 x 108 CFU/mL (Sihombing, 2014).
3.3.2.9 Peremajaan bakteri
Satu ose koloni bakteri patogen S. aureus dan E. coli dengan menggunakan jarum ose steril, ditanam pada media NA miring dengan cara menggores. Kemudian diinkubasi pada suhu 37oC selama 24 jam. Hal yang sama dilakukan terhadap BAL pada media MRSA miring (Sihombing, 2014).
3.3.2.10 Pembuatan inokulum bakteri patogen
Koloni bakteri patogen S. aureus dan E. coli hasil peremajaan pada media NA miring diambil dengan jarum ose steril lalu disuspensikan dalam 10 mL NaCl 0,9%. Kultur diukur kekeruhan dengan membandingkan kekeruhannya mengunakan larutan McFarland No. 0,5 (konsentrasi bakteri 1,5 x 108 CFU/mL) (Sihombing, 2014; Barzavar, 2015).
3.3.2.11 Pembuatan lempeng bakteri patogen
Dipipet sebanyak 1 mL inokulum bakteri patogen S. aureus dan E. coli (konsentrasi bakteri 1,5 x 108 cfu/mL) dimasukkan ke dalam cawan petri steril kemudian ditambahkan 15 mL media MHA steril. Lalu cawan petri diputar sesuai angka delapan agar bakteri menyebar rata pada media (Sutrisna, et al., 2012).
2.14 Prosedur
3.4.1 Uji viabilitas BAL
Sebanyak 1 g serbuk sampel dilarutkan homogen dalam 9 mL NaCl 0,9%, diperoleh konsentrasi pengenceran 10-1. Dibuat pengenceran bertingkat hingga pengenceran 10-10. Dipipet 1 mL larutan dari masing-masing serial pengenceran
dimasukkan dalam cawan petri steril (triplo). Dituang 15 ml media MRSA suhu 45oC ke dalam cawan petri tersebut dan dihomogenkan. Diinkubasi pada
pada media MRSA menggunakan colony counter. Pengenceran dengan jumlah koloni 30-300 koloni dijadikan dasar perhitungan. Uji viabilitas dilakukan pada hari ke-0 dan setelah di simpan pada suhu 4oC dan 28oC hari ke-7, 14, 21 dan 28 (Carollina, 2015; Abbas, et al., 2015; Utami, 2013). Alur pengujian terdapat pada Lampiran 3a halaman 78.
3.4.2 Uji aktivitas antibakteri hasil uji viabilitas BAL
Sebanyak 1 ose koloni BAL hasil uji viabilitas pada media MRSA diinokulasikan ke dalam 20 mL media MRSB dan diinkubasi pada suhu 37oC selama 72 jam secara aerobik (inokulum). Inokulum bakteri yang diperoleh disentrifugasi pada kecepatan 10.000 rpm pada suhu 4oC selama 20 menit (supernatan). Diukur dan disesuaikan pH supernatan menjadi pH 7,0 menggunakan NaOH 1 N (supernatan netral). Supernatan netral yang diperoleh kemudian disaring menggunakan penyaring mikro 0,22 µm (bakteriosin). Dipipet sebanyak 20 µL masing-masing inokulum, supernatan dan bakteriosin lalu diteteskan pada pencadang kertas yang sudah disusun diatas lempeng bakteri patogen kemudian diinkubasi pada suhu 37oC selama 24 jam. Diukur zona bening yang terbentuk dengan Tetrasiklin HCl 30 µg sebagai kontrol positif dan akuades sebagai kontrol negatif (Begum, 2015; Yulinery, 2015; Khoiriyah, dkk., 2014; Jiang, 2011; Setianingsih, 2010). Alur pengujian dapat dilihat pada Lampiran 4 halaman 79. 3.4.3 Isolasi BAL
Isolasi BAL dilakukan dengan mengamati morfologi koloni bakteri yang tumbuh pada media MRSA pada uji viabilitas meliputi bentuk, tepian, warna, permukaan, elevasi dan ukuran (Utami, 2013; Ramalingam dan Anvita, 2011). 3.4.4 Identifikasi BAL
a. Pewarnaan Gram
Isolat BAL dari media MRSA dibuat olesan tipis pada gelas objek steril dan difiksasi panas. Kemudian diteteskan gentian violet, tunggu selama 1 menit, dibilas dengan akuades. Preparat diberi tetesan lugol dan dibiarkan selama 1 menit lalu dibilas dengan akuades. Kemudian preparat dicuci dengan alkohol 96% sampai gentian violet pada preparat tidak luntur lagi lalu dibilas dengan akuades. Selanjutnya preparat diberi tetesan zat warna safranin dan dibiarkan selama 45 detik lalu dibilas dengan akuades dan dikeringkan. Kemudian preparat diteteskan minyak imersi dan diamati dibawah mikroskop dengan perbesaran 100x untuk melihat bentuk dan warna dinding sel setelah dilakukan pewarnaan. Bakteri yang termasuk dalam kelompok Gram positif dinding selnya berwarna ungu atau gelap sedangkan kelompok bakteri Gram negatif akan menunjukkan warna merah safranin (Sharah, dkk., 2015).
b. Uji katalase
Isolat BAL dari media MRSA dioles pada gelas objek yang telah disterilkan dengan alkohol, lalu diteteskan larutan H2O2 3%. Preparat diamati, bila
terdapat gelembung gas maka menunjukkan bakteri tersebut katalase positif dan apabila tidak terbentuk gelembung gas maka bakteri tersebut katalase negatif (Sharah, dkk., 2015). Alur terdapat pada Lampiran 3b halaman 78. 3.4.5 Penentuan waktu inkubasi optimum BAL
Modifikasi penentuan waktu inkubasi optimum BAL dari masing-masing sampel dengan mengambil 1 ose koloni BAL pada media MRSA miring diinokulasikan secara aseptis ke dalam 10 mL media MRSB diinkubasi pada suhu 37oC selama 24 jam (kultur). Kultur dipindahkan ke dalam media MRSB segar disamakan kekeruhannya dengan mengukur nilai Optical Dencity
menggunakan spektrofotometer UV-Vis pada panjang gelombang 600 ŋm, absorbansi 1 (setara 109 CFU/mL) menggunakan media MRSB sebagai blanko. Sebanyak 2 mL inokulum setara 109 CFU/mL diinokulasi ke dalam 100 mL media MRSB secara aseptik kemudian diinkubasi pada suhu 37oC selama 120 jam
(inokulum aktif). Sebanyak 1 mL inokulum aktif diencerkan homogen dengan 9 mL NaCl 0,9 % (pengenceran 10-1). Dibuat pengenceran bertingkat hingga
diperoleh piring dengan jumlah koloni 30-300 koloni dengan memipet sebanyak 1 mL dari masing-masing serial pengenceran dimasukkan ke dalam cawan petri steril dan ditambahkan 15 mL media MRSA suhu 45oC dan dihomogenkan kemudian diinkubasi terbalik pada suhu 37oC selama 48 jam pada kondisi aerobik. Perhitungan ALT koloni yang tumbuh pada media MRSA dilakukan terhadap inokulum aktif pada waktu inkubasi ke-0, 24, 48, 72, 96 dan 120 jam menggunakan colony counter (Khoiriyah, dkk., 2014; Barua, et al., 2015). Alur penelitian dapat dilihat pada Lampiran 5 halaman 80.
3.4.6 Penentuan waktu optimum aktivitas antibakteri bakteriosin dari BAL Dipipet 1 mL kultur aktif BAL diinokulasi ke dalam 20 mL media MRSB diinkubasi pada suhu 37oC selama 96 jam (inokulum). Inokulum disentrifugasi pada kecepatan 10.000 rpm pada suhu 4oC selama 20 menit. pH supernatan diukur dan disesuaikan menjadi pH 7,0 menggunakan NaOH 1 N lalu disaring menggunakan penyaring mikro 0,22 µm. Pemanenan dilakukan pada waktu inkubasi ke-48, 72 dan 96 jam. Uji aktivitas dilakukan terhadap bakteri S. aureus karena memiliki kesamaan filogenetik dengan memipet 1 mL inokulum bakteri patogen setara larutan McFarland No. 0,5 (konsentrasi bakteri 1,5 x 108 CFU/mL) ke dalam cawan petri steril lalu ditambahkan 15 mL media MHA, dihomogenkan. Disusun cakram kertas steril pada lempeng patogen untuk masing-masing BAL
kemudian diteteskan 20 µL bakteriosin lalu diinkubasi pada suhu 37oC selama 24 jam (Khoiriyah, dkk., 2014; Rawal, 2013; Sutrisna, dkk., 2012).
3.4.7 Produksi bakteriosin dari BAL
Dipipet 1 mL kultur aktif BAL diinokulasikan ke dalam 20 mL media MRSB dan diinkubasi pada suhu 37oC selama 72 jam secara aerobik (inokulum). Inokulum bakteri disentrifugasi pada kecepatan 10.000 rpm pada suhu 4oC selama 20 menit (supernatan dan pelet). Diukur dan disesuaikan pH supernatan menjadi pH 7,0 menggunakan NaOH 1 N (supernatan netral), lalu disaring menggunakan penyaring mikro 0,22 µm (bakteriosin). Kemudian bakteriosin yang dihasilkan disimpan pada suhu 4oC dan 28oC selama 28 hari (Khoiriyah, dkk., 2014; Barzavar, 2015; Abbas, et al., 2016; Abdelsamei, et al., 2015; Gomashe, 2014; Francois, et al., 2013). Alur ekstraksi bakteriosin dapat dilihat pada Lampiran 6 halaman 81.
3.4.8 Uji aktivitas antibakteri bakteriosin dari BAL
Sebanyak 20 µL bakteriosin dari masing-masing BAL diteteskan pada pencadang kertas steril yang telah disusun sebelumnya pada lempeng bakteri patogen S. aureus dan E. coli. Diinkubasi pada suhu 37oC selama 24 jam. Pengamatan aktivitas antibakteri bakteriosin dari BAL dilakukan dengan mengukur zona bening yang terbentuk pada skala mm termasuk diameter pencadang kertas (6 mm), serta membandingkan aktivitas antibakteri bakteriosin dari BAL berdasarkan tabel potensi antibakteri. Pengukuran aktivitas antibakteri bakteriosin dari BAL terhadap bakteri patogen S. aureus dan E. coli dilakukan dengan 2 tahap yaitu: (i) sebelum penyimpanan yaitu pada hari ke-0, (ii) setelah penyimpanan pada suhu 4oC (dalam refrigerator) dan 28oC (dalam inkubator) pada hari ke-7, 14, 21, dan 28. Tetrasiklin HCl 30 µg digunakan sebagai kontrol positif
dan akuades sebagai kontrol negatif (Yulinery, 2015; Barua, et al., 2015; Francois, et al., 2013; Jiang, 2011). Secara keseluruhan alur penelitian dapat dilihat pada Lampiran 7 halaman 82.
2.15 Analisis Data
Analisis data menggunakan metoda analysis one-way of variance (ANOVA) dimana hasil dianggap berbeda secara signifikan jika P < 0,05. Selanjutnya untuk membandingkan hasil rata-rata setiap perlakuan, maka uji dilanjutkan dengan analisis Tukey HSD pada program Statistic Product and Service Solutions 17.0 (SPSS) (Abdelsamei, et al., 2015).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Viabilitas BAL
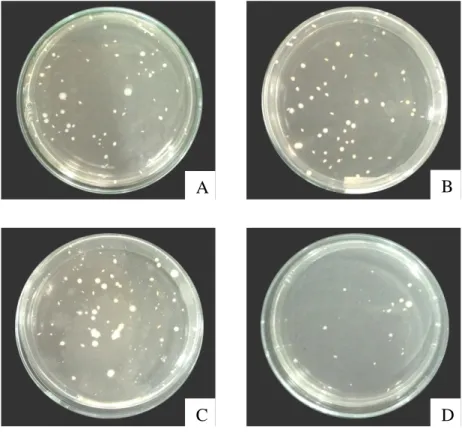
Sampel merupakan 4 jenis sediaan probiotik mengandung BAL khususnya Lactobacillus secara tunggal maupun campuran yaitu: A (Lacto B) mengandung L. acidophilus, B (Rillus) mengandung L. plantarum, C (Interlac) mengandung L. reuteri, dan D (Lacbon) mengandung L. sporogenes. Komposisi sampel dapat dilihat pada Lampiran 1 halaman 79. Pengamatan dan perhitungan jumlah BAL menggunakan alat colony counter dapat dilihat pada Gambar 4.1, Gambar 4.2, Tabel 4.1, dan Tabel 4.2.
Gambar 4.1 Jumlah koloni BAL
Keterangan: A (Lacto B): koloni BAL pada pengenceran 10-5; B (Rillus): koloni BAL pada pengenceran 10-6; C (Interlac): koloni BAL pada pengenceran 10-6; D (Lacbon): koloni BAL pada pengenceran 10-6.
A B
Tabel 4.1 Pengaruh penyimpanan pada suhu 4oC terhadap viabilitas BAL (log CFU/sediaan)
Hari ke- Viabilitas rata-rata pada suhu 4
o
C ± SD (n=3)
A (log107) B (log109) C (log108) D (log 107)
Label 7,78 9,00 8,00 7,70 0 7,70 ± 0,1 9,08 ± 0,1 8,30 ± 0,0 7,77 ± 0,1 7 7,70 ± 0,1 9,09 ± 0,1 8,29 ± 0,1 7,77 ± 0,1 14 7,71 ± 0,1 9,09 ± 0,0 8,29 ± 0,1 7,78 ± 0,1 21 7,68 ± 0,1 9,09 ± 0,0 8,29 ± 0,1 7,76 ± 0,2 28 7,70 ± 0,1 9,09 ± 0,0 8,29 ± 0,0 7,76 ± 0,1
Tabel 4.2 Pengaruh penyimpanan pada suhu 28oC terhadap viabilitas BAL (log CFU/sediaan)
Hari ke- Viabilitas rata-rata pada suhu 28
o
C ± SD (n=3)
A (log107) B (log109) C (log108) D (log 107)
Label 7,78 9,00 8,00 7,70 0 7,70 ± 0,1 9,08 ± 0,1 8,30 ± 0,0 7,77 ± 0,1 7 7,70 ± 0,1 9,09 ± 0,0 8,30 ± 0,1 7,76 ± 0,1 14 7,69 ± 0,1 9,09 ± 0,0 8,27 ± 0,1 7,78 ± 0,0 21 7,69 ± 0,1 9,09 ± 0,0 8,20 ± 0,1 7,77 ± 0,1 28 7,67 ± 0,1 9,11 ± 0,1 8,03 ± 0,1(*) 7,77 ± 0,1
Gambar 4.2 Pengaruh penyimpanan terhadap viabilitas BAL
Keterangan: A (Lacto B); B (Rillus); C (Interlac); D (Lacbon); Ts1 (disimpan pada suhu 4oC); Ts2 (disimpan pada suhu 28oC); (*) berbeda secara signifikan. 7.5 8.5 9.5 0 7 14 21 28 V iabili tas ba kter i (log C F U/sed iaa n)
Waktu simpan (hari)
Berdasarkan pengamatan dan perhitungan jumlah koloni BAL yang terdapat pada sediaan A, B, C, dan D diperoleh hasil bahwa jumlah koloni BAL yang tumbuh pada sediaan B, C, dan D sudah sesuai dengan jumlah koloni BAL yang tertera pada label kemasan. Sedangkan jumlah koloni BAL yang tumbuh pada sediaan A lebih rendah dari jumlah koloni BAL yang tertera pada label kemasan. Data perhitungan dapat dilihat pada Lampiran 8 s/d Lampiran 12 halaman 86-90. Penurunan jumlah koloni BAL dapat disebabkan oleh berbagai faktor yang mempengaruhi viabilitas seperti formulasi atau bentuk sediaan, aktivitas air, nutrisi, dan suhu.
Penyimpanan pada suhu 4oC selama 28 hari tidak menyebabkan perubahan jumlah koloni dari seluruh BAL meskipun BAL dari sampel A tidak sesuai label. Jumlah koloni bakteri L. acidophilus dari susu fermentasi tetap baik saat di simpan pada suhu 4 ± 1oC selama 28 hari (> 7 log CFU/g). Begitu juga dengan jumlah koloni bakteri L. plantarum dari produk makanan yang disimpan pada suhu 4oC tetap menunjukkan hasil yang baik jika dibandingkan dengan penyimpanan pada suhu 27oC selama 7 minggu (Ozcan, 2015; Darmasena, 2012). Carollina (2015) melakukan penelitian terhadap 4 jenis suplemen probiotik mengandung bakteri Lactobacillus yaitu Rillus, Lacbon, Lacto B, dan Lacidofil menggunakan media Plate Count Agar (PCA), menyimpulkan bahwa hanya suplemen Lacto B yang memiliki jumlah koloni yang tidak sesuai label.
Jumlah koloni BAL pada sampel C turun secara signifikan saat disimpan pada suhu 28oC selama 28 hari meskipun masih sesuai label. Hal ini dikarenakan suhu 28oC merupakan suhu tumbuh optimum BAL pada fermentasi terkontrol. Selain itu dekatnya tanggal kadaluarsa dari sampel C (November 2017) merupakan faktor lain penyebab turunnya jumlah koloni BAL dari sampel C secara signifikan.
Penelitian sebelumnya menjelaskan bahwa penyimpanan pada suhu 25oC (pada ruangan yang diatur suhunya) selama 4 minggu mengakibatkan penurunan jumlah koloni BAL yang signifikan dari sampel Interlac. Jumlah koloni BAL dalam sampel probiotik menurun dengan meningkatnya suhu penyimpanan yang menyebabkan dehidrasi sel sehingga mengakibatkan kebocoran pada sel. Oleh karena itu penyimpanan pada suhu tinggi tidak dianjurkan untuk sediaan probiotik (Utami, 2013).
4.2 Aktivitas antibakteri hasil uji viabilitas BAL
Data aktivitas antibakteri BAL dilihat pada Lampiran 13 s/d Lampiran 15 halaman 91-97, Gambar 4.3 s/d Gambar 4.6, serta Tabel 4.3 dan Tabel 4.4.
Tabel 4.3 Pengaruh suhu 4oC terhadap aktivitas antibakteri BAL
Sampel Bakteri
patogen
Meta bolit
Diamater zona hambat rata-rata (mm) ± SD (n=3) hari ke-
0 7 14 21 28 A S. aureus i s 8,17±0,5 8,17±0,2 8,17±0,5 8,16±0,4 8,17±0,2 8,13±0,4 8,13±0,3 8,13±0,4 8,13±0,4 8,13±0,1 E. coli i s 7,68±0,5 7,68±0,5 7,68±0,3 7,67±0,2 7,68±0,2 7,65±0,5 7,65±0,4 7,65±0,5 7,62±0,3 7,62±0,5 B S. aureus i s 8,21±0,2 8,21±0,6 8,21±0,4 8,21±0,3 8,21±0,3 8,19±0,2 8,18±0,6 8,17±0,4 8,18±0,3 8,18±0,2 E. coli i s 7,80±0,5 7,80±0,3 7,79±0,4 7,79±0,6 7,79±0,3 7,74±0,5 7,74±0,4 7,72±0,5 7,72±0,7 7,71±0,4 C S. aureus i s 8,14±0,4 8,11±0,5 8,14±0,3 8,10±0,3 8,14±0,2 8,09±1,1 8,14±0,6 8,10±0,4 8,10±0,1 8,08±0,2 E. coli i s 7,97±0,4 7,91±0,5 7,97±0,4 7,91±0,3 7,96±0,2 7,90±0,3 7,96±0,1 7,88±0,3 7,95±0,1 7,88±0,7 D S. aureus i s 8,11±0,3 8,09±0,3 8,11±0,6 8,08±0,7 8,11±0,2 8,08±0,3 8,11±0,1 8,07±1,1 8,10±0,4 8,07±0,3 E. coli i s 7,86±0,2 7,80±0,2 7,86±0,4 7,79±0,4 7,85±0,4 7,85±0,4 7,84±0,7 7,74±0,5 7,82±0,1 7,73±0,4 A, B, C, D S. aureus E. coli b b 6,00 ± 0,00 6,00 ± 0,00 Kontrol (+) S. aureus 21,09 ± 0,56 E. coli 21,34 ± 0,85 Kontrol (-) S. aureus E. col 6,00 ± 0,00 6,00 ± 0,00
Keterangan: A (Lacto B); B (Rillus); C (Interlac); D (Lacbon); K (+) kontrol
positif: Tetrasiklin HCL 30 µg; K (-) kontrol negatif: Akuades; i (inokulum); s (supernatan); b (bakteriosin).
Tabel 4.4 Pengaruh suhu 28oC terhadap aktivitas antibakteri BAL
Sampel Bakteri
patogen
Meta bolit
Diamater zona hambat rata-rata (mm) ± SD (n=3) hari ke-
0 7 14 21 28 A S. aureus i s 8,17±0,5 8,13±0,4 8,12±0,4 8,06±0,4 8,16±0,2 8,13±0,1 8,18±0,3 8,01±0,2 8,16±0,1 8,11±0,2 E. coli i s 7,68±0,5 7,60±0,5 7,69±0,5 7,57±0,2 7,61±0,1 7,65±0,5 7,65±0,4 7,61±0,2 7,64±0,2 7,63±0,4 B S. aureus i s 8,21±0,2 8,21±0,2 8,18±0,3 8,19±0,2 8,17±0,2 8,19±0,2 8,09±0,4 8,17±0,3 8,16±0,1 8,17±0,3 E. coli i s 7,80±0,5 7,73±0,5 7,97±0,4 7,82±0,6 7,77±0,5 7,74±0,5 7,70±0,6 7,74±0,3 7,52±0,6 7,77±0,2 C S. aureus i s 8,14±0,4 8,11±0,5 8,10±0,8 8,09±0,8 8,06±0,2 8,09±0,2 8,10±0,4 8,07±0,6 8,08±0,2 8,08±0,2 E. coli i s 7,97±0,4 7,91±0,5 8,00±0,3 7,86±0,5 7,91±0,3 7,87±0,3 7,87±0,3 7,86±0,3 7,91±0,1 7,88±0,4 D S. aureus i s 8,11±0,3 8,09±0,3 8,06±0,3 8,06±0,2 8,11±0,1 8,11±0,1 8,11±0,4 8,08±0,2 8,07±0,3 8,08±0,2 E. coli i s 7,86±0,2 7,80±0,2 7,93±0,3 7,76±0,3 7,92±0,3 7,79±0,2 7,88±0,4 7,81±0,3 7,87±0,3 7,80±0,3 A, B, C, D S. aureus E. coli b b 6,00 ± 0,00 6,00 ± 0,00 Kontrol (+) S. aureus 21,09 ± 0,56 E. coli 21,34 ± 0,85 Kontrol (-) S. aureus E. coli 6,00 ± 0,00 6,00 ± 0,00
Gambar 4.3 Aktivitas antibakteri BAL terhadap bakteri S. aureus.
Keterangan: A (Lacto B); B (Rillus); C (Interlac); D (Lacbon); K (+) kontrol
positif: Tetrasiklin HCL 30 µg; K (-) kontrol negatif: Akuades; i (inokulum); s (supernatan); b (bakteriosin); Sa (S. aureus).
A B C D K (-) K (+) K (+) K (+) K (+) K (-) K (-) K (-) b i i i i s s s s b b b Sa C Sa B Sa A Sa D
Gambar 4.4 Aktivitas antibakteri BAL terhadap bakteri E. coli.
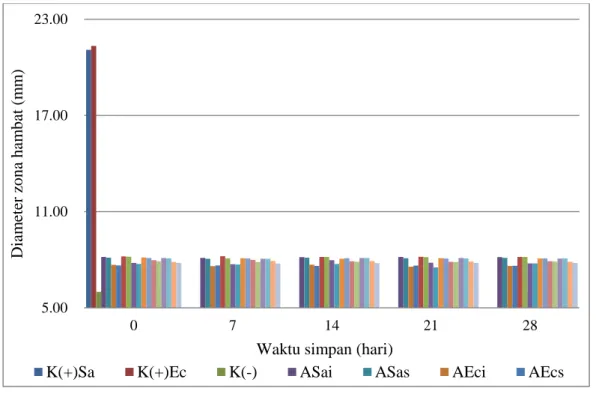
Gambar 4.5 Pengaruh suhu 4oC terhadap aktivitas antibakteri BAL
Keterangan: A (Lacto B); B (Rillus); C (Interlac); D (Lacbon); K (+) kontrol positif: Tetrasiklin HCL 30 µg; K (-) kontrol negatif: Akuades;
i (inokulum); s (supernatan); b (bakteriosin); Sa (S. aureus); Ec (E. coli). 5.00 11.00 17.00 23.00 0 7 14 21 28 D iam et er z ona ha m bat ( m m )
Waktu simpan (hari)
K(+)Sa K(+)Ec K(-) ASai ASas AEci AEcs
D C B A K (+) K (+) K (+) K (+) K (-) K (-) K (-) K (-) Ec A i i i i s s s s b b b b Ec D Ec C Ec B
Gambar 4.6 Pengaruh suhu 28oC terhadap aktivitas antibakteri BAL
Keterangan: A (Lacto B); B (Rillus); C (Interlac); D (Lacbon); K (+) kontrol positif: Tetrasiklin HCL 30 µg; K (-) kontrol negatif: Akuades;
i (inokulum); s (supernatan); b (bakteriosin); Sa (S. aureus); Ec (E. coli).
Diameter zona hambat yang dihasilkan oleh inokulum dan supernatan dari seluruh BAL pada sampel probiotik yang disimpan pada suhu 4oC dan 28oC
selama 28 hari menunjukkan adanya aktivitas antibakteri terhadap bakteri S. aureus dan E. coli dan menghilang setelah dinetralkan menjadi bakteriosin
menggunakan NaOH 1 N. Penelitian sebelumnya menyatakan bahwa 3 dari 4 sediaan probiotik mengandung bakteri Lactobacillus sp. memiliki jumlah koloni bakteri yang tidak sesuai label, namun aktivitas antibakteri yang dihasilkan dari inokulum bakteri probiotik menunjukkan hasil yang baik. Supernatan bebas sel dari BAL pada dadih memiliki aktivitas antibakteri yang kuat terhadap bakteri S. aureus dibandingkan terhadap E. coli dan mengalami penurunan aktivitas antibakteri hingga tidak memberikan zona hambat saat supernatan dinetralkan menggunakan NaOH 3 N (Begum, et al., 2015; Syukur, et al., 2015).
5.00 11.00 17.00 23.00 0 7 14 21 28 D iam et er z ona ha m bat ( m m )
Waktu simpan (hari)
Menghilangnya aktivitas antibakteri bakteriosin dari BAL pada tahap ini disebabkan rendahnya perbandingan antara jumlah dan konsentrasi BAL terhadap media, sehingga bakteriosin tidak diproduksi secara optimum. Pada tahap ini BAL masih melakukan proses pertumbuhan dan belum maksimum mengeluarkan zat anti metabolit karena media yang tersedia masih cukup untuk melakukan proses pembelahan sel (Setianingsih, 2010).
4.3 Karakteristik BAL
Pengamatan morfologi koloni BAL dapat dilihat pada Gambar 4.7.
Gambar 4.7 Morfologi koloni BAL
Keterangan: A (Lacto B): mengandung L. acidophilus; B (Rillus): mengandung L. plantarum; C (Interlac): mengandung L. reuteri; D (Lacbon): mengandung L. sporogenes.
Hasil pengamatan visual terhadap morfologi koloni BAL yang tumbuh pada media MRSA dari keempat sediaan probiotik yaitu berbentuk bulat dengan tepian
A B
rata menyeluruh, berwarna putih buram atau krim, halus, cembung dengan ukuran 0,1-4 mm. BAL memiliki bentuk bulat, warna putih buram atau krim, permukaan halus dan tepian rata (Syukur, 2014; Nudyanto, 2015). Utami (2013) melakukan pengamatan terhadap morfologi koloni bakteri Lactobacillus dari 3 sediaan probiotik masing-masing mengandung bakteri L. acidophilus, L. reuteri dan L. sporogenes bahwa seluruh morfologi koloni yang terbentuk hampir sama yaitu berbentuk bulat, tepian rata, dan berwarna putih buram.
4.4 Jenis BAL
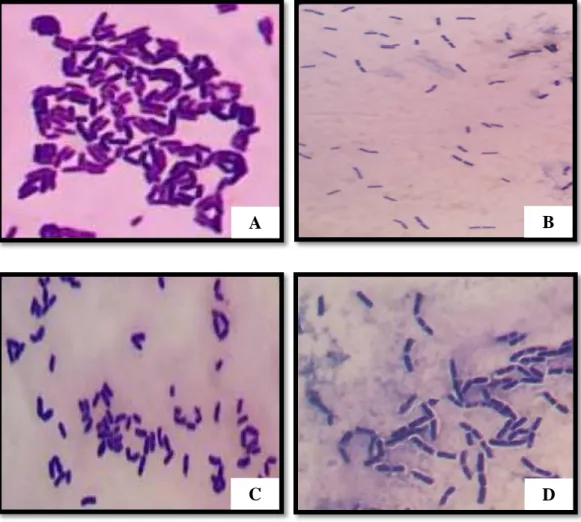
Hasil uji identifikasi BAL pada pewarnaan Gram menggunakan mikroskop cahaya menghasilkan sel bakteri berwarna ungu dengan bentuk sel batang bulat, tunggal atau membentuk rantai/berkelompok. Hasil menunjukkan bahwa bakteri yang dihasilkan merupakan jenis bakteri Gram positif. BAL merupakan bakteri Gram positif dengan dinding sel yang terdiri dari dua lapisan yaitu peptidoglikan yang tebal dan membran dalam. Lapisan peptidoglikan inilah yang dapat mengikat zat warna kristal violet. Zat warna yang telah diikat oleh dinding sel bakteri tidak akan hilang walaupun telah melalui proses pelunturan menggunakan alkohol 96% (Sharah, 2015; Pyar dan Peh, 2014; Nudyanto, 2015).
Pada uji katalase empat isolat BAL dari sampel probiotik menunjukan hasil yang negatif ditandai dengan tidak terbentuknya gelembung udara saat diberi larutan H2O2 3%. Bakteri tidak menghasilkan gelembung udara saat ditambahkan
larutan H2O2 3% disebabkan bakteri tidak dapat menguraikan komposisi H2O2
menjadi O2 dan H2O (Sharah, 2015; Pyar dan Peh, 2014; Nudyanto, 2015). Hasil
pengamatan morfologi sel bakteri menggunakan mikroskop dengan perbesaran 100x ditunjukkan pada Gambar 4.8 dan Tabel 4.5.
Gambar 4.8 Morfologi sel BAL
Tabel 4.5 Jenis BAL dalam sampel
No. Sampel Pewarnaan Gram Bentuk sel Katalase
1. A positif batang bulat berkelompok negatif
2. B positif batang bulat tunggal negatif
3. C positif batang bulat berkelompok negatif
4. D positif batang bulat berantai negatif
Keterangan: A (Lacto B): mengandung L. acidophilus; B (Rillus): mengandung L. plantarum; C: (Interlac) mengandung L. reuteri; D (Lacbon): mengandung L. sporogenes.
4.5 Waktu Inkubasi Optimum BAL
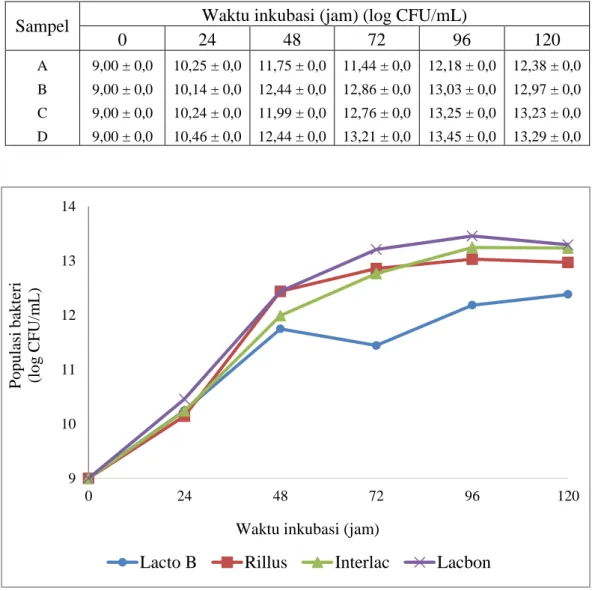
Waktu inkubasi optimum BAL pada Lampiran 16 halaman 98, Tabel 4.6 dan Gambar 4.9.
A B
Tabel 4.6 Waktu inkubasi BAL
Sampel Waktu inkubasi (jam) (log CFU/mL)
0 24 48 72 96 120
A 9,00 ± 0,0 10,25 ± 0,0 11,75 ± 0,0 11,44 ± 0,0 12,18 ± 0,0 12,38 ± 0,0
B 9,00 ± 0,0 10,14 ± 0,0 12,44 ± 0,0 12,86 ± 0,0 13,03 ± 0,0 12,97 ± 0,0
C 9,00 ± 0,0 10,24 ± 0,0 11,99 ± 0,0 12,76 ± 0,0 13,25 ± 0,0 13,23 ± 0,0
D 9,00 ± 0,0 10,46 ± 0,0 12,44 ± 0,0 13,21 ± 0,0 13,45 ± 0,0 13,29 ± 0,0
Gambar 4.9 Pengaruh waktu inkubasi terhadap pertumbuhan BAL
Keterangan: A (Lacto B): mengandung L. acidophilus; B (Rillus): mengandung L. plantarum; C (Interlac): mengandung L. reuteri; D (Lacbon): mengandung L. sporogenes.
Seluruh BAL pada sampel mengalami fase lag pada waktu inkubasi 0 sampai 24 jam dan fase log pada waktu inkubasi 48 jam. Fase stasioner BAL
pada sampel A di mulai pada waktu inkubasi 48 sampai 72 jam, sedangkan BAL pada sampel B, C dan D dimulai pada waktu inkubasi 48 sampai 96 jam. Fase kematian terjadi pada waktu inkubasi 96 jam untuk BAL pada sampel A dan pada waktu 120 jam untuk BAL pada sampel B, C dan D.
9 10 11 12 13 14 0 24 48 72 96 120 Po pulas i bak ter i (l og C FU /m L)
Waktu inkubasi (jam)
Inkubasi optimum bakteri Lactobacillus sp. dari sampel susu kambing pada suhu inkubasi 10, 27, 37 dan 45oC dengan waktu inkubasi 18, 24, 48, 72, 96 dan 120 jam memberikan hasil bahwa suhu 37oC dan waktu inkubasi 18 jam merupakan kondisi inkubasi optimum untuk bakteri Lactobacillus sp. Hal ini disebabkan oleh perbedaan jenis bakteri dan sampel yang diteliti karena karakteristik pertumbuhan masing-masing bakteri berbeda (Barua, et al., 2015)
4.6 Pengaruh Inkubasi terhadap Aktivitas Antibakteri Bakteriosin dari BAL Pengaruh waktu inkubasi optimum terhadap aktivitas antibakteri bakteriosin dari BAL pada bakteri patogen S. aureus dapat dilihat pada Lampiran 17 halaman 99, Gambar 4.10 dan Tabel 4.7.
Gambar 4.10 Aktivitas antibakteri bakteriosin dari BAL terhadap S. aureus
Tabel 4.7 Aktivitas antibakteri bakteriosin dari BAL sampel terhadap S. aureus
Waktu inkubasi
Diameter zona hambat rata-rata (mm) ± SD (n=3)
48 jam 72 jam 96 jam
Sampel A 6,00 ± 0,00 7,76 ± 0,33 6,49 ± 0,06 B 6,00 ± 0,00 8,02 ± 0,06 6,59 ± 0,04 C 6,00 ± 0,00 8,03 ± 0,10 6,54 ± 0,06 D 6,00 ± 0,00 7,95 ± 0,09 6,52 ± 0,09
Kontrol (-) 6,00 ± 0,00
Keterangan: A (Lacto B); B (Rillus); C (Interlac); D (Lacbon); K (-) kontrol negatif: Akuades; a: (waktu inkubasi 48 jam); b: (waktu inkubasi 72 jam); c: (waktu inkubasi 96 jam).
D K (-) K (-) K (-) A A A B B B C C C D D a b c
Berdasarkan pengamatan pada seluruh cakram kertas dari tiap isolat BAL tidak ditemukan penghambatan berupa areal bening sebagai aktivitas
antibakteri bakteriosin pada waktu inkubasi 48 jam terhadap bakteri S. aureus. Aktivitas optimum antibakteri bakteriosin muncul pada waktu inkubasi 72 jam dan menurun kembali setelah waktu inkubasi 96 jam.
Rawal, et al. (2013) menyatakan bahwa produksi optimum bakteriosin dari Lactobacillus dari tablet Sporolac terjadi pada awal fase stasioner yaitu pada waktu inkubasi 24 jam dan hilang setelah diinkubasi selama 48, 72 dan 96 jam. Karthikeyan dan Santosh (2009), bakteri L. plantarum menunjukkan aktivitas antibakteri bakteriosin secara optimum pada akhir fase stasioner (Setianingsih, 2010). Fakta ini menegaskan bahwa BAL memproduksi antimetabolit sekunder berupa bakteriosin setelah melewati fase pertumbuhannya (Pratiwi, 2008).
4.7 Aktivitas Antibakteri Bakteriosin dari BAL
Aktivitas antibakteri bakteriosin dari BAL pada Lampiran 18 s/d Lampiran 21 halaman 100-104, Gambar 4.11 s/d Gambar 4.13, Tabel 4.8 dan Tabel 4.9.
Gambar 4.11 Aktivitas antibakteri bakteriosin dari BAL
Keterangan: A (Lacto B); B (Rillus); C (Interlac); D (Lacbon); K(+) kontrol positif: Tetrasiklin HCl 30 µg; K (-) kontrol negatif: Akuades; Sa (S. aureus); Ec (E.coli). D K (+) K (+) K (-) K (-) A A B B C C D D K (-) K (+) A B C Sa Ec
Tabel 4.8 Pengaruh penyimpanan pada suhu 4oC terhadap aktivitas antibakteri bakteriosin dari BAL.
Sampel Bakteri
patogen
Diameter zona hambat rata-rata (mm) ± SD (n=3) hari ke-
0 7 14 21 28 A S. aureus E. coli 8,10 ± 0,39 8,10 ± 0,38 8,10 ± 0,45 8,09 ± 0,40 7,91 ± 0,40 7,45 ± 0,31 7,45 ± 0,34 7,45 ± 0,28 7,31 ± 0,16 7,24 ± 0,14 B S. aureus E. coli 8,15 ± 0,25 8,15 ± 0,61 8,14 ± 0,51 8,12 ± 0,43 8,12 ± 0,15 7,62 ± 0,37 7,62 ± 0,26 7,59 ± 0,39 7,41 ± 0,15 7,31 ± 0,20 C S. aureus E. coli 8,07 ± 0,57 8,07 ± 0,47 8,07 ± 1,20 8,00 ± 0,65 7,87 ± 0,18 7,54 ± 0,22 7,53 ± 0,07 7,53 ± 0,42 7,30 ± 0,22 7,26 ± 0,92 D S. aureus E. coli 8,08 ± 0,40 8,08 ± 0,72 8,08 ± 0,31 7,96 ± 0,99 7,70 ± 0,14 7,56 ± 0,18 7,53 ± 0,36 7,50 ± 0,25 7,50 ± 0,44 7,37 ± 0,27 Kontrol (+) S. aureus E. coli 21,09 ± 0,56 21,34 ± 0,85 Kontrol (-) S. aureus E. coli 6,00 ± 0,00 6,00 ± 0,00
Gambar 4.12 Pengaruh penyimpanan pada suhu 4oC terhadap aktivitas antibakteri bakteriosin dari BAL.
Keterangan: A (Lacto B); B (Rillus); C (Interlac); D (Lacbon); K(+) kontrol positif: Tetrasiklin HCl 30 µg; K (-) kontrol negatif: Akuades; Sa (S. aureus); Ec (E.coli); a (S. aureus), b (E. coli).
4.00 8.00 12.00 16.00 20.00 24.00 0 7 14 21 28 Dia mete r zona ha mbat ( mm )
Waktu simpan (hari)
K(+)Sa K(+)Ec K(-) Aa Ab Ba Bb Ca Cb Da Db
Tabel 4.9 Pengaruh penyimpanan pada suhu 28oC terhadap aktivitas antibakteri bakteriosin dari BAL.
Sampel Bakteri
patogen
Diameter zona hambat rata-rata(mm) ± SD (n=3) hari ke-
0 7 14 21 28 A S. aureus E. coli 8,10 ± 0,39 8,02 ± 0,38 7,75 ± 0,14 7,51 ± 0,34 7,26 ± 0,08(*) 7,45 ± 0,31 7,39 ± 0,44 7,05 ± 0,21 6,67 ± 0,07 6,36 ± 0,08(*) B S. aureus E. coli 8,15 ± 0,25 8,06 ± 0,38 7,91 ± 0,54 7,70 ± 0,28 7,54 ± 0,33 7,62 ± 0,37 7,37 ± 0,21 7,18 ± 0,14 6,87 ± 0,18 6,56 ± 0,25(*) C S. aureus E. coli 8,07 ± 0,57 8,03 ± 0,80 7,93 ± 0,36 7,87 ± 0,77 7,71 ± 0,75 7,54 ± 0,22 7,24 ± 0,10 7,08 ± 0,30 6,92 ± 0,20 6,85 ± 0,38 D S. aureus E. coli 8,08 ± 0,40 8,00 ± 0,16 7,95 ± 0,16 7,71 ± 0,81 7,52 ± 0,28 7,56 ± 0,18 7,26 ± 0,96 7,10 ± 0,34 6,94 ± 0,21 6,88 ± 0,38 Kontrol (+) S. aureus E. coli 21,09 ± 0,56 21,34 ± 0,85 Kontrol (-) S. aureus E. coli 6,00 ± 0,00 6,00 ± 0,00
Gambar 4.13 Pengaruh penyimpanan pada suhu 28oC terhadap aktivitas antibakteri bakteriosin dari BAL.
Keterangan: A (Lacto B); B (Rillus); C (Interlac); D (Lacbon); K(+) kontrol positif: Tetrasiklin HCl 30 µg; K (-) kontrol negatif: Akuades; 4.00 8.00 12.00 16.00 20.00 24.00 0 7 14 21 28 Dia mete r zona ha mbat ( mm )
Waktu simpan (hari)
K(+)Sa K(+)Ec K(-) Aa Ab Ba Bb Ca Cb Da Db
Sa (S. aureus); Ec (E.coli); a (S. aureus), b (E. coli), (*) berbeda secara signifikan.
Aktivitas antibakteri bakteriosin dari BAL pada setiap sampel yang disimpan pada suhu 4oC selama 28 hari tidak menunjukkan perbedaan yang signifikan terhadap bakteri S. aureus dan E. coli. Berbeda dengan penyimpanan yang dilakukan pada suhu 28oC selama 28 hari. Aktivitas antibakteri bakteriosin dari BAL pada sampel A turun secara signifikan terhadap bakteri S. aureus dan E. coli dan aktivitas antibakteri bakteriosin dari BAL pada sampel B turun secara signifikan hanya terhadap bakteri E. coli, meskipun aktivitas antibakteri bakteriosin dari sampel C dan D tidak turun secara signifikan terhadap bakteri S. aureus dan E. coli.
Aktivitas antibakteri bakteriosin L. acidophilus dari biakan murni yang di
simpan pada suhu 4oC tetap memberikan efek yang sama terhadap bakteri S. aureus dan E. coli selama 30 hari. Begitu juga dengan aktivitas antibakteri
bakteriosin Lactobacillus sp. dari sampel dadih, keju dan tablet Sporolac tetap memberikan hasil yang sama terhadap bakteri S. aureus saat disimpan pada suhu 4oC selama 2 bulan (Abdelsamei, et al., 2015; Rawal, et al., 2013).
Aktivitas antibakteri bakteriosin dari BAL pada sediaan sereal OGI yang
disimpan pada suhu 28oC selama 7 hari meningkat terhadap bakteri patogen S. aureus yaitu dari 2 mm menjadi 5 mm pada pengenceran 10-1 dan dari 1 mm
menjadi 3 mm pada pengenceran 10-2. Aktivitas antibakteri bakteriosin menurun terhadap bakteri patogen E. coli yaitu dari 5 mm menjadi 1 mm pada pengenceran 10-1 dan dari 3 mm menjadi tidak memiliki aktivitas pada pengenceran 10-2 (Ohenhen, et al., 2015).
Secara keseluruhan, aktivitas antibakteri bakteriosin dari BAL pada sediaan probiotik yang disimpan pada suhu 4oC dan 28oC memiliki potensi aktivitas
antibakteri sedang (diameter antara 5-10 mm) terhadap bakteri S. aureus dan bakteri E. coli. Potensi aktivitas antibakteri ini sangat berbeda jika dibandingkan dengan diameter kontrol positif Tetrasiklin HCl 30 µg yang memiliki potensi antibakteri sangat kuat terhadap bakteri S. aureus dan terhadap bakteri E. coli dengan diameter rata-rata 21 mm (Wardani, 2015). Suhu 4oC merupakan suhu terbaik untuk mempertahankan aktivitas antibakteri bakteriosin dari BAL pada sampel probiotik (Rawal, et al., 2013).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Jumlah koloni BAL dari sampel A (Lacto B): mengandung L. acidophilus tidak sesuai label sedangkan jumlah koloni BAL dari sampel B (Rillus): mengandung L. plantarum, C (Interlac): mengandung L. reuteri, dan sampel D (Lacbon): mengandung L. sporogenes) sesuai label.
b. Penyimpanan pada suhu 4oC selama 28 hari mempertahankan viabilitas seluruh BAL sedangkan penyimpanan pada suhu 28oC selama 28 hari menyebabkan viabilitas BAL dari sampel C turun secara yang signifikan. Penyimpanan pada suhu 4oC dan 28oC selama 28 hari tetap menunjukkan daya hambat yang baik dari inokulum dan supernatan BAL dari sampel A, B, C dan D.
c. Penyimpanan pada suhu 28oC selama 28 hari menyebabkan aktivitas antibakteri bakteriosin dari BAL pada sampel A turun secara signifikan terhadap bakteri S. aureus ATCC 6538 dan E. coli ATCC 8939, dan BAL dari sampel B turun secara signifikan terhadap bakteri E. coli ATCC 8939.
5.2 Saran
Diharapkan melakukan penyimpanan pada suhu 4oC (dalam refrigerator) terhadap sediaan probiotik terutama jenis A, B, C dan D untuk mempertahankan viabilitas dan aktivitas antibakteri bakteriosin terhadap bakteri patogen S. aureus dan E. coli. Kepada peneliti selanjutnya agar melakukan uji terhadap faktor-faktor lain yang mempengaruhi viabilitas dan aktivitas antibakteri bakteriosin dari BAL.