commit to user
DETEKSI VIRUS HEPATITIS C PADA KOMUNITAS GIGOLO SURAKARTA MENGGUNAKAN NESTED PCR YANG MENGAMPLIFIKASI
SEBAGIAN REGIO NS5B
SKRIPSI
Untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran
Wike Astrid Cahayani G.0008023
FAKULTAS KEDOKTERAN UNIVERSITAS SEBELAS MARET
Surakarta 2011
commit to user 1 BAB I PENDAHULUAN
A. Latar Belakang Masalah
Infeksi yang disebabkan Virus Hepatitis C (HCV) telah menjadi beban kesehatan masyarakat. Diperkirakan 170 juta orang terinfeksi HCV di seluruh dunia (Chevaliez et al., 2009). Dalam kurun waktu 20-30 tahun, sekitar 80% dari kasus tersebut berkembang menjadi infeksi hepatitis C kronis yang dapat menyebabkan sirosis hati dan karsinoma hepatoseluler (Alter, 2007). Selain itu, angka kejadian infeksi hepatitis C di Indonesia hampir 2,4% dari seluruh penduduk (WHO, 2003). Adanya koinfeksi HCV pada pasien HIV (Human Immunodeficiency Virus) positif juga menimbulkan masalah baru karena dapat mempercepat penurunan sistem imunitas tubuh, terutama oleh infeksi HCV genotipe 1 (Balogun et al., 2010).
Saat terjadi infeksi hepatitis C akut, gejala pada penderita seringkali tidak tampak sehingga terjadi keterlambatan diagnosis (Alter, 2007). Padahal, infeksi hepatitis C akut dapat berkembang menjadi kronis sehingga dapat meningkatkan mortalitas dan morbiditas (Alter, 2007; Schnuriger et al., 2006). Oleh karena itu, deteksi dini terhadap infeksi hepatitis C berperan penting dalam mencegah penularan lebih lanjut, khususnya pada kelompok dengan risiko tinggi. Deteksi dini juga bermanfaat membantu tenaga kesehatan dalam menentukan diagnosis serta penatalaksanaan yang sesuai, sehingga kasus infeksi hepatitis C dapat diatasi seawal mungkin (Schnuriger et al., 2006).
commit to user
Pada umumnya, kelompok yang memiliki risiko tinggi tertular infeksi hepatitis C pernah menggunakan narkotika suntik, memiliki tato atau tindik, dan seseorang dengan HIV/AIDS (Albeldawi et al., 2010; Jafari et al., 2010). Adapun riwayat berhubungan seksual dengan banyak pasangan, dikategorikan sebagai faktor risiko rendah (Albeldawi et al., 2010). Meskipun tergolong berisiko rendah, aktivitas seksual merupakan aktivitas yang umum, sehingga penularan HCV dapat terjadi secara lebih luas. Di Amerika Serikat misalnya, kelompok dengan pasangan seksual lebih dari 50 orang memiliki prevalensi anti-HCV 5% lebih besar dibandingkan kelompok dengan pasangan seksual kurang dari 50 orang (Armstrong et al., 2006). Selain itu, kasus koinfeksi HCV pada pasien HIV juga meningkat pada kelompok yang memiliki aktivitas seksual berisiko tinggi dan menggunakan jarum suntik (Operskalski dan Kovacs, 2011).
Berkaitan dengan permasalahan tersebut, alasan dipilihnya komunitas pekerja seks komersial pria (gigolo) di Surakarta dalam penelitian ini karena mereka aktif secara seksual. Perilaku aktif secara seksual dalam komunitas gigolo tidak hanya dengan pasangan wanita, tetapi juga dengan pria dan transgender (Baral et al., 2010; dos Ramos Farías et al., 2011). Di samping memiliki perilaku seksual yang berisiko, komunitas gigolo juga mempunyai perilaku berisiko tinggi lain yang mempermudah penyebaran infeksi HCV, seperti penggunaan narkotika suntik, tato, dan tindik (Baral et al., 2010; Estcourt et al., 2000). Hal ini menjadikan mereka sebagai subjek penelitian yang unik serta lebih rentan terinfeksi hepatitis C dibandingkan pekerja seks komersial wanita (dos Ramos Farías et al., 2011; Estcourt et al., 2000).
commit to user
Selain pengetahuan tentang faktor risiko penularan, pemahaman akan identifikasi genotipe dan subtipe HCV juga dibutuhkan dalam mempelajari epidemiologi tentang HCV. Regio NS5B diamplifikasi karena memiliki karakter yang sangat informatif serta heterogen (Baclig et al., 2010; Cantaloube et al., 2006). Hasil penelitian Cantaloube et al. (2006) dan Murphy et al. (2007) memperlihatkan bahwa NS5B mampu membedakan HCV subtipe 1a dari subtipe 1b dalam lebih dari 90% kasus. Dengan demikian, regio NS5B berpotensi memfasilitasi identifikasi subtipe HCV secara lebih akurat. Identifikasi subtipe HCV ini bermanfaat sebagai langkah awal dalam studi epidemiologi molekuler mengenai strain HCV yang beredar di Indonesia.
Studi ini merupakan bagian dari penelitian payung epidemologi molekuler Human Blood Borne Viruses yang dilakukan oleh Laboratorium Mikrobiologi Fakultas Kedokteran UNS, bekerja sama dengan Laboratorium Biomedik Fakultas Kedokteran UNS dan Division of Virology Faculty of Medicine Tottori University Japan. Kerjasama penelitian tersebut berupa penelitian epidemiologi molekular yang difokuskan terhadap Human Immunodeficiency Virus, Hepatitis B Virus, Hepatitis C Virus, Hepatitis D Virus, Human T-Lymphotropic Virus 1/2, dan Torque Teno Virus di Indonesia. Berkaitan dengan studi tersebut, produk Polymerase Chain Reaction (PCR) yang dihasilkan akan disekuensing dan dianalisis secara molekuler. Namun, dalam skripsi ini hanya dilaporkan data epidemiologi dan hasil pemeriksaan serologi molekuler HCV dan tidak dilakukan sekuensing genom maupun analisis molekulernya.
commit to user B. Perumusan Masalah
Bagaimanakah virus hepatitis C pada komunitas gigolo di Surakarta menggunakan Nested PCR yang mengamplifikasi sebagian regio NS5B?
C. Tujuan Penelitian
Tujuan jangka pendek dari penelitian ini adalah memperoleh data awal epidemiologi infeksi hepatitis C pada komunitas gigolo di Surakarta. Data awal ini diharapkan dapat digunakan untuk membuat kebijakan di bidang kesehatan dalam rangka mengeradikasi infeksi hepatitis C.
Adapun tujuan jangka panjang dari penelitian ini adalah mengetahui profil epidemiologi dan strain human blood borne viruses (khususnya HCV) yang beredar di Indonesia, sekaligus untuk pengumpulan isolat virus yang dapat digunakan untuk studi lanjutan HCV di bidang patogenesis, diagnosis, terapi, dan vaksin.
D. Manfaat Penelitian 1. Manfaat Teoritis
Penelitian ini dapat memberikan informasi tentang epidemiologi HCV pada komunitas gigolo di Surakarta.
2. Manfaat Praktis
Manfaat praktis penelitian ini adalah diperolehnya data awal mengenai infeksi hepatitis C yang dapat digunakan oleh petugas maupun dinas kesehatan dalam melaksanakan program preventif, diagnosis, maupun kuratif terhadap infeksi hepatitis C, khususnya pada komunitas gigolo.
commit to user 5 BAB II LANDASAN TEORI A. Tinjauan Pustaka 1. Virus Hepatitis C (HCV) a. Klasifikasi HCV
HCV termasuk dalam famili Flaviviridae dan genus Hepacivirus (ICTVdB, 2006). HCV dapat diklasifikasikan dalam beberapa genotipe dan subtipe berdasarkan susunan gennya. Genotipe HCV dibedakan antara satu dengan lainnya berdasarkan 31-33% perbedaan urutan nukleotida, sedangkan subtipe dibedakan berdasarkan 20-25% perbedaan urutan nukleotida (Simmonds et al., 2005). Saat ini terdapat tujuh genotipe HCV yang diklasifikasikan menjadi beberapa subtipe, yaitu a, b, c, d, dan seterusnya (Sharma, 2010; Simmonds et al., 2005).
b. Morfologi dan Komponen HCV
HCV termasuk virus yang berukuran kecil (kurang lebih 55-65 nm), berbentuk sferis, dan memiliki selubung glikoprotein (Sharma, 2010). Genom HCV merupakan RNA rantai tunggal positif sepanjang 9,6 kb dengan daerah Open Reading Frame (ORF) yang diapit oleh 5’-Untranslated Region (UTR) dan 3’-UTR (Lemon et al, 2007).
Poliprotein HCV yang dihasilkan secara fungsional dapat dibagi menjadi tiga daerah, yaitu terminal, tengah, dan C-terminal. Daerah N-terminal diasosiasikan sebagai protein struktural, yaitu protein inti (core/C),
commit to user
envelope glycoprotein 1 dan 2 (E1 dan E2). Daerah tengah terdiri atas protein p7 dan NS2. Daerah C-terminal terdiri atas protein nonstruktural (NS3, NS4A, NS4B, NS5A, dan NS5B) yang berfungsi penting dalam replikasi RNA (Lemon et al, 2007; Sharma, 2010).
Ujung 5’-UTR diketahui sangat terkonservasi dan telah digunakan dalam deteksi HCV secara klinis (Simmonds et al., 2005). Meskipun demikian, regio ini tidak mampu mendiskriminasi subtipe secara akurat. Di sisi lain, terdapat regio NS5B yang lebih potensial dalam membedakan subtipe HCV dibandingkan 5’UTR. Heterogenitas pada sekuens NS5B lebih banyak, sehingga NS5B memiliki akurasi yang lebih tinggi dalam mendeteksi subtipe HCV (Baclig et al, 2010).
2. Hepatitis C pada Pekerja Seks Komersial Pria (Gigolo)
Kelompok yang berisiko terhadap penularan infeksi HCV dapat diklasifikasikan menjadi tiga kelompok, yaitu kelompok dengan risiko tinggi, sedang, dan rendah (Albeldawi et al., 2010, Jafari et al., 2010). Kelompok risiko tinggi meliputi pengguna narkotika suntik, penderita hemofilia, penderita HIV, serta pengguna tato dan tindik. Kelompok dengan risiko sedang meliputi resipien transfusi darah, resipien transplantasi organ, dan bayi yang dilahirkan oleh ibu dengan infeksi hepatitis C. Kelompok dengan risiko rendah terdiri atas kelompok yang memiliki banyak pasangan seksual atau berhubungan seksual dengan orang yang terinfeksi hepatitis C, serta pekerja kesehatan yang terpapar HCV melalui jarum suntik.
commit to user
Penggunaan narkotika suntik dilaporkan sebagai rute utama yang berperan dalam penularan infeksi HCV (Albeldawi et al., 2010; Roy et al., 2001). Studi meta-analisis yang dikemukakan oleh Hagan et al. (2011) menyebutkan bahwa prevalensi infeksi HCV pada pengguna narkotika suntik bervariasi antara 40-90%. Jumlah ini jauh lebih besar dibandingkan prevalensi infeksi HCV pada pengguna narkotika nonsuntik yang hanya berkisar 5% (Fuller et al., 2004). Terkait dengan komunitas gigolo, Baral et al. (2010), menemukan sebanyak 8% dari 50 gigolo di Moscow, Rusia, merupakan pengguna narkotika suntik. Adapun di Australia, studi terhadap komunitas yang sama menemukan 17% (16/94) gigolo dengan anti-HCV positif memiliki riwayat sebagai pengguna narkotika suntik (Estcourt et al., 2000).
Tato dan tindik merupakan faktor risiko tinggi lain dalam penularan infeksi hepatitis C (Jafari et al., 2010; Roy et al., 2001). Pada penelitian Roy et al. (2001), di antara 247 remaja jalanan di Kanada yang memiliki setidaknya satu tato pada tubuh mereka, 10,3% positif anti-HCV, sedangkan di antara 342 remaja yang memiliki satu tindik atau lebih, 13,5% positif anti-HCV. Prevalensi anti-HCV positif tersebut lebih besar dibandingkan angka seropositif HCV pada remaja yang tidak menggunakan tato dan tindik, yaitu hanya 6,7% dari 284 remaja (Roy et al., 2001). Mengenai studi di Indonesia, sejauh yang peneliti ketahui belum terdapat studi yang mengobservasi faktor risiko penggunaan narkotika suntik, tato, maupun tindik pada komunitas gigolo.
Di samping risiko terinfeksi HCV melalui penggunaan narkotika suntik, tato, dan tindik, komunitas gigolo juga rentan tertular HCV terkait aktivitas
commit to user
seksual mereka. Penelitian tentang transmisi HCV melalui hubungan seksual pada masyarakat umum dikemukakan oleh Kao et al. (2000) yang menemukan adanya risiko penularan infeksi HCV di antara pasangan suami istri. Penelitian lain juga mendapati kasus hepatitis C akut pada seorang istri yang telah menikah selama 30 tahun dengan suami yang terinfeksi hepatitis C (Nishimura et al., 2010). Risiko penularan HCV melalui aktivitas seksual ini akan meningkat seiring bertambahnya jumlah pasangan seksual yang terlibat (Armstrong et al., 2006).
Adapun penelitian yang mengobservasi prevalensi HCV pada komunitas pekerja seks komersial terdapat dalam beberapa studi. Pada studi yang dilakukan terhadap 1.527 pekerja seks komersial wanita di Korea Selatan, didapatkan 1,4% partisipan dengan anti-HCV positif (Kweon et al., 2006). Semua subjek tidak memiliki riwayat HIV positif maupun menggunakan narkotika suntik. Penelitian serupa yang melibatkan 1.144 pekerja seks komersial wanita di Kongo menunjukkan adanya prevalensi anti-HCV sebesar 6,6% (Laurent et al., 2001). Studi lain yang dilakukan terhadap 625 pekerja seks komersial wanita di enam kota di Argentina menunjukkan prevalensi hepatitis C sebesar 4,3% (Pando et al., 2006).
Berbeda dengan penelitian pada pekerja seks komersial wanita, studi tentang prevalensi HCV pada komunitas gigolo masih terbatas. Pada penelitian Baral et al. (2010), 8% dari 50 gigolo di Moscow, Rusia, terinfeksi HCV. Sementara itu, prevalensi HCV pada gigolo di Argentina sebesar 6,1% dari 82 responden (dos Ramos Farías et al., 2011). Adapun di Indonesia, belum ada
commit to user
studi mengenai data epidemiologi HCV pada komunitas gigolo. Sejauh yang peneliti peroleh, terdapat satu penelitian terkait HCV pada komunitas pekerja seks di Indonesia, yaitu penelitian Basri et al. (2003) yang mengemukakan prevalensi anti-HCV sebesar 9,1% pada 33 orang pekerja seks komersial wanita di kota Padang.
3. Koinfeksi HCV dengan HIV
Hingga tahun 2007, diperkirakan 33 juta orang di dunia telah terinfeksi HIV. Di Indonesia, jumlah penduduk yang terinfeksi HIV diperkirakan meningkat menjadi 270.000 orang pada tahun 2007, di mana sebelumnya 93.000 orang pada tahun 2001 (UNAIDS, 2008). Dari seluruh orang yang terinfeksi HIV di dunia, sekitar 4-5 juta orang mengalami koinfeksi dengan HCV (Operskalski dan Kovacs, 2011). Adapun di Indonesia, belum terdapat data resmi mengenai prevalensi koinfeksi HCV dengan HIV.
Terdapat rute penularan infeksi HIV yang hampir sama dengan infeksi HCV, yaitu melalui penggunaan narkotika suntik dan hubungan seksual. Oleh karena itu, kejadian koinfeksi HCV dengan HIV sangat mungkin terjadi (Chen et al., 2011). Infeksi HIV berdampak signifikan terhadap riwayat alamiah penyakit hepatitis C. Koinfeksi HIV dengan HCV dapat mempercepat tingkat kerusakan hepar yang mengakibatkan elevasi ALT, mempercepat terjadinya sirosis hati, serta meningkatkan risiko karsinoma hepatoseluler (Chen et al., 2011; Thomas et al., 2000).
Terkait jalur penularan infeksi HIV dan HCV, terdapat koinfeksi HCV pada 72-95% pasien HIV positif dengan riwayat penggunaan narkotika suntik di
commit to user
Amerika Serikat dan beberapa negara Eropa serta Asia (Operskalski dan Kovacs, 2011). Penggunaan tato dengan cara yang tidak aman juga disinyalir berkontribusi dalam terjadinya koinfeksi HCV dengan HIV (Thomas et al., 2011). Akan tetapi, berbeda dengan penggunaan narkotika suntik, koinfeksi HCV terjadi kurang dari 15% pada populasi yang tertular HIV melalui hubungan seksual (Operskalski dan Kovacs, 2011; Thomas et al., 2011).
B. Kerangka Pemikiran
Data awal epidemiologi HCV pada komunitas gigolo di Surakarta Komunitas gigolo di Surakarta
Faktor risiko transmisi HCV: 1. Aktivitas seksual dengan lebih
dari satu pasangan
2. Penggunaan narkotika suntik 3. Tato
4. Tindik
(Albeldawi et al., 2010; Armstrong et al., 2006; Baral et al., 2010; dos Ramos Farías et al., 2011; Jafari et al., 2010; Roy et al., 2001)
Skrining anti-HCV
Anti-HCV negatif
Amplifikasi sebagian genom HCV NS5B dengan Nested PCR
Anti-HCV positif
commit to user 11 BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini merupakan penelitian eksploratif dengan pendekatan cross-sectional.
B. Lokasi penelitian
Deteksi serologi dilaksanakan di Laboratorium Mikrobiologi dan deteksi molekuler dilakukan di Laboratorium Biomedik Fakultas Kedokteran Universitas Sebelas Maret.
C. Subjek Penelitian
Subjek yang digunakan dalam penelitian ini adalah komunitas gigolo di Surakarta. Subjek yang bersedia menandatangani surat persetujuan menjadi partisipan studi serta informed consent untuk semua tindakan yang akan dilakukan, dilibatkan dalam penelitian ini. Penelitian ini telah mendapatkan ethical clearance dari Komisi Etik Penelitian Fakultas Kedokteran Universitas Sebelas Maret Surakarta/RSUD Dr. Moewardi Surakarta.
D. Teknik Sampling
Teknik sampling yang digunakan dalam penelitian ini adalah non probability sampling, menggunakan teknik quota sampling dengan jumlah sampel 30 orang.
commit to user E. Alur Kerja Penelitian
Sampel darah
Skrining dengan kit Ortho HCV Ab PA II®
Anti-HCV positif Anti-HCV negatif Sintesis cDNA Nested PCR Elektroforesis Fraksinasi Aliquot Plasma
Isolasi RNA HCV dari aliquot plasma
F. Instrumentasi Penelitian 1. Alat penelitian
a. Centrifuge (Eppendorf, Hamburg, Deutschland)
b. Mastercycler Personal® PCR (Eppendorf, Hamburg, Deutschland) c. Micropipette (P1000, P200, P10) (Gilson, Middleton, WI)
d. Vortex (Thermo Fisher Scientific, Worcester, MA) e. Digital scale (Mettler Toledo, Greifensee, Switzerland) f. Autoclave (Hirayama, Saitama, Japan)
commit to user h. Magnetic stirrer (Biomega, Redding, CA)
i. Deepfreezer (New Brunswick Scientific, Edison, NJ)
j. Aparatus elektroforesis (chamber, comb, dan power supply) (BioRad, Los Angeles, CA)
k. Gel DocTM XR (Bio-Rad, Hercules, CA) l. Refrigerator (Sharp, Osaka, Japan)
m. Class II safety cabinet (ESCO, Portland, OR) n. Tube rack
o. Beaker glass 2. Bahan penelitian
a. Filter tips RNase/DNase pyrogen free (10 l, 200 l, dan 1000 l) b. Microcentrifuge tube 1,5 ml
c. PCR tube dan PCR cap
d. Polypropylene (PP) tube 15 ml
e. F96 MicroWell™ Plates (Nunc, Rochester, NY) f. Sarung tangan
g. Masker h. Kertas tisu
i. Bufer Tris-EDTA (TE) pH 8 j. Etidium bromida (EtBr) 0,5 μg/ml k. Agarose
l. Bufer TAE (Tris-acetate EDTA) 1 x (Promega, Madison, WI) m. Primer oligonukleotida (primer forward dan primer backward)
commit to user n. Etanol 70% dan 96%
o. Kit Ortho HCV Ab PA II® (Fujirebio, Tokyo, Japan)
p. Kit PureLink™ Viral RNA/DNA (Invitrogen, Carlsbad, CA)
q. Kit SuperScript™ First-Strand Synthesis System Mix (Invitrogen, Carlsbad, CA)
r. Kit Platinum® PCR SuperMix (Invitrogen, Carlsbad, CA)
s. Loading Quick® λ/Hind III digest, DNA-110 (Toyobo, Osaka, Japan) t. Loading Quick® ϕX174/Hae III digest, DNA-112 (Toyobo, Osaka, Japan) G. Cara Kerja
1. Fraksinasi Plasma Darah
Sampel darah disentrifugasi pada kecepatan 3.000 rpm selama 15 menit. Setelah itu, diperoleh tiga lapisan pada tabung. Lapisan pertama adalah plasma darah, lapisan kedua merupakan peripheral blood mononuclear cell (PBMC), dan lapisan ketiga adalah red blood cell (RBC). Plasma darah pada lapisan pertama diambil sebanyak mungkin tanpa mengenai dua lapisan di bawahnya, kemudian dibuat aliquot. Sebagian aliquot dipergunakan langsung untuk skrining dan sebagian lain disimpan pada suhu –80°C.
2. Pemeriksaan Serologi HCV
Pemeriksaan serologi sampel darah untuk anti-HCV menggunakan kit Ortho HCV Ab PA II® (Fujirebio). Satu mililiter reconstituting solution dimasukkan ke dalam tabung control particles lyophilized, kemudian dicampur menggunakan micropipette. Setelah itu, F96 MicroWell™Plates (Nunc) disiapkan untuk particle agglutination assay dan digunakan tiga well untuk
commit to user
setiap sampel yang diperiksa. Dari ketiga well tersebut, pada well ke-1 dimasukkan 75 µl sample diluent, sedangkan pada well ke-2 dan ke-3 masing-masing dimasukkan 25 µl sample diluent. Plasma darah sebanyak 25 µl dimasukkan ke dalam well ke-1 dan dicampur menggunakan micropipette. Selanjutnya, transfer antar well dilakukan sebagai berikut: 25 µl larutan diambil dari well ke-1, dimasukkan ke dalam well ke-2 dan dicampur menggunakan micropipette; 25 µl larutan diambil dari well ke-2, dimasukkan ke dalam well ke-3 dan dicampur menggunakan micropipette; dari well ke-3 diambil 25 µl larutan kemudian dibuang ke tempat sampah infeksius. Selanjutnya, 25 µl control particle dimasukkan ke dalam well ke-2 dan 25 µl sensitized particle dimasukkan ke dalam well ke-3. F96 MicroWell™Plates (Nunc) ditutup dengan plastik dan diinkubasi selama dua jam pada suhu ruang. Setelah dua jam, pola aglutinasi yang terjadi di dasar well diinterpretasi sebagai berikut:
a. Positif dua (++): partikel yang teraglutinasi menyebar secara seragam di dasar well dan dikelilingi lingkaran merah.
b. Positif satu (+): partikel membentuk pola cincin dengan garis terluar terlihat kasar dan tidak teratur, serta dikelilingi lingkaran merah kecil. c. Positif negatif (+-): partikel membentuk pola cincin bergaris luar halus
dengan lubang di tengah. Pada hasil seperti ini, dilakukan pemeriksaan ulang.
commit to user
d. Negatif (-): partikel membentuk titik di tengah dasar well dengan garis luar halus, atau partikel membentuk pola cincin dengan lubang sangat kecil di tengahnya dan bergaris luar halus.
3. Isolasi Asam Nukleat
Isolasi asam nukleat menggunakan kit PureLink™ Viral RNA/DNA (Invitrogen).
a. Preparasi lisat untuk volume plasma 200 μl.
Dua puluh lima mikroliter Proteinase K, 200 μl cell-free sample, dan 200 μl Lysis Buffer dimasukkan ke dalam microcentrifuge tube steril. Setelah itu, microcentrifuge tube ditutup dan di-vortex selama 15 detik. Kemudian, lisat diinkubasi pada suhu 56°C selama 15 menit. Proses presipitasi dilakukan dengan menambahkan 250 μl 96% etanol ke dalam tabung. Selanjutnya, tabung ditutup dan di-vortex selama 15 detik. Lisat diinkubasi pada suhu ruang selama lima menit.
b. Purifikasi lisat.
Lisat dipindahkan dari microcentrifuge tube ke Viral Spin Column dalam tabung koleksi dan disentrifugasi pada 6.000 rpm selama satu menit. Selanjutnya, cairan bersama tabung koleksi dibuang dan spin column ditempatkan dalam Wash Tube baru. Spin column dicuci dengan 500 μl Wash Buffer (W5) dan disentrifugasi pada kecepatan 6.000 rpm selama satu menit. Cairan yang tertampung dalam Wash Tube dibuang dan Wash Tube digunakan kembali. Spin column dicuci kembali dengan 500 μl Wash Buffer (W5). Setelah itu, spin column diletakkan dalam Wash Tube baru dan
commit to user
disentrifugasi pada 14.000 rpm selama satu menit untuk membuang sisa Wash Buffer (W5). Kemudian, spin column diletakkan dalam 1,7 ml Recovery Tube dan dielusi dengan 50 μl TE. Spin column diinkubasi pada suhu ruang selama satu menit, kemudian disentrifugasi pada 14.000 rpm selama satu menit. Setelah langkah tersebut, Recovery Tube berisi asam nukleat virus murni sehingga spin column dapat dibuang. Asam nukleat murni selanjutnya dapat disimpan pada suhu -80°C atau digunakan untuk tahap berikutnya (Invitrogen, 2006).
4. Sintesis cDNA
Sintesis cDNA dari RNA menggunakan kit SuperScript™ First-Strand Synthesis System Mix (Invitrogen). Enam mikroliter asam nukleat (RNA), 1 μl primer random hexamer, dan 1 μl Annealing Buffer dimasukkan ke dalam PCR tube, kemudian diinkubasi pada suhu 65°C selama lima menit. Setelah itu, campuran reaksi didinginkan pada suhu 4°C selama satu menit dan di-spin down. Berikutnya, 10 μl 2X First-Strand Reaction Mix dan 2 μl SuperScript® III/RNaseOUT™ Enzyme Mix ditambahkan ke dalam PCR tube, dicampur menggunakan micropipette, kemudian di-spin down. Inkubasi dilakukan selama 50 menit pada suhu 50°C dan reaksi diakhiri pada suhu 85°C selama lima menit. Setelah didinginkan pada suhu 4°C, cDNA ini dapat disimpan pada suhu –20°C atau langsung digunakan untuk PCR (Life Technologies, 2010).
commit to user
5. Amplifikasi Sebagian Regio NS5B dengan Nested PCR
Nested PCR dilakukan menggunakan kit Platinum® PCR SuperMix (Invitrogen). Pasangan primer oligonukleotida yang digunakan untuk mengamplifikasi sebagian regio NS5B adalah hep31b, sense outer (5’-TGG GST TCT CDT ATG AYA CC-3’); hep32, antisense outer (5’-GCD GAR TAC CTG GTC ATA GC-3’); hep33b, sense inner (5’-AYA CCC GMT GYT TTG ACT C-3’); hep34b, antisense inner (5’-CCT CCG TGA AKR CTC KCA G-3’). Kode huruf standar yang digunakan sebagai alternatif basa adalah D = A, G, atau T; K = G atau T; M = A atau C; R = A atau G; S = C atau G; dan Y = C atau T.
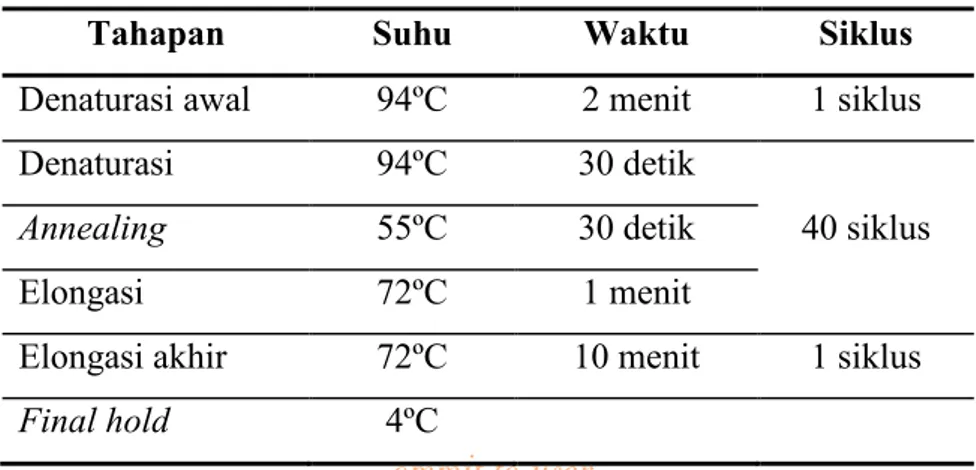
Prosedur amplifikasi sebagian regio NS5B dengan Nested PCR dimulai dengan mencairkan Platinum® PCR SuperMix (Invitrogen) pada suhu kamar, kemudian dilakukan spin down. Selanjutnya, 4,5 μl cDNA ditambahkan pada 22,5 μl Platinum® PCR SuperMix (Invitrogen), 0,57 μl primer forward (hep31b), dan 0,57 μl primer backward (hep32). Tahapan siklus Nested PCR putaran pertama terdapat pada tabel 1.
Tabel 1. Tahapan Siklus Nested PCR Putaran Pertama.
Tahapan Suhu Waktu Siklus
Denaturasi awal 94ºC 2 menit 1 siklus
Denaturasi 94ºC 30 detik
40 siklus Annealing 55ºC 30 detik
Elongasi 72ºC 1 menit
Elongasi akhir 72ºC 10 menit 1 siklus Final hold 4ºC
commit to user
Selanjutnya, diambil 2,5 μl produk PCR putaran pertama dan ditambahkan pada 22,5 μl Platinum® PCR SuperMix (Invitrogen), 0,53 μl primer forward (hep33b), dan 0,53 μl primer backward (hep34b). Tahapan siklus Nested PCR putaran kedua terdapat pada tabel 2. Ukuran produk PCR yang didapatkan dari Nested PCR putaran kedua adalah 328 bp.
Tabel 2. Tahapan Siklus Nested PCR Putaran Kedua.
Tahapan Suhu Waktu Siklus
Denaturasi awal 94ºC 2 menit 1 siklus
Denaturasi 94ºC 30 detik
40 siklus Annealing 60ºC 30 detik
Elongasi 72ºC 1 menit
Elongasi akhir 72ºC 10 menit 1 siklus Final hold 4ºC
(White et al., 2000). 6. Elektroforesis
Analisis produk Nested PCR dilakukan dengan elektroforesis pada agarose 1,5% dalam larutan TAE. Untuk membuat 200 ml larutan agarose 1,5%, 3 gram agarose dimasukkan ke dalam beaker glass, kemudian ditambahkan 1xTAE hingga 200 ml. Agarose tersebut dicairkan, setelah itu dicampur menggunakan magnetic stirrer dalam keadaan panas dan didinginkan hingga 55ºC sebelum dituangkan. EtBr ditambahkan hingga mencapai konsentrasi 0,5 μg/ml, kemudian dicampur menggunakan magnetic stirrer. Selanjutnya, agarose dituangkan ke dalam gel tray yang sudah dipasangi comb dan didiamkan pada suhu kamar selama 15-20 menit sampai menjadi padat. Setelah padat, comb diambil secara hati-hati, lalu gel diletakkan
commit to user
ke dalam electrophoresis chamber dan digenangi (sampai cukup tergenang) dengan bufer TAE. Kemudian, 5 μl Loading Quick® λ/Hind III digest, DNA-110 (Toyobo) dimasukkan ke dalam sumur pertama dan 5 μl Loading Quick® ϕX174/Hae III digest, DNA-112 (Toyobo) dimasukkan ke dalam sumur kedua, dilanjutkan 2,5 l produk Nested PCR ke dalam sumur berikutnya secara urut sesuai nomor sampel. Elektroforesis dilakukan pada voltase 100 Volt selama 30 menit (Prasetyo, 2011).
H. Analisis Data
Analisis data terkait faktor risiko dan hasil pemeriksaan Nested PCR disajikan dalam bentuk deskriptif.
commit to user 21 BAB IV
HASIL PENELITIAN
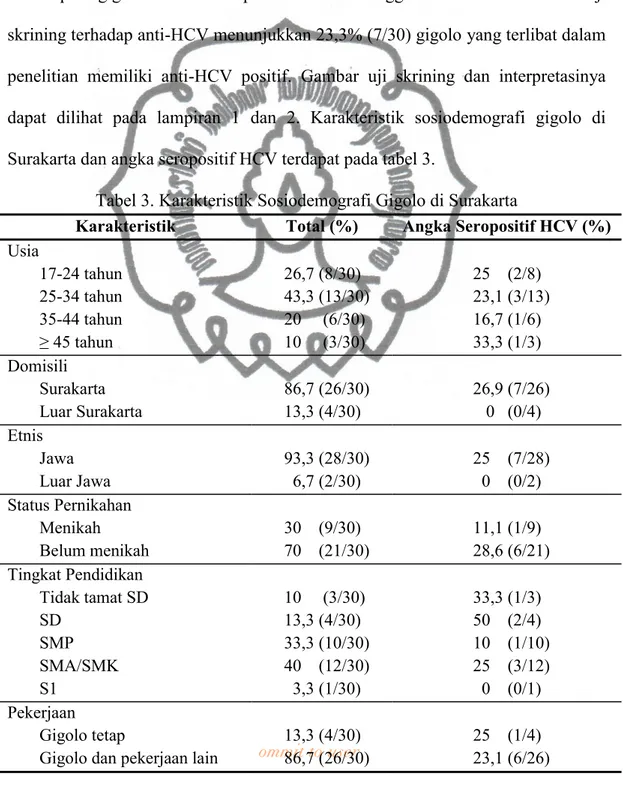
Dalam penelitian ini, telah dilakukan wawancara dan pemeriksaan darah terhadap 30 gigolo di Surakarta pada bulan Mei hingga Juni tahun 2011. Hasil uji skrining terhadap anti-HCV menunjukkan 23,3% (7/30) gigolo yang terlibat dalam penelitian memiliki anti-HCV positif. Gambar uji skrining dan interpretasinya dapat dilihat pada lampiran 1 dan 2. Karakteristik sosiodemografi gigolo di Surakarta dan angka seropositif HCV terdapat pada tabel 3.
Tabel 3. Karakteristik Sosiodemografi Gigolo di Surakarta
Karakteristik Total (%) Angka Seropositif HCV (%)
Usia 17-24 tahun 25-34 tahun 35-44 tahun ≥ 45 tahun 26,7 (8/30) 43,3 (13/30) 20 (6/30) 10 (3/30) 25 (2/8) 23,1 (3/13) 16,7 (1/6) 33,3 (1/3) Domisili Surakarta Luar Surakarta 86,7 (26/30) 13,3 (4/30) 26,9 (7/26) 0 (0/4) Etnis Jawa Luar Jawa 93,3 (28/30) 6,7 (2/30) 25 (7/28) 0 (0/2) Status Pernikahan Menikah Belum menikah 30 (9/30) 70 (21/30) 11,1 (1/9) 28,6 (6/21) Tingkat Pendidikan Tidak tamat SD SD SMP SMA/SMK S1 10 (3/30) 13,3 (4/30) 33,3 (10/30) 40 (12/30) 3,3 (1/30) 33,3 (1/3) 50 (2/4) 10 (1/10) 25 (3/12) 0 (0/1) Pekerjaan Gigolo tetap
Gigolo dan pekerjaan lain
13,3 (4/30) 86,7 (26/30)
25 (1/4) 23,1 (6/26)
commit to user
Faktor risiko penularan HCV yang diteliti dalam skripsi ini adalah aktivitas seksual gigolo dengan lebih dari satu pasangan seksual, penggunaan narkotika suntik, tato, dan tindik. Secara keseluruhan, faktor risiko transmisi HCV pada gigolo di Surakarta dan angka seropositif HCV terangkum dalam tabel 4.
Tabel 4. Faktor Risiko Penularan HCV pada Komunitas Gigolo di Surakarta Faktor Risiko Total (orang)
n = 30
Positif HCV (orang)
Angka Seropositif HCV (%) Aktivitas seksual dengan
lebih dari satu pasangan 30 7 23,3
Penggunaan narkotika Suntik Nonsuntik Tidak menggunakan 7 1 6 23 3 1 2 4 42,9 100 33,3 17,4 Tato Steril Tidak steril Tidak tahu Tidak memiliki 7 1 6 0 23 2 0 2 0 5 28,6 0 33,3 0 21,7 Penggunaan tindik Steril Tidak steril Tidak tahu Tidak menggunakan 11 2 6 3 19 4 1 1 2 3 36,4 50 16,7 66,7 15,8
Dari ketujuh gigolo dengan anti-HCV positif, ada yang mempunyai satu faktor risiko transmisi HCV dan ada juga yang memiliki lebih dari satu faktor risiko. Berikut gambaran faktor risiko transmisi HCV yang terdapat pada gigolo dengan anti-HCV positif (Tabel 5).
commit to user
Tabel 5. Faktor Risiko Transmisi HCV pada Gigolo dengan Anti-HCV Positif Responden
dengan Anti-HCV Positif
Faktor Risiko
Aktivitas Seksual dengan Lebih dari
Satu Pasangan Riwayat Penggunaan Narkotika Suntik Riwayat Penggunaan Tato Riwayat Penggunaan Tindik AK1911052503 – – AK1911053003 – – – AK1911053104 – – AK1911053106 – – AK1911060803 – – – AK1911060804 – – AK1911060805 Keterangan:
= memiliki faktor risiko – = tidak memiliki faktor risiko
Terdapat satu responden yang mengalami koinfeksi dengan HIV dari ketujuh responden dengan anti-HCV positif, yaitu responden AK1911053106. Berdasarkan tabel 5, responden diketahui tidak memiliki riwayat menggunakan narkotika suntik maupun tato. Faktor risiko yang dimiliki responden adalah aktivitas seksual dengan lebih dari satu pasangan dan penggunaan tindik. Sebelumnya, responden juga pernah melakukan operasi plastik pada daerah hidung, bibir, dan dagu atas indikasi kosmetik di suatu salon kecantikan. Selain mengalami koinfeksi dengan HIV, tujuh bulan sebelum wawancara dan pemeriksaan darah dilakukan, responden juga sempat dirawat di rumah sakit karena menderita tuberkulosis (TB) paru.
Faktor risiko aktivitas seksual dengan lebih dari satu pasangan dimiliki oleh semua gigolo dengan anti-HCV positif. Jumlah pasangan seksual yang
commit to user
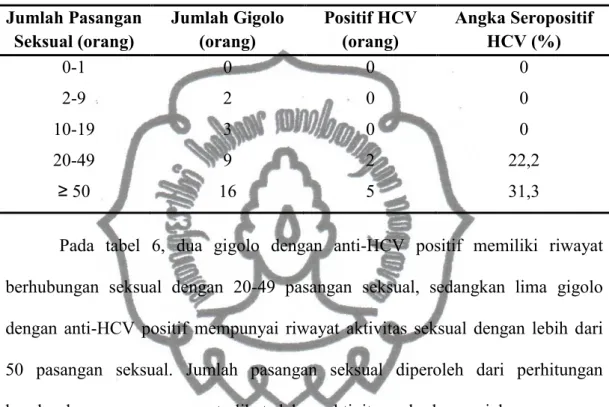
terlibat dengan gigolo di Surakarta tercantum dalam tabel 6. Pengklasifikasian jumlah pasangan seksual tersebut disesuaikan dengan penelitian yang dilakukan oleh Armstrong et al. (2006).
Tabel 6. Jumlah Pasangan Seksual Gigolo di Surakarta Jumlah Pasangan Seksual (orang) Jumlah Gigolo (orang) Positif HCV (orang) Angka Seropositif HCV (%) 0-1 2-9 10-19 20-49 ≥ 50 0 2 3 9 16 0 0 0 2 5 0 0 0 22,2 31,3
Pada tabel 6, dua gigolo dengan anti-HCV positif memiliki riwayat berhubungan seksual dengan 20-49 pasangan seksual, sedangkan lima gigolo dengan anti-HCV positif mempunyai riwayat aktivitas seksual dengan lebih dari 50 pasangan seksual. Jumlah pasangan seksual diperoleh dari perhitungan keseluruhan pasangan yang terlibat dalam aktivitas seks komersial maupun non komersial dengan gigolo, berjenis kelamin pria dan wanita, Warga Negara Asing (WNA), serta pasangan yang terlibat dalam pesta seks. Rincian jumlah pasangan seksual tersebut dapat dilihat pada lampiran 4.
Mengenai faktor risiko penggunaan narkotika suntik, faktor ini hanya dimiliki oleh satu dari tujuh gigolo dengan anti-HCV positif, yaitu AK1911060805. Responden AK1911060805 menggunakan narkotika suntik saat berada dalam penjara dan pernah menggunakannya secara bergantian dengan penghuni penjara lain. Selama di penjara, responden menggunakan narkotika suntik sebanyak 2-3 kali per minggu. Data mengenai riwayat penggunaan
commit to user
narkotika dan jarum suntik bersama pada komunitas gigolo di Surakarta selengkapnya dapat dilihat pada lampiran 5.
Faktor risiko penggunaan tato terdapat pada dua orang gigolo dari tujuh gigolo dengan anti-HCV positif. Hasil wawancara mengenai riwayat penggunaan tato pada responden terdapat pada lampiran 6. Kedua responden dengan tato tersebut adalah:
1. Responden AK1911053104
Responden melakukan prosedur tato di rumah dengan bantuan teman. Responden mengaku menggunakan alkohol saat menato bagian tubuhnya, akan tetapi jarum tato dipergunakan secara bergantian dengan lima orang teman yang lain. Dengan demikian, tindakan tato responden AK1911053104 tergolong tidak steril.
2. Responden AK1911060805
Responden mendapatkan tato saat di penjara. Tato diperoleh secara tidak steril karena jarum tato digunakan secara bergantian dengan penghuni penjara lain. Adapun faktor risiko penggunaan tindik terdapat pada empat orang gigolo dari tujuh gigolo dengan anti-HCV positif. Data mengenai penggunaan tindik pada responden dapat dilihat pada lampiran 7. Keempat gigolo dengan tindik tersebut adalah:
1. Responden AK1911052503
Responden melakukan prosedur tindik di tempat komersial pada salah satu pusat perbelanjaan. Responden mengaku tidak tahu secara pasti apakah prosedur tindik telah dilakukan secara steril atau tidak.
commit to user 2. Responden AK1911053106
Responden melakukan prosedur tindik di salah satu pusat perbelanjaan. Responden mengaku tidak tahu apakah prosedur tindik dilakukan secara steril. Akan tetapi, menurut responden jarum pada alat tindik yang saat itu digunakan juga dimanfaatkan secara bergantian dengan orang lain.
3. Responden AK1911060804
Responden melakukan prosedur tindik di rumah. Responden menyatakan bahwa tindik yang dilakukan telah melalui langkah yang steril dan jarum yang digunakan untuk menindik tidak dipakai secara bergantian.
4. Responden AK1911060805
Responden melakukan prosedur tindik di rumah. Responden tidak mengetahui secara pasti apakah telah melakukan prosedur sterilisasi secara benar. Jarum yang dipergunakan untuk menindik tidak digunakan secara bergantian.
Sesuai alur kerja penelitian, sampel anti-HCV positif yang diperoleh dari skrining awal selanjutnya dikonfirmasi dengan pemeriksaan Nested PCR. Hasil pemeriksaan Nested PCR yang dilakukan tidak berhasil mengamplifikasi sebagian gen HCV NS5B pada semua sampel anti-HCV positif. Gambar hasil elektroforesis dapat dilihat pada lampiran 3.
commit to user 27 BAB V PEMBAHASAN
Deteksi HCV yang dilakukan pada penelitian ini telah melibatkan 30 gigolo di Surakarta. Deteksi tersebut dilakukan dengan skrining anti-HCV, di mana hasil positif selanjutnya diperiksa dengan Nested PCR yang tujuannya mengamplifikasi sebagian regio NS5B. Hasil dari pemeriksaan ini kemudian disajikan secara deskriptif bersama faktor risiko penyebaran infeksi hepatitis C, sehingga diharapkan dapat menghasilkan data awal epidemiologi infeksi hepatitis C pada komunitas gigolo di Surakarta.
Skrining anti-HCV dan Nested PCR yang dilakukan terhadap sampel plasma darah dapat mengarahkan pada diagnosis terjadinya infeksi hepatitis C akut maupun kronis. Perbedaan antara infeksi hepatitis C akut dari infeksi kronis tergantung dari presentasi klinis yang tampak pada penderita, misal adanya gejala ikterus dan apakah terdapat riwayat peningkatan level serta durasi dari serum alanine aminotransferase (ALT) (Ghany et al., 2009). Setelah terjadi paparan akut, RNA HCV pada umumnya terdeteksi di dalam serum sebelum terbentuknya antibodi terhadap HCV. RNA HCV tersebut dapat diidentifikasi sejak dua minggu setelah terjadi paparan, sedangkan anti-HCV belum bisa terdeteksi hingga 8-12 minggu kemudian (Centers for Disease Control and Prevention, 2003; Ghany et al., 2009).
commit to user
Pada penelitian ini, diperoleh angka seropositif HCV pada tujuh responden (23,3%) dan angka seronegatif HCV pada 23 responden (76,7%). Mengenai faktor risiko yang diteliti, dideskripsikan bersama hasil pemeriksaan serologi dengan anti-HCV positif. Faktor risiko penularan HCV yang dipilih adalah riwayat aktivitas seksual dengan lebih dari satu pasangan, penggunaan narkotika suntik, penggunaan tato, serta penggunaan tindik.
Pada responden yang memiliki faktor risiko berhubungan seksual dengan 20-49 pasangan, angka seropositif HCV diperoleh sebesar 22,2% (2/9). Adapun pada responden yang melakukan aktivitas seksual dengan lebih dari atau sama dengan 50 pasangan, angka seropositif HCV didapatkan sebesar 31,3% (5/16). Hal tersebut menunjukkan bahwa anti-HCV positif lebih banyak ditemui pada responden dengan jumlah pasangan seksual terbanyak, yaitu lebih dari 50 orang. Hasil demikian sejalan dengan penelitian Armstrong et al. (2006).
Pada faktor risiko penggunaan narkotika dalam komunitas gigolo, angka seropositif HCV didapatkan sebesar 42,9% (3/7). Faktor risiko pemakaian narkotika ini terbagi menjadi narkotika suntik dan nonsuntik. Angka seropositif HCV pada gigolo yang menggunakan narkotika suntik adalah 100% (1/1), sedangkan pada gigolo yang memakai narkotika nonsuntik adalah 33,3% (2/6). Pada gigolo yang tidak menggunakan narkotika jenis apapun, angka seropositif HCV diperoleh sebesar 17,4% (4/23). Sebelumnya diketahui bahwa penggunaan narkotika suntik merupakan salah satu rute utama dalam penularan infeksi HCV (Albeldawi et al., 2010). Pada penelitian Quaglio et al. (2003) juga didapatkan prevalensi anti-HCV positif empat kali lebih besar pada pengguna narkotika suntik
commit to user
dibandingkan pengguna narkotika nonsuntik, yaitu 81,6% banding 20%. Oleh karena itu, hasil yang berbeda dari penelitian ini dimungkinkan karena jumlah responden yang diteliti jauh lebih sedikit dibandingkan penelitian Quaglio et al. (2003) maupun penelitian lain dengan hasil yang serupa.
Adapun angka seropositif HCV pada gigolo yang memiliki tato adalah 28,6% (2/7). Pada gigolo yang tidak memiliki tato, angka seropositif HCV 21,7% (5/23). Semua gigolo yang menato bagian tubuh mereka tidak melakukan prosedur sterilisasi sebelumnya. Pada penelitian Roy et al. (2001), angka seropositif HCV pada kelompok yang memiliki tato adalah 18,2%, lebih besar jika dibandingkan angka seropositif HCV pada kelompok yang tidak memiliki tato (5,3%). Hasil yang diperoleh dalam penelitian ini sesuai dengan studi yang dilakukan oleh Roy et al. (2001). Roy et al. (2001) dan Jafari et al. (2010) juga mengemukakan bahwa terdapat peningkatan risiko terjadinya infeksi hepatitis C pada seseorang yang mendapatkan tato secara tidak profesional atau tidak melalui prosedur sterilisasi.
Pada gigolo dengan faktor risiko penggunaan tindik, angka seropositif HCV diperoleh sebesar 36,4% (4/11), sedangkan pada gigolo yang tidak menggunakan tindik diperoleh lebih kecil, yaitu 15,8% (3/19). Dari 11 gigolo yang menggunakan tindik, terdapat dua orang yang menempuh prosedur steril, sedangkan enam orang tidak melakukan secara steril dan tiga orang lainnya tidak tahu secara pasti apakah mereka sudah melewati prosedur yang steril. Hasil penelitian ini sesuai dengan penelitian Chaudhry et al. (2010) dan Roy et al. (2001) yang menyebutkan bahwa prevalensi anti-HCV positif lebih banyak
commit to user
ditemui pada kelompok yang menggunakan tindik dibandingkan kelompok yang tidak menggunakan tindik.
Anti-HCV positif menunjukkan terjadinya infeksi hepatitis C di masa lalu atau saat ini (Centers for Disease Control and Prevention, 2003). Sesuai algoritma dari kerangka pemikiran yang telah disusun sebelumnya, sampel dengan anti-HCV positif diuji dengan Nested PCR. Setelah produk PCR divisualisasi dengan elektroforesis, tidak didapatkan sampel dengan PCR positif. Interpretasi hasil deteksi hepatitis C di mana anti-HCV positif dengan PCR negatif, menunjukkan adanya infeksi hepatitis C akut dengan viremia rendah, infeksi HCV yang telah diobati, kondisi non-viremia pada infeksi hepatitis C kronis, atau adanya hasil negatif palsu akibat kesalahan prosedur laboratorium (Albeldawi et al., 2010; Centers for Disease Control and Prevention, 2003; Ghany et al., 2009).
Dalam penelitian ini, kemungkinan hasil negatif palsu akibat kesalahan prosedur laboratorium dapat dieliminasi, mengingat pemeriksaan serologi dan Nested PCR telah diulang beberapa kali. Di samping itu, kontrol amplifikasi eksternal juga sudah digunakan dalam Nested PCR. Pada deteksi molekuler terhadap sebagian gen E1-E2 HCV, Nested PCR juga memberikan hasil yang negatif meskipun telah menggunakan sampel dan kit yang sama. Oleh karena itu, hal tersebut menyingkirkan kemungkinan adanya kontaminasi pada sampel, kerusakan kit dan primer, maupun kesalahan dalam teknik penelitian.
Pada seseorang dengan infeksi hepatitis C aktif, terdapat situasi tertentu di mana hasil PCR dapat menjadi negatif (Centers for Disease Control and Prevention, 2003). Hal ini terjadi ketika titer RNA HCV mengalami penurunan
commit to user
sedangkan titer anti-HCV meningkat selama fase infeksi akut. Dengan demikian, RNA HCV dapat tidak terdeteksi pada orang tertentu selama fase akut infeksi hepatitis C. Di samping itu, terdapat penelitian yang telah mengobservasi penderita dengan infeksi hepatitis C kronis dan ditemukan hasil positif RNA HCV yang intermiten (Thomas et al., 2000). Oleh karena itu, dengan tidak adanya informasi klinis tambahan, maka makna dari suatu hasil negatif RNA HCV belum dapat diketahui dan perlu dilakukan pemantauan lebih lanjut (Centers for Disease Control and Prevention, 2003).
Hasil PCR negatif juga dapat mengindikasikan adanya infeksi HCV yang sudah diobati. Telah diketahui bahwa 15-25% dapat mengalami kesembuhan sehingga hasil PCR menjadi negatif (Alter dan Seeff, 2000). Oleh karena itu, untuk menentukan apakah infeksi hepatitis C pada seseorang telah teratasi, harus ditunjukkan melalui hasil negatif dari pemeriksaan PCR yang dilakukan dalam 4-6 bulan berikutnya (Ghany et al., 2009).
Pada penderita infeksi hepatitis C kronis, viremia dapat diklasifikasikan menjadi tiga derajat, yaitu viremia ringan dengan level RNA HCV < 106 kopi/ml, viremia sedang dengan level RNA HCV 106-108 kopi/ml, dan viremia berat dengan level RNA HCV > 108 kopi/ml (Rahman dan Mannan, 2010). Dalam hal ini, hasil PCR dapat menjadi negatif pada pasien hepatitis C kronis dengan viremia ringan terkait level RNA HCV yang rendah (Scott et al., 2006). Di samping itu, terdapat penelitian pada pasien hepatitis C kronis di Jepang dengan RNA HCV seronegatif yang sebelumnya seropositif, setelah enam dari 310 pasien tersebut memasuki fase gagal hati akibat terjadinya karsinoma hepatoseluler (Yokosuka et
commit to user
al., 1999). Pada kondisi tersebut, level viremia pada pasien hepatitis C kronis tidak dipengaruhi oleh derajat kerusakan pada hepar, kecuali pada beberapa pasien yang memasuki stadium akhir penyakit hepar, di mana pasien tersebut memiliki level RNA HCV yang rendah bahkan mungkin tidak terdeteksi (Pawlotsky, 2002; Rahman dan Mannan, 2010). Penurunan kadar viremia pada penyakit hepar stadium akhir ini lebih dimungkinkan akibat terjadinya deplesi pada sel-sel hepatosit dan fibrosis hepar yang meluas, daripada adanya perubahan struktur virus (Pawlotsky, 2002).
Selain faktor viremia rendah dan infeksi HCV yang sudah diobati, terdapat faktor lain yang dapat menyebabkan RNA HCV terdeteksi negatif pada sampel responden. Faktor tersebut adalah adanya variasi atau polimorfisme yang terlibat dalam respon imun yang berkontribusi pada kemampuan tubuh untuk mengeliminasi virus (Ge et al., 2009). Hal ini disimpulkan dari penelitian genome wide association study (GWAS) yang berhasil mengidentifikasi adanya single nucleotide polymorphism (SNP) pada kromosom 19q13, yaitu rs12979860, yang terkait kuat dengan terjadinya sustained virological response (SVR) pada infeksi hepatitis C kronis dan pembersihan HCV spontan pada fase infeksi akut (Ge et al., 2009; Thomas et al., 2009). SVR tercapai apabila RNA HCV pasien tetap negatif setelah enam bulan pasca pengobatan hepatitis C (Veldt et al., 2007). Individu yang memiliki genotipe C/C pada SNP rs12979860 berkesempatan mencapai status SVR hingga tiga kali lipat lebih besar dibandingkan pasien lain dengan genotipe C/T dan T/T. Hal ini mengindikasikan bahwa alel C dapat mendukung terjadinya pembersihan spontan dari HCV (Ge et al., 2009; Thomas et al., 2009).
commit to user
SNP rs12979860 terletak 3 kb upstream dari gen interleukin-28B (IL-28B) yang menyandi interferon (IFN)-λ3 (Ge et al., 2009). IFN-λ3 termasuk dalam keluarga sitokin IFN-λ yang berperan sebagai sitokin antivirus endogen. Saat sel hepatosit terinfeksi RNA HCV, akan terbentuk protein retinoid-acid inducible gene 1 (RIG1) dan Toll-like receptor 3 (TLR3) dalam sitoplasma hepatosit, suatu protein yang berfungsi sebagai pattern recognition receptor yang dapat mendeteksi adanya infeksi virus. Keduanya mengaktifkan faktor transkripsi interferon regulatory factor 3 (IRF3) dan IRF 7 yang berfungsi sebagai sinyal terhadap nukleus hepatosit untuk membentuk IFN-α dan IFN-β. Sebagai respon terhadap sinyal tersebut, gen IL28B pada kromosom 19 juga mengekspresikan IFN-λ3. IFN-α dan IFN-β kemudian ditranspor ke luar sel untuk berikatan dengan reseptor IFN tipe I yang terdapat pada membran sel hepatosit dan antigen-presenting cell (APC), sedangkan IFN-λ3 berikatan dengan reseptor IFN tipe III. Ikatan pada reseptor tersebut mengaktifkan jalur transduksi sinyal Janus kinase-signal transducer and activator of transcription (JAK-STAT) yang memicu pembentukan molekul efektor interferon-stimulated genes (ISGs). ISGs ini selanjutnya berperan dalam menghambat replikasi HCV (Balagopal et al., 2010; Gonzalez dan Keffe, 2011).
Selain rs12979860, sejauh ini terdapat sembilan SNP lain pada gen IL-28B yang telah berhasil diidentifikasi. SNP tersebut adalah rs12980275, rs8105790,
rs11881222, rs8103142, rs28416813, rs4803219, rs8099917, rs7248668,
rs10853728 (Chen et al., 2011; Ito et al., 2011; Lin et al., 2011). Dari kesembilan SNP tersebut, terdapat satu SNP yang dinilai berdampak signifikan terhadap hasil
commit to user
akhir pengobatan infeksi hepatitis C, yaitu rs8099917 (Balagopal et al., 2010; Chen et al., 2011). SNP rs8099917 terletak 8 kb upstream dari gen IL-28B (Balagopal et al., 2010; Mahboobi et al., 2011). Akan tetapi, terdapat sebuah studi meta-analisis yang melaporkan bahwa SNP rs12979860 lebih erat kaitannya dengan pencapaian SVR pada pasien hepatitis C kronis dibandingkan SNP rs8099917 (Lin et al., 2011; Mahboobi et al., 2011).
Meskipun mekanisme inhibisi replikasi HCV yang dimediasi oleh IFN-λ3 telah dipahami, namun sampai saat ini masih belum jelas bagaimana polimorfisme pada gen IL28B meregulasi aktivitas dan fungsi dari IFN-λ3 sehingga terdapat respon yang berbeda pada beberapa orang yang terinfeksi hepatitis C. Sejauh ini, penelitian yang dikemukakan oleh Ge et al. (2009), Gonzalez dan Keffe (2011), serta Thomas et al. (2009), hanya menyimpulkan bahwa adanya polimorfisme pada IL28B dapat mendukung terjadinya pembersihan spontan HCV pada fase akut dan memprediksi hasil terapi pada pasien hepatitis C kronis. Dengan demikian, polimorfisme tersebut dapat berdampak pada status klinis pasien yang terinfeksi HCV, sehingga pada individu-individu tertentu hasil pemeriksaan PCR dapat menjadi negatif.
commit to user 35 BAB VI
SIMPULAN DAN SARAN
A. Simpulan
1. Dua puluh tiga koma tiga persen dari 30 gigolo di Surakarta memiliki anti-HCV positif.
2. Gigolo dengan HCV seropositif mempunyai faktor risiko terinfeksi HCV melalui aktivitas seksual dengan lebih dari satu pasangan, penggunaan narkotika suntik, tato, dan tindik.
3. Deteksi dengan Nested PCR pada sebagian gen HCV NS5B menunjukkan hasil yang negatif pada semua sampel HCV seropositif.
B. Saran
1. Penelitian mengenai deteksi HCV ini diharapkan dapat dilanjutkan dengan komunitas gigolo yang lebih besar dan mencakup wilayah yang lebih luas. 2. Hasil penelitian ini diharapkan dapat dimanfaatkan oleh petugas kesehatan
dan pihak terkait dalam melakukan sosialisasi peningkatan status kesehatan pada komunitas gigolo di Surakarta.
commit to user 36
DAFTAR PUSTAKA
Albeldawi M., Rodriguez E.R., Carey W.D. 2010. Hepatitis C virus: prevention, screening, and interpretation of assays. Cleaveland Clin J Med. 77:616-626.
Alter M.J. 2007. Epidemiology of hepatitis C infection. World J Gastroenterol. 13:2436-2441.
Alter H.J. and Seeff LB. 2000. Recovery, persistence, and sequelae in hepatitis C virus infection: a perspective on long-term outcome. Semin Liver Dis. 20:17–35.
Armstrong G.L., Wasley A., Simard E.P., McQuillan G.M., Kuhnert W.L., Alter M.J. 2006. The prevalence of hepatitis C virus infection in the United States, 1999 through 2002. Ann Intern Med. 144:705-714.
Baclig M.O., Chan V.F., Ramos J.D.A., Cervantes J.G., Natividad F.F. 2010. Correlation of the 5’untranslated region (5’UTR) and non-structural 5B (NS5B) nucleotide sequences in hepatitis C virus subtyping. Int J Mol Epidemiol Genet. 1:236-244.
Balagopal A., Thomas D.L., Thio C.L. 2010. IL28B and the control of hepatitis C virus infection. J Gastro. 139:1865–1876.
Balogun T.M., Emmanuel S., Wright K.O. 2010. Hepatitis C virus co infection in HIV positive patients. Nig Q J Hosp Med. 20:117-120.
Baral S., Kizub D., Masenior N.F., Peryskina A., Stachowiak J., Stibich M., Moguilny V., et al. 2010. Male sex workers in Moscow, Russia: a pilot study of demographics, substance use patterns, and prevalence of HIV-1 and sexually transmitted infections. AIDS Care. 1:112–118.
Basri H, Zubir N, Julius. 2003. Gambaran HbsAg dan anti-HCV pada pekerja seks komersil di kota Padang. Acta Med Indones. 25: 140-143.
Cantaloube J.F., Laperche S., Gallian P., Bouchardeau F., de Lamballerie X., de Micco1 P. 2006. Analysis of the 5’noncoding region versus the NS5B region in genotyping hepatitis C virus isolates from blood donors in France. J Clin Microbiol. 44:2051-2056.
Centers for Disease Control and Prevention. 2003. Guidelines for laboratory testing and result reporting of antibody to hepatitis C virus. MMWR. 52:1-16.
commit to user
Chaudhry M.A., Rizvi F., Afzal M., Ashraf M.Z., Niazi S., Beg A., Kharal T.H. 2010. Frequency of risk factors for hepatitis B (HBV) and hepatitis C virus (HCV). Ann Pak Inst Med Sci. 6:161-163.
Chen J.J., Yu C.B., Du W.B., Li L.J. 2011. Prevalence of hepatitis B and C in HIV-infected patients: a meta-analysis. Hepatobiliary Pancreat Dis Int. 10:122-127.
Chen J.Y., Lin C.Y., Wang C.M., Lin Y.T., Kuo S.N., Shiu C.F., Chang S.W., et al. 2011. IL28B genetic variations are associated with high sustained virological response (SVR) of interferon-α plus ribavirin therapy in Taiwanese chronic HCV infection. Genes Immun. 12:300-309.
Chevaliez S., Alias M.B., Brillet R., Pawlotsky J.M. 2009. Hepatitis C virus (HCV) genotype 1 subtype identification in new HCV drug development and future clinical practice. PLoS ONE. 4:e8209. doi:10.1371/journal.pone.0008209.
dos Ramos Farías M.S., Garcia M.N., Reynaga E., Romero M., Vaulet M.L., Fermepín M.R., Toscano M.F., et al. 2011. First report on sexually transmitted infections among trans (male to female transvestites, transsexuals, or transgender) and male sex workers in Argentina: high HIV, HPV, HBV, and syphilis prevalence. Int J Infect Dis. 15:635-640.
Estcourt C.S., Marks C., Rohrsheim R., Johnson A.M., Donovan B., Mindel A. 2000. HIV, sexually transmitted infections, and risk behaviours in male commercial sex workers in Sydney. Sex Transm Inf. 76:294-298.
Fuller C.M., Ompad D.C., Galea S., Wu Y., Koblin B., Vlahov D. 2004. Hepatitis C incidence—a comparison between injection and noninjection drug users in New York city. J Urban Health. 81:20-24.
Ge D., Fellay J., Thompson A.J., Simon J.S., Shianna K.V., Urban T.J., Heinzen E.L., et al. 2009. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature. 461:399-401.
Ghany M.G., Strader D.B., Thomas D.L., Seeff L.B. 2009. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology. 49:1335-1374.
Gonzalez S.A. and Keeffe E.B. 2011. IL-28B as a predictor of sustained virologic response in patients with chronic hepatitis C virus infection. Gastroenterol Hepatol. 7:366-373.
commit to user
Hagan H., Pouget E.R., Jarlais D.C.D. 2011. A systematic review and meta-analysis of interventions to prevent hepatitis C virus infection in people who inject drugs. J Infect Dis. 204:74-83.
ICTVdB. 2006. Index of Viruses-Flaviviridae. In : ICTVdB-The Universal Virus Database, version 4. Büchen-Osmond, C (Ed), Columbia University, New York, USA. http://www.ncbi.nlm.nih.gov/ICTVdb/Ictv/fs_index.htm. (1 Januari 2011).
Invitrogen. 2006. PureLink™ Viral RNA/DNA Kits. http://tools.invitrogen.com/ content/sfs/manuals/purelink_viral_rna_dna_man.pdf. (19 Januari 2011). Ito K., Higami K., Masaki N., Sugiyama M., Mukaide M., Saito H., Aoki Y., et al.
2011. The rs8099917 polymorphism, when determined by a suitable genotyping method, is a better predictor for response to pegylated alpha interferon/ribavirin therapy in Japanese patients than other single nucleotide polymorphisms associated with interleukin-28b. J Clin Microbiol. 49:1853-1860.
Jafari S., Copes R., Baharlou S., Etminan M., Buxton J. 2010. Tattooing and the risk of transmission of hepatitis C: a systematic review and meta-analysis. Int J Infect Dis. 1145:xxx.e1–xxx.e13.
Kao J.H., Liu C.J., Chen P.J., Chen W., Wang T.H., Chen D.S. 2000. Low incidence of hepatitis C virus transmission between spouses: a prospective study. J Gastroenterol Hepatol. 15:391–395.
Kweon S.S., Shin M.H., Song H.J., Jeon D.Y., Choi J.S. 2006. Seroprevalence and risk factors for hepatitis C virus infection among female commercial sex workers in South Korea who are not intravenous drug users. Am J Trop Med Hyg. 74:1117-1121.
Laurent C., Henzel D., Kabeya C.M., Maertens G., Larouzé B., Delaporte E. 2001. Seroepidemiological survey of hepatitis C virus among commercial sex workers and pregnant women in Kinshasa, Democratic Republic of Congo. Int J Epid. 30:872-877.
Lemon S.M., Walker C., Alter M.J., Yi M.K. 2007. Hepatitis C Virus. In : Knipe D.M. and Howley P.M. (eds). Fields Virology. 5th ed. Philadelphia: Lippincott Williams & Wilkins, pp: 1254-1265.
Life Technologies. 2010. SuperScript® III First-Strand Synthesis SuperMix. http://tools.invitrogen.com:80/content/sfs/manuals/superscripst_firststrands upermix_man.pdf. (19 Januari 2011).
commit to user
Lin C.Y., Chen J.Y., Lin T.N., Jeng W.J., Huang C.H., Huang C.W., Chang S.W., et al. 2011. IL28B SNP rs12979860 is a critical predictor for on-treatment and sustained virologic response in patients with hepatitis C virus
genotype-1 infection. PLoS ONE. 6: e18322.
doi:10.1371/journal.pone.0018322.
Mahboobi N., Behnava B., Alavian S.M. 2011. IL28B SNP genotyping among Iranian HCV-infected patients: a preliminary report. Hepat Mon. 11:386-387.
Murphy D.G., Willems B., Deschênes M., Hilzenrat N., Mousseau R., Sabbah S. 2007. Use of sequence analysis of the NS5B region for routine genotyping of hepatitis C virus with reference to C/E1 and 5’ untranslated region sequences. J Clin Microbiol. 45:1102–1112.
Nishimura N., Isoda N., Higashizawa T., Otake T., Tsukui M., Nagashima S., Takahashi M. 2010. A case of acute hepatitis C caused by interspousal transmission after 30 years of marriage. Clin J Gastroenterol. 3:50–56. Operskalski E.A. and Kovacs A. 2011. HIV/HCV co-infection: pathogenesis,
clinical complications, treatment, and new therapeutic technologies. Curr HIV/AIDS Rep. 8:12-22.
Pando M.A., Berini C., Bibini M., Fernandez M., Reinaga E., Maulen S., Marone R., et al. 2006. Prevalence of HIV and other sexually transmitted infections among female commercial sex workers in Argentina. Am J Trop Med Hyg. 74:233–238.
Pawlotsky J.M. 2002. Use and interpretation of virological tests for hepatitis C. Hepatology. 36:S65-S73.
Prasetyo A.A. 2011. Teknik Biologi Molekuler Dasar. Surakarta: LPP UNS dan UNS Press, pp: 94-95.
Quaglio G., Lugoboni F., Pajusco B., Sarti M., Talamini G., Lechi A., Mezzelani P., et al. 2003. Factors associated with hepatitis C virus infection in injection and noninjection drug users in Italy. Clin Infect Dis. 37:33-40. Rahman M.A. and Mannan S.R. 2010. Degree of viremia and liver histology in
chronic hepatitis C. AKMMC J. 1:17-20.
Roy É., Haley N., Leclerc P., Boivin J.F., Cédras L., Vincelette J. 2001. Risk factors for hepatitis C virus infection among street youths. Can Med Assoc J. 165:557-560.
commit to user
Schnuriger A., Dominguez S., Valantin M.A., Tubiana R., Duvivier R., Ghosn J., Simon A., et al. 2006. Early detection of hepatitis C virus infection by use of a new combined antigen-antibody detection assay: potential use for high-risk individuals. J Clin Microbiol. 44:1561-1563.
Scott J.D., McMahon B.J., Bruden D., Sullivan D., Homan C., Christensen C., Gretch D. 2006. High rate of spontaneous negativity for hepatitis C virus RNA after establishment of chronic infection in Alaska natives. Clin Infec Dis. 42:945-952.
Sharma S.D. 2010. Hepatitis C virus: molecular biology and current therapeutic options. Indian J Med Res. 131:17-34.
Simmonds P., Bukh J., Combet C., Deléage G., Enomoto N., Feinstone S., Halfon P., et al. 2005. Consensus proposal for a unified system of nomenclature of hepatitis C virus genotype. Hepatology. 42:962-973.
Thomas D.L., Astemborski J., Rai R.M., Anania F.A, Schaeffer M., Galai N., Nolt K., et al. 2000. Natural history of hepatitis C virus infection: host, viral, and environmental factors. J Am Med Assoc. 284:450-456.
Thomas D.L., Leoutsakas D., Zabransky T., Kumar M.S. 2011. Hepatitis C in HIV-infected individuals: cure and control, right now. J Int AIDS Soc. 14:1-8.
Thomas D.L., Thio C.L., Martin M.P., Qi Y., Ge D., O’huigin C., Kidd J. 2009. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature. 461:798-801.
UNAIDS. 2008. Report on the Global AIDS Epidemic. http://www.unaids.org/en/media/unaids/contentassets/dataimport/pub/globa lreport/2008/jc1510_2008globalreport_en.zip. (5 Desember 2011).
Veldt B.J., Heathcote E.J., Wedemeyer H., Reichen J., Hofmann W.P., Zeuzem S., Manns M.P., et al. 2007. Sustained virologic response and clinical outcomes in patients with chronic hepatitis C and advanced fibrosis. Ann Intern Med. 147:677-684.
White P.A., Zhai X., Carter I., Zhao Y., Rawlinson W.D. 2000. Simplified hepatitis C virus genotyping by heteroduplex mobility analysis. J Clin Microbiol. 38:477-482.
WHO. 2003. Global Alert and Response: Hepatitis C. http://www.who.int/csr/disease/hepatitis/whocdscsrlyo2003/en/index4.html #incidence. (1 Januari 2011).
commit to user
Yokosuka O., Kojima H., Imazeki F., Tagawa M., Saisho H., Tamatsukuri S., Omata M. 1999. Spontaneous negativation of serum hepatitis C virus RNA is a rare event in type C chronic liver diseases: analysis of HCV RNA in 320 patients who were followed for more than 3 years. J Hepatol. 31:394-399.