Stabilitas Aktivitas Fitase Dari Bukholderia lata Strain HF.7
HAFSAN1, LAILY AGUSTINA2,ASMUDDIN NATSIR2, AHYAR AHMAD3
1Jurusan Biologi, Fakultas sains dan teknologi, Universitas Islam Negeri Alauddin Makassar,
Gowa, Sulawesi Selatan 92113
2Jurusan Nutrisi dan Makanan Ternak, Fakultas Peternakan, Universitas Hasanuddin, Makassar,
Sulawesi Selatan 90245
3Jurusan Kimia, Fakultas MIPA, Universitas Hasanuddin, Makassar, Sulawesi Selatan 90245
Email: hafsan.bio@uin-alauddin.ac.id ABSTRAK
Penelitian ini bertujuan untuk mengetahui stabilitas fitase ekstraseluler Bukholderia lata strain HF.7 terhadap suhu, pH, dan aktivitas protease sebagaimana kondisi saluran pencernaan unggas pada umumnya. Uji stabilitas suhu dilakukan dengan memaparkan pada suhu yang bervariasi (20, 30, 37, 40, 45, 50, 55, 60, dan 65oC), sedangkan uji stabilitas pH dilakukan dengan cara menginkubasi fitase pada buffer Na-asetat dengan pH bervariasi (1, 2, 3, 4, 5, 6, 7, 8). Uji stabilitas fitase terhadap protease dilakukan dengan penambahan protease dengan level perlakuan P0: tanpa protease, P1: penambahan pepsin (5000 unit/ mL), P2: penambahan pepsin (5000 unit/ mL) dan P3: penambahan pepsin + tripsin (@2500 unit/ mL) dengan Rancangan Acak Lengkap. Nilai aktivitas fitase pada suhu dan pH dilakukan dengan menggunakan analisis deskriptif dengan mengamati nilai rata-rata dari aktivitas fitase. Hasil penelitian menunjukkan bahwa fitase ekstraseluler Bukholderia lata strain HF.7 memiliki aktivitas yang lebih baik pada kemurnian yang lebih tinggi serta optimum pada pH 4 dan suhu 37oC. Fitase yang dihasilkan juga aktivitas yang stabil pada pH maupun suhu serta protease (pepsin dan tripsin) sebagaimana kondisi saluran pencernaan unggas pada umumnya. Temuan ini menunjukkan prospek potensial fitase ekstraseluler Bukholderia lata strain HF.7 yang dapat diaplikasikan pada pakan unggas untuk meningkatkan produktivitas.
Kata kunci: fitase, fitat, Bukholderia lata, stabilitas PENDAHULUAN
Fitase merupakan enzim penghidrolisis asam fitat, namun tidak diproduksi pada saluran pencernaan ternak monogastrik seperti unggas. Hal ini menyebabkan asam fitat yang merupakan bentuk penyimpanan pospor terbesar pada bahan pakan unggas tidak dapat dicerna, sehingga akan terbuang ke lingkungan bersama feses dan dapat menyebabkan terjadinya pencemaran. Sebagai zat anti nutrisi, asam fitat juga memiliki efek negatif terhadap kecukupan nutrisi lainnya yang seharusnya diserap oleh ternak unggas. Pada kondisi alami asam fitat mampu mengikat protein dan
mineral-mineral bervalensi dua yang sangat dibutuhkan untuk pertumbuhan menjadi senyawa yang sukar larut sehingga menyebabkan mineral dan protein tidak dapat diserap tubuh dan nilai cernanya menjadi rendah (Widowati, et al., 2001).
Upaya untuk menekan akibat buruk dari asam fitat yang terkandung dalam ransum dapat dilakukan dengan penambahan enzim penghidrolisis asam fitat tersebut yang bersifat aman seperti enzim fitase. Penambahan enzim fitase ke dalam ransum diduga akan mengurangi aktivitas asam fitat dalam saluran pencernaan, sehingga nutrisi ransum terserap secara optimal dan efisien.
Fitase adalah enzim, yang juga merupakan protein, sehingga dapat dengan mudah terdegradasi oleh kondisi lingkungan (Anselme, 2006).
Beberapa persyaratan yang harus diperhatikan dalam aplikasi praktis enzim pada unggas adalah enzim tersebut harus memiliki stabilitas pada suhu, pH, dan aktivitas protease sebagaimana kondisi saluran pencernaan (Abondano, 2009). Fitase ektraselular yang dihasilkan oleh bakteri endofit tanaman Jagung yaitu Bukholderia lata strain HF.7 telah dioptimasi dan diproduksi. Namun, stabilitas enzim dalam saluran pencernaan ternak unggas belum diketahui, sehingga penelitian ini bertujuan untuk mengetahui stabilitas aktivitas fitase ekstraselular pada suhu, pH dan aktivitas protease saluran pencernaan unggas secara in vitro.
METODE
Bahan yang digunakan dalam percobaan ini adalah kultur murni bakteri Bukholderia lata strain HF.7 strain HF.7, ekstrak kasar fitase ekstraseluler dan fitase ekstraseluler murni, media Luria Bertani (Sigma, katalog P-7012), NaHCO3, pankreas (Sigma, katalog P-3292), tabung dialisis (Sigma, katalog D-9652-100FT), parafilm, NaCl, EDTA, natrium suksinat, dan asam sulfat.
Analisis Stabilitas Fitase terhadap Suhu dan pH saluran pencernaan unggas secara in vitro. Stabilitas terhadap suhu dan pH diukur sesuai dengan metode Sajidan (2002) dengan mengamati aktivitas relatif ekstrak kasar fitase ekstraseluler dan fitase ekstraseluler murni. Uji stabilitas suhu dilakukan dengan memaparkan fitase pada suhu yang bervariasi (20, 30, 37, 40, 45, 50, 55, 60, dan 65oC) selama 10 menit dan dilanjutkan dengan percobaan aktivitas fitase. Uji stabilitas pH dilakukan dengan cara menginkubasi ekstrak kasar fitase
ekstraseluler pada buffer Na-asetat dengan pH bervariasi (1, 2, 3, 4, 5, 6, 7, 8).
Analisis Stabilitas Fitase terhadap Protease. Aktivitas hidrolitik oleh fitase ekstraseluler dianalisis dengan kecernaan P secara in vitro pada dedak padi berdasarkan metode Wu et al. (2004). Level perlakuan adalah sebagai berikut P0: tanpa protease, P1: penambahan pepsin (5000 unit/ mL), P2: penambahan pepsin (5000 unit/ mL) dan P3: penambahan pepsin + tripsin (@2500 unit/ mL). Kecernaan in vitro diamati berdasarkan
pengukuran nilai P menggunakan
spektrofotometer pada λ 415 nm (Jackson, 1985). Nilai kecernaan P dihitung dengan mengamati nilai P pakan setelah hidrolisis secara in vitro pada masing-masing perlakuan. Peningkatannya dibandingkan dengan nilai P bahan pakan sebelum hidrolisis oleh fitase.
Analisis statistik. Analisis statistik nilai aktivitas fitase pada suhu dan pH dilakukan dengan menggunakan analisis deskriptif dengan mengamati nilai rata-rata dari aktivitas enzim relatif. Analisis statistik stabilitas protease dilakukan dengan menggunakan analisis varians pada α = 0,05 dengan Rancangan Acak Lengkap (Steel and Torrie, 1993).
HASIL DAN PEMBAHASAN
Nilai aktivitas ekstrak kasar fitase ekstraseluler maupun fitase ekstraseluler murni ditunjukkan pada Tabel 1. Hasil pengukuran menunjukkan bahwa Vm, Km, dan aktivitas fitase ektraselular murni lebih baik daripada ektrak kasar fitase ekstraseluler. Fitase merupakan protein yang memiliki aktivitas katalitik karena keberadaan sisi aktifnya. Fitase diproduksi setelah bakteri dikultivasi pada media produksi. Ektrak kasar fitase ekstraseluler diperoleh dengan memisahkannya dari media melalui ekstraksi dengan sentrifugasi. Ektrak kasar fitase ekstraseluler kemudian
dimurnikan sampai tingkat kemurnian tertentu (Clarkson et al., 2001). Tahap pra pemurnian dilakukan dengan fraksinasi amonium sulfat, kemudian dilakukan dialisis serta pemurnian lebih lanjut menggunakan kromatografi filtrasi gel sephadeks G-100 (Raju et al., 2007). Menurut David dan Thomas (1990) pemurnian protein dilakukan dengan tujuan menghilangkan kontaminan sehingga secara kuantitatif protein bebas dari kontaminan. Produk yang dimurnikan akan memiliki aktivitas yang lebih baik karena berbagai inhibitor terlarut dikeluarkan dari pelarut selama pemurnian enzim.
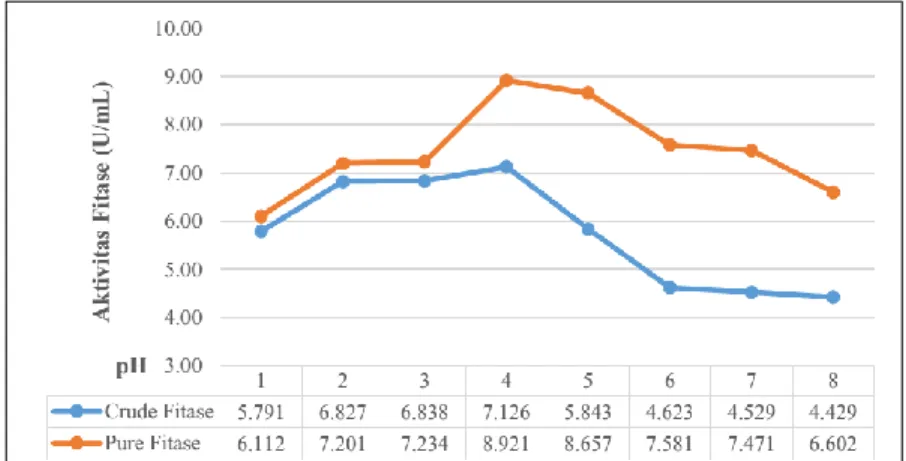
Hasil pengujian stabilitas fitase ekstraseluler pada suhu dan pH masing-masing ditunjukkan pada Gambar 1 dan 2. Fitase ekstraseluler Bukholderia lata strain HF.7 menunjukkan aktivitas pada seluruh variasi pH yaitu dari pH 1 sampai pH 8. Aktivitas fitase ekstraseluler Bukholderia lata strain HF.7 terlihat mulai dari perlakuan pH 1 dan menunjukkan peningkatan mulai pada pH 2 hingga mencapai optimum pada pH 4 dan pada pH 5 hingga pH 8 aktivitasnya mengalami penurunan. Perbedaan aktivitas pada pH berbeda diakibatkan oleh terjadinya
perubahan intramolekuler dari enzim yang
disebabkan ionisasi mengikat dan
melepaskan proton (ion hidrogen) pada gugus amino, karboksil dan gugus fungsional lainnya. Apabila perubahan terlalu besar dapat mengakibatkan denaturasi enzim, sehingga aktivitasnya akan hilang (Muchtadi dkk, 1992). Hasil pengukuran ini sejalan dengan sifat fitase yang merupakan heterologous group dari enzim, memiliki kemampuan untuk menghidrolisis ester fosfat dan optimal pada pH rendah. Pada pH netral dan basa, aktivitas katalitik menurun. Hal ini disebabkan oleh terjadinya ketidakstabilan struktur pada molekul protein enzim sehingga menyebabkan perubahan struktural pada kondisi pH tersebut. (Furlan and Pant, 2008). Kondisi pH saluran pencernaan unggas, khususnya ayam yaitu 4,5 pada tembolok, 4,4 pada proventriculus, 2, 6 pada gizzard, pada duodenum 5.7-6.0, jejunum 5.8, ileum 6.3, kolon 6.3, dan pada ceca 5.7 (Sun, 2004). Fitase ekstraseluler Bukholderia lata strain HF.7 menunjukkan stabilitas aktivitas pada pH 4-6. Dengan demikian, fitase ini dapat aktif pada sepanjang saluran pencernaan unggas.
Gambar 1. Aktivitas Fitase Bukholderia lata strain HF.7 pada Variasi pH
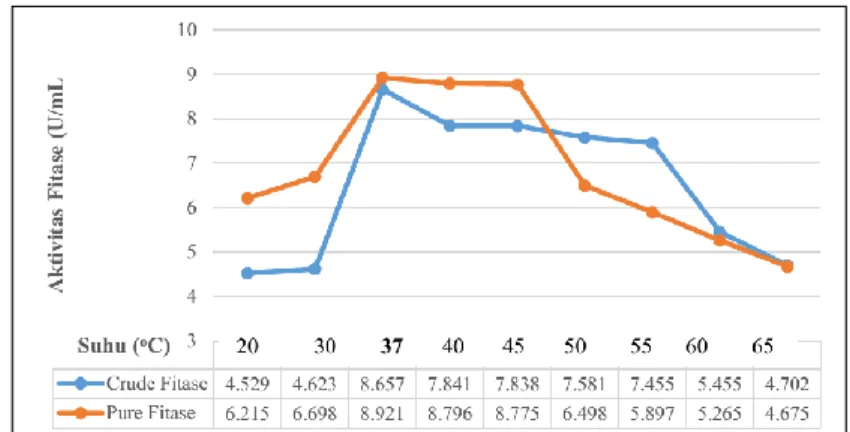
Pengujian stabilitas fitase ekstraseluler Bukholderia lata strain HF.7 terhadap suhu sebagaimana pada Gambar 2, menunjukkan bahwa meningkatnya suhu menyebabkan
peningkatan aktivitas hingga mencapai titik optimum yaitu pada suhu 37 oC. Peningkatan suhu selanjutnya menunjukkan penurunan aktivitas fitase, yang mulai terlihat pada suhu
40oC dan pada suhu selanjutnya masih menunjukkan adanya aktivitas, namun terus mengalami penurunan hingga suhu 65oC. Mula-mula dengan bertambahnya suhu terjadi kenaikan kecepatan reaksi enzim karena bertambahnya energi kinetik yang mempercepat gerak vibrasi, translasi dan rotasi enzim dan substrat sehingga memperbesar peluang keduanya untuk
bereaksi. Pada paparan suhu yang lebih tinggi dari suhu optimum, protein akan mengalami perubahan konformasi. Demikian juga substrat dapat mengalami perubahan konformasi sehingga gugus reaktifnya tidak dapat lagi, atau mengalami hambatan dalam memasuki sisi aktif enzim sehingga secara nyata mempengaruhi aktivitas katalisis enzim.
Gambar 2. Aktivitas Fitase Bukholderia lata strain HF.7 pada Variasi Suhu
Suhu dan pH optimum enzim sangat tergantung dari jenis dan sumber enzimnya. Beberapa pH dan suhu optimum fitase dari berbagai mikroba telah dilaporkan. Mikio (1992) mendapatkan fitase dari B. subtillis (natto) N-77 suhu 60oC dan pH 6,0-6,5, sedangkan dari Enterobacter sp. 4 pH 7,5, suhu 50oC. Fitase juga diproduksi oleh Aspergillus niger (suhu 58oC, pH 5,5), Schwanniomiyces castellii (suhu 7,7oC, pH
4,4), dan Klebsiella aerogenes (suhu 45oC, pH 7,0).
Hasil analisis perbedaan stabilitas hidrolisis fitase secara in vitro terhadap protease dalam bahan pakan yaitu dedak padi dengan mengevaluasi kecernaan P secara invitro dengan perlakuan penambahan pepsin dan tripsin secara terpisah maupun kombinasi ditunjukkan pada Tabel 1. Uji stabilitas penting untuk dilakukan karena penambahan enzim ke dalam pakan membutuhkan kebutuhan spesifik agar enzim tersebut tidak dapat terdegradasi oleh protease yang terdapat dalam saluran pencernaan unggas (Wang et al., 2007; Kornegay, 2001).
Tabel 1. Hasil analisis varians kadar P dedak padi terhidrolisis oleh fitase Sumber Variasi Jumlah
Kuadrat db Kudrat Tengah Nilai F Sig. Perlakuan 1.823 3 6.076 1.156 0.384 Galat 4.204 8 5.255 Total .000 12
Kandungan P dedak padi setelah hidrolisis secara in vitro oleh fitase
menunjukkan tidak ada perbedan (P <0,05) antar perlakuan. Kandungan P tetap
meningkat setelah terhidrolisis oleh fitase baik dengan penambahan pepsin maupun tripsin serta kombinasi keduanya. Hal ini membuktikan bahwa fitase dari bakteri Bukholderia lata strain HF.7 tidak terdegradasi oleh pepsin, tripsin atau gabungan keduanya sehingga aktivitas fitase tetap stabil, yang dibuktikan dengan
peningkatan kandungan P dengan
penambahan fitase. KESIMPULAN
Fitase ekstraseluler Bukholderia lata strain HF.7 memiliki aktivitas yang lebih baik pada kemurnian yang lebih tinggi. Fitase ekstraseluler Bukholderia lata strain HF.7 memiliki stabilitas yang baik pada pH maupun suhu serta pepsin dan tripsin sebagaimana kondisi saluran pencernaan unggas pada umumnya.
DAFTAR PUSTAKA
Abondano, E., 2009. Enzymatic Fungtions: Protease, Amilase and Phytase. Biotechno Ebook. USA: North Dakota State University.
Anselme, P., 2006. Considerations on The Use of Microbial Phytase. CEFIC. Brussels: Inorganic Feed Phosphates. Berka, R. M., M. W. Rey, K. M. Brown, T.
Byun and A. V. Klotz, 1998. Molecular Characterization and Expression of a Phytase Genefrom the Thermophilic Fungus Thermomyces lanuginosus. J. App. Enviro. Microbiol. (Online) 64(11):4423-4427.
Clarkson, K., B. Jones, R. Batt, B. Bower, G. Chotani, and T. Becker, 2001. Enzymes: Screening, Expression, Design and Production. In: Enzyme in Farm Animal Nutrition.
Kornegay, E.T., 2001. Digestion of Phosphorus and Other Nutrients: the Role of Phytases and Factors
Influencing Their Activity. In: Enzymes in Farm Animal Nutrition. M.R. Bedford and G.G. Partridge, Eds. CAB, Blacksburg, USA.
Muchtadi, D., N.S. Palupi, dan M. Astawan, 1992. Enzim dalam Industri Pangan. Bogor: Depdikbud Dirjen Pendidikan Tinggi PAU Bioteknologi IPB.
Sun, X., 2004. Broiler Performance and Intestinal Alterations when Fed Drug-free Diets. Thesis. Faculty of the Virginia Polytechnic Institute and State University, Blacksburg, Virginia.
Wang Y., X. Gao, Q. Su, W. Wu, and Lijia, 2007. Cloning, Expression, and Enzyme Characterization of an Acid Heat-Stable Phytase from Aspergillus fumigatus WY-2. J. Current Microbiol. (Online) 55(2007): 65–70.
Widowati. S, L. Sukarno, P. Raharto, dan Ahmad Thontowi. 2006. Studi Pengaruh
Penambahan Mineral terhadap Aktivitas Protease dari Bacillus circulans. [Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman]
(Online).
Wu, Y. B., V. Ravidran, J. Pierce and W. H. Hendriks, 2002. Influence of three preparation in broiler diets based on wheat or corn: In vitro measurements of nutrient release. J. Poult. Sci. (Online) 3 (7): 450-455.
Wyss, M., L. Pasamontes, A. Friedlein, R. Remy, M. Tessier, A. Kronenberger, A.
Middendorf, M. Lehmann, L.
Schnoebelen, U. Rothlisbuis, G. Wahl, F. Muller, Hans-Werner L., K. Vogel and P. G. M. Adolphus, 1999. Biophysical characterization of fungal phytases (myo-inositol hexaisphosphat phosphohydrolases): molecular size, glycosylation pattern and engeneering resistance. J. App. Enviro. Microbiol. (Online) 65 (2): 359-366.