PROSES PEMBUATAN ETILEN GLIKOL
DARI ETILEN OKSIDA DENGAN PROSES KARBONASI KAPASITAS 400.000 TON/TAHUN
TUGAS MAKALAH MIGAS Disusun oleh :
ANISA KEMALA DEWI 2012430002
JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS MUHAMMADIYAH JAKARTA 2014
1. Bahan Pembantu Pembuatan Etilen Glikol
Ada tiga reaksi utama dalam pembuatan etilen glikol:
C2H4 + ½O2 C2H4O
etilen etilen oksida
C2H4O + CO2 C3H4O3
etilen oksida etilen karbonat
C3H4O3 + H2O CO2 + C2H6O2
etilen karbonat etilen glikol
Bahan baku etilen oksida yang diperlukan diperoleh dari PT.Candra Asri Petrochemical Center, Cilegon, yang berakpasitas produksi 510.000 ton per tahun. Bahan baku karbon dioksida diperoleh dari PT. Air Liquide. Bahan baku air dapat diperoleh dari water treatment pihak pengelola KIEC. Sedangkan udara dapat diperoleh dengan mudah dari lingkungan sekitar.
1.1. Etilen Oksida
Pada tahun 1959, seorang ilmuwan Perancis, Charles-Adolphe Wurtz, menemukan etilen oksida dengan mereaksikan 2-kloroethanol dengan senyawa basa. Penemuan tersebut merupakan keberhasilanpada Perang Dunia 1 karena penemuan tersebut menjadi pelopor dari senyawa kimia etilen glikol dan senjata kimia beracun (mustard gas). Pada tahun 1931, ilmuwan Perancis menemukan cara menghasilkan etilen oksida secara langsung dengan mereaksikan etilen dan oksigen menggunakan katalis perak. Metode ini kemudian digunakan untuk memproduksi etilen oksida dalam skala industri (Emulsifiers, 2007).
Etilen oksida merupakan zat kimia komoditas utama yang diproduksi di seluruh dunia. Etilen oksida diproduksi dengan proses oksidasi katalitik etilen dengan katalis perak. Banyak metode lain yang telah diajukan untuk memproduksi etilen oksida namun tidak ada metode lain yang diterapkan dalam skala industri selain metode ini. Reaksi samping mengoksidasi etilen dan etilen oksida menjadi karbon dioksida dan uap air. Reaksi yang berlangsung yaitu :
C2H4 + ½O2 C2H4O
etilen etilen oksida
C2H4 + 3O2 2CO2 + 2H2O
Etilen oksida menimbulkan efek beracun bila dihirup. Gejala-gejala yangtimbul akibat menghirup terlalu banyak gas etilen oksida antara lain pusing, kejang-kejang (mendadak) dan koma. Gas ini juga mengiritasi kulit dan menghirup uap etilen oksida dapat menyebabkan paru-paru teriritasi dengan cairan selama beberapa jam.
Sifat-sifat fisika dan kimia etilen oksida : 1. Rumus molekul : C2H4O
2. Berat molekul : 44,053 g/mol
3. Bentuk fisik : gas (pada temperature ruang)
4. Titik didih : 10,5oC
5. Titik leleh : -112,44oC
6. Densitas : 0,8711 g/cm3
7. Tekanan uap : 1305 torr (25oC) 8. Viskositas : 0,34 cp (4oC) 9. Kalor jenis : 0,44 kal/g oC 10. Kalor uap : 136,1 kal/g (1 atm) 11. Flash point : < -18oC
12. Suhu nyala : 429oC (udara, 1 atm) 13. Panas pembakaran : 1306,4 kJ/mol (25oC)
14. Tekanan kritik : 7,19 MPa
15. Suhu kritik : 195,8oC
16. Kalor fusi : 5,17 kJ/mol
17. Panas larutan : 6,3 kJ/mol (dalan air murni 25oC)
18. Kelarutan : larut dalam air, aseton CCl4, eter, methanol
19. Kereaktifan : mudah meledak jika dipanaskan, meledak dengan logam alkali dalam basa
20. Reaksi kimia yang melibatkan etilen oksida:
Penambahan asam karboksilat pada etilen oksida akan membentuk glikol ester, dengan reaksi :
(CH2CH2)O + CH3COOH HO - CH2CH2 – OCHCH3
Penambahan air dan asam pada etilen oksida akan membentuk etile glikol dengan reaksi :
C2H4O + H2O C2H6O2
etilen oksida etilen glikol
Penambahan ammonia akan membentuk campuran mono dan tri etanolamin dengan reaksi :
(CH2CH2)O + NH3 HO – CH2 – CH2 – NH2
etilen oksida ammonia tri etanolamin
1.2. Karbon Dioksida
Karbon dioksida adalah sa;ah satu gas di atmosfer, terdistribusi seragam pada permukaan bumi dengan konsentrasi sekitar 0,033% atau 330 ppm. Secara komersil, CO2 digunakan sebagai
refrigerant, minuman bersoda, dan pemadam api. Secara praktek sulit unyuk mengekstrak gas ini dari udara. Kebanyakan karbon dioksida diperoleh dari hasil samping dari proses lain seperti produksi etanol dengan fermentasi dan pembuatan amoniak (Shakhashiri, 2008)
Sifat-sifat fisika dan kimia karbon dioksida : 1. Rumus molekul : CO2
2. Berat molekul : 44,0095 g/mol
3. Bentuk fisik : gas tak berwarna (pada temperature tinggi)
4. Massa jenis : 1600 kg/m3
5. Titik lebur : -57oC 6. Titik didih : -78oC 7. Kelarutan dalam air : 1,45 kg/m3 8. Kalor laten sublimasi : 25, 13 kJ/mol 9. Viscositas : 0,07 cp pada -78oC 10. Tekanan Kritis : 7821 kPa
11. Suhu kritis : 34,1oC
12. Beraksi dengan air membentuk asam karbonat, dengan rekasi :
CO2 + H2O H2CO3
13. Pada foto sintesis karbon dioksida bereaksi dengan air membentuk karbohidrat/gula dan oksigen, denga reaksi:
6CO2 + 6H2O + Cahaya C6H12O6 + 6O2
Karbohidrat
14. Reaksi karbonasi etilen oksida dengan karbon dioksida, dengan reaksi :
C2H4O + CO2 C3H4O3
1.3. Etilen Karbonat
Etilen karbonat adalah salah satu ester dari etilen glkol dan asam karbonik. Ada temperature ruang, etilen karbonat berbentuk kristal transparan seperti padatan. Pada suhu 34-37oC berbentuk cairan yang tidak berwarna dan tidak berbau.
Sifat-sifat fisika dan kimia etilen karbonat : 1. Rumus molekul : C3H4O3
2. Berat molekul : 88,06 g/mol
3. Bentuk fisik : padatan berwarna kekuningan (pada 25 oC) dan cairan tak berwana (pada 34-37 oC) 4. Titik leleh : 34-37 oC 5. Titik didih : 260,7 oC 6. Titik beku : 36 oC 7. Densitas : 1,3210 g/cm3 8. Flash point : 150 oC 9. Viskositas : 1,5 cp (40 oC) 10. Spesific gravity : 1,3
11. Bereaksi dengan air membentuk etilen glikol :
C3H4O3 + H2O CO2 + C2H6O2
etilen karbonat etilen glikol
1.4. Air
Air mempunyai rumus kimia H2O yang berarti satu molekul air terdiri dari dua atom
hydrogen dan satu atom oksigen. Sering digunakan sebagai pelarut. Air merupakan senyawa kimia yang paling aman dan paling dibutuhkan seluruh makhluk hidup karena tanpa air makhluk
hidup tidak akan bertahan hidup. Ilmu yang mempelajari tentang kandungan, sifat-sifat, proses penyebaran, dan kebiasaan alami air dikenal dengan hidrologi.
Sifat-sifat fisika dan kimia air :
1. Rumus kimia : H2O
2. Berat molekul : 18,016 g/mol 3. Titik lebur : 0oC (1 atm)
4. Titik didih : 100oC
5. Densitas : 1 g/ml (4oC)
6. Spesific gravity : 1,0 (4o C)
7. Viskositas : 0,8949 cp
8. Indeks bias : 1,333 (20oC) 9. Kapasitas panas : 1 kal/g 10. Panas pembentukan : 80 kal/g 11. Panas penguapan : 340 kal/g 12. Temperatur kritis : 374oC 13. Tekanan kritis : 217 atm
14. Bereaksi dengan senyawa ester membentuk senyawa alkanot
CH3 – COOC2H5 + H2O CH3COOH + C2H5 – OH
ester asam karboksilat alcohol
15. Dapat terurai menjadi unsur-unsurnya dengan cara mengalirkan listrik (membentuk larutan elektrolit)
H2O H2O + ½O2
2. Produk dan Sifat-sifatnya 2. 1. Etilen Glikol
Etilen glikol pertama kali ditemukan oleh Charles Adolphe Wurtz pada tahun 1859 dengan hidrolisis etilen glikol diasetat via saponifikasi dengan KOH dan pada tahun 1860 melalui hidrolisis etilen oksida. Senyawa ini belum dikomersialkan hingga perang dunia pertama, dimana etilen glikol disentisis dari etilen diklorida dan digunakan sebagai substituent gliserol pada industry peledakan di Jerman.
Monoetilen glikol yang sering disebut etilen glikol adalah cairan jenuh, tidak berwarna, tidak berbau, berasa manis, dan larut sempurna dalam air. Grup hidroksil ini bisa diubah menjadi aldehid, alkil halide, amina, azida, asam karboksil, eter, merkaptan, ester nitrat, nitrit, aster nitrit, ester organic, ester posphat, dan ester sulfat. Senyawa-senyawa ini membuat etilen glikol bisa menjadi senyawa intermediet dengan banyak reaksi, terutama dalam formasi resin, termasuk kondensasi dengan dimetil terephtalat atau asam terphtalat yang menghasilkan resin polytester (MEG Global Group, 2008).
Sifat-sifat fisika dan kimia etilen glikol : 1. Rumus molekul : C2H6O2
2. Berat molekul : 62,068 g/mol
3. Densitas : 1,1132 g/cm3 4. Titik leleh : -12oC 5. Titik didih : 197,3 oC 6. Titik beku : -13oC 7. Flash point : 244oC 8. Spesific gravity : 1,115 9. Viskositas : 20,9 cp (20oC) 10. Densitas : 9,28 lb/gal (20oC) 11. Temperature kritis : 645, 2oC
12. Dapat mengalami oksidasi membentuk glioksial, dengan reaksi : C2H4(OH)2 + O2 CH2O2 + 2H2O
13. Etilen glikol beraksi dengan etilen oksida akan membentuk dietilen glikol yang selanjutnya akan beraksi lebih lanjut membentuk trietilen glikol, dengan reaksi :
C2H4O + C2H4(OH)2 C4H8(OH)2
C2H4O + C4H8(OH)2 C6H12O2(OH)2
2. 2. DEG (Dietilen Glikol)
Sifat-sifat fisika dan kimia dietilen glikol : 1. Rumus molekul : C4H8(OH)2
2. Berat molekul : 106,12
4. Titik beku : -6,5oC 5. Flash point : 280 oC 6. Temperature kritis : 681,04 oC 7. Tekanan kritis : 45,45 oC 8. Density kritis : 0,330 g/ml 9. Density pada 20oC : 1,116 g/ml 10. Viskositas pada 20oC : 36 cp 11. Panas penguapan : 129 kkal/kg
12. Beraksi dengan etilen oksida membentuk tri etilen glikol
Reaksi : C4H10O2 + C2H4O2 C6H14O4
3. Macam – macam Proses Pembuatan Etilen Glikol
Etilen glikol dapat di produksi dengan tiga proses yang berbeda (Mc Ketta dan
Cunningham, 1984) yaitu:
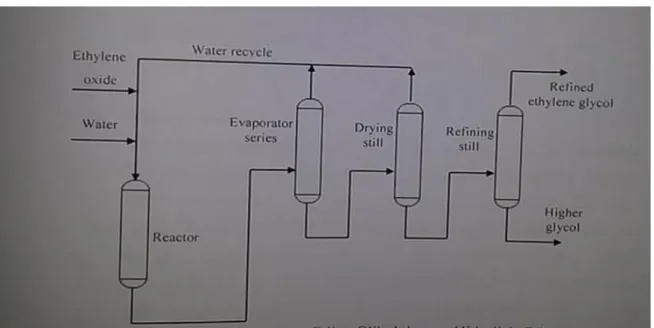
3.1 Proses Hidrolisis Etilen Oksida
Sejauh ini, metode ini merupakan metode yang paling banyak digunakan untuk produksi etilen glikol. Kesederhanaan dan kehandalan dari proses tersebut membuatnya popular. Reaksi kimianya cukup sederhana, dan dapat dijelaskan sebagai berikut: etilen oksida beraksi dengan air membentuk etilen gikol, dan etilen glikol yang terbentuk akan beraksi dengan etilen oksida membentuk dietilen glikol, lebih lanjut dietilen glikol ini akan bereaksi membentuk trietilen glikol. Pembentukan glikol lebih tinggi tidak bisa dihindari karena oksida beraksi lebih cepat dengan etilen glikol dibandingkan dengan air. Untuk menghindari terbentuknya dietilen glikol dan trietilen glikol dapat dilakukan dengan cara menambah jumlah air yang direkasikan. Proses ini berlangsung dengan menggunakan katalis perak dengan penyangga alumina dan katalis amberlist TM 400 pada kondisi 9 – 20 oC dan tekanan 1 – 30 bar.
Dengan menggunakan proses ini dapat dihasilkan etilen glikol sebesar 98,7 %. Beberapa pabrik yang menggunakan proses ini antara lain Nippon Shokubai, Dow Chemical, dan Union Carbide.
C2H4O2 + H2O C2H6O2
etilen oksida etilen glikol
etilen oksida dietilen glikol
Gambar 1. Proses Pembuatan Etilen Glikol dengan Hidrolisis Etilen Oksida
3.2. Proses Du Pont Formaldehid
Proses pembuatan etilen glikol dengan bahan baku etilen oksida saat ini tergantung pada harga etilen sebahai bahan baku pembuatan etilen oksida. Ketergantunga terhadap etilen sebagai bahan baku etilen oksida telah mendorong penyelidikan produksi etilen glikol alternatif proses yang berbasis pada gas sintesis (syngas), yang merupakan bahan baku lebih murah.
DuPont merupakan satu – satunya perusahaan yang benar – benar telah mengoperasikan sintesis berbasis syngas etilen oksida di sebuah pabrik komersial 1940 – 1968. Proses DuPont komersial yang digunakan berasal dari syngas formaldehid sebagai bahan baku uama dan asam sulfat sebagai katalis. Dalam proses ini, mula – mula formaldehid dikarbonasi dengan menggunakan karbon monoksida dan air membentuk asam hydroxyacetic (asam glikolat) pada suhu 200 oC dan 700 bar. Asam glikolat kemudian diesterifikasi dengan methanol untuk membentuk metil glikolat dan air. Metil glikolat selanjutnya dihidrogenasi untuk membentuk etilen glikol dengan disertai pelepasan methanol. Proses DuPont memberikan hasil molar 90% sesuai dengan formaldehida selama langkah karbonilasi.
CO + CH2O + H2O HOOCCH2OH
HOOCCH2OH + CH3OH CH3OOCCH2OH + H2O
3.3. Proses Karbonasi
Etilen Glikol dapat diproduksi dengan mereaksian etilen oksida dengan karbon dioksida membentuk etilen karbonat yang selanjutnya dihidrolisis menjadi etilen glikol. Unit oksidasi etilen dengan proses langsing menghasilkan etilen oksida yang kemudian diabsorbsi oleh suatu larutan absorben sebelum memasuki unit karbonasi. Keluaran dari menara absorbsi direaksikan dengan karbon dioksida, kemudian dikonversi menjadi etilen karbonat yang kemudian masuk ke unit hidrolisis untuk membentuk etilen glikol (Kawabe dkk, 1998). Proses karbonasi ini dapat berlangsung pada tekanan 14,5 bar dan temperature 80 – 150 oC dengan menggunakan katalis molybdenum.
Keuntungan yang paling signifikan pada proses ini yaitu konversi etilen oksida menjadi etilen karbonat yaitu 99,5% dan konversi etilen karbonat menjadi etilne glikl yang hampir sempurna (99%) dimana hanya sekitar 1% dihasilkan dietilen glikol dan senyawa glikol lainnya (Kirk dan Otthmer,1990).
Reaksi utama dalam pembuatan etilen glikol dari etilen dengan proses karbonasi, yaitu : (Kirk
dan otthmer, 1990)
C2H4O + CO2 C3H4O3
C3H4O3 + H2O CO2 + C2H6O2
4. Pemilihan Proses
Dari tiga proses yang dijelaskan diatas, proses yang paling efektif dan efisien adalah proses karbonasi. Pada proses du-pont membutuhkan biaya yang cukup tinggi dalam hal penyediaan bahan baku seperti foemaldehid, air, karbon monoksida, dan methanol. Selain itu peralaran yang dibutuhkan cukup banyak sehingga biaya produksi meningkat. Sedangkan pada proses dengan hidrolisis etilen oksida, agar absorbs etilen oksida dengan air maksimal, maka digunakan air dalam jumlah yang cukup besar. Setelah prosedur absorbs dan separasi etilen oksida, air yang digunakan dalam jumlah besar harus dipanaskan, sehingga akan membutuhkan jumlah energy yang sangat besar. Selain itu, proses dengan hidrolisis etilen oksida ini memerlukan banyak tahap menghasilkan etilen glikol.
Namun, pada proses karbonasi hanya membutuhkan bahan baku yaitu etilen, oksigen dari udara, karbondioksida dan air. Selain itu tahapan proses pada proses karbonasi tidak memerlukan banyak perlatan menjadikan proses ini lebih ekonomis dibandingkan proses du-pont ataupun proses hidrolisis etilen oksida. Dengan menggunakan proses karbonasi, penggunaan air berlebihan dapat dihindari karena proses ini menggunakan karbon dioksida, dimana CO2 ini bisa
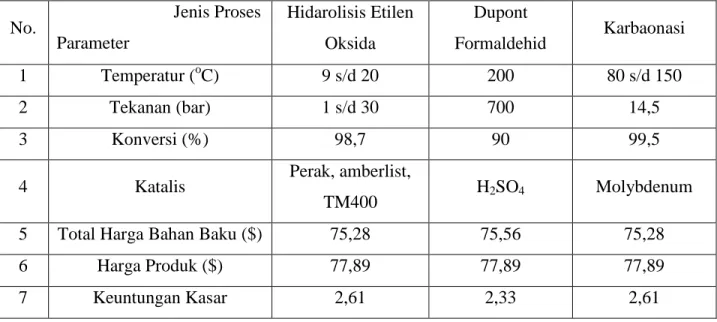
mengurangi pembentukan senyawa glikol berat, sehingga hanya memerlukan air yang sedikit. Proses ini juga mereduksi beberapa peralatan mahal untuk pemurnianetilen glikol seperti stripper. Keuntungan yang lainnya adalah kondisi operasi pada proses karbonasi ini lebih mudah dibandingkan dengan proses du-pont dan hidrolisis etilen oksida. Perbandingan tiga proses pembuatan etilen glikol dapat dilihat pada table berikut.
Tabel 1. Perbandingan Tiga Macam Proses Pembuatan Etilen Glikol No. Jenis Proses
Parameter Hidarolisis Etilen Oksida Dupont Formaldehid Karbaonasi 1 Temperatur (oC) 9 s/d 20 200 80 s/d 150 2 Tekanan (bar) 1 s/d 30 700 14,5 3 Konversi (%) 98,7 90 99,5
4 Katalis Perak, amberlist,
TM400 H2SO4 Molybdenum
5 Total Harga Bahan Baku ($) 75,28 75,56 75,28
6 Harga Produk ($) 77,89 77,89 77,89
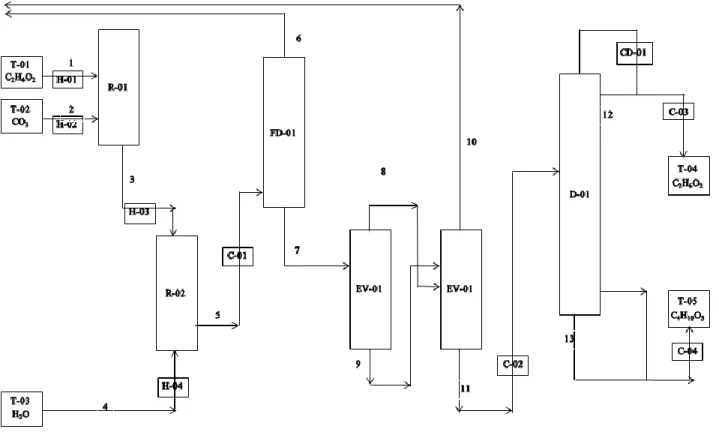
5. Deskripsi Proses
Proses produksi etilen glikol (C2H6O2) dapat dibagi menjadi empat tahapan proses yaitu
proses persiapan bahan baku, proses karbonasi, proses hidrolisis, dan proses pemurnian etilen glikol.
5.1. Persiapan Bahan Baku
Bahan baku yang digunakan dalam proses produksi etilen glikol adalah gas etilen oksida dan gas karbon dioksida. Etilen oksida (C2H4O) dari tangki etilen oksida (T-01) pada tekanan 1
atm dan temperatur 30 oC dialirkan dengan blower 1 (B-01) ke reaktor karbonasi (R-01) yang sebelumnya dilewatkan melalui heater 1 (H-01) hingga mencapai temperatur 70 oC. gas karbon dioksida (CO2) dari tangki karbon dioksida (T-02) pada tekanan 1,1 atam dan temperatur 31 oC
dialirkan dengan blower 2 (B-02) ke reaktor karbonasi (R-01) yang sebelumnya melalui heater 2 (H-02) hingga temperaturnya 70oC.
5.2. Proses Karbonasi
Pembuatan etilen glikol dihasilkan melalui proses karbonasi etilen oksida dan karbon dioksida dengan katalis molybdenum yang menghasilkan senyawa intermediet yaitu etilen karbonat. Reaksi berlangsung secara eksotermik sehingga untuk menyerap kelebihan panas reaksi digunakann multitube fixed bed reactor dilengkapi dengan pendingin. Reaksi yang berlangsung adalah :
C2H4O + CO2 C3H4O3
etilen oksida karbon dioksida etilen karbonat
Proses karbonasi ini berlangsung pada tekanan 5507 kPa dengan temperatur operasi 100oC. jika temperatur operasi terlalu rendah maka lau reaksi akan lambat, reaksi akan berlangsung sangat lama, ukuran reaktor akan lebih besar sehingga tidak ekonomis. Di sisi lain, jika proses dioperasikan pada temperatur tinggi maka banyak panas yang akan hilang dan memberikan efek buruk pada kualitas produk yang dihasilkan. Dari pertimbangan diatas maka temperatur operasi yang digunakan adalah 100oC. konversi reaksi etilen oksida menjadi etilen karbonat pada proses ini adalah 99,5%. Kemudian, produk dari reaktor karbonasi dialirkan
dengan menggunakan pompa 2 (P-02) ke reaktor hidrolisis (R-02) yang sebelumnya dilewatkan pada heater 3 (H-03) untuk mencapat temperatur 130oC.
5.3. Proses Hidrolisis
Air pada temperatur 30oC dialirkan dengan menggunaka pompa 1 (P-01) menuju ke reaktor hidrolisis (R-02) yang sebelumnya temperaturnya dinaikkan hingga 80oC dengan dilewatkan heater 4 (H-04).
Sama seperti pada reaksi karbonasi, reaksi hidrolisis juga berlangsung secara eksotermik sehingga diperlukan multitube fixed bed reactor yang dilengkapi dengan pendingin. Reaksi yang berlangsung adalah :
C3H4O3 + H2O CO2 + C2H6O2
etilen karbonat air karbon dioksida etilen glikol
2C3H4O3 + H2O 2CO2 + C4H10O3
etilen karbonat air karbon dioksida dietilen glikol
Reaksi dalam reaktor hidrolisis berlangsung pada temperatur 150oC dan tekanan 709 kPa. Kondisi ini diharapkan agar etilen karbonat terkonversi hingga mendekati 100% (99% menjadi etilen glikol dan 1% mejadi dietilen glikol).
Produk yang dihasilkan pada reaktor ini adalah etilen glikol, dietilen glikol, gas CO2, dan air
yang tidak beraksi.
5.4. Pemurnian Produk
Produk yang dihasilkan dari reaktor hidrolisis dialirkan dengan menggunakan pompa 3 (P-03) menuju flash drum yang sebelumnya didinginkan dengan cooler 1(C-01) hingga temperaturnya 80oC. Dalam flash drum, gas karbon dioksida dipisahkan sebagai gas buang, dan produk lain dialirkan menuju evaporator 1 (EV-01) dan evaporator 2 (EV-02) untuk memisahkan kandungan airnya. Hasil pemisahan pada evaporator 2 (EV-02) dialirkan menuju kolom detilasi untuk memisahkan etilen glikol sebagai produk atas dan dietilen glikol produk bawah. Etilen glikol sebagai produk utama ditampung pada tangki etilen glikol (T-04) dan dietilen glikol sebagai produk samping ditampung pada tangki dietilen glikol (T-05) yang sebelumnya masing – masing produk akan didinginkan terleboh dahulu melewati cooler 3 (C-03) dan cooler 4 (C-04).
Gambar 3. Diagram Alir Proses Pembuatan Etilen Glikol
Neraca Massa
Berat molekul (BM) senyawa :
Mono Etilen Glikol, MEG (C2H6O2) = 62,070 kg/kmol
Dietilen Glikol, DEG (C4H10O3) = 106,120 kg/kmol
Etilen Karbonat, EC (C3H4O3) = 88,064 kg/kmol
Etilen Oksida, EO (C2H4O) = 44,052 kg/kmol
Karbon Dioksida (CO2) = 44,011 kg/kmol
Air (H2O) = 18,016 kg/kmol
(Sumber : Reklaitis, G. V, 1983)
Basis umpan masuk :
Etilen Oksida (C2H4O) = 100 kg/jam
Kapasitas produksi :
Kapasitas produksi = 400.000 ton/tahun
= 400.000.000 kg/tahun = 6444337,04 kmol/tahun Waktu operasi produksi :
Waktu operasi produksi = 330 hari/tahun
Keterangan penulisan aliran proses : Fn = Aliran massa pada aliran ke-n
1. Reaktor 1 (R-01)
Fungsi : untuk mereaksikan etilen oksida dari tangki T-01 dengan karbon dioksida dari tangki T-02 membentuk etilen karbonat.
Mol rasio C2H4O : CO2 = 0,8 : 1 (Sumber : U.S. patent no. 4,400,559)
Jadi CO2 yang dibutuhkan =
=
= 2,84 kmol/jam
Konversi C2H4O pada Reaktor R-01 = 99,5% (Sumber : U.S. patent no. 4,400,559)
Rekasi yang terjadi pada Reaktor R-01 : C2H4O + CO2 C3H4O3
C2H4O yang beraksi = 99,5% x 2,27 kmol/jam = 2,26 kmol/jam
1 C2H4O 3 C2H4O 2 CO2 CO2 C3H4O3 C2H4O + CO2 C3H4O3 Mula-mula(kmol/jam) 2,27 2,84 0 Beraksi (kmol/jam) 2,26 2,26 2,26 Sisa (kmol/jam) 0,01 0,58 2,26
Aliran masuk reaktor R-01 (F1 dan F2)
F1C2H4O = 100 kg/jam (basis umpan masuk)
= 2,84 x 44,011 =124,99 kg/jam Aliran keluar reaktor R-01 (F3)
F3C2H4O = mol C2H4O x BM C2H4O = 0,01 x 44,052 = 0,44 kg/jam F3CO2 = mol CO2 x BM CO2 = 0,58 x 44,011 = 25,53 kg/jam F3C3H4O3 = mol C3H4O3 x BM C3H4O3 = 2,26 x 88,064 = 199,02 kg/jam
Table 1. Neraca Massa di Reaktor 1 (R-01)
Komponen BM
(gr/kmol) Aliran Masuk
Aliran Keluar F1 (kg/jam) F2 (kg/jam) F3 (kg/jam)
C2H4O 44,052 100 0 0,44 CO2 44,011 0 124,99 25,53 C3H4O3 88,064 0 0 199,02 Total 100 124,99 224,99 224,99 2. Reaktor 2 (R-02)
Fungsi : untuk mereaksikan etilen karbonat hasil reaksi pada reaktor R-01 dengan air dari tangki T-03 yang menghasilkan mono etilen glikol (MEG) dan dietilen glikol (DEG).
Mol rasio C3H4O3 : H2O = 1 : 3 (Sumber : U.S. patent no. 4,519,875)
Jadi H2O yang dibutuhkan = 3 x mol C3H4O3
= 3 x 2,26 = 6,78 kmol/jam Pada reaktor R-02 terjadi reaksi bertahap sebagai berikut :
(1) C3H4O3 + H2O CO2 + C2H6O2
(2) 2C3H4O3 + H2O 2CO2 + C4H10O3
Konversi etilen karbonat pada reaktor R-02 adalah 100% (99% menjadi MEG (C2H6O2) dan 1 %
menjadi DEG (C4H10O3)) (Sumber : U.S. patent no. 5,763,691)
3 C2H4O C2H6O2 CO2 5 CO2 C3H4O3 C4H10O3 4 H2O H2O Reaksi 1: C3H4O3 + H2O CO2 + C2H6O2 Mula-mula (kmol/jam) 2,26 6,78 0 0 Beraksi (kmol/jam) 2,24 2,24 2,24 2,24 Sisa (kmol/jam) 0,02 4,54 2,24 2,24 Reaksi 2 : 2C3H4O3 + H2O 2CO2 + C4H10O3 Mula-mula (kmol/jam) 0,02 4,54 0 0 Beraksi (kmol/jam) 0,02 0,01 0,02 0,01 Sisa (kmol/jam) 0 4,53 0,02 0,01 Reaksi 3 : C2H4O + H2O C2H6O2 Mula-mula (kmol/jam) 0,01 4,53 0 Beraksi (kmol/jam) 0,01 0,01 0,01 Sisa (kmol/jam) 0 4,52 0,01
Aliran masuk reaktor R-02 ( F3 dan F4) : F3C2H4O = 0,44 kg/jam
F3CO2 = 25,53 kg/jam F3C3H4O3 = 199,02 kg/jam F4H2O = mol H2O x BM H2O
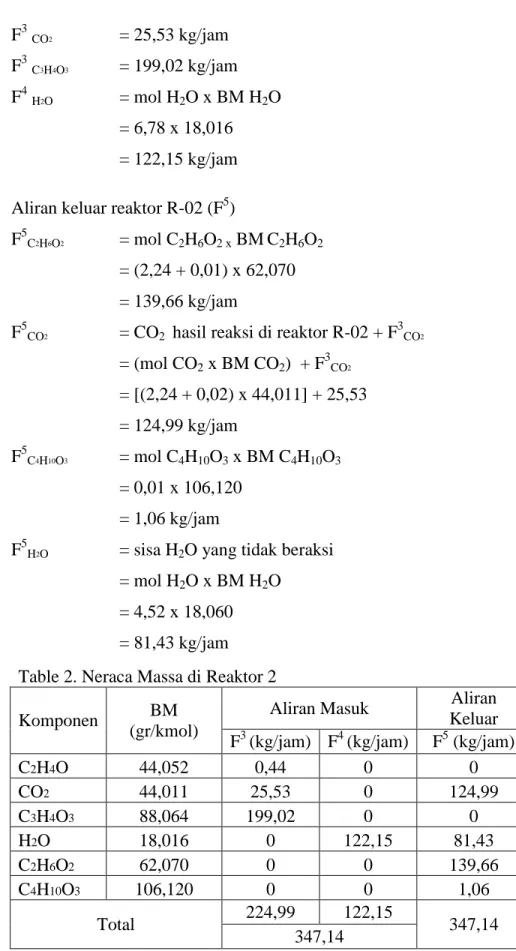
= 6,78 x 18,016 = 122,15 kg/jam Aliran keluar reaktor R-02 (F5)
F5C2H6O2 = mol C2H6O2 x BMC2H6O2
= (2,24 + 0,01) x 62,070 = 139,66 kg/jam
F5CO2 = CO2 hasil reaksi di reaktor R-02 + F3CO2 = (mol CO2 x BM CO2) + F3CO2 = [(2,24 + 0,02) x 44,011] + 25,53 = 124,99 kg/jam F5C4H10O3 = mol C4H10O3 x BM C4H10O3 = 0,01 x 106,120 = 1,06 kg/jam
F5H2O = sisa H2O yang tidak beraksi = mol H2O x BM H2O
= 4,52 x 18,060 = 81,43 kg/jam
Table 2. Neraca Massa di Reaktor 2
Komponen BM
(gr/kmol)
Aliran Masuk Aliran
Keluar F3 (kg/jam) F4 (kg/jam) F5 (kg/jam)
C2H4O 44,052 0,44 0 0 CO2 44,011 25,53 0 124,99 C3H4O3 88,064 199,02 0 0 H2O 18,016 0 122,15 81,43 C2H6O2 62,070 0 0 139,66 C4H10O3 106,120 0 0 1,06 Total 224,99 122,15 347,14 347,14
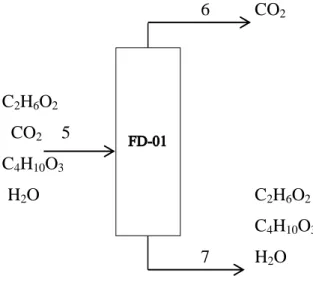
3. Flash Drum 1 (FD-01)
Fungsi : untuk memisahkan CO2 dari aliran yang masuk ke dalam separator S-01, asumsi
CO2 terpisahkan semua. 6 CO2 C2H6O2 CO2 5 C4H10O3 H2O C2H6O2 C4H10O3 7 H2O
Aliran masuk flash drum FD-01 (F5) F5CO2 = 124,99 kg/jam F5C2H6O2 = 139,66 kg/jam F5C4H10O3 = 1,06 kg/jam F5H2O = 81,43 kg/jam
Aliran keluar flash drum FD-01 ( F6 dan F7) F6CO2 = 124,99 kg/jam
F7C2H6O2 = 139,66 kg/jam F7C4H10O3 = 1,06 kg/jam F7H2O = 81,43 kg/jam
Table 3. Neraca Massa di Flash Drum 1
Komponen BM
(gr/kmol)
Aliran
Masuk Aliran Keluar
F5 (kg/jam) F6 (kg/jam) F7 (kg/jam)
CO2 44,011 124,99 124,99 0 H2O 18,016 81,43 0 81,43 C2H6O2 62,070 139,66 0 139,66 C4H10O3 106,120 1,06 0 1,06 Total 347,14 124,99 222,15 347,14
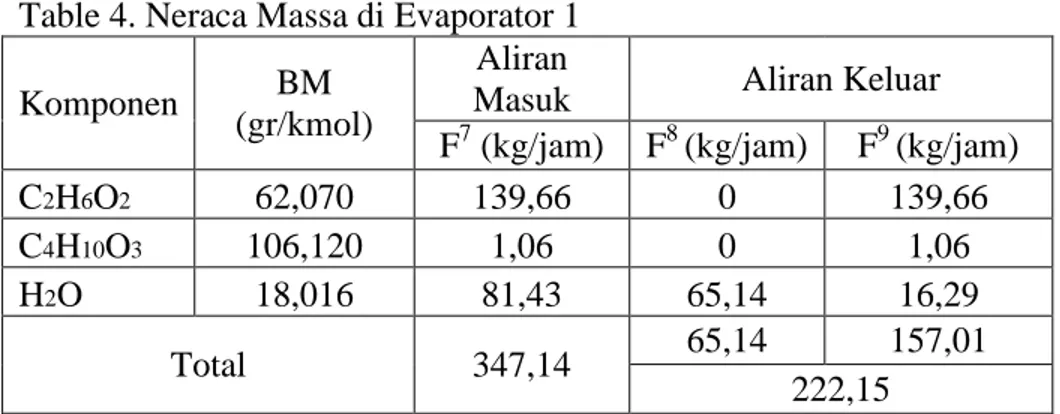
4. Evaporator 1 (EV- 01)
Fungsi : unutuk memekatkan larutan glikol dengan cara menguapkan 80% H2O, umpan
masuk dengan kandungan air 36,6%.
8 H2O C2H6O2 7 C4H10O23 H2O C2H6O2 C4H10O3 9 H2O
Aliran masuk evaporator EV-01 ( F7 ) : F7C2H6O2 = 139,66 kg/jam
F7C4H10O3 = 1,06 kg/jam F7H2O = 81,43 kg/jam
Aliran keluar evaporator EV-01 (F8 dan F9) F8H2O = 80% x F 7 H2O = 80% x 81,43 kg/jam = 65,14 kg/jam F9H2O = F 7 H2O - F 8 H2O = 81,43 – 65,14 = 16,29 kg/jam F9C2H6O2 = F 7 C2H6O2 = 139,66 kg/jam F9C4H10O3 = F 7 C4H10O3 = 1,06 kg/jam
Table 4. Neraca Massa di Evaporator 1
Komponen BM
(gr/kmol)
Aliran
Masuk Aliran Keluar
F7 (kg/jam) F8 (kg/jam) F9 (kg/jam)
C2H6O2 62,070 139,66 0 139,66 C4H10O3 106,120 1,06 0 1,06 H2O 18,016 81,43 65,14 16,29 Total 347,14 65,14 157,01 222,15 5. Evaporator 2 (EV-02)
Fungsi : untuk memekatkan larutan glikol dengan cara menguapkan 80% H2O.
10 H2O H2O 8 C2H6O2 C4H10O3 C2H6O2 H2O 9 C4H10O3 11 H2O
Aliran masuk evaporator EV-02 (F8 dan F9) F8H2O = 65,14 kg/jam
F9H2O = 16,29 kg/jam
F9C2H6O2 = 139,66 kg/jam F9C4H10O3 = 1,06 kg/jam
Aliran keluar evaporator EV-02 (F10 dan F11) F10H2O = 80% x F9H2O = 80% x 16,29 kg/jam = 13,032 kg/jam F9H2O = F 9 H2O – F 10 H2O = 16,29 – 13,032
= 3,258 kg/jam F9C2H6O2 = F 7 C2H6O2 = 139,66 kg/jam F9C4H10O3 = F 7 C4H10O3 = 1,06 kg/jam
Table 5. Neraca Massa di Evaporator 2
Komponen BM
(gr/kmol)
Aliran
Masuk Aliran Keluar
F9 (kg/jam) F10 (kg/jam) F11 (kg/jam)
C2H6O2 62,070 139,66 0 139,66 C4H10O3 106,120 1,06 0 1,06 H2O 18,016 16,29 13,032 3,258 Total 157,01 13,032 143,978 157,01 6. Destilasi 1 (D-01)
Fungsi : memisahkan C2H6O2, C4H10O3 dan H2O yang masuk ke destilasi D-01 menjadi
produk atas C2H6O2, C4H10O3 dan H2O , sedangkan produk bawah C2H6O2, C4H10O3 dan H2O.
12 C2H6O2 C4H10O3 H2O C2H6O2 11 C4H10O3 H2O C2H6O2 C4H10O3 13 H2O
Komposisi komponen pada produk atas destilasi D-01 aliran 12 (F12) : Fraksi massa C2H6O2, X12C2H6O2 = 0,995
Fraksi massa C4H10O3, X12C4H10O3 = 0,0003 Fraksi massa H2O, X12H2O = 0,0047
(Sumber : U.S. patent no. 4,519,875)
Fraksi massa C2H6O2, X13C2H6O2 = 0,196
(Sumber : U.S. patent no. 4,519,875)
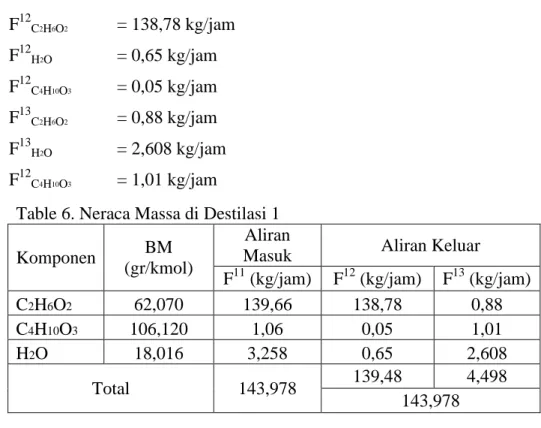
Kesetimbangan massa total : F11 = F12 + F13 143,978 = F12 + F13 F13 = 143,978 – F12...(1) Kesetimbangan massa C2H6O2 : X11C2H6O2 . F 11 C2H6O2 = X 12 C2H6O2 . F 12 + X13C2H6O2 . F 13 139,66 = 0,995 . F12 + 0,196 . F13 ...(2) Subtitusi (1) ke (2) 139,66 = 0,995 . F12 + 0,196 . (143,978 – F12) F12 = 139,48 kg/jam F13 = 143,978 – 139,48 = 4,498 kg/jam F12C2H6O2 = 0,995 . 139,48 kg/jam = 138,78 kg/jam F12H2O = 0,0047 . F 12 = 0,65 kg/jam F12C4H10O3 = 139, 48 - 138,78 – 0,65 = 0,05 kg/jam F13C2H6O2 = 0,196 . F 13 = 0,88 kg/jam F13H2O = 3,258 – 0,65 = 2,608 kg/jam F12C4H10O3 = 1,06 – 0,05 = 1,01 kg/jam
Aliran msuk destilasi D-01 (F11) F11H2O = 3,258 kg/jam
F11C2H6O2 = 139,66 kg/jam F11C4H10O3 = 1,06 kg/jam
F12C2H6O2 = 138,78 kg/jam F12H2O = 0,65 kg/jam F12C4H10O3 = 0,05 kg/jam F13C2H6O2 = 0,88 kg/jam F13H2O = 2,608 kg/jam F12C4H10O3 = 1,01 kg/jam
Table 6. Neraca Massa di Destilasi 1
Komponen BM
(gr/kmol)
Aliran
Masuk Aliran Keluar
F11 (kg/jam) F12 (kg/jam) F13 (kg/jam)
C2H6O2 62,070 139,66 138,78 0,88
C4H10O3 106,120 1,06 0,05 1,01
H2O 18,016 3,258 0,65 2,608
Total 143,978 139,48 4,498
143,978
Total produk yang dihasilkan
F12 = 139,48 kg/jam (dengan kemurnian C2H6O2, 99,5 %)
F13 = 4,498 kg/jam (denga kemurnian C4H10O3, 22,45%)
Faktor pengali :
Kapasitas pabrik = 400.000 ton/tahun = = 50505,0505 kg/jam
Etilen glikol (C2H6O2) yang dihasilkan = 139,48 kg/jam
Faktor pengali =
Neraca Massa Sebenarnya 1. Raktor 1 (R-01)
Table 1. Neraca Massa Sebenarnya di Reaktor 1
Komponen BM
(gr/kmol)
Aliran Masuk Aliran
Keluar F1 (kg/jam) F2 (kg/jam) F3 (kg/jam)
C2H4O 44,052 36.209,50 0 159,32 CO2 44,011 0 45.258,25 9.244,29 C3H4O3 88,064 0 0 72.064,15 H2O 18,016 0 0 0 C2H6O2 62,070 0 0 0 C4H10O3 106,120 0 0 0 Total 36.209,50 45.258,25 81.467,75 81.467,75 2. Reaktor 2 (R-02)
Table 2. Neraca Massa Sebenarnya di Reaktor 2
Komponen BM
(gr/kmol)
Aliran Masuk Aliran
Keluar F3 (kg/jam) F4 (kg/jam) F5 (kg/jam)
C2H4O 44,052 159,32 0 0 CO2 44,011 9.244,29 0 45.258,25 C3H4O3 88,064 72.064,15 0 0 H2O 18,016 0 44.229,90 29.485,40 C2H6O2 62,070 0 0 50.570,19 C4H10O3 106,120 0 0 383,82 Total 81.467,75 44.229,90 125.697,66 125.697,66
3. Flash Drum 1 (FD-01)
Table 3. Neraca Massa Sebenarnya di Flash Drum 1
Komponen BM
(gr/kmol)
Aliran
Masuk Aliran Keluar
F5 (kg/jam) F6 (kg/jam) F7 (kg/jam)
C2H4O 44,052 0 0 0 CO2 44,011 45.258,25 45.258 0 C3H4O3 88,064 0 0 0 H2O 18,016 29.485,40 0 29.485,40 C2H6O2 62,070 50.570,19 0 50.570,19 C4H10O3 106,120 383,82 0 383,82 Total 125.697,66 45.258,25 80.439,40 125.697,66 4. Evaporator 1 (EV-01)
Table 4. Neraca Massa Sebenarnya di Evaporator 1
Komponen BM
(gr/kmol)
Aliran
Masuk Aliran Keluar
F7 (kg/jam) F8 (kg/jam) F9 (kg/jam)
C2H4O 44,052 0 0 0 CO2 44,011 0 0 0 C3H4O3 88,064 0 0 0 H2O 18,016 29.485,40 23.586,87 5.898,53 C2H6O2 62,070 50.570,19 0 50.570,19 C4H10O3 106,120 383,8207 0 383,8207 Total 80.439,40 23.586,87 56.852,54 80.439,40
5. Evaporator 2 (EV-02)
Table 5. Neraca Massa Sebenarnya di Evaporator 2
Komponen BM
(gr/kmol)
Aliran
Masuk Aliran Keluar
F9 (kg/jam) F10 (kg/jam) F11 (kg/jam)
C2H4O 44,052 0 0 0 CO2 44,011 0 0 0 C3H4O3 88,064 0 0 0 H2O 18,016 5.898,53 4.718,82 1.179,71 C2H6O2 62,070 50.570,19 0 50.570,19 C4H10O3 106,120 383,82 0 383,82 Total 56.852,54 4.718,82 52.133,71 56.852,54 6. Destilasi 1 (D-01)
Table 6. Neraca Massa Sebenarnya di Destilasi 1
Komponen BM
(gr/kmol)
Aliran
Masuk Aliran Keluar
F11 (kg/jam) F12 (kg/jam) F13 (kg/jam)
C2H4O 44,052 0 0 0 CO2 44,011 0 0 0 C3H4O3 88,064 0 0 0 H2O 18,016 1.179,71 235,36 944,34 C2H6O2 62,070 50.570,19 50.251,54 318,64 C4H10O3 106,120 383,82 18,10 365,72 Total 52.133,71 50.505,011 1.628,70 52.133,71