SOLUSI NUMERIK JERAPAN KIMIA MODEL “LANGMUIR-HINSHELWOOD” MENGGUNAKAN PERANGKAT LUNAK MATLAB.
Muzakky*, Imam Prayogo*, Muhadi A.W.*
ABSTRAK
SOLUSI NUMERIK JERAPAN KIMIA MODEL “LANGMUIR-HINSHELWOOD” MENGGUNAKAN PERANGKAT LUNAK MATLAB. Telah dilakukan solusi numerik jerapan kimia
model “Langmuir-Hinshelwood” logam U(VI), Cr(IV) dan Cu(II) dengan program Matlab. Penelitian ini bertujuan untuk memprediksi pengaruh jerapan kimia seperti pH dan kompetisi logam ikutan, serta membandingkan hasil solusi numerik dengan hasil percobaan laboratorium. Ternyata solusi numerik jerapan kimia pada pH 5 mendekati percobaan laboratorum, tetapi pada pH 9 solusi numerik cenderung lebih tinggi dari percobaan laboratorium. Hal ini disebabkan pada pH = 9 logam akan lebih dahulu mengendap sebelum proses penjerapan kimia terjadi. Dari solusi numerik dan percobaan laboratorium didapat bahwa kesetimbangan jerapan U(VI) sebesar 200 menit, kemudian Cr(III) dan Cu(II) masing-masing mempunyai kesetimbangan jerapan sebesar 800 menit dan 1000 menit.
ABSTRACT
THE NUMERICAL SOLUTION OF CHEMICAL SORPTION “LANGMUIR-HINSHELWOOD” MODEL USING MATLAB SOFTWARE. The numerical solution of chemical
sorption “Langmuir-Hinshelwood” model for U(VI),Cr(III) and Cu(II) metals using Matlab have been done. This investigation is aimed at predicting the influence of chemical sorption such as pH and the competition of common metals,as well as comparing the numerical solution result to the experimental result. If turned act that the numerical solution of chemical sorption at pH=5 is close to the experimental result, but at the pH=9 the numerical solution bend to higher that the experimental work. The reason is that at pH=9 the metals would be precipitated before to the chemical sorption occurred. It was conclused from the numerical solution and the experiment that the sorption equilibrium of U(VI) was 200 minutes, while Cr(III) and Cu(II) were 800 minutes and 1000 minutes respectively.
PENDAHULUAN
Jerapan atau adsorpsi bahan padat terhadap solute dapat terjadi karena proses fisika atau kimia. Pendekatan model matematis jerapan tersebut biasanya dengan model Gibbs, BET, Langmuir, Freundlich ataupun Penukar ion. Tetapi untuk asam
humat sebagai penjerap alam yang berupa makromolekul, berdimensi tiga, terdiri banyak campuran molekul organik yang berbeda (“Phenol-Carboxylate polyelectrolite”[1] ), berat molekul rerata 15.000 (gr/gramol) dengan diameter 1,72 (nm)[2] pendekatan tersebut di atas tidak dapat dipakai karena sering kali mengabaikan kapasitas “multi-ligand”nya sebagai penjerap kimiawi. Suatu konsep yang dikembangkan oleh Davydov[3] dan diadopsi oleh Jin.X[4] mengembangkan jerapan kimia dari sifat dasar macromolekul asam humat yang diidentikan dengan makromolekul protein, dan selanjutnya dikenal dengan model jerapan “Langmuir-Hinshelwood”(LH). Model tersebut menarik untuk diteliti karena keunggulannya dalam memprediksi laju jerapan khususnya asam humat terhadap species polutan logam yang toksik, seperti U(VI), Cr(IV) dan Cu(II) beserta parameter yang berpengaruh terhadap jerapan LH tersebut.
Model matematik jerapan kimia LH tersebut di atas diturunkan dari kesetimbangan kimiawi antara metal tunggal (M) dengan multi ligand (LI)[5], yang secara garis besar merupakan persamaan deferensial ordiner dengan bentuk[1] :
- ra = - dCM / dt = k1 * [M] / (1 + ko * [M]) (1)
dengan:
ko = konstante kecepatan reaksi order nol, (mole/l)-1
k1 = konstante kecepatan reaksi order satu, (min)-1
ra = k1/ ko = kecepatan atau laju reaksi, (mole/l).min-1 ;
CM / dt = konsentrasi ion logam dalam larutan setiap detik (mole/l).
[M] = konsentrasi logam yang terjerap dalam asam humat (mole/l).
Dengan asumsi harga k1 dan ko diperoleh dari hasil percobaan laboratorium atau tabel, maka solusi persamaan diferensial ordiner tersebut diatas dipilih metoda Runge-Kutta yang terdapat dalam fasilitas perangkat lunak “Matlab” versi 4.2c.1[6]. Pada penelitian ini akan dicoba menyelesaikan model matematik jerapan LH di atas beserta dengan pengaruhnya seperti pH, perbandingan ion logam terjerap dengan ion logam lain dan kompetisi jerapan akibat dari banyaknya ion logam lain.
TEORI
Pengaruh pH
Untuk mengetahui bagaimana pengaruh pH terhadap reaksi single logam (M) terhadap multi ligand (LI) (reaksi no 1), kita lihat 2 kesetimbangan reaksi berikut.
M + Li MLi (2) H + Li HLi (3) Dan konstante kesetimbangan persamaan (2) dan (3), adalah
KM = [MLi] / [M] * [Li] (4)
KH = [HLi] / [H] * [Li] (5)
Neraca masa yang dibutuhkan dari ke dua persamaan di atas adalah :
[M] = CM - [MLi] (6)
[HLi] = C L - [MLi] - [Li] (7)
Dari persamaan (4), notasi [L] dapat dinyatakan sbb. :
[Li] = [MLi] / KM * [M]. (8)
Bila persamaan (8), [L] disubtitusikan pada persamaan (7) akan menghasilkan: [HLi] = {(KM * [M] * CL ) - (1 + KM * [M] ) [MLi]} / {KM * [M]} …. (9)
Dari difinisi persamaan (4) dan (5), perbandingan dua konstante tersebut dapat dinyatakan sbb. :
KM / KH = ([MLi] * [H]) / ([M] * [HLi]). (10)
Bila [HL] pada persamaan (9) kita subtitusikan pada persamaan (10) kita dapatkan harga [MLi] pada persamaan (11) adalah sbb. :
[MLi] = (KM * CL) * [M] / 1 + KM * [M] + KH* [H] (11)
Menurut Jin, X. [4], bahwa pembilang (KM * CL) pada persamaan (11) merupakan konstante kecepatan reaksi order 1 ( = k1), sedangkan pada penyebut KM merupakan konstante kecepatan reaksi order O (= ko), sehingga laju kecepatan reaksi pembentukan [MLi] atau (-ra) dan jerapan model LH, sebagai fungsi waktu adalah[4]: - ra = - dCM / dt = k1 * [M] / (1 + ko * [M] + KH * [H] ) (12)
Pengaruh Adanya Ion Logam Lain
Untuk mempelajari pengaruh ion lain, kita misalkan dalam sistem larutan kimiawi yang dipelajari mengandung ion logam M dan N dengan keadaan konsentrasi ion hidrogen H, akan dijerap dengan asam humat Li. Sehingga terdapat tiga reaksi kesetimbangan sbb. :
M + Li MLi (2) H + Li HLi (3) N + Li NLi (13) Konstante kesetimbangan ke tiga reaksi tersebut adalah:
KM = [MLi] / [M] * [Li] (4)
KH = [HLi] / [H] * [Li] (5)
KN = [NLi] / [N] * [Li] (14)
Neraca masa yang dibutuhkan dari ke dua persamaan di atas adalah :
[M] = CM - [MLi] (6)
[N] = C N - [NLi] (15)
[HLi] = C L - [MLi] - [NLi] - [Li] (16)
Dengan cara matematik seperti persamaan (2) hingga persamaan (11), kita dapatkan laju kecepatan reaksi (-ra) model jerapan LH yang identik dengan konsentrasi ion metal yang tertinggal dalam larutan [M] sebagai fungsi waktu sbb. :
- ra = - dCM / dt = k1 * [M] / (1 + ko * [M] + KN * [N] + KH * [H] ) (17) Dari penjabaran persoalan-persoalan di atas, bila sistem tersebut mengandung multi-logam yang saling berpengaruh dan saling berkompetisi dari satu logam terhadap logam yang lain secara umum persamaan (17) dapat disingkat menjadi :
dengan indeks KXi dan [x], merupakan simbul total konstante pembentukan kompleks ion logam pengotor dan [x] merupakan total konsentrasi ion logam pengotor yang terdapat dalam sistem.
TATA KERJA
Percobaan Laboratorium Bahan-bahan :
1. Asam humat, yang diperoleh dari hasil isolasi tanah gambut yang diperoleh dari Sumatra Barat. Isolasi dilakukan dengan menggunakan metode”Scnitzer”[6]. 2. Garam nitrat, Cr(NO3)3, U(NO3)2 .7 H2O, dan Cu(NO3)2.dari Merck Co Inc. 3. Filter membrane 0,20-mikrometer, dari Schicher & Schuell Inc.
Alat-alat:
1. Reaktor batch, pada labu leher 3 yang berkapasitas 300 ml, yang dilengkapi water bath untuk menjaga temperatur terjaga 25 ± 0,010C.
2. Siringe, pH meter dan alat-alat laboratorium lain
3. Seperangkat alat AAS, beserta lampu katoda buatan “Simatshu” 4. PC komputer, yang dilengkapi perangkat lunak “Matlab” version 4.2c,1
Cara kerja :
Kedalam reaktor batch dimasukan asam humat sebanyak 150 mg, dan diaduk dengan kecepatan konstan. Kedalamnya di masukkan ion logam dengan konsentrasi 12,54 ppm. Kedalam sistem larutan tersebut setelah volume akhir 200 ml, dibuat sedemikian rupa sehingga pH = 5-6, dan kekuatan ion larutan menjadi 1.10-3 mol/l Ca(NO3)2. Pada selang waktu tertentu secara periodik diambil sebanyak 10 ml hasil reaksi dengan siringe, kemudian disaring dengan membrane filter 0,2 um. Hasil saringan yang mengandung Cr(III) atau Cu(II) di analisis dengan alat AAS, sedangkan U(VI) dengan pendar sinar x. Setelah didapat data konsentrasi logam sebagai fungsi waktu dibuat kurva antara [ln(Co/ CA)]/( Co/ CA) lawan t/(Co/ CA), akan didapat persamaan garis lurus dengan k1 dan ko sebagai slope dan intersep sesuai dengan persamaan 19[4] (19) A o o A o A o C C t k k C C C C − = + − . 1 ln
Simulasi Komputer/Diagram Alir
Mulai
Bukalah M-File baru, tulis persamaan diferensial, masukan harga k1dan ko masing-masing logam dan simpanlah
sebagai function M-File (1)
Bukalah M-File baru, buatlah format numerik “Bank”, masukkan harga batas awal, dan daerah
operasi waktu dalam perintah “ODE23” serta simpanlah sebagai function M-File (2)
Masukan data percobaan laboratorium untuk masing masing
logam terjerap
Buatlah out-put grafika dengan perintah subplot(111) dan teks yang diinginkan
Out-put grafika valid
Selesai
tidak
HASIL DAN DISKUSI
Solusi dari persamaan 1, 12, 17 dan 18 diawali dengan penentuan harga konstante ko dan k1 yang didapat dari hasil percobaan laboratorium dengan cara membuat kurva antara [ln(Co/ CA)]/( Co/ CA) lawan t/(Co/ CA), akan didapat persamaan garis lurus dengan k1 dan ko sebagai slope dan intersep sesuai dengan persamaan 19, dengan hasil sbb :
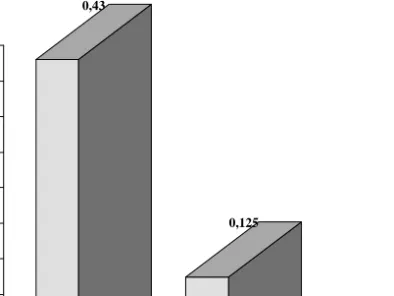
Gambar 1. Hasil penentuan k1 dan ko secara laboratorium dari Cu(II), Cr(III) dan U(VI).
Dari gambar 1 tersebut dapat diperlihatkan bahwa Cu (II) mempunyai harga ko paling tinggi yaitu 0,43 (mole/l)-1 tetapi harga k1 paling rendah yaitu 9,34.10-3 (menit)-1
disusul harga ko untuk Cr(III) sebesar 0,125 (mole/l)-1 dan k1 sebesar
7,61.10-3 (menit)-1 dan disusul ko U(VI) 0,0015 (mole/l)-1 dan k1 sebesar 2,21.10-2 (menit)-1. Bila harga-harga k1 dan ko logam tersebut dimasukkan kedalam persamaan 1, 12, 17 dan 18 dan diselesaikan secara numerik dengan program Matlab akan didapat gambar-gambar 2, 3 dan 4 dibawah ini :
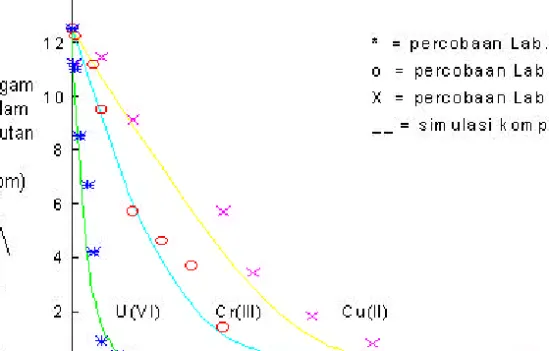
Dari gambar 2, dapat diperlihatkan bahwa U(VI) pada kondisi pH 5, kuat ion 1.10-3 mol/l Ca(NO3)2 mempunyai harga ko paling rendah, dan k1 paling besar. Pada kondisi ini U(VI) terjerap ke dalam asam humat paling cepat dibandingkan dengan logam Cr(III) dan Cu(II). Hal ini kemunginan besar disebabkan oleh kerapatan elektron densitas U(VI) lebih tinggi dari pada logam Cr(III) dan Cu(II), akibatnya U(VI) mempunyai kesetimbangan jerapan paling cepat yaitu 200 menit, disusul Cr(III)
0,43 0,00934 0,125 0,00761 0,00150,0221 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45
Cu (II) Cr(III) U(VI)
ko (l/mole) k1(1/menit)
dan Cu(II) masing-masing mempunyai kesetimbangan jerapan sebesar 800 menit dan 1000 menit. Apabila dihitung laju kecepatan reaksinya (r = k1/ko) ternyata U(VI) mempunyai harga laju reaksi paling besar yaitu 14,73 mole/menit, disusul Cr(III) sebesar 0,06 mole/menit dan Cu(II) 0,02 mole/menit.
Gambar 2. Perbandingan hasil solusi nemerik dan percobaan laboratorium jerapan
Cu(II), Cr(III) dan U(VI) dalam asam humat.
Dari gambar 2 juga dapat diperlihatkan bahwa hasil solusi numerik pola jerapan logam–logam tersebut tidak begitu jauh berbeda dengan hasil percobaan di laboratorium. Dengan demikian solusi numerik tersebut dapat dipertanggung jawabkan secara ilmiah.
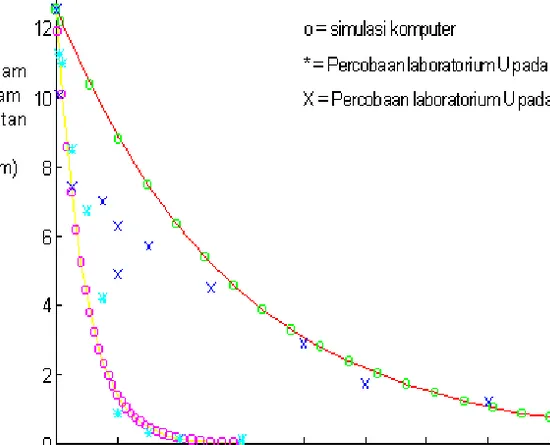
Pada gambar 3, dibuat berdasarkan solusi numerik persamaan 12 pada batas awal konsentrasi logam terjerap sebesar 12,54 ppm dan harga KH diambil dari pustaka[9] sebesar 0,5877 pada pH = 9
Dari gambar 3 tersebut ternyata pada kondisi kuat ion 1.10-3 mol/l Ca(NO3)2 dan pH = 9, logam Cu(II) terjerap lebih lama dari pada jerapan yang dilakukan pada kondisi pH 5. Hal ini kemungkinan terjadi karena pada keadaan dengan sistem ion
Sehingga dari gambar 3 tersebut, tampak bahwa pola hasil solusi numerik dengan komputer akan cenderung lebih besar dari percobaan laboratorium. Dugaan ini diperkuat dengan hasil analisis dengan atomic absorpsion spektroskopi terhadap logam yang tersisa dalam larutan akan cenderung lebih rendah dibandingkan dengan logam yang terdapat dalam padatan.
Gambar 3. Perbandingan hasil solusi numerik pengaruh pH dengan percobaan
laboratorium terhadap jerapan Cu(II) ke dalam asam humat.
Seperti halnya dengan pengaruh pH diatas, ternyata gambar 4 yang dibuat dengan persamaan 18 dan kondisi sama dengan gambar 3, tetapi selain pH ditambah dengan pengaruh kompetisi logam Cr(III) dan Cu(II) terhadap jerapan logam U(VI). Ternyata pengaruh OH- sangatlah dominan, hal ini begitu jelas antara hasil pola solusi numerik dengan hasil percobaan laboratorium. Hal ini terutama pada keadaan jerapan pada menit-menit awal, dan mendekati kesetimbangan pola jerapan antara percobaan laboratorium mirip dengan solusi numerik. Peristiwa ini terjadi karena logam yang akan terjerap mengendap sebagai logam hidroksida terlebih dahulu, kemudian turun secara asimtotik karena jerapan kimia hingga mencapai kesetimbangan.
Gambar 4. Perbandingan hasil solusi numerik pengaruh pH, Cr(III) dan Cu(II) terhadap jerapan U(VI) ke dalam asam humat dengan percobaan laboratorium.
KESIMPULAN
Dengan diawali penentuan harga k1 dan ko secara percobaan laboratorium solusi numerik jerapan kimia dapat dilakukan dengan perangkat lunak Matlab. Didapat bahwa Cu (II) mempunyai harga ko paling tinggi yaitu 0,43 (mole/l)-1 tetapi harga k1 paling rendah yaitu 9,34.10-3 (menit)-1 disusul harga ko untuk Cr(III) sebesar 0,125 (mole/l)-1 dan k1 sebesar 7,61.10-3 (menit)-1 kemudian ko U(VI) 0,0015 (mole/l)-1 dan k1 sebesar 2,21.10-2 (menit)-1. Kesetimbangan jerapan U(VI) paling cepat yaitu 200 menit, disusul Cr(III) dan Cu(II) masing-masing mempunyai kesetimbangan jerapan
sebesar 800 menit dan 1000 menit. Ternyata solusi numerik jerapan kimia pada pH 5 mendekati percobaan laboratorium, tetapi pada pH 9 solusi numerik cenderung lebih tinggi dari percobaan laboratorium hal ini disebabkan logam akan mengendap terlebih dahulu dibandingkan peristiwa jerapan kimia.
DAFTAR PUSTAKA
1. DAVYDOV, A.S.,”The theory of contraction of protein under their exitation”., J.Theor.Biol., 38, (1973) p.559-569.
2. HANSELMAN, D., LITTLEFIELD, B., The student Edition of MATLAB., Version 4, User’s Guide, Printice Hall, Englewood Cliffs, New Jersey 07632, (1995) 3. JIN, X., et al, “Kinetics of Single and Multiple ion Sorption Processes on Humic
Subtances”., Soil Science, 161, 8., (1996) p.509-520.
4. MACCARTHY, P., PERDUE, E.M., “Complexation of Metal ions by Humic Substances: Fundamental Considerations”., Interaction at the Soil Colloid-Soil Solution Interface., Kluwer Academic Publishers, London., Series E; Applied Sciences, 190., Chapter13, (1991) p.469-489.
5. SUSETYO, W., Development of Gaussian Distribution Model in The Characterization of humic Acids by Lanthanide ion Spectroscopy, A Dissertation Submitted to the Graduate Faculty of The University of Georgia in Partial Fulfillment of the requirements for the Degree Doctor Of Philosophy, Athens, Georgia, (1989)
6. WARWICK, P., “ A Comparative Evaluation of metal Humic and Fulvik Acid Prediction Models”., Radiochemica Acta; 73, (1996) p.11-19.
LAMPIRAN :
% ____________________________________________________________ % PROGRAM SOLUSI NUMERIK JERAPAN KIMIA LOGAM U(VI), %CR(III) %MODEL “LANGMUIR-HINSHELWOOD” MENGGUNAKAN %PROGRAM MATLAB. %Oleh Muzakky. %_____________________________________________________________ %Cu function dc = g1(t,c); ko=0.43; k1=9.34*10^(-3); dc=-(k1*c)/(1+(ko*c)); %Cr %function dc2= g4(t2,c2); %koCr=0.125124; %k1Cr=7.61*10^(-3); %dc2=-((k1Cr*c2)/(1+(koCr*c2))); %U %function dc6= g7(t6,c6); %koU=0.0015; k1U=2.21*10^(-2); %dc6=-((k1U*c6)/(1+(koU*c6))); format bank [t,c]=ode23('langmuii',0,1500,12.54);% Cu [t2,c2]=ode23('langmui4',0,1000,12.54);% Cr [t6,c6]=ode23('langmui8',0,300,12.54);% U % Masukan data percobaan
yu=[12.54 11.25 11.0 8.5 6.7 4.2 0.87 0.3 0.15 0.1]; xu=[0 5 10 25 50 75 100 150 200 300]; ycr=[12.54 12.25 11.2 9.5 5.7 4.6 3.7 1.4 0.05 0.1]; xcr=[0 10 70 100 200 300 400 500 800 1000]; ycu=[12.54 11.25 11.45 9.1 5.7 3.4 1.8 0.8 0.15 0.1]; xcu=[0 10 100 200 500 600 800 1000 1500 2000];
subplot(111), plot(t,c,xcu,ycu,'X',t2,c2,xcr,ycr,'o',t6,c6,xu,yu,'*'); %u,cr dan Cu %disp([c6 t6]); text(150,2,'U(VI)');text(480,2,'Cr(III)');text(900,2,'Cu(II)');
text(1000,12,'* = percobaan Lab.U(VI)');text(1000,11,'o = percobaan Lab.Cr(III)') text(1000,10,'X = percobaan Lab.CU(II)'); text(1000, 9,'__ = simulasi komputer')
DAFTAR RIWAYAT HIDUP
1. Nama : MUZAKKY
2. Tempat/Tanggal Lahir : Solo, 23 Juni 1957
3. Instansi : P3TM - BATAN
4. Pekerjaan / Jabatan : Ajun Peneliti Madya
5. Riwayat Pendidikan : (setelah SMA sampai sekarang)
• Analis Kimia Bogor, (S0)
• Teknik Kimia Yogyakarta (S1)
6. Pengalaman Kerja : Isolasi, Karakterisasi/Komputasi Senyawa Humat
dari tanah Gambut
7. Organisasi Professional :
• HKI (Himpunan Kimia Indonesia) Cabang Yogyakarta
• PPI Cabang Yogyakarta
• Jaringan Kerjasama Kimia Analitik