BAB II
DASAR TEORI
2.1 PENDAHULUAN
Pada bab ini akan menjelaskan teori tentang baja karbon (carbon steel), jenis-jenis
carbon steel, karakteristik carbon steel 1020, PEM fuel cell, komponen utama PEM fuel cell, bipolar pelat, faktor-faktor terjadinya korosi, mekanisme korosi, jenis-jenis
korosi, dampak korosi, laju korosi, SEM (Scaning Electron Microscopy).
2.2 BAJA KARBON (CARBON STEEL)
Baja merupakan paduan yang sebagian besar terdiri dari unsur besi dan karbon 0,2% -2,1%. Selain itu juga mengandung unsur-unsur lain seperti sulfur (S), fosfor (P), silikon (Si), mangan (Mn), dan sebagainya. Namun unsur-unsur ini hanya dalam presentase kecil. Sifat baja karbon dipengaruhi oleh presentase karbon dan struktur mikro.Sedangkan struktur mikro pada baja karbon dipengaruhi oleh perlakuan panas dan komposisi baja. Karbon dengan campuran unsur lain dalam baja dapat meningkatkan nilai kekerasan, tahan gores dan tahan suhu. Unsur paduan utama baja adalah karbon, dengan ini baja dapat digolongkan menjadi tiga yaitu baja karbon rendah, baja karbon sedang, dan baja karbon tinggi (Budinski, 2010).
Dalam pengaplikasiannya baja karbon sering digunakan sebagai bahan baku untuk pembuatan alat-alat perkakas, komponen mesin, struktur bangunan, dan lain sebagainya, baja karbon dapat diklasifikasikan berdasarkan jumlah persentase komposisi kimia karbon dalam baja yakni sebagai berikut (Murtiono, 2012).
2.2.1 Baja Karbon Rendah (Low Carbon Steel)
Baja karbon rendah merupakan baja dengan kandungan unsur karbon dalam sturktur baja kurang dari 0,30% C. Baja karbon rendah ini memiliki ketangguhan dan keuletan tinggi akan tetapi memiliki sifat kekerasan dan ketahanan aus yang rendah. Pada umumnya baja jenis ini digunakan sebagai bahan baku untuk pembuatan komponen struktur bangunan, pipa gedung, jembatan, bodi mobil, dan lain-lainya.
2.2.2 Baja Karbon Sedang (Medium Carbon Steel)
Baja karbon sedang merupakan baja karbon dengan persentase kandungan karbon pada besi sebesar 0,30% C – 0,60% C. Baja karbon ini memiliki kelebihan bila dibandingkan dengan baja karbon rendah, baja karbon sedang memiliki sifat mekanis yang lebih kuat dengan tingkat kekerasan yang lebih tinggi dari pada baja karbon rendah. Besarnya kandungan karbon yang terdapat dalam besi memungkinkan baja untuk dapat dikeraskan dengan memberikan perlakuan panas (heat treatment) yang sesuai. Baja karbon sedang biasanya digunakan untuk pembuatan poros, rel kereta api, roda gigi, baut, pegas, dan komponen mesin lainnya.
2.2.3 Baja Karbon Tinggi (High Carbon Steel)
Baja karbon tinggi adalah baja karbon yang memiliki kandungan karbon sebesar 0,70% C – 1,5% C. Baja karbon tinggi memiliki sifat tahan panas, kekerasan serta kekuatan tarik yang sangat tinggi akan tetapi memiliki keuletan yang lebih rendah sehingga baja karbon ini menjadi lebih getas. Baja karbon tinggi ini sulit diberi perlakuan panas untuk meningkatkan sifat kekerasannya, hal ini dikarenakan baja karbon tinggi memiliki jumlah martensit yang cukup tinggi sehingga tidak akan memberikan hasil yang optimal pada saat dilakukan proses pengerasan permukaan. Dalam pengaplikasiannya baja karbon tinggi banyak digunakan dalam pembuatan alat-alat perkakas seperti palu, gergaji, pembuatan kikir, pisau cukur, dan sebagainya.
2.3 KARAKTERISTIK CARBON STEEL 1020
1. Tahan Panas
Carbon steel AISI 1020 juga memiliki salah satu sifat yang unik yaitu mampu tahan
terhadap panas dan bisa menghadapi suhu sekitar 700°C. Namun jika ingin mempertahankan sifat baja terhadap korosi maka suhu 750 °C sampai 850 °C sangat
dilarang karena bisa memperpendek dari umur baja itu sendiri. Carbon steel ini juga sangat tahan terhadap material kimia seperti klorida dan surfur.
2. Ulet Dan Tangguh
Carbon steel 1020 mempunyai keuletan dan ketangguhan yang sangat tinggi karena
baja jenis ini hanya mengandung karbon kurang dari 0,30%. Baja jenis ini paling murah di produksi diantara semua baja karbon, mudah di maching dan di las.
3. Tahan Terhadap Suhu Tinggi
Carbon steel AISI 1020 juga memliki sifat yang tahan terhadap suhu yang sangat
tinggi sehingga banyak digunakan dalam sistem boiler dalam suhu sekitar 300 °C dan pada bipolar pelat pada PEM fuel cell.
Tabel 2.1 Komposisi Carbon Steel 1020
Element Content Carbon, C 0,17-0,23% Iron, Fe 98,29% Mangane, Mn 0,30-0,60% Phosphour,P 0,30% Sulphur, S 0,35% Silicon, Si 0,15-0,35% (Sumber: Nugroho, 2012)
Tabel 2.2 Sifat Mekanik Carbon Steel 1020
Pysial Properties Metrik Imperial
Density 7,87 g/cc 0,284 lb/in³
Tensile Streng 294,74 Mpa 42748 psi
Thermal Conduktivity 51,9 W/mK 360 in/hr.ft²
(Sumber: Nugroho, 2012)
2.4 PEM FUEL CELL
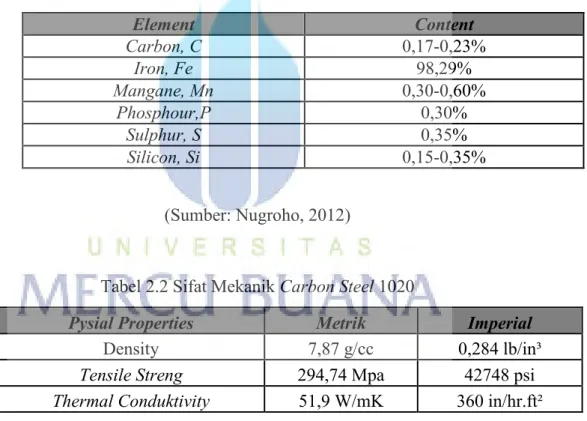
Proton Exchange Membrane (PEM), yang secara langsung mengubah energi kimia menjadi energi listrik, telah menarik banyak perhatian karena banyaknya keuntungan, seperti kepadatan daya tinggi, efisiensi konversi energi tinggi, waktu startup yang
menunjukkan skematik sel bahan bakar PEM tunggal yang khas , di mana kompartemen anoda dan katoda di pisahkan oleh sepotong PEM seperti Nafion. Membran Nafion ini berfungsi sebagai elektrolit dan membantu melakukan proton dari anoda ke katoda dan juga memisahkan anoda dan katoda. Selama operasi sel bahan bakar, bahan bakar (misalnya H2) di oksidasi secara elektrokimia di dalam
lapisan katalis anoda (Cl), dan ini menghasilkan proton dan elektron.
Proton kemudian diangkut melintasi membran ke sisi katoda, sementara elektron bergerak melalui sirkuit luar dan dengan demikian juga mencapai sisi katoda. Proton dan elektron ini bereaksi secara elektrokimia dengan oksidan (yaitu oksigen di udara umpan) di dalam katoda Cl dan menghasilkan air dan panas. Seluruh proses sel bahan bakar H2 / udara PEM menghasilkan listrik, air, dan panas, tanpa hasil
sampingan yang mencemari (Zhang, 2013).
Reaksi katalitik oksidasi hidrogen pada anoda dan oksigen pengurangan dikatoda menghasilkan beda potensial listrik antara elektroda, yang dapat digunakan dalam sirkuit eksternal jika elektrolit memungkinkan transportasi massal ionik tapi isolat elektrik kedua elektroda. Di sisi anoda, katalis menghasilkan disosiasi molekul hidrogen menjadi proton (H+) dan elektron (e-). Proton melintasi membran polimer, sedangkan elektron dipaksa untuk jaringan listrik eksternal. Di permukaan katoda ini molekul oksigen bereaksi dengan elektron dari sirkuit eksternal dan proton dari membran untuk menghasilkan air. Dalam proses ini, satu-satunya produk sampingan air. Reaksi secara keseluruhannya adalah sebagai berikut (Zhang, 2013).
Anoda: H2 → 2 H+ + 2 e- (2.1)
Katoda: O2 + 4 H+ + 4 e- → H2O (2.2)
Reaksi total: H2 + ½ O2 → H2O + energi listrik + kalor (2.3)
Fuel cell memiliki beberapa kelebihan yaitu 1.Memiliki efiesiensi yang tinggi (60%-70%)
2. Ramah lingkungan (tidak berisik, emisinya rendah)
Gambar 2.1 PEM Fuel Cell (Sumber: Zhang, 2013)
2.4.1 Komponen-Komponen Utama PEM Fuel Cell
1. Membrane Electrolyte Assembly (MEA)
Material yang digunakan adalah polimer solid terimpregnasi dengan lapisan katalis pada anaoda dan katoda. Kertas atau kain karbon berpori untuk melapisi difusi gas (GDL). Terdiri dari dua elektroda, satu membran elektrolit, dan dua GDL. Membran ini memisahkan (dengan pembatas gas) dua setengah reaksi sel dan melepaskan proton dari anoda ke katoda. Lapisan katalis yang terdispersi pada elektroda memacu setiap setengah reaksi. GDL mendistribusikan gas secara merata ke katalis dimembran, mengalirkan elektroda dari area aktif menuju pelat bipolar dan membantu pengaturan air.
2. Pelat Penutup
Material yang digunakan biasanya baja ataupun alumunium, berfungsi untuk menyatukan rangkaian fuel cell.
3. Penyimpan Arus
Material yang digunakan biasanya tembaga karena meliki konduktivitas yang baik, berfungsi untuk menyimpan dan mentrasnfer arus listrik dari dalam ke luar sirkuit. 4. Pelat Bipolar
Material yang digunakan adalah grafit, carbon steel, stainless stell atau komposit polimer termoplastik. Berfungsi untuk mendistribusikan gas dibagian area aktif membran dan mengalirkan elektroda dari anoda menuju katoda serta membuang air keluar sel.
2.4.2 Pelat Bipolar
Pelat bipolar atau pelat bidang alir (flow field plate) digunakan sebagai penghubung antara dua elektroda berbeda kutub. Pelat bipolar dibuat dari material yang mampu mengalirkan listrik dan tidak dapat ditembus gas, fungsinya sebagai penyimpan arus dan sebagai struktur penguat rangkaian fuel cell. Pelat ini biasa dibuat dari grafit, logam (alumunium, carbon steel, stainless steel, titanium, dan nikel), atau dapat juga dibuat dari komposit. Saluran alir gas dicetak pada permukaan pelat sebagai tempat aliran gas-gas yang bereaksi.
Gambar 2.2 Pelat Bipolar (Sumber: Renato, 2010)
Tabel 2.3 Sifat material yang dibutuhkan untuk pelat bipolar.
Parameter Standar Nilai
Konduktivitas Listrik > 100 S/cm
Kekuatan Mampu menahan tekanan 200 Psi
Bobot Maksimum 200 gram/pelat
Volume 1 L/kW/stack
Biaya Fabrikasi < $ 0,0045/cm2
Kerapatan Arus Decay < 10% per 5000 jam operasi
Daya Tembus (permeability) Maksimum kebocoran H2 10-4cm3/s-cm2
2.5 PENGERTIAN KOROSI
Korosi adalah penghancuran spontan logam dan paduan yang disebabkan oleh bahan kimia, bio-kimia, dan elektrokimia antara logam dan paduan dan lingkungan. Lingkungan korosif meliputi uap air, oksigen, asam anorganik dan organik, tekanan tinggi, suhu, dan klorida (Popov, 2015). Korosi adalah kerusakan atau degradasi logam akibat adanya reaksi oksidasi-reduksi antara suatu logam dengan berbagai zat di lingkungannya dan menghasilkan senyawa-senyawa/residu yang tidak dikehendaki yaitu karat, sehingga dalam bahasa sehari-hari proses korosi biasa disebut perkaratan. Contoh korosi yang paling umum adalah perkaratan pada logam besi atau baja. Korosi dapat juga diartikan sebagai serangan yang merusak logam karena logam bereaksi secara kimia dengan lingkungannya.
Ada definisi lain mengatakan bahwa korosi adalah kebalikan proses ekstraksi logam dari bijih materialnya. Contohnya, bijih material logam besi di alam bebas ada dalam bentuk senyawa besi oksida (FeO) atau besi sulfida (FeSO), setelah diekstraksi dan diolah, akan dihasilkan besi yang digunakan untuk pembuatan baja atau besi paduan. Selama pemakaian, besi atau baja tersebut akan bereaksi dengan lingkungan yang menyebabkan korosi dan kembali menjadi senyawa besi oksida.
2.6 FAKTOR-FAKTOR TERJADINYA KOROSI
Beberapa faktor lingkungan yang dapat mempengaruhi proses korosi antara lain (Chemberlain, 1998), yaitu:
1. Suhu kenaikan suhu akan menyebabkan bertambahnya kecepatan reaksi korosi. Hal ini terjadi karena makin tinggi suhu maka energi kinetik dari partikel-partikel yang bereaksi akan meningkat sehingga melampaui besarnya harga energi aktivasi dan akibatnya laju kecepatan reaksi (korosi) juga akan makin cepat, begitu juga sebaliknya.
2. Kecepatan alir fluida atau kecepatan pengadukan laju korosi cenderung bertambah jika laju atau kecepatan aliran fluida bertambah besar. Hal ini karena kontak antara zat pereaksi dan logam akan 15 semakin besar sehingga ion-ion logam akan makin banyak yang lepas sehingga logam akan mengalami kerapuhan (korosi).
3. Konsentrasi bahan korosif hal ini berhubungan dengan pH atau keasaman dan kebasaan suatu larutan. Larutan yang bersifat asam sangat korosif terhadap logam dimana logam yang berada didalam media larutan asam akan lebih cepat terkorosi karena karena merupakan reaksi anoda. Sedangkan larutan yang bersifat basa dapat menyebabkan korosi pada reaksi katodanya karena reaksi katoda selalu serentak dengan reaksi anoda.
4. Oksigen adanya oksigen yang terdapat di dalam udara dapat bersentuhan dengan permukaan logam yang lembab. Sehingga kemungkinan menjadi korosi lebih besar. Di dalam air (lingkungan terbuka), adanya oksigen menyebabkan korosi.
5.Waktu kontak aksi inhibitor diharapkan dapat membuat ketahanan logam terhadap korosi lebih besar. Dengan adanya penambahan inhibitor kedalam larutan, maka akan menyebabkan laju reaksi menjadi lebih rendah, sehingga waktu kerja inhibitor untuk melindungi logam menjadi lebih lama. Kemampuan inhibitor untuk melindungi logam dari korosi akan hilang atau habis pada waktu tertentu, hal itu dikarenakan semakin lama waktunya maka inhibitor akan semakin habis terserang oleh larutan.
2.7 MEKANISME KOROSI
Hampir semua logam mengalami korosi yang meliputi perpindahan atau serangan elektron dalam larutan. Semua reaksi korosi dalam air melibatkan reaksi anodik, potensial yang menyertai kelebihan elektron selalu berkurang pada laju korosi. Ini merupakan dasar dari proteksi katodik untuk mengurangi laju korosi pada pipa, tangki baja air panas, dan lain-lain. Semua reaksi korosi larutan merupakan reaksi elektrokimia. Banyak reaksi korosi melibatkan air dan juga fasa uap kondensat, reaksi korosi kering tanpa melibatkan perpindahan elektron dalam zat padat pada keadaan elektrolit dan dianggap sebagai elektrokimia.
Reaksi anodik untuk logam yang rusak:
M → M n+ + ne – (2.4)
Sebagai contoh:
Reaksi reduksi dari oksidasi ion dalam larutan disebut reaksi redoks sebagai contoh:
Fe 3+ + e- → Fe 2+ (2.6)
Reduksi dari oksigen terlarut selalu diamati dalam larutan netral dan asam. Reaksi reduksi oksidasi
O2 + 2H2O + 4e- → 4OH dan O2 + 4H+ + 4e- (2.7)
Pada keadaan semua reaksi reduksi, air akan tereduksi.
2H2O + 2e → H2 + 2OH – (2.8)
Dari reaksi diatas diasumsikan peruraian air menjadi H+ dan air mengurangi OH- dari kedua sisi reaksi. Laju korosi akan bertambah cepat jika dipengaruhi oleh peningkatan temperatur, adanya beda potensial antara dua logam , adanya perlakuan panas pada logam.
2.8 JENIS – JENIS KOROSI
Adapun jenis-jenis korosi menurut mekanisme terjadinya korosi adalah sebagai berikut (Popov, 2015).
2.8.1 Uniform Corrosion
Korosi ini adalah korosi yang terjadi secara menyeluruh dipermukaan. Bentuk korosi ini mudah diprediksi karena kecepatan atau laju korosi di setiap permukaan adalah sama. Dalam upaya pencegahan biasanya kita dapat melakukan pelapisan (coating) di permukaan yang terpapar oleh lingkungan.
Gambar 2.3 Uniform Corrosion (Sumber: Popov, 2015)
2.8.2 Galvanic Corrosion
Korosi ini terjadi akibat dua logam atau lebih yang memiliki potensial reduksi (Eored) yang berbeda baik dihubungkan atau terhubung. Berdasarkan deret volta / deret galvanik, material yang memiliki potensial reduksi yang lebih kecil akan mengalami korosi.
Gambar 2.4 Contoh Galvanic Corrosion (Sumber: Popov, 2015)
2.8.3 Crevice Corrosion
Korosi ini terjadi karena terdapat celah antara 2 logam sejenis yang digabungkan. Sehingga terbentuk kadar oksigen yang berbeda diantara area di dalam celah dan diluarnya, sehingga akan menyebabkan korosi.
Gambar 2.5 Contoh Crevice Corrosion (Sumber: Utomo, 2009)
2.8.4 Stress Corrosion Cracking (SCC)
Korosi terjadi karena adanya tegangan beban tarik pada suatu material di lingkungan korosif. Logam pertama-tama akan terkena korosi pada suatu titik, dan kemudian akan terbentuk retakan. Retakan ini akan menjalar dan dapat menyebabkan kegagalan pada
komponen tersebut. Sifat yang khas dari korosi ini adalah crack yang berbentuk akar serabut.
Gambar 2.6 Contoh stress corrosion cracking (Sumber: Popov, 2015)
2.8.5 Corrosion Fatigue Cracking (CFC)
Korosi terjadi karena adanya tegangan beban fatik pada suatu material di lingkungan korosif. Hal ini sewaktu-waktu akan menyebabkan material tersebut akan terkena korosi pada satu titik yang menyebabkan crack yang menjalar berbentuk tidak serabut.
Gambar 2.7 Contoh Fatique Cracking Corrosion (Sumber: Popov, 2015)
2.8.6 Erosion-Corrosionand Fretting
Korosi ini terjadi karena adanya fluida korosif yang mengalir pada permukaan material. Fluida tersebut dapat berupa liquid (Erosion Corrosion) maupun gas (Fretting Corrosion) dengan kecepatan tinggi. Karena kecepatan tinggi dari fluida korosif yang mengalir, terjadi efek keausan mekanis atau abrasi. Lapisan pasif atau
pun coating pada permukaan material akan terkikis, sehingga kemungkinan terjadinya korosi semakin besar.
Gambar 2.8 Contoh Erosion Corrosion (Sumber: Utomo, 2009)
2.8.7 Hydogen Induced Cracking (HIC)
Korosi terjadi karena adanya tegangan internal pada suatu material karena adanya molekul-molekul gas hidrogen yang berdifusi ke dalam struktur atom logam. Hidrogen dapat terbentuk akibat reduksi H2O ataupun dari asam. Penetrasi hidrogen
ini akan menyebabkan korosi pada material, dan kemudian terjadi perpatahan getas.
Gambar 2.9 Contoh Hydrogen Induced Cracking (Sumber: Popov, 2015)
2.8.8 Intergranular Corrosion (Korosi Batas Butir)
Korosi terjadi akibat adanya chrome pada sekitar batas butir yang membentuk presipitat kromium karbida di batas butir. Kemudian akan terjadi crack yang menjalar
Gambar 2.10 Contoh Intergranular Corrosion (Sumber: Popov, 2015)
2.8.9 Pitting Corrosion
Korosi yang terjadi akibat rusaknya lapisan pasif di satu titik karena pengaruh dari lingkungan korosif. Contoh lingkungan korosif tersebut seperti pada air laut. Air laut yang mengandung Ion Cl-akan menyerang lapisan pasif dari logam. Ketika terjadi permulaan pitting pada satu titik di permukaan lapisan pasif, maka ion Cl- akan terkonsentrasi menyerang pada permukaan lapisan pasif yang terjadi pitting terlebih dahulu sehingga pitting akan menjadi dalam. Pecahnya lapisan pasif mengakibatkan gas hidrogen dan oksigen mudah masuk dan mengkorosikan material tersebut. Material yang biasa mengalami pitting corrosion salah satunya adalah stainless steel.
Gambar 2.11 Contoh pitting corrosio (Sumber: Popov, 2015)
2.9 DAMPAK KOROSI
Korosi yang terjadi pada logam tidak dapat dihindari, tetapi hanya dapat dicegah dan dikendalikan sehingga struktur atau komponen mempunyai masa pakai yang lebih lama. Setiap komponen atau struktur mengalami tiga tahapan utama yaitu perancangan, pembuatan dan pemakaian. Ketidakberhasilan salah satu aspek seperti
korosi menyebabkan komponen akan mengalami kegagalan. Kerugian yang akan dialami dengan adanya korosi meliputi finansial dan safety, diantaranya:
1. Penurunan kekuatan material 2. Penipisan
3. Downtime dari equipment 4. Retak & Pitting
5. Kebocoran fluida 6. Embrittlement
7. Penurunan sifat permukaan material 8. Penurunan nilai / hasil produksi 9. Modification
2.9.1 Laju Korosi
Laju korosi merupakan suatu besaran cepat atau lambat suatu material bereaksi dengan lingkungannya dan mengalami korosi. Menurut (Fontana, 1987) dalam bukunya “ Corrosion Engineering” laju korosi dapat di definisikan dalam berbagai macam, seperti presentase kehilangan massa, miligram per sentimeter persegi per hari dan gram per inchi persegi per jam. Selain itu juga digunakan mils per year (mpy) yang menyatakan laju penetrasi serangan korosi. Menghitung laju korosi pada umumnya menggunakan 2 cara yaitu:
2.9.2 Metode Kehilangan Berat
Metode kehilangan berat adalah perhitungan laju korosi dengan mengukur kekurangan berat akibat korosi yang terjadi. Metode ini menggunakan jangka waktu penelitian hingga mendapatkan jumlah kehilangan akibat korosi yang terjadi. Perhitungan laju korosi atas dasar kehilangan berat selama pengujian, seperti pada persamaan di bawah ini (Abu-Dalo, 2012).
Keterangan:
m2 = massa yang terkorosi (mg)
t = waktu perendaman (jam)
A = luas permukaan spesimen (cm2)
Metode ini adalah mengukur kembali berat awal dari benda uji (objek yang ingin diketahui laju korosi yang terjadi padanya), kekurangan berat dari pada berat awal merupakan nilai kehilangan berat. Kekurangan berat dikembalikan kedalam rumus untuk mendapatkan laju kehilangan beratnya. Pada penelitian yang dilakukan (Ornelasari, 2015) dijelaskan dari hasil perhitungan dengan metode kehilangan berat pada media air nira aren dan asam asetat bahwa ada beberapa hal yang bisa mempengaruhi dari laju korosi yaitu dari pengaruh waktu perendaman dan kadar dari keasaman larutan pH di penelitian ini di jelaskan bahwa untuk perendaman dalam air nira aren dengan pH 4,6 laju korosi terbesarnya adalah 48,669
mpy dengan waktu perendaman selama 4 hari. Sedangkan untuk laju korosi terkecil
sebesar 14,36 mpy dengan waktu perendaman selama 7 hari. Untuk perendaman dalam larutan asam asetat dengan pH 2,5 laju korosi terbesarnya adalah 69,574 mpy juga terjadi pada waktu perendaman 4 hari, sedangkan untuk laju korosi terkecil sebesar 13,936 mpy dialami oleh sample dengan waktu perendaman selama 7 hari. Berdasarkan data bahwa semakin lama perendaman laju korosi yang terjadi akan semakin menurun dan laju korosi terbesar terjadi pada diawal proses perendaman yaitu pada waktu 4 hari. Hal ini berkaitan dengan permukaan logam yang masih telanjang belum terselimuti oleh lapisan hasil korosi. Pada rentang waktu 4 sampai 7 hari laju korosi menurun, hal ini dikarenakan terbentuknya lapisan hasil korosi.
2.9.3 Metode Elektrokimia
Metode elektrokimia adalah metode mengukur laju korosi dengan mengukur beda potensial objek hingga didapat laju korosi yang terjadi, metode ini mengukur laju korosi pada saat diukur saja dimana memperkirakan laju tersebut dengan waktu yang panjang (memperkirakan walaupun hasil yang terjadi antara satu waktu dengan waktu lainya berbeda). Kelemahan metode ini adalah tidak dapat menggambarkan secara pasti laju korosi hanya pada waktu tertentu saja, hingga secara umur pemakaian maupun kondisi untuk dapat di treatmen tidak dapat diketahui.
Kelebihan dari metode ini adalah kita bisa langsung mengetahui laju korosi pada saat di ukur, hingga waktu pengukuran tidak memakan waktu yang lama dan salah satu contoh alat dari metode elektrokimia yang dipakai untuk penelitian ini adalah potensiostat.
2.9.4 Potensiostat
Teknik elektrokimia untuk keperluan analisis kuantitatif instrumental membutuhkan pengetahuan dan alat-alat tambahan untuk pengolahan data . Hal ini berkenaan dengan kenyataan bahwa pembangkit sinyal analitik yang dihasilkan dalam komponen instrumen memerlukan pengolahan agar dapat memberikan data yang mudah dibaca dan diolah untuk bahan informasi.
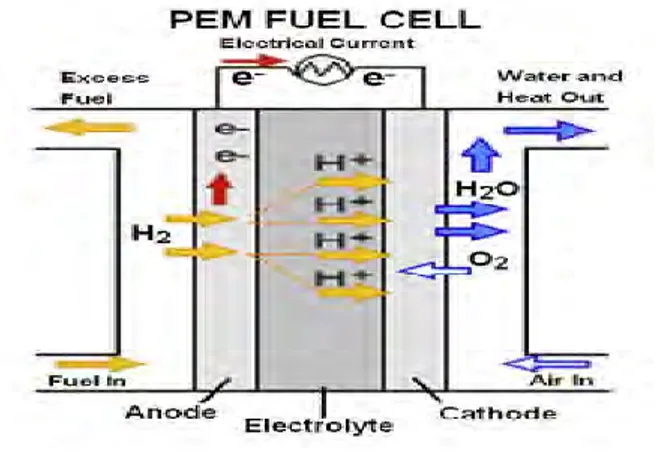
Potensiostat merupakan instrumen yang dapat digunakan untuk mengukur arus yang melewati pasangan elektroda kerja dan elektroda kounter dan selalu menjaga keseimbangan beda potensial antara elektroda kerja dan elektroda pembanding. Potensiostat mengukur arus yang mengalir antara elektroda kerja dan elektroda pembanding. Variabel yang di kontrol oleh potensiostat adalah potensial sel, sedangkan variabel yang diukur adalah arus sel. Bentuk dari potensiostat dapat dilihat pada gambar yang terdiri dari lima komponen yaitu: sinyal generator, power amplifier, elektrometer, I/E converter dan perekam.
Gambar 2.11 Susunan Dasar Potensiostat (Sumber: Anggraeni, 2008)
Perbedaan potensial dibentuk dari potensial tunggal atau potensial yang di kontrol oleh komputer. Output digital ke analog (D/A) mengubah bilangan yang dihasilkan komputer kedalam potensial. Pemilihan yang tepat dari urutan bilangan memungkinkan komputer menghasilkan potensial yang konstan, potensial yang linier dan gelombang sinusdatar (sinusoidal). Bilangan dari eksitasi potensial menghasilkan variasi yang berbeda dari voltammetri.
Elektrometer Rangkaian elektrometer mengukur beda potensial antara elektroda kerja dengan elektroda pembanding. Outputnya memiliki dua fungsi yaitu feedback signal pada rangkaian potensiostat dan sinyal diukur sewaktu-waktu potensial sel dibutuhkan. Elektrometer yang ideal memiliki arus input nol dan memiliki impedansi input yang tidak terbatas.
The I/E conventer (pengubah arus ke potensial) Pengubah arus ke potensial merupakan rangkaian pengikut arus untuk mengukur arus sel dan menampilkan sebagai potensil. Potensial output, Eout diperoleh dari arus sel X resistor feedback.
The Power Amplifier (Daya Amplifier) Daya amplifier atau pengontrol amplifier dari potensiostat berfungsi mengatur potensial pada elektroda kounter–elektroda kerja untuk mencapai selisih yang tepat pada elektroda pembanding-elektroda kerja. Pengontrol amplifier membandingkan potensial sel yang diukur dengan potensial yang di harapkan dan mengendalikan arus yang masuk kedalam sel untuk memaksa potensialnya menjadi sama. Potensial yang diukur adalah input yang masuk ke dalam input negatif dari pengontrol amplifier.
Perekam Data/ The Recorder Merupakan peralatan sederhana untuk menampilkan dan merekam potensiostat dalam bentuk chart recorder output atau voltameter digital.
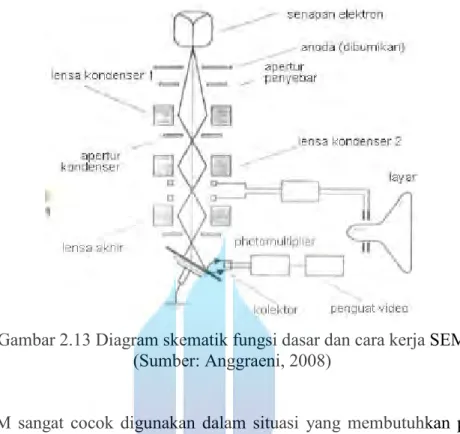
2.9.5 SEM (Scanning Electron Microscopy)
SEM terdiri dari sebuah senapan elektron yang memproduksi berkas elektron pada tegangan dipercepat sebesar 2–30 kV. Berkas elektron tersebut dilewatkan pada beberapa lensa elektromagnetik untuk menghasilkan image berukuran <~10nm pada
sampel yang ditampilkan dalam bentuk film fotografi atau ke dalam tabung layar. Diagram skematik dan cara kerja SEM pada Gambar 2.13.
Gambar 2.13 Diagram skematik fungsi dasar dan cara kerja SEM (Sumber: Anggraeni, 2008)
SEM sangat cocok digunakan dalam situasi yang membutuhkan pengamatan permukaan kasar dengan pembesaran berkisar antara 20 kali sampai 500.000 kali. Sebelum melalui lensa elektromagnetik terakhir scanning raster mendeflesikan berkas elektron untuk men-scan permukaan sampel. Hasil scan ini tersinkronisasi dengan tabung sinar katoda dan gambar sampel akan tampak pada area yang di-scan. Tingkat kontras yang tampak pada tabung sinar katoda timbul karena hasil refleksi yang berbeda-beda dari sampel. Sewaktu berkas elektron menumbuk permukaan sampel sejumlah elektron direfleksikan sebagai backscattered electron (BSE) dan yang lain membebaskan energi rendah secondary electron (SE).
Emisi radiasi elektromagnetik dari sampel timbul pada panjang gelombang yang bervariasi tapi pada dasarnya panjang gelombang yang lebih menarik untuk digunakan adalah daerah panjang gelombang cahaya tampak (cathode luminescence) dan sinar-X. Elektron-elektron BSE dan SE yang di refleksikan dan di pancarkan sampel dikumpulkan oleh sebuah scintillator yang memancarkan sebuah pulsa cahaya pada elektron yang datang. Cahaya yang dipancarkan kemudian diubah menjadi sinyal
Setelah melalui proses pembesaran sinyal tersebut dikirim ke bagian grid tabung sinar katoda. Scintillator biasanya memiliki potensial positif sebesar 5–10 kV untuk mempercepat energi rendah yang dipancarkan elektron agar cukup untuk mengemisikan cahaya tampak ketika menumbuk scintillator. Scintillator harus dilindungi agar tidak terkena defleksi berkas elektron utama yang memiliki potensial tinggi. Pelindung metal yang mengandung metal gauze terbuka yang menghadap sampel memungkinkan hampir seluruh elektron melalui permukaan scintillato (Anggraeni, 2008).