5
HASIL DAN PEMBAHASAN
5.1 Komposisi Hasil Tangkapan
Ikan yang tertangkap selama penelitian di bulan Januari dan Maret 2012 berjumlah 69 ekor yang terdiri dari 12 spesies (10 famili). Frekuensi tertinggi hasil tangkapan terdapat pada bulan Maret 2012 yaitu berjumlah 41 ekor yang terdiri dari 11 spesies (9 famili) jika dibandingkan dengan hasil tangkapan pada bulan Januari 2012 dengan jumlah 28 ekor yang terdiri dari 8 spesies (10 famili). Berat total hasil tangkapan mencapai 15413 gr atau 15,413 kg. Perbandingan frekuensi hasil tangkapan ini dapat dilihat pada histogram berikut (Gambar 12).
Gambar 12 Jumlah hasil tangkapan pada bulan Januari dan bulan Maret 2012
Hasil tangkapan pada bulan Maret 2012 lebih banyak daripada bulan Januari 2012 karena berdasarkan hasil wawancara dengan nelayan, bulan Januari-Februari adalah musim paceklik dan bulan Maret adalah musim biasa dimana pasang lebih tinggi, sehingga ikan lebih banyak tertangkap. Hal ini dihubungkan dengan pendapat Elliott dan Hemingway (2002) yang menyatakan bahwa tingginya pasang surut memengaruhi ukuran populasi ikan. Data hasil tangkapan diuji dengan metode statistik non parametrik menggunakan Uji Mann-Whitney U test dan hasilnya menunjukkan bahwa nilai asymp. Sig/asymptotic significance yaitu
0,276 atau probabilitas di atas 0,05 (0,276 > 0,05) maka berdasarkan hipotesis, dapat disebutkan bahwa distribusi hasil tangkapan menyebar normal. Analisis data dengan metode parametrik menggunakan Uji-F (ANOVA) juga digunakan untuk mengetahui perbandingan hasil tangkapan setiap bulan dan hasilnya menunjukkan nilai P-value yaitu 0,427 atau lebih besar di atas 0,05 (0,427 > 0,05). Jadi, dapat dinyatakan bahwa tidak terdapat perbedaan yang signifikan untuk jumlah hasil tangkapan pada bulan Januari dan bulan Maret 2012.
Hasil wawancara dengan nelayan menjelaskan bahwa 61 % responden menyebutkan hasil tangkapan utama di padang lamun yaitu ikan baronang dari famili Siganidae; kemudian 23 % responden menyebutkan ikan lingkis yang masih satu famili dengan ikan baronang sebagai hasil tangkapan utama. Sisanya yaitu ikan cendro dari famili Belonidae. Menurut data statistik perikanan Provinsi DKI Jakarta tahun 2010, jenis ikan yang terhitung nilai produksinya di Kepulauan Seribu dan juga terdapat di padang lamun adalah ikan cendro (Belonidae), lencam (Lethrinidae), kerapu lumpur/sunu (Serranidae) dan baronang (Siganidae). Namun, hasil penelitian menunjukkan bahwa famili Holocentridae dan Belonidae merupakan hasil tangkapan utama. Perbedaan ini disebabkan oleh waktu dan metode penangkapan ikan yang berbeda.
Tabel 14 Komposisi hasil tangkapan nelayan pada habitat padang lamun di perairan Pulau Pramuka, Kepulauan Seribu
No. Nama Umum Spesies Famili Jumlah (ekor)
Panjang Total ± SD (cm)
Berat ± SD (gr) 1 Baronang Siganus guttatus Siganidae 1 18,0 109 2 Belanak Mugil cephalus Mugilidae 1 28,5 232 3 Cendro Tylosurus strongylura Belonidae 18 65,9 ± 21,7 584 ± 245 4 Jarang gigi Choerodon anchorago Labridae 5 16,9 ± 4,6 106 ± 78 5 Kalam pute Leiognathus nuchalis Leiognathidae 1 14,1 37 6 Kerapu koko Epinephelus quoyanus Serranidae 2 20,9 ± 3,3 147 ± 76 7 Lencam Lethrinus reticulatus Lethrinidae 4 17,8 ± 0,6 71 ± 29 8 Lingkis Siganus canaliculatus Siganidae 5 18,1 ± 0,8 81 ± 19 9 Pasir Pentapodus trivittatus Nemipteridae 1 18,1 73 10 Serak Scolopsis lineata Nemipteridae 10 17,4 ± 1,4 77 ± 19 11 Swanggi Sargocentron rubrum Holocentridae 18 16,5 ± 1,6 87 ± 30 12 Tanda-tanda Lutjanus ehrenbergii Lutjanidae 3 24,3 ± 1,4 103 ± 30
Tabel 14 menunjukkan komposisi hasil tangkapan secara detail. Spesies dominan yang tertangkap adalah ikan swanggi (Sargocentron rubrum) dengan jumlah 18 ekor atau setara dengan 1,574 kg. Selain ikan swanggi, hasil tangkapan
dengan jumlah dan proporsi yang sama dari total hasil tangkapan, yaitu cendro (Tylosurus strongylura). Jumlah cendro yang tertangkap setara dengan 10,507 kg, merupakan penyumbang terbesar bagi berat total hasil tangkapan. Hasil tangkapan dominan berikutnya adalah ikan serak (Scolopsis lineata). Ikan serak berjumlah 10 ekor yang setara dengan 0,770 kg.
Famili Holocentridae dengan proporsi 26 % dari total hasil tangkapan merupakan hasil tangkapan dominan. Selain Holocentridae, hasil tangkapan dengan proporsi yang sama dari total hasil tangkapan yaitu famili Belonidae. Hasil tangkapan dominan berikutnya adalah famili Nemipteridae dengan proporsi 15,9 % dari total hasil tangkapan yang terdiri dari 2 spesies, yaitu ikan pasir (Pentapodus trivittatus) dan ikan serak (Scolopsis lineata). Bentuk grafik proporsi spesies yang tertangkap dikelompokkan dalam kategori famili dan ditampilkan secara detail pada Gambar 13.
Gambar 13 Persentase hasil tangkapan total selama penelitian
Menurut Tomascik et al. (1997), ikan yang banyak ditemukan di padang lamun Indonesia adalah dari famili Siganidae, Lethrinidae dan Labridae. Ketiga spesies ini termasuk dalam komunitas lamun yang terbentuk pada habitat padang lamun yang berdekatan dengan terumbu karang atau terkadang bersatu dengan terumbu karang. Namun, hasil penelitian menunjukkan bahwa spesies terbanyak
yang tertangkap berasal dari famili Holocentridae dan Belonidae. Hal ini disebabkan Holocentridae menggunakan padang lamun sebagai tempat untuk mencari makan, sehingga Holocentridae termasuk penghuni berkala yang menggunakan padang lamun sebagai tempat untuk mencari makan (occasional residents) berdasarkan pengelompokan Tomascik et al. (1997). Metadata FishBase (Froese dan Pauly 2012) mendukung pendapat ini dengan mengemukakan bahwa habitat Holocentridae adalah di padang lamun. Pernyataan Setipermana (1996) vide Andriana et al. (2011) yang menyebutkan bahwa Holocentridae termasuk ikan nokturnal (aktif pada malam hari) juga dapat dijadikan penyebab banyaknya Holocentridae yang tertangkap karena alat tangkap nelayan (set gillnet) dioperasikan dari pukul 14.00-06.00 WIB.
Famili Belonidae juga banyak tertangkap karena menggunakan padang lamun sebagai tempat pengasuhan (nursery grounds). Banyak ditemukan juvenil Belonidae di daerah lamun yang berdekatan dengan mangrove. Hal ini juga didukung oleh ditemukannya telur-telur Belonidae pada waktu ikan tersebut dibedah. Jumlah Belonidae yang tertangkap adalah 18 ekor, namun 12 lambung diantaranya ditemukan dalam keadaan kosong. Hal ini berarti Belonidae ke daerah lamun memang bukan untuk mencari makan. Selanjutnya, famili Nemipteridae yang bersifat diurnal dan pada malam hari beristirahat di antara karang (Andriana et al. 2011) banyak tertangkap di padang lamun karena sedang mencari makan.
Famili Siganidae, Labridae dan Lethrinidae yang tertangkap merupakan spesies lamun yang termasuk penghuni yang ada di padang lamun hanya selama tahapan juvenilnya (Tomascik et al. 1997), terutama Siganidae yang dijelaskan oleh Kuncoro (2008) yaitu bersifat herbivora (memakan tumbuhan laut), sehingga sering terdapat di daerah padang lamun maupun tempat yang banyak ditumbuhi rumput lautnya. Namun, ketiga spesies ini tertangkap dalam jumlah yang sedikit. Effendie (1997) menjelaskan alasan yang dapat menjawab hal ini, yaitu mengenai besarnya populasi ikan dalam suatu perairan itu antara lain ditentukan oleh jumlah dan kualitas makanan yang tersedia, mudahnya tersedia makanan dan lama masa pengambilan makanan ikan. Khusus untuk jenis ikan yang berasosiasi dengan padang lamun, Lestari (2010) mengungkapkan bahwa keanekaragaman dan
kelimpahan kumpulan ikan berubah sesuai dengan perubahan kondisi struktur lamun, sebab perubahan dalam indeks luas daun akan mengubah laju pemangsaan yang memengaruhi kelimpahan juvenil ikan dan distribusi ikan predator besar.
5.2 Perbandingan Panjang dan Berat Ikan
Hasil analisis hubungan panjang dan berat ikan swanggi (Sargocentron rubrum) menggunakan Solver pada Microsoft Excel mendapatkan nilai b sebesar 3,23 yang menunjukkan bahwa pola pertumbuhan ikan swanggi yang ditangkap oleh nelayan di perairan Pulau Pramuka, Kepulauan Seribu adalah alometrik positif (pertambahan berat relatif lebih besar dari pertambahan panjang). Hasil perhitungan ini dibandingkan dengan data yang dimiliki oleh metadata FishBase (Froese dan Pauly 2012), nilai b ikan swanggi di perairan Thailand yaitu 2,65 dan di perairan Turki yaitu 3,01. Namun dalam buku yang ditulis bersama Pauly dan Martosubroto (1996), disebutkan bahwa nilai b ikan swanggi sebesar 2,99 atau berarti pertumbuhannya alometrik negatif (pertambahan berat relatif lebih kecil dari pertambahan panjang). Hubungan panjang dan berat spesies yang lain beserta perbandingannya dengan metadata FishBase (Froese dan Pauly 2012) dapat dilihat pada Tabel 15.
Tabel 15 Hubungan panjang dan berat ikan hasil tangkapan nelayan pada habitat padang lamun di perairan Pulau Pramuka, Kepulauan Seribu
No. Nama Umum Spesies Jumlah (ekor)
Nilai b
Perhitungan Metadata FishBase 1 Cendro Tylosurus strongylura 18 1,22 3,00 2 Jarang gigi Choerodon anchorago 5 2,67 - 3 Kerapu koko Epinephelus quoyanus 2 3,41 - 4 Lencam Lethrinus reticulatus 4 3,84 - 5 Lingkis Siganus canaliculatus 5 2,66 3,01 6 Swanggi Sargocentron rubrum 10 3,23 2,65 7 Serak Scolopsis lineata 18 2,69 - 8 Tanda-tanda Lutjanus ehrenbergii 3 0,60 3,33 Keterangan: - = tidak ada data pada pustaka
Keempat spesies lainnya yaitu ikan pasir (Pentapodus trivittatus), ikan baronang (Siganus guttatus), ikan kalam pute (Leiognathus nuchalis) dan ikan belanak (Mugil cephalus) tidak dapat dianalisis hubungan panjang dan beratnya karena hanya terdapat satu spesies pada masing-masing jenis ikan tersebut. Nilai b untuk ikan tanda-tanda (Lutjanus ehrenbergii) menunjukkan pertumbuhan
alometrik negatif yang sangat kecil. Hal ini disebabkan oleh jumlah spesies (tiga ekor) yang terbatas tidak memperlihatkan panjang dan berat yang bervariasi.
5.3 Komposisi Makanan Ikan
5.3.1 Komposisi makanan famili Siganidae
Famili Siganidae yang tertangkap terdiri dari dua spesies, yaitu ikan baronang (Siganus guttatus) dan ikan lingkis (Siganus canaliculatus). Jenis organisme makanan yang dikonsumsi oleh ikan baronang berdasarkan hasil penelitian diperlihatkan pada Tabel 16.
Tabel 16 Jenis dan nilai IP organisme makanan ikan baronang
No. Kelompok Makanan Indeks Bagian Terbesar (IP)
1 Zygnema pectinatum (Chlorophyceae) 52
2 Oedocladium (Chlorophyceae) 48
Jenis makanan yang ditemukan pada ikan baronang lebih sedikit daripada ikan lingkis. Perbedaan dominansi jenis organisme yang dimakan oleh ikan lingkis dan ikan baronang disebabkan oleh adanya kompetisi dalam mencari makan di antara kedua spesies tersebut. Daftar makanan ikan baronang memang tidak begitu bervariasi berdasarkan metadata FishBase (Froese dan Pauly 2012), yaitu tanaman berupa alga atau rumput laut dan zooplankton berupa avertebrata air. Hasil penelitian menemukan jenis-jenis tanaman laut dari kelas alga hijau (Chlorophyceae), yaitu Zygnema pectinatum dan Oedocladium. Komposisi makanan yang didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan baronang adalah herbivorous, yaitu pemakan alga atau tumbuhan laut lainnya. Kuncoro (2008) juga menyebutkan hal yang sama, bahwa baronang merupakan ikan herbivora.
Apabila dibandingkan, ikan lingkis lebih banyak tertangkap (5 ekor) daripada ikan baronang (1 ekor). Jenis organisme makanan yang dikonsumsi oleh ikan lingkis berdasarkan hasil penelitian diperlihatkan pada Tabel 17. Menurut nilai Indeks Bagian Terbesar yang didapat, makanan utama ikan lingkis adalah hancuran lamun (tumbuhan). Siganidae merupakan ikan khas daerah padang lamun yang makanannya hampir keseluruhan adalah lamun.
Tabel 17 Jenis dan nilai IP organisme makanan ikan lingkis
No. Kelompok Makanan Indeks Bagian Terbesar (IP)
1 Enteromorpha sp. (Chlorophyceae) 14
2 Hancuran lamun 39
3 Enhalus acoroides (Liliopsida) 36
4 Halodule uninervis (Liliopsida) 1
5 Gracilaria (Rhodophyceae) 3
6 Hydroides elegans (Polychaeta) 2
7 Eucheuma sp. (Rhodophyceae) 3
8 Caulerpa sp. (Chlorophyceae) 1
9 Thalassia hemprichii (Liliopsida) 1
Hasil yang hampir sama ditemukan pada metadata FishBase (Froese dan Pauly 2012), yang menunjukkan bahwa daftar makanan ikan lingkis di perairan Hongkong adalah tumbuhan, zooplankton dan zoobentos. Lebih lanjut dijelaskan bahwa komposisi makanan yang berupa tumbuhan terdiri atas Enhalus sp., Enteromorpha sp., Eucheuma sp., Gracilaria dan Hypnea spinella serta komposisi makanan yang berupa zoobentos terdiri atas Balanus amphitrite, Bugula neritina, Hydroides elegans, Limnoria tripunctata dan Ophiura kinbergii. Kuncoro (2008) juga mengemukakan bahwa makanan Siganidae adalah tumbuhan laut.
Organisme makanan dominan yang dikonsumsi oleh ikan lingkis yaitu jenis-jenis lamun dari kelas Liliopsida. Liliopsida termasuk tumbuhan berbiji tertutup (Angiospermae) yang mempunyai biji berkeping satu (Monocotyledoneae). Jenis-jenis lamun yang ditemukan sebagai makanan ikan lingkis berasal dari dua famili yang berbeda, yaitu Enhalus acoroides dan Thalassia hemprichii dari famili Hydrocharitaceae serta Halodule uninervis dari famili Cymodoceaceae berdasarkan klasifikasi tumbuhan lamun yang terdapat di perairan pantai Indonesia oleh Kuriandewa (2009). Persentase Indeks Bagian Terbesar sebagai makanan ikan lingkis selanjutnya merupakan kelas alga hijau (Chlorophyceae), yaitu Enteromorpha sp. dan Caulerpa sp. Hasil penelitian Genisa (1999) juga menunjukkan terdapat Eucheuma sp dan Caulerpa sp di dalam isi perut spesies ini. Selanjutnya, di dalam lambung ditemukan rumput laut jenis Eucheuma sp. dari kelas Rhodophyceae (ganggang merah) dan zoobentos jenis Hydroides elegans dari kelas Polychaeta (Filum Anelida). Komposisi makanan yang
didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan lingkis adalah herbivorous, yaitu pemakan alga atau tumbuhan laut lainnya.
5.3.2 Komposisi makanan famili Mugilidae
Famili Mugilidae yang tertangkap yaitu ikan belanak (Mugil cephalus). Jenis organisme makanan yang dikonsumsi oleh ikan belanak berdasarkan hasil penelitian diperlihatkan pada Tabel 18.
Tabel 18 Jenis dan nilai IP organisme makanan ikan belanak
No. Kelompok Makanan Indeks Bagian Terbesar (IP)
1 Caulerpa sp. 72
2 Detritus 28
Menurut nilai Indeks Bagian Terbesar yang didapat, makanan utama ikan belanak adalah Caulerpa sp dari kelas alga hijau (Chlorophyceae). Penelitian yang dilakukan oleh Genisa (1999) di Pulau Handeuleum, Taman Nasional Ujung Kulon menunjukkan bahwa isi perut ikan belanak terdiri atas Hypnea, Gracilaria, Chaetomorpha dan fragmen ophiurid. Ikan belanak di Segera Anakan, Cilacap memanfaatkan detritus mangrove sebagai makanannya. Komposisi makanan yang didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan belanak adalah herbivorous, yaitu pemakan alga atau tumbuhan laut lainnya. Genisa (1999) menyimpulkan hasil yang sama dan menyatakan bahwa alga yang tumbuh di perairan merupakan makanan ikan belanak. Namun, metadata FishBase (Froese dan Pauly 2012) mengelompokan kebiasaan makan ikan belanak berdasarkan tingkat hidup sebagai pemangsa, yaitu zooplanktonic ketika larva, benthophagous dan detritivores ketika juvenil serta herbivorous ketika dewasa.
5.3.3 Komposisi makanan famili Belonidae
Famili Belonidae yang tertangkap yaitu ikan cendro (Tylosurus strongylura). Jenis organisme makanan yang dikonsumsi oleh ikan cendro berdasarkan hasil penelitian diperlihatkan pada Tabel 19.
Tabel 19 Jenis dan nilai IRP organisme makanan ikan cendro
No. Kelompok Makanan Indeks Relatif Penting
1 Phasmida (Nematoda) 1156,3157
2 Enhalus acoroides (Hydrocharitaceae) 279,2495
3 Sisik dan duri Pisces (Chordata) 4391,4610
4 Potongan Moluska 280,1957
Menurut nilai Indeks Relatif Penting yang didapat, makanan utama ikan cendro adalah sisik dan duri nekton (Pisces). Hal ini sesuai dengan metadata FishBase (Froese dan Pauly 2012) yang menunjukkan bahwa makanan ikan cendro di Australia adalah nekton. Nematoda yang ditemukan dalam perut ikan cendro merupakan parasit bagi spesies ini. Enhalus acoroides (Hydrocharitaceae) tidak sengaja termakan ketika ikan cendro menerkam mangsanya dengan cepat karena cara makannya dilakukan dengan pelan-pelan, kemudian sampai jarak yang memungkinkan melompati dan menerjang dengan cepat. Selain itu, hasil penelitian juga menunjukkan bahwa ikan cendro menjadikan Moluska sebagai pilihan makanan, akan tetapi Indeks Relatif Pentingnya menunjukkan bahwa makanan ini tidak terlalu penting bagi ikan cendro. Jika menurut Hobson (1975) vide Andriana et al. (2011) kebiasaan makan spesies ini termasuk ke dalam ikan karnivora yang menggunakan cara mengintai untuk mendapatkan mangsanya, maka berdasarkan komposisi makanan yang didapatkan dari hasil penelitian, dapat dinyatakan bahwa feeding guilds dari ikan cendro adalah piscivorous, yaitu pemangsa dan pemakan ikan.
5.3.4 Komposisi makanan famili Labridae
Famili Labridae yang tertangkap yaitu ikan jarang gigi (Choerodon anchorago). Menurut Setipermana (1996) vide Andriana et al. (2011) Labridae termasuk ikan diurnal (aktif mencari makan pada siang hari) dan pada malam hari masuk ke dalam pasir dan akan keluar lagi pada pagi hari (Kuncoro 2008). Jenis organisme makanan yang dikonsumsi oleh ikan jarang gigi berdasarkan hasil penelitian diperlihatkan pada Tabel 20. Menurut nilai Indeks Relatif Penting yang didapat, makanan utama ikan jarang gigi adalah Copepoda dari Filum Crustacea. Nematoda yang ditemukan dalam perutnya merupakan parasit bagi spesies ini.
Tabel 20 Jenis dan nilai IRP organisme makanan ikan jarang gigi
No. Kelompok Makanan Indeks Relatif Penting
1 Copepoda (Crustacea) 14559,5293
2 Nematoda 5440,4707
Hasil yang hampir sama ditemukan pada metadata FishBase (Froese dan Pauly 2012), yang menunjukkan bahwa daftar makanan ikan jarang gigi di perairan Ryuku Island adalah zoobentos berupa Moluska, Crustacea, cacing dan Echinodermata. Kuncoro (2008) juga berpendapat sama, bahwa spesies ini memiliki gigi yang kuat untuk memecah karang, lobster dan beberapa Moluska. Jonna (2003) menambahkan pada umumnya, Labridae berperan sebagai penggali pasir, karnivora terhadap avertebrata dasar, planktivor dan sebagian kecil adalah ekto parasit untuk ikan-ikan yang lebih besar. Namun, Khalifa (2011) menyebutkan bahwa spesies ini termasuk ikan pemakan alga di karang mati. Komposisi makanan yang didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan jarang gigi adalah zooplanktonic, yaitu pemakan plankton, khususnya Copepoda dengan ukuran meroplankton (larva atau organisme bentik). Namun, komposisi makanan yang ditunjukkan oleh metadata FishBase (Froese dan Pauly 2012) di perairan Ryuku Island dan Filipina menyatakan bahwa ikan jarang gigi adalah benthophagous.
5.3.5 Komposisi makanan famili Leiognathidae
Famili Leiognathidae yang tertangkap yaitu ikan kalam pute (Leiognathus nuchalis). Jenis organisme makanan yang dikonsumsi oleh ikan kalam pute berdasarkan hasil penelitian hanya satu, yaitu larva Crustacea dengan nilai Indeks Relatif Penting sebesar 20000. Hasil yang hampir sama ditemukan oleh metadata FishBase (Froese dan Pauly 2012), yang menunjukkan bahwa daftar makanan ikan kalam pute di perairan Jepang adalah zooplankton, zoobentos dan detritus. Lebih lanjut dijelaskan bahwa komposisi makanan yang berupa zooplankton terdiri atas plankton dan Crustacea (Copepoda dan Cladocerans) serta zoobentos berupa ostracods. Komposisi makanan yang didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan kalam pute
adalah zooplanktonic, yaitu pemakan plankton, khususnya Copepoda dengan ukuran meroplankton (larva atau organisme bentik).
5.3.6 Komposisi makanan famili Serranidae
Famili Serranidae yang tertangkap yaitu ikan kerapu koko (Epinephelus quoyanus). Jenis organisme makanan yang dikonsumsi oleh ikan kerapu koko berdasarkan hasil penelitian hanya satu, yaitu ikan betok hitam (Neoglyphidodon crossi) dengan nilai Indeks Relatif Penting sebesar 20000. Setipermana (1996) vide Andriana et al. (2011) juga menyebutkan bahwa spesies ini tergolong karnivora yang memakan ikan dan Crustacea. Daftar makanan yang sama diungkapkan oleh metadata FishBase (Froese dan Pauly 2012), yaitu nekton dan zoobentos (termasuk Crustacea dan Anelida). Komposisi makanan yang didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan kerapu koko adalah piscivorous, yaitu pemangsa dan pemakan ikan. Hutomo (1995) vide Ramadan (2011) menyebutkan hal yang sama, bahwa ikan kerapu koko termasuk ikan piscivorous, yaitu pemangsa dan pemakan ikan. Komposisi makanan yang ditunjukkan oleh metadata FishBase (Froese dan Pauly 2012) di perairan Australia juga menyatakan bahwa ikan kerapu koko adalah piscivorous.
5.3.7 Komposisi makanan famili Lethrinidae
Famili Lethrinidae yang tertangkap yaitu ikan lencam (Lethrinus reticulatus). Jenis organisme makanan yang dikonsumsi oleh ikan lencam berdasarkan hasil penelitian diperlihatkan pada Tabel 21.
Tabel 21 Jenis dan nilai IRP organisme makanan ikan lencam
No. Kelompok Makanan Indeks Relatif Penting
1 Potongan Malacostraca (Crustacea) 17341,6020
2 Sisik dan duri Pisces (Chordata) 886,1327
Menurut nilai Indeks Relatif Penting yang didapat, makanan utama ikan lencam adalah potongan Malacostraca dari Filum Crustacea. Hasil yang hampir sama ditemukan pada metadata FishBase (Froese dan Pauly 2012), yang menunjukkan bahwa daftar makanan ikan lencam di perairan Australia adalah
bentos, Crustacea dan nekton. Lebih lanjut dijelaskan, ikan lencam bersifat karnivora, mencari makan pada malam hari di dasar perairan dan memakan bentos atau ikan. Komposisi makanan yang didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan lencam adalah demersal feeders, yaitu pemakan avertebrata yang hidup dan bergerak di atas substrat, terutama Crustacea kecil (udang/kepiting). Penelitian Hutomo (1995) vide Ramadan (2011) mengungkapkan bahwa ikan lencam termasuk ikan piscivorous, yaitu pemangsa dan pemakan ikan. Namun, komposisi makanan yang ditunjukkan oleh metadata FishBase (Froese dan Pauly 2012) di perairan Australia menyatakan bahwa ikan lencam adalah benthophagous.
5.3.8 Komposisi makanan famili Nemipteridae
Famili Nemipteridae yang tertangkap terdiri dari dua spesies, yaitu ikan pasir (Pentapodus trivittatus) dan ikan serak (Scolopsis lineata). Jenis organisme makanan yang dikonsumsi oleh ikan pasir berdasarkan hasil penelitian diperlihatkan pada Tabel 22.
Tabel 22 Jenis dan nilai IRP organisme makanan ikan pasir
No. Kelompok Makanan Indeks Relatif Penting
1 Potongan Polychaeta (Anelida) 12345,6581
2 Potongan Cephalopoda (Moluska) 7654,3419
Apabila dibandingkan, ikan serak lebih banyak tertangkap (sepuluh ekor) daripada ikan pasir (satu ekor). Jenis organisme makanan yang dikonsumsi oleh ikan serak berdasarkan hasil penelitian diperlihatkan pada Tabel 23.
Tabel 23 Jenis dan nilai IRP organisme makanan ikan serak
No. Kelompok Makanan Indeks Relatif Penting
1 Potongan Holothuria 327,4809
2 Pterygota (Uniramia) 290,9836
3 Potongan Gastropoda (Moluska) 3066,8142
4 Potongan Crustacea 1069,8206
5 Potongan Polychaeta (Anelida) 1023,7694
6 Sisik dan duri Pisces (Chordata) 169,6121
Menurut nilai Indeks Bagian Terbesar yang didapat, makanan utama ikan pasir adalah potongan Polychaeta dari Filum Anelida. Hasil yang hampir sama
ditemukan pada metadata FishBase (Froese dan Pauly 2012), yang menunjukkan bahwa daftar makanan ikan pasir adalah nekton dan zoobentos. Lebih lanjut dijelaskan bahwa komposisi makanan yang berupa zoobentos terdiri atas Crustacea dan Polychaeta. Selanjutnya, di dalam lambung ditemukan Cephalopoda dari Filum Gastropoda. Komposisi makanan yang didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan pasir adalah benthophagous, yaitu pemakan avertebrata bentik.
Jenis makanan yang ditemukan pada ikan serak lebih beragam. Perbedaan dominansi jenis organisme yang dimakan oleh ikan pasir dan ikan serak disebabkan oleh adanya kompetisi dalam mencari makan di anatara kedua spesies tersebut. Organisme makanan dominan yang dikonsumsi oleh ikan serak (ditunjukkan oleh Indeks Relatif Penting yang tertinggi), yaitu potongan Gastropoda dari Filum Moluska. Namun, daftar makanan ikan serak sama dengan ikan pasir berdasarkan metadata FishBase (Froese dan Pauly 2012), yaitu nekton dan zoobentos (termasuk Crustacea). Hasil penelitian menunjukkan spesies ini lebih memilih Moluska sebagai makanannya daripada Crustacea dan ditemukan pula bentos lainnya, yaitu Polychaeta dan Holothuria. Pterygota dari Filum Uniramia merupakan jenis serangga bersayap yang hidup di habitat perairan, sehingga adanya Pterygota di dalam salah satu spesies ikan serak karena tidak sengaja termakan ketika ikan tersebut sedang mencari makan. Komposisi makanan yang didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan serak adalah benthophagous, yaitu pemakan avertebrata bentik. Komposisi makanan yang ditunjukkan oleh metadata FishBase (Froese dan Pauly 2012) di perairan Ryuku Island juga menyatakan bahwa ikan serak adalah benthophagous.
5.3.9 Komposisi makanan famili Holocentridae
Famili Holocentridae yang tertangkap yaitu ikan swanggi (Sargocentron rubrum). Jenis organisme makanan yang dikonsumsi oleh ikan swanggi berdasarkan hasil penelitian diperlihatkan pada Tabel 24. Menurut nilai Indeks Relatif Penting yang didapat, makanan utama ikan swanggi adalah Crustacea.
Tabel 24 Jenis dan nilai IRP organisme makanan ikan swanggi
No. Kelompok Makanan Indeks Relatif Penting
1 Potongan Malacostraca (Crustacea) 17007,8353
2 Nematoda 39,8421
3 Sisik dan duri Pisces (Chordata) 41,3786
4 Potongan Lamun (Liliopsida) 37,2673
Hasil yang hampir sama ditemukan oleh De Bruin et al. (1995) vide Fitriyanti (2000) yang menyatakan bahwa makanan ikan swanggi adalah zooplankton yang besar, cacing Polychaeta, Crustacea dan ikan kecil. Nematoda ditemukan di dalam lambung ikan ini bukan sebagai makanannya, tetapi sebagai parasit karena sebagian besar Nematoda hidup sebagai endoparasit pada ikan (Suwignyo et al. 2005). Pendapat ini didukung oleh penelitian yang dilakukan Fitriyanti (2000) yang menemukan Nematoda sebagai salah satu parasit pada ikan swanggi. Lamun tidak sengaja termakan, namun menandakan bahwa ikan ini memang mencari makan di daerah padang lamun.
Komposisi makanan yang didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan swanggi adalah demersal feeders, yaitu pemakan avertebrata yang hidup dan bergerak di atas substrat, terutama Crustacea kecil (udang/kepiting). Namun, Hutomo (1995) vide Ramadan (2011) mengungkapkan bahwa ikan swanggi termasuk ikan piscivorous, yaitu pemangsa dan pemakan ikan. Sisik ikan memang ditemukan di dalam perutnya, tetapi dalam nilai Indeks Relatif Penting yang relatif kecil (41,37) jika dibandingkan dengan nilai Crustacea yang mencapai 17007,83. Metadata FishBase (Froese dan Pauly 2012) menyebutkan hal yang berbeda, bahwa dalam hal kebiasaan makan, spesies ini termasuk ke dalam benthophagous, yaitu pemakan avertebrata bentik. Menurut De Bruin et al. (1995) vide Fitriyanti (2000), ikan swanggi bersifat soliter tetapi ada juga yang berkelompok sehingga kompetisi dalam mencari makan dapat menjadi penyebab perbedaan komposisi makanan dan kebiasaan makan ini.
5.3.10 Komposisi makanan famili Lutjanidae
Famili Lutjanidae yang tertangkap yaitu ikan tanda-tanda (Lutjanus ehrenbergii). Ikan ini disebut nelayan sebagai ikan tanda-tanda karena
mempunyai bintik hitam besar di dekat sirip ekornya. Jenis organisme makanan yang dikonsumsi oleh ikan tanda-tanda berdasarkan hasil penelitian hanya satu, yaitu potongan Crustacea dengan nilai Indeks Relatif Penting sebesar 20000. Menurut Setipermana (1996) vide Andriana et al. (2011), spesies ini merupakan predator ikan, Crustacea dan plankton. Daftar makanan yang sama diungkapkan oleh metadata FishBase (Froese dan Pauly 2012), yaitu nekton dan zoobentos yang terdiri dari cumi-cumi, kepiting dan udang. Komposisi makanan yang didapatkan dari hasil penelitian tersebut dapat memberikan pernyataan bahwa feeding guilds dari ikan tanda-tanda adalah demersal feeders, yaitu pemakan avertebrata yang hidup dan bergerak di atas substrat, terutama Crustacea kecil (udang/kepiting). Namun, Hutomo (1995) vide Ramadan (2011) mengungkapkan bahwa ikan tanda-tanda termasuk ikan piscivorous, yaitu pemangsa dan pemakan ikan. Komposisi makanan yang ditunjukkan oleh metadata FishBase (Froese dan Pauly 2012) di perairan Solomon juga menyatakan bahwa ikan tanda-tanda adalah piscivorous.
Perbedaan komposisi makanan dan feeding guilds dapat terjadi karena ada beberapa faktor yang memengaruhi kebiasaan makan ikan, diantaranya ukuran, umur, jenis kelamin, morfologi, tingkah laku, waktu dan lokasi yang berbeda (Elliott dan Hemingway 2002). Jika ikan tumbuh, maka kemampuannya untuk memangsa akan berubah. Ikan yang lebih besar biasanya makan lebih banyak dan berkemungkinan untuk bergerak dan memangsa lebih cepat daripada ikan yang berukuran kecil. Effendie (1997) juga menambahkan umumnya makanan pertama untuk semua ikan ialah plankton bersel tunggal yang berukuran kecil. Selain itu, spesies yang mencari makan secara individu akan berbeda tingkah laku pemangsaannya dengan spesies yang bergerombol. Ketersediaan makanan juga berperan penting karena akan memengaruhi kompetisi intraspesies dan interspesies.
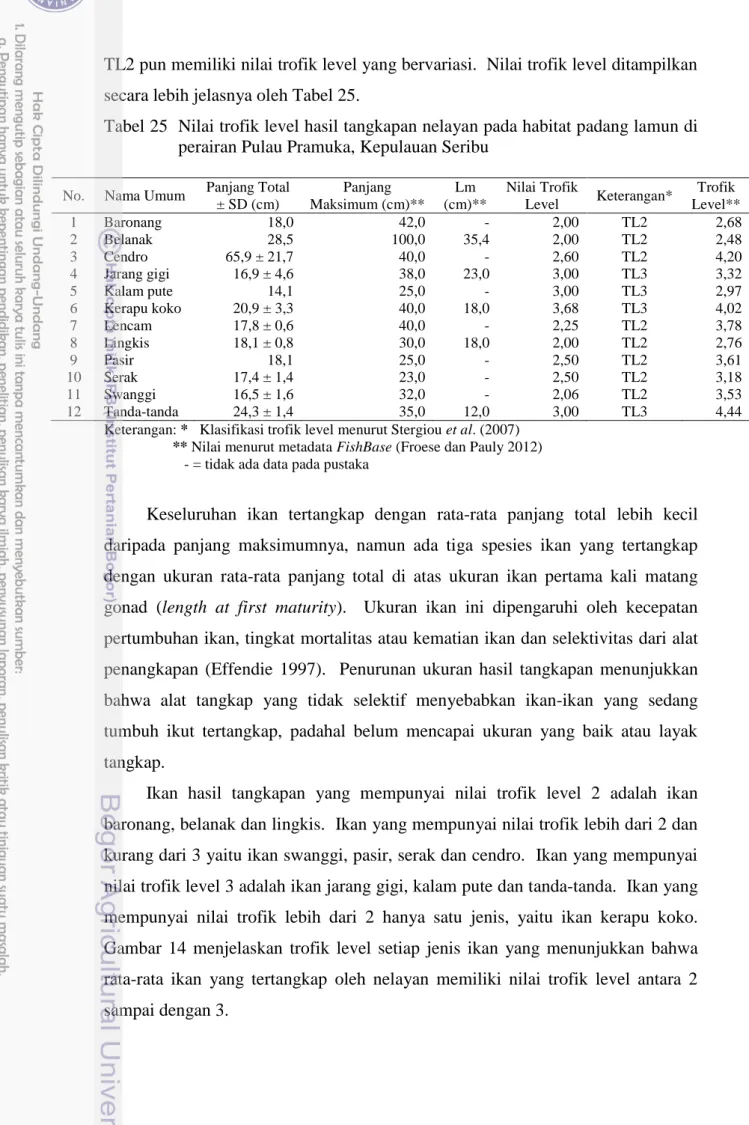
5.4 Trofik Level Hasil Tangkapan
Hasil analisis trofik level menunjukkan bahwa delapan spesies yang tertangkap berada pada TL2 dan empat spesies pada TL3. Spesies-spesies pada
TL2 pun memiliki nilai trofik level yang bervariasi. Nilai trofik level ditampilkan secara lebih jelasnya oleh Tabel 25.
Tabel 25 Nilai trofik level hasil tangkapan nelayan pada habitat padang lamun di perairan Pulau Pramuka, Kepulauan Seribu
No. Nama Umum Panjang Total ± SD (cm) Panjang Maksimum (cm)** Lm (cm)** Nilai Trofik Level Keterangan* Trofik Level** 1 Baronang 18,0 42,0 - 2,00 TL2 2,68 2 Belanak 28,5 100,0 35,4 2,00 TL2 2,48 3 Cendro 65,9 ± 21,7 40,0 - 2,60 TL2 4,20 4 Jarang gigi 16,9 ± 4,6 38,0 23,0 3,00 TL3 3,32 5 Kalam pute 14,1 25,0 - 3,00 TL3 2,97 6 Kerapu koko 20,9 ± 3,3 40,0 18,0 3,68 TL3 4,02 7 Lencam 17,8 ± 0,6 40,0 - 2,25 TL2 3,78 8 Lingkis 18,1 ± 0,8 30,0 18,0 2,00 TL2 2,76 9 Pasir 18,1 25,0 - 2,50 TL2 3,61 10 Serak 17,4 ± 1,4 23,0 - 2,50 TL2 3,18 11 Swanggi 16,5 ± 1,6 32,0 - 2,06 TL2 3,53 12 Tanda-tanda 24,3 ± 1,4 35,0 12,0 3,00 TL3 4,44
Keterangan: * Klasifikasi trofik level menurut Stergiou et al. (2007) ** Nilai menurut metadata FishBase (Froese dan Pauly 2012)
- = tidak ada data pada pustaka
Keseluruhan ikan tertangkap dengan rata-rata panjang total lebih kecil daripada panjang maksimumnya, namun ada tiga spesies ikan yang tertangkap dengan ukuran rata-rata panjang total di atas ukuran ikan pertama kali matang gonad (length at first maturity). Ukuran ikan ini dipengaruhi oleh kecepatan pertumbuhan ikan, tingkat mortalitas atau kematian ikan dan selektivitas dari alat penangkapan (Effendie 1997). Penurunan ukuran hasil tangkapan menunjukkan bahwa alat tangkap yang tidak selektif menyebabkan ikan-ikan yang sedang tumbuh ikut tertangkap, padahal belum mencapai ukuran yang baik atau layak tangkap.
Ikan hasil tangkapan yang mempunyai nilai trofik level 2 adalah ikan baronang, belanak dan lingkis. Ikan yang mempunyai nilai trofik lebih dari 2 dan kurang dari 3 yaitu ikan swanggi, pasir, serak dan cendro. Ikan yang mempunyai nilai trofik level 3 adalah ikan jarang gigi, kalam pute dan tanda-tanda. Ikan yang mempunyai nilai trofik lebih dari 2 hanya satu jenis, yaitu ikan kerapu koko. Gambar 14 menjelaskan trofik level setiap jenis ikan yang menunjukkan bahwa rata-rata ikan yang tertangkap oleh nelayan memiliki nilai trofik level antara 2 sampai dengan 3.
Gambar 14 Grafik trofik level hasil tangkapan setiap jenis ikan yang tertangkap pada habitat padang lamun di perairan Pulau Pramuka
Teori mengatakan ikan yang berada di trofik level bawah harus lebih sedikit tertangkap daripada ikan pada trofik level diatasnya. Namun, kegiatan penangkapan pada habitat padang lamun ini menyebabkan ikan-ikan di trofik level bawah lebih banyak tertangkap, hal ini diperlihatkan oleh Gambar 15 yang menunjukkan bahwa total biomassa hasil tangkapan pada TL2 jauh lebih besar daripada total biomassa hasil tangkapan di TL3.
Gambar 15 Grafik total biomassa hasil tangkapan pada setiap tingkat rantai makanan di habitat padang lamun perairan Pulau Pramuka
Banyaknya hasil tangkapan ikan yang tertangkap pada TL2 menyebabkan trofik level hasil tangkapan nelayan menjadi tidak seimbang. Hal ini menunjukkan bahwa kegiatan penangkapan ikan berpotensi merusak keseimbangan ekosistem pada habitat padang lamun di perairan Pulau Pramuka, Kepulauan Seribu, Provinsi DKI Jakarta.
Estimasi trofik level berhubungan dengan tingkat hidup ikan (juvenil atau dewasa). Gambar 16 menunjukkan hubungan antara spesies ikan, rata-rata trofik levelnya dengan panjang total ikan tersebut.
Gambar 16 Grafik hubungan antara trofik level dengan panjang maksimum spesies ikan hasil tangkapan di habitat padang lamun perairan Pulau Pramuka
Analisis regresi atau persamaan linear menghasilkan nilai slope atau kemiringan sebesar 2,220. Nilai slope yang positif ini menunjukkan bahwa spesies yang lebih besar cenderung menjadi piscivorous atau pemakan ikan daripada spesies yang lebih kecil. Hubungan makan dan dimakan ini dapat dilihat lebih jelas pada rantai makanan. Gambar 17 menunjukkan rantai makanan pada habitat tersebut.
I II III IV
Gambar 17 Gambar rantai makanan pada habitat padang lamun di perairan Pulau Pramuka berdasarkan analisis feeding guilds hasil tangkapan
Keterangan: = hasil pengukuran = sumber pustaka = teridentifikasi = tidak teridentifikasi Leiognathus nuchalis Sargocentron rubrum Epinephelus quoyanus Pentapodus trivittatus
Fitoplankton Copepoda Choerodon
anchorago Larva Crustacea Zooplankton Diatoms dan Macrophtyes Mugil cephalus Siganus canaliculatus Siganus guttatus Ikan herbivora Crustacea kecil Lutjanus ehrenbergii Lethrinus reticulatus Zooplanktonic Detritus Moluska Tylosurus strongylura Scolopsis lineata Anelida Echinodermata Neoglyphidodon crossi
Studi lebih lanjut perlu dilakukan untuk memperoleh gambaran yang lebih baik tentang struktur rantai makanan (food chain). Studi ini dilakukan dengan meningkatkan intensitas penangkapan agar diperoleh sampel ikan yang lebih mewakili populasi di lokasi tersebut. Berbagai alat tangkap dan metode penangkapan perlu diterapkan untuk memperoleh data yang lebih baik namun penangkapan untuk memperoleh sampel ini pun harus memperhatikan prinsip-prinsip ekologis agar tidak berpotensi merusak keseimbangan ekologi pada habitat tersebut.
Berkaitan dengan tanggung jawab kegiatan penangkapan ikan yang harus disertai dengan manajemen, salah satu prinsip yang terkait dalam pengelolaan perikanan menurut FAO (2005) yaitu pendekatan ekosistem harus seimbang antara konservasi dan pemanfaatan. Pilihan-pilihan yang dapat dilakukan dalam mengimplementasikan pendekatan ekosistem yaitu pengaturan alat tangkap yang digunakan oleh nelayan serta pengaturan secara spasial dan temporal.
Pengaturan alat tangkap dapat dilakukan dengan mengatur ukuran mata jaring, dalam hal ini berarti memperbesar ukuran mata jaring agar ikan-ikan yang berukuran kecil tidak ikut tertangkap. Pengubahan ukuran mata jaring juga harus memperhatikan ukuran ikan untuk pertama kali matang gonad sehingga dapat dipastikan ikan-ikan yang tertangkap minimal sudah pernah memijah. Penyesuaian metode penangkapan yang lebih ramah lingkungan perlu dilakukan untuk mengurangi dampak negatif terhadap habitat dan spesies yang dilindungi, misalnya tidak menangkap ikan di daerah pengasuhan.
Pengaturan secara spasial dapat dilakukan apabila habitat sudah dalam kondisi sangat terancam. Kawasan yang dulunya daerah penangkapan ikan untuk selanjutnya dijadikan kawasan konservasi laut dan nelayan diberi alternatif daerah penangkapan lain yang belum dimanfaatkan atau masih dalam status baik. Pengaturan secara temporal dilakukan dengan memperhatikan musim pemijahan ikan dan waktu migrasi ikan. Menurut Effendie (1997), hal ini dilakukan dengan tujuan agar jumlah induk ikan tidak berkurang dan tingkah lakunya pada waktu pemijahan tidak terganggu.