AKTIVITAS ENZIM KITINASE DAN PROTEASE PADA
CENDAWAN NEMATOFAGUS (Duddingtonia flagrans
DAN Saccharomyces cerevisiae)
(Kitikase and Protease Enzym Activity on Nemotophagus Fungi
(Duddingtonia Flagrans and Saccharomyces Cerevisiae))
R.Z.AHMAD
Balai Besar Penelitian Veteriner, Jl. R.E. Martadinata 30, Bogor 16114
ABSTRACT
Enzymes are proteins that catalyze chemical reactions, and that convert molecule arrangements into different molecules form (products). Chitinase and protease enzyme are needed by nematophagous fungi in the mechanism to kill nematode worms. In this experiment nematophagous fungi Duddingtonia flagrans and
Saccharomyces cerevisiae were inspected for the contents of enzyme activities. The aim of this experiment is
to study chitinase and protease enzymes that may be contained by both fungi above. The inspection of enzyme on intracellular and extracellular fungi was at Institute of Agriculture Bogor (IPB) and Research Institute for Veterinary Science (BBalitvet) Bogor. The observation on intra cellular was conducted by sonicating the harvest isolates, and then adding some chemical reaction, then reading the activities in spectrophotometer. The observation on the activity of extra cellular enzyme was done by adding a trigger (protein or chitin) in harvested isolates, and then incubating them for 4 days, and then adding some chemical reactions, then reading their activities in spectrophotometer. The result of experiment showed that intracellular chitinase activities in D. flagrans and S. cerevisiae are 3.180 units/g and 4.256 units/g respectively, while those of protease are: 7.131 units/g and 0.005 unit/g. The tests on chitinase extracelluler activities in D. flagrans and S. cerevisiae were 2.172 units/g and 2.181 units/g, while protease content was 0.0003 unit/g and 0.00 unit/g respectively. The conclusion of this study is that the amount of activity of protease enzyme from nematophagous fungi D. flagrans is significantly (P < 0.05) bigger than that of S.
cerevisiae. While the amount of activity of chitinase enzyme S. cerevisiae is significantly (P < 0.05) bigger
than that of D. flagrans.
Key Words: Chitinase, Protease, D. flagrans, S. cerevisiae ABSTRAK
Enzim adalah protein sebagai katalis yang mempercepat suatu reaksi kimia dan merubah suatu susunan molekul menjadi molekul dalam bentuk lain (produk). Enzim kitinase dan protease diperlukan cendawan nematofagus di dalam mekanisme membunuh cacing nematoda. Pada percobaan ini cendawan nematofagus
Duddingtonia flagrans dan Saccharomyces cerevisiae diperiksa aktivitas enzim yang dikandungnya. Tujuan
dari percobaan ini untuk mempelajari aktivitas enzim kitinase dan protease yang mungkin dimiliki kedua cendawan isolat lokal tersebut di atas. Pengujian enzim terhadap intra dan ekstraseluler cendawan dilakukan di Institut Pertanian Bogor (IPB) dan Balai Besar Penelitian Veteriner (BBalitvet) Bogor. Pengujian aktivitas enzim intra seluler dilakukan dengan cara mensonikasi isolat yang telah dipanen dan kemudian menambahkan beberapa reaksi kimia lalu dibaca aktivitasnya pada spektrofotometer. Pengujian aktivitas enzim ekstraseluler dilakukan dengan cara menambahkan trigger (protein atau kitin) pada isolat yang telah dipanen lalu menginkubasikan selama 4 hari dan kemudian menambahkan beberapa reaksi kimia lalu dibaca aktivitasnya pada spektrofotometer. Hasil percobaan ini adalah aktivitas kitinase intraseluler pada D. flagrans dan S. cerevisiae sebesar: 3,180 unit/g dan 4,256 unit/g sedangkan protease adalah: 7,131 unit/gr dan 0,005 unit/g. Sedangkan uji aktivitas enzim ekstraseluler kitinase pada D. flagrans dan S. cerevisiae adalah: 2,172 g/unit dan 2,181 unit/g, sedangkan kandungan proteasenya adalah 0,0003 unit/g dan 0,00 unit/g. Kesimpulan dari percobaan ini adalah jumlah aktivitas enzim protease cendawan nematofagus D. flagrans lebih besar dari pada S. cerevisiae secara nyata (P < 0,05). Sedangkan jumlah aktivitas kitinase pada S. cerevisiae lebih besar dari pada D. flagrans secara nyata (P < 0,05).
PENDAHULUAN
Enzim merupakan protein untuk katalis (percepatan) reaksi kimia. Enzim tersebut akan merubah suatu susunan molekul menjadi susunan lain yang lebih sederhana berupa produk, bereaksi secara spesifik, dan bekerja seperti kunci dan gembok, artinya suatu aktivitas enzim hanya bereaksi terhadap susunan molekul tertentu. Aktivitas kerja enzim dipengaruhi oleh beberapa faktor seperti inhibitor (memperlambat reaksi), aktivator (mempercepat reaksi), kofaktor, koenzim, suhu, pH, konsentrasi dari substrat (WIKIPEDIA. 2007).
Enzim kitinase adalah enzim pencerna yang memecah ikatan glikosida dalam kitin, menghidrolisis kitin menjadi kitosan. Enzim ini dapat digambarkan dari rangkaian molekul-molekul penyusunnya berbentuk seperti pita (Gambar 1) (SOMASHEKAR dan JOSEPH, 1996). Sedangkan enzim protease adalah enzim yang memecah protein menjadi peptida atau ikatan asam amino yang lebih sederhana. Protease terdiri dari asam aspartat, asam glutamik cysteine metallo, serine, dan threonine. Enzim protease dapat digambarkan dari rangkaian molekul-molekul penyusunnya berbentuk seperti pita (Gambar 2) (WIKIPEDIA, 2007).
Protein sendiri artinya adalah kumpulan asam amino yang disusun oleh rantai linier yang mempunyai gugus karboksil dan amin nitrogen, polimer linier yang dibuat dari 20 L-α asam amino yang berbeda. Sementara itu Kitin mempunyai arti berbeda yaitu Polisakarida yang tidak larut terdiri dari β (1 – 4) berikatan dengan N-asetil D-Glukosamin (GLc Nac) unit. Kitin merupakan polisakarida yang banyak ditemukan di alam sebagai komponen struktur kepiting, serangga, cacing, cendawan dan tumbuhan lain (GOODAY, 1994). Protein
dan kitin merupakan bagian materi penyusun struktur larva dan telur cacing Haemonchus contortus. Cacing ini mempunyai pelindung kutikula yang mengandung lapisan kitin dan protein. Telur cacing juga mempunyai beberapa lapisan pelindung dan diantara lapisan tersebut adalah lapisan pelindung lipoprotein dan kitin (CROLL dan MATTHEW, 1977).
Di dalam pengendalian cacing, cendawan D. flagrans dan S. cerevisiae membunuh cacing memerlukan bantuan enzim kitinase dan protease, sehingga keberadaan enzim-enzim ini
sangat diperlukan oleh cendawan nematofagus di dalam mempertahankan kelangsungan hidupnya. Kedua enzim ini dipakai pada saat penetrasi telur dan cacing. Lapisan struktur pelindung larva cacing dan telur tersebut akan dilisiskan kemudian cendawan akan masuk dan mengambil nutrisi. Virulensi beberapa cendawan nematofagus seperti Arthrobotrys spp dan D. flagrans ditentukan aktivitasnya dengan keberadaan enzim kitinase dan protease (serin protease) (PARK et al. 2000; HUANG et al. 2004; MEYER dan WIEBE, 2003).
Oleh karena itu penting kiranya diketahui kemungkinan keberadaan kandungan enzim kitinase dan protease yang terdapat pada cendawan D. flagrans dan S. cerevisiae isolat lokal. Tujuan penelitian ini adalah mempelajari aktivitas enzim intraseluler dan ekstraseluler yang terkandung oleh cendawan D. flagrans dan S. cerevisiae isolat lokal.
Gambar 1. Struktur pita molekul kitinase Sumber: SEWONSUH (2007)
Gambar 2. Struktur pita molekul protease Sumber: ARGONNE (2003)
MATERI DAN METODE Isolat cendawan
Isolat D. flagrans yang digunakan ialah isolat lokal yang telah dikarakterisasi (AHMAD, 2003). Sedangkan S. cerevisiae yang digunakan adalah isolat yang diisolasi dari Cianjur pada tahun 2002 (ISTIANA et al., 2002). Kedua isolat lokal yang digunakan berasal dari biakan yang disimpan dalam media Souborouth Dextrosa Agar (SDA) dan diremajakan setiap 4 bulan. Isolat diperbanyak dengan media SDA sesuai keperluan.
Tempat dan waktu penelitian
Penelitian dilaksanakan di Pusat Penelitian Sumber Daya Hayati dan Bioteknologi IPB, dan Balai Besar Penelitian Veteriner. Penelitian ini dilakukan selama 6 bulan dimulai bulan Juni sampai dengan bulan Desember tahun 2006.
Isolat-isolat lokal diperbanyak dan dipanen, selanjutnya dilakukan pemeriksaan aktivitas kandungan enzim kitinase dan protease khamir S. cerevisiae dan kapang D. flagrans. Perbanyakan S. cerevisiae dilakukan dengan cara menginokulasikan dan menginkubasi isolat pada suhu kamar (22° – 30°C) selama 3 hari dan D. flagrans selama 10 hari pada medium Potato Dekstrosa Agar (PDA), kemudian dipanen di Laboratorium Mikologi Bbalitvet. Cendawan hasil panen selanjutnya dibawa ke Pusat Penelitian Sumber Daya Hayati dan Bioteknologi IPB untuk diperiksa aktivitas enzimnya. Cendawan tersebut disonikasi, lalu diperiksa aktivitas enzim kitinase dan protease yang dikandungnya untuk enzim intraseluler. Sedangkan untuk enzim ekstraseluler cendawan tersebut ditambahkan trigger (kitin atau protein) diinkubasikan 2 hari pada suhu kamar kemudian diperiksa aktivitas enzimnya.
Pengukuran aktivitas kitinase
Pemeriksaan aktivitas kitin dilakukan menurut Imoto dan Yagashita (1971) yang telah dimodifikasi dilakukan dalam beberapa tahap seperti sebagai berikut:
a. Penyiapan koloidal kitin
Ke dalam Erlenmeyer dimasukkan 20 g kitin, lalu ditambahkan 400 ml HCl pekat, setelah itui ditutup rapat dan dibiarkan semalam pada temperatur 4°C, kemudian disaring dengan menggunakan glasswool, filtrat yang didapat ditambahkan 200 ml air dingin dan pH larutan diatur menjadi 7,0 dengan menambahkan secara perlahan-lahan NaOH 10 N. Disentrifugasi pada 7000 rpm, suhu 4°C selama 10 menit. Filtrat dibuang dan pelet ditambahkan dengan air dingin kemudian disentrifugasi lagi dengan kondisi yang sama Pelet (koloidal kitin) disimpan pada 4°C (siap untuk digunakan).
b. Pengukuran aktivitas kitinase
Aktivitas enzim kitinase ditentukan berdasarkan jumlah N-asetil-D glukosamin yang dibebaskan hidrolisa substrat koloidal kitin. Senyawa N-asetil-D- glukosamin diukur dengan metode Schales (IMOTO dan YAGASHITA, 1971) yang telah dimodifikasi. Satu unit aktivitas dinyatakan sebagai jumlah N-asetil_D-glukosamin (M mol) yang terbentuk permenit pada kondisi assaynya.
Untuk mengukur aktivitas enzim kitinase setiap contoh diikuti dengan kontrol. Contoh terdiri dari 200 μl substrat koloidal kitin 0,3%, 200 μl buffer fosfat pH 7 0,02 M dan 200 μl larutan enzim diinkubasi selama 30 menit pada suhu 55°C. Campuran tersebut kemudian disentrifugasi 10000 rpm, 4 menit pada suhu 4°C. 500 μl filtratnya diambil, ditambahkan 500 μl akuades dan 1 ml pereaksi Schales, direbus selama 10 menit untuk menghentikan aktivitas enzim dan setelah dingin diukur absorbansinya pada panjang gelombang 420 nm. Kadar GLC Nac pada contoh (Xc) dihitung berdasarkan kurva standar, Kontrol terdiri dari 200 μl substrat koloidal kitin 0,3%, 200 μl buffer fosfat pH 7 (0,02 M), diinkubasi pada kondisi yang sama dengan contoh, setelah disentrifugasi 300 μl filtrat diambil ditambah dengan 200 μl larutan enzim dan diperlakukan sama dengan contoh. Kadar Glc kontrol (Xk) dihitung dari kurva standar.
Pengukuran aktivitas protease
Untuk pemeriksaan aktivitas protease menurut BERGMEYER dan GRASS (1983) yang
a. Disiapkan 3 tabung untuk tabung contoh, standard dan blanko. Kemudian ditambahkan buffer Fosfat berpH 7, dan buffer Kasein pada setiap tabung sebanyak 1 ml, kemudian pada tabung contoh ditambahkan 0,2 ml larutan enzim dan tabung standar ditambah kan 0,2 ml Tirosin, dan tabung blanko ditambahkan 0,2 ml akuades, setelah itu diinkubasi selama 10 menit pada suhu 37°C.
b. Pada setiap tabung dimasukkan 2 ml TCA dan akuades dimasukkan pada tabung contoh sebanyak 0,2 ml. sedangkan pada tabung standard dan tabung blanko dimasukkan larutan enzim (contoh) sebanyak 0,2 ml. Kemudian diinkubasi selama 10 menit pada suhu 37°C, dan disentrifugasi pada 4000 rpm selama 10 menit.
c. Selanjutnya menyiapkan 3 tabung baru dan pada setiap tabung ditambahkan masing-masing supernatan dari larutan di atas sebanyak 1,5 ml, lalu ditambahkan 5 ml Na2CO3 dan 1 ml larutan pereaksi Folin. Kemudian diinkubasikan selama 20 menit pada suhu 37°C, lalu diukur absorbensinya pada panjang gelombang λ 578 nm. Parameter yang diamati adalah perubahan warna (panjang gelombang) pada spektrofotometer yang selanjutnya dikonversikan dengan aktivitas enzim pergramnya. Pemeriksaan enzim-enzim dilakukan sebanyak 3 kali ulangan. Hasil yang didapat diuji secara statistik untuk membedakan produksi enzim kedua cendawan tersebut dengan uji Duncan dan Bonferroni (STELL dan
TORRIE, 1995).
HASIL DAN PEMBAHASAN
Cendawan D. flagrans dan S. cerevisiae adalah 2 isolat yang berbeda genus sehingga
cara hidup dan berkembang biaknya berlainan. D. flagrans adalah termasuk golongan kapang sedangkan S. cerevisiae adalah khamir. Kemampuan berkembang biak S. cerevisiae lebih besar dan cepat dibandingkan dengan kapang D. flagrans (DUBE, 1996). Demikian
pula dengan produksi enzim-enzim yang dihasilkan oleh S. cerevisiae lebih banyak dibandingkan produksi D.flagrans selain kitinase dan protease yaitu seperti invertase, asam fosfatase, melibiase, katalase, glukanse, glukosidase, glukoamilase, fosfolipase (LAMPEN, 1968; LODDER, 1970). Namun
kapang D. flagrans lebih mampu bertahan hidup di alam bebas dibandingkan S. cerevisiae karena D. flagrans mempunyai klamidospora (modifikasi hifa untuk reproduksi), klamidospora ini dapat bertahan sampai berbulan-bulan dari kekeringan (GRONVOLD et al., 1996). Dari perbedaan karakter diatas tentunya kedua cendawan tersebut akan menghasilkan jumlah enzim yang berbeda. Enzim-enzim tersebut digunakan cendawan untuk mempertahankan kelangsungan hidupnya, untuk mencerna bahan tertentu yang keras dan kemudian mengambil nutrisi yang dibutuhkannya. Pada proses pemeriksaan enzim sangat tergantung pada ketrampilan operator pelaksana, bila tidak terampil hasil yang didapat akan berbeda. Berikut ini adalah hasil aktivitas enzim yang dikandung oleh D. flagrans dan S. cerevisiae. Kandungan aktivitas enzim unit pergram contoh yang dimiliki kedua cendawan tersebut berbeda hasilnya. Pengukuran aktivitas enzim ini dibaca dengan spektrofotometer yang terbatas kemampuan membacanya, jadi meskipun pada hasil pemeriksaan nilai 0 unit/gr seperti pada protease yang dimiliki S. cerevisae (Tabel 2) belum tentu tidak ada, bisa pula belum dapat terbaca atau terdeteksi karena kandungan enzimnya sangat kecil.
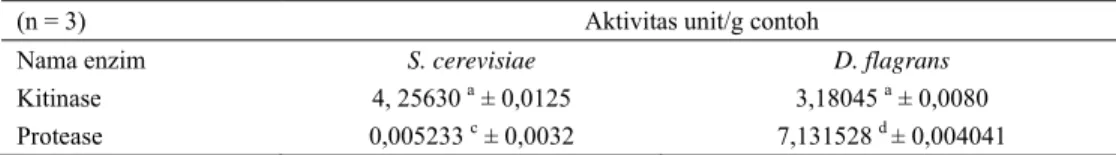
Tabel 1. Rataan aktivitas enzim intraseluler Kitinase dan Protease yang dimiliki oleh D. flagrans dan S.
cerevisiae
(n = 3) Aktivitas unit/g contoh
Nama enzim S. cerevisiae D. flagrans
Kitinase 4, 25630 a ± 0,0125 3,18045 a ± 0,0080
Protease 0,005233 c ± 0,0032 7,131528 d ± 0,004041
Angka-angka dengan huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan nyata (P < 0,05)
Tabel 2. Rataan aktivitas ekstraseluler enzim kitinase dan protease yang dimiliki oleh D. flagrans dan S.
cerevisiae
(n = 3) Aktivitas unit/g
Nama enzim S. cerevisiae D. flagrans
Kitinase 2,18115 a ± 0,003 2,1724 3 c ±0,0127
Protease 0 b ±0 0,0003 b ± 0,0001
Angka-angka dengan huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan nyata (P< 0,05)
Hasil uji pada Tabel 1 dan 2 didapat dengan cara membuat kurva persamaan standar, Untuk uji protease mempunyai persamaan Y = -0,0039x + 1,0119 dengan R2 = 0,987. Sedangkan Kitinase Y= -0,0048x + 1,0445. dengan R2 = 0,9949 pada absorbansi 420 nm.
Dari Tabel 1 menunjukkan bahwa kedua isolat cendawan tersebut memiliki enzim kitinase maupun protease, tetapi kandungan enzim keduanya mempunyai komposisi berbeda. Aktivitas enzim protease yang dimiliki cendawan D. flagrans lebih tinggi dari pada S. cerevisiae, sebaliknya enzim kitinase yang dimiliki cendawan S. cerevisiae lebih tinggi dari pada D. flagrans. Sehubungan uji ini dilakukan dengan metode IMOTO dan YAGASHITA (1971) yang telah dimodifikasi,
dan metode BERGMEYER dan GRASS (1983)
maka diperoleh hasil seperti di atas, bila diganti metodenya hasil yang didapat akan sedikit berbeda meskipun tidak berbeda jauh nilai enzimnya. Adapun pada Tabel 1 enzim yang diuji adalah kandungan enzim intraseluler karena yang diperiksa adalah hasil sel-sel yang telah dihancurkan setelah melalui proses sonikasi. Kandungan (aktivitas) enzim kitinase intraseluler S. cerevisiae dan D. flagrans tidak beda nyata secara statistik (P > 0,05), tetapi jumlah aktivitas enzim protease D. flagrans lebih besar dari pada S. cerevisiae dan berbeda nyata secara statistik (P < 0,05). Pada enzim intraseluler faktor utama yang mempengaruhi produksi enzim adalah faktor dalam yaitu kandungan gen penghasil enzim yang dimiliki cendawan tersebut. Diduga gen-gen penghasil enzim protease yang dimiliki oleh D. flagrans lebih banyak dibandingkan S. cerevisiae. Sebaliknya untuk aktivitas enzim ekstra seluler sangat banyak dipengaruhi faktor luar. Namun di dalam proses kehidupannya kedua enzim ini dipakai oleh cendawan tersebut dengan cara
kerja sinergis untuk melisiskan protein dan kitin.
Pada pengujian aktivitas enzim ekstraseluler berbeda pula jumlah kandungan dan perbandingan komposisi enzimnya dibandingkan dengan intraseluler. Pada pengujian kitinase kedua cendawan tersebut memiliki kandungan enzim yang hampir sama yaitu 2,18 dan 2,17 unit/g, demikian pula kandungan enzim protease keduanya hampir tidak terbaca aktivitasnya sampai 4 desimal, 0,0003 unit/gr artinya meskipun D. flagrans memiliki enzim protease namun sangat kecil. Pada Tabel 2 secara statistik aktivitas enzim protease yang dimiliki kedua cendawan tersebut tidak berbeda nyata (P > 0,05), tetapi jumlah aktivitas enzim kitinase S. cerevisiae beda nyata (P < 0,05) lebih besar dari pada D. flagrans. Bila dibandingkan dengan Tabel 1 di atas hasil pengujian adalah sebaliknya.
Perbedaan aktivitas enzim intraseluler yang lebih tinggi dari enzim ekstraseluler, belum membuktikan bahwa enzim yang dihasilkan intraseluler lebih tinggi dari ekstra seluler, karena banyaknya enzim yang dihasilkan sangat dipengaruhi berbagai faktor-faktor seperti trigger (zat yang merangsang cendawan mengeluarkan enzim), waktu inkubasi, purifikasi, pH, enzim lainnya, suhu yang optimal, sehingga tentunya dengan prosedur di atas hasil belum maksimal (FERNANDEZ et al.,
1982; PARK et al., 1997; SHIGEMATSU et al. 1993).
Namun sebenarnya kedua cendawan tersebut mempunyai kemampuan menghasilkan enzim-enzim tersebut karena pada dasarnya isolat tersebut memiliki gen yang akan memproduksi enzim-enzim tersebut. Pada khamir S. cerevisiae dengan gen CYM1 dan Ssy 5 P mempunyai kemampuan menghasilkan enzim Protease dan gen CTS1-2 adalah gen
yang memiliki kemampuan menghasilkan gen Kitinase (BULIK et al., 2003; JONSON, 2004; CARTENS, 2003; POULSEN, 2006). Sedangkan kapang D. flagrans memiliki enzim protease dan kitinase (MEYER dan WIEBE, 2003). Tetapi
di dalam menghasilkan enzim-enzim tersebut isolat cendawan dipengaruhi berbagai faktor seperti yang dijelaskan di atas. Enzim Kitinase dan protease diperlukan di dalam proses membunuh larva H. contortus. Enzim-enzim ini digunakan utuk mendegradasi dan melisiskan dinding kulit larva cacing. Selanjutnya larva akan mati dijerat, dan cendawan akan masuk ke dalam tubuh larva yang selanjutnya akan berkembang biak serta mengambil nutrisi dari larva tersebut (GRONVOLD et al., 1993). Selain itu diduga pula
enzim-enzim ini berperanan mempengaruhi proses rusaknya saluran reproduksi testis dan ovarium cacing dewasa. Degenerasi testis dan ovum akan menyebabkan penurunan jumlah larva cacing.
KESIMPULAN
Aktivitas enzim protease cendawan nematofagus kapang D. flagrans berbeda secara nyata (P < 0,05) lebih besar dari pada khamir S. cerevisiae. Sedangkan besarnya aktivitas kitinase S.cerevisiae berbeda secara nyata (P < 0,05) lebih besar dari D. flagrans.
DAFTAR PUSTAKA
AHMAD,R.Z. 2003. Potensi Duddingtonia flagrans sebagai cendawan nematofagus. J. Mikol. Ked.
Indon. 5: 14 – 20.
ARGONNE. 2003. http://www.aps.anl.gov/News/ ANL_News/Argonne_News_2003.htm. (13 Juni 2007).
BERGMEYER and GRASS. 1983. Method of Enzymatic Analysis. Third Edition. VCH (Verlagsgesellschaft), Meinheim, Germany. Volume II (Samples, reagents, assesment of results). pp. 1 – 159.
BULIK, D.A., M. OLEZAK, H.A.LUCERO, B.C. OSMOND, P.W. ROBBINS and C.A. SPECHT. 2003. Chitin synthesis in Saccharomyces
cerevisiae in response to supplementation of
growth medium with glucosamine and cell wall stress. Eukaryotic Cell. 2(5): 886 – 900.
CARTENS,M.,M.A.VIVIER,P.VAN RENSBURG and I.S. PRETORIUS. 2003. Overexpression, secretion and antifungal activity of the
Saccharomyces cerevisiae chitinase Abstract.
Annals of Microbiology, 53: 15 – 28. http://www.annmicro.unimi.it/abst/53/cartens_ 53_15.pdf. (18 Mei 2006).
CROLL,A.C. and B.E.MATTHEW. 1977. Biology of nematodes. Blackie & Sun limited Bishopbriggs glasgow. Thompson Litho Ltd. East kilbride Scotland.
DUBE,H.C. 1996. An Introduction to Fungi. Vikas Publishing House PVT Ltd. Delhi. Second edition.
FERNANDEZ, M.P., U. JUELITA, CORREA and E. CABIB. 1982. Activation ofchitin synthetase in permeabilized cells of a Saccharomyces
cerevisiae mutantb lacking proteinase B. J. Bacteriol. pp. 1255 – 1264.
GOODAY, G.W. 1994. Physiology of microbial degradation of chitin andchitosan. In: Biochemistry of Microbial Degradation. RABLEDGE,C. (Ed.). Kluwer Academic pulb., Netherland. pp. 279 – 312.
GRONVOLD, J., J. WOLSTRUP, P. NANSEN, S.A. HENRIKSEN, M. LARSEN and J. BRESCIANI. 1993. Biological control of nematode parasites in cattle with nematode-trapping fungi: A survey of Danish studies. Veterinary Parasitol. 48: 311 – 325.
GRONVOLD, J., J. WOLSTRUP, P. NANSEN, S.A. HENRIKSEN, M. LARSEN and J. BRESCIANI. 1993. Biological control of nematode parasites in cattle with nematode-trapping fungi: a survey of Danish studies. Veterinary Parasitol. 48: 311 – 325.
GRONVOLD,J.,P. NANSEN P,S.A.HENRIKSEN, M. LARSEN, J. WOLSTRUP, J. BRESCIANI, H. RAWAT and L. FRIBERT. 1996. Induction of traps by Ostertagia ostertagi larvae, chlamydospore production and growth rate in the nematode-trapping fungus Duddingtonia
flagrans. J. Helminthol. 70: 291 – 297.
HUANG, X., N. ZHAO and K. ZHANG. 2004. Extracellular enzymes serving as virulence factors in nematophagous fungi involved in infection of the host. Res. Microbial. 155(10): 811 - 816.
IMOTO,I. dan K.YAGASHITA. 1971. A simple activity measurement of lisoenzyme. Agric. Biol.
ISTIANA, E. KUSUMANINGTYAS, D. GHOLIB and S. HASTIONO. 2002. Isolasi dan identifikasi
Saccharomyces cerevisae beserta in vitro
terhadap (Salmonella typhimurium). Pros. Seminar Nasional Teknologi Peternakan dan Veteriner. Ciawi, Bogor, 30 September –1 Oktober 2002. Puslitbang Peternakan, Bogor. hlm. 459 – 462.
JONSON,L.,J.F.REHFELD and A.H.JONSON. 2004. Enhanced peptide secretion by gene disruption of CYMI, a novel protease in Saccharomyces
cerevisiae. Europan J. Biochemistry. issue
23-24. 71: 4788 – 4797.
LAMPEN, O.J. 1968. External enzymes of yeast: Their nature and formation. Antonie van Leeuwenhoek. (34): 1 – 18.
LODDER,J. 1970. The Yeast A Taxonomic Study. Second revised and enlarged edition, the Netherland, Northolland Publishing Co., Amsterdam.
MEYER, W.J. and M.G. WIEBE. 2003. Enzyme production by nematode-trapping fungus,
Duddingtonia flagrans. Biotechnol. Lett May;
25: 791 – 795. (abstrak)
PARK, J.O., W. GAMS, M. SCHOLLER, E.L. GHISALBERTII and K. SIVASITHAMPARAM. 2002. Orbiliaceous nematode-trapping fungi and related species in Western Australia and their biological activities. Austrasian Mycologist. 21(2): 7 – 11.
PARK,K.C.,S.K.WOO,Y.J.YOO,A.M.WYNDHAM, R.T. BAKER and C.H. CHUNG. 1997. Purification and characterization of UBP6, a new Ubiquitin-specific protease in
Saccharomyces cerevisiae. Archives of
Biochemistry and Biophysics. 347(1): 78 – 84.
POULSEN, P., L. LEGGIO and M.C. KIELLAND -BRANDT. 2006. Mapping of an internal protease clevage site in the Say5p component of the amino acid sensor of Saccharomyces cerevisiae and functional characterization of the resulting pro and protease domains by gain-of-function genetics. Abstract. Eukaryot Cell. 5(3): 601 - 608. http:// www. ncbi.nlm. nih.gov/entrez/query.fcgi?CMD=Display&DB =pubmed. (18 Mei 2006).
SEWONSUH. 2007. Chitinase. http://plaza.snu.ac. kr/~sewonsuh/home/structures.html. (13 Juni 2007).
SHIGEMATSU, T., K. MATSUTANI, Y. FUKUDA, A. KIMURA and K.MURATA. 1993. Enzymes and germination of spores of the yeast
Saccharomyces cerevisiae. J. Fermentation and Bioenginering. 75(3): 187 – 190.
SOMASHEKAR,D. and R.JOSEPH. 1996. Chitosanases -properties and applications: A review. Biores.
Technol. 55: 35 – 45.
STELL,R.G.D. and J.H.TORRIE. 1995. Prinsip dan Prosedur Statistika. PT Gramedia Pustaka, Jakarta.
WIKIPEDIA. 2007. Enzyme. Free Encyclopedia. http://en.wikipedia.org/wiki/Enzyme. (9 Juni 2007).
WIKIPEDIA. 2007. Protease. Free Encyclopedia. http://en.wikipedia.org/wiki/Protease. (9 Juni 2007).
WIKIPEDIA. 2007. Protein. Free Encyclopedia. http://en.wikipedia.org/wiki/Protein. (9 Juni 2007).
DISKUSI Pertanyaan:
Mana yang lebih berpengaruh, faktor luar atau dalam?
Jawaban: