Ratna dkk
KIMIA
JILID 2
SMK
Hak Cipta pada Departemen Pendidikan Nasional Dilindungi Undang-undang
KIMIA
JILID 2
U nt uk SM K
Penulis : Ratna
Didik Prasetyoko
Lukman Atmaja
Irmina Kris Murwani
Hendro Juwono
Perancang Kulit : TIM
Ukuran Buku : 17,6 x 25 cm
Diterbitkan oleh
Direktorat Pembinaan Sekolah Menengah Kejuruan
Direktorat Jenderal Manajemen Pendidikan Dasar dan Menengah
Departemen Pendidikan Nasional
Tahun 2008
RAT RATNA
k Kimia Jilid 2 untuk SMK /oleh Ratna, Didik Prasetyoko, Lukman Atmaja, Irmina Kris Murwani, Hendro Juwono ---- Jakarta : Direktorat Pembinaan Sekolah Menengah Kejuruan, Direktorat Jenderal Manajemen Pendidikan Dasar dan Menengah, Departemen Pendidikan Nasional, 2008.
viii. 236 hlm
Daftar Pustaka : A1
ISBN : 978-602-8320-45-0
KATA SAMBUTAN
Puji syukur kami panjatkan kehadirat Allah SWT, berkat rahmat
dan karunia Nya, Pemerintah, dalam hal ini, Direktorat
Pembinaan Sekolah Menengah Kejuruan Direktorat Jenderal
Manajemen Pendidikan Dasar dan Menengah Departemen
Pendidikan Nasional, telah melaksanakan kegiatan penulisan
buku kejuruan sebagai bentuk dari kegiatan pembelian hak cipta
buku teks pelajaran kejuruan bagi siswa SMK. Karena buku-buku
pelajaran kejuruan sangat sulit di dapatkan di pasaran.
Buku teks pelajaran ini telah melalui proses penilaian oleh Badan
Standar Nasional Pendidikan sebagai buku teks pelajaran untuk
SMK dan telah dinyatakan memenuhi syarat kelayakan untuk
digunakan dalam proses pembelajaran melalui Peraturan Menteri
Pendidikan Nasional Nomor 45 Tahun 2008 tanggal 15 Agustus
2008.
Kami menyampaikan penghargaan yang setinggi-tingginya
kepada seluruh penulis yang telah berkenan mengalihkan hak
cipta karyanya kepada Departemen Pendidikan Nasional untuk
digunakan secara luas oleh para pendidik dan peserta didik SMK.
Buku teks pelajaran yang telah dialihkan hak ciptanya kepada
Departemen Pendidikan Nasional ini, dapat diunduh (
download
),
digandakan, dicetak, dialihmediakan, atau difotokopi oleh
masyarakat. Namun untuk penggandaan yang bersifat komersial
harga penjualannya harus memenuhi ketentuan yang ditetapkan
oleh Pemerintah. Dengan ditayangkan
soft copy
ini diharapkan
akan lebih memudahkan bagi masyarakat khsusnya para
pendidik dan peserta didik SMK di seluruh Indonesia maupun
sekolah Indonesia yang berada di luar negeri untuk mengakses
dan memanfaatkannya sebagai sumber belajar.
KATA PENGANTAR
Buku Kimia ini disusun unt uk memenuhi kebut uhan buku aj ar di Sekolah Menengah Kej uruan yang isinya didasarkan pada KTSP unt uk Sekolah Menengah Kej uruan dan t erdiri dari t eori, cont oh soal sert a lat ihan. Adapun urut an penyaj ian set iap mat eri didasarkan pada inst rumen penyusunan buku kimia yang dikeluarkan oleh BNSP. Unt uk memperkaya penget ahuan para siswa Sekolah Menengah Kej uruan, dalam buku ini j uga disaj ikan t opik yang seyogyanya dimiliki oleh para siswa t ersebut , sepert i polimer, cat , logam dan sebagainya.
Sebagai bahan acuan penyusunan buku ini, digunakan buku t eks Kimia yang digunakan oleh para siswa Sekolah Menengah At as di Inggris, Sekolah Menengah Kej uruan di Jerman sert a beberapa buku t eks Kimia Dasar yang lain.
Kami berharap, kehadiran buku ini dapat membant u siswa maupun guru dalam pembelaj aran Kimia di Sekolah Menegah Kej uruan. Tidak lupa, ucapan t erimakasih kami sampaikan pada Direkt ur Pembinaan Sekolah Menengah Kej uruan at as kepercayaan yang t elah diberikan.
DAFTAR ISI
KATA PENGANTAR... iv
DAFTAR ISI... v
JILID 1
1
MATERI DAN WUJUDNYA ... 1
1.1
Materi... 1
1.2
Perubahan Fisika dan Kimia ... 3
1.3
Wujud Materi... 5
1.4
Hukum Keadaan Standar ... 13
1.5
Hukum Gas Ideal ... 13
2
STRUKTUR ATOM ... 23
2.1
Partikel-Partikel Dasar Atom ... 24
2.2
Nomor atom, nomor massa, isotop, isobar dan isoton32
2.3
Elektron Dalam Atom... 34
2.4
Perkembangan Model Atom ... 43
2.5
Perkembangan pengelompokan unsure... 46
2.6
Sifat periodik unsure ... 52
3
STOIKHIOMETRI... 63
3.1
Konsep mol ... 63
3.2
Penerapan Hukum Proust... 68
4
IKATAN KIMIA... 75
4.1
Elektron dan Ikatan Aturan Oktet ... 76
4.2
Ikatan Ion ... 77
4.3
Ikatan Kovalen ... 79
4.4
Polaritas Ikatan Kovalen... 81
4.5
Sifat senyawa ion dan senyawa kovalen... 83
4.6
Ikatan Kovalen Koordinat ... 83
4.7
Penyimpangan Aturan Oktet... 84
4.8
Struktur Lewis ... 84
4.9
Ikatan Logam ... 85
5
LARUTAN... 89
5.1
Pendahuluan... 90
5.2
Larutan Elektrolit ... 91
5.3
Konsentrasi Larutan... 92
5.4
Stoikiometri Larutan ... 94
5.5
Sifat Koligatif Larutan ... 96
5.6
Hasil Kali Kelarutan... 102
5.7
Kelarutan ... 103
6.2
Pengelompokan Koloid... 109
6.3
Sifat-Sifat Koloid... 110
6.4
Koloid Liofil dan Koloid Liofob ... 112
6.5
Pemisahan Koloid ... 115
6.6
Pembuatan Kolid ... 117
7
KESETIMBANGAN... 121
7.1
Definisi ... 122
7.2
Karakteristik keadaan kesetimbangan ... 123
7.3
Macam-macam Sistem Kesetimbangan ... 124
7.4
Konstanta Kesetimbangan ... 124
7.5
Hukum Guldberg dab Wange... 125
7.6
Beberapa Hal yang Harus Diperhatikan ... 126
7.7
Azas Le Chatelier ... 128
7.8
Faktor-faktor yang Dapat Menggeser Letak
Kesetimbangan ... 130
7.9
Hubungan Antara Harga Kc Dengan Kp... 133
7.10
Dissosialisasi ... 136
8
TERMOKIMIA... 141
8.1
Definisi ... 141
8.2
Pengukuran Energi dalam Reaksi Kimia ... 143
8.3
Panas Reaksi dan Termokimia ... 144
8.4
Entalpi (H) dan Perubahan Entalpi (
¨
H)... 146
8.5
Istilah yang Digunakan pada Perubahan Entalpi... 147
8.6
Hukum Hess mengenai jumlah panas... 148
8.7
Panas Pembentukan... 153
8.8
Keadaan Standard ... 154
8.9
Kapasitas panas dan panas spesifik ... 157
8.10
Kalorimetri ... 157
8.11
Energi Ikatan Dan Entalphi Reaksi ... 158
9
ELEKTROKIMIA... 167
9.1
Reaksi Redoks ... 168
9.2
Harga Bilangan Oksidasi ... 170
9.3
Langkah-langkah penyetaraan reaksi redoks... 170
9.4
Penyetaraan persamaan reaksi redoks ... 171
9.5
Perbedaan Oksidasi Reduksi ... 172
9.6
Sel Elektrokimia... 173
10
KINETIK KIMIA ... 193
10.1
Definisi Laju Reaksi... 194
10.2
Hukum Laju ... 196
10.3
Faktor-Faktor Yang Mempengaruhi Kecepatan Reaksi
... 196
Reaksi yang mel i put i perubahan pada int i disebut r eaksi i nt i
at au reaksi nukl i r
(nukl eus=i nt i ).
11. Kimia Radiasi
Apakah sebenarnya Nuklir itu?
St andar Kompet ensi Kompet ensi Dasar
Menj el askan kimia radiasi Menj al askan pengaruh kimia radiasi pada makhl uk hidup Menj el askan kegunaan kimia radiasi
Tuj uan pembel aj aran
1. Menget ahui lat ar bel akang penemuan zat radioakt if dan cont oh unsur-unsur zat radi oakt if , sert a apl ikasinya.
2. Menget ahui dan memahami macam-macam sinar
radioakt if dan karakt erist iknya.
3. Menget ahui dan mempel aj ari macam-macam dan cont oh apl ikasi radioisot op, sert a sumber dan pengaruh radiasinya.
Kit a t el ah menget ahui bahwa at om t erdiri at as int i at om dan el ekt ron-el ekt ron yang beredar mengit arinya. Reaksi kimia biasa (sepert i reaksi pembakaran dan penggaraman) hanya menyangkut perubahan pada kul it at om, t erut ama el ekt ron pada kul it t erl uar, sedangkan int i at om t idak berubah. Reaksi yang mel iput i perubahan pada int i disebut r eaksi i nt i at au reaksi nukl i r (nukl eus=i nt i ).
Sinar X adal ah suat u radiasi el ekt romagnet ik yang t imbul karena bent uran
berkecepat an t inggi (yait u sinar kat oda dengan suat u mat eri (anoda)
yang mengandung int i t idak st abil ini disebut zat r adi oakt i f . Adapun
reaksi nukl ir t idak spont an dapat t erj adi pada int i yang st abil maupun int i yang t idak st abil . Reaksi nukl i r disert ai perubahan energi berupa radiasi dan kal or. Berbagai j enis reaksi nukl ir disert ai pembebasan kal or yang sangat dasyat , l ebih besar dan reaksi kimia biasa.
Dewasa ini, reaksi nukl ir t el ah banyak digunakan unt uk t uj uan damai (bukan t uj uan mil it er) baik sebagai sumber radiasi maupun sebagai sumber t enaga dan pemanf aat annya dal am bidang kesehat an.
11. 1 Penemuan Keradioaktifan
Gambar 11. 1 Radioakt if
Pada t ahun 1895, W. C. Ront gen menemukan bahwa t abung sinar kat oda menghasil kan suat u radiasi berdaya t embus t inggi yang dapat menghit amkan f ilm pot ret , wal upun f ilm t ersebut t erbungkus kert as hit am. Karena bel um mengenal hakekat nya, sinar ini dinamai sinar X. Ternyat a sinar X adal ah suat u radiasi el ekt romagnet ik yang t imbul karena bent uran berkecepat an t inggi (yait u sinar kat oda dengan suat u mat eri (anoda). Sekarang sinar X disebut j uga sinar ront gen dan digunakan unt uk rongent yait u unt uk menget ahui keadaan organ t ubuh bagian dal am.
Penemuan sinar X membuat Henr y Becguer el t ert arik unt uk
menel it i zat yang bersif at f l uoresensi, yait u zat yang dapat bercahaya set el ah t erlebih dahul u mendapat radiasi (disinari), Becquerel menduga bahwa sinar yang dipancarkan ol eh zat sepert i it u sepert i sinar X. Secara kebet ulan, Becquerel menel it i bat uan uranium. Ternyat a dugaan it u benar bahwa sinar yang dipancarkan uranium dapat menghit amkan f il m pot ret yang masih t erbungkus kert as hit am. Akan t et api, Becqueret menemukan bahwa bat uan uranium memancarkan sinar berdaya t embus t inggi dengan sendirinya t anpa harus disinari t erl ebih dahul u. Penemuan ini t erj adi pada awal bul an Maret 1986. Gej al a semacam it u, yait u pemancaran radiasi secara spont an, disebut keradioakt if an, dan zat yang bersif at radioakt if disebut zat radioakt if .
Sinar al f a merupakan radiasi part ikel yang bermuat an posit if
pol onium (berdasarkan nama Polonia, negara asal dari Marie Curie), dan radium (berasal dari kat a Lat in radiare yang berart i bersinar).
Ternyat a, banyak unsur yang secara alami bersif at radioakt if . Semua isot op yang bernomor at om diat as 83 bersif at radioakt if . Unsur yang bernomor at om 83 at au kurang mempunyai isot op yang st abil kecual i t eknesium dan promesium. Isot op
yang bersif at radioakt if disebut isot op radioakt if at au radio- isot op, sedangkan isot op yang t idak radiakt if disebut isot op st abil . Dewasa ini, radioisot op dapat j uga dibuat dari isot op st abil . Jadi disamping radioisot op alami j uga ada radioisot op buat an.
11. 2 Sinar-sinar Radioaktif
Gambar 11. 2 Sinar-sinar radioakt if
Pada t ahun 1903, Ernest Rut herf ord mengemukakan bahwa radiasi yang dipancarkan zat radioakt if dapat dibedakan at as dua j enis berdasarkan muat annya. Radiasi yang bermuat an posit if dinamai sinar al f a, dan yang bermuat an negat if diberi nama sinar bet a. Sel anj ut nya Paul U. Viil l ard menemukan j enis sinar yang ket iga yang t idak bermuat an dan diberi nama sinar gamma.
a. Sinar alfa ( Ş )
Sinar al f a merupakan radiasi part ikel yang bermuat an posit if . Part ikel sinar al f a sama dengan int i hel ium -4, bermuat an +2e dan bermassa 4 sma. Part ikel al f a adal ah part ikel t erberat yang dihasil kan ol eh zat radioakt if . Sinar al f a dipancarkan dari int i dengan kecepat an sekit ar 1/ 10 kecepat an cahaya. Karena memil iki massa yang besar, daya t embus sinar al f a pal ing l emah diant ara diant ara sinar-sinar radioakt if . Diudara hanya dapat menembus beberapa cm saj a dan t idak dapat menembus kul it . Sinar al f a dapat dihent ikan ol eh sel embar kert as biasa. Sinar al f a segera kehil angan energinya ket ika bert abrakan dengan mol ekul media yang dil al uinya. Tabrakan it u mengakibat kan media yang dil al uinya mengalami ionisasi. Akhirnya part ikel al f a akan menangkap 2 el ekt ron dan berubah menj adi at om
Sinar bet a merupakan radiasi part ikel bermuat an negat if
Sinar gamma adal ah radiasi el ekt romagnet ek berenergi t inggi, t idak bermuat an dan t idak bermassa
b. Sinar beta (ş)
Sinar bet a merupakan radiasi part ikel bermuat an negat if . Sinar bet a merupakan berkas el ekt ron yang berasal dari int i at om. Part ikel bet a yang bemuat an -1e dan bermassa 1/ 836 sma. Karena sangat kecil , part ikel bet a dianggap t idak bermassa sehingga dinyat akan dengan
not asi 0
-1e. Energi sinar bet a sangat bervariasi, mempunyai daya t embus l ebih besar dari sinar al f a t et api daya pengionnya l ebih l emah. Sinar bet a paling energet ik dapat menempuh sampai 300 cm dal am udara kering dan dapat menembus kul it .
c. Sinar gamma ( )
Sinar gamma adal ah radiasi el ekt romagnet ek berenergi t inggi, t idak bermuat an dan t idak bermassa. Sinar dinyat akan dengan
not asi 0
0 . Sinar gamma mempunyai daya t embus. Sel ain sinar al f a, bet a, gamma, zat radioakt if buat an j uga ada yang memancarkan sinar X dan sinar Posit ron. Sinar X adal ah radiasi sinar el ekt romagnet ik.
11. 3 Penggunaan Radioisotop
11. 3. 1 Radioisotop digunakan sebagai perunut dan sumber radiasi Dewasa ini, penggunaan radioisot op unt uk maksud-maksud damai (unt uk kesej aht eraan umat manusia) berkembang dengan pesat . Pusat l ist rik t enaga nukl ir (PLTN) adal ah sal ah sat u cont oh yang sangat populer. PLTN ini memanf aat kan ef ek panas yang dihasil kan reaksi int i suat u radioisot op , misal nya U-235. Sel ain unt uk PLTN, radioisot op j uga t el ah digunakan dalam berbagai bidang misal nya indust ri, t eknik, pert anian, kedokt eran, il mu penget ahuan, hidrol ogi, dan l ain-l ain.
Pada bab ini kit a akan membahas dua penggunaan radioisot op, yait u sebagai perunut (t racer) dan sumber radiasi. Pengunaan radioisot op sebagai perunut didasarkan pada ikat an bahwa isot op radioakt if mempunyai sif at kimia yang sama dengan isot op st abil . Jadi suat u isot op radioakt if melangsungkan reaksi kimia, yang sama sepert i isot op st abil nya. Sedangkan penggunaan radioisot op sebagai sumber radiasi didasarkan pada kenyat aan bahwa radiasi yang dihasil kan zat radioakt if dapat mempengaruhi mat eri maupun mahl uk. Radiasi dapat digunakan unt uk memberi ef ek f isis: ef ek kimia, maupun ef ek biol ogi. Ol eh karena it u, sebel um membahas pengunaan radioisot op kit a akan mengupas t erl ebih dahul u t ent ang sat uan radiasi dan pengaruh radiasi t erhadap mat eri dan mahl uk hidup.
11. 3. 2 Satuan radiasi
Berbagai macam sat uan digunakan unt uk menyat akan int ensit as at au j uml ah radiasi bergant ung pada j enis yang diukur.
1. Curie(Ci) dan Becquerrel (Bq)
1Bq = 1 dps dps = disint egrasi per sekon
Sat uan l ain yang j uga biasa digunakan ial ah Curie. Sat u Ci ial ah keakt if an yang set ara dari 1 gram garam radium, yait u 3, 7. 1010 dps.
1Ci = 3, 7. 1010 dps = 3, 7. 1010 Bq
2. Gray (gy) dan Rad (Rd)
Gray dan Rad adal ah sat uan yang digunakan unt uk menyat akan keakt if an yakni j uml ah (dosis) radiasi yang diserap ol eh suat u mat eri. Rad adalah singkat an dari 11 radiat ion absorbed dose. Dal am sist em sat uan SI, dosis dinyat akan dengan Gray (Gy). Sat u Gray adal ah absorbsi 1 j oul e per kil ogram mat eri. 1 Gy = 1 J/ kg
Sat u rad adal ah absorbsi 10-3 j oul e energi/ gram j aringan. 1 Rd = 10-3 J/ g
Hubungan gray dengan f ad
1 Gy = 100 rd 3. Rem
Daya perusak dari sinar-sinar radioakt if t idak saj a bergant ung pada dosis t et api j uga pada j enis radiasi it u sendiri. Neut ron, sebagai cont oh, l ebih berbahaya daripada sinar bet a dengan dosis dan int ensit as yang sama. Rem adal ah sat uan dosis set el ah memperhit ungkan pengaruh radiasi pada mahl uk hidup (rem adal ah singkat an dari radiat ion equival en f or man).
11. 3. 3 Pengaruh radiasi pada materi
Radiasi menyebabkan penumpukan energi pada mat eri yang dil al ui. Dampak yang dit imbul kan radiasi dapat berupa ionisasi, eksit asi, at au pemut usan ikat an kimia. Ionisasi: dal am hal ini part ikel radiasi menabrak el ekt ron orbit al dari at om at au mol ekul zat yang dil al ui sehingga t erbent uk ion posit if dan el ekt ron t erion.
Eksit asi: dalam hal ini radiasi t idak menyebabkan el ekt ron t erl epas dari at om at au mol ekul zat t et api hanya berpindah ke t ingkat energi yang l ebih t inggi. Pemut usan Ikat an Kimia: radiasi yang dihasil kan ol eh zat radioakt if rnempunyai energi yang dapat mernut uskan ikat an-ikat an kimia.
11. 3. 4 Pengaruh radiasi pada mahluk hidup
Gambar 11. 4 Pengaruh Radiasi pada makhl uk hidup
Wal aupun energi yang dit umpuk sinar radioakt if pada mahl uk hidup rel at if kecil t et api dapat menimbul kan pengaruh yang serius. Hal ini karena sinar radioakt if dapat mengakibat kan ionisasi, pemut usan ikat an kimia pent ing at au membent uk radikal bebas yang reakt if . Ikat an kimia pent ing misal nya ikat an pada st rukt ur DNA dal am kromosom. Perubahan yang t erj adi pada st rukt ur DNA akan dit eruskan pada sel berikut nya yang dapat mengakibat kan kel ainan genet ik, kanker, dl l .
Pengaruh radiasi pada manusia at au mahl uk hidup j uga bergant ung pada wakt u paparan. Suat u dosis yang dit erima pada sekal i paparan akan l ebih berbahaya daripada bil a dosis yang sama dit erima pada wakt u yang l ebih l ama.
Secara al ami kit a mendapat radiasi dari l ingkungan, misal nya radiasi sinar kosmis at au radiasi dari radioakif al am. Disamping it u, dari berbagai kegiat an sepert i diagnosa at au t erapi dengan sinar X at au radioisot op. Orang yang t inggal disekit ar inst al asi nukl ir j uga mendapat radiasi l ebih banyak, t et api masih dalam bat as aman.
11. 3. 5 Radioaktif sebagai perunut
sist em biol ogi. Ol eh karena radioisot op mempunyai sif at kimia yang sama sepert i isot op st abilnya, maka radioisot op dapat digunakan unt uk menandai suat u senyawa sehingga perpindahan perubahan senyawa it u dapat dipant au.
11. 3. 6 Bidang Kedokteran
Gambar 11. 5 Pengaruh radiokat if t erhadap l ingkungan
Berbagai j enis radio isot op digunakan sebagai perunut unt uk mendet eksi (diagnosa) berbagai j enis penyakit ant ara l ain: t eknesium (Tc-99), t al ium-201 (Ti-201), iodin 131(1-131), nat rium-24 (Na-24), senon-133 (xe-133) dan besi (Fe-59). Tc-99 yang disunt ikkan ke dal am pembul uh darah akan diserap t erut ama ol eh j aringan yang rusak pada organ t ert ent u, sepert i j ant ung, hat i dan paru-paru Sebal iknya Ti-201 t erut ama akan diserap ol eh j aringan yang sehat pada organ j ant ung. Ol eh karena it u, kedua isot op it u digunakan secara bersama-sama unt uk mendet eksi kerusakan j ant ung
gangguan peredaran darah misal nya apakah ada penyumbat an dengan mendet eksi sinar gamma yang dipancarkan isot op Nat rium t sb.
Xe-133 digunakan unt uk mendet eksi penyakit paru-paru. P-32 unt uk penyakit mat a, t umor dan hat i. Fe-59 unt uk mempel aj ari pembent ukan sel darah merah. Kadang-kadang, radioisot op yang digunakan unt uk diagnosa, j uga digunakan unt uk t erapi yait u dengan dosis yang l ebih kuat misal nya, 1-131 j uga digunakan unt uk t erapi kanker kel enj ar t iroid.
B. Bidang lndustri
Unt uk mempel aj ari pengaruh ol i dan adit if pada mesin sel ama mesin bekerj a digunakan suat u isot op sebagai perunut , Dal am hal ini, pist on, ring dan komponen l ain dari mesin dit andai dengan isot op radioakt if dari bahan yang sama.
C. Bidang hidrologi.
1. Mempel aj ari kecepat an al iran sungai.
2. Menyel idiki kebocoran pipa air bawah t anah.
D. Bidang biologis
1. Mempel aj ari keset imbangan dinamis.
2. Mempel aj ari reaksi pengest eran.
3. Mempel aj ari mekanisme reaksi f ot osint esis.
11. 3. 7 Radioisotop sebagai sumber radiasi.
A. Bidang Kedokteran
Gambar 11. 6 Al at – al at kedokt eran
1) St eril isasi radiasi.
-al at kedokt eran. St erilisasi dengan cara radiasi mempunyai beberapa keunggul an j ika dibandingkan dengan st eril isasi konvensional (menggunakan bahan kimia), yait u:
a) St eril isasi radiasi l ebih sempurna dalam memat ikan mikroorganisme.
b) St eril isasi radiasi t idak meninggal kan residu bahan kimia. c) Karena dikemas dul u baru dist er il kan maka al at t ersebut t idak mungkin t ercemar bakt eri l agi sampai kemasan t erbuka. Berbeda dengan cara konvensional , yait u di st eril - kan dul u baru dikemas, maka dalam proses pengemasan masih ada kemungkinan t erkena bibit penyakit .
2) Terapi t umor at au kanker.
Berbagai j enis t umor at au kanker dapat dit erapi dengan radiasi. Sebenarnya, baik sel normal maupun sel kanker dapat dirusak ol eh radiasi t et api sel kanker at au t umor t ernyat a l ebih sensit if (l ebih mudah rusak). Ol eh karena it u, sel kanker at au t umor dapat dimat ikan dengan mengarahkan radiasi secara t epat pada sel -sel kanker t ersebut .
B. Bidang pertanian
Gambar 11. 7 Pemberant asan hama
1) Pemberant asan hama dengan t eknik j ant an mandul
2) Pemul iaan t anaman
Pemul iaan t anaman at au pembent ukan bibit unggul dapat dil akukan dengan menggunakan radiasi. Misal nya pemul iaan padi, bibit padi diberi radiasi dengan dosis yang bervariasi, dari dosis t erkecil yang t idak membawa pengaruh hingga dosis rendah yang memat ikan. Bij i yang sudah diradiasi it u kemudian disemaikan dan dit anam berkel ompok menurut ukuran dosis radiasinya.
3) Penyimpanan makanan
Kit a menget ahui bahwa bahan makanan sepert i kent ang dan bawang j ika disimpan l ama akan bert unas. Radiasi dapat menghambat pert umbuhan bahan-bahan sepert i it u. Jadi sebel um bahan t ersebut di simpan diberi radiasi dengan dosis t ert ent u sehingga t idak akan bert unas, dengan dernikian dapat disimpan l ebih l ama.
C. Bidang Industri
Gambar11. 8 Proses Pengel asan
Gambar 11. 9 Cacat pada Logam
1) Pemeriksaan t anpa merusak.
bahan t ersebut . Tekhnik ini berdasarkan sif at bahwa semakin t ebal bahan yang dil al ui radiasi, maka int ensit as radiasi yang dit eruskan makin berkurang, j adi dari gambar yang dibuat dapat t erl ihat apakah l ogam merat a at au ada bagian-bagian yang berongga didal amnya. Pada bagian yang berongga it u f il m akan l ebih hit am,
2) Mengont rol ket ebal an bahan
Gambar 11. 10 Logam
Ket ebal an produk yang berupa l embaran, sepert i kert as f il m at au lempeng l ogam dapat dikont rol dengan radiasi. Prinsipnya sama sepert i diat as, bahwa int ensit as radiasi yang dit eruskan bergant ung pada ket ebal an bahan yang dil alui. Det ekt or radiasi dihubungkan dengan alat penekan. Jika l embaran menj adi l ebih t ebal , maka int ensit as radiasi yang dit erima det ekt or akan berkurang dan mekanisme alat akan mengat ur penekanan l ebih kuat sehingga ket ebal an dapat dipert ahankan.
3) Pengawet an bahan
Gambar 11. 11 Makanan dan Minuman yang diawet kan
dapat meningkat kan mut u t ekst il karena mengubah st rukt ur serat sehingga l ebih kuat at au l ebih baik mut u penyerapan warnanya. Berbagai j enis makanan j uga dapat diawet kan dengan dosis yang aman sehingga dapat disimpan l ebih l ama.
KESIMPULAN
Kimia radiasi sangat berbahaya bagi makhl uk hidup karena dapat menyebabkan berbagai penyakit yang dapat menyebabkan kemat ian. namun j ika penggunaannya benar maka kimia radiasi dapat dimanf aat kan unt uk berbagai kepent ingan diant aranya dal am bidang pert anian, indust ri, kedokt eran, dl l .
sinar radioakt if t erdiri dari sinar alf a ( ), sinar bet a ( ) dan sinar gamma ( ).
Latihan Soal
1. Perubahan energi dal am reaksi nukl ir berupa apa? 2. Apa yang dimaksud f l uoresensi?
3. Apa yang dimaksud sinar X? Apa nama lain dan kegunaan sinar X? 4. Mengapa daya t embus sinar pal ing l emah?
5. Sebut kan dan j el askan 3 macam sinar radioakt if !
6. Apa dasar penggunaan radioisot op sebagai sumber radiasi dan perunut !
7. Apa yang dimaksud 1 rad dan bagaimana hubungan Gray dengan Fad?
8. Apa perbedaan ionisasi dan eksit asi?
At om karbon dapat membent uk empat ikat an koval en
12 SENYAWA KARBON
12. 1 Dasar-dasar kimia organik
Standar Kompetensi Kompetensi Dasar
Mengkomunikasikan senyawa hidrokarbon dan kegunaanya
Mendiskripsikan kekhasan at om karbon yang membent uk senyawa hidrokarbon
Menggol ongkan senyawa hidrokarbon dan t urunannya
Mendiskripsikan kegunaan senyawa hidrokarbon dal am kehidupan manusia
Tuj uan pembel aj aran
1. Mengident if ikasi unsur C, H dan O dalam senyawa karbon mel alui percobaan
2. Mendiskripsikan kekhasan at om karbon dal am senyawa karbon
3. Membedakan at om C primer, sekunder, t ert ier dan kuart ener
a. Kekhasan Atom karbon
At om karbon (C) dengan nomor at om 6 mempunyai susunan el ekt ron K = 2, L = 4. C mempunyai 4 el ekt ron val ensi dan dapat mernbent uk empat ikat an koval en sert a dapat digambarkan dengan rumus Lewis. Sebagai cont oh, dapat dil ihat mol ekul CH4 (met ana) yang memiliki diagram yang cukup sederhana dibawah ini.
Gambar 12. 1
Sel ain it u kemampuan diat as, at om karbon j uga dapat membent uk ikat an dengan at om karbon l ain unt uk membent uk rant ai karbon yang t erbuka, t erbuka bercabang dan t ert ut up. Cont oh rant ai karbon dapat digambarkan dengan rumus st rukt ur berikut :
Gambar 12. 2 Rant ai t erbuka
Gambar 12. 3 Rant ai t erbuka dan bercabang
Gambar 12. 4 Rant ai t ert ut up
Dapat l ah sekarang dimengert i bahwa j uml ah senyawa karbon demikian banyaknya walaupun j uml ah j enis unsur pembent uknya sedikit .
Kini kit a dapat mul ai membuat kl asif ikasi hidrokarbon, yang merupakan senyawa yang hanya t ersusun oleh karbon dan hidrogen.
Senyawa-senyawa karbon l ainnya dapat dipandang sebagai t urunan dari hidrokarbon ini. Hidrokarbon dapat dibagi menj adi dua kelompok ut ama : hi dr okar bon al i f at i k dan hi dr okar bon ar omat i k. Termasuk di
kel ompok pert ama adalah senyawa yang berant ai l urus, berant ai cabang dan rant ai mel ingkar. Kel ompok kedua, hi dr okar bon ar omat i k,
hidrokarbon j enuh yang mengandung ikat an t unggal karbon-karbon,
sert a hidrokarbon t ak j enuh yang mengandung paling sedikit sat u
ikat an rangkap dua, at au ikat an rangkap t iga.
Karena senyawa hidro karbon t erdiri at as karbon dan hidrogen, maka sal ah sat u bagian dari ilmu kimia yang membahas segala sesuat u t ent ang senyawa hidrokarbon disebut ki mi a kar bon. Dulu ilmu kimia
karbon disebut kimia organik, karena senyawa-senyawanya dianggap hanya dapat diperol eh dari t ubuh makhl uk hidup dan t idak dapat disint esis dal am pabrik.
Pada t ahun 1928, Friedrich Wohl er berhasil mensint esis urea (suat u senyawa yang t erdapat dal am air seni) dari senyawa anorganik yait u amonium sianat – dengan j al an memanaskannya.
O
| |
NH4
+
CNO-
o
H2N - C - NH2Reaksi pemanasan amonium sianat ol eh Wohl er
Gambar 12. 5 Friedrich Wohl er
Set el ah keberhasil an Wohl er diket ahui, banyakl ah sarj ana l ain yang mencoba membuat senyawa karbon dari senyawa anorganik. Lambat laun t eori t ent ang art i hidup hilang dan orang hanya
menggunakan kimia organik sebagai nama saj a t anpa disesuaikan dengan art i yang sesungguhnya. Sej ak saat it u banyak senyawa karbon berhasil disint esis dan hingga sekarang l ebih dari 2 j ut a senyawa karbon dikenal orang dan t erus bert ambah set iap harinya. Apa sebabnya j uml ah senyawa karbon sedemikian banyak bil a dibandingkan dengan j uml ah senyawa anorganik yang hanya sekit ar serat us ribuan?
Sel ain perbedaan j uml ah yang sangat mencol ok yang menyebabkan kimia karbon dibicarakan secara t ersendiri, karena memang t erdapat perbedaan yang sangat besar ant ara senyawa karbon dan senyawa anorganik sepert i yang dit ul iskan pada t abel berikut .
Hidrokarbon adal ah sej enis senyawa yang banyak t erdapat dial am sebagai minyak bumi. Indonesia banyak menghasil kan senyawa ini dalam bent uk minyak bumi yang mempunyai nil ai ekonomi t inggi.
Senyawa hidrokarbon t erdiri dari : 1. Al kana (CnH2n+2)
rumus umum senyawa al kana CnH2n+2
Tabel 12. 1 Perbandingan senyawa karbon dengan senyawa anorganik
Senyawa karbon Senyawa anorganik
xmembent uk ikat an koval en
xdapat membent uk rant ai karbon
xnon el ekt rol it
xreaksi berl angsung l ambat
xt it ik didih dan t it ik l ebur rendah
xl arut dal am pel arut organik
xmembent uk ikat an ion
xt idak dapat membent uk rant ai karbon
xel ekt rol it
xreaksi berl angsung cepat
xt it ik didih dan t it ik l ebur t inggi
xl arut dal am pel arut pengion
1. Alkana
Gambar 12. 6
Cont oh senyawa al kana (et ana)
Hidrokarbon j enuh yang pal ing sederhana merupakan suat u deret senyawa yang memenuhi rumus umum CnH2n+2 yang dinamakan al kana at au paraf in. Suku pert ama sampai dengan 14 senyawa al kana dapat kit a perol eh dengan mensubst it usikan harga n kedalam rumus t ersebut , dengan n adal ah j uml ah at om C yang ada. Hasil l engkapnya t ert ul is dalam Tabel 14. 2 berikut .
Tabel 12. 2 Suku pertama sampai dengan 14 senyawa alkana
Suku ke Rumus Mol ekul Nama Tit ik Didih (°C/ 1 at m)
Massa 1 mol dal am g
1 CH4 met ana -161 16
2 C2H6 et ana -89 30
3 C3H8 propana -44 44
4 C4H14 but ana -0. 5 58
5 C5H12 pent ana 36 72
6 C6H14 heksana 68 86
7 C7H16 hept ana 98 140
8 C8H18 okt ana 125 114
9 C9H20 nonana 151 128
Sel isih ant ara suku sat u dan suku berikut nya sel al u sama, yait u CH2 at au 14 sat uan massa at om, sehingga der et homol og (deret sepancaran). Ternyat a banyak senyawa-senyawa karbon yang merupakan deret sepert i al kana sepert i yang akan kit a pel aj ari nant i. Unt uk dapat memberi nama pada suku-suku al kana, dapat dil akukan dengan memperhat ikan nama set iap suku it u dan nama umumnya (= al kana).
Umpamanya, met ana dan al kana apanya yang sama? Keduanya memil iki akhiran -ana, j adi al k- digant i dengan met - unt uk suku
pert ama. Unt uk suku kedua digant i dengan et -, suku ket iga dengan pr op-, suku keempat dengan but -, mulai suku kelima dan set erusnya
diberi awalan angka-angka Lat in; pent - unt uk 5, heks- unt uk 6, hept -
unt uk 7, okt - unt uk 8, non- unt uk 9, dan dek- unt uk 14. Hasil
penamaan sudah dapat dil ihat pada t abel di at as. Kit a harus bet ul -bet ul menguasai nama-nama dari kesepul uh al kana yang sederhana ini karena akan merupakan dasar bagi penamaan senyawa-senyawa karbon l ainnya.
Al kana-al kana pent ing sebagai bahan bakar dan sebagai bahan ment ah unt uk mensint esis senyawa-senyawa karbon l ainnya. Sepert i disebut dimuka, al kana banyak t erdapat dalam minyak bumi, dan dapat dipisahkan menj adi bagian-bagiannya dengan dist il asi bert ingkat . Suku pert ama sampai dengan keempat senyawa alkana (met ana sampai but ana) berwuj ud gas pada t emperat ur kamar. Met ana biasa disebut j uga gas alam yang banyak digunakan sebagai bahan bakar rumah t angga/ indust ri. Gas propana, dapat dicairkan pada t ekanan t inggi dan digunakan pul a sebagai bahan bakar yang disebut LPG (l iquif ied pet rol eum gas). LPG dij ual dal am t angki-t angki baj a dan diedarkan ke rumah-rumah. Gas but ana l ebih mudah mencair daripada propana dan digunakan sebagai "geret an" rokok. Okt ana mempunyai t it ik didih yang t empat nya berada dal am l ingkungan bahan bakar mot or. Al kana-al kana yang bersuhu t inggi t erdapat dalam kerosin (minyak t anah), bahan bakar diesel , bahan pel umas, dan paraf in yang banyak digunakan unt uk membuat l il in.
Bagaimana sif at -sif at senyawa karbon yang t ermasuk dal am sat u deret homol og ? Perhat ikan Tabel 12. 2 di at as di mana t erdapat sal ah sat u sif at , yait u t i t ik didih. Tit ik didih semakin t inggi j ika massa mol ekul relat if nya makin besar. Hal ini berart i bahwa pada suhu kamar, wuj udnya akan berubah dari gas ke cair kemudian padat . Kecenderungan sif at apa l agi yang dapat kit a ramalkan ?
Dal am kimia karbon adal ah pant ing bagi kit a unt uk dapat menul iskan r umus mol ekul dan r umus st r ukt ur . Rumus molekul
menyat akan banyaknya at om set iap unsur yang ada dal am suat u mol ekul . Sedangkan rumus st rukt ur (Lihat Tabel 12. 3) menggambarkan bagaimana at om-at om it u t erikat sat u sama l ain. Karena at om karbon merupakan t ul ang punggung dari semua senyawa karbon, maka kit a harus mampu menggambarkan rangka karbon dal am suat u mol ekul senyawa karbon. Set iap at om karbon dikel il ingi secara
t et r ahedr al ol eh at om-at om yang t erikat dal am gambaran t iga
H | H-C-H
| H
Gambar 12. 7 Rumus st rukt ur met ana
Tabel 12. 3 Rumus struktur beberapa senyawa alkana
Nama Formula
(rumus) Formula struktural
met ana CH4
H |
H - C - H |
H
et ana C2H6
H H
| |
H - C - C - H
| |
H H
propana C3H8
H H H
| | |
H - C - C - C - H
| | |
H H H
but ana C4H14
H H H H
| | | |
H - C - C - C - C - H
| | | |
H H H H
Penggambaran rant ai st rukt ur senyawa ini sebenarnya mudah. Bil a rant ai karbonnya panj ang at au bercabang, maka set el ah kit a buat rangka at om karbonnya t inggal membubuhkan at om-at om hidrogen pada ikat an at om karbon yang masih kosong.
Cont oh : mol ekul but ana. Pert ama sekal i, dibuat rangkanya yang t erdiri dari 4 at om karbon yang dil et akkan berdampingan. Sel anj ut nya, at om-at om hidrogennya dil et akkan pada masing-masing at om karbonnya.
Bent uk but ana dal am ruang sesunggunhya adal ah sepert i yang dit ampil kan ol eh Gambar 12. 8
Kal au kit a membuat mol ekul but ana dengan mol ymod, t erl ihat bahwa rant ai karbonnya t idak benar-benar l urus sepert i rumus st rukt urnya, karena at om karbon t et rahedral mencegah gambaran rant ai karbon l urus. Kebanyakan yang kit a t ul iskan adal ah rumus st rukt ur yang l ebih sederhana l agi yait u:
CH3 - CH2 - CH2 - CH3 at au CH3CH2CH2CH3
Jadi asal t erbaca rant ai karbonnya, it ul ah yang akan kit a gunakan sel anj ut nya asal sel al u ingat bahwa sesungguhnya adal ah gambaran ruang.
Ciri-ciri alkana
xMerupakan hidrokarbon j enuh (al kana rant ai l urus dan sikl o/ cincin al kana)
xDisebut gol ongan paraf in : af f init as kecil (=sedikit gaya gabung)
xSukar bereaksi
xC1 – C4 : pada Tdan P normal adal ah gas
xC4 – C17 : pada T dan P normal adal ah cair
x> C18 : pada T dan P normal adal ah padat
xTit ik didih makin t inggi : t erhadap penambahan unsur C
xJuml ah at om C sama : yang bercabang mempunyai TD rendah
xKel arut an : mudah l arut dal am pel arut non pol ar
xBJ naik dengan penambahan j uml ah unsur C
xSumber ut ama gas al am dan pet rol ium
Pembuat an alkana
xHidrogenasi senyawa Al kena
xReduksi Al kil Hal ida
xReduksi met al dan asam
Penggunaan alkana
xMet ana : zat bakar, sint esis, dan carbon bl ack (t int a, cat , semir, ban)
xPropana, But ana, Isobut ana : zat bakar LPG (Liquif ied Pet rol ium Gases)
xPent ana, Heksana, Hept ana : sebagai pel arut pada sint esis.
Tata nama alkana
Sekarang bagaimana cara memberi nama i somer but ana it u?
Unt uk it u maril ah kit a gunakan at uran t at a nama yang dit erbit kan IUPAC (Int er nat i onal Uni on of Pur e and Appl i ed Chemi st r y).
dan l et akkan di bagian bel akang. Kadang-kadang rumus st rukt ur it u t idak digambarkan dengan rant ai karbon t erpanj ang dal am garis l urus.
2. Isomer bercabang diberi nama sebagai t urunan rant ai l urus di mana sat u at au beberapa at om hidrogen digant i dengan pecahan al kana. Pecahan al kana ini disebut gugus al kil , biasa diberi t anda -R (dari kat a radikal ), dan mempunyai rumus umum -CnH2n+1 .
Nil ai n adal ah j uml ah at om karbon yang ada pada senyawa t ert ent u t ersebut sedemikian hingga didapat suku-sukunya sepert i t erl ihat pada t abel berikut :
Tabel 12. 4 Gugus al kil
-CnH2n+1 Rumus struktur sederhana Nama
-CH3 -CH3 Met il
-C2H5 -CH2-CH3 Et il
-C3H7 -CH2-CH2-CH3 Propil
-C4H9 -CH2-CH2-CH2-CH3 But il
Tent u kit a dapat meneruskan unt uk al kil -al kil l ain, t et api unt uk gugus bercabang t ent u j arang yang berant ai panj ang. Let akkan nama gugus cabang ini di depan nama rant ai induk. Unt uk menent ukan cabang pada rant ai induk, rant ai induk it u diberi diberi nomor dari kiri at au dari kanan sehingga cabang pert ama mempunyai nomor t erkecil .
Dibawah ini adal ah cont oh cara menamakan senyawa berikut :
H H H H H | | | | | H - C5 - C4 - C3 - C2 - C1 - H
| | | |
H H H H-C-H
|
H
a. Menurut at uran nomor sat u, rant ai C t erpanj ang 5, j adi namanya pent ana dan kit a l et akkan di bagian bel akang.
b. Cabangnya adal ah met il
Kadang-kadang t erdapat l ebih dari sat u cabang. Jika cabang-cabang it u sama, namanya t idak perl u disebut dua kal i. Cukup diberi awal an di- , kal au 3 cabang sama awal annya t ri-, t et ra unt uk 4 cabang yang sama dan set erusnya. Ingat set iap cabang diberi sat u nomor, t idak pedul i cabangnya sama at au beda.
Dibawah ini adal ah cont oh penamaan yang l ain.
H H H H | | | |
H- 1C - 2C - 3C - 4C - H 2, 3-dimet il but ana | | | |
H H-C-H H-C-H H | | H H
a. Rant ai t erpanj angnya 4, j adi dinamakan but ana b. Cabangnya adal ah met il dan ada dua buah
c. Let ak cabangnya pada at om C nomor 2 dan nomor 3.
Jika cabang-cabang it u berbeda, maka urut an menyebut nya adal ah menurut urut an abj ad huruf pert amanya, cabang et il disebut dul u dari cabang met il .
Isomer alkana
Bagaimana kit a dapat memperol eh mol ekul al kana yang l ebih panj ang dari mol ekul yang l ebih pendek ? Gant il ah sal ah sat u at om H dari met ana dengan gugus -CH3 maka akan kit a perol eh mol ekul et ana. Demikian j uga j ika kit a menggant i sal ah sat u at om H dari et ana dengan gugus -CH3 akan kit a perol eh propana yang rant ai karbonnya l ebih panj ang sat u l agi. Lihat berikut ini.
CH3-H digant i dengan -CH3 akan diperol eh CH3-CH3 CH3-CH2-H digant i dengan -CH3 diperol eh CH3-CH2-CH3. Dan set erusnya.
Kit a bol eh memilih sal ah sat u at om H yang mana saj a unt uk digant i dengan gugus -CH3 dan kit a akan memperol eh hasil penggant ian yang sama. Kit a mengat akan bahwa set iap at om H t erikat secara ekuival en dengan at om karbon. Tet api bila sekarang kit a akan menggant i sal ah sat u at om H dari propana dengan gugus -CH3 anda akan memperol eh l ebih dari sat u macam hasil ,
Perhat ikanl ah:
Rumus umum Senyawa al kena CnH2n
H CH3
| |
CH3-CH-CH3 digant i dengan -CH3 diperoleh CH3-CH-CH3 i sobut ana
Jel as t erl ihat bahwa kedua hasil penggant ian di at as berbeda, kit a mengat akan at om H t idak l agi t erikat secara ekuival en. At om C yang t erikat dengan sat u at om C dan 3 at om H disebut at om C primer, sedang at om C yang t erikat dengan dua at om C den dua at om H disebut at om C sekunder. Kedua hasil penggant ian it u mempunyai rumus st rukt ur yang berbeda t et api rumus mol ekul nya sama, perist iwa ini disebut isomer. Jadi dapat kah kit a mendef inisikan apa it u isomer ? Kedua hasil penggant ian it u adal ah senyawa yang berbeda t erbukt i mempunyai sif at -sif at berbeda. Tit ik beku dan t it ik didih dari yang berant ai l urus adal ah -138, 3°C dan -0, 5°C seda ng yang rant ainya bercabang adal ah -159°C dan -12°C. Sekarang semakin j el as t ent unya mengapa j uml ah senyawa karbon it u demikian banyaknya.
2. Alkena
Gambar 12. 9
Cont oh senyawa al kena
Al kena t ergol ong hidrokarbon t idak j enuh yang mengandung sat u ikat an rangkap dua ant ara dua at om C yang berurut an. Jadi rumus umumnya mempunyai 2 at om H l ebih sedikit dari al kana karena it u rumus umumnya menj adi CnH2n+2-2H = CnH2n. Kekurangan j uml ah at om H pada al kena dibandingkan dengan j uml ah at om H pada alkana dapat dij el askan sebagai berikut . Perhat ikan unt uk n = 2, pada al kana adal ah C2H6 sedang pada al kena adal ah C2H4, bagaimana dapat digambarkan rumus st rukt urnya?
Perhat ikan cont oh berikut !
H H H H | | | | H - C - C - H berubah menj adi H - C = C - H
| |
Kedua at om H di bawah harus dibebaskan supaya el ekt ron-el ekt ron at om C yang t adinya dipakai unt uk membent uk ikat an koval en dengan at om H dapat dial ihkan unt uk membent uk ikat an koval en dengan sesama at om karbon. Al kena mengandung sat u ikat an rangkap dua ant ara dua at om C, maka suku pert ama al kena harus mengandung dua at om C. Jadi n = 2, dan beberapa suku l ain dapat Anda l ihat pada t abel berikut ini.
Tabel 12. 5. Lima suku pertama alkena
Suku ke rumus st rukt ur nama
1 2 3 4 5 3 4 5 6
CH2 = CH2
CH2 = CH - CH3
CH2 = CH - CH2 - CH3
CH2 = CH - CH2 - CH2 - CH3 CH2 = CH - CH2 - CH2 -CH2 - CH3
et ena propena 1-but ena 1-pent ena 1-heksena
Nama al kena berbeda dengan al kana hanya pada bagian bel akang, j adi bagian yang menunj uk pada j uml ah t idak berubah. Bagaimana memberi nama al kena yang bercabang? Secara garis, besar t idak berbeda dengan cara memberi nama al kana yang bercabang, t et api pada penent uan rant ai induk yang t erpanj ang harus rant ai yang mengandung ikat an rangkap. Jadi ikat an rangkapnya diut amakan dengan nomor t erkecil . Sebagai cont oh l ihat l ah rumus st rukt ur berikut ini.
H H H H
| | | |
1
C = C2 - C3 - C4 - H 3-met il -1-but ena (bukan 2-met il -3-but ena)
| | |
H CH3 H
Pada al kana t idak ada bagian dari rumus st rukt urnya yang mempunyai ciri khas, sebal iknya pada al kena ada bagian dari rumus st rukt urnya yang mengandung sat u ikat an rangkap dua. Bagian ini
(-C=C-) disebut gugus f ungsi onal .
Suku al kena yang banya dikenal adal ah et ena (et il ena) dan propena (propil ena) yang merupakan bahan dasar unt uk membuat pl ast ik pol iet ena (pol it ena) dan pol ipropil en.
Ciri-ciri alkena
x Hidrokarbon t ak j enuh ikat an rangkap dua
x Al kena = ol ef in (pembent uk minyak)
x Sif at f isiologis l ebih akt if (sbg obat t idur) : 2-met il -2-but ena
x Sif at sama dengan Al kana, t api l ebih reakt if
x Sif at -sif at : gas t ak berwarna, dapat dibakar, bau yang khas, eksplosif dalam udara (pada konsent rasi 3 – 34%)
Rumus umum senyawa al kuna : CnH2n-2
x Pembuat an : pengawahidrat an et anol
Penggunaan etena
x Dapat digunakan sebagai obat bius (dicampur dengan O2)
x Unt uk memasakkan buah-buahan
x Sint esis zat lain (gas al am, minyak bumi, et anol )
Pembuatan alkena :
x Dehidrohal ogenasi al kil hal ida
x Dehidrasi al kohol
x Dehal ogenasi dihal ida
x Reduksi al kuna
3. Alkuna
Al kuna merupakan deret senyawa hidrokarbon t idak j enuh yang dal am t iap mol ekul nya mengandung sat u ikat an rangkap 3 diant ara dua at om C yang berurut an. Unt uk membent uk ikat an rangkap 3 at au 3 ikat an koval en diperl ukan 6 el ekt ron, sehingga t inggal sat u el ekt ron pada t iap-t iap at om C t ersisa unt uk mengikat at om H. Jumlah at om H, yang dapat diikat berkurang dua, maka rumus umumnya menj adi
CnH2n+2 - 4H = CnH2n-2
Sepert i hal nya al kena, alkuna j uga mempunyai suku pert ama dengan harga n = 2, sehingga rumus mol ekul nya C2H2, sedang rumus st rukt urnya H - C = C - H. Senyawa al kuna t ersebut mempunyai nama et una at au dengan nama l azim aset il ena. Aset il ena merupakan suat u gas yang dihasil kan dari reaksi senyawa karbida dengan air dan banyak digunakan oleh t ukang l as unt uk menyambung besi. Reaksinya adal ah sebagai berikut :
CaC2 (s) + 2 H20 (l ) Æ C2H2 (g) + Ca(OH)2 (aq)
Tat a nama al kuna sama dengan al kana at au al kena, bagian pert ama menunj uk pada j uml ah sedang bagian kedua adal ah akhiran -una, t et api suku pert amanya j uga mempunyai n = 2 sepert i alkena.
Et una merupakan suku alkuna sat u-sat unya yang dapat dibuat . Suku-suku al kuna l ain sering diberi nama at au dianggap sebagai t urunan et una. Jadi propuna disebut met il aset il ena.
Tabel 12. 6 Isomer Butena
1-but ena
CH2=CH-CH2-CH3
2-but ena
CH3-CH=CH-CH3
2-met il -1-propena
CH2=C-CH3 |
CH3
Tabel 12 . 7 Isomer pada butuna
1-but una
3 2
3
C
CH
CH
CH
{
2-but una
CH
3C
{
C
CH
3Jadi perist iwa isomeri t erj adi pul a pada al kena dan al kuna, bahkan penyebabnya dua. Kal au pada al kana hanya pada rant ainya berbeda (disebut isomeri rant ai), pada al kena dan al kuna dapat pul a disebabkan ikat an rangkapnya berpindah t empat (disebut isomeri posisi) karena it u l et ak ikat an rangkap pada suku-suku al kena dan al kuna yang lebih t inggi sel al u diberi nomor sepert i t erl ihat di at as.
Ciri-ciri alkuna
x Hidrokarbon t ak j enuh mempunyai ikat an rangkap t iga
x Sif at -sif at nya menyerupai al kena, t et api l ebih reakt if
x Pembuat an : CaC2 + H2O Æ C2H2 + Ca(OH)2
x Sif at -sif at :
► Suat u senyawaan endot erm, maka mudah mel edak
► Suat u gas, t ak berwarna, baunya khas
x Penggunaan et una :
► Pada pengelasan : dibakar dengan O2 memberi suhu yang t inggi (± 3000oC), dipakai unt uk mengel as besi dan baj a
► Unt uk penerangan
► Unt uk sint esis senyawa l ain
Pembuat an alkuna
x Dehidrohal ogenasi al kil hal ida
x Reaksi met al aset ilida dengan al kil halida primer
Beberapa hidrokarbon lain
umum al kena j uga menunj ukkan hidrokarbon sikl is yang j enuh yang dikenal sebagai si kl ana (siklo-alkana) dan siklo-propana sebagai suku
pert amanya mempunyai harga n = 3. Al kandiena dan siklo-alkena mempunyai rumus umum yang sama dengan al kuna. Rumus molekul C5H8 dapat merupakan pent una, isoprena (monomer dari karet al am at au sikl opent ana).
H3C - CH2 - CH2 - C - CH pent una
H2C = C - CH = CH2
| isoprena
CH3
Adalagi hidrokarbon berlingkar yang mengandung cincin segi enam, dikenal sebagai hi dr okar bon ar omat i k karena umumnya
hidrokarbon ini harum baunya wal aupun banyak j uga yang beracun. St rukt ur ut ama senyawa aromat ik yang menj adi dasar sif at -sif at kimianya adal ah cincin benzena. Cincin benzena biasa digambarkan sebagai segi-enam berat uran dengan t iap sudut dit empat i ol eh at om C yang mengikat sat u at om H dan ikat an rangkap yang bersel ang-sel ing ant ara dua at om C yang berurut an (l ihat gambar di bawah ini). Gambaran ini sempat menguasai senyawa aromat ik unt uk beberapa pul uh t ahun sebel um akhirnya diubah karena sif at -sif at ut ama ikat an rangkap t idak t ampak pada gambaran st rukt ur benzena sebel umnya. Hidrokarbon aromat ik banyak pul a t erdapat dalam minyak bumi.
a. Alkohol
Al kohol mempunyai rumus umum R-OH. St rukt urnya serupa dengan air, t et api sat u hidrogennya digant i dengan sat u gugus al kil . Gugus f ungsi al kohol adalah gugus hidroksil , -O. Al kohol t ersusun dari unsur C, H, dan O. St rukt ur al kohol : R-OH primer, sekunder dan t ersier
Sifat fisika alkohol :
x TD al kohol > TD al kena dengan j umlah unsur C yang sama (et anol = 78oC, et ena = -88, 6oC)
x Umumnya membent uk ikat an hidrogen
x Berat j enis alkohol > BJ al kena
x Al kohol rant ai pendek (met anol , et anol ) l arut dal am air(=polar)
Struktur Alkohol : R - OH
R-CH2-OH (R)2CH-OH (R)3C-OH Primer sekunder t ersier
Pembuatan alkohol :
x Hidroborasi – oksidasi
x Sint esis Grignard
x Hidrolisis al kil hal ida
Penggunaan alkohol :
x Met anol : pel arut , ant if reeze radiat or mobil , sint esis f ormal dehid, met il amina, met il kl orida, met il sal isilat , dl l
x Et anol : minuman beral kohol , l arut an 70 % sebagai ant isept ik, sebagai pengawet , dan sint esis et er, kol orof orm, dl l .
Tatanama alkohol
Nama umum unt uk al kohol dit urunkan dari gugus al kol yang mel ekat pada –OH dan kemudian dit ambahkan kat a al kohol . Dal am sisit em IUAPAC, akhiran-ol menunj ukkan adanya
gugus hidroksil . Cont cont oh berikut menggambarkan cont oh-cont oh penggunaan kaidah IUPAC (Nama umum dinyat akan dal am t anda kurung).
CH3OH CH3CH2OH
CH3CH2CH2OH CH3CHCH3
|
OH
b. Eter
Bagi kebanyakan orang kat a et er dikait kan dengan anest esi. Et er yang dimaksud adal ah hanyal ah sal ah sat u anggot a kel ompok et er, yait u senyawa yang mempunyai dua gugus organik mel ekat pada at om oksigen t unggal . Rumus umum et er ial ah ROR’ , yang R dan R’ -nya bisa sama at au berbeda, gugus-nya dapat berupa al kil at au aril . Pada anest esi umum kedua R-nya adal ah gugus et il . CH3CH2-O- CH2 CH3.
Et er merupakan isomer at au t urunan dari al kohol (unsur H pada OH digant i ol eh al kil at au aril ). Et er mengandung unsur C, H, dan O.
Sifat fisika eter :
x Senyawa et er rant ai C pendek berupa cair pada suhu kamar dan TD nya naik dengan penambahan unsur C.
Methanol (metal alkohol)
Ethanol (etil alkohol)
Propanol (n-propil alkohol)
x Et er rant ai C pendek medah l arut dal am air, et er dengan rant ai panj ang sulit l arut dalam air dan larut dal am pel arut organik.
x Mudah t erbakar
x Unsur C yang sama TD et er > TD alkana dan < TD al kohol (met il , n-pent il et er 140oC, n-hept ana 98oC, heksil al kohol 157oC).
Pembuatan eter :
x Sint esis Wil l iamson
x Al koksi mercurasi – demercurasi
Penggunaan eter :
x Diet il et er : sbg obat bius umum, pel arut dari minyak, dsb.
x Et er-et er t ak j enuh : pada opersi singkat : il mu kedokt eran gigi dan ilmu kebidanan.
Tatanama eter
Et er diberi nama berdsarkan gugus alkil at au aril nya menurut urut an abj ad, diikut i dengan kat a et er misalnya :
CH3-O-CH2CH3 CH3CH2-O- CH2CH3
Unt uk et er dengan st ukt ur kompl eks, kadang-kaang diperl ukan nama gugus –OR sebagai gugus al koksi. Misal nya, dal am sist em IUPAC et er diberi nama sebagai hidrokarbon dengan subst it usi al koksi.
CH3CHCH2CH2CH3 |
OCH3
c. Aldehida dan keton
Sekarang kit a sampai pada st ukt ur dan reaksi yang menyangkut gugus f ungsi pent ing dalm kimia organik , yait u gugus
Etil metal eter
dietil eter
O CH3 O
Siklopentil metil eter
Difenil eter
O H
O C H3
karbonil , C = O. Gugus ini dimil iki oleh gol ongan senyawa al dehida, ket on, asam karboksil at , est er dan t urunan l ainnya. Senyawa ini pent ing dal am banyak proses biol ogi dan merupakan mat a niaga pent ing pul a.
Al dehida mempunyai pal ing sedikit sat u at om hidrogen mel ekat pada gugus karbonil . Gugus l ainnya dapat berupa gugus hydrogen, al kil at au aril .
O O O O Œ Œ Œ Œ
- C – H at au – CHO H - C – H R - C – H Ar - C – H
Al dehid adalah suat u senyawa yang mengandung gugus karbonil (C=O) yang t erikat pada sebuah at au dua buah unsur hidrogen. Al dehid berasal dari “ alkohol dehidrogenat um“ . (cara sint esisnya). St rukt ur Al dehid : R – CHO
Ciri-ciri aldehid :
x Sif at -sif at kimia al dehid dan ket on umumnya serupa, hanya berbeda dal am deraj at nya. Unsur C kecil larut dal am air (berkurang + C).
x Merupakan senyawa pol ar, TD al dehid > senyawa non pol ar
x Sif at f isika f ormal dehid : suat u gas yang baunya sangat merangsang
x Akrol ein = propanal = CH2=CH-CHO : cairan, baunya t aj am, sangat reakt if .
Contoh : Formaldehid = metanal = H-CHO
x Sif at -sif at : sat u-sat unya al dehid yang berbent uk gas pada suhu kamar, t ak berwarna, baunya t aj am, l arut anya dalam H2O dari 40 % disebut f ormal in.
x Penggunaan : sebagai desinf ekt ans, mengeraskan prot ein (mengawet kan cont oh-cont oh biologik), membuat damar buat an.
Pembuat an aldehid :
x Oksidasi dari al kohol primer
x Oksidasi dari met il benzen
x Reduksi dari asam kl orida
Ket on adalah suat u senyawa organik yang mempunyai sebuah gugus karbonil (C=O) t erikat pada dua gugus al kil , dua gugus aril at au sebuah al kil dan sebuah aril . Sif at -sif at sama dengan aldehid. St rukt ur: (R)2-C=O
Contoh : propanon = dimetil keton = aseton = (CH3)2-C=O
x Sif at : cairan t ak berwarna, mudah menguap, pel arut yang baik.
x Penggunaan : sebagai pelarut .
Contoh lain : asetofenon = metil fenil keton
x Sif at : berhabl ur, t ak berwarna
x Penggunaan : sebagai hipnot ik, sebagai f enasil klorida (kl oroaset of enon) dipakai sebagai gas air mat a.
Pembuatan keton
x Oksidasi dari al kohol sekunder
x Asil asi Friedel -Craf t
x Reaksi asam kl orida dengan organol ogam
Tatanama aldehida dan keton
Dal am sist em IUPAC, al dehida diberi akhiran –al (berasal dari
suku pert ama al dehida). Cont oh-cont ohnya adal ah sebagai berikut :
Karena al dehida t el ah l ama di kenal , nama-nama umum masih sering digunakan. Nama-nama t ersebut dicant umkan dibawah nama IUPAC-nya. Karena nama ini sering digunakan, anda perl u j uga mempel aj arinya j uga.
Unt uk al dehida yang mempunyai subt it uen, penomoran rant ai dimulai dari karbon al dehida sebagai mana cont oh berikut :
Unt uk al dehida siklik, digunakan awalan-kar bal dehi da. Aldehida
aromat ik sering mempunyai nama umum. O H C H O H C CH3 O H C
CH3CH2CH2
Metanal (formaldehid) Etanal (asetaldehid) butanal (n-butiraldehid)
C H3
O
H C C H3C H2C H2
O
H C C H2 C H2
O H O H
O
C
O C RDal am sist em IUPAC, ket on diberi akhiran-on (dari suku kat a
t erakhir ket on). Penomoran dil akukan sehingga gugus karbonil mendapat nomor kecil . Biasanya ket on diberi nama dengan menambahkan kat a ket on set el ah nama-nama gugus al kil at au aril yang melekat pada gugus karbonil . Sama hal nya dengan al dehida nama umum sering digunakan. Cont ohnya adal ah sebagai berikut :
d. Asam karboksilat dan turunannya
Asam organik yang paing pent ing adal ah asam-asam karboksilat . Gugus f ungsinya adalah gugus karboksil , kependekan dari dua bagian yait u gugus karbonil dan hidroksil . Rumus asam karboksilat dapat dipanj angdan at au dipendekkan sepert i :
at au RCO2H at au RCOOH
H O C CHO OH Siklopentana karbaldehida (formilsiklopentana) salisilaldehida (2-hidroksibenzenakarbaldehida))
C H3
O
C
C H3 C H3C H2
O
C C H3
benzof enon (dif enil ket on)
2-but anon (et il met al ket on) O
C
C H3
O
O O
C C H3
2-met il sikl opent anon
Ciri-ciri asam karboksilat
x Mengandung gugus COOH yang t erikat pada gugus al kil (R-COOH) maupun gugus aril (Ar-COOH)
x Kel arut an sama dengan alkohol
x Asam dengan j uml ah C 1 – 4 : l arut dal am air
x Asam dengan j uml ah C = 5 : sukar l arut dal am air
x Asam dengan j uml ah C > 6 : t idak l arut dal am air
x Larut dal am pel arut organik sepert i et er, al kohol , dan benzen
x TD asam karboksil at > TD al kohol dengan j uml ah C sama.
Contoh : asam format = HCOOH
x Sif at f isika : cairan, t ak berwarna, merusak kul it , berbau t aj am, l arut dal am H2O dengan sempurna.
x Penggunaan : unt uk koagul asi l at eks, penyamakkan kul it , indust ri t ekst il , dan f ungisida.
Contoh lain :asam asetat = CH3-COOH
x Sif at : cair, TL 17oC, TD 118oC, l arut dal am H2O dengan sempurna
x Penggunaan : sint esis anhidrat asam aset at , est er, garam, zat warna, zat wangi, bahan f armasi, pl ast ik, serat buat an, sel ul osa dan sebagai penambah makanan.
Pembuatan asam karboksilat
x Oksidasi al kohol primer
x Oksidasi al kil benzen
x Carbonasi Reagen Grignard
x Hidrolisin nit ril
Tatanama Asam karboksilat
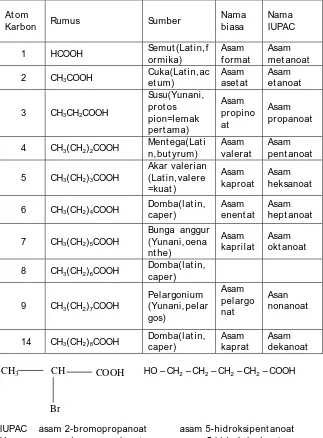
Karena banyak t erdapat dial am, asam-asam karboksil at adal ah gol ongan senyawa yang pal ing dul u dipel aj ari ol eh kimiawan organik. Karena t idak mengherankan j ika banyak senyawa-senyawa asam mempunyai nama-nama biasa. Nama-nama ini biasanya dit urunkan dari bahasa Lat in yang menunj ukkan asal nya. Tabel 12. 8 memuat nama-nama asam berant ai l urus besert a nama IUPAC-nya. Banyak dari asam ini mul a-mula dipisahkan dari l emak sehingga sering dinamakan sebagai asam-asam l emak (st rukt ur lemak secara t erinci dibahas dal am bab berikut nya). Unt uk memperol eh nama IUPAC suat u asam karboksilat (Tabel 12. 8 kolom t erakhir) diperl ukan awal an kat a asam da akhiran at .
CH3 CH
Br
COOH
Asam-asam bersubst it usi diberi nama menurut dua cara. Dal am sisit em IUPAC, nomor rant ai dimul ai dari asam karbon pembawa gugus karboksil dan subst it uen diberi nomor l okasi. Jika nama umum yang digunakan l okasi subst it uen dil ambangkan dengan huruf l at in, dimul ai dengan at om karbon .
Tabel 12. 8 Asam-asam Karboksilat alifatik
At om
Karbon Rumus Sumber
Nama biasa
Nama IUPAC
1 HCOOH Semut (Lat in, f
ormika)
Asam f ormat
Asam met anoat
2 CH3COOH
Cuka(Lat in, ac et um)
Asam aset at
Asam et anoat
3 CH3CH2COOH
Susu(Yunani, prot os pion=l emak pert ama) Asam propino at Asam propanoat
4 CH3(CH2)2COOH
Ment ega(Lat i n, but yrum)
Asam val erat
Asam pent anoat
5 CH3(CH2)3COOH
Akar val erian (Lat in, val ere =kuat )
Asam kaproat
Asam heksanoat
6 CH3(CH2)4COOH
Domba(l at in, caper)
Asam enent at
Asam hept anoat
7 CH3(CH2)5COOH
Bunga anggur (Yunani, oena nt he) Asam kaprilat Asam okt anoat
8 CH3(CH2)6COOH
Domba(l at in, caper)
9 CH3(CH2)7COOH
Pel argonium (Yunani, pel ar gos) Asam pel argo nat Asan nonanoat
14 CH3(CH2)8COOH
Domba(l at in, caper)
Asam kaprat
Asam dekanoat
HO – CH2 – CH2 – CH2 – CH2 – COOH
IUPAC asam 2-bromopropanoat asam 5-hidroksipent anoat Umum asam -bromopropionat asam -hidroksival erat
( = del t a)
Asam-asam aromat ic j uga diberi t ambahan –at pada t urunan hidrokarbon aromat iknya. Beberapa cont oh diant aranya :
Ester
Est er dit urunkan dari asam dengan menggant i gugus OH dengan gugus OR. Sif at f isika : berbent uk cair at au padat , t ak berwarna, sedikit l arut dal m H2O, kebanyakan mempunyai bau yang khas dan banyak t erdapat di al am. St rukt ut est er : R – COOR. Est er diberi nama sepert i penamaan pada garam.
COOH
CH3
COOH
COOH
Cl COOH
Asam benzoat e (asam benzanal karboksi l at )
Asam o-t ol uat
(asam 2-met il benzena karboksil at )
Asam p-kl orobenzoat (asam 4-kl oro benzena karboksil at )
Asam 1-naf t oat (asam 1-naf t al ena karboksil at )
O
O
CH3C OCH3
O
C OCH3
O
CH3C OCH2CH3
O
CH3C
Etil
OCH3
O
CH2CH2CH3C
R C OH O
+ HO R' R C OR' H2O O
+
Perhat ikan bahwa bagian R dari gugus OR disebut kan dahul u, diikut i dengan nama asam yang berakhiran –at .
Pembuatan ester :
x Reaksi al kohol dan asam karboksilat
x Reaksi asam kl orida at au anhidrida.
Penggunaan ester :
x Sebagai pel arut , but il aset at (pel arut dal am indust ri cat ).
x Sebagai zat wangi dan sari wangi.
Pembuatan ester, estrerifikasi Fischer
Jika asam karboksil at dan al kohol dan kat al is asam (biasanya HCl at au H2SO4) dipanaskan t erdapat keset imbangan dengan est er dan air.
Proses ini dinamakan est erif ikasi f ischer, yait u berdasarkan nama Emil Fischer kimiawan organik abad 19 yang mengembangkan met ode ini. Wal aupun reaksi ini adal ah reaksi keset imbangan, dapat j uga digunakan unt uk membuat est er dengan hasil yang t inggi dengan menggeser keset imbangan kekanan. Hal ini dapat dicapai dengan beberapa t eknik. Jika al kohol at au asam harganya l ebih murah, dapat digunakan j uml ah berl ebihan. Cara lain ial ah dengan memisahkan est er dan/ at au air yang t erbent uk (dengan penyul ingan) sehingga menggeser reaksi kekanan.
Reaksi-reaksi senyawa karbon
Reaksi senyawa karbon dapat dapat t erj adi dengan berbagai cara, sepert i reaksi subst it usi, reaksi adisi dan reaksi el iminasi.
1. Reaksi substitusi
digant ikan ol eh at om at au gugus at om l ain dari senyawa yang l ain. Secara umum mekanismenya :
R – X + R’ – Y Æ R – Y + R’ - X
At om karbon uj ung suat u al kil hal ida mempunyai muat an posit if parsial . Karbon ini bisa rent an t erhadap (suscept ibl e; mudah diserang ol eh) serangan ol eh anion dan spesi l ain apa saj a yang mempunyai sepasang elekt ron menyendiri (unshared) dal am kul it l uarnya. Dihasil kan reaksi subt it usi –suat u reasi dal am mana sat u at om, ion at au gugus disubst it usikan unt uk (menggant ikan) at om, at au gugus l ain.
HO- + CH3CH2 – Br Î CH3CH2 – OH + Br
-CH3O
+ CH3CH2CH2 – Cl Î CH3CH2CH2 – OCH3 + Cl
-Dal am suat u reaksi subst it usi al kil hal ida, hal ida it u disebut gugus pergi (l eaving group) suat u ist ilah yang berart i gugus apa saj a yang dapat digeser dari ikat annya dengan suat u at om karbon. Ion Hal ida merupakan gugus peri yang baik, karena ion-ion ini merupakan basa yang sangat l emah. Basa kuat sepert i misal nya OH-, bukan gugus pergi yang baik.
Spesi (spesies) yang menyerang suat u alkil hal ida dalam suat u reaksi subst it usi disebut nukl eof il (nucl eophil e, “ pecint a nukl eus” ), sering dil ambangkan dengan Nu-. Dal am persamaan reaksi diat as, OH -dan CH3O-, adal ah nukl eof il . Umumnya, sebuah nukl eof il aial ah spesi apasaj a yang t ert arik ke suat u pusat posit if ; j adi sebuah nukl eof il adal ah suat u basa Lewis. Kebanyakan nukl eof il adal ah anion, namun beberapa mol ekul pol ar yang net ral , sepert i H2O, CH3OH dan CH3NH2 dapat j uga bert indak sebagai nukl eof il . Mol ekul net ral ini memil iki pasangan el ekt ron menyendiri, yang dapat digunakan unt uk membent uk ikat an sigma.
Lawan nukl eof il ial ah elekt rof il (“ pecint a el ekt ron” ) sering dil ambangkan dengan E+. Suat u el ekt rof il ial ah spesi apa saj a yang t ert arik ke suat u pusat negat if , j adi suat u el ekt rof il ial ah suat u asam Lewis sepert i H+ at au ZnCl2.
Beberapa reaksi substitusi
a. Reaksi al kil a hal ida dengan basa kuat b. Reaksi al kohol dengan PCl3
c. Reaksi al kohol dengan l ogam Nat rium d. Reaksi klorinasi
e. Reaksi est erif ikasi (pembent ukan est er) f . Reaksi saponif ikasi (penyabunan)
2. Reaksi Adisi
rangkap berubah menj adi ikat an t unggal . Ikat an rangkap merupakan ikat an t ak j enuh, sedangkan ikat an t unggal merupakan ikat an j enuh. Jadi, reaksi adisi t erj adi dari ikat an t ak j enuh menj adi ikat an j enuh.
Mekanismenya reaksi adisi : C = C Æ C- C
CŁ C Æ C = C Æ C – C Beberapa reaksi adisi
a. Reaksi hidrogenasi al kana
R – CH = CH – R’ + H – H Æ R – CH2 – CH2 – R’ Cont oh :
C2H5 – CH = CH – CH3 + H – H Æ C2H5 – CH - CH – CH3
2-pent ena n-pent ana
Reaksi hidrogenasi ini digunakan unt uk membuat margarin (ment ega t iruan) dari minyak yang mengandung asam l emak t ak j enuh (C = C). Minyak cair dihidrogenasi dengan bant uan kat al is Ni menghasil kan l emak padat .
a. Reaksi adisi dengan hal ogen
R – CH = CH – R’ + X2Æ R – CH – CH – R’
| |
X X
Reaksi adisi dengan brom digunakan unt uk membedakan senyaw al kena (C = C) dengan sikloal kana. Hal ini karena kedua senyawa mempunyai isomer f ungsional (rumus mol ekul sama, t et api gugus f ungsi berbeda). Pengamat an reaksinya dengan membedakan warna dari brom yait u merah cokl at . Al kena dapat bereaksi dengan brom sehingga warna merah cokl at dari brom hil ang menj adi t idak berwarna. Akan t et api, sikl oal kana t idak bereaksi dan warna merah cokl at dari brom t et ap.
Al kena + brom Æ bereaksi, warna merah cokl at dari brom hil ang
Sikl oal kana + brom t idak bereaksi, warna merah cokl at dari brom t et ap.
a. Adisi dengan asam halida (HX)
R – CH = CH – R’ + H – X Æ R – CH – CH – R’
| |
H X
Dal am adisi ini at om X t erikat pada C rangkap dikiri at au dikanan akan menghasil kan senyawa yang berbeda, kecual i kal au R dengan R’ sama. Unt uk it u, ada at uran yang
(padat) n tristeari 3H
(cair)
Triolein Ni
CH3CH
Br H
CH2 + OH- CH3CH CH2 + H2O + Br
-Cl Cl
-CH3 C
CH3
CH3
+ OH- CH3 C
CH2
CH3
+ + H2O
menet apkan hasil ut ama dari t reaksi adisi t ersebut yang dikemukankan ol eh Vl ademir Markovnikov. At uran Markovnikov :
a. ikat an rangkap merupakan kumpul an el ekt ron
b. gugus al kil merupakan gugus pendorong el ekt ron. Al kil makin besar, daya dorong makin kuat . Urut an kekuat an al kil : - CH3 < - C2H5 < - C3H7
c. gugus elekt rongat if merupakan gugus penarik el ekt ron. Makin el ekt ronegat if , daya t arik el ekt ron makin kuat .
3. Reaksi eliminasi
Reaksi eliminasi kebal ikan dari reaksi adisi. Pada reaksi ini mol ekul senyawa yang berikat an t unggal (ikat an j enuh) berubah menj adi senyawa berikat an rangkap (ikat an t ak j enuh) dengan mel epaskan mol ekul yang kecil .
Mekanismenya :
C – C Æ C = C + X – Y | |
X Y
Bil a suat u alkil hal ida diol ah dengan suat u basa kuat , dapat t erj adi suat u reaksi el iminasi. Dal am reaksi ini sebuah mol ekul kehil angan at om-at om at au ion-ion dari st rukt ur-st rukt urnya. Produk organik suat u reaksi el iminasi suat u alkil hal ida adal ah suat u alkena. Dal am suat u t ipe reaksi eliminasi ini, unsur H dan X kel uar dari dal am al kil halida ; ol eh karena it u reaksi ini disebut reaksi dehidrohal ogenasi. (awal an de- berart i “ minus” at au “ hil angnya” ).
Beberapa reaksi eliminasi
c. Reaksi dehidrohal ogenasi
RANGKUMAN
At om karbon dengan nomor at om 6 mempunyai susunan
el ekt ron K = 2, L = 4, j adi mempunyai 4 el ekt ron val ensi dan dapat
mernbent uk empat ikat an koval en, sert a dapat digambarkan dengan
rumus Lewis sebagai berikut , umpamanya unt uk CH4.
Dal am bidang kimia, hidrokarbon adalah sebuah senyawa yang
t erdiri dari unsur karbon (C) dan hidrogen