Recover y Logam Titanium Dioxide (TiO
2)
dar i Limbah Pr oses Pengambilan Pasir Besi
Disusun Oleh :
Mei Liana Sukar ti
0931010003
PROGRAM STUDI TEKNIK KIMIA
FAKULTAS TEKNOLOGI INDUSTRI
YAYASAN KEJ UANGAN PANGLIMA BESAR SUDIRMAN
UNIVERSITAS PEMBANGUNAN NASIONAL “VETERAN” J AWA TIMUR
FAKULTAS TEKNOLOGI INDUSTRI
PROGAM STUDI TEKNIK KIMIA
KETERANGAN REVISI
Yang bertanda tangan dibawah ini :
Nama : Mei Liana Sukarti
NPM : 0931010003
Progam Studi : Teknik Kimia
Telah mengerjakan revisi Proposal / Skripsi / Kerja Praktek, dengan judul :
“ RECOVERY LOGAM TITANIUM DIOXIDE (TiO2) DARI LIMBAH PROSES
PENGAMBILAN PASIR BESI “
Surabaya, Maret 2013
Dosen penguji yang memerintahkan revisi :
1. Ir. Sukamto NEP, MS ( )
2. Erwan Adi Saputro, ST, MT ( )
Mengetahui:
Dosen Pembimbing
Ir. Siswanto
PENELITIAN
Diajukan Sebagai Salah Satu Syar at
Untuk Memper oleh Gelar Sar jana Teknik
J ur usan Teknik Kimia
Oleh :
Mei Liana Sukar ti
0931010003
J URUSAN TEKNIK KIMIA
FAKULTAS TEKNOLOGI INDUSTRI
UNIVERSITAS PEMBANGUNAN NASIONAL ”VETERAN” J AWA TIMUR
LEMBAR PENGESAHAN
RECOVERY LOGAM TITANIUM DIOXIDE (TiO2) DARI LIMBAH
PROSES PENGAMBILAN PASIR BESI
Oleh :
Mei Liana Sukarti
0931010003
Telah Dipertahankan Dihadapan Dan Diterima Oleh Tim Penguji
Pada Tanggal 30 J anuar i 2013
Mengetahui,
Dekan Fakultas Teknologi Industri
Univer sitas Pembangunan Nasional “Veteran” J awa Timur
Ir. Sutiyono, MT
NIP.19600713 198703 1 001 Penguji :
1.
Ir. Sukamto NEP, MS
NIP. 19541019 198503 1 001
Pembimbing :
Ir. Siswanto
NIP. 19541212 198303 1 001
2.
Erwan Adi Saputro, ST, MT
PROGRAM STUDI TEKNIK KIMIA
LEMBAR REVISI SEMINAR HASIL
Nama : 1. Mei Liana Sukarti (0931010003)
2. Ika Debby Aries Sandi (0931010012)
Program Studi : ...
Judul : ...
...
No. KETERANGAN REVISI
Surabaya, ...
i
Recovery logam Titanium Dioxide (TiO2) Dari
Limbah Proses Pengambilan Biji Besi
Kata Pengantar
Dengan rahmat dan petunjuk Allah SWT, sehingga penulis dapat
menyelesaikan laporan skripsi yang merupakan hasil penelitian dengan judul “
Recovery Logam Titanium Dari Limbah Proses Pengambilan Biji Besi “.
Adapun penyusunan penelitian ini merupakan salah satu syarat yang harus
ditempuh dalam kurikulum program studi S-1 Teknik Kimia dan untuk
memperoleh gelar Sarjana Teknik Kimia di Fakultas Teknologi Industri UPN
“Veteran” Jawa Timur, Surabaya. Laporan hasil ini ditujukan sebagai laporan
hasil telah terlaksananya penelitian. Dengan harapan penelitian ini dapat
bermanfaat untuk diterapkan oleh masyarakat. Dalam industri pertambangan
dibutuhkan inovasi baru tentang pengolahan bahan dan pengolahan limbah
industri pertambangan. Dikarenakan sampai saat ini keadaan industri
pertambangan semakin miris dalam hal keramahan lingkungan.
Laporan penelitian yang kami dapatkan tersusun atas kerjasama dan berkat
bantuan dari berbagai pihak. Oleh karena itu pada kesempatan ini kami
mengucapkan terima kasih kepada:
1. Bapak Ir. Sutiyono, MT selaku Dekan Fakultas Teknologi Industri UPN
“Veteran” Jawa Timur.
2. Ibu Ir. Retno Dewati, MT selaku Ketua Program Studi Teknik Kimia UPN
“Veteran” Jawa Timur.
3. Ibu Ir. Suprihatin, MT selaku Sekertaris Program Studi Teknik Kimia
UPN “Veteran” Jawa Timur.
4. Bapak Ir.Siswanto selaku Dosen Pembimbing Penelitian.
5. Bapak Ir. Sukamto NEP, MS selaku Dosen Penguji Penelitian
6. Bapak Erwan Adi Saputro, ST, MT selaku Dosen Penguji Penelitian
7. Kedua orang tua yang telah memberikan dukungan doa dan semangat yang
8. Seluruh teman – teman di jurusan Teknik Kimia FTI UPN “Veteran”
JATIM yang telah memberikan dorongan semangat dalam pelaksanaan
dan penyusunan laporan penelitian.
9. Semua pihak yang tidak dapat dituliskan dengan terperinci yang telah
membantu hingga terselesainya enelitian ini
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan
laporan hasil, oleh karena itu penulis mengharapkan adanya saran dan kritik yang
sifanya membangun untuk kesempurnaan laporan hasil ini.
Akhir kata, semoga hasil dari penelitian ini dapat memberikan manfaat
bagi kita semua. Terima kasih.
Surabaya, Januari 2013
iii
Recovery logam Titanium Dioxide (TiO2) Dari
Limbah Proses Pengambilan Biji Besi
DAFTAR ISI
I.3 Manfaat penelitian ………...…3
BAB II TINJ AUAN PUSTAKA II.1 Secara Umum……….……….4
II.2 Pasir Besi ...….………..……….…..6
II.2.1 Titanium Dioxide ………..…....…7
II.2.1.1 Sifat Fisik Titanium Dioxide……….………..…...8
II.3 Titanium ……….……….8
II.3.1 Sifat Fisik Titanium ……….……….9
II.3.2 Sifat Kimia Titanium ………..….……….10
II.3.4 Aplikasi Titanium ……….………12
II.4 Asam Klorida……….………..………..….12
II.4.1 Sifat Fisik Asam Klorida (HCl) ……….….……...12
II.4.2 Sifat Kimia Asam Klorida (HCl) ……….………….13
II.5 Landasan Teori ……….………...14
II.5.1 Ekstraksi Padat – Cair ……….………...17
II.6 Hipotesa ……….………...19
BAB III METODE PENELITIAN III.1 Bahan Yang Digunakan …………..………..………20
III.2 Alat Yang Digunakan.……….………..…20
III.3 Gambar Rangkaian Alat ……….………..20
III.4 Variabel Yang Di Gunakan……….………..…21
III.4.1 Variabel Yang Di Tetapkan………...21
III.4.2. Variabel Yang Dijalankan……….………...21
III.5 Prosedur Penelitian……….…………...21
BAB IV HASIL DAN PEMBAHASAN IV.1 Hasil ...…………..………..………24
IV.2 Pembahasan ...……….………..25
v
Recovery logam Titanium Dioxide (TiO2) Dari
Limbah Proses Pengambilan Biji Besi
V.2 Saran ...……….……….…35
APPENDIX
DAFTAR GAMBAR
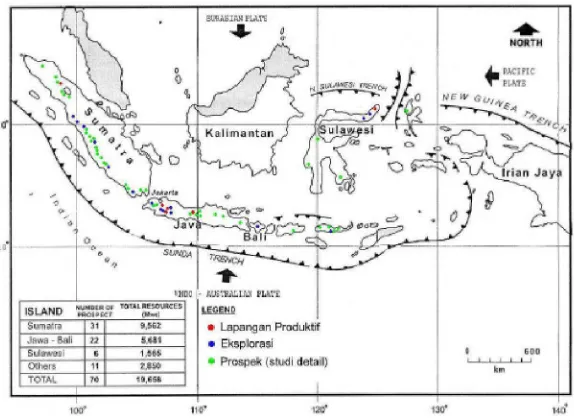
Gambar 2.1. Peta Penyebaran Sumber Daya Mineral dan Panas Bumi Di
Indonesia………...………..……….5
Gambar 2.2.1.1. Titanium Dioxide …...………...8
Gambar 3.3.1. Rangkaian Alat ...……...………..……….20
vii
Recovery logam Titanium Dioxide (TiO2) Dari
Limbah Proses Pengambilan Biji Besi
DAFTAR GRAFIK
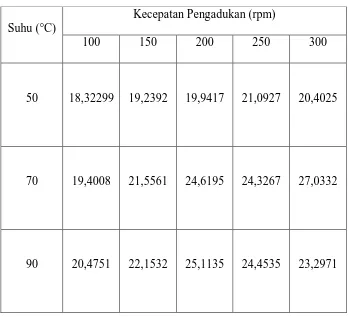
Grafik IV.2.1 Pengaruh asam klorida yang dipanaskan hingga 50°C terhadap
Persen Yield (% yield) dibandingkan dengan kecepatan
pengadukan (rpm)...25
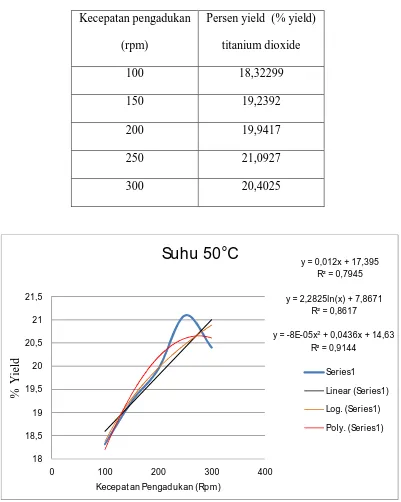
Grafik IV.2.2 Pengaruh asam klorida yang dipanaskan hingga 70°C terhadap
Persen Yield (% yield) dibandingkan dengan kecepatan
pengadukan (rpm)...27
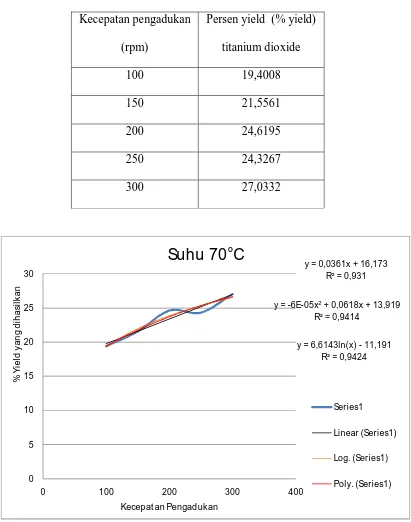
Grafik IV.2.3 Pengaruh asam klorida yang dipanaskan hingga 90°C terhadap
Persen Yield (% yield) dibandingkan dengan kecepatan
DAFTAR TABEL
Tabel II.2.1. Tabel Hasil Analisa Sampel Bahan Baku ..………..…..………….7
Tabel IV.1.1. Pengaruh Asam Klorida Dan Kecepatan Pengadukan Terhadap
Persen Yield (% yield )Titanium Dioxide...24
Tabel IV.2.1. Pengaruh asam klorida yang dipanaskan hingga 50°C terhadap
Persen Yield (% yield )Titanium Dioxide...25
Tabel IV.2.2. Pengaruh asam klorida yang dipanaskan hingga 70°C terhadap
Persen Yield (% yield )Titanium Dioxide...27
Tabel IV.2.3. Pengaruh asam klorida yang dipanaskan hingga 90°C terhadap
ix
Recovery logam Titanium Dioxide (TiO2) Dari
Limbah Proses Pengambilan Biji Besi
INTISARI
Di Indonesia, endapan bijih besi dalam bentuk pasir besi diperkirakan
berjumlah 83 juta ton. Pasir besi ini diketemukan di pantai selatan Pulau Jawa.
Kebutuhan akan besi dari tahun ke tahun makin meningkat. Pada saat ini
kebutuhan besi baja di Indonesia mencapai sekitar sembilan juta ton pertahun.
Bahan baku bijih besi berbentuk pellet yang digunakan untuk pembuatan besi baja
tersebut saat ini masih diimpor. Indonesia sebagai negara yang mempunyai
cadangan bijih besi yang melimpah, harus dapat memanfaatkan kekayaan alam
yang ada sebaik mungkin.
Penelitian ini bertujuan mengurangi kandungan Fe2O3 dalam limbah
proses pengambilan pasir besi, memperbesar kadar titanium dioxide dalam limbah
proses pengambilan pasir besi, dan mengetahui besarnya pengaruh kecepatan
pengadukan dan kenaikan suhu dalam pembentukan titanium dioxide.
Limbah pasir besi yang telah diayak ukuran 150 mesh, di ekstraksi dengan
menggunakan HCl 32% dengan variasi suhu (50, 70, 90 °C) dan kecepatan
pengadukan (100, 150, 200, 250,300 rpm). Setelah itu filtrat yg telah dikeringkan
dianalisa kadar Fe2O3 dan TiO2.
Berdasarkan penelitian yang dilakukan maka di dapatkan , hasil terbaik
didapat pada suhu 90°C dengan kecepatan 200 rpm didapatkan kadar TiO2
BAB I
PENDAHULUAN
I.1 Latar Belakang
Pengolahan bahan baku alam dan bahan baku jadi diperlukan untuk
menopang perkembangan perindustrian di indonesia. Namun hal ini tidak akan
tercapai bila penelitian akan bahan baku secara berkesinambungan tidak
dilakukan. Pasir mineral atau pasir besi merupakan bahan mentah yang banyak
tersebar di sepanjang pesisir pantai selatan Indonesia. Pasir besi juga diduga
mengandung banyak mineral yang berharga yakni hematit, magnetit dan ilmenit
dan banyak unsur mineral yang lain seperti TiO2.
Di Indonesia penelitian tentang pasir besi masih belum terlalu intensif.
Padahal banyak mineral yang bernilai tinggi terkandung didalamnya. Dan karena
belum intensif maka generasi muda yang harus menggerakkan penelitian ini.
Ekstraksi TiO2 dalam pasir besi berhasil dilakukan dengan larutan H2SO4
dengan konsentrasi 7,5 M dan diperoleh berupa endapan TiO dengan tingkat
kemurnian ~85% . Proses ekstraksi menghasilkan efisiensi sebanyak 35,7%.
(Zulfalina & Azwar, 2004)
Di alam TiO2 juga ditemukan sebagai mineral tersendiri, namun saat ini
bisa dikatakan habis karena jumlahnya yang mulai menurun, sehingga industri
beralih ke rutil sintetik yang dibuat dari ilmenite dengan kadar 45 – 70 % TiO2
sebagai bahan baku pembuatan TiO2. Melihat potensi tersebut maka ekstraksi
titanium dioksida dari mineral ilmenit sebagai bahan baku material maju menjadi
2
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
Pengaplikasian bahan titanium sendiri sangat diperlukan dalam beberapa
bidang, salah satunya seperti pada bidang industri yang mengunakan titanium
dalam membuat beberapa mesin pemindah panas (heat exchanger) dan bejana
bertekanan tinggi serta pipa-pipa yang tahan korosi. Alasan pengguanaan bahan
titanium sendiri tak terlepas dari karakteristik titanium yang tahan pada suhu
tinggi dan tahan terhadap korosi. (Campbell.F.C,2006)
Penulis melakukan penelitian dengan judul “Recovery Logam Titanium
Dioxide (TiO2) Dari Limbah Proses Pengambilan Pasir Besi “ dengan harapan
dapat mengoptimalkan pengetahuan tentang limbah pasir besi supaya dapat
berguna diwaktu yang akan datang. Dikarenakan belum adanya industri yang
mengelola secara langsung di Indonesia, dan kebutuhan dari pengaplikasian
titanium itu sendiri.
I.2 Tujuan Penelitian
Tujuan dari penelitian “Recovery Logam Titanium Dioxide (TiO2) Dari
Limbah Proses Pengambilan Pasir Besi “ ini adalah :
1. Memperbesar kadar Titanium Dioxide dalam Limbah Proses
Pengambilan Pasir Besi
2. Mengetahui besarnya pengaruh kecepatan pengadukan dan kenaikan
suhu dalam pembentukan Titanium Dioxide.
3. Mengurangi kandungan Fe2O3 dalam Limbah Proses Pengambilan Pasir
I.3 Manfaat Penelitian
Manfaat dari penelitian “Recovery Logam Titanium Dioxide (TiO2) dari
Limbah Proses Pengambilan Pasir Besi “ ini adalah :
1. Menambah pengetahuan dan pengalaman dalam penelitian terapan serta
menambah wawasan tentang mineral.
2. Penguasaan teknologi proses recovery titanium dari limbah pasir besi
dengan menggunakan ekstraksi (leaching).
3. Mengurangi adanya pencemaran pada lingkungan karena adanya limbah
logam berat yang tidak mudah untuk diuraikan.
4. Memberi nilai ekonomi pada limbah pasir besi yang telah melewati
4
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
BAB II
TINJ AUAN PUSTAKA
II.1 Secara Umum
Perkembangan industri yang cukup pesat di Indonesia selama 5 tahun
belakangan ini menuntut tersedianya bahan baku industri yang cukup besar. Salah
satu industri yang cukup berkembang pesat di Indonesia adalah industri besi dan
baja. Peningkatan jumlah industri di bidang besi dan baja ini dikaitkan dengan
semakin dibutuhkannya besi dan baja untuk keperluan kontruksi yang akhir-akhir
ini terus berkembang.
Peningkatan pembangunan di bidang konstruksi yang cukup pesat di
Indonesia inilah yang secara tidak langsung dapat meningkatkan kebutuhan besi
dan baja untuk industri. Selain untuk kepentingan kontruksi, besi dan baja juga
mulai banyak dibutuhkan di industri transportasi dan juga industri rumah tangga.
Untuk mencukupi kebutuhan besi dan baja nasional saat ini lebih banyak
dipenuhi dengan melakukan import bahan baku mentah berupa pellet besi dari
Australia atau negara lain penghasil bahan baku tersebut seperti Cina atau
Kanada. Selain dengan melakukan impor pellet besi industri dalam negeri juga
memanfaatkan besi bekas utuk dilebur kembali.
Di Indonesia, endapan bijih besi dalam bentuk pasir besi diperkirakan
berjumlah 83 juta ton. Pasir besi ini diketemukan di pantai selatan Pulau Jawa.
Kebutuhan akan besi dari tahun ke tahun makin meningkat. Pada saat ini
kebutuhan besi baja di Indonesia mencapai sekitar sembilan juta ton pertahun.
Bahan baku bijih besi berbentuk pellet yang digunakan untuk pembuatan besi baja
cadangan bijih besi yang melimpah, harus dapat memanfaatkan kekayaan alam
yang ada sebaik mungkin. (Badan Pertambangan dan Geologi Banten,2011)
Pemanfaatan pasir besi yang ada di Indonesia saat ini tidak di ikuti dengan
pengolahan limbah dari pasir besi itu sendiri, padahal dari pasir besi yang
mengalami proses hingga kandungan besi oksidanya meningkat limbahnya
banyak mengandung titanium.
Gambar 2.1.1. Peta Penyebaran Sumber Daya Mineral dan Panas Bumi
Di Indonesia
Dalam sudut pandang manusia melihat masalah industri penambangan dan
aktivitas yang dilakukannya menekankan keuntungan financial yang dipakai
untuk meningkatkan kesejahteraan manusia.
Limbah pasir besi yang penulis gunakan adalah limbah pasir besi yang
berasal dari pemrosesan secara separasi sebelum pemisahan mineral besi menjadi
6
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
II.2 Pasir Besi
Pasir besi terbentuk karena adanya hasil dari pelapukan andesit yang
terbawa aliran sungai dan diendapkan di pantai dengan bantuan gelombang laut.
Dengan analisa petrografi terdapat tiga jenis mineral bijih yaitu :
• Magnetit (Fe3O4)
• Hematit (Fe2O3)
• Ilmenit (FeTiO3)
Ilmenit juga dikenal sebagai besi titanium. Ilmenit secara formal campuran
dengan proporsi 48% oksida besi dan 53% titanium dioksida. Ilmenite sering
dapat bersama-sama dengan magnetit. Umumnya, ilmenite ditambang untuk
mendapatkan unsur titaniumnya, sedangkan Fe hanya sebagai produk samping.
Untuk ilmenite sendiri mengandung hampir 53% TiO2 (rutile) yang
merupakan mineral penting untuk pengolahan titanium yang masih ada pengotor
sekitar 10% besi oksida, vanadium, niobium, tantalum, dan sedikit timah,
kromium. Dari beberapa bentuk bijih titanium hanya bijih ilmenite (FeTiO3) yang
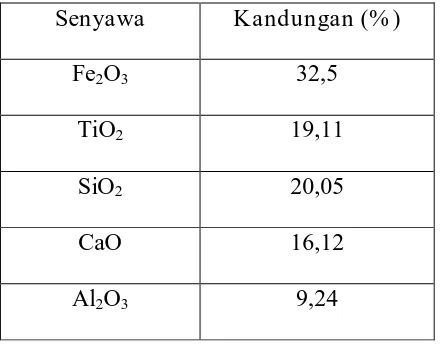
Tabel II.2.1. Tabel Hasil Analisa Sampel Bahan Baku Limbah Pasir Besi
Senyawa Kandungan (% )
Fe2O3 32,5
TiO2 19,11
SiO2 20,05
CaO 16,12
Al2O3 9,24
Sumber : Balai Penelitian Dan Konsultasi Industri Laboratorium Surabaya
II.2.1 Titanium Dioxide
Titanium Dioxida adalah merupakan bentuk oksida dari titanium secara
kimia dapat dituliskan TiO2 Senyawa ini biasa digunakan sebagai pigmen pada cat
tembok dan sunscreen.
Titanium dioksida murni tidak terjadi di alam tetapi berasal dari bijih
ilmenit. Hal ini juga mudah ditambang di salah satu bentuk yang paling murni,.
Proses pengambilan titanium dioksida banyak digunakan menggunakan ilmenit
sebagai sumber, dan diekstraksi dengan asam klorida.
Maka di dapat reaksi antara ilmenit (FeTiO3) dengan Asam klorida (HCl)
sebagai berikut :
FeTiO3 + 2HCl FeCl2 + TiO2 + H2O
Ilmenit yang direaksikan dengan asam klorida dengan konsentrasi dan
8
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
Gambar 2.2.1.1. Titanium Dioxide
II.2.1.1 Sifat Fisik Titanium Dioxide
1. Molekul rumus :TiO 2
2. Massa molar :79,866 g / mol
3. Kepadatan :4,23 g / cm 3
4. Titik lebur :1843 ° C
5. Titik didih :2972 ° C
II.3 Titanium
Titanium, yang dilambangkan dengan simbol Ti, merupakan logam
transisi dan mempunyai nomor atom 22 dan berat atom 47,90. Titanium adalah
logam yang paling melimpah keempat, yaitu sekitar 0,62% dari kerak bumi.
Meski melimpah, titanium jarang ditemukan dalam bentuk logam murni.
Kebanyakan titanium ditemukan dalam bentuk rutile atau titanium dioksida
(TiO2). Titanium umumnya terbentuk pada batuan igneous, sering ditemukan
Titanium berwarna abu abu keperakan. Logam ini memiliki kerapatan
4510 kg/m3, berada diantara aluminium dan stainless steel (bisa dikatakan
sebagai logam ringan). Meski ringan, logam ini mempunyai kekuatan hampir
sama dengan baja, ditambah mempunyai daktilitas yang tinggi. Bentuk titanium
yang dikomersilkan (kemurnian 99,2%) memiliki ultimate tensile strength (UTS)
sekitar 63.000 psi atau 434 Mpa. Logam ini memiliki kekerasan yang cukup
tinggi, non-magnetik dan konduktor yang buruk. Selain itu, memiliki fatigue limit
untuk batas pemakaian pada beberapa aplikasi. Logam ini memiliki allotrope
dimorphic dengan bentuk alfa hexagonal yang dapat berubah menjadi bentuk beta
body-centered cubic pada temperatur 8820C.
II.3.1 Sifat Fisik Titanium
• Radius Atom: 1.45 Å
• Volume Atom: 10.6 cm3/mol
• Massa Atom: 47.88
• Titik Didih: 3560 K
• Radius Kovalensi: 1.32 Å
• Struktur Kristal: Heksagonal
• Massa Jenis: 4.54 g/cm3
• Konduktivitas Listrik: 2.6 x 106 ohm-1cm-1
• Elektronegativitas: 1.54
• Konfigurasi Elektron: [Ar]3d2 4s2
10
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
• Potensial Ionisasi: 6.82 V
• Titik Lebur: 1935 K
• Bilangan Oksidasi: 4,3
• Kapasitas Panas: 0.523 Jg-1K-1
• Entalpi Penguapan: 455.2 kJ/mol
(http//www.chemistry.org/titanium)
II.3.2 Sifat Kimia Titanium
• Reaksi dengan Air
Titanium akan bereaksi dengan air membentuk Titanium dioksida dan
hydrogen.
Ti(s) + 2H2O(g) → TiO 2(s) + 2H2(g) • Reaksi dengan Udara
Ketika Titanium dibakar di udara akan menghasilkan Titanium dioksida
dengan nyala putih yang terang dan ketika dibakar dengan Nitrogen murni
akan menghasilkan Titanium Nitrida.
Ti(s) + O2(g) → TiO 2(s)
2Ti(s) + N2(g) → TiN(s) • Reaksi dengan Halogen
Reaksi Titanium dengan Halogen menghasilkan Titanium Halida. Reaksi
dengan Fluor berlangsung pada suhu 200°C.
Ti(s) + 2F2(s) → TiF 4(s)
Ti(s) + 2Br2(l) → TiBr 4(s)
Ti(s) + 2I2(s) → TiI 4(s) • Reaksi dengan Asam
Logam Titanium tidak bereaksi dengan asam mineral pada temperatur
normal tetapi dengan asam hidrofluorik yang panas membentuk kompleks
anion (TiF6)
3-2Ti(s) + 2HF (aq) → 2(TiF 6)3-(aq) + 3 H2(g) + 6 H+(aq)
II.3.3 Keunggulan Titanium
• Salah satu karakteristik Titanium yang paling terkenal bahwa
titanium sama kuatnya dengan baja, tetapi hanya 60% dari berat baja.
• Kekuatan fatik (fatigue strength) lebih tinggi daripada paduan
aluminium.
• Tahan pada suhu tinggi. Ketika temperatur pemakaian melebihi 150
C maka dibutuhkan titanium karena aluminium akan kehilangan
kekuatannya seacara nyata.
• Tahan korosi. Ketahanan korosi titanium lebih tinggi daripada
aluminium dan baja.
• Dengan rasio berat-kekuatan yang lebih rendah daripada aluminium,
maka komponen-komponen yang terbuat dari titanium membutuhkan
12
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
II.3.4 Aplikasi Titanium
• Militer. Oleh karena kekuatannya, unsur ini digunakan untuk membuat
peralatan perang (tank) dan untuk membuat pesawat ruang angkasa.
• Industri. Beberapa mesin pemindah panas (heat exchanger)dan bejana
bertekanan tinggi serta pipa-pipa tahan korosi memakai bahan titanium.
• Kedokteran. Bahan implan gigi, penyambung tulang, pengganti tulang
tengkorak, struktur penahan katup jantung.
• Mesin. Material pengganti untuk batang piston (Wikipedia,2012)
II.4 Asam Klorida
Asam klorida adalah larutan akuatik dari gas hidrogen klorida (HCl). Ia
adalah asam kuat, dan merupakan komponen utama dalam asam lambung.
Senyawa ini juga digunakan secara luas dalam industri. Asam klorida harus
ditangani dengan wewanti keselamatan yang tepat karena merupakan cairan yang
6. Kelarutan dalam air : Tercampur penuh
7. Keasaman (pKa) −8,0
8. Viskositas 1,9 mPa·s pada 25 °C,larutan 31,5% (Wikipedia,2011)
II.4.2 Sifat Kimia Asam Klorida (HCl)
Hidrogen klorida (HCl) adalah asam monoprotik, yang berarti bahwa ia
dapat berdisosiasi melepaskan satu H+ hanya sekali. Dalam larutan asam klorida,
H+ ini bergabung dengan molekul air membentuk ion hidronium, H3O+.
HCl + H2O → H 3O+ + Cl−
Ion lain yang terbentuk adalah ion klorida, Cl−. Asam klorida oleh karenanya dapat digunakan untuk membuat garam klorida, seperti natrium
klorida. Asam klorida adalah asam kuat karena ia berdisosiasi penuh dalam air.
Dari tujuh asam mineral kuat dalam kimia, asam klorida merupakan asam
monoprotik yang paling sulit menjalani reaksi redoks. Ia juga merupakan asam
kuat yang paling tidak berbahaya untuk ditangani dibandingkan dengan asam kuat
lainnya. Walaupun asam, ia mengandung ion klorida yang tidak reaktif dan tidak
beracun. Asam klorida dalam konsentrasi menengah cukup stabil untuk disimpan
dan terus mempertahankan konsentrasinya. Oleh karena alasan inilah, asam
klorida merupakan reagen pengasam yang sangat baik.
Asam klorida merupakan asam pilihan dalam titrasi untuk menentukan
jumlah basa. Asam yang lebih kuat akan memberikan hasil yang lebih baik oleh
14
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
II.5 Landasan Teori
Recovery titanium dioxide merupakan pengambilan kembali senyawa
titanium dioxide dari limbah pengambilan pasir besi titan (FeTiO3) dengan
menggunakan metode ekstraksi padat cair dengan menggunakan solvent HCl.
Hasil recovery tersebut berupa TiO2 yang diambil dari residu. Dapat dieraksikan
seperti berikut :
FeTiO3 + 2HCl FeCl2 + TiO2 + H2O
Recovery titanium dioxide dapat di hasilkan dengan cara leaching atau
mengekstrak ilmenit untuk di larutkan kandungan besinya dengan menggunakan
solvent HCl. Maka residu dari ekstraksi tersebut ialah residu yang mengandung
titanium dioxide yang berkadar tinggi.
Proses leaching dengan menggunakan asam klorida telah pula digunakan
untuk ekstraksi TiO2 dari pasir besi dan cukup efektif untuk memisahkan senyawa
ini dengan Fe yang cenderung membentuk FeCl2 ketika di ekstraaksikan dengan
asam klorida. (Zulfalina dan Azwar,2004)
Sering kali campuran bahan padat dan cair (misalnya bahan alami) tidak
dapat atau sukar sekali dipisahkan dengan metode pemisahan mekanis atau termis
yang telah dibicarakan. Misalnya saja, karena komponennya saling bercampur
secara sangat erat, peka terhadap panas, beda sifat- sifat fisiknya terlalu kecil, atau
Suatu proses ekstraksi melibatkan tahap-tahap sebagai berikut :
• Mencampur bahan ekstraksi dengan pelarut dan membiarkannya saling
berkontak. Dalam hal ini terjadi perpisahan massa dengan cara difusi pada
bidang antar muka bahan ekstraksi pelarut.
• Memisahkan larutan ekstraksi dari rafinat,umumnya dengan cara
penjernihan atau filtrasi.
• Mengisolasi eksterak dari larutan ekstrak dan mendapatkan kembali
pelarut, umumnya dengan menguapkan pelarut. Dalam hal- hal tertentu
larutan ekstrak dapat langsung diolah lebih lanjut atau diolah setelah
dipekatkan.seringkali juga diperlukan tahap-tahap lainnya pada ekstraksi
padat – cair, misalnya dapat dilakukan pra-pengolahan bahan ekstraksi
atau pengolahan lanjut untuk mendapatkan kembali sisa-sisa pelarut.
Pemilihan pelarut pada umumnya dipengaruhi oleh faktor – faktor berikut ini:
o Selektivitas
Diharapkan pelarut hanya akan melarutkan ekstrak yang diinginkan,
bukan komponen-komponen lain dari bahan ekstrak.
o Kelarutan
Pelarut sedapat mungkin memiliki kemampuan melarutkan ekstrak yang
besar jika kebutuhan pelarut sedikit .
o Kemampuan tidak saling bercampur
Pada ekstraksi cair-cair, pelarut tidak boleh (atau hanya secara sebatas)
16
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
o Kerapatan
Terutama pada ekstraksi cair-cair sedapat mungkin terdapat perbedaan
kerapatan yang besar antara pelarut dan bahan ekstraksi. Hal ini
dimaksudkan agar kedua fasa dapat dengan mudah dipisahkan kembali
setelah pencampuran (pemisahan dengan gaya berat). Bila beda
kerapatannya kecil, seringkali pemisahan harus dilakukan dengan
menggunakan gaya sentrifugal (misalnya dalam ekstraktor sentrifugal).
o Reaktivitas
Pada umumnya pelarut tidak menyebabkan perubahan secara kimia pada
komponen – komponen bahanekstraksi. Sebaliknya dalam hal-hal tertentu
diperlukan adanya reaksi kimia (misalnya pembentukan garam) untuk
mendapatkan selektivitas yang tinggi.
o Titik didih
Karena ekstrak dan pelarut biasanya harus dipisahkan dengan cara
penguapan, distilasi atau rektifikasi maka titik didih kedua bahan itu tidak
boleh terlalu dekat dan keduanya tidak membentuk azeotrop.
o Kriter ia lain
Pelarut sedapat mungkin harus :
- Murah
- Tersedia dalam jumlah besar
- Tidak beracun
- Tidak eksplosif jika bercampur dengan udara
- Tidak menyebabkan terbentuknya emulsi
- Memiliki viskositas yang rendah
- Stabil secara kimia dan termis,
Berdasarkan bentuk campuran yang diekstrak ekstraksi dan dibedakan
menjadi dua macam yaitu :
1. Ekstraksi Padat – Cair
Dalam hal ini zat yang akan diekstrak terdapat dalam campurannya
yang berbentuk padatan.
2. Ekstraksi Cair – Cair
Dalam hal ini zat yang akan diekstrak terdapat dalam campurannya
yang berbentuk cair.
II.5.1 Ekstraksi Padat – Cair
Ekstraksi padat-cair atau leaching adalah transfer difusi komponen terlarut
dari padatan inert kedalam pelarutnya. Proses ini merupakan proses yang bersifat
fisik karena komponen terlarut kemudian dikembalikan lagi ke keadaan semula
tanpa mengalami proses perubahan kimiawi. Ekstraksi dari bahan padat dapat
dilakukan jika bahan yang diinginkan dapat larut dalam solvent pengekstraksi.
Ekstraksi berkelanjutan dapat dilakukan diperlukan apabila padatan hanya sedikit
larut dalam pelarut. Namun sering digunakan padad padatan yang karena
18
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
Ada empat faktor penting yang harus diperhatikan dalam operasi ekstraksi:
1.Ukuran partikel
Ukuran partikel mempengaruhi kecepatan ekstraksi. Semakin kecil
ukuran partikel maka areal terbesar antara padatan terhadap cairan
memungkinkan terjadi kontak secara tepat. Semakin besar partikel,
maka cairan yang akan mendifusi akan memerlukan waktu yang
relative lama.
2. Faktor pengaduk
Semakin cepat laju putaran pengaduk partikel akan semakin
terdistribusi dalam permukaan kontak akan lebih luas terhadap pelarut.
Semakin lama waktu pengadukan berarti difusi dapat berlangsung terus
dan lama pengadukan harus dibatasi pada harga optimum agar dapat
optimum agar konsumsi energi tak terlalu besar. Pengaruh faktor
pengadukan ini hanya ada bila laju pelarutan memungkinkan.
3. Temperatur
Pada banyak kasus, kelarutan material akan diekstraksi akan meningkat
dengan temperatur dan akan menambah kecepatan ekstraksi.
4. Jenis Pelarut
Pemilihan pelarut yang baik adalah pelarut yang sesuai dengan
viskositas yang cukup rendah agar sirkulasinya bebas. Umumnya
pelarut murni akan digunakan meskipun dalam operasi ekstraksi
konsentrasi dari solute akan meningkat dan kecepatan reaksi akan
melambat, karena gradien konsentrasi akan hilang dan cairan akan
II.6 Hipotesa
Proses recovery logam titanium dioxide (TiO2) dari limbah proses
pengambilan biji besi diharapkan dapat menghasilkan logam titanium dioxide
20
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
BAB III
METODE PENELITIAN
III.1. Bahan – bahan yang digunakan
1. Limbah Pasir Besi
2. HCl
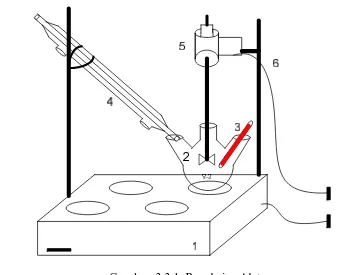
III.2. Alat – alat yang digunakan
1. Water Bath
2. Labu Leher tiga
3. Thermometer
4. Condensor
5. Motor Pengaduk
6. Statif
III.3. Gambar Rangkaian Alat
III.4 Variabel Penelitian
III.4.1 Variabel yang Dijalankan
1. Kecepatan Pengadukan (rpm) : 100, 150, 200, 250,300
2. Suhu (°C) : 50, 70, 90
III.4.2 Variabel yang Ditetapkan
1. Berat sample limbah : 15 gram
2. Waktu Operasi : 90 menit
3. Ukuran Partikel : 150 mesh
4. Konsentrasi HCl : 32%
5. Volume HCl : 450 ml
III.5 Prosedur Penelitian
1. Analisa awal kualitas limbah pasir besi, dengan menganalisa kandungan
titanium dalam limbah pasir besi.
2. Haluskan limbah pasir besi dan ayak sesuai dengan ukuran partikel yang
telah ditetapkan yaitu 150 mesh.
3. Lalu cuci pasir besi dengan menggunakan air agar dapat terpisahkan dari
impurities (zat campuran) yang terdapat pada pasir. Timbang limbah
tersebut sebanyak 15gram.
4. Buat larutan HCl sesuai dengan konsentrasi yang telah ditetapkan yaitu
32% dengan volume masing- masing 450ml untuk setiap beakerglass.
5. Masukkan limbah kedalam labu leher tiga, kemudian ditambah dengan
22
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
6. Aduk dengan kecepatan sesuai dengan variabel yang ada, dengan waktu
operasi yang telah ditentukan selama 90 menit . Lakukan operasi ekstraksi
sesuai dengan suhu operasi yang telah dijadikan variabel.
7. Setelah mencapai waktu proses yang telah ditentukan saring dengan
kertas saring untuk memisahkan padatan dan cairan lalu tampung dalam
Erlenmeyer.
8. Padatan dikeringkan lalu dianalisa.
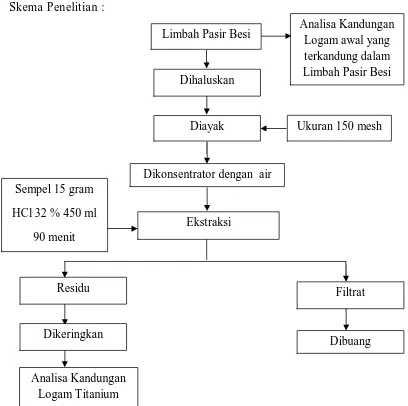
Skema Penelitian :
Gambar 3.5.1. Skema Prosedur Penelitian
Limbah Pasir Besi Analisa Kandungan
Logam awal yang terkandung dalam Limbah Pasir Besi Dihaluskan
Diayak
Ekstraksi
Filtrat Residu
Dikeringkan
Dibuang
Analisa Kandungan Logam Titanium
Dikonsentrator dengan air
Ukuran 150 mesh
Sempel 15 gram
HCl 32 % 450 ml
24
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
BAB IV
HASIL DAN PEMBAHASAN
IV.1. Hasil Penelitian
Tabel IV.1.1. Pengaruh Suhu Asam Klorida Dan Kecepatan Pengadukan
Terhadap Persen Yield (% yield) Titanium Dioxide
Suhu (°C)
Kecepatan Pengadukan (rpm)
100 150 200 250 300
50 18,32299 19,2392 19,9417 21,0927 20,4025
70 19,4008 21,5561 24,6195 24,3267 27,0332
IV.2. Pembahasan
Tabel IV.2.1. Pengaruh asam klorida yang dipanaskan hingga 50°C terhadap
persen yield (% yield) titanium dioxide.
Kecepatan pengadukan
Grafik IV.2.1. Pengaruh asam klorida yang dipanaskan hingga 50°C terhadap
26
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
Pembahasan :
Berdasarkan tabel VI.2.1 dan grafik VI.2.1, hasil penelitian yang penulis
lakukan menunjukkan pada suhu 50°C. Nilai error yang didapat dari ketiga
metode grafik yang penulis gunakan, antara lain :
1. Linier, didapat error sebesar = 0,794
2. Logarithmic, didapat error sebesar = 0,861
3. Polynomial, didapat error sebesar = 0,914
Dari ketiga metode grafik yang menggunakan Ms.Excel didapat Error dari
% yield menggunakan data dengan nilai yang terendah yaitu 0,794. Maka
progress dari penelitian ini menghasilkan % yield yang linier dapat disimpulkan
bahwa dari % yield yang terbentuk tidak mengalami keoptimalan produk.
Persen yield (% yield) titanium dioxide pada hasil penyaringan proses
ekstraksi semakin meningkat, namun pada kecepatan pengadukan pada 300 rpm
kadar menurun dikarenakan solvent mengalami reaksi yang berlebih sedangkan
temperature yang ditetapkan ialah sangat rendah, sehingga Fe2O3 yang terkandung
pada pasir besi tidak terikat secara sempurna.
Dalam bentuk reaksi didapatkan hasil sebagai berikut :
Tabel IV.2.2. Pengaruh asam klorida yang dipanaskan hingga 70°C terhadap
persen yield (% yield) titanium dioxide.
Kecepatan pengadukan
Grafik IV.2.2. Pengaruh asam klorida yang dipanaskan hingga 70°C terhadap
28
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
Pembahasan :
Berdasarkan tabel VI.2.2 dan grafik VI.2.2, hasil penelitian yang penulis
lakukan menunjukkan pada suhu 70°C.Nilai error yang didapat dari ketiga metode
grafik yang penulis gunakan, antara lain :
1. Linier, didapat error sebesar = 0,931
2. Logarithmic, didapat error sebesar = 0,941
3. Polynomial, didapat error sebesar = 0,942
Dari ketiga metode grafik yang menggunakan Ms.Excel didapat Error dari
% yield menggunakan data dengan nilai yang terendah yaitu 0,931. Maka
progress dari penelitian ini menghasilkan % yield yang linier dapat disimpulkan
bahwa dari % yield yang terbentuk tidak mengalami keoptimalan produk.
Dari grafik IV.2.2 telah di jelaskan bahwa pada variable suhu 70°C
mengalami kenaikan yield yang sangat nyata pada kecepatan pengadukan 100
hingga 200 rpm,dikarenakan terdapat keseimbangan kelarutan namun pada saat
pengadukan 250 rpm yield yang di hasilkan mengalami penurunan. Dikarenakan
pada kecepatan pengadukan ini HCl yang bereaksi mengalami kondisi tak jenuh
dan pengadukan tidak bisa mengaduk padatan secara menyeluruh, sehingga
produk yang dihasilkan mengalami penurunan, namun pada kecepatan
pengadukan 300 rpm mengalami kenaikan % yield.
Dalam bentuk reaksi didapatkan hasil sebagai berikut :
Tabel IV.2.3. Pengaruh asam klorida yang dipanaskan hingga 90°C terhadap
persen yield (% yield) titanium dioxide.
Kecepatan pengadukan
Grafik IV.2.3. Pengaruh asam klorida yang dipanaskan hingga 90°C terhadap
30
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
Pembahasan :
Berdasarkan tabel VI.2.3 dan grafik VI.2.3, hasil penelitian yang penulis
lakukan menunjukkan pada suhu 90°C.Nilai error yang didapat dari ketiga metode
grafik yang penulis gunakan, antara lain :
1. Linier, didapat error sebesar = 0,460
2. Logarithmic, didapat error sebesar = 0,592
3. Polynomial, didapat error sebesar = 0,909
Dari ketiga metode grafik yang menggunakan Ms.Excel didapat Error dari
% yield menggunakan data dengan nilai yang terendah yaitu 0,460. Maka
progress dari penelitian ini menghasilkan % yield yang linier dapat disimpulkan
bahwa dari % yield yang terbentuk tidak mengalami keoptimalan produk.
Dari hasil penelitian yang kami lakukan pada suhu 90°C, dengan
ditambahnya kecepatan putaran pengadukan (rpm) maka persen yield (% yield)
titanium dioxide semakin besar karena besi yang terkandung dalam pasir besi
dapat terikat oleh pelarutnya pada saat proses ekstraksi berlangsung. Namun pada
kecepatan maksimum 300 rpm, kadar titanium dioxide mengalami penurunan
dikarenakan pada variable tersebut pengaduk kurang terkontrol dan pemanasan
HCl berjalan lambat. Dari grafik juga menunjukan pada kecepatan pengadukan
200 sampai 300 rpm tidak ada peningkatan yang signifikan disebabkan suhu titik
didih dari HCl 32% adalah 90°C.
Dalam bentuk reaksi didapatkan hasil sebagai berikut :
Hasil penelitian ini rata – rata dihasilkan kurang lebih 12 gram dari 15
gram sampel yang digunakan oleh peneliti. Dan peningkatan jumlah titanium
dioxide sebesar 21 – 28%. Dari ke tiga reaksi yang telah didapatkan dapat pula
diketahui rendahnya kadar titanium dioxide yang disebabkan oleh kadar HCl yang
sifatnya merupakan senyawa polar yang cenderung salah satu pasangan elektron
ikatan tertarik lebih kuat kesalah satu atomnya. Meskipun atom H dan Cl sama –
sama menarik pasangan elektron ikatan , tetapi perbedaan keelektronegatifan lebih
besar dari pada atom H dan mengakibatkan atom Cl menarik pasangan elektron
ikatan lebih kuat dari pada atom H.
Berdasarkan asas Le Chatelier dengan pernyataan bahwa adanya ion
sejenis akan mempengaruhi kelarutan dari ion sejenis, dan perubahan dari
keadaan kesertimbangan semula ke keadaan kesetimbangan yang baru akibat
adanya aksi atau pengaruh dari luar itu disebut dengan pergeseran kesetimbangan.
Secara kuantitas larutan HCl pekat yang digunakan berlebih sehingga
mengakibatkan kuantitas relatif zat yang ada pada limbah pasir besi seperti Fe2O3,
SiO2, CaO, Al2O3, dan beberapa senyawa lainnya yang tidak terikat secara
sempurna pada saat proses ektraksi berlangsung.
Diketahui bahwa senyawa yang mengandung unsure titanium merupakan
senyawa yang mampu membentuk oksida logam yang bersifat asam, terutama
pada saat kondisi oksidanya meningkat. Namun dikarenakan terdapat berbagai
halangan seperti penggunaan suhu dan konsentrasi pelarut yang kurang tepat,
maka penelitian ini belum mampu menghasilkan kadar titanium dioxide yang
32
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
transisi yakni keadaan yang dapat mengikat unsure klor lebih banyak terikat pada
senyawa FeCl. Apalagi keadaan transisi sering dialami oleh senyawa anorganik.
Maka seharusnya penelitian ini memerlukan perlakuan awal seperti proses fisik.
Dan secara kimia dengan menentukan zat antara reaksi.
Selain itu ke tidak tersedianya fasilitas penjaga suhu (termokopel) di
dalam laboratorium juga perengaruh dalam variabel yang dijalankan oleh peneliti,
karena termokopel dibutuhkan untuk menjaga kestabilan suhu sesuai dengan
BAB V
KESIMPULAN DAN SARAN
V.1. Kesimpulan
1. Dari hasil penelitian yang sudah dilakukan titanium dioxide dapat
dihasilkan karena sebelum diekstraksi kita melakukan pengurangan
kandungan Fe dengan cara pemagnetan dan roasting pasir. Juga
menggunakan asam klorida 32% sebagai pelarut yang efektif untuk
mengikat Fe menjadi FeCl2.
2. Peningkatan titanium dioxide pada penelitian ini berkisar antara 21 – 28%
berat dari kadar analisa awal. Jadi pada setiap 15 gram sampel yang kami
pakai untuk penelitian kandungan titanium yang dihasilkan berkisar antara
2-4 gram dari rata – rata berat sampel filtat hasil yang telah diekstraksi
seberat 12 gram. Peningkatan kadar titanium dioxide yang tidak siknifikan
dapat disebabkan oleh perbedaan keelektronegatifan antara atom- atom
yang berikatan. Meskipun atom H dan Cl sama – sama menarik pasangan
elektron ikatan , tetapi perbedaan keelektronegatifan lebih besar dari pada
atom H dan mengakibatkan atom Cl menarik pasangan elektron ikatan
lebih kuat dari pada atom H. Dengan didasari dari asas Le Chatelier
dengan pernyataan bahwa adanya ion sejenis akan mempengaruhi
kelarutan dari ion sejenis. Dan perubahan dari keadaan kesertimbangan
semula ke keadaan kesetimbangan yang baru akibat adanya aksi atau
pengaruh dari luar itu disebut dengan pergeseran kesetimbangan.
34
Recovery logam Titanium Dioxide (TiO2 ) Dari
Limbah Proses Pengambilan Biji Besi
direcovery dan produk apa yang dihasilkan dari recovery serta faktor-
faktor apa saja yang mempengaruhi proses recovery. Recovery dari
penelitian in menghasilkan produk yang sangat kecil. Karena reaksi
mengalami keadaan yang sangat kompleks yakni akibat memberikan asam
klorida yang berlebih, reaksi ini mengalami keadaan transisi. Dari
perhitungan juga didapat Ksp FeCl2 yang terlarut dalam asam klorida
sebesar 1,0683 x 10-12. Dan Ksp TiCl4 yang kemungkinan terlarut dalam
asam klorida sebesar 2.124 x 10-11. Di duga dengan Ksp TiCl4 yang lebih
kecil dari FeCl2 , senyawa TiCl4 senyawa ini lebih mudah terbentuk dalam
reaksi ini namun besar atau kecilnya TiCl4 yang terbentuk dengan asam
klorida tergantung kondisi pelarut tersebut, jenuh atau tak jenuh.
4. Selain itu perlunya penjaga suhu ( termokopel) juga diperlukan untuk
menjaga suhu sesuai dengan yang dibutuhkan, dikarenakan dapat
V.2. Sar an
Pengaplikasian untuk penelitian ini yang terpenting adalah melakukan
treatmen secara fisik maupun kima, seperti melakukan pemagnetan dan roasting
untuk mengurangi kadar besi yang terlalu banyak dalam limbah pasir besi dan
treatmen trersebut dapat dilakukan pada sample sebelum atau sesudah proses
berlangsung dengan tujuan untuk memperbesar kandungan dari titanium dioxide
tersebut. Serta pentingnya untuk memperhatikan besarnya kecepatan dari motor
pengaduk yang digunakan agar proses pengadukan tersebut berlangsung secara
optimal, dengan harapan dapat diperoleh kadar titanium dioxide sesuai dengan
Recovery logam Titanium Dioxide (TiO2) Dari
Limbah Proses Pengambilan Biji Besi
DAFTAR PUSTAKA
Campbell,F.C. (2006).” Manufacturing Technology for Aerospace Structural
Materials “(edisi ke-1st).
Lalasari, Latifa Hanum, 2010, “Pengoahan Sumber Daya Pr imer (Mineral)”,
P3M LIPI
http://www.chem-is-try.org/materi_kimia/kimia-industri/teknologi-proses/ekstraksi
http://blogger.com/Titanium Dioxida (TiO2) Fotokatalis (photocatalist) Yang
Potensial _ Curvate
http://id.wikipedia.org/wiki/Asam_klorida
http://id.wikipedia.org/wiki/ilmenit
http://id.wikipedia.org/wiki/Titanium
http://www.lipi.go.id/www.cgi?proyek&1264061640&1&&1036006099&2011
http://pertambangan-geologi.blogspot.com/2011/03/potensi-pasir-besi-dibanten.html
http://www.patentgenius.com/patent/6699446.html
http://www.ugm.ac.id/index.php?page=rilis&artikel=1371
Petrucci, Ralph H. 1985 .” Kimia Dasar : Prinsip Dan Terapan Modern”.
Zulfalina, Manaf, Azwar, 2004, “Identifikasi Senyawa Mineral dan Ekstraksi