Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB
SKRIPSI
diajukan untuk memenuhi sebagian dari syarat memperoleh gelar Sarjana Sains Jurusan Pendidikan Biologi
Program Studi Biologi
disusun oleh:
Nur Rahim Rabbani NIM. 1006883
PROGRAM STUDI BIOLOGI JURUSAN PENDIDIKAN BIOLOGI
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
UNIVERSITAS PENDIDIKAN INDONESIA 2014
Kinetika Pertumbuhan dan Isolasi Genomik Konsorsium Bakteri Hydrothermal Vent Kawio Menggunakan Medium Modifikasi LB
Oleh
Nur Rahim Rabbani
1006883
Sebuah skripsi yang diajukan untuk memenuhi salah satu syarat memperoleh gelar Sarjana Sains pada Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam
@Nur Rahim Rabbani 2014
Universitas Pendidikan Indonesia
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Hak Cipta dilindungi undang-undang
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
LEMBAR PENGESAHAN
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB
Oleh:
Nur Rahim Rabbani NIM. 1006883
DISETUJUI DAN DISAHKAN OLEH:
Pembimbing I
Dr. Topik Hidayat, M. Si. NIP. 197004101997021001
Pembimbing II
Dr. Hj. Widi Purwianingsih, M. Si. NIP. 196209621991012001
Pembimbing III
Elvi Restiawaty, ST. Ph.D. NIP. 1975072720010122001
Mengetahui,
Ketua Jurusan Pendidikan Biologi
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
ABSTRAK
Indonesia merupakan negara yang memiliki banyak daerah dengan aktivitas geotermal salah satunya laut dalam kawasan hydrothermal vent kepulauan Kawio Sulawesi Utara. Daerah ini merupakan salah satu tempat keragaman bakteri termofilik yang berpotensi dengan enzim termostabilnya. Penelitian mengenai kinetika pertumbuhan dan isolasi genom dari konsorsium bakteri asal perairan laut dalam kawasan hydrothermal vent Kawio Sulawesi Utara telah dilakukan. Tujuan penelitian ini adalah untuk mengetahui kinetika pertumbuhan dan hasil isolasi genom dari konsorsium bakteri termofilik menggunakan medium modifikasi Luria Bertani.Pengamatan pertumbuhan bakteri dilakukan selama 24 jam dengan pengecekan setiap 2 jam sekali. Setelah diketahui waktu pertumbuhan bakteri yang optimum, dilakukan isolasi genom. Metode isolasi genom yang dilakukan yaitu metode isolasi kloroform isoamil alkohol dengan beberapa modifikasi. Hasil menunjukkan bahwa bakteri ini memiliki nilai OD maksimum sebesar 0,576 dengan berat kering sel 6 g/l. Fase logaritmik pertumbuhan bakteri ini terjadi pada waktu pertumbuhan jam ke 2 sampai dengan jam ke 12. Nilai laju pertumbuhan spesifik (µ) bakteri ini adalah 0,2 jam-1. Hasil kuantitatif dari isolasi genom mencapai rasio 1,294 dengan konsentrasi 52,5 ng/µl.
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
ABSTRACT
Indonesia is a country that has many areas with geothermal activity, one of thedeep-sea hydrothermal vent area is Kawio North Sulawesi islands. This area is one of the potential diversity of thermophilic bacteria with thermostable enzymes. Study of kinetics of growth and genomic isolationof consortium marine bacterial from hydrothermal vent area, Kawio North Sulawesi has been done. The purpose of this study was to determine the kinetics of growth and result of genomic isolation from thermophilic bacteria using a modified Luria Bertani medium. The observation of bacteria growth has been done for 24 hours and has been checked in every 2 hours. After the optimum time of bacteria growth was found, then the isolation of the genome was done. Genome isolation method was performed by the isolation method of chloroform isoamyl alcohol with some modifications. The results showed that the bacterium had a maximum OD value with 0.576 and dry weight of cells 6 g/l. Logarithmic phase of bacterial growth occured in the growth time of 2nd hours until 12nd. The specific value of growth rate (μ) of this bacterium is 0.2 hours-1. Quantitative results from isolation of genomic reachedthe ratio 1.294and the concentration52,5 ng / ml .
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... iii
BAB I PENDAHULUAN ... 1
A. LatarBelakang ... 1
B. RumusanMasalah ... 5
C. Batasan Masalah... 6
D. Tujuan Penelitian ... 6
E. ManfaatPenelitian ... 6
BAB II KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK BAKTERI TERMOFILIK HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LURIA BERTANI .... 7
A. Kinetika Pertumbuhan Bakteri ... 7
B. Bakteri Termofilik ... 11
1. Suhu Pertumbuhan Bakteri Termofilik ... 12
2. Habitat Bakteri Termofilik ... 14
3. Struktur Bakteri Termofilik ... 15
4. Pemanfaatan Bakteri Termofilik ... 18
C. Konsorsium Bakteri ... 20
D. Hydrothermal Vent Kawio ... 21
E. Medium Luria Bertani – Magnesium Sulfat ... 24
1. Luria Bertani ... 24
2. Magnesium Sulfat ... 25
F. Genom ... 27
G. Isolasi DNA Genom ... 29
H. Elektroforesis ... 34
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
A. JenisPenelitian ... 38
B. Subjek dan Sampel Penelitian ... 38
C. Waktu dan LokasiPenelitian ... 38
D. AlatdanBahan ... 38
E. Prosedur Penelitian... 39
1. Tahap Persiapan ... 39
2. Tahap Penelitian ... 39
a. Enrichment ... 39
b. Pengukuran Optical Density (OD) ... 40
c. Analisa Kadar Biomassa ... 40
d. Isolasi Genom Bakteri ... 41
e. Uji Kemurnian ... 41
f. Elektroforesis Gel Agarosa ... 42
g. Analisis Data ... 44
F. Alur Penelitian ... 45
BAB IV HASIL DAN PEMBAHASAN ... 46
A. Kinetika Laju Pertumbuhan ... 46
B. Isolasi DNA Genom dan Spektrofotometer ... 52
C. Elektroforesis Hasil Isolasi Genom ... 55
BAB V KESIMPULAN DAN SARAN ... 57
A. Kesimpulan ... 57
B. Saran ... 57
DAFTAR PUSTAKA ... 58
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
DAFTAR TABEL
Tabel Halaman
2.1 Hidro-oseanografi Perairan Hydrothermal Vent Kawio ... 23
2.2 Makroelemen dan Fungsi Fisiologisnya ... 26
4.1 Perbandingan Nilai OD dengan Berat Basah dan Berat Kering Sel dari
Konsorsium Bakteri Hydrothermal Vent Kawio ... 50
4.2 Hasil Spektrofotometer DNA Genom Konsorsium Bakteri
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
DAFTAR GAMBAR
Gambar Halaman
2.1 Fase Pertumbuhan Bakteri ... 9
2.2 Struktur Sel Bakteri ... 12
2.3 Hubungan Suhu dan Pertumbuhan pada Kelompok Mikroorganisme dengan Temperatur yang Berbeda ... 13
2.4 White Smokersmuncul dari Celah Kerak Bumi di Dasar Laut ... 21
2.5 Black Smokersmuncul dari Celah Kerak Bumi di Dasar Laut ... 21
2.6 Lokasi Ekspedisi Index Satal Hydrothermal Vent Kawio Sulawesi Utara 23 2.7 Struktur Genom ... 28
2.8 Fasa Atas, Interfasa dan Fasa Bawah ... 31
2.9 Proses Elektroforesis Gel Agarose ... 34
3.1 Sampel Air Laut Dalam Kawasan Hydrothermal Vent Kawio Sulawesi Utara ... 39
3.2 Alur Cara Kerja Enrichment ... 40
3.3 Alur Cara Kerja Analisis Kadar Biomassa... 41
3.4 Alur Cara Kerja Isolasi Genom ... 42
3.5 Alat untuk Elektroforesis ... 43
3.6 UV Transilluminator ... 44
3.7 Diagram Alur Penelitian ... 45
4.1 Kurva Pertumbuhan Konsorsium Bakteri Hydrothermal Vent Kawio ... 46
4.2 Kurva Berat Kering Sel dan Berat Basah Sel dari Konsorsium Bakteri Hydrothermal Vent Kawio ... 52
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
BAB I PENDAHULUAN
A. Latar Belakang
Selama beberapa dekade ini, manusia beranggapan laut dalam itu merupakan
lingkungan yang tidak layak huni untuk berbagai jenis organisme. Hal ini
disebabkan antara lain tidak terdapatnya cahaya matahari yang masuk dan
kandungan oksigen yang sangat rendah (Rositasari, 1992). Namun, dalam
beberapa tahun terakhir ini pendapat-pendapat tersebut mulai berubah setelah
beberapa peneliti geologi pada tahun 1977 secara tidak sengaja menemukan
keajaiban alam di kawasan hydrothermal vent, berupa oasis makhluk hidup pada
kedalaman 2600 meter di bawah permukaan laut (Felbeck, 1981). Penemuan laut
dalam hydrothermal vent di sepanjang Pasifik Timur itu telah secara signifikan
mengubah pandangan terhadap laut dalam yang sudah lama dikenal dengan
dingin, gelap, bertekanan tinggi dan lingkungan yang miskin hara (Corliss et al.,
1979).
Indonesia merupakan salah satu negara yang memiliki laut dalam
kawasanhydrothermal vent yang berlokasi di kepulauan Kawio provinsi Sulawesi
Utara. Pulau Kawio telah dijadikan sebagai tempat ekspedisi karena terbilang unik
secara tektonik dimana tidak banyak daerah di dunia yang mempunyai
karakteristik seperti ini. Wilayah ini merupakan pertemuan dua jalur gunung api
besar di dunia dan pertemuan jalur gempa wilayah timur dan pasifik. Selain itu
juga wilayah ini merupakan wilayah laut dalam yang belum banyak dieksplorasi
potensinya (BPPT, 2010). Eksplorasi ini berhasil mengungkap adanya kehidupan
yang unik di kedalaman lebih dari 4.000 meter di bawah laut. Pada kedalaman
1.900 meter di bawah laut Sangihe telah diketahui keberadaan sebuah gunung api
aktif setinggi 3.200 meter. Gunung api tersebut membentuk sebuah kawasan
komunitas baru di areal geotermal. Banyak mikroorganisme termofilik dan
hipertermofilik yang hidup di laut dalam hydrothermal vent termasuk bakteri dan
2
Bakteri termofilik selain banyak ditemukan di air panas daerah pegunungan,
juga terdapat di lautan, tepatnya laut dalam kawasan hydrothermal vent. Beberapa
kondisi lingkungan yang berbeda dalam setiap lokasi memungkinkan adanya
heterogenitas bakteri termofilik yang tinggi. Hingga saat ini, lebih dari 70 genus
dan 140 spesies termofil telah diisolasi dari berbagai lingkungan termis (George,
2001; Adiguzel et al., 2010). Eksplorasi terhadap bakteri-bakteri termofilik yang
berasal dari kawasan ini masih sangat terbatas sehingga perlu adanya penelitian
lebih lanjut agar potensi bakteri di kawasan hydrothermal vent ini dapat
dimanfaatkan dengan baik.
Penelitian mengenai bakteri termofilik saat ini cukup menarik untuk
dilakukan. Sifat termofilik yang terdapat dalam bakteri ini merupakan fenomena
yang unik karena kemampuannya untuk hidup pada temperatur yang relatif tinggi,
juga kemampuan beradaptasinya dalam lingkungan ekstrim (Kato et al., 1995).
Pemanfaatan bakteri termofilik misalnya yaitu sebagai sumber enzim tahan panas.
Mikroorganisme termofilik mampu mensintesis molekul stabil pada kondisi
panas, termasuk molekul enzim. Faktor utama yang paling merusak enzim adalah
suhu. Enzim dari mikroorganisme ini mendukung untuk bekerja di bawah kondisi
normal dimana enzim dari mikroorganisme mesofilik akan mengalami denaturasi.
Enzim tahan panas atau enzim termostabil banyak dieksplorasi dalam dasawarsa
terakhir karena perannya yang sangat luas dan penting bagi pengembangan ilmu
dasar maupun industri. Enzim termostabil memiliki beberapa keunggulan
dibanding enzim termolabil karena penerapannya umumnya memiliki kestabilan
yang lebih tinggi dan ketahanan yang cukup baik terhadap zat-zat kimia serta
lebih mudah diisolasi. Hal ini berkaitan dengan keuntungan yang akan diperoleh
bila proses produksi dilakukan pada suhu tinggi, diantaranya mengurangi
kontaminasi, meningkatkan kecepatan transfer massa dan menurunkan viskositas
dari larutan. Aplikasi pada bidang bioteknologi dan industri seperti dalam
teknik-teknik biologi molekuler untuk kegunaan penelitian dan diagnostik (enzim yang
memproses DNA dan RNA) dan kemampuan enzim mengubah tepung, makanan,
pengelolaan sampah, sintesis organik, pembuatan kertas dan industri kulit.
3
model untuk penelitian dan penyelidikan protein-protein yang bersifat termostabil
dan kemampuannya sebagai biokatalis pada bioteknologi modern(Andrade C.,
1999; Kamelia T., 2005; Madigan et al., 2009; Suhartono M.T., 2000).
Untuk memanfaatkan dan mempelajari potensi enzim termostabil bakteri
termofilik, tahap awal yang perlu dilakukan yaitu mengisolasi DNA genom. Asam
deoksiribonukleat (DNA) merupakan persenyawaan kimia yang paling penting
pada makhluk hidup, yang membawa keterangan genetik dari sel khususnya atau
dari makhluk dalam keseluruhannya dari satu generasi ke generasi berikutnya.
DNA sangat menarik perhatian para Biologiwan modern dalam abad ini. Hal ini
disebabkan karena DNA sangat erat hubungannya dengan hampir semua aktivitas
biologi (Suryo, 2005). Genom adalah keseluruhan informasi genetik yang dimiliki
suatu sel atau organisme, atau khususnya keseluruhan asam nukleat yang memuat
informasi tersebut (Alberts et al., 2002). Konstruksi pustaka genom dan
pengklonan DNA membutuhkan DNA yang utuh agar fragmen DNA betul-betul
berasal dari proses pemotongan enzimatik yang sangat spesifik. Bila terpotongnya
DNA bukan karena reaksi enzimatik, maka fragmen DNA tersebut sulit
disambungkan dengan DNA dari vektor pengklonan. Oleh sebab itu isolasi DNA
genom yang utuh sangat diperlukan bila DNA tersebut akan diproses untuk
pengklonan (Suharsono dan Widyastuti, 2006). Kemurnian dan kualitas DNA
yang diperoleh dari tahap ini akan sangat menentukan dalam penelitian-penelitian
biologi molekuler. Tiga langkah utama dalam isolasi DNA adalah perusakan
dinding sel atau lisis, pemisahan DNA dari bahan padat seperti selulosa dan
protein, serta pemurnian DNA. Ada beberapa hal yang perlu diperhatikan dalam
proses isolasi DNA antara lain harus menghasilkan DNA tanpa adanya
kontaminan seperti protein dan RNA, metodenya harus efektif dan bisa dilakukan
untuk semua spesies, metode yang dilakukan tidak boleh mengubah struktur dan
fungsi molekul DNA serta metodenya harus sederhana dan cepat (Surzycki,
2000).
Pengujian kuantitatif dan kualitatif isolat DNA dapat dilakukan dengan
pengukuran menggunakan spektrofotometer UV dan elektroforesis gel agarosa.
4
panjang gelombang sinar UV 260 nm akan menangkap molekul DNA sehingga
terukur nilai arbsorbansinya. Uji kualitatif dengan gel agarosa dapat mengukur
kualitas kemurnian DNA, dimana konsentrasi gel agarosa yang digunakan
berbanding terbalik dengan panjang/pendeknya pita DNA atau bentuk struktur
DNA. Makin pendek urutan basa DNA-nya maka konsentrasi gelnya tinggi.
Struktur DNA sirkuler lebih ringan dibanding DNA linier (Fatchiyah, 2011).
Informasi mengenai kinetika pertumbuhan dapat digunakan untuk
menentukan waktu isolasi DNA genom. Pertumbuhan bakteri mengacu pada
pertambahan total massa sel. Pertambahan massa bakteri berbanding lurus dengan
pertambahan komponen seluler yang lain seperti DNA (Deoxyribosa Nucleotida
Acid), RNA (Ribosa Nucleotida Acid) dan protein (Pelczar & Chan, 2005). Untuk
mendapatkan waktu panen bakteri yang optimal, maka perlu diketahui kinetika
pertumbuhan suatu bakteri.Pertumbuhan bakteri dapat diukur dengan melihat
kenaikan biomassa atau jumlah sel. Pertumbuhan bakteri biasanya mengikuti
suatu pola pertumbuhan tertentu berupa kurva pertumbuhan sigmoid. Studi
mengenai kinetika pertumbuhan kultur bakteri dapat digunakan untuk menduga
efisiensi biaya produksi dalam sekala besar. Selain itu setiap bakteri akan
menunjukkan perbedaan pola pertumbuhan, periode waktu yang dibutuhkan untuk
tumbuh maupun beradaptasi, dan metabolit yang dihasilkan. Kinetika
pertumbuhan dapat memberikan informasi tentang kecepatan produksi biomasa
sel dan pengaruh lingkungan terhadap kecepatan pertumbuhan (Pramono et al.,
2003).
Untuk menumbuhkan dan mempelajari sifat-sifat suatu bakteri diperlukan
suatu substansi yang sudah diatur komposisi nutrisinya, yaitu berupa medium.
Laju pertumbuhan bakteri dipengaruhi oleh kondisi lingkungan medium
pertumbuhan tersebut. Medium yang sesuai akan mengoptimalkan pertumbuhan
bakteri.Semua bentuk kehidupan, mulai dari jasad renik (mikroorganisme) sampai
manusia mempunyai persamaan dalam persyaratan nutrisi tertentu dalam bentuk
zat-zat kimia yang diperlukan untuk pertumbuhan dan fungsinya yang normal
(Lestari, 1998). Namun perlu diketahui jenis-jenis nutrisi yang disyaratkan oleh
5
pertumbuhannya. Berbagai macam jenis media tersedia dan dikenal untuk isolasi,
identifikasi dan pemeliharaan bakteri (Cowan, 1975; Collin & Lyne, 1987),
namun tidak semua media dapat mendorong pertumbuhan bakteri. Bakteri sangat
beragam, baik dalam persyaratan nutrisinya maupun fisiknya, beberapa ada yang
mempunyai persyaratan nurtisi yang sederhana adapula yang mempunyai
persyaratan yang agak rumit.
Luria Bertani (LB) adalah medium cair yang paling umum digunakan untuk
menumbuhkan berbagai jenis bakteri (Peanut, 2013). LB digunakan sebagai
media pertumbuhan karena sangat efisien dalam merangsang pertumbuhan dan
cocok untuk berbagai mikroorganisme. Resep pembuatan LB sering diubah atau
dimodifikasi tergantung pada bakteri dan kondisinya. Menurut Restiawaty (2013),
penambahan MgSO4 pada media pertumbuhan dapat meningkatkan pertumbuhan
bakteri asal perairan hydrothermal vent Kawio. Oleh karena itu dalam peneitian
ini digunakan LB dengan penambahan MgSO4 sebagai medium pertumbuhan.
Berdasarkan uraian tersebut maka penelitian ini dimaksudkan untuk
mengetahui kinetika pertumbuhan dan hasil isolasi genom bakteri konsorsium dari
air laut dalam kawasan hydrothermal vent Kawio pada medium modifikasi LB.
B. Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan di atas, dapat dirumuskan masalah dari penelitian ini, yaitu: “Bagaimana kinetika pertumbuhan dan hasil isolasi genomik konsorsium bakteri asal perairan hydrothermal vent Kawio pada medium modifikasi LB?”
Dari rumusan masalah tersebut dapat dituliskan pertanyaan penelitian,yaitu:
1. Bagaimana kurva pertumbuhan konsorsium bakteri hydrothermal vent Kawio
yang ditumbuhkan pada medium modifikasi LB?
2. Berapakah nilai laju pertumbuhan spesifik dari konsorsium bakteri
hydrothermal vent Kawio yang ditumbuhkan pada medium modifikasi LB?
3. Bagaimana hasil isolasi DNA genom secara kuantitatif dan kualitatif dari
konsorsium bakteri hydrothermal vent Kawio yang ditumbuhkan pada
6
C. Batasan Masalah
Agar permasalahan dalam penelitian ini terfokus pada hal yang diharapkan,
ruang lingkup dibatasi pada:
1. Sampel bakteri yang diujikan dalam penelitian ini diambil dari laut dalam
kawasan hydrothermal vent kepulauan Kawio provinsi Sulawesi Utara yang
telah tersedia di PAU ITB.
2. Konsentrasi MgSO4 yang ditambahkan dalam medium Luria Bertani yaitu
sebanyak 0,5%.
3. Konsorsium bakteri yang diisolasi merupakan konsorsium bakteri termofilik
yang bersifat aerob.
D. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui kinetika laju pertumbuhan
dan mengisolasi DNA genom konsorsium bakteri dari perairan hydrothermal vent
Kawio menggunakan medium modifikasi LB, yang dapat dirinci sebagai berikut:
1. Mengetahui kurva pertumbuhan konsorsium bakteri hydrothermal vent
Kawio yang ditumbuhkan pada medium modifikasi LB.
2. Mengetahui laju pertumbuhan spesifik dari konsorsium bakteri hydrothermal
vent Kawioyang ditumbuhkan pada medium modifikasi LB.
3. Mengetahui hasil isolasi genom konsorsium bakteri termofilik hydrothermal
vent Kawio secara kuantitatif dan kualitatif yang ditumbuhkan pada medium
modifikasi LB.
E. Manfaat Penelitian
Manfaat dari penelitian ini adalah memberikan informasi mengenai pengaruh
lingkungan dan kecepatan pertumbuhan konsorsium bakteri laut dalam
hydrothermal vent Kawio pada medium modifikasi LB. Hasil isolasi genom yang
didapatkan dapat digunakan sebagai acuan untuk penelitian lebih lanjut seperti
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini merupakan penelitian murni yang dilakukan dengan metode
deskriptif, yaitu suatu metode penelitian untuk membuat deskripsi, gambaran atau
lukisan secara sistematis, faktual, dan akurat mengenai fakta-fakta, sifat-sifat,
serta hubungan antar fenomena yang diselidiki (Nazir, 1988).
B. Subjek dan Sampel Populasi
Populasi pada penelitian ini adalah konsorsium bakteri yang berasal dari
perairan laut dalam kawasan hydrothermal vent Kawio provinsiSulawesi Utara.
Sampel air laut yang digunakan diambil dari perairan hydrothermal vent
kedalaman 1500 – 3000 m dengan tekanan 317 atm. Temperatur kawasan ini
berkisar 25 – 80oC dan keadaan pH 2,8 – 6,5 dengan salinitas sekitar 35 – 40 ppt.
Jenis sampelnya merupakan campuran dari air laut dengan sedikit sediemen.
C. Waktu dan Lokasi Penelitian
Waktu penelitian ini dimulai dari bulan Maret 2014 sampai bulan September
2014. Penelitian ini dilakukan di Laboratorium Rekayasa Genetika,Pusat
Penelitian Pangan, Kesehatan, Obat-obatan dan Kesehatan, gedung Pusat Antar
Universitas Institut Teknologi Bandung dan Laboratorium Mikrobiologi Fakultas
Pendidikan Matematika dan Ilmu Pengetahuan Alam Universitas Pendidikan
Indonesia.
D. Alat dan Bahan
Alat dan bahan yang digunakan dalam penelitian ini terdapat di Laboratorium
Rekayasa Genetika, gedung Pusat Antar Universitas Institut Teknologi Bandung
39
Pengetahuan Alam Universitas Pendidikan Indonesia. Daftar alat dan bahan dapat
dilihat pada Lampiran 1.
E. Prosedur Penelitian 1. Tahap Persiapan
Persiapan penelitian meliputi sterilisasi alat dan bahan, pembuatan larutan
stok untuk medium, isolasi genom dan elektroforesis. Medium tumbuh yang
digunakan adalah medium Luria Bertani yang dimodifikasi. Alat-alat yang
digunakan dicuci terlebih dahulu dan dikeringkan kemudian dibungkus. Setelah
itu disterilisasi panas lembab dengan cara diautoklaf selama 15-20 menit pada
suhu 121oC.
2. Tahap Penelitian a. Enrichment
Sampel air laut dalam (Gambar 3.1.) telah diambil dari kawasan
hydrothermal vent Kawio. Sampel yang dikumpulkan berupa air laut dan
jumlahnya terbatas. Maka untuk memperkaya sampel dan menghindari terjadinya
degradasi jumlah bakteri, dilakukan metode pengayaan (enrichment).
Gambar3.1. Sampel Air Laut Dalam Kawasan Hydrothermal Vent Kawio Sulawesi Utara
(Sumber: Dokumentasi Pribadi, 2014)
Pengayaan dilakukan dengan menggunakan medium Luria Bertani (LB) +
0,5% MgSO4. Sebanyak 10% sampel air laut dalam Kawio ditambahkan ke dalam
40
flow untuk mencegah adanya kontaminasi. Kemudian diinkubasi dalam inkubator
shaker dengan kecepatan 175 rpm dan suhu 60oC.Setelah inkubasi overnight atau
hingga sampel terlihat keruh, sebanyak 10% sampel hasil inkubasi diinokulasikan
kembali ke dalam 50 ml medium LB + 0,5% MgSO4dengan inkubasi pada
keadaan yang sama. Baru setelah itu sampel hasil inkubasi diperbanyak dengan
menginokulasikan 10% sampel ke dalam 250 ml medium LB + 0,5% MgSO4
yang kemudian digunakan untuk pengamatan dengan inkubasi pada keadaan yang
sama.Alur pengerjaan proses enrichment dapat dilihat padaGambar 3.2.
Gambar3.2. Alur Cara Kerja Enrichment
b. Pengukuran Optical Density (OD)
Pengukuran OD dilakukan dengan metode langsung berdasarkan turbiditas.
Alat yang digunakan yaitu spektrofotometer. Pengecekan OD dilakukan setiap 1 -
2 jam sekali dengan cara 1 ml sampel dimasukkan ke dalam kuvet. Panjang
gelombang yang digunakan yaitu 600 nm.
c. Analisa Kadar Biomassa
Biomassa diukur berdasarkan berat kering sel. Sebanyak 1 ml sampel
dimasukkan ke dalam tabung eppendorf yang sebelumnya telah ditimbang
beratnya, kemudian disentrifugasi dengan kecepatan 14.000 rpm selama 15 menit.
Supernatan yang terbentuk dibuang dan pelet yang tersisa ditimbang untuk
41
atau beratnya konstan. Alur pengerjaan analisis kadar biomassa dapat dilihat
padaGambar 3.3.
Gambar 3.3. Alur Cara Kerja Analisis Kadar Biomassa
Berat kering sel dan berat basah sel(x) dihitung dengan rumus sebagai
berikut:
X (g/l) = Berat tabung berisi sel kering/basah (g) – berat tabung kosong (g) x 103
Volume sampel (ml)
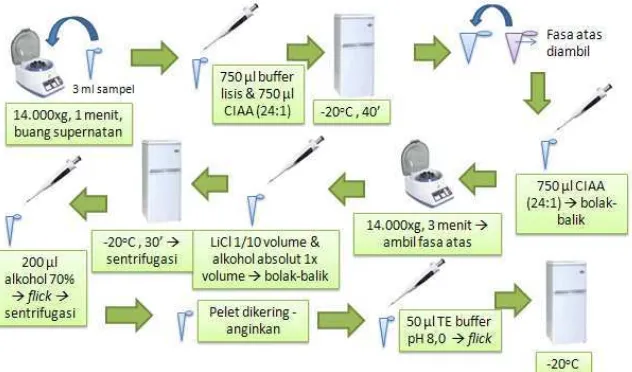
d. Isolasi Genom Bakteri
Isolasi genom bakteri ini mengacu pada metode kloroform isoamil alkohol
(Sambrook et al., 1989) dengan beberapa modifikasi pada beberapa langkah
proses isolasi. Sampel yang digunakan merupakan hasil inkubasi yang telah
diketahui waktu pertumbuhan optimumnya.
Pertama-tama dilakukan dengan sentrifugasi sampel untuk memisahkan sel
dengan medium. Sebanyak 3 ml sampel dimasukkan ke dalam tabung eppendorf
(masing-masing dua kali) kemudian disentrifugasi dengan kecepatan 14.000xg
selama 1 menit. Supernatan yang terbentuk dibuang sehingga hanya pelet yang
tersisa. Pelet hasil sentrifugasi ditambahkan 750 µl buffer lisis dan 750 µl
kloroform : isoamil alkohol (24:1), kemudian diresuspensi menggunakan tips
hingga tercampur rata. Hal ini dimaksudkan untuk melisiskan membran sel
bakteri agar isi selnya keluar. Setelah homogen kemudian disimpan dalam freezer
-20oC selama 40 menit. Setelah itu disentrifugasi 14.000xg selama 3 menit.
Setelah disentrifugasi, pada tabung terbentuk tiga lapisan, yaitu fasa atas,
tengah dan bawah. Fasa atas diambil dengan menggunakan tips dan dipindahkan
ke tabung baru dan ditambahkan 750 µl kloroform : isoamil alkohol. Tabung
42
14.000xg selama 3 menit. Fasa atas diambil dan dimasukkan ke tabung baru.
Ditambahkan LiCl sebanyak 1/10 volume dan alkohol absolut sebanyak 1x
volume lalu tabung dibolak-balik hingga homogen, kemudian disimpan di dalam
freezer -20oC selama 30 menit dan setelah itu disentrifugasi.
Setelah disentrifugasi dengan kecepatan 14.000xg selama 3 menit, supernatan
yang terbentuk dibuang hingga yang tersisa peletnya, kemudian ditambahkan 200
µl alkohol 70%. Flick menggunakan jari hingga homogen dan disentrifugasi
dengan kecepatan 14.000xg selama 3 menit. Selanjutnya supernatan yang
terbentuk dibuang dan peletnya dikeringkan pada suhu ruang untuk menguapkan
sisa-sisa etanol. Setelah itu dilarutkan dengan menambahkan 50 µl TE buffer pH
8,0 dan flick hingga homogen. Disimpan pada suhu -20oC. Alur pengerjaan proses
isolasi genom dapat dilihat pada Gambar 3.4.
Gambar 3.4. Alur Cara Kerja Isolasi Genom
e. Uji Kemurnian
Uji kemurnian dilakukan dengan menggunakan spektrofotometer. Kemurnian
DNA dapat diukur dengan menghitung nilai absorbansi 260 nm dibagi dengan
nilai absorbansi 280 nm (Å 260 / Å 280), sedangkan untuk mengukur konsentrasi
DNA digunakan rumus sebagai berikut:
[DNA] = Å 260 x 50 x faktor pengenceran
43
Å 260 = Nilai absorbansi pada 260 nm
50 = Larutan dengan nilai absorbansi 1,0 sebanding dengan 50 µg untai ganda
DNA per ml
f. Elektroforesis Gel Agarosa
Hasil isolasi DNA genom kemudian dilakukan runningdengan menggunakan
alat elektroforesis (Gambar 3.5.) dengan konsentrasi gel agarosa sebanyak 0,7%.
Sebelum melakukan elektroforesis, terlebih dahulu disiapkan gel agarosa untuk
dicetak pada cetakan gel yang telah dipasang sisir sebagai sumur. Gel agarose
yang baru dibuat atau dipanaskan didiamkan hingga hangat-hangat kuku
kemudian dituangkan ke dalam cetakan. Setelah gel sudah dingin atau beku
kemudian gel diletakkan pada kolom elektroforesis. Buffer TAE 1x dituangkan
dalam kolom elektroforesis hingga gel terendam. Line pertama pada sumur
dimasukkan 8 µl marker (ladder 1 kb DNA), line berikutnya diisi dengan 3 µl
sampel hasil isolasi genom yang dicampurkan dengan 2 µl loading dye. Setelah
itu tegangan dipasang 100 volt dengan waktu elektroforesis selama 25 menit.
Gambar 3.5. Alat untuk Elektroforesis (Sumber: Dokumentasi Pribadi, 2014)
Gel berisi DNA hasil running pada elektroforesis kemudian diambil dan
direndam dalam larutan Ethidium Bromide (EtBr) selama 3 menit, kemudian
44
pada UV transilluminator (Gambar 3.6.). Fragmen DNA yang muncul
didokumentasikan dengan menggunakan kamera digital.
Gambar 3.6. UV Transilluminator (Sumber: Dokumentasi Pribadi, 2014)
Hasil positif elektroforesis gel agarosa adalah munculnya pita yang berpendar
jika gel dilihat di bawah sinar UV. Hasil negatif elektroforesis gel agarosa adalah
tidak adanya pita yang berpendar jika gel agarosa dilihat di bawah sinar UV.
g. Analisis Data
Analisis data pada penelitian ini dimulai dengan membuat kurva pertumbuhan
dari nilai optical density (OD) yang diperoleh dari hasil pengamatan. Laju
pertumbuhan spesifik (µ) konsorsium bakteri dihitung dari data berat kering sel
(g/l) yang telah diperoleh per satuan waktu pada pengamatan laju pertumbuhan
konsorsium bakteri dengan menggunakan persamaan sebagai berikut:
µ = ln (Xt– X0)/ (t - t0)
Keterangan:
µ = Laju pertumbuhan spesifik (jam-1)
X = Konsentrasi biomassa (g/l)
t = Waktu pertumbuhan (jam)
DNA genom hasil isolasi dianalisis secara kualitatif dan kuantitatif. Secara
kualitatif dilakukan dengan elektroforesis pada gel agarosa dan secara kuantitatif
45
menghitung konsentrasi DNA. Data yang diperoleh kemudian dibahas sesuai
46
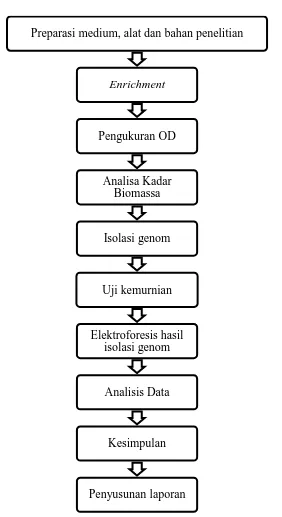
F. Alur Penelitian
Penjelasan mengenai prosedur penelitian dapat dilihat dalam bentuk diagram,
yaitu sebagai berikut:
Gambar 3.7. Diagram Alur Penelitian Preparasi medium, alat dan bahan penelitian
Enrichment
Pengukuran OD
Analisa Kadar Biomassa
Isolasi genom
Uji kemurnian
Elektroforesis hasil isolasi genom
Analisis Data
Kesimpulan
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian tentang kinetika pertumbuhan dan isolasi
genomik konsorsium bakteri asal perairan hydrothermal vent Kawio pada medium
modifikasi Luria Bertani, dapat disimpulkan bahwa:
1. Kurva pertumbuhan menunjukkan empat fase yang terdiri dari fase lag, fase
logaritma atau eksponensial, fase stasioner dan fase kematian. Fase logaritmik
terjadi dari waktu pertumbuhan jam ke-2 hingga jam ke-12. Nilai OD
maksimum mencapai 0,576 dengan berat basah dan berat kering sel
berturut-turut sebesar 57 g/l dan 6 g/l.
2. Laju pertumbuhan spesifik dari konsorsium bakteri termofilik hydrothermal
vent Kawio adalah 0,2 jam-1.
3. Secara kuantitatif pada hasil spektrofotometri yang telah dilakukan, rasio
konsorsium bakteri termofilik hydrothermal vent Kawio yang didapat yaitu
1,294 dengan konsentrasi 52,5 ng/µl. Sedangkan secara kualitatif DNA
genom diketahui memiliki ukuran lebih dari 10000 bp.
B. Saran
Berdasarka npenelitian yang telah dilakukan, saran untuk penelitian
selanjutnya yaitu perlu dilakukan PCR untuk mengidentifikasi enzim-enzim
termostabil yang potensinya dapat dimanfaatkan dalam berbagai bidang. Selain itu
disarankan jugapenelitian lebih lanjut mengenai karakteristik spesifik dari
konsorsium bakteri asal perairan hydrothermal vent Kawio selain ditinjau dari
segi kinetika pertumbuhannya. Untuk mendapatkan nilai kemurnian yang tinggi,
perlu adanya optimasi kembali dari metode isolasi genom yang telah dilakukan
Rabbani, Nur Rahim 2014
KINETIKA PERTUMBUHAN DAN ISOLASI GENOMIK KONSORSIUM BAKTERI HYDROTHERMAL VENT KAWIO MENGGUNAKAN MEDIUM MODIFIKASI LB Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
DAFTAR PUSTAKA
Adiguzel, A. et al. (2010). Molecular diversity of thermophilic bacteria isolated from Pasinler hot spring (Erzurum, Turkey). Turkey Journal Biology, 35, hlm, 267-274.
Alberts, B. et al. (2002). Molecular Biology of the Cell. (edisi keempat). New York: Garland Science.
Andrade C., Jr pereira N., Antranikian G. (1999). Extremely thermophilic microorganisms and their polymer hidrolytic enzymes. Rev de. Microbiol. 30, hlm. 287-298.
Andrade, C.,M.M.C Nei Pereira Jr., & G. Antranikian.(1999).Extremely thermophilic microorganisms and their polymerhidrolytic enzyme.(A reviews, Department of Technical Microbiology). Germany: Technical University Hamburg.
Ausubel, et al. (2003). Current protocols in Molecular Biology. United Kingdom: John Wiley & Sons Ltd.
Baig M.M.V., Big M.L.B., Yasmaen M. (2004). Saccharification of banana agrowaste by cellulolytic enzymes. Afr J. Biotechnol. 3, hlm. 447-450.
Bailey James E. and David F. Ollis. (1987). Biochemical Engineering Fundamentals. New York: McGraw-Hill Book Company.
Barnet, Margaret. (1997). Microbiology Laboratory Exercises. (edisi kedua). London: WM.C. Brown Publisher.
Bertani, G. (1952). Studies on Lysogenesis I. The mode of phage liberation by lysogenic Escherichia coli. Bacteriology, 62, hlm. 293-300.
Bertani, G. (2004). Lysogeny at mid-twentieth century: P1, P2, and other experimental systems. Bacteriology, 186, hlm. 595-600.
Bettelheim, F.A., & Landesberg, J. (1984). Laboratory Experiments for General, Organic, and Biochemistry. (edisi keempat). New Jersey: John Wiley and Sons Inc.
Birren, B. et al. (1997). Genome analysis: A Laboratory Manual Volume 1. Cold Spring Harbor Laboratory Press.
59
BPPT. (2010). Baruna Jaya IV mulai Berlayar lakukan Ekspedisi. [Online]. Diakses dari http://www.bppt.go.id/index.php/teknologi-sumberdaya-alam-dan-kebencanaan/489-baruna-jaya-iv-mulai-berlayar-lakukan-index-satal.
Brown, T.A. (2002). Genomes. (edisi kedua). Oxford: Wiley-Liss.
Büchel K. H. et al. (2000). Industrial Inorganic Chemistry. (edisi kedua). ISBN.
Campbell, N.A. et al. (2008). Biology. (edisi kedelapan). San Francisco: Pearson Benjamin Cummings.
Cappuccino, J.G. & Sherman, N (1987). Microbiology:A Laboratory Manual. California: The Benjamin Comings Publishing Company.Inc.
Collin, C.H and Lyne, P. M. (1987). Microbiological Method. (edisi kelima). London: Butterworths.
Corkill, G., Rapley, R. (2008). The Manipulation of Nucleic Acids: Basic Tools and Techniques. In: Molecular Biomethods Handbook. (edisi kedua). USA: Humana Press, NJ.
Corliss, J. B., et al. (1979).Submarine thermal springs on the Galapagos Rift. Science, 203, hlm.1073–1082.
Cowan, S.T. (1975). Cowan and Steel's Manual for Identification of Medical Bacteria. (edisi kedua). Cambridge: Cambridge University Press.
Cummings, B. (2006). Growth. [Online]. Diakses dari http://academic.pgcc.edu/~kroberts/Lecture/Chapter%206/growth.html.
D’Auria, S., F. La Cara, F. Nazzaro, N. Vespa, and M. Rossi. (1996). A thermophilic alcoholdehydrogenase from Bacillus acidocaldarius not reactive towards ketones. J. Biochem. 120, 498−504.
Dessy, C. S. (2008). Isolasi Bakteri dan Uji Aktivitas Amilase Termofil Kasar dari Sumber Air Panas Penen Sibirubiru Sumatra Utara. (Tesis). Medan: Universitas Sumatra Utara.
Dirnawan H. (1999). Isolasi bakteri termofil penghasil enzim hidrolitik ekstraseluler dari sumber air panas Gunung Pancar. (skripsi). Institut Pertanian Bogor.
Dwidjoseputro, D. (1985). Dasar-dasar Mikrobiologi. Malang: Djembatan.
Edwards C. (1990). Microbiology of Extreme Environments. New York: Mc Graw-Hill Publishing Company.
60
Fardiaz, S. (1998). Fisiologi Fermentasi. Bogor : Lembaga Sumberdaya Informasi, IPB.
Fatchiyah, et al. (2011). Biologi Molekular Prinsip Dasar Analisis. Jakarta: Erlangga.
Felbeck, H., et al. (1981). Calvin - Benson cycle and sulphid-oxidation enzymes in animals from sulphide-rich habitats.Nature, 293, hlm. 291 - 293.
Fikrinda. (2000). Isolasi dan karakterisasi bakteri penghasil selulase ekstermofilik dari ekosistem air hitam. (tesis). Institut Pertanian Bogor.
Frederick A. Bettelheim, Joseph Marvin Landesberg. (2007). Laboratory Experiments for General, Organic and Biochemistry. USA: Brooks
Gerhardt, P., R.G.E. Murray, W.A. Wood and N.R. Krieg. (1994). Methods for General and Molecular Bacteriology. Washington D.C.: ASM Press.
Gottschal, J.C., Harder W., & Prins R.A. (2000). Principles of Enrichment, Isolation, Cultivation, and Preservation of Bacteria. [Online]. Diakses dari http://rizzo.springer-ny.com:6336/dynaweb/verlagprok/prokbook/IDMATCH (CHP2NDED,6/@BrowserPrint__BookTextView/;uf=0;ts=chapters;cs=brwp rint.
Handelsman, J. (2004). Metagenomics: Application of Genomics to Uncultured Microorganisms. Microbiology and Molecular Biology, 68 (4), hlm. 669– 685.
Harahap E.S. (2007). Amplifikasi gen 16SrRNA bakteri termofilik dari kawah air panas, Gunung Pancar Bogor. (skripsi). Institut Pertanian Bogor.
Helin, et al. (2010). Identifikasi Fragmen Gen 16S rRNA Bakteri Termofilik Hasil Isolasi dari Air Panas Gedong Songo. (Laporan Penelitian).
Hoelzel A.R, et al. (1994). Rapid Evolution of aheteroplasmic repetitive in the Mitochondrial DNA Control Region of Carnivores. Microbiology and Molecular Biology. 39, hlm. 191-199.
Ibrahim ASS, El-diwany AI. (2007). Isolation and identification of new cellulases producing thermophilic bacteria from an Egyptian hot spring and some properties of the crude enzyme. J Appl Sci. 1, hlm. 473-478.
Index Satal. (2010). EM302 Multibeam Survey of the Sangihe‐Talaud Region, North Sulawesi, Indonesia NOAA Office of Ocean Exploration and Research. University of New Hampshire, Department of Earth Sciences.
61
Jeanthon, C. (2000). Molecular ecology of hydrothermal vent microbial communities. Antonie van Leeuwenhoek. Microbiology and Molecular Biology. 77, hlm. 117–133.
Joannefox. (2013). The Human Genome Project: The Impact Of Genome Sequencing Technology On Human Health. [Online]. Diakses dari http://www.scq.ubc.ca/the-human-genome-project-the-impact-of-genome-sequencing-technology-on-human-health/.
Jude, Brooke. (2012). Agarose Gel Electrophoresis (basic methode). Bard College.
Judoamidjojo, M., A.A. Darwis, dan E.G. Sa’id. (1990). Teknolologi Fermentasi. Rajawali Pers: Jakarta.
Kamelia, R., M. Sidumarta & D. Natalia. (2005). Isolasi dan Karakterisasi Protease Intraselular Termostabil dan Bakteri Bacillus stearothermophilus RP1.(Makalah Seminar Nasional MIPA). Jakarta: Universitas Indonesia.
Karina, dkk. (2010). Isolasi Bakteri Termofilik dari Sumber Air Panas di Songgoriti. (Prosiding Tugas Akhir Semester Genap). Institut Teknologi 10 November.
Karp, Gerald. (2008). Cell and Molecular Biology. (edisi kelima). Wiley.
Kathleen. (2008). Foundations in Microbiology. New York: Prentice Hall.
Kato, et al. (1999). Analyses of microbial diversity in the sediment obtained from Japan Trench at a depth of 7326 m and high pressure cultivation. Biology Molecular, 15, hlm. 47–52.
Keller, G. H dan Mark M. M. (1989). DNA Probe. Macmilan: University Michgan.
Kennedy J, Marchesi JR, and Dobson ADW. 2008. Marine Metagenomics: Strategies for the Discovery of Novel Enzymes with Biotechnological Applications from Marine Environments. Microbial Cell Factories, 7 (27).
Kimura. (2006). DNA repair in plants. Chemistry, 106, hlm. 753-766.
Lay, B.W. (1996). Analisis Mikroba di Laboratorium. Jakarta: Raja Grafindo Persada. Hal. 57-58, 109.
Lederberg, J. & McCray, A.T. (2001). Ome Sweet ‘Omics—A Genealogical Treasury of Words. The Scientist,15 (7), hlm. 8.
62
Leja, Darryl. (2013). National Human Genome Research Institute (NHGRI). [Online]. Diakses dari http://www.scimathmn.org/stemtc/frameworks/9431-genes-proteins.
Lennox, E.S. (1955). Transduction of linked genetic characters of the host by bacteriophage P1. Virology, 1, hlm. 190-206.
Lestari, Y. (1998). Persiapan dan Pengenalan Bahan Laboratorium Mikrobiologi. (Pelatihan Peningkatan Pengetahuan dan Keterampilan Teknisi Litkayasa Pertanian). Bogor: IPB.
Lewin, B. (2008). Genes IX (dalam bahasa Inggris). Sudbury: Jones and Bartlett Publishers.
Luria, S. E. & Burrous, J. W.. (1957). Hybridization between Escherichia coli and Shigella. J. Bacteriol. 74, hal. 461-476.
Madigan, M.T., J.M. Martinko, and J. Parker. (2009). Biology of Microorganisms. (edisi kedua belas). New York: Prentice Hall International.
Mangunwidjaja, D. dan A. Suryani. (1994). Teknologi Bioproses. Swadaya: Jakarta.
Maryanti, B. dan Ariesyady, H.D. (2009). Indentifikasi keberagaman bakteri pada commercial seed pengolah limbah cair cat. Institut Teknologi Bandung.
Mayende L., Wilhelmi B.S., Pletschke B.I.. (2006). Cellulase (CMCase) and polyphenol oxidase from thermophilic Bacillus spp. Isolated from compost. Soil Biol Biochem. 38, hlm. 2963-2966.
Middlebeek, E.J., R.O. Jenkins and J.S. Drijver-de Haas. (1992). Growth in batch culture. In Vitro Cultivation of Micro-organisms. Biotechnology by Open Learning.
Molecular Station. (2008). Southern Blot.
http://www.molecularstation.com/dna/southern-blot/.
Nandi. B., R. K. Nandy, S. Mukhopadhyay, G. B. Nair, T. Shimada, and A. C. Ghose1. (2000). Rapid Method for Species-Specific Identification of Vibrio cholerae Using Primers Targeted to the Gene of Outer Membrane Protein OmpW. Clinical Microbiology. 38, hlm. 4145–4151.
National Oceanic and Atmospheric Administration. (2010). Vents. [Online]. Diakses dari http://www.pmel.noaa.gov/vents/chemocean.html.
63
Nazir, M. (1998). Metode Penelitian. Jakarta: Ghalia Indonesia.
NIehaus F, Bertoldo, Kahler M, Antranikian G. (1999). Extremophiles as a source of novel enzymes for industrial application. Applied Microbiol Biotechnol. 51 (6), hlm. 711-729.
Ningrum, E. P. (2008). Keragaman Gejala dan Penyebab Penyakit Keriting Kuning Cabai. (Skripsi). Universitas Gadjah Mada.
Okoh, Al. (2006). Biodegradation alternative in the cleanup of petroleum hydrocarbon pollutants. Biotechnol. And Molecular Biology Review. 1, (2), hlm. 38-50.
Panikov N.S. (1995). Microbial Growth Kinetics. London: Chapman & Hall.
Peanut. (2013). Luria Bertani broth. [Online]. Diakses dari http://everything2.com/title/Luria-Bertani+broth.
Pearce, Evelyn C. (2002). Anatomi dan Fisiologi untuk Paramedis. Jakarta : Gramedia Pustaka Umum.
Pelczar, M.J. & Chan, E.C.S. (1986). Dasar-dasar Mikrobiologi. Jakarta: Penerbit Universitas Indonesia (UI-Press).
Pramono Y.B., Harmayani E., dan Utami T. (2003). Kinetika Pertumbuhan Lactobacillus plantarum dan Lactobacillus sp. pada Media MRS Cair. Jurnal Teknol. dan Industri Pangan. 14, (1), hlm. 46-50.
Pratiwi, S.T. (2008). Mikrobiologi Farmasi. Yogyakarta: Erlangga. Hal. 23,106-108,111-117,142.
Purwantara, A. (2001). Principles of DNA Isolation and Manipulation. (Workshop on Plant Pathogens Detection by Moleculae Tehniques).
Radjasa, O.K. 2004. Deep-Sea Bacteria and Their Biotechnological Potential. J. Of CoastalDevelopment. 7 (3), hlm. 109–118.
Restiawaty, E., Pertiwi, W., Insani, N., Aryantha, I.N.P., Natalia, D. (2013). Screening Bakteri untuk Biokonversi Limbah Biodiesel dari Diversitas Bakteri Indonesia. Seminar dan Pameran Inovasi dan Konstribusi Perempuan Peneliti ITB bagi Industri dan Masyarakat. Bandung, Indonesia.
Richardson, B. J, P. R. Baverstock and M. Adams. (1986). Allozyme Electro-phoresis. San Diego: Aca-demic Press.
Riesenfeld CS, Schloss PD, and Handelsman J. (2004). Metagenomics: Genomic Analysis of Microbial Communities. Annu. Rev. Genet. 38, hlm. 525–52.
64
Rondon, et al. (1999). Toward functional genomics in bacteria: analysis of gene expression in Escherichia coli from a bacterial artificial chromosome library of Bacillus cereus. Proc. Natl. Acad. Sci. USA. 96, hlm. 6451– 6455.
Rositasari. (1992). Keunikan Komunitas Sumur Hidrotermal. Oseana. 17 (1), hlm. 21 – 34.
Ryu S. & Yun J. (2005). Screening for novel enzymes from metagenome and SIGEX, as a way to improve it. Microbial Cell Factories. 4, hlm. 8.
Sa’id, E.G. (1987). Bioindustri Penerapan Teknologi Fermentasi. PT. Melton Putra: Jakarta.
Sambrook J, Fritsch EF, Maniati T. (1989). Molecular Cloning A Laboratory Manual. USA: Cold Spring Harbor Lab Press.
Sambrook, J., & Russel. (2001). Molecular Cloning-A Laboratory Manual. New York: Cold Spring Harbor Laboratory Press.
Sandro. (2012). Hyrothermal Vents Deep Oceanic Hotsprings. [Online]. Diakses dari http:// unpad.ac.id/ronasandro/2012/10/31/hydrothermal-vents-deep-oceanic-hotsprings/.
Sari W.W. (2008). Karakterisasi selulase bakteri asal tanah pertanian Jawa Tengah dan Jawa Barat. (skripsi Institut Pertanian Bogor.
Scearce, C. 2006. Hydrothermal Vent Communities. [Online]. Diakses dari http://www.csa.com/discoveryguides/discoveryguides-main.php.
Schloss, P. D., and J. Handelsman. (2003). Biotechnological prospects from metagenomics. Curr. Opin. Biotechnol. 14, hlm. 303–310.
Schmeisser, C., Steele, H., Streit, W. R. (2007). Metagenomics: Biotechnology with Non-Culturable Microbes. Journal of Applied. Microbiol Biotechnol. 75, hlm. 955–962.
Shuler Michael L. dan Fikret Kargi. (1992) Bioprocess Engineering Basic Concepts. New Jersey: Prentice-Hall International Inc.
Sleator RD, Shortall C, and Hill C. (2008). Metagenomics. Applied Microbiology. hlm. 361– 366.
Sterrit, R.M., J.N. Lester. (1988). Microbiology for Environmental and Public Health Engineers. London: E&FN Spon Ltd.
Suckale, Jakob. (2009). DNA extraction with phenol chloroform. [Online].
Diakses dari
65
Sudarsono. (1996). Retricsion Fragmen Length Polymorphism (RFLP). (Tugas Akhir). Institut Pertanian Bogor.
Suharsono dan Widyastuti, U. (2006). Penuntun Praktikum Pelatihan Teknik Pengklonan Gen. Pusat Penelitian Sumber Daya Hayati dan Bioteknologi. Institut Pertanian Bogor.
Suhartono, M.T. (2000). Exploration Of Indonesian Thermophiles Producing Thermostable Chitinolytic Enzymes.(Report, Research Center For Biotechnology). Bogor:IPB.
Suryo. (2005). Genetika. Yogyakarta: Gadjah Mada University Press.
Surzycki, S. (2000). Basic Techniques in Molecular Biology. Spinger-Verlag. Berlin. Heidelberg. New York. [Online]. Diakses dari
http://www.palmta.org/uploads/132561702960108human-Molecular-Biology-Manual.pdf
Susanti H.E. (2007). Isolasi dan optimasi flokulasi bakteri penghasil bioflokulan dari sumber perairan di daerah Bogor (skripsi). Institut Pertanian Bogor.
Sutarma. (2000). Kultur Media Bakteri. (Temu Teknis Fungsional non Peneliti). Bogor: Balai Penelitian Veteriner.
Sutiamiharja, N. (2008). Isolasi Bakteri dan Uji Aktivitas Amilase Kasar Termofilik dari Sumber Air Panas Gurukinayan Karo Sumatra Utara. (Tesis). Universitas Sumatra Utara.
Suyono et al. (2008). Isolasi bakteri termofilik asam laktat dari kawah air panas Gunung Pancar Bogor (laporan akhir PKM). Institut Pertanian Bogor.
Tjahjoleksono, A. (2009). Plasmid.[Online]. Diakses dari http://web.ipb.ac.id/tpb/files/materi/genetika/dnarekombinan/plasmid.pdf
Uchiyama, T., & Miyazaki, K. (2009). Functional Metagenomics for Enzyme Discovery. Challenges.
Uria AR, Fawzya YN, dan Chasanah E. (2005). Eksplorasi Enzim Mikroba dari Lingkungan Laut Melalui Pendekatan Metagenomika. WPPI, 11 (7), hlm. 17-24.
Van Dover, C. L. (2000). The Ecology of Deep-Sea Hydrothermal Vents. Princeton University Press. 424 pp.
Verkuil, et al. (2008). Principles and Technical Aspects of PCR Amplification. Berlin: Springer Science + Business Media.
66
Westerheide SD,and R.I Morimoto. (2005). Heat shock resonse modulators as therapeutic tools for disease of protein conformation. J. Biol Chem. 9, (5), 97-100.
Williams, M.P.M. & Liao, M.K. (2013). Luria Broth LB and Luria Agar LA media and their uses protocol. [Online]. Diakses dari http://www.microbelibrary.org/component/resource/laboratory-test/3031-luria-broth-lb-and-luria-agar-la-media-and-their-uses-protocol.