PENGARUH PANGAN YANG DICEMARI LOGAM BERAT TIMBAL (Pb) TERHADAP KADAR TIMBAL PADA CACING Lumbricus rubellus
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Jimmy Pieter Chua
NIM : 098114018
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
PENGARUH PANGAN YANG DICEMARI LOGAM BERAT TIMBAL TIMBAL (Pb) TERHADAP KADAR TIMBAL PADA CACING Lumbricus
rubellus
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Jimmy Pieter Chua
NIM : 098114018
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
“Jadilah seperti pohon yang ditanam ditepi aliran air, yang
menghasilkan buah pada musimnya, dan tidak layu daunnya, serta apa yang diperbuatnya pun berhasil ”
(Mazmur 1: 3)
Karya ini kupersembahkan untuk:
Bapak dan Ibu sebagai rasa syukur atas kasih sayang yang berlimpah, perhatian, semangat, dan dukungannya
Teman - teman
PRAKATA
Puji Syukur kepada Tuhan Yesus Kristus dan Bunda Maria berkat kasih
karunia-Nya sehingga penulis dapat menyelesaikan penelitian serta penyusunan skripsi
yang berjudul “Pengaruh Pangan yang Dicemari Logam Berat Timbal (Pb)
Terhadap Kadar Timbal Pada Cacing Lumbricus rubellus” dengan baik. Skripsi
ini disusun untuk memenuhi salah satu persyaratan mendapatkan gelar Sarjana
Farmasi (S. Farm.) di Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Dalam pelaksanaan penelitian hingga penyusunan skripsi ini, penulis
banyak mendapatkan dukungan dari banyak pihak. Maka dari itu, penulis ingin
mengucapkan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
2. C.M. Ratna Rini Nastiti, M.Pharm., Apt. selaku Ketua Program Studi Fakultas
Farmasi Sanata Dharma Yogyakarta yang turut memberikan saran dan
masukan untuk penulis selama tahap penelitian.
3. Prof. Dr. Sri Noegrohati Apt, selaku Dosen pembimbing yang telah
memberikan pengarahan, bantuan, tuntunan, kritik, dan saran sejak awal
penelitian hingga akhir penyusunan skripsi ini.
4. Dra. M.M. Yetty Tjandrawati, M.Si. dan Enade Perdana Istyastono, Ph. D., Apt.
selaku dosen penguji atas segala masukan dan bimbingannya.
5. Rini Dwiastuti, M.Sc., Apt. atas dukungan dan segala bantuan dalam perijinan
7. Segenap dosen yang telah berkenan membagikan ilmu kepada penulis selama
belajar di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
8. Teman seperjuangan skripsi: Rachelia Octavia, A. A. Istri Yulianti S., untuk
kesabaran, kebersamaan dan suka dukanya.
9. Mas Bimo, Pak Parlan, Mas Kunto, Mas Kethul Ismadi, Mas Ottok dan
seluruh staff laboratorium Fakultas Farmasi serta staff keamanan dan
kebersihan Universitas Sanata Dharma Yogyakarta atas bantuan dan
kerjasamanya.
10.Teman seperjuangan di laboratorium Kimia Analisis Instrumentasi : Leo,
Topan, Ina, Nety, Jo, Shinta, Sasya, Metri, Victor, Agnes, Novia, Teti, Febrin,
Wisnu dan Ozy.
11.Teman-teman FST A 2009 dan seluruh angkatan 2009 atas dukungan dan suka
duka yang diberikan, Semoga pengalaman yang telah kita lalui bersama bisa
menjadi bekal untuk perjuangan hidup kita kelak.
12.Seluruh pihak, yang tidak dapat disebutkan satu per satu atas yang telah
membantu penulis dalam pelaksanaan penelitian dan penyusunan skripsi.
Penulis menyadari bahwa masih banyak kekurangan dalam penelitian dan
penyusunan skripsi ini mengingat keterbatasan dan kemampuan penulis, sehingga
sangat diharapkan adanya masukan dan saran yang membangun untuk penulis.
Semoga skripsi ini dapat bermanfaat bagi pembaca dan berguna bagi dunia ilmu
pengetahuan.
DAFTAR ISI
HALAMAN JUDUL ……….. i
HALAMAN PERSETUJUAN………... ii
HALAMAN PENGESAHAN………. iii
PERNYATAAN KEASLIAN KARYA……….. iv
LEMBAR PERSETUJUAN PUBLIKASI KARYA………... v
HALAMAN PERSEMBAHAN……….. vi
PRAKATA………... vi
DAFTAR ISI………... viii
DAFTAR TABEL……….. xiv
DAFTAR GAMBAR……….. xv
DAFTAR LAMPIRAN………... xvi
INTISARI………... xvii
ABSTRACT……….. xviii
BAB I. PENGANTAR A. Latar Belakang……… 1
1. Perumusan Masalah ……….. 3
2. Keaslian Penelitian ………. 3
3. Manfaat Penelitian ………... 4
B. Tujuan Penelitian ………... 4
BAB II. PENELAAHAN PUSTAKA
A. Lumbricus rubellus………..…………...
B. Manfaat Cacing Lumbricus rubellus………...
5
C. Pencemaran Logam Berat .…..………...………… 6
D. Timbal………...………...… 6
1. Definisi ………..………..…….. 6
2. Keracunan Timbal…….……… 7
E. Destruksi………...………...
1. Destruksi Kering……….
2. Destruksi Basah………...………
a. Satu Jenis Asam………..
b. Campuran Asam……….
7
8
8
9
10
F. Spektroskopi Serapan Atom ……….……….
1. Source (Sumber Cahaya) ……….
2. Absorption Cell……….
a. Burner system……….
b. Nebulizer……….
3. Slit………
4. Monochromator………...
5. Detector………...
6. Display………
G. Validasi Metode Analisis………
1.Linearitas………...………..
2.Spesifisitas………..…
a. Repeatability……….
b. Intermediate Precision...
c. Reproducibility………..
5.Limit of Detection………....
6.Limit of Quantitation………...
H. Landasan Teori………
I. Hipotesis………..
J. Bagan Kerja ………
16 16 17 17 18 19 19 19
BAB III. METODE PENELITIAN
A. Jenis Penelitian ………...……… 20
B. Variabel Penelitian………...……… 20
C. Definisi Operasional……… 20
D. Bahan-bahan Penelitian ……….. 21
E. Alat-Alat Penelitian ……… 21
F. Tatacara Penelitian ………..
1. Pencucian Wadah dan Peralatan……….
2. Pemilihan Sampel………...
3. Penimbangan Bobot Kering Sampel ………..
4. Destruksi Cacing Lumbricus rubellus………...
a. Digesti Basah………...
b. Penyaringan……….
5. Kondisi Optimum Analisis………...………...
a. Optimasi Tinggi Burner………...
b. Optimasi Untuk Perbandingan Bahan Bakar dan Oksidator…...
6. Kurva Baku……….
a. Larutan Stok (1000 µg/ml)………..
b. Larutan Intermediet……….
7. Validasi Metode Analisis………...
a. Prosedur Standar Adisi………
8. Penetapan Kadar………..………
a. Penyiapan Sampel………
b. Preparasi Sampel……….
c. Digesti Basah………...
d. Penyaringan……….
e. Penetapan Kadar………..
24 24 24 24 25 25 26 26 26 26 26 27 27
G. Tata Cara Analisis Hasil... ………..
1. Validitas Alat Untuk Determinasi…….………..
a. Linearitas……….
b. Sensitivitas………...
2. Validasi Metode………
a. Akurasi……….
b. Presisi………...
c. Intermediate precision……….
d. Limit of Quantitation………...
e. Pengaruh Prosedur Analisis……….………
BAB IV. HASIL DAN PEMBAHASAN
A. Pemilihan Sampel………
B. Destruksi Sampel……….
C. Optimasi Spektroskopi Serapan Atom……….
1. Garis Resonansi………...
2. Lebar Celah……….
3. Kuat Arus………
4. Perbandingan Udara-Asetilen……….
5. Tinggi Burner…………...………...
D. Validasi Instrumen Analisis……….
1. Linearitas……….
2. Sensitivitas………..
E. Validasi Metode Standar Adisi………
1. Akurasi………....
2. Presisi………..
3. .Intermediate Precision………..
4. Limit Of Quantification(LOQ) ...………...
5. Pengaruh Prosedur Analisis………
F. Penetapan Kadar………..
1. Perlakuan Sampel………..
2. Penetapan Kadar………
30 31 33 34 35 36 38 40 41 42 44 46 46 47 48 49 50 53 53 54
BAB V. KESIMPULAN DAN SARAN
B. Saran ………... 56
DAFTAR PUSTAKA ………. 57
LAMPIRAN ………... 59
DAFTAR TABEL
Halaman
Tabel I Kategori metode analisis………. 15
Tabel II Perolehan kembali menurut Horwitz …………..………... 16
Tabel III %RSD menurut Horwitz dan AOAC……….. 17
Tabel IV Data optimasi spektroskopi serapan atom………... 33
Tabel V Hasil perolehan kembali (Recovery)………... 47
Tabel VI CV dari standar adisi………...……… 48
Tabel VII Uji signifikansi intersep dan slope……….. 49
Tabel VIII LOQ………. 50
Tabel IX Uji F standar deviasi baku dan adisi………... 52
DAFTAR GAMBAR
Halaman
Gambar 1. Instrumen spektroskopi serapan atom……….. 11
Gambar 2. Cacing Lumbricus rubellus……….. 31
Gambar 3. Garis resonansi timbal……… 34
Gambar 4. Ilustrasi pengecilan garis resonansi……… 36
Gambar 5. Hollow Cathode Lamp………... 36
Gambar 6. Sputtering……….... 37
Gambar 7 Sistem nebulizer………. 39
Gambar 8. Porses atomisasi……….. 39
Gambar 9. Flame Structure……….. 40
Gambar 10. Profil suhu nyala………. 41
Gambar 11. Kurva Baku PbNO3……… 43
Gambar 12. Ilustrasi pencarian LOD………. 44
Gambar 13. Overlapping kurva LOD………. 44
Gambar 14. Gabungan Kurva baku dan kurva standar adisi rep 1………. 50
Gambar 15. Gabungan Kurva baku dan kurva standar adisi rep 2………. 51
DAFTAR LAMPIRAN
Halaman
Lampiran 1. COA PbNO3………. 60
Lampiran 2. Pengenceran HNO3 65% p.a menjadi 1 M……… 60
Lampiran 3. Penimbangan PbNO3 99,7%... 60
Lampiran 4. Pengenceran larutan stok menjadi larutan kerja………... 61
Lampiran 5. Penimbangan bobot kering……….……. 61
Lampiran 6. Data optimasi SSA………... 63
Lampiran 7. Data absorbansi kurva baku………. 63
Lampiran 8. Kurva regresi baku PbNO3 dan kisaran linearitas……… 64
Lampiran 9. Perhitungan sensitifitas alat………. 65
Lampiran 10. Data absorbansi standar adisi………... 65
Lampiran 11. Perhitungan akurasi standar adisi (%Recovery)………... 67
Lampiran 12. Perhitungan presisi standar adisi (CV)……… 71
Lampiran 13. Intermediate Precision..…….………. 71
Lampiran 14. Perhitungan LOQ………. 75
Lampiran 15. Pengaruh prosedur analisis……….. 78
INTISARI
Cacing Lumbricus rubellus memiliki Lumbricin I yaitu antimikroba
dengan spektrum luas tanpa menimbulkan hemolitik dan Lumbrokinase yaitu enzim yang memiliki daya fibrinolotik yang sangat kuat. Pemberian pangan yang terkontaminasi dapat menyebabkan terjadinya peningkatan kadar logam berat pada cacing Lumbricus rubellus. Tujuan penelitian ini ingin melihat apakah terjadi
peningkatan kadar logam berat timbal (Pb) pada cacing Lumbricus rubellus
karena pangan yang diberikan terkontaminasi oleh timbal (Pb).
Metode yang digunakan dalam penelitian ini adalah destruksi basah dan instrumen yang digunakan adalah Spektroskopi Serapan Atom. Dari hasil penelitian dengan instrumen yang optimal didapatkan hasil validitas yang baik dari sisi linearitas, akurasi, presisi. Dalam penelitian ini juga melihat apakah ada pengaruh prosedur analisis terhadap hasil akhir dengan mengunakan statistik.
Hasil dari penetapan kadar tidak dapat disimpulkan. Hal ini dikarenakan semua sampel yang digunakan baik perlakuan maupun blanko tidak dapat dikuantifikasikan karena semua data berada di bawah LOQ (4,1460 µg/g sampel).
ABSTRACT
Lumbricus rubellus has Lumbricin I and Lumbrokinase. Lumbrin I is a
broad spectrum antimicrobial without hemolytic activity. Lumbrokinase is an enzyme with very strong fibrinolytic activity. Provision of contaminated food can cause elevated levels of heavy metal lead (Pb) in the Lumbricus rubellus because
given food contaminated by lead (Pb).
The method which is used in this study is wet digestion and the instrument is Atomic Absorption Spectrophotometry. This study obtains a good validity from the linearity, accuracy, and precision parameters. This study determines the effect of analysis method to the result using statistic.
The results of this study are inconclusive because all the samples cannot be quantified. All the data that obtain from this study is under the LOQ value (4,1460 µg/g sample).
BAB I PENGANTAR A.Latar Belakang
Di Indonesia baru-baru ini sedang marak penggunaan cacing Lumbricus
rubellus sebagai obat alternatif untuk mengobati penyakit tipus dan demam. RRC,
Korea, Vietnam, dan banyak tempat lain di Asia Tenggara cacing jenis Lumbricus
rubellus sudah biasa digunakan sebagai obat sejak ribuan tahun yang lalu (Dina,
2012). Cacing Lumbricus rubellus memiliki peptida antimikroba yang disebut
dengan Lumbricin I yang terdiri dari 62 asam amino. Peptida dari Lumbriucs
rubellus ini ternyata memiliki daya antimikroba dengan spektrum yang luas tanpa
menimbulkan efek hemolitik (Cho, Chan Young, Sun, 1998).
Lumbricus rubellus juga memiliki enzim yang disebut dengan
lumbrokinase. Enzim ini terdapat dalam tubuh cacing Lumbricus rubellus dalam
bentuk iso-enzim yang berada pada saluran cerna dan cairan usus dari cacing
tersebut. Enzim lumbrokinase ini memiliki daya aktivitas fibrinolitik yang sangat
kuat, stabil dalam rentang pH yang luas dan menunjukkan kestabilan terhadap
panas dan degradasi. Lumbrokinasi memiliki efek sebagai pemacu aktivitas
plasminogen dan memacu sistem normal di dalam tubuh manusia untuk
melarutkan fibrin pada bekuan darah (Verma dan Pulicherla, 2011).
Manfaat dari cacing Lumbricus rubellus cukup banyak, maka perlu
adanya penangganan khusus dalam pemilihan media tumbuh dan pangan untuk
mengurangi kontaminan yang ada. Cacing Lumbricus rubellus yang beredar
hal ini menjadi suatu keraguan bagi peneliti terhadap pangan cacing dan proses
dari pembuatan kapsul cacing ini.
Laporan adanya timbal (Pb) dalam obat tradisional yang teramati berasal
dari USA, Australia, India, New Zealand dan Hongkong terdapat beberapa
formulasi yang mengandung timbal sebanyak 30% dari berat serbuk dan pil
(Babu, 2011). Dampak dari timbal sendiri sangat mengerikan bagi manusia,
utamanya bagi anak-anak diantaranya adalah mempengaruhi fungsi kognitif,
kemampuan belajar, penurunan fungsi pendengaran, merusak fungsi organ tubuh,
seperti ginjal, sistem syaraf, dan reproduksi, meningkatkan tekanan darah dan
mempengaruhi perkembangan otak (BPLH, 2009).
Jika pembudidayaan cacing Lumbricus rubellus tidak tepat pemberian
pangannya, maka cemaran yang ada dipangan cacing tersebut dapat berpindah ke
dalam tubuh cacing. Salah satunya adalah timbal (Pb) yang dapat berasal dari
kendaraan bermotor, debu bangunan tua serta air dan tanah yang terkontaminasi.
(Babu, 2011).
Untuk menganalisis kadar logam timbal maka dapat digunakan metode
destruksi basah dan menggunakan instrumen SSA (Spektroskopi Serapan Atom)
dimana instrumen ini sangat selektif untuk mendeteksi timbal. Instrumen ini
menggunakan hollow cathode lamp yang menghasilkan garis resonansi yang
spesifik sehingga mampu menghasilkan intensitas yang tinggi untuk timbal. Hal
ini membuat spektroskopi serapan atom menjadi instrumen analisis yang spesifik
Penelitian ini bertujuan untuk melihat apakah dengan pemberian pangan
yang terkontaminasi timbal dapat berpindah ke tubuh cacing Lumbricus rubellus
dan mengalami akumulasi dalam masa pemeliharaan selama 2 bulan.
1. Perumusan Masalah
a. Apakah metode untuk penetapan kadar logam berat timbal (Pb) pada cacing
Lumbricus rubellus menggunakan spektroskopi serapan atom memiliki
validitas yang baik?
b. Apakah terjadi akumulasi kadar timbal di dalam tubuh cacing dengan
pemberian pangan yang tercemar selama dua bulan?
2. Keaslian Penelitian
Penelitian mengenai logam berat pada cacing Lumbricus rubellus, yaitu
The Accumulation of Metals (Cd, Cu, Pb, Zn and Ca) by two Ecologically
Contrasting Earthworm Species (Lumbricus rubellus and Aporrectodea
caliginosa): Implications for Ecotoxicological testing oleh J.E. Morgan dan
A.J. Morgan (1999).
Penelitian yang akan dilakukan terdapat perbedaan yaitu media yang
digunakan adalah serbuk gergaji dan cemaran logam berat berasal dari pangan
bukan dari media tumbuh.
3. Manfaat Penelitian
a. Manfaat teoritis. Menambah informasi bagi ilmu pengetahuan khususnya
dalam bidang kefarmasian mengenai metode yang digunakan untuk analisis
b. Manfaat metodologi. Metode penelitian ini diharapkan dapat dijadikan
suatu metode yang dapat digunakan untuk sampel mahluk hidup.
c. Manfaat praktis. Memberikan informasi tentang pengaruh pemberian
pangan yang tercemar terhadap cacing Lumbricus rubellus yang digunakan
sebagai bahan obat.
B.Tujuan Penelitian
1. Mengetahui metode untuk penetapan kadar logam berat timbal (Pb) pada
cacing Lumbricus rubellus menggunakan spektroskopi memiliki validitas yang
baik.
2. Mengetahui apakah terjadi akumulasi kadar timbal di dalam tubuh cacing
BAB II
PENELAHAAN PUSTAKA A. Lumbricus rubellus
Lumbricus rubellus termasuk dalam kelompok binatang tidak bertulang
belakang (avertebrata) dan banyak ditemukan di daerah yang lembap. Seluruh
badannya tersusun atas segmen-segmen yang berbentuk cincin sehingga dapat
digolongkan dalam filum Annelida. Pada setiap segmen tubuh terdapat seta yaitu
rambut yang keras dan pendek. Jumlah seta ini sangat sedikir maka Lumbricus
rubellus dimasukkan dalam kelas oligochaeta. Genus Lumbricus ini suka dengan
bahan organik yang berasal dari kotoran hewan maupun dedaunan (Palungkun,
2010).
B.Manfaat Cacing Lumbricus rubellus
Antimikroba yang berasal dari cacing Lumbricus rubellus dinamakan
dengan Lumbricin I, dimana Lumbricin I ini memiliki daya antimikroba dengan
spektrum yang luas tanpa menimbulkan efek hemolitik. Lumbricin I hanya
dihasilkan oleh cacing Lumbricus rubellus dewasa (Cho, Chan, Young, dan Sun,
1998).
Lumbrokinase hadir dalam bentuk iso-enzim dalam usus terutama dalam
cairan usus dari cacing Lumbricus rubellus. Lumbrokinase memiliki karakteristik
yang unggul yaitu stabil dalam pelarut organik dan anorganik dan menjadi tidak
aktif pada suhu 600C. Enzim Lumbrukinase memiliki aktivitas fibrinolytic yang
sangat kuat, stabil pada kisaran pH yang luas dan menunjukkan kestabilan
C. Pencemaran Logam Berat
Pencemaran adalah peningkatan berbagai macam bahan yang biasanya
bersifat berbahaya ke lingkungan dan dapat merusak lingkungan sebagai aktivitas
manusia ke lingkungan. Pencemaran logam berat terhadap lingkungan merupakan
suatu proses yang erat hubungannya dengan penggunaan logam tersebut oleh
manusia. Logam biasanya digunakan dalam peralatan rumah tangga, batu baterai,
tempat makanan, pipa-pipa logam, perhiasan, peralatan pertanian dan lain-lain.
Pencemaran logam dapat berasal dari proses produksi, misalnya pembakaran batu
bara, pemurnian minyak, pembangkit listrik. Pada cacing pencemaran ini dapat
berasal dari pangan yang diberikan (Buchari, Wayan, Pharma dan Kunti, 2001).
D. Timbal (Pb) 1. Definisi
Timbal lebih dikenal dengan nama timah hitam dan dalam bahasa
ilmiahnya dikenal dengan kata Plumbum dan logam ini dilambangkan dengan
Pb. Di dalam tabel periodik unsur kimia, logam ini termasuk kedalam
kelompok logam-logam golongan IV–A. Mempunyai nomor atom 82 dengan
masa atom 207,2 adalah suatu logam berat berwarna kelabu kebiruan dan lunak
dengan titik leleh 327°C dan titik didih 1.620°C. Pada suhu 550-600°C. Timbal
(Pb) menguap dan membentuk oksigen dalam udara membentuk timbal oksida.
Bentuk oksidasi yang paling umum adalah timbal (II). Walaupun bersifat lunak
larut dalam air dingin, air panas dan asam. Timbal (Pb) ini bisa larut dalam
asam nitrit, asam asetat dan asam sulfat pekat (Palar, 1994).
2. Keracunan Timbal
Kelebihan timbal di dalam tubuh dapat memberikan efek toksik
multisistemik melalui tiga mekanisme, yaitu melalui aktivitas hambatan enzim,
sebagai konsekuensi ikatan pada gugus sulfuhidril (-SH); dengan mempengaruhi
aksi kation esensial, terutama kalsium, zat besi dan seng dengan mengubah
struktur reseptor serta membran sel (Katzung, 2004).
Timbal dapat mengakibatkan yang bersifat reversibel pada ginjal akibat
efek sampingnya terhadap tubulus proksimal sehingga menganggu kerja dari
ginjal dalam proses mengabsorbsi glukosa, asam amino dan fosfat. Efek jangka
panjangnya yaitu terjadi penurunan fungsi ginjal, termasuk atropi glomular,
fibrosis interstinal, dan sklerosis pembuluh darah (Manahan, 2003).
Gejala yang mengindikasikan keracunan Pb kronis, yaitu anoreksia,
lelah, malaise, sakit kepala, depresi, kelemahan otot kaki dan tangan, anemia,
neuropati perifer (Katzung, 2004).
E. Destruksi
Jaringan hewan dan tanaman, cairan biologis, dan komponen organik
biasanya diuraikan dengan destruksi basah dengan menggunakan satu jenis asam
atau campuran asam, bisa juga dengan destruksi kering yang dipanaskan pada
temperatur tinggi (400-700°C) pada tungku api. Pada destruksi basah, hasil
menguap sehingga menyisakan garam atau asam dari konstituen inorganik.
(Christian, 2004).
1. Destruksi Kering
Walaupun berbagai macam kombinasi pengabuan dan destruksi basah
digunakan dalam frekuensi yang hampir sama oleh analisis senyawa organik dan
material biologik, destruksi kering merupakan metode tanpa bantuan bahan kimia
adalah teknik yang paling banyak digunakan. Timbal, seng, kobalt dan besi dapat
diperoleh dengan kehilangan yang sedikit karena retensi dan penguapan
(Christian, 2004).
2. Destruksi Basah
Destruksi basah dengan menggunakan campuran dari asam nitrat dan
asam sulfat adalah prosedur oksidasi yang paling sering dipakai. Biasanya
sejumlah kecil dari asam sulfat digunakan dengan volume asam nitrat yang lebih
besar (20-30 ml). Destruksi basah biasanya dilakukan dengan labu Kjehdahl.
Asam nitrat menghancurkan zat organik, tetapi tidak cukup panas untuk
menghancurkan sisa terakhir. Campuran dipanaskan selama proses destruksi
sampai asap SO3 putih terbentuk dan mulai berefluk dalam labu. Pada keadaan ini
cairan akan sangat panas, dan asam sulfat bereaksi terhadap sisa bahan organik.
Destruksi basah terdiri dari 2 jenis yaitu:
a. Satu Jenis Asam.Sebagai panduan umum berguna untuk mengklasifikasikan
perlakuan asam lebih umum menurut apakah asam tersebut dapat
mengoksidasi sampel atau tidak. Asam nonoxidizing termasuk asam klorida,
fluorida, sulfat, dan perklorat encer, sedangkan asam pengoksidasi termasuk
panas, nitrat pekat, sulfat, dan asam perklorat. Larutnya logam dengan asam
nonoxidizing adalah proses penggantian hidrogen.
Asam klorida akan melarutkan logam di atas potensial reduksi hidrogen,
garam dari asam lemah, dan oksida banyak. Pengenceran asam sulfat dan
berguna untuk logam di atas potensial reduksi hidrogen. Asam sulfat pekat
akan sering melarutkan logam di bawah potensial reduksi standar hidrogen.
Kondisi oksidasi paling ampuh yang diperoleh dengan menggunakan asam
perklorat pekat panas, yang akan melarutkan semua logam biasa. Asam
klorida pekat merupakan pelarut yang sangat baik untuk oksida logam
banyak serta mereka logam yang lebih mudah teroksidasi dibanding
hidrogen. Selain itu, sering lebih baik untuk pelarut oksida daripada asam
pengoksidasi.
Asam nitrat pekat akan melarutkan semua logam biasa dengan pengecualian
dari aluminium dan kromium, yang pasif untuk reagen sebagai akibat
pembentukan permukaan oksida. Asam nitrat panas juga mudah
mengoksidasi zat organik banyak. Asam sulfat pekat dapat digunakan untuk
mengurai dan melarutkan berbagai zat dan itu sangat berguna untuk
b. Campuran Asam. Kombinasi asam lebih disukai untuk matriks organik
tertentu dan umumnya lebih menguntukan untuk penguraian senyawa
organik. Untuk senyawa organik biasanya digunakan yaitu campuran aqua
regia (1:3 asam nitrat-asam klorida). Asam nitrat berfungsi untuk agen
pengoksidasi sementara asam klorida berfungsi sebagai agen pengkompleks.
Sebagai tambahan brom atau hidrogen peroksida bisa meningkatkan
kelarutan dari mineral. Campuran 1:4 asam sulfat dan asam nitrat biasanya
digunakan untuk sampel organik. Asam nitrit akan mengurai zat organik
tetapi tidak mencapai suhu yang cukup untuk mengurai yang tersisa. Namun
karena asam nitrat mendidih dan menguap maka tertinggal asam sulfat. Asap
SO3 menguap dan memenuhi labu sehingga membuat suasana yang sangat
panas dan memungkinkan asam sulfat panas ini untuk menguraikan
bahan-bahan organik yang tersisa. Metode ini harus dilakukan didalam lemari
asam. Lebih banyak asam nitrat yang ditambahkan maka akan
memperpanjang proses dekstruksi dan menghilangkan bahan organik yang
sulit dihancurkan (Twyman, 2005).
F. Spektroskopi Serapan Atom.
Instrumen spektroskopi serapan atom berprinsip pada absorbsi cahaya
oleh atom. Atom-atom menyerap cahaya tersebut pada panjang gelombang
tertentu, tergantung pada sifat unsurnya. Transisi elektronik suatu unsur bersifat
spesifik. Dengan absorbsi energi, berarti memperoleh lebih banyak energi, suatu
Keberhasilan analisis ini tergantung dari proses eksitasi dan cara memperoleh
resonansi yang tepat (Khopkar, 1990).
Atomisasi dapat dilakukan dengan nyala maupun dengan tungku. Untuk
mengubah unsur metalik menjadi uap atau hasil disosiasi diperlukan energi panas.
Temperatur harus benar-benar terkendali dengan sangat hati-hati agar proses
atomisasinya sempurna. Ionisasi harus dapat dihindartkan dan ini dapat terjadi
bila temperatur terlalu tinggi (Khopkar, 1990).
Seperangkat sumber yang dapat memberikan garis emisi yang tajam dari
suatu unsur spesifik tertentu sebagai hollow cathode lamp. Lampu ini memiliki
dua elektroda, satu diantaranya berbentuk silinder dan terbuat dari unsur zat yang
sama dengan unsur yang dianalisis. Dengan pemberian tegangan pada arus
tertentu, logam mulai memijar, dan atom-atom logam katodanya akan teruapkan
dengan pemercikan. Atom yang tereksitasi kemudian mengemisikan radiasi pada
panjang gelombang tertentu (Khopkar, 1990).
Interaksi materi dengan berbagai energi seperti energi panas, energi
radiasi, energi kimia dan energi listik selalu memberikan sifat-sifat yang
karakteristik untuk untuk setiap unsur (atau persenyawaan) dan besarrnya
perubahan yang terjadi biasanya sebanding dengan jumlah unsur atau
persenyawaan yang terdapat didalamnya. Di dalam kimia analisis yang
mendasarkan pada proses interaksi itu antara lain cara analisis spektrofotometri
serapan atom yang bisa berupa cara emisi dan cara absorpsi (serapan) (Gandjar
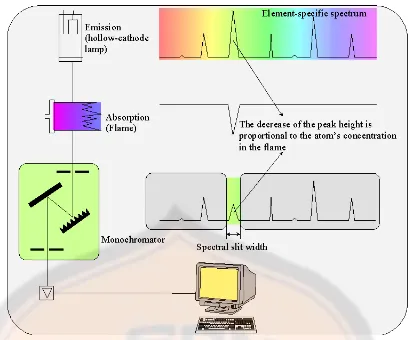
Gambar 1. Instrumen spektroskopi serapan atom(Beaty dan Kerber, 1996)
ada 6 komponen dasar dalam instrument serapan atom yaitu:
1. Source (Sumber Cahaya)
Atom-atom menyerap cahaya dengan panjang gelombang yang spesifik,
maka perlu digunakan spektra sinar yang sempit. Spektra yang sempit ini
memberikan intensitas yang tinggi dan membuat serapan atom menjadi teknik
analisis yang spesifik. Sumber cahaya yang digunakan dalam spektroskopi
serapan atom adalah hollow catoda lamp (HCL) dan electrodeless discharge lamp
(EDL) (Beaty dan Kerber, 1996).
Hollow catoda lamp memiliki sinar yang terang dan stabil untuk sumber
cahaya untuk kebanyakan elemen. Akan tetapi untuk elemen yang menguap,
dimana memiliki intensitas yang kecil dan umur lampu yang pendek menjadi
permasalahan yang utama. Untuk kebanyakan elemen hollow catoda lamp sangat
memuaskan sebagai sumber cahaya akan tetapi memiliki kekurangan terutama
sampel dengan intensitas kecil. Electrodeless discharge lamp merupakan sumber
cocok untuk varietas elemen yang lebih luas termasuk yang bersifat menguap
(Beaty dan Kerber, 1996).
2. Absorption Cell
Dalam Absorption cell merupakan tempat atom dari sampel hasilkan
dimana terdiri dari burner system, nyala dan pengontrol gas.
a. Burner system. Burner system terdiri dari burner heads dan nebulizers.
Burner heads terbuat dari titanium padat dimana memiliki karakteristik
tahan terhadap karat dan tahan terhadap pemanasan tinggi. Burner heads
dengan panjang 10 cm didesain untuk nyala hasil campuran udara-asetilen.
Karena panjang burner ini menyediakan sensitivitas yang baik untuk elemen
air-asetilen.
b. Nebulizer. Nebulizer berfungsi mengisap sampel cairan dengan jumlah yang
terkontrol diubah menjadi aerosol untuk dimasukkan ke dalam api dan
mencampur aerosol sampel, pembakar dan oksidator menuju ke dalam nyala
3. Slit
Berfungsi untuk mengatur jumlah cahaya yang berasal dari nyala dan
diteruskan ke monokromator
4. Monokromator
Monokromator untuk mengisolasi cahaya dengan panjang gelombang
tertentu dari nyala sehingga cahaya dengan panjang gelombang yang lain tidak
diteruskan ke detektor.
5. Detector
6. Display
Untuk menunjukkan hasil pembacaan dari hasil proses instrument (Beaty
dan Kerber, 1996).
G.Validasi Metode Analisis
Validasi metode analisis adalah suatu proses untuk memastikan bahwa
prosedur analisis yang digunakan cocok. Metode analisis dapat dikelompokkan
menjadi 4 kategori yaitu :
1. Kategori 1, merupakan metode analisis yang digunakan untuk mengukur
komponen utama dalam jumlah besar (termasuk bahan pengawet) atau bahan
aktif obat dari suatu sediaan.
2. Kategori 2, merupakan metode analisis untuk penentuan impurities bahan obat
dan degradasi produk obat, termasuk penentuan kuantitatif dan uji batas.
3. Kategori 3, merupakan metode analisis yang digunakan untuk menentukan
karakteristik sediaan farmasi (misalnya disolusi).
4. Kategori 4, merupakan metode analisis untuk identifikasi secara kualitatif
(Synder, Kirkland dan Dolan, 2010).
Setiap kategori metode analisis memiliki persyaratan validasi yang
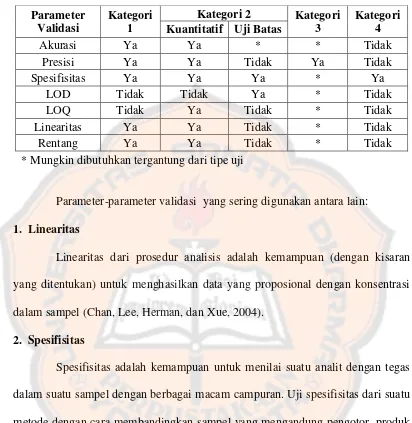
Table I. Kategori metode analisis (Synder, Kirkland dan Dolan, 2010)
Parameter Validasi
Kategori 1
Kategori 2 Kategori 3
Kategori 4 Kuantitatif Uji Batas
Akurasi Ya Ya * * Tidak Presisi Ya Ya Tidak Ya Tidak Spesifisitas Ya Ya Ya * Ya
LOD Tidak Tidak Ya * Tidak LOQ Tidak Ya Tidak * Tidak Linearitas Ya Ya Tidak * Tidak Rentang Ya Ya Tidak * Tidak * Mungkin dibutuhkan tergantung dari tipe uji
Parameter-parameter validasi yang sering digunakan antara lain:
1. Linearitas
Linearitas dari prosedur analisis adalah kemampuan (dengan kisaran
yang ditentukan) untuk menghasilkan data yang proposional dengan konsentrasi
dalam sampel (Chan, Lee, Herman, dan Xue, 2004).
2. Spesifisitas
Spesifisitas adalah kemampuan untuk menilai suatu analit dengan tegas
dalam suatu sampel dengan berbagai macam campuran. Uji spesifisitas dari suatu
metode dengan cara membandingkan sampel yang mengandung pengotor, produk
yang terdegradasi atau dengan penyusun placebo dengan sampel yang tidak ada
pengotor, produk yang terdegradasi atau dengan penyusun placebo (Chan, Lee,
Herman, dan Xue, 2004).
3. Akurasi
Menurut ICH (International Conference on Harmonization), akurasi dari
sebagai persen perolehan kembali (percent recovery) (Chan, Lee, Herman, dan
Xue, 2004).
Persentase perolehan kembali yang diperboleh ditunjukkan pada tabel II
[image:36.595.98.505.223.643.2]dibawah ini:
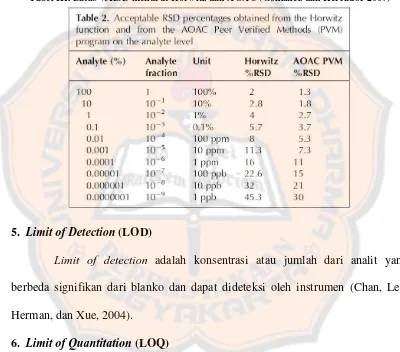
Tabel II. Perolehan kembali menurut Horwitz dan AOAC (Gonzalez dan Herrador, 2007)
4. Presisi
Presisi dari prosedur analisis menunjukkan kedekatan antara seri
pengukuran yang didapatkan dari beberapa sampel dengan perlakuan yang sama.
Presisi dilaporkan sebagai %RSD atau CV dan presisi diamati dalam 3 tingkatan
yaitu:
a. Repeatability (Precision). Repetability adalah pengukuran presisi daalam
kondisi operational yang sama dalam jangka waktu yang singkat.
b. Intermediate Precision. Intermediate precision didefinisikan sebagai
variasi yang muncul pada laboratorium yang sama. Parameter yang diuji
tempat dan waktu serta variasi dari yang melakukan proses tersebut yang
dilakukan hari demi hari.
c. Reproducibility. Reproducibility mengukur presisi antara laboratorium
yang berbeda ketika digunakan kolaborasi dua atau lebih ilmu (Chan, Lee,
[image:37.595.102.502.260.612.2]Herman, dan Xue, 2004).
Tabel III. Batas %RSD menurut Horwitz dan AOAC (Gonzalez dan Herrador 2007)
5. Limit of Detection (LOD)
Limit of detection adalah konsentrasi atau jumlah dari analit yang
berbeda signifikan dari blanko dan dapat dideteksi oleh instrumen (Chan, Lee,
Herman, dan Xue, 2004).
6. Limit of Quantitation (LOQ)
Limit of quantitation adalah konsentrasi atau jumlah analit terkecil yang
dapat dikuantifikasi dengan presis dan akurasi yang cocok. Limit of quantitation
merupakan parameter kuantitatif untuk analit dalam suatu matriks dengan
konsentrasi kecil dan digunakan untuk menetukan jumlah pengotor atau jumlah
H.Landasan Teori
Cacing Lumbricus rubellus sebagai obat alternatif untuk mengobati
penyakit tipus dan demam oleh sebab itu dalam hal pemilihan pangan dan media
perlu diperhatikan. Jikalau pangan yang diberikan diambil dengan sembarangan
misalnya dari pinggir jalan maka akan ada kemungkinan terdapat cemaran logam
berat salah satunya timbal. Timbal dapat mengakibatkan yang bersifat reversibel
pada ginjal akibat efek sampingnya terhadap tubulus proksimal shingga
menganggu kerja dari ginjal dalam proses mengabsorbsi glukosa, asam amino dan
fosfat (BPLHD, 2009).
Keberadaan timbal ini dapat dideteksi dengan menggunakan instrument
spektrofotometri serapan atom. Instrumen ini bisa dengan spesifik mendeteksi
keberadaan timbal meski ada logam-logam lain yang dapat mengganggu dari
pembacaan alat ini. Sampel yang digunakan adalah mahluk hidup maka perlu
dilakukan penghilangan senyawa organik dengan cara destruksi. Destruksi yang
dipilih adalah destruksi basah karena keamanan dari pengerjaannya terjamin
dibandingkan dengan destruksi kering. Pelarut yang digunakan untuk destruksi
adalah H2SO4 dan HNO3 (Twyman, 2005).
Untuk mendapatkan hasil yang optimal maka perlu dilakukan optimasi
spektroskopi serapan atom. Optimasi yang dilakukan antara lain optimasi tinggi
burner, kuat arus, garis resonansi, perbandingan bahan bakar dan udara, serta
lebar celah. Disamping itu perlu dilakukan optimasi terhadap metode analisis
I. Hipotesis
Dari pangan dicemari yang diberikan terhadap cacing Lumbricus
rubellus, terjadi akumulasi kadar timbal yang masuk ke dalam tubuh cacing.
J. Bagan Kerja
Cacing
Lumbricus
rubellus
Pangan yang
Tidak Dicemari
Timbal
Tidak Terjadi
Akumulasi Timbal
Pangan yang
Dicemari Timbal
Terjadi Akumulasi
Timbal
BAB III
METODOLOGI PENELITIAN A. Jenis Penelitian
Penelitian ini termasuk penelitian eksperimental dengan rancangan
deskriptif karena dilakukan manipulasi terhadap subjek uji, subyek uji yang
dimaksud disini adalah perlakuan yang diberikan terhadap sampel.
B. Variabel Penelitian 1. Klasifikasi Variabel
a. Varibel bebas. Variabel pada penelitian ini adalah kadar larutan baku
PbNO3, tinggi burner,perbandingan udara dan asetilen
b. Varibel tergantung. Variabel tergantung pada penelitian ini adalah
absorbansi, kadar timbal dalam cacing dan parameter validasi
c. Variabel pengacau terkendali. Variabel pengacau terkendali dalam
penelitian ini adalah asal cacing Lumbricus rubellus dan alat-alat yang
digunakan
C.Definisi Operasional
1. Lumbricus rubellus adalah termasuk dalam kelompok binatang tidak
bertulang belakang (avertebrata) dan banyak ditemukan di daerah yang
lembab.
2. Cemaran logam berat adalah cemaran Pb dalam cacing Lumbricus rubellus
3. Destruksi basah merupakan salah satu cara dekomposisi sampel dengan
penambahan reagen cair.
D.Bahan Penelitian
PbNO3 p.a Merck®, asam sulfat(H2SO4) 90,63% p.a Merck®, asam nitrat
(HNO3) 65% p.a Merck®, cacing Lumbricus rubellus, daun hasil fermentasi, asam
bikromat, aquabidest ( Laboratorium Kimia Analisis Instrumental Fakultas
Farmasi Sanata Dharma).
E. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas merk
Pyrex®, hotplate merk LabTech®, Seperangkat instrument SSA merk Perkin
Elmer SSA 3110®, Tipe nyala api yaitu Asetilen : udara, neraca analitik merk
Denver®, kertas Whatman No.42, vacuum dan botol plastik.
F. Tata Cara Penelitian 1. Pencucian Wadah dan Peralatan
Peralatan dan wadah yang akan digunakan untuk analisis, dibilas dengan
asam pencucikemudian didiamkan pada lemari asam selama 24 jam lalu dibilas
dengan aquabidest. Dilakukan pergantian asam pencuci ketika warnanya sudah
berubah menjadi kehijauan. Setelah kering, alat ini dimasukkan dalam kantong
2. Pemilihan Sampel
Sampel cacing Lumbricus rubellus dibeli langsung dari petani cacing di
Nyamplung, Gamping Yogyakarta. Cacing yang digunakan memiliki ciri-ciri
warna bagian atas tubuh merah dan bawah tubuh merah pucat dan adanya warna
kuning bagian anus.
3. Penimbangan Bobot Kering Sampel
Wadah dipanaskan dalam oven pada suhu 105oC selama 1 jam,
ditimbang kemudian dipanaskan kembali dalam oven pada suhu 105oC selama 1
jam. Cara ini dilakukan berulang kali sampai diperoleh bobot tetap. Bobot tetap
berarti selisih dua kali penimbangan sampel berturut-turut tidak lebih dari 0,5 mg
tiap g sisa yang ditimbang. Penimbangan bobot kering juga dilakukan terhadap
sampel yang digunakan. Ditimbang 1-2 g sampel kemudian lakukan seperti
prosedur diatas menggunakan wadah yang telah dikuantifikasi (Dirjen POM,
1974).
4. Destruksi Cacing Lumbricus rubellus
a. Destruksi Basah. Ditimbang seksama dua setengah gram sampel (bobot
kering), dalam labu Erlenmeyer 50 ml (sebelumnya dicuci asam dan
dikeringkan). Ditambahkan 7,5 ml H2SO4 pekat diikuti oleh 12,5 ml HNO3
pekat ke dalam labu sampel. Sampel dipanaskan menggunakan hotplate
pada suhu ±130°C (mendidih). Ketika dipanaskan akan keluar asap
cokelat-kuning. Setelah asap cokelat-kuning tersebut hilang, maka akan mucul asap
putih dari H2SO4 yang menunjukkan terjadinya proses penguraian H2SO4
pekat setetes demi setetes. Dilanjutkan sampai warna larutan menjadi jernih,
yaitu berwarna kuning jerami. Jika larutan itu masih gelap warnanya
ditambahkan HNO3 pekat perlahan-lahan dan dididihkan lagi. Proses ini
diulangi sampai larutan tersebut jernih, kuning jerami dan ketika
dimasukkan kedalam wadah yang berisi es tidak terbentuk gumpalan
minyak. Sampel dibiarkan mendingin sampai suhu kamar (dilakukan tiga
kali replikasi) (AOAC, 2007).
b. Penyaringan. Penyaringan dilakukan dengan menggunakan corong burner
dan Kertas Whatman No. 42. Kertas Whatman No. 42 dijenuhkan dengan
HNO3 1 M lalu diletakkan di bagian atas corong. Corong diletakkan pada
mulut labu isap. Sebanyak 5 ml HNO3 1 M dituangkan ke dalam erlenmeyer
yang berisi timbal hasil destruksi basah lalu disaring. Kedalam Erlenmeyer
kosong dibilas dengan 5 mL HNO3 1 M sebanyak 2 kali untuk mengantipasi
sampel tertinggal di Erlenmeyer. Sebanyak 5 ml HNO3 1 M dituangkan ke
dalam labu isap melewati kertas saring tadi untuk mengantisipasi adanya
sampel yang tertinggal di kertas saring dan corong. Larutan hasil
penyaringan dipindahkan ke dalam labu ukur 50 mL kemudian ditambahkan
HNO3 1 M hingga batas tanda pada labu ukur. Larutan dipindahkan ke
wadah plastic dan disimpan dalam lemari pendingin. Larutan siap diujikan
ke SSA pada kondisi optimum (dilakukan tiga kali replikasi) (AOAC,
5. Kondisi Optimum Analisis
a. Optimasi Tinggi Burner. Tekanan bahan bakar dan gas pembawa diatur
sampai nyala api stokiometrik nyala berwarna kuning tipis. Tekanan
dinaikkan sampai nyala berpijar kuning kuat. Larutan Pb 5 µg/ml disiapkan
dan absorbansinya dicatat pada 217 nm dan λ diatur hingga absorbansi
maksimum. Tinggi burner diatur hingga cahaya tampak melalui ujungnya
dengan tombol. Aquadest digunakan untuk men “zero” kan instrumen lalu
diukur absorbansi dari larutan Pb lima µg/ml.
b. Optimasi Untuk Perbandingan Bahan Bakar dan Oksidator. Digunakan tipe
nyala udara : asetilen dengan perbandingan 20:5 dan 20:10. Tekanan udara
dijaga konstan dan tekanan bahan bakar diatur bertahap dari kaya bahan
bakar hingga nyala kecil. Absorbansi Pb 5 µg/ml dicatat pada setiap
penambahan. Tekanan bahan bakar dipilih yang optimum dan tekanan udara
diubah dengan cara yang sama. Absorbansi vs tekanan udara diplot, dengan
catatan satu dibuat konstan. Setting tekanan bahan bakar dipilih yang
optimum.
6. Kurva Baku
a. Larutan Stok (1000 µg/ml). Dilarutkan 0,31970 g Pb(NO3)2 dalam 50 ml
HNO3 1M dalam labu takar 200 ml, kemudian ditambahkan HNO3 1M
Konsentrasi 1000 µg/ml didapat dari:
b. Larutan Intermediet 100 µg/ml. Pembuatan larutan Pb 100 µg/ml dengan
cara memipet 10 ml larutan stok lalu di ditambahkan dengan HNO3 1M
hingga batas tanda pada labu takar 100 ml. Buat seri konsentrasi dari
larutan intermediet yaitu 0.1, 0.5, 1, 1.5, 2, 2.5, 3 µg/ml. Kurva kalibrasi
unsur Pb diperoleh dengan mengukur serapan larutan standar unsur pada
kondisi optimum (dengan menggunakan tinggi burner dan perbandingan
bahan bakar dan udara hasil optimasi diawal). Dari hasil yang didapatkan
ditentukan linearitas dengan memplotkan absorbansi dan konsentrasi,
membuat kisaran linearitas dan menentukan sensitivitas alat dengan
menghitung LOD.
7. Validasi Metode Analisis
a. Prosedur Standar Adisi. Sebelum proses destruksi ke dalam 2.5 g sampel
(bobot kering) ditambahkan standar PbNO3 dengan konsentrasi 0, 2, 4, 6, 8
dan 10 µg/ml sebanyak 10 ml. Setelah didestruksi kemudian disaring
dengan kertas Whatman no.42 dan diukur absorbansinya menggunakan SSA
pada kondisi optimum dengan panjang gelombang (λ) 217 nm. Proses ini
dilakukan sebanyak tiga kali replikasi. Hasil pembacaan alat digunakan
8. Penetapan Kadar
a. Penyiapan Sampel. Sebanyak dua buah wadah yang berisikan media dari
serbuk kayu dimasukkan cacing Lumbricus rubellus 1 kg untuk setiap
wadah dan diberikan perlakuan yaitu pemberian pangan daun tercemar
timbal (Pb) yang diperoleh dari pohon di jalan Godean, Yogyakarta.
Kemudian daun-daun ini disemprotkan dengan PbNO3 10µg/ml secara
merata dan difermentasi selama seminggu menggunakan cairan EM4®.
Pemberian pangan dilakukan semenjak cacing Lumbricus rubellus berumur
2 minggu hingga 2 bulan. Dimana pemberian pangan dilakukan setiap 6
kali sehari.
b. Preparasi Sampel. Sebanyak sejumlah cacing lalu direndam didalam air
panas. Jika cacing tidak bergerak lagi diangkat dari wadah lalu dikering
anginkan.
c. Destruksi Basah. Ditimbang seksama dua setengah gram sampel (bobot
kering), dalam labu Erlenmeyer 50 ml (sebelumnya dicuci asam dan
dikeringkan). Ditambahkan 7,5 ml H2SO4 pekat diikuti oleh 12,5 ml HNO3
pekat ke dalam labu sampel. Sampel dipanaskan menggunakan hotplate
pada suhu ±130°C (mendidih). Ketika dipanaskan akan keluar asap
cokelat-kuning. Setelah asap cokelat-kuning tersebut hilang, maka akan mucul asap
putih dari H2SO4 yang menunjukkan terjadinya proses penguraian H2SO4
dan sampel akan berwarna lebih gelap. Dengan segera ditambahkan HNO3
pekat setetes demi setetes. Dilanjutkan sampai warna larutan menjadi jernih,
ditambahkan HNO3 pekat perlahan-lahan dan dididihkan lagi. Proses ini
diulangi sampai larutan tersebut jernih, kuning jerami dan ketika
dimasukkan kedalam wadah yang berisi es tidak terbentuk gumpalan
minyak. Sampel dibiarkan mendingin sampai suhu kamar (dilakukan dua
kali replikasi) (AOAC, 2007).
d. Penyaringan. Penyaringan dilakukan dengan menggunakan corong burner
dan Kertas Whatman No. 42. Kertas Whatman No. 42 dijenuhkan dengan
HNO3 1 M lalu diletakkan di bagian atas corong. Corong diletakkan pada
mulut labu isap. Sebanyak 5 ml HNO3 1 M dituangkan ke dalam erlenmeyer
yang berisi timbal hasil destruksi basah lalu disaring. Kedalam Erlenmeyer
kosong dibilas dengan 5 mL HNO3 1 M sebanyak 2 kali untuk mengantipasi
sampel tertinggal di Erlenmeyer. Sebanyak 5 ml HNO3 1 M dituangkan ke
dalam labu isap melewati kertas saring tadi untuk mengantisipasi adanya
sampel yang tertinggal di kertas saring dan corong. Larutan hasil
penyaringan dipindahkan ke dalam labu ukur 50 mL kemudian ditambahkan
HNO3 1 M hingga batas tanda pada labu ukur. Larutan dipindahkan ke
wadah plastic dan disimpan dalam lemari pendingin. Larutan siap diujikan
ke SSA pada kondisi optimum (dilakukan dua kali replikasi) (AOAC,
2007).
e. Penetapan Kadar. Larutan hasil destruksi diujikan ke SSA dengan kondisi
optimum dan diukur absorbansinya dengan panjang gelombang (λ) 217 nm.
Lalu dihitung kadarnya dan dibuat kurva antara peningkatan kadar timbal
G. Tata Cara Analisis Hasil 1. Validasi Alat Untuk Determinasi
a. Linearitas. Linearitas ditentukan dari koefisien korelasi (r) yang diperoleh
dari kadar dan serapan dari data penentuan kurva baku ke dalam regresi
linear.
b. Sensitivitas. Sensitivitas alat dapat ditentukan dengan menghitung LOD
dengan rumus:
Keterangan: Sa : standar deviasi dari intercept kurva baku dan b : slope
2. Validasi Metode
a. Akurasi. Akurasi dapat dihitung dengan rumus:
Perolehan Kembali (recovery) =
x 100%
b. Presisi. Presisi dapat dihitung dengan rumus:
Kesalahan Acak (%RSD) =
c. Intermediate Precision. Kesesuain alat ditentukan dengan uji-t terhadap
slope dan intersept dari 2 kurva baku yang dibaca pada hari yang berbeda.
d. Limit of Quantitation. Limit Of Quantitation (LOQ) dapat dihitung dengan
rumus:
e. Pengaruh Prosedur Analisis. Pengaruh prosedur analisis ditentukan dengan
membandingkan antara kurva baku dengan kurva standar adisi. Dilihat
apakah terdapat perbedaan slop yang signifikan antara kurva baku dengan
BAB IV
HASIL DAN PEMBAHASAN
Penelitian yang berjudul “Pengaruh Pangan yang Dicemari Logam Berat Timbal
(Pb) Terhadap Kadar Timbal pada Cacing Lumbricus rubellus” dilakukan
beberapa tahapan seperti destruksi basah optimasi spektroskopi serapan atom,
pembuatan kurva baku, preparasi sampel dengan menggunakan destruksi basah,
pembuatan kurva adisi, perhitungan validasi metode dan penetapan kadar sampel.
A.Pemilihan Sampel
Sampel yang digunakan dalam penelitian ini adalah cacing Lumbricus
rubellus yang dibeli langsung dari petani cacing di Nyamplung Gamping
Yogyakarta. Cacing Lumbricus rubellus yang dibeli sudah dewasa dan siap untuk
berkembangbiak. Cacing Lumbricus rubellus memiliki ciri-ciri spesifik yang
membedakannya dengan cacing tanah lainnya yaitu perbedaan warna antara
bagian atas badan cacing dan bagian bawah cacing. Pada bagian atas berwarna
merah sedangkan pada bagian bawah berwarna merah pucat. Selain itu pada
bagian anus cacing Lumbricus rubellus berwarna kuning. Hal ini ditunjukkan
Gambar 2. Cacing Lumbricus rubellus
B.Destruksi Sampel
Metode destruksi ada 2 jenis yaitu destruksi kering dan destruksi
basah. Destruksi kering merupakan metode untuk mengekstraksi cemaran
logam dengan cara mengabukan (ashing) sampelnya dengan suhu diatas 500oC
sedangkan destruksi basah melibatkan degradasi kimia dari matriks sampel
dalam larutan, biasanya dengan kombinasi asam untuk meningkatkan kelarutan
elemen yang akan dianalisis.
Dalam penelitian ini digunakan metode destruksi basah karena:
a. Destruksi kering dapat menyebabkan beberapa elemen seperti AS, Cr dan
Pb pada saat pemanasan dan memungkinkan terjadinya adsorpsi pada
dinding tungku pada pengabuan dengan suhu 500-5500C (Hseu dan Yei,
2004).
b. Dalam penelitian Sastre et al. (2002) menyatakan destruksi menggunakan
asam nitrat merupakan metode yang optimal untuk menentukan jumlah
logam berat dalam sampel tanah dengan jumlah material organik yang
c. Dalam penelitian Zheljazkov dan Warman (2002) membandingkan antar
asam nitrat, campuran asam nitrat-asam perklorat dan metode destruksi
basah untuk menganalisis 17 elemen dalam 6 kompos dari Kanada. Hasil
penelitian menunjukkan dengan jumlah yang sama, antara asam nitrat
dengan campuran campuran asam nitrat-asam perklorat memberikan
perolehan kembali (recovery) yang lebih baik daripada digesti kering untuk
Cd dan Pb (Hseu dan Yei, 2004).
d. Dalam penelitian ini digunakan campuran asam nitrat-asam sulfat karena
mengutamakan keamanan (safety) dalam bekerja. Penggunaan dari asam
perklorat perlunya penanganan khusus karena mampu meledak dan mudah
mengoksidasi material inorganik (Twyman, 2005).
Untuk sampel organik secara umum digunakan campuran 1:2 asam sulfat
dan asam nitrat. Asam nitrat akan mengurai sebagian besar material organik akan
tetapi tidak mencapai suhu yang cukup untuk menghancurkan material organik
yang tersisa karena terlebih dahulu menguap dan yang tertinggal adalah asam
sulfat. Asap SO3 akan memenuhi labu dan membuat larutan menjadi semakin
panas dan memungkinkan asalm sulfat untuk mengurai bahan organik yang
tersisa. Ketika timbul asap putih menunjukkan asam sulfat mulai terurai jadi perlu
ditambahkan asam nitrat sedikit demi sedikit untuk memperpanjang proses
destruksi maka demi keamanan pengerjaan dengan metode ini harus dikerjakan
dalam lemari asam karena asap yang dihasilkan (Twyman, 2005).
Asam nitrat berfungsi sebagai pengoksida yang utama dan asam sulfat
sisa-sisa material organik yang tidak bisa dihancurkan oleh sama nitrat. Reaksi
yang terjadi adalah sebagai berikut:
H2SO4
3Pb + 8HNO3 3Pb2+ + 6 NO3- + 2NO + 4H2O (1)
C.Optimasi Spektroskopi Serapan Atom
Hal yang dilakukan pertama kali adalah pengaturan alat spektroskopi
serapan atom untuk memperoleh hasil analisis yang sensitif. Ketika instrumen
yang akan digunakan dioptimasi diharapkan semakin banyak atom-atom yang
menyerap dalam nyala api sehingga serapan yang dihasilkan semakin banyak
pula. Pada kondisi optimum akan diperoleh serapan yang maksimum. Dalam
penelitian ini spektroskopi serapan atom yang digunakan adalah tipe serapan
(absorbation) dari logam timbal (Pb).
Parameter kondisi optimum pada alat spektroskopi serapan atom meliputi
garis resonansi, lebar celah, kuat arus lampu katoda, laju alir udara dan asetilen,
kuat arus lampu katoda, dan tinggi pembakar burner. Data hasil pengoptimasian
instrumen tersaji lengkap pada tabel IV dan data ini diperoleh dari Fakultas MIPA
[image:53.595.103.511.338.738.2]Universitas Gadjah Mada.
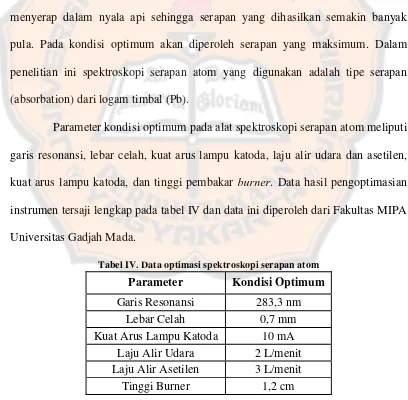
Tabel IV. Data optimasi spektroskopi serapan atom
Parameter Kondisi Optimum
Garis Resonansi 283,3 nm Lebar Celah 0,7 mm Kuat Arus Lampu Katoda 10 mA
1. Garis Resonansi
Monokromator dalam spektroskopi serapan atom berfungsi untuk
mengecilkan garis resonansi dari semua garis resonansi yang tidak diserap yang
dipancarkan oleh sumber. Dari hasil optimasi yang dilakukan oleh Fakultas MIPA
Universitas Gadjah Mada didapatkan garis resonansi yang optimal untuk sampel
Pb yaitu 283,3 nm karena pada panjang gelombang ini merupakan panjang
gelombang yang kuat untuk menyerap transisi elektron dari keadaan dasar
(ground state) ke keadaan tereksitasi. Saat atom-atom dalam keadaan dasar maka
ketika diberikan energi, atom tersebut akan tereksitasi namun pada kondisi
tereksitasi atom-atom ini tidak stabil sehingga melepaskan energi yang diserapnya
dalam bentuk sinar dan kembali ke keadaan dasar.
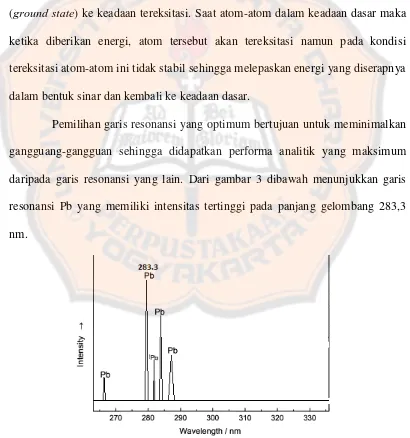
Pemilihan garis resonansi yang optimum bertujuan untuk meminimalkan
gangguang-gangguan sehingga didapatkan performa analitik yang maksimum
daripada garis resonansi yang lain. Dari gambar 3 dibawah menunjukkan garis
resonansi Pb yang memiliki intensitas tertinggi pada panjang gelombang 283,3
[image:54.595.104.514.300.738.2]Intensitas relatif dari garis spektral tergantung pada jumlah populasi
atom. Perubahan suhu dapat mempengaruhi jumlah atom yang berada pada
keadaan tereksitasi. Maka dapat dihitung jumlah populasi atom yang menyerap
sinar dari hollow catoda lamp dan membuat atom tersebut berpindah dari keadaan
dasar ke keadaan tereksitasi dengan persamaan yang dikemukakan oleh
Maxwell-Boltzmann yaitu:
Keterangan, N = jumlah populasi atom (1=dari hollow katoda ; 0 =dari sisa sinar yang diteruskan),
P1 = absorbansi dari lampu hollow katoda, P0 = absorbansi dari sisa sinar yang diteruskan, k =
konstanta Boltzmann (1,38x10-23 J/K), =transisi energi (E1-E0)
(Lajunen, 2004)
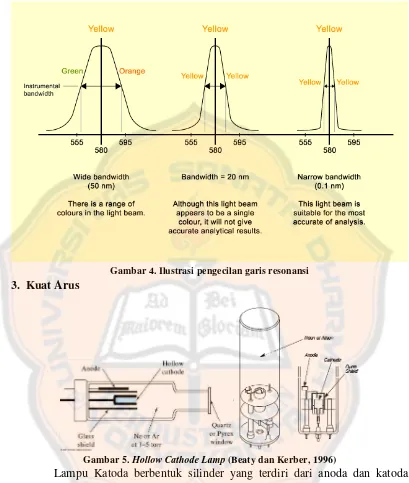
2. Lebar Celah
Lebar Celah monokromator harus dipilih untuk mengoptimasi signal to
noise ratio. Lebar celah dalam spektrofotometri serapan atom harus sebesar yang
diperlukan untuk mengisolasi garis resonansi yang diperlukan. Semakin kecil
lebar celah yang dilakukan akan memperkecil gangguan spektranya. (Narsito,
1992). Pada kondisi optimum lebar celah yang digunakan adalah 0,7 mm, ini
menunjukkan bahwa lebar celah yang digunakan sangat kecil sehingga efektif
Gambar 4. Ilustrasi pengecilan garis resonansi 3. Kuat Arus
Gambar 5. Hollow Cathode Lamp (Beaty dan Kerber, 1996)
Lampu Katoda berbentuk silinder yang terdiri dari anoda dan katoda
yang ditutupi denga kaca Quartz silinder yang diisi dengan gas neon atau argon
dengan tekanan 1-5 torr seperti yang ditunjukkan pada gambar 5. Pengisian gas
yang optimum untuk memberikan intensitas yang maksimum digunakan saat
ketika lampu diisi dengan gas neon sedangkan yang diisi dengan gas argon
menimbulkan warna biru (Elmer, Hon dan Miller, Hon dan Miller 1996).
Pada bagian katoda dilapisi logam yang sesuai dengan logam yang akan
dianalisis. Anoda diberi tegangan sehingga bila sejumlah kecil arus yang
diberikan di antara katoda dan anoda akan mengakibatkan gas yang ada di dalam
tabung akan mengalami ionisasi sehingga ion gas akan tertarik ke arah katoda
dengan kecepatan tinggi menyebabkan terjadinya tumbukan yang mengakibatkan
tereksitasinya atom-atom logam yang ada dikatoda. Peristiwa tumbukkan ini
[image:57.595.102.510.266.607.2]disebut sputtering ditunjukkan pada gambar 6.
Gambar 6. Sputtering (Beaty dan Kerber, 1996)
Ketika atom kembali ke keadaan dasar (ground state), garis resonansi
tertentu akan diemisikan oleh atom tersebut dalam hal ini atom timbal. Sinar akan
diteruskan ke nyala api dan atom dengan elemen yang sama dengan elemen
katoda (Pb) akan menyerap sinar ini dan akan mengalami eksitasi. Hasil optimasi
kuat arus yang dibutuhkan untuk menghasilkan sinar yang memiliki spektrum
spesifik dengan garis resonansi 283,3 nm sebesar 10mA.
Kuat arus lampu katoda yang disarankan tergantung pada unsur yang
akan dianalisis. Kuat arus yang digunakan sebaiknya seoptimal mungkin karena
jika kuat arus yang digunakan terlalu rendah akan menyebabkan intensitas lampu
menjadi terlalu sinar rendah sehingga sinar yang dihasilkan juga rendah
Efisiensi lampu katoda cekung bergantung pada bentuk geometri dari
katodanya dan besarnya tegangan listrik yang diberikan. Peningkatan pemberian
arus pada lampu katoda, pada umumnya akan meningkatkan intensitas akan tetapi
akan mengurangi umur dari lampu tersebut. Peningkatan ini tetap ada batasnya.
Jika pemberian tegangan berlebihan maka akan akan terjadi penyerapan sendiri
(self absorption) karena terjadinya peningkatan jumlah atom-atom yang tidak
tereksitasi dan menyerap emisi yang dipancarkan sendiri. Hal ini dapat
mengurangi intensitas dari lampu tersebut (Underwood, 2002).
4. Perbandingan Udara-Asetilen
Kombinasi udara-asetilen menghasilkan tipe nyala yang lebih banyak
digunakan dalam mendeterminasi 35 elemen dengan spektroskopi serapan atom.
Temperatur dari kombinasi udara-asetilen ini sekitar 23000C. Rasio dari
udara-asetilen perlu dioptimasi untuk mendapatkan sensitivitas yang maksimum (Elmer,
Hon dan Miller, 1996).
Udara digunakan sebagai bahan pengoksida dan astilen digunakan
sebagai bahan pembakar. Laju oksida dan pembakar yang optimal yaitu asetilen 3
mL/menit dan udara 2 mL/menit. Tipe nyala yang dihasilkan yaitu ‘Lean’ flame
ini merupakan kondisi yang baik karena timbal akan cenderung dalam keadaan
atom dibandingkan keadaan oksidanya. Selain itu pada kondisi ‘Lean’ flame suhu
yang dihasilkan akan lebih tinggi dibandingkan ‘Rich’ flame (kondisi pembakar
lebih banyak dan mengurangi jumlah timbal dari bentuk oksida menjadi bentuk
pengabutan (nebulizer) yang mengubah sampel menjadi uap (aerosol) yang siap
masuk ke dalam nyala api untuk atomisasi.
[image:59.595.100.496.166.702.2]Gambar 7. Sistem nebulizer (Beaty dan Kerber, 1996)
5. Tinggi Burner
Tinggi burner Spektroskopi Serapan Atom perlu dioptimasi karena
parameter ini menentukan letak atau posisi pembakaran sampel yang optimal di
burner yang selanjutnya akan mempengaruhi hasil bacaan detektor. Posisi
pembakaran sampel yang optimum akan menentukan sempurnanya pembakaran
[image:60.595.99.511.256.605.2]yang terjadi sehingga proses atomisasi bisa maksimal.
Gambar 9. Flame Structure (Abdel, 2010)
Dari gambar 9 diatas menunjukkan struktur dari nyala yang digunakan
dalam spektroskopi serapan atom. Nyala terbagi menjadi 3 zona yaitu primary
contribution zone, interzonal region dan secondary contribution zone. Primary
contribution zone adalah zona dimana belum terjadi kesetimbangan termal, dalam
zona ini masih kaya akan bahan pembakar dan belum adanya sampel yang
teratomisasi. Interzonal region adalah zona yang relatif sempit dan daerah ini
terjadi peristiwa atomisasi sehingga zona ini merupakan zona yang kaya akan
atom bebas sehingga dipilih untuk spektroskopi. Selain itu zona ini juga
merupakan zona dengan suhu tertinggi. Secondary contribution zone adalah zona
dimana terjadi reformasi molekul dari atom-atom bebas menjadi bentuk oksida
dibandingkan dengan interzonal region (Abdel, 2010), Profil suhu dari nyala
[image:61.595.101.512.168.611.2]spektroskopi serapan atom dapat dilihat pada gambar 10 dibawah ini :
Gambar 10. Profil suhu nyala (Abdel, 2010)
Dari gambar 10 dapat dilihat suhu tertinggi adalah diatas 1 cm primary
contribution zone. Pembakaran yang optimum akan menghasilkan atom bebas
dalam jumlah banyak sehingga pembacaan hasil oleh detektor juga semakin
optimal. Tinggi burner yang optimal hasil optimasi Fakultas MIPA Universitas
Gadjah Mada yaitu 1,2 cm.
D.Validasi Instrumen Analisis
Validasi instrumen adalah proses yang terdokumentasi yang memastikan
bahwa instrumen yang digunakan bekerja dengan benar selain itu untuk memiliki
keyakinan terbukti dalam pengukuran analitis, setiap komponen yang memberikan
kontribusi terhadap kualitas keseluruhan hasil harus diidentifikasi dan
benar dan karenanya tidak memiliki efek yang merugikan untuk hasil analisis.
Validasi instrumen merupakan suatu keharusan bagi perusahaan farmasi untuk
melakukan validasi instrumen (Anonim, 2008). Validasi instrumen dapat
dilakukan dengan cara menguji linearitas, kisaran linearitas dan sensitivitas alat.
1. Linearitas
Linearitas berguna untuk melihat apakah detektor memberikan hasil yang
linear terhadap konsentrasi analit yang kemudian dibuat kurva kalibrasi untuk
mendapatkan persamaan regresi linear. Persamaan regresi linear sebagai berikut:
Y = (a±Sa) +(b±Sb)x
Dimana y = respon detektor, a = intercept, b = slope, x = kadar, dengan standar
deviasi dari intercept dan slope yaitu Sa dan Sb (González dan Herrardor, 2007).
Rekomendasi dari ICH, dalam menguji linearitas setidaknya 5 tingkat
konsentrasi yang harus digunakan dan linearitas tercapai ketika nilai dari
coefficient of determination (r2) ≥ 0,997 atau r ≥ 0,9985. Slope dari regresi linear
akan memberikan gambaran tentang sensitivitas. (Chan, Lee, Herman, dan Xue,
2004).
Pada suatu penetapan kadar hendaknya pembuatan kurva baku dilakukan
setiap akan memulai suatu proses penetapan kadar. Hal tersebut dimaksudkan
agar kurva baku yang dibuat merupakan kurva baku yang teraktual dengan
kondisi spektroskopi serapan atom yang ada, karena dalam selang rentang waktu
tertentu kurva baku yang ada bisa saja memiliki nilai r yang sama dengan kurva
baku pada pembuatan waktu sebelumnya namun tidak dengan nilai slope (b) yang
solution. Working solution adalah larutan yang dipreparasi dari larutan stok yang
kemudian diencerkan dengan pelarut yang sesuai dan membuat konsentrasi yang
diinginkan. Sebanyak 6 buat larutan baku Pb(NO3)2dengan konsentrasi 0,1-3
µg/mL diukur absorbansinya menggunakan spektroskopi serapan atom yang
[image:63.595.103.511.246.603.2]sudah dioptimasi terlebih dahulu didapatkan hasil pada gambar 11.
Gambar 11. Kurva Baku Pb(NO3)2
Dari 6 analit yang digunakan sudah memenuhi persyaratan yang
ditetapkan oleh ICH yaitu sekurang-kurangnya 5 konsentrasi dan hasil coefficient
of determination (r2) yang didapatkan sebesar 0,9985 atau r = 0,9992. r = 0,9992
menunjukkan 99,9% perubahan absorbansi dipengaruhi oleh perubahan
konsentrasi analit (Pb(NO3)2). Kisaran linear dari kurva diatas yaitu 0,1-3 µg/mL.
Dapat disimpulkan hasil uji linearitas yang tercantum pada lampiran 9 memenuhi
syarat yang ditetapkan oleh ICH dan instrumen yang digunakan memberikan
respon yang linear terhadap konsentrasi analit.
y = 0,0126x + 0,0027 R² = 0,9985
0 0,01 0,02 0,03 0,04 0,05
0 0,5 1 1,5 2 2,5 3 3,5
Abso
rb
an
si
Konsentrasi (µg/mL)
Kurva Baku Pb(NO
3)
2Konsentrasi vs absorbansi
<