Gambaran Umum Gaharu (A. malaccencis Lamk.)
Dalam klasifikasi tumbuhan, gaharu (A. malaccencis Lamk.) termasuk dalam divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledone, ordo Thymelaeles, famili Thymeliaceae, genus Aquilaria dan spesies A. malaccensis Lamk (Ponirin, 1997). Menurut Sumarna (2002) di Indonesia ada 8 genus dan 16 spesies tanaman penghasil gaharu antara lain adalah dari genus Aquilaria sp, Aetoxylon, Enkleia, Gonystylus sp, Wikstroemia sp, Grynops, Dalbergia dan Excoccaria. Genus Aquilaria memiliki 6 spesies A. beccariana, A. cumingiana, A.
filaria, A. hirta, A. malaccensis, dan A. microcarpa (Soehartono 1997 dalam Barden et al. 2000). Di beberapa daerah di Indonesia gaharu dikenal dengan nama yang berbeda-beda seperti layak, pohon pelanduk, kayu linggu, menameng, dan terentak. Dalam perdagangan dunia gaharu ini dikenal dengan nama agarwood, aloewood dan eaglewood (Sumarna, 2002).
Secara morfologi, tinggi pohon gaharu dapat mencapai 40 meter dengan diameter batang mencapai 60 cm. Kulit batang licin, berwarna putih atau keputih- putihan, kadang-kadang beralur. Bentuk daunnya lonjong agak memanjang, dengan ukuran 5 – 8 cm, lebar 3 – 4 cm, berujung runcing, dan berwarna hijau mengkilap (Sumarna, 2002). Menurut Ponirin (1997), daun yang kering biasanya berwarna abu-abu kehijauan, tepi daun agak bergelombang, melengkung dan kedua permukaannya licin serta mengkilap, tulang daun sekunder 12 – 16 pasang.
Bunga berada di ujung ranting atau ketiak atas dan bawah daun. Buah berada dalam polong berbentuk bulat telur atau lonjong, berukuran panjang sekitar 5 cm, dan lebar sekitar 3 cm, biji bulat atau bulat telur yang ditutupi bulu-bulu halus berwarna kemerahan (Sumarna, 2002).
Produksi gubal gaharu memerlukan pohon gaharu dan mikroba untuk menginduksi pembentukan senyawa gaharu. Gubal gaharu terbentuk sebagai reaksi pertahanan pohon terhadap infeksi patogen, melalui pelukaan pada batang, cabang, atau ranting atau pengaruh fisik lainnya. Infeksi patogen mengakibatkan keluarnya resin yang terdeposit pada jaringan kayu. Lama kelamaan jaringan kayu ini akan mengeras dan berubah warnanya menjadi coklat sampai kehitaman,
bagian ini menjadi berat dan berbau wangi (Hou, 1960). Patogen yang biasa dijumpai menginfeksi pohon gaharu adalah dari jenis mikroorganisme seperti cendawan. Jenis cendawan yang telah diketahui sebagai pembentuk gaharu ialah Fusarium sp., Phytium sp., Lasiodiplodia sp., Libertela sp., Trichoderma sp., Scytalidium sp., dan Thielaviopsis sp. (Sumarna, 2002).
Penyebaran dan Tempat Tumbuh
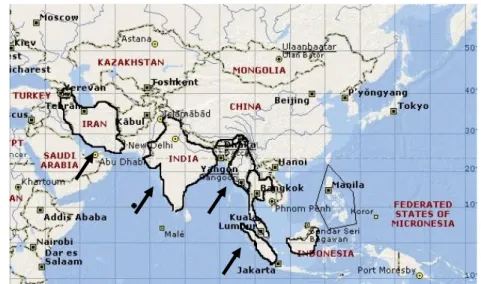
Penyebaran gaharu dimulai dari Iran, India, Vietnam, Malaysia, Sumatera, Kalimantan, Serawak dan Filiphina (Gambar 1 dan 2) (Rimbawanto dan Pamungkas, 2004). Di Indonesia daerah penyebaran gaharu antara lain terdapat di kawasan Sumatera, Kalimantan, Sulawesi, Maluku, Papua, Nusa Tenggara dan Jawa. Secara ekologis jenis-jenis gaharu di Indonesia tumbuh pada daerah dengan ketinggian 0 – 2400 meter di atas permukaan laut. Umumnya gaharu yang berkualitas baik tumbuh pada daerah yang beriklim panas dengan suhu 28–34º C, kelembaban 60 – 80%, dan curah hujan 1000 – 2000 mm/tahun (Sumarna, 2002).
Gambar 1. Peta Penyebaran Gaharu (A. malaccensis Lamk.) di Dunia (Rimbawanto dan Pamungkas, 2004)
Gambar 2. Peta Penyebaran Gaharu (A. malaccensis Lamk.) di Indonesia (Rimbawanto dan Pamungkas, 2004).
Kandungan dan Manfaat Gubal Gaharu
Hasil analisis kimia, gaharu memiliki 6 komponen utama berupa furanoid sesquiterpene diantaranya ialah a-agarofuran, b-agarofuran, dan agarospirol.
Selain itu gaharu jenis A. malaccensis asal Kalimantan ditemukan komponen pokok minyak gaharu berupa chromone. Chromone ini menyebabkan bau harum dari gaharu apabila dibakar. Komponen minyak atsiri yang dikeluarkan gaharu berupa sequiterpenoida, eudesmana, dan valencana (Sumarna, 2002).
Pemanfaatan gaharu hingga saat ini masih dalam bentuk bahan baku yaitu kayu bulatan, cacahan, bubuk, atau fosil kayu yang sudah terkubur. Aroma yang dikeluarkan gaharu sangat populer dan disukai masyarakat Timar Tengah, Saudi Arabia, Uni Emirat, Yaman, Oman, daratan China, Korea, dan Jepang. Menurut Chakrabarty et al. (1994) gubal gaharu digunakan sebagai dupa, wewangian, penghilang rasa sakit, asma, reumatik, tonik saat hamil setelah melahirkan.
Menurut Barden et al. (2000), gubal gaharu juga dimanfaatkan sebagai pelengkap dalam acara ritual keagamaan pada masyarakat khususnya di kawasan Asia dan Timut Tengah dalam bentuk dupa, hio, atau kemenyan.
Di Cina, gaharu dimanfaatkan untuk pengobatan berbagai macam penyakit yang menyerang perut, ginjal, dan dada, kemudian untuk kanker, kolik, diare, cegukan dan tumor (paru-paru). Dalam pengobatan Ayurvedic (India kuno) gaharu juga digunakan sebagai pengobatan penyakit mental dan pengusir roh jahat sedangkan di Mesir digunakan untuk meminyaki jenazah (Soehartono dan Mardiastuti, 2003).
Kultur Jaringan
Kultur jaringan adalah suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, sekelompok sel, jaringan dan organ, serta menumbuhkannya dalam kondisi aseptik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali (Gunawan, 1992). Hartmann et al. (1990), menyatakan bahwa teknik ini dapat digunakan untuk perbanyakan tanaman, perbaikan tanaman, menghasilkan tanaman bebas virus, produksi metabolit sekunder dan preservasi tanaman. Dasar teknik kultur jaringan adalah bahwa sel tanaman mempunyai sifat totipotensi yaitu kemampuan sel untuk tumbuh dan berkembang membentuk tanaman lengkap dalam medium aseptik yang mengandung unsur hara dan ZPT yang sesuai. Dengan sifat totipotensi ini, akan menjadi konsep dasar dalam pelaksanaan kultur jaringan, karena sel, jaringan maupun organ yang digunakan mampu tumbuh dan berkembang sesuai arahan dan tujuan budidaya in vitro. Umumnya sifat totipotensi lebih banyak dimiliki oleh bagian tanaman yang masih juvenil, muda, dan banyak dijumpai pada daerah-daerah meristematik (Santoso dan Nursandi, 2001).
Kondisi totipotensi bahan tanaman antara satu tanaman dengan tanaman yang lain sangat berbeda, bahkan perbedaan juga mungkin terjadi pada satu tanaman yang sejenis (Santoso dan Nursandi, 2001). Teori totipontensi ini dikemukakan oleh Schwann dan Schleiden pada tahun 1838 dengan melakukan berbagai penelitian untuk membuktikan teori totipotensi dan mencari kondisi yang sesuai untuk regenerasi sel menjadi organisme utuh, namun baru berhasil dibuktikan pada pertengahan abad 1930-an setelah ditemukannya ZPT auksin yaitu IAA (Indole Asetic Acid) dan NAA (Naftalene Asetic Acid) (Yusnita, 2003).
Hartmann et al. (1997), menyatakan bahwa kultur jaringan merupakan suatu istilah yang digunakan sebagai prosedur untuk memelihara dan menumbuhkan jaringan tanaman (kalus, sel, protoplas) dan organ-organ (batang, akar, embrio) dalam kultur aseptik (in vitro). Suksesnya mikropropagasi sebagian besar berhubungan dengan aspek-aspek dari tahapan kultur, antara lain dengan cara memanipulasi dengan memodifikasi media dan kontrol lingkungan. Menurut
Hartmann et al. (1997), secara umum ada empat tahap dalam melakukan mikropropagasi melalui kultur jaringan seperti terlihat pada Gambar 3.
Establishment/Persiapan
Multiplikasi
Pembentukan Akar
Aklimatisasi Empat Tahap
Propagasi In Vitro
Gambar 3. Tahapan-tahapan yang Dilakukan dalam Proses Propagasi Tanaman melalui Kultur Jaringan (Hartmann et al. 1997).
Mikropropagasi melalui kultur jaringan telah menjadi bagian yang sangat penting bagi propagasi komersial pada banyak tanaman. Keuntungan dari mikropropagasi sebagai sistem propagasi telah dikemukakan banyak penulis dan dapat diringkas meliputi: propagasi massal pada klon-klon spesifik, produksi tanaman bebas pathogen, propagasi klonal dari parental stock untuk produksi benih hibrida, produksi bibit berkelanjutan, penyelamatan plasma nutfah (Hartmann et al. 1997), dan dapat menghasilkan tanaman baru yang mempunyai sifat yang sama dengan induknya (Nugroho dan Sugito, 1996).
Menurut George dan Sherrington (1984), ada beberapa faktor yang mempengaruhi pertumbuhan dan morfogenesis yaitu (1) genotip, menyangkut semua sifat genetik dari tanaman, (2) substrat yaitu semua yang menyangkut media, komposisi ZPT (3) lingkungan kultur dan (4) eksplan.
Teknik kultur jaringan juga dapat dimanfaatkan untuk mempelajari 4 bidang pokok (Noerhadi, 1979 dalam Herawan, 2004) yaitu (1) perbanyakan klon-klon terpilih (unggul) yang dapat dihasilkan dalam waktu pendek dan dalam jumlah yang besar, (2) melestarikan keragaman sumber daya genetik alami, (3) produksi bahan alam primer dan sekunder dan (4) perbaikan mutu dan sifat genetik tumbuhan, termasuk tanaman bebas penyakit.
Eksplan yang digunakan dalam perbanyakan tanaman dengan teknik kultur jaringan dapat ditumbuhkan dengan beberapa cara, antara lain dengan pembentukan kalus, langsung embriogenesis atau somatik embriogenesis. Dari
kalus dapat dibentuk kultur suspensi, somatik embriogenesis dan organogenesis dan seterusnya, seperti terlihat pada Gambar 4.
Eksplan
Kalus
Langsung Organogenesis
Somatik Embriogenesis
Kultur Suspensi
Somatik Embriogenesis
Organogenesis
Protoplas
Gambar 4. Skema Proses Perubahan Eksplan dalam Kultur Jaringan Tanaman.
Melalui teknik kultur jaringan dapat pula dilakukan berbagai manipulasi seperti: (1) manipulasi jumlah kromosom melalui bahan kimia atau meregenerasikan jaringan tertentu dalam tanaman seperti endosperma yang mempunyai kromosom 3n, (2) polinasi in vitro dan pertumbuhan embrio yang secara internal abortif, (3) tanaman haploid dan double haploid yang homogenous, (4) hibridisasi somatik melalui teknik fusi protoplasma baik intraspesifik maupun interspesifik, (5) variasi somaklonal dan (6) transfer DNA (Deoxyribo Nucleic Acid) atau organel sel untuk memperoleh sifat tertentu (Tim, 1991).
Zat Pengatur Tumbuh
Menurut Wattimena (1988), zat pengatur tumbuh (ZPT) adalah senyawa organik bukan nutrisi yang aktif dalam konsentrasi rendah yang disintesis pada bagian tertentu dari tanaman dan pada umumnya diangkut ke bagian lain organ tanaman dimana zat tersebut menimbulkan tanggapan secara biokimia, fisiologis dan morfologis. Gunawan (1992) menyatakan bahwa ZPT dalam jumlah sedikit (< 1 mM) dapat merangsang, menghambat atau mengubah pola pertumbuhan dan perkembangan tanaman. Menurut Wudianto (2004), hormon ini hanya efektif pada jumlah tertentu. Konsentrasi yang terlalu tinggi dapat merusak bagian yang
terluka. Bentuk kerusakannya berupa pembelahan sel dan kalus yang berlebihan dan mencegah tumbuhnya tunas dan akar, sedangkan konsentrasi di bawah optimum menjadi tidak efektif.
Zat pengatur tumbuh pada umumnya digunakan secara kombinasi dalam kultur jaringan, dengan konsentrasi berbeda untuk tiap jenis tanaman. Penentuan konsentrasi ZPT disesuaikan dengan tipe organ atau eksplan, metode kultur jaringan dan tujuan kultur jaringan untuk menginduksi tunas, akar, kalus dan lain- lain (Wattimena,1988).
Dalam kultur jaringan, dua golongan ZPT yang sangat penting adalah sitokinin dan auksin. Purwito (2004), menyatakan bahwa auksin berfungsi untuk induksi perakaran dan kalus dalam bentuk endogen adalah IAA sedangkan eksogen adalah IAA, NAA, IBA, 2,4-D, Picloram, 2,4,5,-T dan sitokinin berfungsi sebagai induksi tunas dan kalus dalam bentuk endogen zeatin dan eksogen BAP/BA, Kinetin, 2-iP, dan Thidiazuron. Menurut Gunawan (1992), ZPT ini mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, jaringan dan organ. Interaksi dan perimbangan antara ZPT yang diberikan dalam media dan yang diproduksi oleh sel secara endogen, menentukan arah perkembangan suatu kultur. Penambahan auksin atau sitokinin eksogen, mengubah level ZPT endogen sel. Zat pengatur tumbuh endogen ini kemudian merupakan trigerring factor untuk proses-proses yang tumbuh secara morfogenesis.
Zat pengatur tumbuh memegang peranan penting dalam pertumbuhan dan perkembangan kultur. Menurut Gunawan (1992), faktor yang perlu mendapat perhatian dalam penggunaan ZPT antara lain: jenis ZPT yang digunakan, konsentrasi ZPT, urutan penggunaan, dan periode masa induksi dalam kultur tertentu. Wattimena dan Mattjik (1991), menyatakan bahwa ada beberapa hal yang harus diperhatikan dalam pemberian ZPT diantaranya ZPT harus sampai ke dalam jaringan target, ZPT harus cukup lama dalam jaringan target, ZPT yang diberikan akan berinteraksi dengan fitohormon dan tanaman atau bagian tanaman yang sehat akan memberikan respon yang baik terhadap ZPT yang diberikan.
Sitokinin dan auksin merupakan ZPT yang ditambahkan dalam medium.
Sitokinin dimaksudkan untuk merangsang pembentukkan pucuk, sedangkan auksin untuk merangsang pembentukkan akar (Narayanaswamy, 1973).
Sitokinin mempengaruhi berbagai proses fisiologis di dalam tanaman.
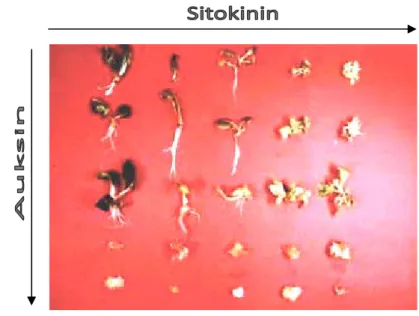
Aktivitas yang utama ialah mendorong pembelahan sel dan aktivitas ini yang menjadi kriteria untuk menggolongkan suatu zat ke dalam sitokinin. Perimbangan ZPT sitokinin dan auksin dalam proses menentukan arah dan perkembangan suatu eksplan dapat dilihat pada Gambar 5.
Gambar 5. Respon Fisiologis ZPT Auksin dan Sitokinin terhadap Perkembangan Eksplan dalam Kultur Jaringan Tanaman. Dari kiri ke kanan peningkatan Sitokinin, dari atas ke bawah peningkatan Auksin (Sumber: http://www.ncbe.reading.ac.uk/
NCBE/PROTOCOLS/planttissue.htm).
Mutasi Genetik dan Variasi Somaklonal
Mutasi adalah perubahan genetik, baik gen tunggal atau sejumlah gen atau susunan kromosom. Mutasi dapat terjadi pada setiap bagian dari pertumbuhan tanaman. Namun lebih banyak terjadi pada bagian yang sedang aktif mengadakan pembelahan sel. Bila mutasi terjadi pada sel somatis, maka perubahan hanya terjadi pada bagian itu dan dapat dilihat pada perkembangan sel dan jaringan ini.
Sedangkan bila terjadi pada sel generatif, maka akan terjadi perubahan menyeluruh pada tanaman keturunannya, dan dapat pula berakibat pada perubahan fisiologis dan biokemis. Mutasi yang disebabkan oleh bahan kimia dapat merubah kemampuan berpasangan rantai DNA sehingga dapat merubah urutan susunan genetik pada kromosom (Poespodarsono, 1987).
Menurut Mattjik (2005), timbulnya variasi genetik dapat terjadi karena pengaruh alam atau perbuatan manusia. Manusia dapat menimbulkan variasi genetik suatu komoditi dengan berbagai cara antara lain melalui persilangan, mutasi, rekayasa genetik dan penggunaan mutagen.
Di dalam kultur jaringan terjadinya variasi genetik karena adanya penyimpangan mitosis yang dapat mengakibatkan tanaman baru yang dihasilkan secara genetik tidak sama dengan induknya yang biasa disebut keragaman somaklonal atau variasi somaklonal. Keragaman somaklonal didefinisikan sebagai keragaman genetik dari tanaman yang dihasilkan oleh sel somatik tanaman yang tumbuh secara in vitro. Keragaman yang berhubungan dengan kultur jaringan dapat disebabkan oleh perubahan jumlah kromosom melalui penggandaan atau reduksi. Keragaman tersebut dapat berasal dari eksplan yang telah memiliki kromosom polisomik.
Terdapat dua dasar terjadinya mutasi yaitu mutasi gen, dimana gen bermutasi dari bentuk dominan ke bentuk resesif dan sebaliknya dan mutasi kromosom yaitu segmen kromosom atau suatu set kromosom yang berubah.
Perubahan susunan maupun jumlah kromosom ini disebut aberasi. Aberasi dapat diklasifikasikan menjadi dua yaitu (1) aberasi struktur kromosom meliputi dilesi, duplikasi dan translokasi dan (2) aberasi jumlah kromosom yang terdiri dari euploid, keragaman dari suatu set kromosom, pada keadaan abnormal dapat menjadi satu (monoploid atau haploid), dua set (diploid), tiga set (triploid) dan empat set (tetraploid) (Suzuki et al. 1981 dalam Mattjik, 2005).
Dalam kasus kultur jaringan yang terjadi adalah mutasi somatik. Kejadian ini banyak dipengaruhi oleh keadaan sel itu sendiri. Sel yang melakukan mutasi akan membelah, kemudian membentuk kumpulan sel yang berbeda dengan induknya, membentuk klon baru yang berbeda dengan induknya. Tanaman baru ini bukan hasil rekombinan atau segregesi seperti hasil persilangan.
Keragaman genetik dalam kultur jaringan dapat terjadi tergantung pada: (1) eksplan yang digunakan (sel, protoplas, kalus atau bagian jaringan), (2) jenis dan ZPT, (3) lamanya fase pertumbuhan, dan (4) komposisi bahan kimia yang digunakan dalam media (Jacobsen, 1987 dalam Mattjik, 2005).
Chawla (2002), menyatakan variasi genetik merupakan komponen yang esensial bagi program pemuliaan untuk memperbaiki karakteristik dari tanaman.
Kultur jaringan tanaman merupakan salah satu sumber potensial terjadinya variasi genetik. Variasi yang dihasilkan dengan menggunakan siklus kultur jaringan dinamakan dengan istilah variasi somaklonal oleh Larkin dan Scowcroft (1981).
Mereka mendefinisikan siklus kultur jaringan adalah suatu proses mengenai pembentukan (establishment) dan dediferensiasi sel atau organ tanaman pada kondisi yang telah ditentukan.
Beberapa faktor yang mempengaruhi terjadinya variasi somaklonal diantaranya adalah (Chawla, 2002):
1. Genotipe; genotipe tanaman dapat mempengaruhi terjadinya frekuensi regenerasi dan frekuensi somaklon
2. Sumber eksplan; sumber eksplan yang telah mempunyai kromosom mosaik dan perbanyakan dengan menggunakan batang dapat menghasilkan jumlah kromosom bervariasi.
3. Lamanya pengkulturan; variasi dapat meningkat dengan ditingkatkannya lama pengkulturan.
4. Kondisi kultur; telah diketahui bahwa komposisi ZPT dalam media kultur dapat menyebabkan perubahan frekuensi karyotipik dalam kultur sel. Zat pengatur tumbuh tersebut adalah 2,4-D, NAA, BAP dan lain-lain yang secara umum dapat menyebabkan kromosom bervariasi.
Menurut Chawla (2002), yang menjadi dasar terjadinya variasi somaklonal adalah:
1. Perubahan karyotipe (karyotype changes): perubahan jumlah kromosom pada berbagai tanaman secara umum berasosiasi dengan menurunnya pembuahan dan merubah rasio genetik pada progeni tanaman dari penyerbukan sendiri.
2. Perubahan pada struktur kromosom; ini terjadi karena delesi kromosom, duplikasi, inversi dan penyusunan kembali kromosom yang timbal balik dan yang tidak timbal balik yang terjadi antara tanaman yang beregenerasi.
3. Mutasi gen tunggal; mutasi gen tunggal biasanya terjadi pada gen yang resesif.
4. Perubahan genetik sitoplasma, persilangan mitotik dan amplifikasi gen dan perubahan nukleus.
Random Amplified Polymorphic DNA (RAPD)
Teknik RAPD (Random Amplified Polymorphic DNA) dimulai oleh Williams et al. (1990) setelah berhasil mengamplifikasi DNA dan bersifat polimorfik dengan menggunakan primer acak serta bantuan enzim Taq (Themus aquaticus) DNA polimerase. Teknik ini sudah banyak digunakan para peneliti di dunia, karena mempunyai beberapa keuntungan. Menurut Williams et al. (1990), metode RAPD lebih sederhana, cepat, DNA yang diperlukan sedikit dan tidak perlu terlalu murni, tidak menggunakan radioisotop maupun DNA probe, cocok digunakan untuk sampel banyak, dan cukup menggunakan satu primer.
Teknik RAPD didasarkan pada penggunaan primer sekuens nukleotida yang berubah-ubah untuk mengamplifikasi segmen genomik DNA acak melalui pemanfaatan PCR (Polymerase Chain Reaction) sehingga menunjukkan polimorfisme. Primer untuk analisis RAPD mengandung 9-10 basa panjangnya.
Polimorfisme yang teramati dengan menggunakan RAPD diyakini karena adanya perubahan basa tunggal yang mencegah perpasangan primer dengan sekuens target, delesi sisi utama, insersi atau delesi yang memodifikasi ukuran DNA.
Keuntungan dari metode ini adalah bahwa set oligonukleotida yang sama dapat digunakan untuk berbagai spesies atau organisme dan setelah amplifikasi selama 2-4 jam, polimorfisme ini dapat diamati secara langsung dengan agarose normal gel elektroforesis (Nasir, 2002).
Kary Mullis memperkenalkan PCR pada tahun 1983 dan publikasi PCR yang pertama muncul pada tahun 1985. Menurut Muladno (2002), PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu dengan cara mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA target tersebut dengan bantuan enzim dan oligonukleotida sebagai primer dalam suatu thermocycler. Panjang target DNA berkisar antara puluhan sampai ribuan nukleotida. Teknik PCR memerlukan dNTPs yang mencakup dATP, dCTP, dGTP, dan dTTP. Teknik RAPD ini juga telah digunakan untuk pemetaan genom, penanda gen dan penelitian kekerabatan tanaman. Analisis ini memerlukan sampel yang lebih sedikit dan tidak memerlukan waktu yang lama, serta pengerjaannya relatif mudah.
Dalam analisis RAPD ada empat tahap yang harus dilakukan, yaitu tahap ekstraksi DNA, tahap pengujian kuantitas DNA, tahap amplipfikasi DNA (PCR) dan tahap elektroforesis. Ekstraksi DNA pada prinsipnya adalah suatu proses pengisolasian DNA bahan amplifikasi dengan cara penggerusan dibantu oleh senyawa-senyawa kimia dengan metode tertentu sehingga didapat DNA yang terpisah dari kontaminan. Keberhasilan ekstraksi DNA dapat diketahui dengan pengujian kualitas dan kuantitas DNA. Uji kualitas dan kuantitas DNA dilakukan secara elektroforesis dengan me’running’ DNA pada bak elektroforesis yang berisi cairan elektrolit. Pada tahap ini semua bahan yang ada dalam larutan DNA dapat terpisah sesuai dengan berat molekulnya masing-masing. Apabila pada UV transilluminator tidak tampak pita DNA, maka kemungkinan besar pengekstrak tidak berhasil.
Menurut Sambrook (1989), daun yang masih muda dengan berat 0,2-0,3 g cukup untuk menghasilkan DNA sesuai dengan kebutuhan selama analisis.
Menurut Kimball (1992), sel berkembang dengan cara menggandakan diri dan memperbesar volume sel. Oleh karena itu semakin muda suatu jaringan daun yang digunakan akan memberikan peluang yang lebih besar dalam menghasilkan DNA dalam jumlah besar dari pada daun yang sudah tua.
Kemajuan dalam pemanfaatan sistem biologi modern tidak terlepas dari prinsip dasar kimia kehidupan. Materi genetik DNA adalah persenyawaan yang terdiri dari gula, fosfat dan basa yang tersusun secara teratur inilah yang menentukan perkembangan dan pertumbuhan suatu organisme dan diturunkan pada generasi berikutnya. Suatu sekuen tertentu dari rantai gula-fosfat-basa ini disebut gen. Gen mengendalikan suatu sifat secara kimiawi melalui kerja enzim- enzim.
Melalui teknik tersebut kita dapat melakukan hal-hal seperti menentukan gen-gen dengan fungsi spesifik, mengisolasi gen yang spesifik tersebut, memasukkan gen spesifik yang kita inginkan ke dalam DNA organisme lain dan gen berekspresi memerintahkan sel inangnya untuk membuat bahan sesuai dengan kodenya (Tim, 1991).
PCR adalah suatu metode in vitro untuk menghasilkan sejumlah fragmen DNA spesifik dengan panjang dan sekuens yang telah ditentukan dari sejumlah
kecil template kompleks. PCR merupakan suatu teknik yang sangat kuat dan sensitif yang dapat diaplikasi dalam berbagai bidang seperti biologi molekuler, diagnostik, genetika populasi dan analisis forensik.
PCR didasarkan pada amplifikasi enzimatik fragmen DNA dengan menggunakan dua oligonukleotida primer yang komplementer dengan ujung 5’
dari kedua untaian sekuens target. Oligonukleotida ini digunakan sebagai primer (primer PCR) untuk memungkinkan DNA template dikopi oleh DNA polimerase.
Untuk mendukung terjadinya annealing primer ini pada template pertama kali diperlukan untuk memisahkan untaian DNA substrat melalui pemanasan.
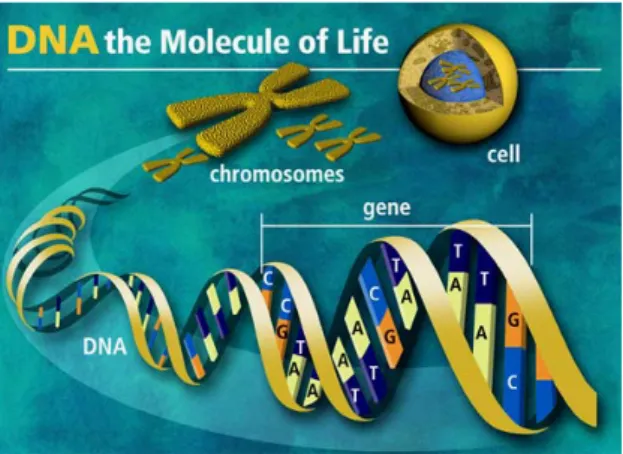
Suhu reaksi selanjutnya diturunkan untuk membiarkan terjadinya perpasangan sekuens dan akhirnya reaksi polimerisasi dilakukan oleh DNA polimerase untuk membentuk untai komplementer. Proses ini dikenal dengan siklus PCR (Nasir, 2002). Untuk membentuk rangkaian molekul DNA heliks ganda (double helix) (Gambar 6), basa nitrogen dari setiap nukleotida dalam satu rangkaian akan berpasangan dengan basa nitrogen dari setiap rangkaian lainnya melalui ikatan hidrogen (Muladno, 2002).
Gambar 6. Sel, Kromosom dan DNA Heliks Ganda (Anonim, 2006).
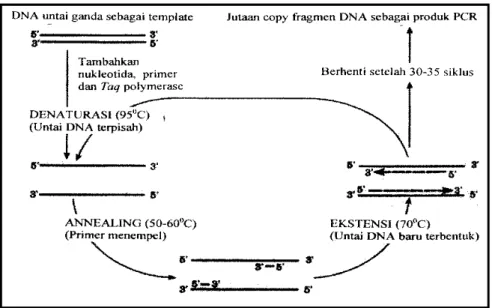
Menurut Muladno (2002), ada 5 komponen utama yang dibutuhkan dalam reaksi PCR yaitu 1) DNA target, 2) Primer, 3) Enzim Taq DNA polymerase 4) dNTP dan 5) Larutan penyangga atau bufer. Prinsip proses PCR adalah suatu siklus berjangka pendek (30-60 detik) dengan tiga perubahan suhu yang berubah secara cepat, proses tersebut dapat dilihat pada Gambar 7. Ketiga tahapan suhu dan fungsinya adalah sebagai berikut :
1. Denaturasi (terbentuk rantai tunggal) suhu 95oC.
Pada tahap pertama ini utas ganda molekul DNA terpisah sempurna dan menghasilkan pita tunggal yang merupakan cetakan bagi primer. Suhu denaturasi biasanya 940 C selama 30 detik atau 970 C selama 15 detik. Dalam Muladno (2002) dinyatakan bahwa denaturasi yang tidak lengkap mengakibatkan DNA mengalami renaturasi (membentuk DNA untai ganda lagi) secara cepat, dan ini mengakibatkan gagalnya proses PCR.
2. Annealing (penempelan primer) suhu berkisar 50 oC -60oC
Temperatur penempelan yang digunakan biasanya 5 oC dibawah Tm, dimana formula untuk menghitung Tm= 4(G + C) + 2(A + T). Semakin panjang ukuran primer, semakin tinggi temperaturnya.
3. Ekstensi (pemanjangan primer) suhu 72 oC
Selama tahap ini, Taq polymerase memulai aktivitasnya memperpanjang DNA primer dari ujung 3’. Kecepatan penyusunan nukleotida oleh enzim tersebut pada suhu 72 oC diperkirakan antara 35 sampai 1000 nukleotida per detik, tergantung pada buffer, pH, konsentrasi garam dan molekul DNA (Muladno, 2002).
Gambar 7. Siklus Pembentukan Molekul DNA Baru dalam Proses PCR (Muladno, 2002).